微生物(共)感染症。免疫に影響を及ぼす強力な因子
微生物(共)感染症。免疫に影響を及ぼす強力な因子
アリ・ハッサン、ニコラ・ブランシャール
論文情報
要旨
宿主の感染は、様々な免疫機能を調節することにより、感染症や自己免疫疾患を原因とする併発する炎症性疾患の経過を変化させる可能性があることがよく知られている。宿主のウイルス、細菌、寄生虫への曝露は、宿主の免疫状態に大きな影響を与えるだけでなく、宿主の炎症性疾患に有益にも有害にも劇的な影響を与える。さらに、病原体の制御や組織障害に対する耐性を変化させることで、併発する感染症の発症に大きな影響を与えることもある。ここでは、(共)感染が炎症性疾患に及ぼす影響の根底にある多様な機序について概説する。まず、衛生仮説の観点から疫学的研究を考察し、細菌への曝露がヒトの炎症性疾患への感受性に時に二重の影響を与えることを明らかにする。そして、免疫担当者の多面的な作用が関与している可能性のある免疫調節機構をまとめ、病原体由来の化合物を宿主のために利用する可能性について議論する。
はじめに
我々の免疫系の主な機能は、病原体や腫瘍細胞の侵入に対する防御を行い、組織の恒常性と修復を促進することである。免疫系は、自己と非自己を区別し、非自己に対しては免疫反応を起こすが、自己には害を与えないという免疫寛容の過程を経て、自己と非自己を区別している。免疫寛容の破綻は、自己の組織を異物とみなして攻撃する自己免疫疾患の発症につながる可能性がある。
免疫系の病原体に対する防御能や、耐性破壊後の自己に対する攻撃の強さは、病原体や常在菌への曝露を含む内在的要因(例えば遺伝)と外在的要因(例えば環境因子やエクスポソーム)に大きく影響される。現在では、様々な免疫機能を調節することによって、宿主の感染が、感染性および自己免疫性の両方の病因による付随的な炎症性疾患の経過を変える可能性があることが十分に立証されている。事実、感染は炎症性疾患の臨床的転帰を改善することも、悪化させることもある。多くの研究が、特定の病態における微生物による免疫調節を支配する様々なメカニズムを明らかにすることに貢献してきた。特に蠕虫については、発見された分子や経路のいくつかが、特定の自己免疫疾患に対する新しい治療戦略として臨床的に試験されている例もある。
本総説では、宿主の生涯を通じて感染症にさらされることによって免疫状態が形成される主なメカニズムについて、包括的に解説することを目的としている。
衛生仮説。細菌への曝露は常に宿主にとって有益か?
1989年、Strachanは、年上の兄弟がいる子どもには花粉症が少ないという事実に基づいて、アレルギー疾患に関する衛生仮説を初めて提唱した[1]。彼は、年上の子どもは年下の兄弟に比べて微生物にさらされる頻度が低いのではないかと推論し、幼少期の微生物への曝露が後に過敏症から身を守ることになると提唱したのである。この仮説はいくつかの疫学的研究によって支持され、他のアレルギー性疾患だけでなく、自己免疫疾患にも拡大されている。過去数十年の間に、喘息、アトピー性皮膚炎、1型糖尿病(T1D)、多発性硬化症(MS)などの自己免疫疾患やアレルギー疾患の発生率は、先進国と後進国の間で実際に増加している[2,3]。この増加は、遺伝、日光やビタミンDへの曝露、社会経済レベルなどのいくつかの要因で説明できるかもしれないが、感染症発生率の低下との強い相関が指摘されている。例えば、Sotgiuらは、サルデーニャ島におけるMS発症率の上昇とマラリアの根絶との相関を報告している[4]。また、MSやT1Dの発症リスクの低さは、多様な微生物群に早期に曝露することと関連しています。例えば、自然に蠕虫に感染したMS患者や治療を受けたMS患者は、感染していない患者やプラセボ患者と比較して、増悪や磁気共鳴画像の変化がそれぞれ少なかったことが示されています[5,6]。また、フィンランドの大規模コホートを対象とした研究では、細菌に触れる確率が高いとされる室内犬と子供時代を過ごした子供は、室内犬を飼っていない子供と比較して、T1Dを発症する確率が低いことが示されています[7]。ガボンとベトナムでは、2つの独立した研究により、スキストソーマまたはアスカリス線虫に感染した学童は、感染していない同級生と比較して、アレルゲン反応性のレベルが低いことが判明しました[8,9]。これらの観察は、感染した子供への駆虫薬治療がアトピー反応性を増加させるという発見によって支持された [10]。日本で4,000人の患者を対象に行われた症例対照研究では、肺や腸に寄生する線虫であるStrongyloides stercoralisによる感染頻度が、自己免疫性肝疾患の患者群では対照群より低いことが示された[11]。その他にも、乳児期に抗生物質を服用した子どもは、後年、炎症性腸疾患 [12]、喘息、湿疹、花粉症を発症するリスクが高いことが報告されている [13]。これらの研究を総合すると、微生物への早期曝露と自己免疫・アレルギー疾患のリスク低減との間に正の相関があることが浮き彫りになります。
このような有益な効果に加えて、微生物への曝露が自己免疫/アレルギー疾患を誘発または悪化させる可能性があることも報告されている。エプスタイン・バー・ウイルス(EBV)の感染は、全身性エリテマトーデス(SLE)およびMSの発症と相関しており、SLEおよびMS患者は健康な対照群と比較してEBVの血清有病率が高く [14,15] 、いくつかの自己反応性CD4+ T細胞クローンはEBVペプチドと交差反応することがあります [16] 。さらに、アシネトバクターや緑膿菌(P. aeruginosa)のような異なるタイプの病原体は、MSの誘発と関連しています[17]。いくつかのウイルスがT1Dと相関している。例えば、コクサッキーウイルスB4は、T1D患者の膵臓だけでなく腸の生検でも、特に最近発症した後に検出されることがあります [18]。
最後に、併発した感染症がその臨床結果に大きな影響を与えることも明らかになってきた。最近の象徴的な例は、リーシュマニア寄生虫に感染し、特定のリーシュマニア寄生虫の分離体内で複製するリーシュマニア寄生虫媒介性RNAウイルス(LRV)で、患者の治療失敗およびリーシュマニア病巣の転移と相関しています[19、20]。LRV以外にも、サハラ以南のアフリカの小児におけるEBVとマラリアの同時感染は、マラリアの増悪またはEBV関連の病態の発症を引き起こす可能性があります[21]。さらに、タンザニアの乳児を対象とした血清疫学研究では、1歳までに重症マラリアを発症した者は、より早い時期にフィラリア抗原の血清陽性であった可能性が高いことが示されている[22]。しかし、フィラリアと原虫は同じ蚊を媒介することがあるので、この研究の限界は、フィラリアの血清反応性が、マラリアの重症度に対するフィラリア寄生虫の直接的影響とは別に、単に原虫への曝露リスクが高いことの徴候である可能性があるということである。一方,セネガルの小児を対象とした研究では,スキストソーマ・ヘマトビウムに軽度感染している小児は,非感染小児と比較してマラリア原虫の密度が低いことが示されている[23].この観察と同様に、アスカリス・ルンブリコイデスとの同時感染は、脳マラリアリスクの低下と関連していました[24]。これらの違いは、蠕虫の性質と小児の年齢によって説明できるかもしれない。というのも、若年小児では共同感染に対する反応が異なる可能性があるからである。
要約すると、ウイルス、寄生虫、細菌への曝露が、自己免疫疾患や感染症を併発した場合の臨床転帰を正または負に制御することが、複数の証拠から示されている。次に、この現象の根底にある主要な免疫調節機構について説明する。
I型インターフェロンを介した免疫調節。高い免疫調節能を有する抗ウイルス性サイトカイン
ほとんどの細胞は、I型インターフェロン(IFN-I)を産生し、その受容体を発現している。IFN-Iは抗ウイルス作用に重要な役割を果たすが、このサイトカインは様々な免疫細胞に多様な作用を及ぼすため、様々な病態を修飾することができる。マウス皮膚リーシュマニア症の場合、LRVの共存はマクロファージにおけるTLR3-TRIF経路の活性化を介してIL-6、TNF-α、CCL5、CXCL10、IFN-Iなどの炎症性サイトカインおよびケモカインの産生を誘導し皮膚病変の重症化および転移を悪化させる [25].興味深いことに、LRVだけでなく、リンパ球性絨毛膜炎ウイルス(LCMV)やトスカナウイルスなどの外来性の非寄生虫媒介ウイルスとの同時感染も、このマウスモデルにおいてIFN-I産生によりリーシュマニア病態を増加させる。IFN-Iの作用の1つは、リーシュマニアの寄生虫制御に通常必要なIFN-γ受容体の発現をダウンレギュレートすることである[26]。IFN-Iの同様の有害な役割は、最近、実験的な緑膿菌の感染中に報告された。この場合、細菌が産生する糸状バクテリオファージは、TLR3-TRIF経路を介してIFN-Iを誘導し、TNF-αの発現低下とマクロファージによる細菌の貪食を変化させることにより、緑膿菌を介した病態を悪化させる [27].寄生虫や細菌感染への影響に加え、ウイルス感染も真菌症の予後を変える可能性があります。ヒトマクロファージを用いた最近の研究では、IFN-I依存的に真菌Cryptococcus neoformansのvomocytosis(食細胞によって飲み込まれた微生物の排出につながる非解離性押し出し)がウイルスによって増強されることが報告されています[28]。
IFN-Iの役割を示すもう一つの例は、毎年世界中の何百万人もの人々が罹患するインフルエンザウイルスによる感染である。インフルエンザ感染は、しばしば二次的な呼吸器系細菌感染を伴い、感染しやすい患者の臨床転帰を劇的に悪化させることがある。動物モデルを用いたいくつかの研究により、A型インフルエンザウイルスの既往または同時感染がグラム陰性およびグラム陽性細菌性肺炎への感受性を高め、その病態がIFN-Iシグナル伝達によって促進されることが示されている。メカニズム的には、IFN-Iは、転写およびエピジェネティックな調節を通じて、CXCL1やCXCL2のようないくつかの化学誘引物質の産生を変えることにより、肺へのマクロファージおよび好中球の動員を抑制する[29,30]。さらに、IFN-Iは、IL-17とIL-23の産生およびROR-γtの発現を減少させることにより、17型免疫反応を抑制する[31,32]。IFN-Iの悪影響は、樹状細胞(DC)にも観察された。実際、A型インフルエンザウイルスの肺同時感染は、IFN-Iを介したDC上のMHC-IおよびMHC-II発現の低下と関連しており、CD4+およびCD8+T細胞の活性化が低下し、マイコバクテリアのクリアランスが損なわれることになる[33]。このような免疫障害は、慢性ウイルス性肝炎のためにIFN-I治療を受けている一部の患者における結核の再活性化を報告した臨床研究を説明しうる[34]。これらの結果は、IFN-Iが様々な自然免疫細胞および適応免疫細胞を調節することによって、大規模な負の作用を及ぼすことを示している(図1)。
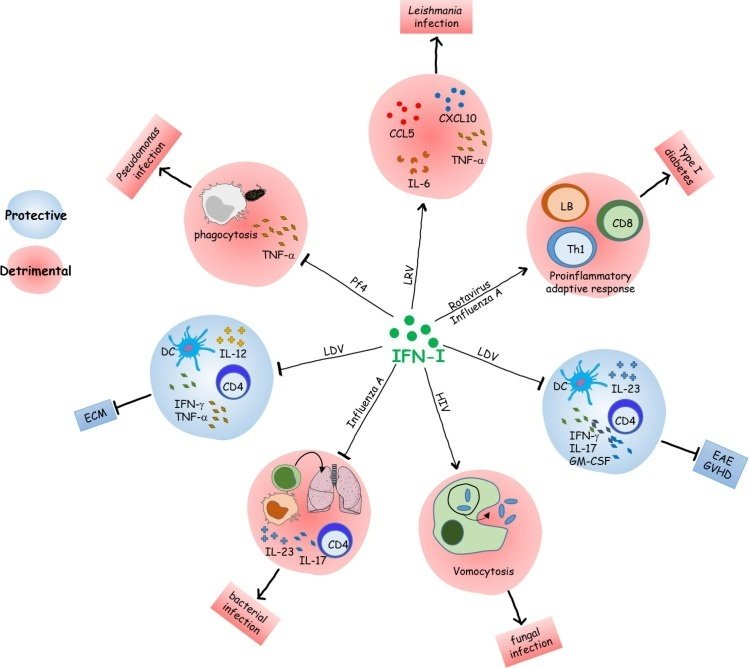
図1
図1
感染を介したIFN-Iによる免疫細胞の機能調節。
逆に、状況によっては、IFN-Iの免疫調節作用が宿主を保護する役割を果たすことがある。例えば、乳酸脱水素酵素上昇ウイルス(LDV)のコインフェクションは、CD8+エフェクターT細胞によって典型的に引き起こされ、CD4+ Th1応答によって持続する血管病理であるPlasmodium berghei ANKA媒介実験脳マラリアからマウスを保護する。この場合、LDVはIFN-Iの産生を誘導し、DCの数の減少、IL-12の産生能力の低下を促進し、その結果、Th1応答を誘導する能力を低下させる。IFN-I の重要な役割は、Ifnar1 KO マウスが LDV 感染時に正常な DC 数と機能を示したことから確認された[35]。これらのデータは、(i) IFN-I が特定のプロアポトーシス蛋白の発現を誘導することによって DC の死を誘発すること [36] 、および (ii) IFN-I が STAT 分子のリン酸化を修飾することによって DC における IL-12p40 の転写を、用量依存的に制御できること [37] という以前の観察結果と一致するものであった。
感染によって引き起こされる IFN-I は、自己免疫疾患の結果も調節することができます。Paneたちは、ロタウイルス感染が、TLR7/MDA5経路を介した形質細胞DC(pDC)のIFN-I放出を誘導することによって、非肥満性糖尿病(NOD)マウスの糖尿病を加速することを示唆した。分泌されたIFN-Iは、自己反応性CD8+T細胞を含むB細胞およびT細胞の活性化を誘導する[38]。したがって、いくつかの研究では、呼吸器系ウイルスによるIFN-IをT1Dの悪化と関連付けている。例えば、A型インフルエンザ感染は、マウスや患者のpDCによるIFN-I産生を誘導し、これはTh1を介したT1D発症と関連している[39,40]。IFN-Iは重要な役割を果たしているようだが、ウイルス複製や細胞溶解作用など他の要因もT1D悪化に寄与している可能性がある[41]。逆に、LDV感染は、MSのマウスモデルである実験的自己免疫性脳脊髄炎(EAE)に対してマウスを保護します。実際、LDV感染は、IFN-Iシグナルを介したDCによるIL-12およびIL-23の発現を損ない、自己反応性CD4+T細胞の発達を変化させる[35]。この質的な欠陥に加えて、LDV由来のIFN-Iは、DCとT細胞の数を減らし、移植片対宿主病のモデルにおいて保護的である[42]。
注目すべきは、IFN-Iシグナル伝達のタイミングが、保護的な反応と有害な反応の結果を分ける重要な要因であることである。早期のIFN-I産生は、結核菌感染に対する防御反応を引き起こすことが報告されている。一方、後期のIFN-Iシグナル伝達は、宿主保護免疫反応を抑制する[43]。このラインに沿って、コロナウイルス病2019(COVID-19)患者のレトロスペクティブ研究は、早期のIFN-I治療が疾患転帰を改善する一方で、遅いIFN-I投与は死亡率の上昇と関連することを発見した[44]。これらの知見に基づき、IFN-Iを誘導する病原体の感染時期が、第二病態の転帰を決定的に左右するはずだと推測される。
結論として、IFN-Iは免疫と細胞の反応に多様な、時には相反する作用を及ぼす(図2)。中程度のレベルのIFN-Iは最適な免疫反応を開始するのに重要であるが、高レベルのIFN-Iは有害となりうる。従って、病原体の種類、低濃度または高濃度のIFN-Iを誘導する能力、二次感染が発生した場合、IFN-Iシグナルのピーク時か消失時かが、免疫反応の運命と病態を決定する重要な要素である。
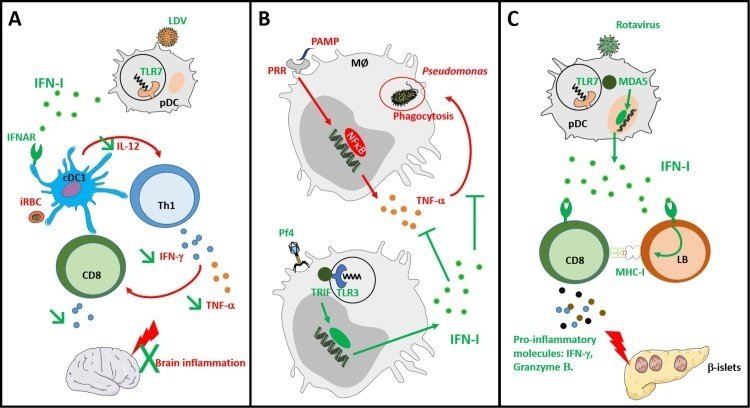
図2
図2
感染によるIFN-Iを介した免疫調節の例。
組織損傷に対する寛容と制御性免疫による免疫調節
組織障害に対する耐性(または疾患耐性) 感染症の際、宿主は病原体の毒性や炎症反応の不十分な収束によって、直接的に組織障害を受けることがある。そのため、様々なストレスの悪影響を抑え、組織障害を最小限にするための防御戦略として、耐性のメカニズムが採用されている。この耐性が確立されないと、病原体の負荷とは無関係に、二次感染の臨床結果が劇的に変化することがある。その一例が、インフルエンザウイルスとLegionella pneumophilaの致死的な共感染である。興味深いことに、弱毒化した細菌、あるいは好中球、ナチュラルキラー(NK)細胞、T細胞、B細胞など、共感染時に誘導される免疫成分を欠いたマウス(Rag2 KO)を用いても、死亡率は改善されない。むしろ、死亡率は肺上皮の損傷と組織修復に関与する遺伝子のダウンレギュレーションに関連している。この文脈では、組織の恒常性と発達に寄与する上皮成長因子による治療が生存率を高める[45]。この先駆的な研究により、感染によって引き起こされる組織損傷に対する耐性喪失の影響と、二次感染の臨床的転帰に対する組織修復の重要性が明らかにされた。同様に、膜結合型マトリックスメタロプロテアーゼMT1-MMPの選択的阻害は、組織を損傷から守り、免疫反応やサイトカイン発現を変えずに、インフルエンザ/肺炎球菌マウス二次感染時のより良い臨床転帰と相関している[46]。
重複感染における制御性反応 上述した疾患耐性と組織修復の免疫非依存性メカニズムに加え、制御性免疫反応もまた、組織修復を促進し恒常性を回復させる重要なプロセスである。特徴的な細胞タイプは制御性T細胞(Treg)で、免疫抑制機能に加え、組織修復に重要な役割を果たす [47,48]。興味深いことに、Tregが発現する成長因子であるアンフィレグリンで処理すると、実験的なインフルエンザ/L. pneumophilaの共感染時の生存率が改善される[45]。しかし、全体として、コイン感染時のTregの役割とその再生特性は、まだ十分に理解されていない。病気の進行をコントロールする免疫抑制サイトカインの役割は、よく知られている。IL-10はその代表的な抑制性サイトカインであり、その制御機能を示す例が多数ある。マカクとマウスを用いた研究では、原虫感染によってSalmonella typhimuriumによる腸の炎症がIL-10依存的に減弱されることが示されている。この改善は、原虫による IL-10により、IL-12、IFN-γ、IL-17A の発現が減少し、CXCL1 による盲腸への好中球の浸潤が減少することに関連している[49]。IL-10 による炎症反応の抑制は、ある場合には有益であるが、有害な場合もある。例えば、進行中の、あるいは過去に解決された蠕虫感染は、様々なマウス研究において、抗インフルエンザワクチン接種の効果を損なうことが報告されている。蠕虫感染は、IL-10を発現するCD49b+ LAG3+ Tr1細胞の拡大を通じて、インフルエンザ特異的抗体の中和能を低下させる[50]。さらに,蠕虫が介在する IL-10 の発現は,CD8+ T 細胞による IFN-γ の発現を弱め,Toxoplasma gondii (T. gondii) 感染を増悪させることが示されました [51].メカニズム的には、IL-10 は、細胞表面のグリコシル化を修正することにより、CD8+ T 細胞の活性化と機能を直接制限することができ、T 細胞の活性化に必要な抗原閾値を増加させます[52]。同じ系統の研究では、IL-10R をブロックしたり、IL-10 を中和すると、Th1 (IFN-γ, TNF-α) と Th17 (IL-17A, IL-17F) の反応が回復し、インフルエンザ A と蠕虫感染でそれぞれ鈍化した Mtb 制御が改善されます [53,54].一方、蠕虫感染症患者の駆虫は、結核の改善なしに、IL-10レベルの有意な低下と相関する[55]。現実には、二次感染には、炎症性サイトカインと抗炎症性サイトカインの複雑なネットワーク、そしておそらく免疫抑制以外の他のメカニズムが関わっていることが示されている。
自然免疫領域に関しては、最近の研究で、γヘルペスウイルスは、胚性肺胞マクロファージの骨髄由来の制御性単球による置換を促進することにより、ハウスダストマイト誘発実験喘息から保護し、肺に定着してDCの特異的Th2反応を誘発する能力を変化させていることが示されている [56].このことは、ある種のウイルスは、免疫微小環境をより制御的なプロファイルに改造することによって、防御することができることを示している。
制御適応細胞の役割に関して、蠕虫寄生虫に感染したMS患者は、非感染患者と比較して、CD4+ CD25+ Foxp3+Treg細胞頻度の増加、IL-10およびTGF-β産生、IL-12およびIFN-γ分泌細胞の減少に関連して、より良い疾患予後を示すことが示された[5,6,57]。Smad7/TGF-β 軸の寄生虫調節が可能な説明として提案された。Tregの保護的役割は、マウスにおいて、EAEの臨床的進化がPlasmodium chabaudi感染によって改善された研究で観察され[58]、Plasmodium-conditioned DCまたは CD4+ Tregの養子移入は、自己反応性 CD4+ T細胞応答の抑制を介してEAEを改善するのに十分であった[58,59]。NODマウスでは、蠕虫の寄生虫だけでなくその生成物も、CD4+ Tregの誘導とIL-10の産生を介して糖尿病を予防する[60,61]。メカニズム的には,寄生虫卵は,DCによるIL-2やIL-10の発現に加えて,TGF-β活性化α8インテグリン,LAP,CD4+ T細胞上のガレクチン1および3の発現誘導を介して,TGF-β依存的にTregの発生を誘導する[60].しかし、IL-10 欠損の NOD マウスは、糖尿病から保護されている[62]。さらに,IL-2 処置は,局所 Treg に作用するが,IL-10 や TGF-β の発現とは無関係に NOD マウスの確立した疾患を逆転させる[63].このように,寄生虫による NOD マウスの保護は,Treg に依存するが,IL-10 産生とは部分的に独立した調節機構によって媒介されているようである.最後に、蠕虫によって誘導されたTregは、喘息のマウスモデルにおいて、抗原特異的免疫グロブリンE(IgE)および肺好酸球増加を低減することによって、気道炎症を調節し、喘息を阻害する[64,65]。興味深いことに、保護的な肺Tregは、蠕虫によって活性化されたCD1d高制御B細胞(Breg)によりIL-10の産生を介して誘導される[66,67]。同様のメカニズムは、ループス [68]、関節炎 [69]、EAE [70]などのいくつかの自己免疫実験モデルで発見されています。アレルギーに関しては、アフリカの小児を対象とした臨床研究で、IL-10 が慢性住血吸虫症によって誘導され、ハウスダストマイト皮膚テストでの反応性と逆相関することが報告されており、蠕虫を介したアトピーの抑制に IL-10 が中心的役割を果たすことが示唆されている [8].
まとめると,感染誘導型TregとBregは,多くの場合,同時にIL-10を介して炎症の制御に有用であるが,IL-10に依存しない機能や重複しない役割も持っている可能性がある(Fig.3).

図3
図3
病原体によって活性化された制御性T細胞およびB細胞による免疫応答調節。
タイプ1/タイプ2免疫スイッチングによる免疫調節
病原体の種類や組織の微小環境に応じて、活性化された免疫細胞は、表現型や機能的に異なる細胞集団へと極性化し、異なるタイプの免疫反応(タイプ1および2)が最も一般的に確立されるようになる。タイプ1免疫は、細胞内病原体やがん細胞と闘うために行われる炎症性細胞傷害性反応に関するもので、タイプ2免疫は、細胞内病原体やがん細胞と闘うために行われる炎症性細胞傷害性反応に関するものである。タイプ2免疫は、蠕虫(ぜんちゅう)感染に対する宿主の抵抗力に重要な反応であり、免疫抑制と組織修復の機能を含んでいる。1型免疫と2型免疫の切り替えは、特定の病的状況に対する免疫系の反応、ひいては病気の経過を劇的に変化させる可能性がある。ヒトやマウスでは、Mtbは炎症性のタイプ1反応を引き起こす。したがって、Th2応答の強力なドライバーである蠕虫と共感染した患者は、より長期的で重篤な結核を発症する [71,72]。蠕虫の共感染は、Th1、Th17、およびNK細胞頻度の減少、Th2およびTregの増加、ならびに炎症促進/抗炎症サイトカイン産生のプロファイルの変更をもたらす[53,71,73]。予期せぬことに、ケニア人におけるCD4+T細胞のプロファイリングは、スキストソーマの共感染がMtb特異的Th1サイトカイン産生を損なわないことを明らかにした。実際、共存感染者は、Mtb特異的なCD4+T細胞のIFN-γを発現する頻度が、Mtb単独感染者よりも高かった[74]。Th1反応だけでなくTh2反応も引き起こす可能性のある、虫のライフサイクルの段階の違いが、これらの不一致の結果を説明しているのかもしれない。また、ヒトでは定義が難しい感染順序も関与している可能性がある。この仮説は、マウスを用いたいくつかの共感染研究によって裏付けられている。T. gondii 感染が蠕虫の感染に先行する場合、転写因子 GATA3 の発現の減少、IL-4、IL-13 の産生、および CD4+ T 細胞による IFN-γ の産生の増加が観察される [75].一方、蠕虫の感染が T. gondii の感染に先行する場合、マウスは CD8+ T 細胞および cDC1 による IFN-γ および IL-12 産生の欠損を示し、IL-4 および IL-10 産生の増加と関連して、共同感染マウスの脳における T. gondii シスト負荷が増加する [51,76].
T 細胞反応以外にも、マクロファージの極性転換もコインフェクションの結果を左右する可能性がある。例えば、蠕虫が促進するIL-4シグナルを介したM1マクロファージから交互活性化マクロファージへの切り替えは、IL-1β、TNF-α、IL-6、IL-12、CCL(1-2-4)、CXCL(2-9-10)などのいくつかの炎症性サイトカインおよびケモカインの発現低下をもたらし、結核増悪と関連している [72,77-79].古典的な作用機序(炎症促進または抗炎症反応)に加えて、最近のin vitro研究では、機能的に調節されたマクロファージが感染を悪化させるという独自の機序に光が当てられた。Mtb感染は、寛容な免疫調節マクロファージの誘導と、IL-10/STAT3シグナル経路を介した細胞間ナノチューブの形成を通じて、HIVの播種を増加させることが示された。
自己免疫の文脈では、蠕虫分子で治療したMS患者は、高いIFN-γとIL-12の発現と制御細胞の数の低下と相関する臨床MS活性の上昇を示す[57]。逆に、マウスでは、蠕虫の感染は、IFN-γ、IL-17、およびIL-12の発現を抑制し、STAT6シグナルを介してIL-4の産生を増強することにより、EAEの重症度を低下させる傾向がある[57,81]。同じ保護効果が関節リウマチのマウスモデルで観察され、予め確立されたシストソーマ感染は、抗コラーゲンIgG、IFN-γ、IL-17A、TNF-α、IL-1β、およびIL-6のレベルのダウンレギュレーションとIL-4のアップレギュレーションを引き起こす[82]。
全体として、これらの研究は、感染が免疫反応のタイプを切り替えることによって、併発する疾患を調節することができることを示している。疾患誘発前の経過は、誘発された免疫応答の表現型、ひいては臨床転帰を決定するのに重要である。
ケモカイン制御と免疫細胞の移動を介した免疫調節
感染症は、感染部位や炎症部位への免疫細胞の移動を調節することで、併発する病態の臨床的進展に劇的な影響を与えることができる。Teoたちは、チクングニアウイルス(CHIKV)の同時感染が、脳への寄生虫特異的CD8+T細胞の輸送を変化させることにより、マウスを脳マラリアから保護することを明らかにした。コイン感染マウスでは、脾臓のIFN-γによるCXCL9およびCXCL10の産生が、CXCR3を発現する病原性CD8+T細胞の脾臓での保持を誘導し、脳への移動を阻止する[83]。逆に、マウスに原虫を事前感染させると、病原性CD4+T細胞の関節への移動が変化することもあり、CHIKV誘発の関節腫脹を消失させる。変化した移動は、リンパ節におけるCD4+ T細胞のアポトーシスの増加に加えて、部分的にCXCR3に依存している[84]。脳におけるCD8+ T細胞浸潤の低下も、スキストゾーマ/プラズモディウムコインフェクションの間に報告された。しかしこの場合、IFN-γの発現が低下しているので、脳内浸潤の低下は脾臓におけるIFN-γを介したケモカインの蓄積によるものではなく、むしろSchistosomaによるCD8+ T細胞の発達の欠如と血液脳関門の限定的な障害によるものである[85]。別の実験的研究において、スキストソーマ感染は、胃に帰巣できないH.ピロリ経験CXCR3+ Th1細胞の誤配を誘発することによって、ヘリコバクター・ピロリのコロニー形成の制御を混乱させる[86]。
T細胞に加えて、好中球の移動は、感染症の制御において重要なプロセスであり、併発感染によって影響を受ける可能性がある。事前に確立された腸管制限蠕虫感染症は、マウスの肺への好中球の動員を増加させることにより、緑膿菌のコインフェクションから保護する[87]。メカニズム的には、蠕虫によって誘導されたIL-4およびIL-13は、リポキシゲナーゼ遺伝子Alox15[87]の転写および活性を増加させ、炎症性脂質メディエーターであるヘポキシリンA3[88]の生成をもたらし、これが粘膜上皮バリアを越えて気道を移動する好中球の移動を推進する[89]。
自己免疫の際、マウスのLCMV感染は、IFN-γを介したCXCL10産生を刺激し、膵島浸潤T細胞を膵島から膵臓排出リンパ節に引き戻すことでT1Dを予防する [90].一方、ケモカインの産生は、A型インフルエンザ感染時には、T細胞、単球、好中球の脳への輸送を誘導することで有害な役割を果たし、自己免疫を起こしやすいT細胞受容体トランスジェニック2D2マウスにおいて自己免疫性脳脊髄炎を発症させる。RNA-seq解析により、感染マウスの中枢神経系(CNS)において、いくつかのケモカインが発現上昇することが示された[91]。分子レベルでは、インフルエンザウイルスRNAのTLR7への結合は、MyD88/NF-κB経路を活性化し、その結果、CNSへの細胞の動員を促進する[91]。したがって、病原体の性質と感染の種類(全身性または局所性)に影響されるリンパ系器官と病変部位の間のケモカイン産生のバランスは、細胞移動を決定する重要な要因である。ケモカイン産生をターゲットにすることで、特定の病態の臨床転帰を改善するのに役立つ可能性がある。
体液性免疫の調節
細胞性免疫に比べ、体液性免疫の調節はあまり研究されていないが、感染症が併発する疾病に影響を与えるメカニズムの一つである。サハラ以南のアフリカでは、乳幼児がしばしばガンマヘルペスウイルスに重複感染している。このウイルスはB細胞に感染し、小児における重症マラリアに対する免疫の獲得が非常に遅いことの一因であると考えられている。Matarたちは、マウスによる重複感染モデルを用いて、ガンマヘルペスウイルスの急性感染(潜伏感染ではない)が抗マラリア体液性反応を抑制することを明らかにした。実際、共同感染マウスは、マラリア特異的IgG産生形質細胞の生成に欠損が見られる。興味深いことに、ウイルスタンパク質は、おそらく抑制リガンドPD-L1の発現を誘導することによって、B細胞が濾胞ヘルパーT細胞(Tfh)とコミュニケーションする能力を低下させることによって、胚中心維持の欠陥を引き起こす[92]。同様のメカニズムが、インフルエンザと肺炎球菌に順次感染したマウスで観察された。この同時感染により、死に至る表現型と、ウイルス特異的IgG、IgM、IgAの減少、B細胞やプラズマ細胞の数の減少、Tfh反応の変化、胚中心維持が見られるようになる[93]。
自己免疫の文脈では、分子模倣やバイスタンダー活性化を通じて、感染が免疫寛容の崩壊を引き起こし、B細胞の活性化や自己抗体の産生を引き起こし、自己免疫疾患の発症につながる可能性がある[14,94]。ヒトの研究では、P. falciparum感染は、脳組織由来の抗原を認識する可能性のある自己反応性IgGのレベルの上昇と相関することが示唆されている [95]。興味深いことに、より最近のマウスマラリアにおける研究では、原虫DNAがTLR9/IFN-γRの相乗的活性化を介して、T-bet+ CD11c+で抗赤血球抗体を産生する「非定型」B細胞の特殊集団の発生を誘導し、自己免疫貧血を発症させることが示されている[96]。脳マラリア患者の脳内自己反応性IgGの起源が同じB細胞集団である可能性はまだ確立されていない.
今後、病原体を介したB細胞やTfhの抑制や活性化・分化のメカニズムを詳細に解析することで、新たな標的経路や治療分子の同定に役立つと思われる。
訓練された免疫による免疫調節
従来、適応免疫のT細胞やB細胞の特徴として、特異的抗原記憶が挙げられる。最近、自然免疫細胞を介したもう一つのタイプの非特異的記憶が発見され、「訓練された免疫」と呼ばれている[97](図4)。訓練された免疫とは、特定の病原体関連分子パターンに遭遇した際に起こる、免疫学的、代謝的、およびエピジェネティックな修飾による自然免疫細胞の機能再プログラミングに基づいており、同一または異なる(交差防御)病原体による二次感染に対してより強い免疫をもたらし、比較的長期間(すなわち、数ヶ月から、特定のケースでは1年以上)にわたって持続するものである。よく知られている例としては、Candida albicansと真菌の細胞壁成分であるβ-グルカンによって誘発される訓練された免疫がある。T細胞やB細胞の機能を欠くマウスでは、β-グルカンや低用量のC. albicansにさらされると、致死的な真菌の再感染に対する防御が可能になる。興味深いことに、事前に曝露された単球は、C. albicansだけでなく、他のパターン認識受容体リガンドや細菌の刺激にも反応して、機能の再プログラミングを示し、IL-6とTNF-αをより多く産生する[98]。メカニズム的には、訓練された単球は、デクチン-1シグナル伝達経路を通じて、関連する遺伝子プロモーターのH3K4me3プロファイルにエピジェネティックな活性化変化を示す[98,99]。さらに、βグルカンによって誘導された訓練免疫は、IL-1シグナル伝達と同様に単球/マクロファージを必要とするメカニズムを通じて、IL-32産生を調節し、炎症および抗菌応答を増加させることによって、二次的な非真菌感染に対する保護を与える[100,101]。同様に、Plasmodium感染赤血球にさらされたヒトPBMCは、二次TLR刺激に応答して、エピジェネティックリモデリングと相関するIL-6およびTNF-αの産生の増加を示している。興味深いことに、原虫に感染したケニアの子供たちは、抗マラリア治療を受けた後でも、同じエピジェネティックな変化を示している[102]。このように、エピジェネティックな変化は、少なくとも部分的には、多重感染者の大半が無症状である理由を説明することができる。自然感染に加えて、ワクチン接種によって訓練された免疫も誘導される。例えば、抗結核ワクチン接種は、マイコバクテリアだけでなく、非標的病原体に対しても保護的である[103,104]。Artsらは、バシル・カルメット・ゲラン(BCG)ワクチン接種が黄熱病ウイルス血症に対する防御を促進することを報告した。この保護は、Nod2の活性化を介した単球のエピジェネティックリモデリングによって媒介され[103]、これがIL-1βおよびTNF-αの産生を促進し[105]、ひいては適応T細胞応答の増強に寄与している[104]。重要なことは、訓練された免疫は、骨髄で誘導されると考えられていることである。実際、感染症に罹患すると骨髄形成が促進され、造血幹細胞が訓練された自然免疫細胞を生成するようになる [106,107] 。この観察は、単球の回転が比較的速いことを考慮すると、訓練された免疫の持続時間を理解するのに不可欠である。その結果、訓練された幹細胞を新しいタイプの非特異的ワクチンとして使用することは魅力的であり、現在活発に検討されている。COVID-19のパンデミックの間、相関データは、普遍的なBCGワクチン接種政策を実施しなかった国は、死亡率およびSARS-CoV2感染の報告例が高いことを示し、BCGがウイルスに対する保護を提供するかもしれないことを示している[108]。全体として、これらの研究は、微生物を介した非特異的ワクチンの新しい概念を強調している。
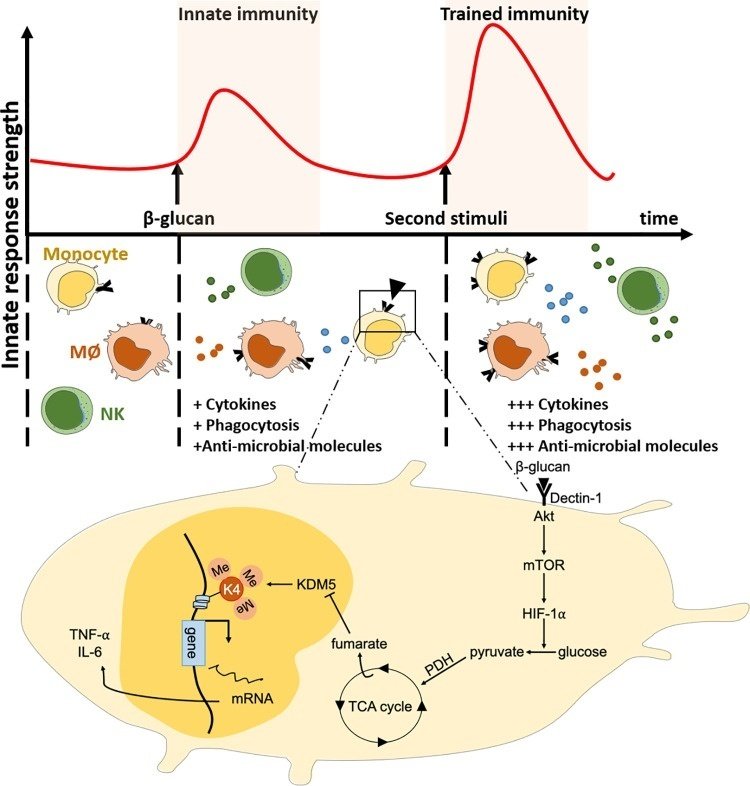
図4
図4
感染によって誘発される訓練された免疫。
自己免疫疾患のいくつかの事例では、患者の単球は、サイトカイン産生の増加、代謝やエピジェネティックな変化など、訓練された免疫の表現型と一致する特徴を示している。例えば、SLEや関節リウマチでは、単離したヒト単球は、IL-1β、IL-6、TNF-αの産生の増加 [109,110] 、PI3K/mTORやMAPKシグナル経路の活性化 [111] 、CD80、CD86、HLA-DRの高い発現 [112] 、自己抗原のT細胞への提示を含む抗原提示の能力の向上が示唆される、自己反応性のT細胞への抗原の提示が見られる。訓練された免疫によって引き起こされる炎症反応の可能性は、自己免疫疾患の文脈では、訓練が有害な役割を果たす可能性が高いという考え方を支持するものである。逆に、自己免疫のマウスモデルにおいて、蠕虫の抽出物を注入すると、抗炎症プロファイルを持つ代替活性化マクロファージが誘導され、適応反応の消失およびEAEに対する抵抗性と相関している[113]。しかし、蠕虫の抽出物が適応細胞に直接影響を与えることを否定することはできない。全体として、ヒトにおける自己免疫と訓練された免疫の表現型との関連が研究によって明らかにされ始めているが、直接的な因果関係はまだ正式に証明されていない。
現在、自然免疫の訓練過程に関与する代謝経路、エピジェネティック経路、免疫経路を阻害または活性化することにより、訓練された免疫は治療やワクチン接種を改善する魅力的なターゲットとして位置づけられている。
結論
グローバルな「エクスポソーム」の一要素である細菌曝露が、併発する感染症や自己免疫疾患の臨床経過にポジティブあるいはネガティブな影響を与えることは、現在ではよく認められている。ヒトの場合、疾患の進行に影響を及ぼす内因性因子と外因性因子が複雑に絡み合っているため、因果関係を明らかにすることはまだ難しいが、実験的研究により、先行感染、同時感染、後発感染が同時発症疾患を改善したり悪化させたりすることが明らかにされている。これらの研究により、感染症が併発する疾患の臨床転帰を変化させる多様な免疫学的プロセスが明らかになったが、ほとんどの場合、実際の効果は予測困難なままである。図5に示すように、感染による免疫調節機構には、IFN-Iの二重の役割、様々な調節経路や細胞、組織修復や損傷に対する耐性の変化、免疫細胞の極性の変化、化学誘引や免疫細胞移動の調節異常、訓練された免疫などが含まれる。
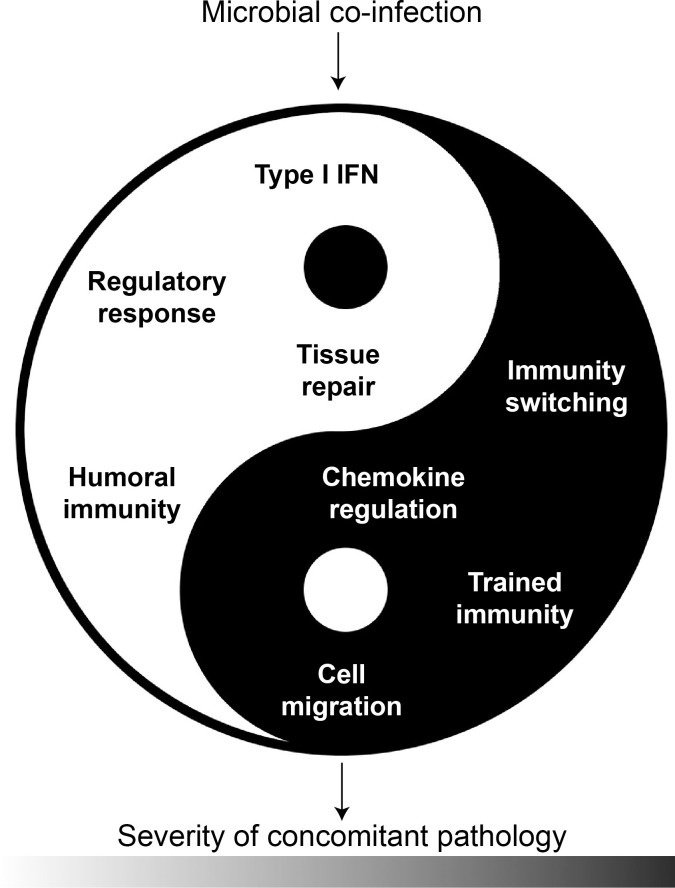
図5
図5
微生物(共)感染は、様々なメカニズムにより、感染症と自己免疫疾患を併発した際の臨床転帰をプラスにもマイナスにも変化させる可能性がある。
今後、これらの免疫調節作用を担う微生物由来分子の特徴を明らかにするために、細胞レベル、分子レベル、遺伝子レベルでのさらなる調査が必要である。これは、微生物を用いた治療の出現とその応用の基礎となるものである。現在、すでにいくつかの臨床試験が、さまざまな種類の感染症や自己免疫疾患の治療に、微生物または微生物由来の製品を使用することを目指しています(レビューについては[114])。いくつかの結果は有望であるが、この種の療法はまだ成熟しておらず、安全性と有効性に関するさらなる研究が必要である。
最後に、感染症が宿主の免疫状態に与える大きな影響により、現在のワクチン開発戦略の弱点が明らかになったことを強調することが重要である。蠕虫の感染率が高い地域に住んでいる場合、子供たちは、感染率の低い地域に住んでいる人に比べて、H1N1特異的抗体反応の低下を示す[115]。おそらく、蠕虫が免疫系に大きな影響を与えるため、欧米で開発・試験されたワクチンは、蠕虫蔓延地域では効率が悪くなる可能性があるためである。大規模なワクチン接種に再び関心が集まっている現在、こうしたデータは、こうした流行地域で治療戦略やワクチン戦略を実施する前に、共同感染のリスクをより適切に評価する必要性を強調している。
謝辞
本論文は、Abdelhadi Saoudi博士に査読を依頼し、その結果に謝意を表する。
資金提供
本研究は、国立衛生研究所(Institut National de la Santé et de la Recherche Médicale)よりNBへ、"Association pour la Recherche sur la Sclérose en Plaques" (ARSEP) よりNBへ、PIA PARAFRAP Consortium (ANR-11-LABX0024) よりNBへ、Agence Nationale pour la Recherche (ANR-18-CE15-0015, ANR-19-CE15-0008, ANR-19-CE15-0023) よりNBへ、フランス教育研究技術相 (MENRT PhD fellowship to AH)より助成金を受領し行ったものである。研究助成機関は,研究デザイン,データ収集と分析,発表の決定,原稿の作成に関与していない。
論文情報
PLoS Pathog. 2022 Feb; 18(2): e1010212.
2022年2月3日オンライン公開 doi: 10.1371/journal.ppat.1010212.
PMCID: PMC8812865
PMID: 35113966
アリ・ハッサン¤とニコラ・ブランシャール(Nicolas Blanchard*)
Salomé LeibundGut-Landmann、編集者
Toulouse Institute for Infectious and Inflammatory Diseases, Infinity, University of Toulouse, CNRS, Inserm, UPS, Toulouse, France
チューリッヒ大学(スイス
著者らは、競合する利害関係が存在しないことを宣言している。
¤現住所。現住所:パリ大学パスツール研究所、真菌感染症免疫学、パリ、フランス
E-mail: rf.mresni@drahcnalb.salocin
著作権 © 2022 Hassan, Blanchard
本論文は、Creative Commons Attribution Licenseの条件の下で配布されるオープンアクセス論文であり、原著者と出典を明記することを条件に、いかなる媒体においても無制限の使用、配布、複製を許可するものです。
PLOS Pathogensの記事は、PLOSの好意によりここに提供されています。
参考文献
Strachan DP. 花粉症、衛生、および世帯サイズ。BMJ. 1989;299(6710):1259-60。 doi:10.1136/bmj.299.6710.1259 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar]
Patterson CC, Dahlquist GG, Gyurus E, Green A, Soltesz G, Group ES. ヨーロッパにおける1989-2003年の小児1型糖尿病の発症傾向および2005-20年の新規症例予測:多施設共同前向き登録研究。Lancet. 2009;373(9680):2027-33. doi: 10.1016/S0140-6736(09)60568-7 [PubMed] [CrossRef] [Google Scholar].
Bach JF. 自己免疫における衛生仮説:病原体と常在菌の役割。Nat Rev Immunol. 2018;18(2):105-20. doi: 10.1038/nri.2017.111 [PubMed] [CrossRef] [Google Scholar].
Sotgiu S, Angius A, Embry A, Rosati G, Musumeci S. Hygiene hypothesis: innate immunity, malaria and multiple sclerosis. Med Hypotheses. 2008;70(4):819-25. doi: 10.1016/j.mehy.2006.10.069 [PubMed] [CrossRef] [Google Scholar].
Correale J, Farez M. Association between parasite infection and immune responses in multiple sclerosis. Ann Neurol. 2007;61(2):97-108. doi: 10.1002/ana.21067 [PubMed] [CrossRef] [Google Scholar].
Tanasescu R, Tench CR, Constantinescu CS, Telford G, Singh S, Frakich N, et al. Hookworm Treatment for Relapsing Multiple Sclerosis(再発性多発性硬化症に対する鉤虫治療)。再発性多発性硬化症に対する鉤虫治療:無作為化二重盲検プラセボ対照試験。JAMA Neurol. 2020;77(9):1089-98. doi: 10.1001/jamaneurol.2020.1118 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Virtanen SM, Takkinen HM, Nwaru BI, Kaila M, Ahonen S, Nevalainen J, et al. 乳幼児期の微生物曝露とその後の1型糖尿病関連自己抗体の出現:コホート研究. JAMA Pediatr. 2014;168(8):755-63. doi: 10.1001/jamapediatrics.2014.296 [PubMed] [CrossRef] [Google Scholar].
van den Biggelaar AH, van Ree R, Rodrigues LC, Lell B, Deelder AM, Kremsner PG, et al. Schistosoma haematobiumに感染した小児のアトピー減少:寄生虫誘発インターロイキン-10に対する役割. Lancet. 2000;356(9243):1723-7. doi: 10.1016/S0140-6736(00)03206-2 [PubMed] [CrossRef] [Google Scholar].
Flohr C, Tuyen LN, Lewis S, Quinnell R, Minh TT, Liem HT, et al. 不衛生と蠕虫感染症はベトナムの子供における皮膚感作から保護する。横断的研究。J Allergy Clin Immunol. 2006;118(6):1305-11. doi: 10.1016/j.jaci.2006.08.035 [PubMed] [CrossRef] [Google Scholar].
van den Biggelaar AH, Rodrigues LC, van Ree R, van der Zee JS, Hoeksma-Kruize YC, Souverijn JH, et al. 腸管蠕虫の長期治療がガボンの学童のダニ皮膚試験反応性を増加させた。J Infect Dis. 2004;189(5):892-900. doi: 10.1086/381767 [PubMed] [CrossRef] [Google Scholar].
自己免疫性肝疾患と Strongyloides stercoralis 感染の逆相関.Am J Trop Med Hyg. 2007;76(5):972-6. [PubMed] [Google Scholar].
Shaw SY, Blanchard JF, Bernstein CN. 生後1年での抗生物質の使用と小児炎症性腸疾患との関連性。Am J Gastroenterol。2010;105(12):2687-92. doi: 10.1038/ajg.2010.398 [PubMed] [CrossRef] [Google Scholar].
Hoskin-Parr L, Teyhan A, Blocker A, Henderson AJ. 生後2年間の抗生物質への曝露と7.5歳までに発症する喘息やその他のアレルギー疾患:用量依存的な関係。Pediatr Allergy Immunol. 2013;24(8):762-71. doi: 10.1111/pai.12153 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Navarra SV、Leynes MS。全身性エリテマトーデスにおける感染症。Lupus. 2010;19(12):1419-24. doi: 10.1177/0961203310374486 [PubMed] [CrossRef] [Google Scholar].
Kivity S, Agmon-Levin N, Blank M, Shoenfeld Y. Infections and autoimmunity-friends or foes? Trends Immunol. 2009;30(8):409-14. doi: 10.1016/j.it.2009.05.005 [PubMed] [CrossRef] [Google Scholar].
Wang J, Jelcic I, Muhlenbruch L, Haunerdinger V, Toussaint NC, Zhao Y, et al. HLA-DR15 分子は多発性硬化症における自己反応性T細胞レパートリーを共同で形成している。Cell. 2020;183(5):1264-81 e20. doi: 10.1016/j.cell.2020.09.054 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Hughes LE, Smith PA, Bonell S, Natt RS, Wilson C, Rashid T, et al. Acinetobacter sp., Pseudomonas aeruginosa, myelin basic protein and myelin oligodendrocyte glycoprotein in multiple sclerosis に見られる関連配列間の交差反応性。J Neuroimmunol. 2003;144(1-2):105-15. doi: 10.1016/s0165-5728(03)00274-1 [PubMed] [CrossRef] [Google Scholar].
Filippi CM, von Herrath MG. 第99回Dahlem conference on infection, inflammation and chronic inflammatory disorders: viruses, autoimmunity and immunoregulation. Clin Exp Immunol. 2010;160(1):113-9. doi: 10.1111/j.1365-2249.2010.04128.x [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Bourreau E, Ginouves M, Prevot G, Hartley MA, Gangneux JP, Robert-Gangneux F, et al. Leishmania guyanensis における Leishmania RNA Virus 1 の存在は一次治療失敗および症状再発のリスクを増大させる。J Infect Dis. 2016;213(1):105-11. doi: 10.1093/infdis/jiv355 [PubMed] [CrossRef] [Google Scholar].
Cantanhede LM, da Silva Junior CF, Ito MM, Felipin KP, Nicolete R, Salcedo JM, et al. Leishmania RNA Virus 1の存在とTegmentary Leishmaniasis患者の粘膜症状の間の関連性に関するさらなるエビデンス。PLoS Negl Trop Dis. 2015;9(9):e0004079. doi: 10.1371/journal.pntd.0004079 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Matar CG, Jacobs NT, Speck SH, Lamb TJ, Moormann AM. EBVはマラリアの病原性を変えるか?Parasite Immunol. 2015;37(9):433-45. doi: 10.1111/pim.12212 [PubMed] [CrossRef] [Google Scholar].
Kwan JL, Seitz AE, Fried M, Lee KL, Metenou S, Morrison R, et al. Seroepidemiology of helminths and the association with severe malaria among infants and young children in Tanzania.(タンザニアの乳幼児の蠕虫の血清疫学と重症マラリアとの関連性)。PLoS Negl Trop Dis. 2018;12(3):e0006345. doi: 10.1371/journal.pntd.0006345 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Lemaitre M, Watier L, Briand V, Garcia A, Le Hesran JY, Cot M. Coinfection with Plasmodium falciparum and Schistosoma haematobium: additional evidence of the protective effect of Schistosomias on malaria in Senegalese children.マラリアに対する住血吸虫症の予防効果の追加証拠. Am J Trop Med Hyg. 2014;90(2):329-34. doi: 10.4269/ajtmh.12-0431 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
このように、寄生虫とマラリア菌の相互作用は非常に複雑である。ある蠕虫種による脳マラリアに対する防御は、別の蠕虫種との共感染により損なわれる。PLoS Negl Trop Dis. 2018;12(5):e0006483. doi: 10.1371/journal.pntd.0006483 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ives A, Ronet C, Prevel F, Ruzzante G, Fuertes-Marraco S, Schutz F, et al. リーシュマニアRNAウイルスは粘膜皮膚リーシュマニア症の重症度を制御している. Science. 2011;331(6018):775-8. doi: 10.1126/science.1199326 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
また、このような感染症は、感染症の予防や治療にも有効である。Proc Natl Acad Sci U S A. 2017;114(19):4987-92. doi: 10.1073/pnas.1621447114 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Sweere JM, Van Belleghem JD, Ishak H, Bach MS, Popescu M, Sunkari V, et al. バクテリオファージは抗ウイルス免疫を誘発し、細菌感染症のクリアランスを防ぐ。サイエンス. 2019;363(6434). doi: 10.1126/science.aat9691 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Seoane PI, Taylor-Smith LM, Stirling D, Bell LCK, Noursadeghi M, Bailey D, et al. Viral infection triggers interferon-induced expulsion of live Cryptococcus neoformans by macrophages.ウイルス感染はマクロファージによってインターフェロンに誘導される。PLoS Pathog. 2020;16(2):e1008240. doi: 10.1371/journal.ppat.1008240 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Shahangian A, Chow EK, Tian X, Kang JR, Ghaffari A, Liu SY, et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice(IFNsはマウスにおけるインフルエンザ後の細菌性肺炎の発生を媒介する。J Clin Invest. 2009;119(7):1910-20. doi: 10.1172/JCI35412 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Schliehe C, Flynn EK, Vilagos B, Richson U, Swaminanthan S, Bosnjak B, et al. メチル基転移酵素Setdb2がウイルスによる細菌スーパー感染への感受性を媒介する。Nat Immunol. 2015;16(1):67-74. doi: 10.1038/ni.3046 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Kudva A, Scheller EV, Robinson KM, Crowe CR, Choi SM, Slight SR, et al. Influenza Aは、マウスにおける細菌性肺炎に対するTh17を介した宿主防御を抑制する。J Immunol. 2011;186(3):1666-74. doi: 10.4049/jimmunol.1002194 [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Er JZ, Koean RAG, Ding JL. T-betの喪失は、インフルエンザ-細菌スーパーインフェクションに生存優位性を与える。EMBO J. 2019;38(1). doi: 10.15252/embj.201899176 [PMCフリー記事] [PubMed] [CrossRef][Googleスカラー]。
Florido M, Grima MA, Gillis CM, Xia Y, Turner SJ, Triccas JA, et al. Influenza A virus infection impairs mycobacteria-specific T cell responses and mycobacterial clearance in the lung during pulmonary coinfection.肺のインフルエンザウイルス感染は、肺のマイコバクテリア特異的T細胞反応とマイコバクテリアクリアランスを損なう。J Immunol. 2013;191(1):302-11. doi: 10.4049/jimmunol.1202824 [PubMed] [CrossRef] [Google Scholar].
Sabbatani S, Manfredi R, Marinacci G, Pavoni M, Cristoni L, Chiodo F. Reactivation of severe, acute pulmonary tuberculosis during treatment with pegylated interferon-alpha and ribavirin for chronic HCV hepatitis. Scand J Infect Dis. 2006;38(3):205-8. doi: 10.1080/00365540500263268 [PubMed] [CrossRef] [Google Scholar].
Hassan A, Wlodarczyk MF, Benamar M, Bassot E, Salvioni A, Kassem S, et al. A Virus Hosted in Malaria-Infected Blood is Protects against T Cell-Mediated Inflammatory Diseases by Impairing DC Function in a Type I IFN-Dependent Manner.mBio. 2020;11(2). [PMC フリーアーティクル] [PubMed] [Google Scholar].
Fuertes Marraco SA, Scott CL, Bouillet P, Ives A, Masina S, Vremec D, et al. Type I interferon drives dendritic cell apoptosis via multiple BH3-only proteins following activation by PolyIC in vivo. In vivo. PLoS ONE. 2011;6(6):e20189. doi: 10.1371/journal.pone.0020189 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Cousens LP、Orange JS、Su HC、Biron CA。インターフェロンα/βは、in vitroおよびウイルス感染時の内因性でのインターロイキン12およびインターフェロンγの産生を抑制する。Proc Natl Acad Sci U S A. 1997;94(2):634-9. doi: 10.1073/pnas.94.2.634 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Pane JA, Webster NL, Coulson BS. ロタウイルスは、形質細胞様樹状細胞におけるtoll-like receptor 7シグナルおよびインターフェロン産生を誘発することにより、非肥満性糖尿病マウスのリンパ球を活性化する。PLoS Pathog. 2014;10(3):e1003998. doi: 10.1371/journal.ppat.1003998 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ferreira RC, Guo H, Coulson RM, Smyth DJ, Pekalski ML, Burren OS, et al. A type I interferon transcriptional signature precedes autoimmunity in children genetically at risk for type 1 diabetes.フェレイラRC、グオH、クールソンRM、スマイスDJ、ペカルスキーML、バーレンOS、他。Diabetes. 2014;63(7):2538-50. doi: 10.2337/db13-1777 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Xia CQ, Peng R, Chernatynskaya AV, Yuan L, Carter C, Valentine J, et al. Increased IFN-alpha-producing plasmacytoid dendritic cells (pDC) in human Th1-mediated type one diabetes: pDC augment Th1 responses through IFN-alpha production. J Immunol. 2014;193(3):1024-34. doi: 10.4049/jimmunol.1303230 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Capua I, Mercalli A, Pizzuto MS, Romero-Tejeda A, Kasloff S, De Battisti C, et al. Influenza A viruses grow in human pancreatic cells and cause pancreatitis and diabetes in an animal model. J Virol. 2013;87(1):597-610. doi: 10.1128/JVI.00714-12 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Gaignage M, Marillier RG, Uyttenhove C, Dauguet N, Saxena A, Ryffel B, et al. マウスニドウィルスLDV感染は移植片対宿主病を緩和し、IFN依存的に樹状細胞および同種応答性T細胞の抑制を誘導する。Immun Inflamm Dis. 2017;5(2):200-13. doi: 10.1002/iid3.157 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Moreira-Teixeira L, Mayer-Barber K, Sher A, O'Garra A. Type I interferons in tuberculosis(結核におけるI型インターフェロン)。結核における I 型インターフェロン:敵であり、時に味方である。J Exp Med. 2018;215(5):1273-85. doi: 10.1084/jem.20180325 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Wang N, Zhan Y, Zhu L, Hou Z, Liu F, Song P, et al. Retrospective Multicenter Cohort Study Shows Early Interferon Therapy Is Associated with Favorable Clinical Responses in COVID-19 Patients.レトロスペクティブ多施設コホート研究、早期インターフェロン療法はCOVID-19患者の良好な臨床的反応と関連する。Cell Host Microbe. 2020;28(3):455-64 e2. doi: 10.1016/j.chom.2020.07.005 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Jamieson AM, Pasman L, Yu S, Gamradt P, Homer RJ, Decker T, et al. Role of tissue protection in lethal respiratory viral-bacterial coinfection(致死的な呼吸器ウイルス-細菌共感染における組織保護の役割). サイエンス. 2013;340(6137):1230-4. doi: 10.1126/science.1233632 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Talmi-Frank D, Altboum Z, Solomonov I, Udi Y, Jaitin DA, Klepfish M, et al. MT1-MMPによる細胞外マトリックスのタンパク質分解は、インフルエンザ関連の組織損傷および死亡率に寄与している。Cell Host Microbe. 2016;20(4):458-70. doi: 10.1016/j.chom.2016.09.005 [PubMed] [CrossRef] [Google Scholar].
Povoleri GAM, Nova-Lamperti E, Scotta C, Fanelli G, Chen YC, Becker PD, et al. Human retinoic acid-regulated CD161(+) regulatory T cells support wound repair in intestinal mucosa.ヒトレチノイン酸制御CD161(+)制御T細胞は腸粘膜の創傷修復をサポートする。Nat Immunol. 2018;19(12):1403-14. doi: 10.1038/s41590-018-0230-z [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
T細胞受容体特異性は、急性損傷した骨格筋内の制御性T細胞の修復性集団の蓄積を促進する。Proc Natl Acad Sci U S A. 2019;116(52):26727-33. doi: 10.1073/pnas.1914848116 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Mooney JP, Butler BP, Lokken KL, Xavier MN, Chau JY, Schaltenberg N, et al. 腸内の非チフス性サルモネラに対する粘膜炎症反応は、マラリア原虫同時感染時にIL-10によって鈍化される。Mucosal Immunol. 2014;7(6):1302-11. doi: 10.1038/mi.2014.18 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Hartmann W, Brunn ML, Stetter N, Gagliani N, Muscate F, Stanelle-Bertram S, et al. Helminth Infections Suppress the Efficacy of Vaccination against Seasonal Influenza.(蠕虫感染症は季節性インフルエンザに対するワクチン接種の効果を抑制する).Cell Rep. Cell Rep. 2019;29(8):2243-56 e4. doi: 10.1016/j.celrep.2019.10.051 [PubMed] [CrossRef] [Google Scholar].
Marple A, Wu W, Shah S, Zhao Y, Du P, Gause WC, et al. Correction: Cutting Edge: Helminth Coinfection Blocks Effector Differentiation of CD8 T Cells through Alternate Host Th2- and IL-10-Mediated Responses. J Immunol. 2017;199(8):3005. doi: 10.4049/jimmunol.1701193 [PubMed] [CrossRef] [Google Scholar].
Smith LK, Boukhaled GM, Condotta SA, Mazouz S, Guthmiller JJ, Vijay R, et al. Interleukin-10 Directly Inhibits CD8(+) T Cell Function by Enhancing N-Glycan Branching to Decrease Antigen Sensitivity.インターロイキン10は、N-グリカン分岐を増強して、抗原感度を低下させ、CD8(+)T細胞の機能を阻害する。Immunity. 2018;48(2):299-312 e5. doi: 10.1016/j.immuni.2018.01.006 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
George PJ, Anuradha R, Kumaran PP, Chandrasekaran V, Nutman TB, Babu S. Modulation of mycobacterial-specific Th1 and Th17 cells in latent tuberculosis by coincident hookworm infection(潜伏結核における鉤虫感染による結核菌特異的Th1およびTh17細胞の調節). J Immunol. 2013;190(10):5161-8. doi: 10.4049/jimmunol.1203311 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ring S, Eggers L, Behrends J, Wutkowski A, Schwudke D, Kroger A, et al. IL-10 受容体シグナルを遮断すると、インフルエンザによる増悪時に結核菌感染が改善される。JCI Insight. 2019;5(10):e1265335. doi: 10.1172/jci.insight.126533 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
このような場合、「痰が出る」「痰が絡む」「痰が絡まない」「痰が絡む」「痰が絡まない」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」「痰が絡む」。PLoS Negl Trop Dis. 2015;9(8):e0003994. doi: 10.1371/journal.pntd.0003994 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
また、このような場合にも、「臓器移植」を行うことができる。Nat Immunol. 2017;18(12):1310-20. doi: 10.1038/ni.3857 [PubMed] [CrossRef] [Google Scholar].
Correale J, Farez MF. 多発性硬化症の経過に対する寄生虫感染の影響。J Neuroimmunol。2011;233(1-2):6-11. doi: 10.1016/j.jneuroim.2011.01.002 [PubMed] [CrossRef] [Google Scholar].
Farias AS, Talaisys RL, Blanco YC, Lopes SC, Longhini AL, Pradella F, et al. Plasmodium chabaudi感染時の制御性T細胞誘導は、実験的自己免疫脳脊髄炎の臨床経過を変更させる。PLoS ONE. 2011;6(3):e17849. doi: 10.1371/journal.pone.0017849 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Thome R, Issayama LK, Alves da Costa T, Gangi RD, Ferreira IT, Raposo C, et al. Plasmodium berghei 粗抽出物で処理した樹状細胞は免疫調整特性を獲得し、自己免疫性神経炎症の発生を抑制する。Immunology. 2014;143(2):164-73. doi: 10.1111/imm.12298 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Zaccone P, Burton O, Miller N, Jones FM, Dunne DW, Cooke A. Schistosoma mansoni egg antigens induce Treg that participate in diabetes prevention in NOD mice.ザッコーニ、バートン、ミラー、ジョーンズ、ダン、クック、A. Eur J Immunol. 2009;39(4):1098-107. doi: 10.1002/eji.200838871 [PubMed] [CrossRef] [Google Scholar].
Mishra PK, Patel N, Wu W, Bleich D, Gause WC. 腸管寄生虫の感染による1型糖尿病の予防には、Th2型反応の非存在下でIL-10が必要である。Mucosal Immunol. 2013;6(2):297-308. doi: 10.1038/mi.2012.71 [PubMed] [CrossRef] [Google Scholar].
ラジャゴパランG、クドバYC、センMM、マリエッタEV、ムラリN、ナスK、他 IL-10欠損は、非肥満性糖尿病マウスにおける独自の免疫システムの欠陥のマスクと臓器特異的自己免疫の制御の違いを明らかにしない。Cytokine. 2006;34(1-2):85-95. doi: 10.1016/j.cyto.2006.04.006 [PubMed] [CrossRef] [Google Scholar].
IL-2は、膵臓制御性T細胞に対する局所的効果によって、NODマウスの確立した1型糖尿病を逆転させる。J Exp Med. 2010;207(9):1871-8. doi: 10.1084/jem.20100209 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, et al. Probiotic-induced suppression of allergic sensitization and airway inflammation is associated with an increase of T regulatory-dependent mechanisms in a murine model of asthma.喘息モデルにおけるプロバイオティクスによるアレルギー感作および気道炎症の抑制と、T調節依存性メカニズムの増加。Clin Exp Allergy. 2007;37(4):498-505. doi: 10.1111/j.1365-2222.2006.02629.x [PubMed] [CrossRef] [Google Scholar].
Schistosoma japonicum egg antigens stimulate CD4 CD25 T cells and modulate airway inflammation in a murine model of asthma. Immunology. 2007;120(1):8-18. doi: 10.1111/j.1365-2567.2006.02472.x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Amu S, Saunders SP, Kronenberg M, Mangan NE, Atzberger A, Fallon PG. B細胞は、FoxP3陽性T制御細胞を介して、マウスモデルでアレルギー性気道炎を予防・回復させる。J Allergy Clin Immunol. 2010;125(5):1114-24 e8. doi: 10.1016/j.jaci.2010.01.018 [PubMed] [CrossRef] [Google Scholar].
Gao X, Ren X, Wang Q, Yang Z, Li Y, Su Z, et al. Helminth parasite-induced protection against allergic airway inflammationにおける制御性B細胞およびT細胞の重要な役割. Clin Exp Immunol. 2019;198(3):390-402. doi: 10.1111/cei.13362 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Watanabe R, Ishiura N, Nakashima H, Kuwano Y, Okochi H, Tamaki K, et al. Regulatory B cells (B10 cells) has a suppressive role in murine lupus.マウス狼瘡における制御性B細胞(B10細胞)の役割: CD19とB10細胞の欠損が全身性自己免疫を増悪させる。J Immunol. 2010;184(9):4801-9. doi: 10.4049/jimmunol.0902385 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
また、このような場合にも、「痒み」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」の5種類の痒み止めが必要となる。J Immunol. 2011;186(10):5569-79. doi: 10.4049/jimmunol.1100284 [PubMed] [CrossRef] [Google Scholar].
松下俊之、堀川正樹、岩田弥生、Tedder TF. このように、B10細胞は実験的自己免疫性脳脊髄炎の発症と後期免疫病態の制御において、それぞれ独立した役割を担っている。J Immunol. 2010;185(4):2240-52. doi: 10.4049/jimmunol.1001307 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
このような場合、「結核の免疫」と「結核治療に対する臨床的反応」の両方にマイナスの影響を与える。Clin Exp Immunol. 2007;147(1):45-52. doi: 10.1111/j.1365-2249.2006.03247.x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
このような場合、「痒み」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」の5つを選択する。J Exp Med. 2011;208(9):1863-74. doi: 10.1084/jem.20091473 [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Anuradha R, Munisankar S, Bhootra Y, Dolla C, Kumaran P, Nutman TB, et al. Anthelmintic Therapy Modifies the Systemic and Mycobacterial Antigen-Stimulated Cytokine Profile in Helminth-Latent Mycobacterium tuberculosis Coinfection.(蠕虫病と結核菌感染症における駆虫薬治療による全身および菌抗原刺激サイトカインプロファイルの変化). Infect Immun. 2017;85(4). doi: 10.1128/IAI.00973-16 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
McLaughlin TA, Khayumbi J, Ongalo J, Tonui J, Campbell A, Allana S, et al. CD4 T Cells in Mycobacterium tuberculosis and Schistosoma mansoni Co-infected Individuals Maintain Functional TH1 Responses. Front Immunol. 2020;11:127. doi: 10.3389/fimmu.2020.00127 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ahmed N, French T, Rausch S, Kuhl A, Hemminger K, Dunay IR, et al. Toxoplasma Co-infection Prevent Th2 Differentiation and Leads to a Helminth-Specific Th1 Response. Front Cell Infect Microbiol. 2017;7:341. doi: 10.3389/fcimb.2017.00341 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Khan IA, Hakak R, Eberle K, Sayles P, Weiss LM, Urban JF Jr. Heligmosomoides polygyrusとのコインフェクションは、Toxoplasma gondiiに対するCD8+ T細胞免疫を確立することができない。Infect Immun. 2008;76(3):1305-13. doi: 10.1128/IAI.01236-07 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Aira N, Andersson AM, Singh SK, McKay DM, Blomgran R. Helminth-derived antigens on human macrophage infected with Mycobacterium tuberculosis.Species dependent impact of helminth-derived antigens on the spies different: 自然抗菌反応への直接効果。PLoS Negl Trop Dis. 2017;11(2):e0005390. doi: 10.1371/journal.pntd.0005390 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Rajamanickam A, Munisankar S, Bhootra Y, Dolla CK, Nutman TB, Babu S. Coexistent Helminth Infection-Mediated Modulation of Chemokine Responses in Latent Tuberculosis(蠕虫感染の共存と潜伏結核におけるケモカイン応答の調節). J Immunol. 2019;202(5):1494-500. doi: 10.4049/jimmunol.1801190 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Rajamanickam A, Munisankar S, Dolla C, Menon PA, Nutman TB, Babu S. Helminth Coinfection Alters Monocyte Activation, Polarization, and Function in Latent Mycobacterium tuberculosis Infection.蠕虫感染症は結核菌の活性化、分極、および機能を変化させる。J Immunol. 2020;204(5):1274-86. doi: 10.4049/jimmunol.1901127 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Souriant S, Balboa L, Dupont M, Pingris K, Kviatcovsky D, Cougoule C, et al. Tuberculosis Exacerbates HIV-1 Infection through IL-10/STAT3-Dependent Tunneling Nanotube Formation in Macrophage(結核はマクロファージにおけるIL-10/STAT3依存性のトンネル型ナノチューブ形成を通じてHIV-1感染を悪化させる。Cell Rep. 2019;26(13):3586-99 e7. doi: 10.1016/j.celrep.2019.02.091 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Gruden-Movsesijan A, Ilic N, Mostarica-Stojkovic M, Stosic-Grujic S, Milic M, Sofronic-Milosavljevic L. Mechanisms of modulation of experimental autoimmune encephalomyelitis by chronic Trichinella spiralis infection in Dark Agouti rats.日本におけるトリコネラ感染による脳炎の発症メカニズムの解明。Parasite Immunol. 2010;32(6):450-9. doi: 10.1111/j.1365-3024.2010.01207.x [PubMed] [CrossRef] [Google Scholar].
Schistosoma mansoni 感染は炎症性メディエーターの制御を介してコラーゲン誘発関節炎の重症度を低下させる。Int J Parasitol. 2009;39(4):457-64. doi: 10.1016/j.ijpara.2008.08.007 [PubMed] [CrossRef] [Google Scholar].
Teo TH, Howland SW, Claser C, Gun SY, Poh CM, Lee WW, et al. Chikungunya virusとの共感染は、脳への病原性CD8(+) T細胞の輸送を変化させ、Plasmodium-誘導神経病理を防止する。EMBO Mol Med. 2018;10(1):121-38. doi: 10.15252/emmm.201707885 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Teo TH, Lum FM, Ghaffar K, Chan YH, Amrun SN, Tan JJL, et al. 原虫の共感染はチクングニアウイルスによる病態から保護される。Nat Commun. 2018;9(1):3905. doi: 10.1038/s41467-018-06227-9 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar] (英語)。
Wang ML, Feng YH, Pang W, Qi ZM, Zhang Y, Guo YJ, et al. Schistosoma japonicumとPlasmodium bergheiの共感染時の寄生虫密度はマウスの脳マラリアへの感受性を調節している。Malar J. 2014;13:116. doi: 10.1186/1475-2875-13-116 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Bhattacharjee S, Mejias-Luque R, Loffredo-Verde E, Toska A, Flossdorf M, Gerhard M, et al. S. mansoni and H. pyloriの併発感染は抗原経験細胞のプロモスクイットと低い線維性反応のために肝臓をプライムする. Cell Rep. 2019;28(1):231-44 e5. doi: 10.1016/j.celrep.2019.05.108 [PubMed] [CrossRef] [Google Scholar].
Long SR, Lanter BB, Pazos MA, Mou H, Barrios J, Su CW, et al. 腸管蠕虫感染症は、細菌による好中球の気圏への動員を促進する。Sci Rep. 2019;9(1):15703. doi: 10.1038/s41598-019-51991-3 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ivanov I, Kuhn H, Heydeck D. Structural and functional biology of arachidonic acid 15-lipoxygenase-1 (ALOX15). Gene. 2015;573(1):1-32. doi: 10.1016/j.gene.2015.07.073 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Pazos MA, Pirzai W, Yonker LM, Morisseau C, Gronert K, Hurley BP. ヘポキシリン A3 とロイコトリエン B4 の異なる細胞ソースは、細菌によって誘導された好中球の上皮横断移動の調整に使用されている。J Immunol. 2015;194(3):1304-15. doi: 10.4049/jimmunol.1402489 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Christen U, Benke D, Wolfe T, Rodrigo E, Rhode A, Hughes AC, et al. Cure of prediabetic mice by viral infections involves lymphocyte recruitment along an IP-10 gradient. J Clin Invest. 2004;113(1):74-84. doi: 10.1172/JCI17005 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Blackmore S, Hernandez J, Juda M, Ryder E, Freund GG, Johnson RW, et al. Influenza infection triggers disease in a genetic model of experimental autoimmune encephalomyelitis.インフルエンザ感染による実験的自己免疫性脳脊髄炎の遺伝子モデルにおける疾患の発症。Proc Natl Acad Sci U S A. 2017;114(30):E6107-E16. doi: 10.1073/pnas.1620415114 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
マラリアとガンマヘルペスウイルスの共感染は、抗寄生虫体液性免疫を抑制する。PLoS Pathog. 2015;11(5):e1004858. doi: 10.1371/journal.ppat.1004858 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Wolf AI, Strauman MC, Mozdzanowska K, Whittle JR, Williams KL, Sharpe AH, et al. Streptococcus pneumoniaeとの共感染は、インフルエンザウイルスに対するB細胞応答を調節する。J Virol. 2014;88(20):11995-2005. doi: 10.1128/JVI.01833-14 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Poole BD, Gross T, Maier S, Harley JB, James JA. EBNA-1 断片を免疫した後のウサギとマウスにおけるループス様自己抗体の発現。J Autoimmun. 2008;31(4):362-71. doi: 10.1016/j.jaut.2008.08.007 [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Bansal D, Herbert F, Lim P, Deshpande P, Becavin C, Guiyedi V, et al. IgG autoantibody to brain beta tubulin III associated with cytokine cluster-II discriminate cerebral malaria in central India(インド中央部の脳マラリアを識別する脳βチューブリンIIIに対するIgG自己抗体). PLoS ONE. 2009;4(12):e8245. doi: 10.1371/journal.pone.0008245 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
リベラ-コレアJ、Guthmiller JJ、Vijay R、Fernandez-Arias C、Pardo-Ruge MA、Gonzalez S、他。 原虫DNAが媒介するTLR9のT-bet(+)B細胞活性化はマラリア中の自己免疫性貧血に寄与する。Nat Commun. 2017;8(1):1282. doi: 10.1038/s41467-017-01476-6 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Netea MG, Quintin J, van der Meer JW. 訓練された免疫:自然宿主防御のためのメモリ。Cell Host Microbe. 2011;9(5):355-61. doi: 10.1016/j.chom.2011.04.006 [PubMed] [CrossRef] [Google Scholar].
また、このような感染症が発生した場合、その感染症がどのような影響を及ぼすのか、そのメカニズムを解明することが重要である。Cell Host Microbe. 2012;12(2):223-32. doi: 10.1016/j.chom.2012.06.006 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Saeed S, Quintin J, Kerstens HH, Rao NA, Aghajanirefah A, Matarese F, et al. Epigenetic programming of monocyte-to-macrophage differentiation and trained innate immunity.(単球からマクロファージへの分化と自然免疫のエピジェネティックプログラミング). Science. 2014;345(6204):1251086. doi: 10.1126/science.1251086 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Dos Santos JC, Barroso de Figueiredo AM, Teodoro Silva MV, Cirovic B, de Bree LCJ, Damen M, et al. beta-Glucan-Induced Trained Immunity Protects against Leishmania braziliensis Infection : a Crucial Role for IL-32. Cell Rep. 2019;28(10):2659-72 e6. doi: 10.1016/j.celrep.2019.08.004 [PubMed] [CrossRef] [Google Scholar].
Ciarlo E, Heinonen T, Theroude C, Asgari F, Le Roy D, Netea MG, et al. 訓練された免疫は細菌感染に対して幅広いスペクトルの防御を付与する。J Infect Dis. 2020;222(11):1869-81. doi: 10.1093/infdis/jiz692 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Schrum JE, Crabtree JN, Dobbs KR, Kiritsy MC, Reed GW, Gazzinelli RT, et al. Cutting Edge: Plasmodium falciparum Induces Trained Innate Immunity.(最先端:熱帯熱マラリア原虫は訓練された自然免疫を誘導する). J Immunol. 2018;200(4):1243-8. doi: 10.4049/jimmunol.1701010 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Kleinnijenhuis J, Quintin J, Preijers F, Joosten LA, Ifrim DC, Saeed S, et al. Bacille Calmette-Guerin induces NOD2-dependent nonspecific protection from reinfection via epigenetic reprogramming of monocytes.(BCGは単球のエピジェネティックな再プログラミングを介してNOD2依存性の非感染防御を誘導する). Proc Natl Acad Sci U S A. 2012;109(43):17537-42. doi: 10.1073/pnas.1202870109 [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Kleinnijenhuis J, Quintin J, Preijers F, Joosten LA, Jacobs C, Xavier RJ, et al. BCG-induced trained immunity in NK cells.BCGは、NK細胞における訓練された免疫である。BCG が誘発する NK 細胞における訓練された免疫:感染に対する非特異的防御の役割。Clin Immunol. 2014;155(2):213-9. doi: 10.1016/j.clim.2014.10.005 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Arts RJW, Moorlag S, Novakovic B, Li Y, Wang SY, Oosting M, et al. BCG Vaccination Protects against Experimental Viral Infection in Humans through the Induction of Cytokines Associated with Trained Immunity.BCGワクチン接種はヒトの実験的ウイルス感染から保護する. Cell Host Microbe. 2018;23(1):89-100 e5. doi: 10.1016/j.chom.2017.12.010 [PubMed] [CrossRef] [Google Scholar].
Kaufmann E, Sanz J, Dunn JL, Khan N, Mendonca LE, Pacis A, et al. BCG Educates Hematopoietic Stem Cells to Generate Protective Innate Immunity against Tuberculosis.BCGは結核に対する保護的な自然免疫力を生成する。Cell. 2018;172(1-2):176-90 e19. doi: 10.1016/j.cell.2017.12.031 [PubMed] [CrossRef] [Google Scholar].
de Laval B, Maurizio J, Kandalla PK, Brisou G, Simonnet L, Huber C, et al. C/EBPbeta-Dependent Epigenetic Memory Induces Trained Immunity in Hematopoietic Stem Cells.C/EBPβ依存的エピジェネティックメモリーは造血幹細胞において訓練された免疫力を誘導する。Cell Stem Cell. 2020;26(5):657-74 e8. doi: 10.1016/j.stem.2020.01.017 [PubMed] [CrossRef] [Google Scholar].
Netea MG, Giamarellos-Bourboulis EJ, Dominguez-Andres J, Curtis N, van Crevel R, van de Veerdonk FL, et al. Trained Immunity: a Tool for Reducing Susceptibility to and the Severity of SARS-CoV-2 Infection.(訓練された免疫:SARS-CoV-2感染の感受性と重症度を低減するためのツール)。Cell. 2020;181(5):969-77. doi: 10.1016/j.cell.2020.04.042 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Kavai M, Szegedi G. Immune complex clearance by monocytes and macrophages in systemic lupus erythematosus. Doi: 10.1016/j.autrev.2007.01.017 [PubMed] [CrossRef] [Google Scholar].
Liote F, Boval-Boizard B, Weill D, Kuntz D, Wautier JL. 関節リウマチにおける血中単球の活性化:単球接着性、インテグリン発現、サイトカイン放出量の増加。Clin Exp Immunol. 1996;106(1):13-9. doi: 10.1046/j.1365-2249.1996.d01-820.x [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Malemud CJ.PI3K/Akt/PTEN/mTOR経路:関節リウマチにおける細胞死誘導のための実りある標的か?Future Med Chem. 2015;7(9):1137-47. doi: 10.4155/fmc.15.55 [PubMed] [CrossRef] [Google Scholar].
Zhu H, Hu F, Sun X, Zhang X, Zhu L, Liu X, et al. CD16(+) Monocyte Subset Was Enriched and Functionally Exacerbated in Driving T-Cell Activation and B-Cell Response in Systemic Lupus Erythematosus. Front Immunol. 2016;7:512. doi: 10.3389/fimmu.2016.00512 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Quinn SM, Cunningham K, Raverdeau M, Walsh RJ, Curham L, Malara A, et al. Helminth Productsを介した抗炎症性訓練免疫は、T細胞媒介性自己免疫疾患の誘発を抑止する. Front Immunol. 2019;10:1109. doi: 10.3389/fimmu.2019.01109 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Ryan SM, Eichenberger RM, Ruscher R, Giacomin PR, Loukas A. Harnessing helminth-driven immunoregulation in the search for novel therapeutic modalities(新規治療法の探索における蠕虫駆動型免疫調節の活用)。PLoS Pathog. 2020;16(5):e1008508. doi: 10.1371/journal.ppat.1008508 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
van Riet E, Adegnika AA, Retra K, Vieira R, Tielens AG, Lell B, et al. 地方および半都市部に住むガボン人小児におけるインフルエンザに対する細胞性および体液性応答. J Infect Dis. 2007;196(11):1671-8. doi: 10.1086/522010 [PubMed] [CrossRef] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
