組織工学的に作られた血管 自家移植片に代わるもの?
Michel R. Hoenig、Gordon R. Campbell、Barbara E. Rolfe、Julie H. Campbell
Originally published10 Feb 2005
https://doi.org/10.1161/01.ATV.0000158996.03867.72Arteriosclerosis, Thrombosis, and Vascular Biology.2005;25:1128-1134
元記事はこちら。
要 旨
虚血性心疾患や末梢血管疾患に対する血行再建術は依然として血管バイパス移植が主流であるが、多くの患者は採取に適した健康な血管を有していない。そのため、合成高分子製の人工血管が開発されたが、合成高分子表面は弾力性に乏しく、コンプライアンスが低く、血栓を生じやすいため、高流量・低抵抗の条件での使用に限定される。
このニーズを満たすために、いくつかの研究室では、鋳型や補綴物または生分解性の足場を用いてin vivoまたはin vitroの組織工学的血管を製造してきたが、それぞれの人工グラフトには大きな問題がある。
最近では、移植する動物の腹腔内で導管を増殖させ、拒絶反応を起こさず、2~3週間という短期間で移植できるようになった。移植後はリモデリングが起こり、本来の血管とほとんど見分けがつかない状態になる。この導管は骨髄由来の細胞に由来しており、血管のモデリングやリモデリングに新たな可能性をもたらしている。
いくつかの研究室では、型や補綴物あるいは生分解性の足場を用いて組織工学的な血管を作製しているが、それぞれ大きな問題点を抱えている。最近、骨髄由来の細胞に由来する自家血管導管が、動物の腹腔内で培養されるようになった。この技術は、血管のモデリングやリモデリングに新しい可能性を開くものである。
血管バイパス術は、虚血性心疾患や末梢血管疾患に対する血行再建術の主流であり、米国だけでも年間140万件の動脈バイパス術が行われている。しかし、約10万人の患者が適切な自家動脈または静脈を持っていません。1 合成材料(主にダクロンとポリテトラフルオロエチレン;PTFE)が末梢血管疾患の治療に頻繁に使用されていますが、合成表面の弾力性、4コンプライアンスが低く、血栓形成性があるため、高流量/低抵抗の条件2、3 に限られています5。冠動脈疾患の治療に用いられる自家移植片には、伏在静脈、内乳動脈、橈骨動脈がある。9,10 静脈移植片は血栓、閉塞、動脈瘤を起こしやすいのに対し、動脈移植片は臨床的にも血管造影的にも優れた結果をもたらすが、それはプロスタサイクリン産生の増大11 血管を通じた血液供給12 および本来の冠動脈径との適合に起因する。しかし、静脈は(動脈と同様に)常に利用できるとは限らず、その結果、望ましい最終生成物を設計する必要がある。
ここでは、人工血管の作製に使用されるいくつかのin vitroおよびin vivoの方法について、私たち独自のin vivo腹腔内モデルを含めて説明する。
人工血管の生体内工学
人工血管の改良
合成高分子人工血管の改良には、抗血栓薬の埋め込み、内皮細胞の播種、あるいは新しいバイオマテリアルの開発などが試みられている。ヘパリンでコートされたグラフトは標準的な人工血管より良好な結果を示したが、一般に改善はわずかであり14、ヘパリンは血漿中に急速に失われる15。このアプローチを拡張して、グラフトにジピリダモール、16ヒルジン、17組織因子経路阻害剤、18または非血栓性リン脂質ポリマーを埋め込むことが行われた19。
21 内皮細胞の供給源としては、静脈、脂肪組織毛細血管、血中細胞、循環 CD34+幹細胞などがある22。内皮細胞は裸の人工血管表面には接着しにくいた め23、グラフト材料はしばしばRGD配列ペプチド24、フィブロ ネクチンなどのマトリックスタンパク質25、線維芽細胞増殖因子26や 内皮細胞増殖因子27などの増殖因子、あるいは複合 コーティング28で被覆することにより、保持を強化するこ とができる。移植時にグラフト表面に細胞を播種しても、ヒトではグラフト開存性 を改善しないようなので29 、内皮細胞を採取し、グラフト材に播種し、コン フルエントになるまで培養してから移植するという複雑な2段階 の作業が必要である。この方法は、末梢血行再建術や冠動脈血行再建術の合成グラフトに使用され、一定の成功を収めている31。人工グラフトに播種された他の細胞タイプには、中皮細胞32や骨髄細胞33がある。
ポリウレタンは、ダクロンやPTFEに比べてコンプライアンスが高いため、機械的および流動的パラメータが本来の血管系のパラメータによく適合することから、代替グラフト材料として研究されてきた。ポリウレタンを使用した初期の試みは、従来の人工血管と比較して動脈瘤の形成や血栓症の発生率が高いという結果になりました。
管状臓器からの天然足場
内臓平滑筋臓器は、血管と同様の細胞外マトリックス蛋白質を含んでおり、これらの臓器からの脱細胞化スキャフォールドは、ex vivoバイオリアクターなしで人工血管として広範囲に使用されてきた。しかし、これらの足場の製造方法には問題があり、抗原性を低下させるためにグルタルアルデヒドで処理することは、悪い結果と関連している37。にもかかわらず、Lantzは自家血管移植として犬の空腸粘膜下層を移植してから28日後に、組織が内皮の層で覆われ、本来の血管系と同様の組織外観を有することを見いだした。この良好な結果は、ウシコラーゲンを強化した非細胞性粘膜下移植片を使用したHuynhらによって確認され た40 。移植後、腸管粘膜下移植片のリモデリングにより、 機械特性41 と構造特性42 が正常血管系と同様になった。腹膜で汚染された豚に移植した場合、腸粘膜下層は標準的なPTFEプロ テーゼと比較して、グラフト感染の割合が有意に低く、偽性動脈瘤の割合 も低い傾向があった43 。
足場として使用される他の異種臓器には、脱細胞化したブタ大動脈44、総頸動脈45、腸骨動脈46、ウシ尿管37がある。しかしながら、この方法はグラフトの成熟期間を必要とせず、既製品として使用でき、 構成材料が豊富にあるため、人工動脈を作成する方法として魅力的である。
異物(マンドレル)による人工血管の作製
マンドレルは、足場とは対照的に、動脈を形成するための型であり、移植前に取り外される。塚越らは、異物(マンドレル)に対する宿主の炎症反応を利用して、自家筋膜を線維性コラーゲンチューブの骨格として用い、in vivoで人工血管を作成した47。
1ヶ月後、インプラントを切除し、シリコンのマンドレルを取り除き、チューブを人工血管として使用したところ、73%の開存性が認められた。残念なことに、人工血管に見られるような新生内膜が移植片の吻合端に見られた。この方法は1969年にSparksによってすでにヒトで試みられていたが48、高い確率で血栓と動脈瘤が発生していた49。これは、血流の悪い地域の高齢患者から採取したグラフトでは組織の質が変わりやすいためと思われる。
人工血管の生体内工学
恒久的な人工スカフォールド
WeinbergとBellは、ダクロンメッシュ上でウシの線維芽細胞と平滑筋細胞を培養し、内皮細胞を播種して、最初の組織工学的人工血管を作った50。
最近、コラーゲンやデルマタン硫酸を人工血管の足場に埋め込んでから、線維芽細胞や平滑筋細胞、内皮細胞を播種した51。この方法は、動物の総頸動脈に移植後23〜26週で80%程度の開存率を示している52。内皮前駆細胞は患者の末梢血から採取でき、侵襲的な採取方法を必要としないため、特に魅力的な細胞源となる。55 その他、永久足場のパラダイムを修正するものとして、流体条件下での細胞の培養が挙げられる56。
生分解性スキャフォールド
この方法は、血管の形成とリモデリングに伴って足場が分解することを除けば、永久的な人工足場に使用されるものと同様である。Shum-Timらは、子羊頸動脈の細胞を播種し、子羊大動脈に移植したポリグリコール酸とポリヒドロキシアルカン酸のポリマーは、5ヶ月で100%の開存率を示したことを示した57。同様の研究で、Niklasonは、ウシ平滑筋細胞を播種し、8週間脈動流条件に曝した改良ポリグリコール酸スキャフォールドをブタに移植した4週間後に100%の開存性を示した58。これらの移植片の収縮反応は正常ウサギ大動脈のわずか5%だったが、2000mmHg以上の破裂圧力があった。McKeeらは、このモデルで強い人工動脈を作るには、平滑筋細胞が培養中にその表現型を失い59 、老化を迎える前に有限回分裂する傾向があるため、限界があると仮定した。そこで彼らは、成体ヒト平滑筋にヒトテロメラーゼ逆転写酵素サブユニットの異所性発現を誘導し、細胞の寿命を延長させた1。
60 この材料は皮膚や軟骨の組織工学で使われており、ヒアルロニダーゼによって自然に分解され、細胞外マトリックスの生成と血管新生を誘発する生成物になるという理論的利点がある61。生分解性スキャフォールドは必ずしも完全に分解されるとは限らず62、炎症反応を誘発する可能性があるので、これは潜在的に重要である。63 残念ながら、エステル化ヒアルロン酸に基づくグラフトは、通常のブタ動脈と比較すると軸方向の強度が低く、剛性が高かった60。
マンドレルを型にする
この方法では、新生血管構築物はマンドレルの形に成形され、移植の前に取り除かれる。例えば、平井と松田は、ウシ大動脈平滑筋細胞とI型コラーゲンをガラスの型に流し込み、37℃のオーブンで培養して人工中膜を作製した64。しかし、できた組織は壊れやすく、破裂圧は100mmHg以下だった。興味深いことに、これらのチューブは時間とともにリモデリングされ、平滑筋細胞は収縮性の表現型を獲得し、弾性ラメラが形成され、組織の比重が増加した。コラーゲンチューブの外側をセグメント化されたポリエステルまたは 高密度ポリウレタンで包むと、コンジットのコンプライアンスが向上し、 6ヵ月後には240mmHg66の破裂圧と100%の開存率が得られた67。しかし、補強材の使用はグラフトの血管リモデリングを損ねる可能性があるため、移植後数ヶ月の間に観察されたコンプライアンスの低下を部分的に説明している68。プロテーゼに頼ることなくコラーゲンゲルに基づくグラフトの強度を改善するために、Burglandらは架橋コラーゲンのアセルスリーを作り、足場として機能させることにした。コラーゲンと新生児皮膚線維芽細胞をこの生物学的足場に加え、ヒト冠動脈内皮細胞を播種した。このグルタルアルデヒド架橋コンストラクトでは脆さが問題となり、著者らは、他の架橋方法を用いればより良い結果が得られる可能性があると指摘した69。
L'Heureuxは、PTFEマンドレルを用いて、12週 間にわたってヒト細胞を連続的に播種し、人工血管を作製し た。培養血管平滑筋細胞をマンドレル上に置き、人工血管の中膜を形成し、次に線維芽細胞を中膜に巻きつけて外膜を形成し、マンドレルを取り除いて露出した内腔表面に内皮を播種した。このようにしてできた血管は、超微細構造的にも機能的にも正常な動脈と同じ特徴を持ち、2000mmHgの破裂圧力が得られた。70 このグラフトの非内皮化バージョンをイヌに移植したところ、1週間後の開存率は50%であった71。
例えば、培養液にアスコルビン酸やレチノイン酸を加えると、 血管構築物のコラーゲン産生、ひいては機械的特性が向上 するが76 、一方で内腔を流れる脈動流などによるグラフトの物理 的伸縮は、細胞の増殖や分化に影響する77-81。
新しいアプローチ
腹腔内グラフトモデル
このアプローチの根拠は、腹腔内に異物が留置されると炎症反応が起こり、中皮細胞の単層に覆われた筋線維芽細胞の層を含む線維性カプセルが生成されるという観察からきている82。
1999年、この知見は人工動脈の作成に応用された(図)。ウサギとラットの腹腔内にシラスティックチューブを移植すると、2週間かけて腸管との癒着がほとんどない自由浮動性の無血管チューブが形成された。84 Western解析と免疫組織化学によって、この組織チューブを本来の大動脈と比較すると、α-平滑筋アクチンとデスミンは同レベル、平滑筋ミオシン重鎖は少なく、βアクチンおよびビメンチンは高いレベルで、コラーゲンレベルも本来と同様だったがエラスチン発現量は少ないことが示された。さらに、ラット大動脈に自家移植した3カ月後、移植細胞の筋原線維の体積分率は、本来の動脈と類似しており、筋線維芽細胞が平滑筋様細胞に分化していることが示唆された。このリモデリング効果は、機械的な要因(壁の伸縮)、特に脈動血流によって引き起こされることが示された。75 また、グラフトがラットの大動脈に移植された4ヶ月間、構築物は、壁の厚さ、細胞数、中膜の弾性ラメラ、外膜の血管壁に関して、本来の血管と類似するようにリモデリングされた。機能的には、グラフトは血管活性剤に反応し、6週間までにアセチルコリンに反応して内皮依存性の血管弛緩を示した(正常大動脈のおよそ10%から20%の反応)。84 グラフト後の人工血管にエラスチンが存在することは、大動脈のような高圧回路において、人工グラフト中のエラスチンの欠如が人工血管の遅延拡張を引き起こすと考えられており85、したがって動脈瘤形成の一因になると考えられるので、特に有望である。さらに、エラスチンはグラフトの生存に重要であると考えられており86 、その分解は有害なリモデリングの一因となる可能性がある87 。
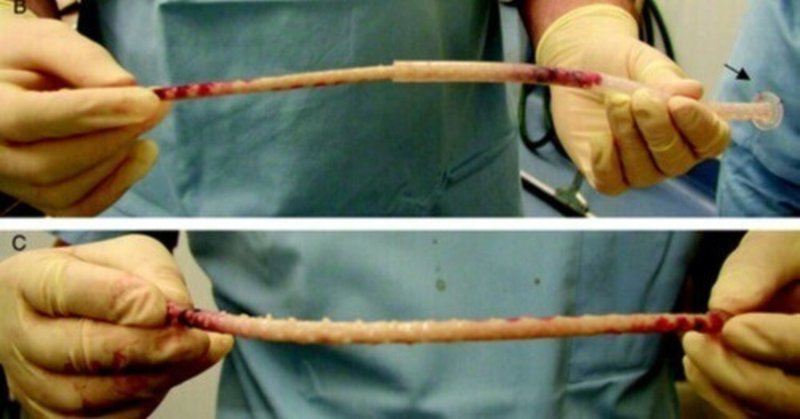
写真

A、犬の腹腔内で2~3週間かけて組織カプセルを成長させた「装置」。腹腔液に浮遊する細胞は、シースの穴から「装置」の中に入り、直径を変えることができる内側のチューブの周りに組織カプセルを形成している。シースの外表面は、癒着を防ぐために界面活性剤でコーティングされていた。腹部の皮膚に2~3cmの切開を加え、その下の腹膜壁をより小さく切開し、フランジ(矢印)を腹膜壁の外面に位置させて「デバイス」を挿入した(遠位端が先)。腹膜切開部を財布の紐で縫合し、3本の緩い縫合糸でフランジを固定し、皮膚切開部を閉じた。採取のため、皮膚を切開し、フランジの縫合を切断し、「デバイス」をスライドさせて取り出し、その後切開部を閉鎖した。B, 組織カプセルと内部チューブは、遠位端のタブの周囲を切断し、それらをスライドさせることによって、外側のシースから取り出される。C, 組織カプセルをスライドさせてインナーチューブから外すことができる。
組織チューブの長さは、ウサギの頸動脈(直径1.9mm、長さ3cm)およびイヌの大腿動脈(直径3.5mm、長さ7cm)に端と端を吻合して移植することにも成功し、ウサギでは少なくとも16カ月(MacGinleyら、未発表データ)、イヌでは6カ月半にわたって80%から90%の開存率を示した88。イヌでは、組織チューブの破裂強度は本来の大腿動脈や頸動脈と同じであり(2500mmHg以上)、縫合糸の保持力は10~11.5Nと同程度であった88。
このモデルは、2~3週間という比較的短い期間で動脈を生成し、in vitroでの操作を必要としない。このモデルは、2~3週間という比較的短い期間で動脈を生成し、in vitroでの操作を必要としない。まだ、ヒトでの培養は行われていない。しかし、組織カプセルを成長させ、癒着のリスクを低減させる移植可能な「装置」が最近開発され、臨床試験前に犬の腹腔内でテストされている(図AからC)。2回の外科手術が必要ですが、「装置」を腹腔内に埋め込むのは簡単な作業で、この天然のバイオリアクターからの移植片回収はバイパス移植と同時に行うことが可能です。また、管状の型を使い分けることで、人工血管を任意の直径(1.5~7mm)、長さ(現在では25cmまで)に成長させることができる。
骨髄細胞から組織工学的動脈ができるのか?
異物反応は、完全に分解されていない生分解性ポリマーを用いたグラフトの悩みの種かもしれないが、腹腔内モデルの基礎となるものである。腹腔内に移植されたシラスチックチューブは、宿主に炎症反応を引き起こす異物として機能する。この炎症反応を利用して、宿主自身の細胞から移植片を作るため、同種移植片の拒絶反応に伴う問題を回避することができる。
しかし、この細胞の起源は何なのだろうか?89 移植後3日目に、丸みを帯びたCD45+細胞が表面に付着し、超微細構造的には、これらの細胞はマクロファージに類似していた。カプセルは2週間の移植期間中に成熟し、超微細構造および免疫組織化学的に筋線維芽細胞の特徴を有する細胞の多層を含む線維性構造となった。CD45に対する抗体で染色される細胞は、現在ではごくわずかである。骨髄由来の細胞の分化が起こったかどうかを調べるために、雌マウスに放射線を照射して骨髄を破壊した後、コンジェニック雄マウスの骨髄細胞を輸血した。4週間後、これらの雌マウスの腹腔内に異物を移植し、得られた組織カプセルを14日後に摘出した。In situハイブリダイゼーションにより、成熟したカプセルの平滑筋様細胞のほとんどがY染色体を含んでおり、ドナーである骨髄由来であることが示された8。
これは、傷ついた動脈を治すために、平滑筋細胞の移動と増殖が局所で起こるというドグマに反するものであった91。しかし、この発見は、血管形成術後の再狭窄、グラフト血管障害、高脂血症誘発性アテローム性動脈硬化症など、様々な血管傷害のモデルを用いた他の研究者によって、後に確認された。
同様に、Feiglら97は、血栓形成性ポリウレタン壁で作られた人工血管であるが、血管導管の壁ではなく、循環血液と接触する血栓形成性ダクロンの中央部分が、活性単核細胞から筋線維芽細胞および内皮形成へと進むダクロン表面のリモデリングを刺激することを見いだした。
このことは、腹腔内に形成された人工血管の骨髄由来細胞が、実際には平滑筋と内皮細胞の両方に分化した単球系細胞であるという興味深い可能性を提起している。この仮説は、いくつかの証拠から信憑性がある。例えば、Cebotariらは、移植後、脱細胞化した血管足場が、白血球(CD18)および内皮(CD31)マーカーを共発現する細胞で裏打ちされるようになったことを示した98。最近、内皮前駆細胞はCD14、Mac-1、CD11cのような単球/マクロファージマーカーを発現し、一方、前駆細胞マーカーAC133とc-kitの発現は最小であることが示された99。重要なことは、これらの細胞は著しい増殖を示さなかったが血管形成性成長因子を分泌していた。Simperらは、異なる培養液を用いて、ヒト単球系細胞や精製CD34+細胞は、α-平滑筋アクチン、ミオシン重鎖、カルポニン、インテグリンα5β1を発現する平滑筋細胞や、典型的な内皮細胞マーカーCD31、フォンウィルブランド因子、血管内皮カドヘリンを発現する細胞を生じさせることを示した100。他の研究では、内皮前駆細胞は単球系細胞に由来すること、101,102、単球系細胞は血管新生の部位に集積することも示唆されている103。単球系細胞は、動脈損傷部位に局在し104,105、熱による血管損傷後に血管壁に侵入し、マクロファージと平滑筋細胞マーカーを共発現する106。単球/マクロファージが筋線維芽細胞に分化する能力についても、いくつかのグループにより報告されている107,108。しかし、これらの研究はいずれも単球が血管壁の細胞に分化することを支持しているが、Sataらは、いくつかの血管損傷モデルで新生内膜過形成の原因となる細胞がc-kit+sca-1+lin-であることを示し、このプロセスにはより原始的な細胞が関与している可能性を提起しているため、問題は完全に解決されていない92。
結 論
過去40年以上にわたって、人工動脈を作るための数多くのアプローチが報告されてきました。
私たちは、体内の免疫系を利用して、腹腔内で骨髄由来の細胞から2週間かけて管状構造体を増殖させ、エラスチンを含む本来の血管に類似した大規模なリモデリングを行いながら自家人工血管として機能させることができることを明らかにした。
これにより、患者さんが自分の体腔内で、必要な時に必要な大きさの人工血管を作ることができるようになる可能性が出てきました。そうなれば、移植に適した健康な血管が不足し、人工血管や足場を使用する必要がなくなります。血管損傷後の治癒には、造血細胞が関与していることはすでによく知られているが、移植片の細胞の骨髄由来についても、現在、解明されつつあるところである。In vivoバイオリアクター内の血管経路に沿った分化を制御する因子がわかれば、成人の血管平滑筋細胞に伴う老化の問題を持たない、血管導管の「既製」の組織バンクを作ることができるかもしれない。
脚注
Julie H. Campbell教授(クイーンズランド大学生物医学部、血管生物学研究センター、オーストラリア、クイーンズランド州ブリスベーン、4072)宛にお送りください。電子メール julie.campbell@uq.edu.au
参考文献
1McKee JA, Banik SS, Boyer MJ, Hamad NM, Lawson JH, Niklason LE, Counter CM.ヒトの動脈をin vitroで操作した。EMBO Rep. 2003; 4: 633-638.CrossMedlineGoogle Scholar
2Whittemore AD, Kent KC, Donaldson MC, Couch NP, Mannick JA.血管内再建術におけるポリテトラフルオロエチレン製グラフトの適切な役割とは?J Vasc Surg. 1989; 10: 299-305.CrossMedlineGoogle Scholar
3Faries PL, Logerfo FW, Arora S, Hook S, Pulling MC, Akbari CM, Campbell DR, Pomposelli FB, Jr.の比較研究。下肢血行再建術における代替コンジットの比較研究:全自家コンジットと人工グラフトの比較。J Vasc Surg. 2000; 32: 1080-1090.CrossrefMedlineGoogle Scholar
4Gozna ER, Mason WF, Marble AE, Winter DA, Dolan FG.合成動脈グラフトにおける弾性特性の必要性。1974; 17: 176-179passim.MedlineGoogle Scholar
5グライスラーHP。血液と材料の界面における相互作用。1990; 4: 98-103.CrossrefMedlineGoogle Scholar
6Favaloro RG.冠動脈疾患の外科的治療における伏在静脈グラフト。手術手技。1969; 58: 178-185.CrossMedlineGoogleスカラー
7Kolessov VI。狭心症の治療の方法として、乳腺動脈-冠状動脈吻合。1967; 54: 535-544.CrossrefMedlineGoogle Scholar。
8Carpentier A, Guermonprez JL, Deloche A, Frechette C, DuBost C. 大動脈-冠状動脈バイパスグラフト。グラフトの病理学的変化を回避する技術。1973; 16: 111-121.CrossrefMedlineGoogleスカラー
9Berger PB, Alderman EL, Nadel A, Schaff HV.9Berger PB, Alderman EL, Nadel A, Schaff HV. 左内乳頭動脈から左前下行動脈へのバイパスグラフトにおける早期閉塞と狭窄の頻度:従来のバイパス術における胸骨正中切開による手術:低侵襲直接冠動脈バイパスのベンチマーク循環。1999; 100: 2353-2358.CrossrefMedlineGoogleスカラー
10Verma S, Szmitko PE, Weisel RD, Bonneau D, Latter D, Errett L, LeClerc Y, Fremes SE.橈骨動脈は冠動脈バイパス術にルーチンに使用されるべきか?Circulation.2004; 110: e40-e46.LinkGoogle Scholar
11Chaikhouni A, Crawford FA, Kochel PJ, Olanoff LS, Halushka PV.ヒト内乳頭動脈は、伏在静脈よりも多くのプロスタサイクリンを産生する。J Thorac Cardiovasc Surg. 1986; 92: 88-91.CrossrefMedlineGoogle Scholar
12太田修一、草場明彦:イヌの動脈埋め込み型オートベインバイパスグラフトとその吻合部における血管壁の発達.Int Angiol.1997; 16: 197-203.MedlineGoogle Scholar
13Conte MS, Mann MJ, Simosa HF, Rhynhart KK, Mulligan RC.静脈バイパス移植片疾患に対する遺伝的介入:総説。J Vasc Surg。2002年、36:1040から1052.CrossrefMedlineGoogleスカラ。
14Begovac PC, Thomson RC, Fisher JL, Hughson A, Gallhagen A. Carmeda BioActive 表面ヘパリン固定化による GORE-TEX 血管グラフト性能の向上.Eur J Vasc Endovasc Surg. 2003; 25: 432-437.CrossrefMedlineGoogle Scholar
15Engbers GH, Feijen J. 生体材料表面の血液適合性を向上させるための最新技術。Int J Artif Organs.1991; 14: 199-215.CrossrefMedlineGoogle Scholar
16Aldenhoff YB, van Der Veen FH, ter Woorst J, Habets J, Poole-Warren LA, Koole LH.内腔表面にジピリダモール(ペルサンチン)コーティングを施したポリウレタン製人工血管の性能。J Biomed Mater Res. 2001; 54: 224-233.CrossrefMedlineGoogle Scholar
17Phaneuf MD, Szycher M, Berceli SA, Dempsey DJ, Quist WC, LoGerfo FW.(ファヌフMD、シーチャーM、ベルセリSA、デンプシーDJ、クイストWC、ロガーフォFW)。タンパク質結合部位を有する新規イオン性ポリ(カーボネート)ウレタンポリマーへの組換えヒルジンの共有結合:表面アンチトロンビン活性の決定。Artif Organs.1998; 22: 657-665.CrossrefMedlineGoogle Scholar
18Sun LB, Utoh J, Moriyama S, Tagami H, Okamoto K, Kitamura N. Dacron graftの組織因子経路阻害剤による前処理は血栓形成能と新生内膜厚を減少させる:動物実験による予備的検討。また、このような場合にも、「臓器移植」を行うことができる。
19米山高志、伊藤雅彦、杉原一美、石原謙一、中林直樹、非血栓性リン脂質ポリマー表面を有する小口径人工血管:偽内膜・新内膜形成がない場合の機能に関する新しい概念の予備的研究。Artif Organs.2000; 24: 23-28.CrossrefMedlineGoogle Scholar
20Fujisawa N, Poole-Warren LA, Woodard JC, Bertram CD, Schindhelm K. A novel textured surface for blood-contact.Biomaterials.1999; 20: 955-962.CrossrefMedlineGoogle Scholar
21Schmidt SP, Hunter TJ, Sharp WV, Malindzak GS, Evancho MM.内皮細胞を播種した4ミリのダクロン人工血管:人工血管を介した血流操作の効果。Journal Of Vascular Surgery:公式出版、血管外科学会[と]国際心臓血管外科学会、北アム章。1984; 1: 434-441.Googleスカラー
22Rashid ST, Salacinski HJ, Fuller BJ, Hamilton G, Seifalian AM.バイパスコンデュイットの開存性向上のためのエンジニアリング。Cell Prolif, 2004; 37: 351-366.CrossMedlineGoogle Scholar
23Kent KC, Oshima A, Whittemore AD.ヒト内皮細胞に対する最適な播種条件。このような場合、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う必要があります。
24Walluscheck KP, Steinhoff G, Kelm S, Haverich A. 合成RGD含有ペプチドで前処理したePTFE人工血管上での内皮細胞接着の改善。Eur J Vasc Endovasc Surg. 1996; 12: 321-330.CrossrefMedlineGoogle Scholar
25Budd JS, Bell PR, James RF.前処理したポリテトラフルオロエチレン製人工血管へのインジウム-111標識内皮細胞の付着。
26Gosselin C, Vorp DA, Warty V, Severyn DA, Dick EK, Borovetz HS, Greisler HP. フィブリン糊、FGF-1およびヘパリンによるePTFEコーティング:播種した内皮細胞の保持に対する効果.J Surg Res. 1996; 60: 327-332.CrossrefMedlineGoogle Scholar
27Greisler HP, Klosak JJ, Dennis JW, Karesh SM, Ellinger J, Kim DU.内皮細胞増殖を増強するECGFによる生体材料の前処理。J Vasc Surg. 1987; 5: 393-399.CrossrefMedlineGoogle Scholar
28Anderson JS, Price TM, Hanson SR, Harker LA.小口径人工血管のin vitro内皮化。Surgery.1987; 101: 577-586.MedlineGoogle Scholar
29Herring M, Smith J, Dalsing M, Glover J, Compton R, Etchberger K, Zollinger T. Polytetrafluoroethylene femoral popliteal bypassesの内皮播種:低密度播種は開存性を改善しないこと.J Vasc Surg. 1994; 20: 650-655.CrossrefMedlineGoogle Scholar
30Deutsch M, Meinhart J, Fischlein T, Preiss P, Zilla P. 100人の患者における鼠径部ePTFEグラフトの臨床的自己in vitro内皮化:9年の経験。Surgery.1999; 126: 847-855.CrossrefMedlineGoogle Scholar
31Laube HR, Duwe J, Rutsch W, Konertz W. 自己内皮細胞を注入したポリテトラフルオロエチレン冠動脈バイパスグラフトに関する臨床的経験。J Thorac Cardiovasc Surg. 2000; 120: 134-141.CrossrefMedlineGoogle Scholar
32Bull HA, Pittilo RM, Drury J, Pollock JG, Clarke JM, Woolf N, Marston A, Machin SJ.自己中皮細胞播種がダクロン人工血管内のプロスタサイクリン産生に及ぼす影響。このような場合、臓器移植が必要である。
33Noishiki、Tomizawa Y、Yamane Y、Matsumoto A. 骨髄移植による人工血管のオートクライン性血管形成。Nat Med.1996; 2: 90-93.CrossrefMedlineGoogle Scholar
34Brothers TE, Stanley JC, Burkel WE, Graham LM.小口径ポリウレタンおよびポリテトラフルオロエチレン製グラフト:イヌの大動脈モデルにおける比較研究。J Biomed Mater Res. 1990; 24: 761-771.CrossrefMedlineGoogle Scholar
35Seifalian AM, Salacinski HJ, Tiwari A, Edwards A, Bowald S, Hamilton G. In vivo biostability of a poly(carbonate-urea)urethane graft.Biomaterials.2003; 24: 2549-2557.CrossrefMedlineGoogle Scholar
36Giudiceandrea A, Seifalian AM, Krijgsman B, Hamilton G. Endothelial cell seeded PTFE and compliant polyurethane vascular grafts on vitro prolonged pulsatile shear stress effect of an endothelial cell seeded PTFE and compliant polyurethane vascular grafts.Eur J Vasc Endovasc Surg. 1998; 15: 147-154.CrossrefMedlineGoogle Scholar
37Clarke DR, Lust RM, Sun YS, Black KS, Ollerenshaw JD.非血管性細胞組織マトリックスの耐久性のある血管導管への変換。このような場合、「臓器移植」と呼ばれる。S433-436.CrossrefMedlineGoogle Scholar
38O'Brien T, Collin J. 人工血管グラフトの感染。このような状況下で、医療従事者はどのように対処すればよいのでしょうか。
39Lantz GC, Badylak SF, Hiles MC, Coffey AC, Geddes LA, Kokini K, Sandusky GE, Morff RJ.血管移植片としての小腸粘膜下層:総説。J Invest Surg. 1993; 6: 297-310.CrossrefMedlineGoogle Scholar
40Huynh T, Abraham G, Murray J, Brockbank K, Hagen PO, Sullivan S. acellular collagen graftから生理的応答性のある新生血管へのリモデリング(再生)。Nat Biotechnol.1999; 17: 1083-1086.CrossrefMedlineGoogle Scholar
41Roeder RA, Lantz GC, Geddes LA.小腸粘膜下部の小口径人工血管の機械的リモデリング-予備的報告。Biomed Instrum Technol.2001; 35: 110-120.MedlineGoogle Scholar
42Sandusky GE, Lantz GC, Badylak SF.頚動脈における小腸粘膜下層とePTFEグラフトの治癒比較。J Surg Res. 1995; 58: 415-420.CrossMedlineGoogle Scholar
43Jernigan TW, Croce MA, Cagiannos C, Shell DH, Handorf CR, Fabian TC.このような場合には、血管再建のための小腸粘膜下層を使用します。2004; 239:733-740.CrossrefMedlineGoogle Scholar
44Bader A, Steinhoff G, Strobl K, Schilling T, Brandes G, Mertsching H, Tsikas D, Froelich J, Haverich A. Engineering of human vascular aortic tissue based on a xenogeneic starter matrix(異種移植基質に基づくヒト血管性大動脈組織の構築).Transplantation.2000; 70: 7-14.MedlineGoogle Scholar
45田村直樹、中村哲也、寺井秀樹、岩倉具視、野村誠、清水勇夫、コメダ亮介:宿主組織再生の足場となる新しい人工血管の開発。Int J Artif Organs.2003; 26: 783-792.MedlineGoogle Scholar
46Kaushal S, Amiel GE, Guleserian KJ, Shapira OM, Perry T, Sutherland FW, Rabkin E, Moran AM, Schoen FJ, Atala A, Soker S, Bischoff J, Mayer JE, Jr.生体外で増殖させた内皮前駆細胞を用いて作成した機能的小口径新生血管。Nat Med.2001; 7: 1035-1040.CrossrefMedlineGoogle Scholar
47Tsukagoshi T, Yenidunya MO, Sasaki E, Suse T, Hosaka Y. Experimental vascular graft using small-caliber fascia wrapped fibrocollagenous tube: short-term evaluation.J Reconstr Microsurg.1999; 15: 127-131.CrossrefMedlineGoogle Scholar
48Sparks CH.自家移植片は注文に応じて作られる。1969; 8: 104-113.CrossrefMedlineGoogle Scholar
49Conte MS.理想的な小動脈代替物:聖杯の探求?FASEB J. 1998; 12: 43-45.CrossMedlineGoogle Scholar
50Weinberg CB, Bell E. コラーゲンと培養血管細胞から構築された血管モデル。Science.1986; 231:397-400.CrossrefMedlineGoogle Scholar
51石橋和彦、松田敏雄:3種類の細胞が階層的に積層されたハイブリッド人工血管の再構築.52松田武彦, 三輪哲雄: 血管を構成する3種類の細胞からなるハイブリッド人工血管の再構築, 朝青社, 1994; 40: M284-M290.CrossrefMedlineGoogle Scholar
52Matsuda T, Miwa H. Biomimicking a hybrid vascular model of the hierarchic structure of arterial wall: neointimal stability and neoarterial regeneration process under arterial circulation.ハイブリッド血管モデルによる動脈壁の階層構造模倣:動脈循環下での新生血管の安定性と再生過程.J Thorac Cardiovasc Surg. 1995; 110: 988-997.CrossrefMedlineGoogle Scholar
53イヌの内皮前駆細胞を用いた非血栓性ハイブリッド人工血管の開発。J Thorac Cardiovasc Surg. 2003; 126: 455-464.CrossrefMedlineGoogle Scholar
54Sparks SR, Tripathy U, Broudy A, Bergan JJ, Kumins NH, Owens EL.このような場合、臓器移植が必要である。2002; 16: 73-76.CrossrefMedlineGoogle Scholar
55Rabkin E, Schoen FJ.Cardiovascular tissue engineering.Cardiovasc Pathol.2002; 11: 305-317.CrossrefMedlineGoogle Scholar
56Ratcliffe A. Tissue engineering of vascular grafts.2000; 19: 353-357.CrossMedlineGoogle Scholar
57Shum-Tim D、Stock U、Hrkach J、Shinoka T、Lien J、Moses MA、Stamp A、Taylor G、Moran AM、Landis W、Langer R、Vacanti JP、Mayer JE、Jr.新しい生分解性ポリマーを使用した自己大動脈の組織工学。1999; 68: 2298-2305.CrossrefMedlineGoogle Scholar.
58Niklason LE, Gao J, Abbott WM, Hirschi KK, Houser S, Marini R, Langer R. Functional arteries grown in vitro.Science.1999; 284: 489-493.CrossrefMedlineGoogle Scholar
59Campbell JH, Campbell GR.血管平滑筋の培養技術とその研究への応用。Clin Sci (Lond).1993; 85: 501-513.CrossrefMedlineGoogle Scholar
60Remuzzi A, Mantero S, Colombo M, Morigi M, Binda E, Camozzi D, Imberti B. ヒアルロン酸上の血管平滑筋細胞:人工血管構築物の培養と力学的特性評価.2004; 10: 699-710.CrossrefMedlineGoogle Scholar
61Chen WY, Abatangelo G. 創傷修復におけるヒアルロン酸の機能。Wound Repair Regen.1999; 7: 79-89.CrossrefMedlineGoogle Scholar
62Niklason LE, Abbott W, Gao J, Klagges B, Hirschi KK, Ulubayram K, Conroy N, Jones R, Vasanawala A, Sanzgiri S, Langer R. 人工ウシ血管の形態的および機械的特性.J Vasc Surg. 2001; 33: 628-638.CrossrefMedlineGoogle Scholar
63Greisler HP, Petsikas D, Lam TM, Patel N, Ellinger J, Cabusao E, Tattersall CW, Kim DU.血管移植片材料の機能としての細胞増殖のキネティックス。
64平井潤一郎、松田敏明 血管細胞とコラーゲンからなる自己組織化チューブ状ハイブリッド血管組織の低圧負荷静脈系への応用。Cell Transplant.1995; 4: 597-608.CrossrefMedlineGoogle Scholar
65平井潤一郎、松田敏明 血管細胞とコラーゲンからなるハイブリッド血管組織による静脈再建:組織再生過程.Cell Transplant.1996; 5: 93-105.CrossrefMedlineGoogle Scholar
66エラストマーメッシュで支持されたハイブリッドグラフトの作製。Cell Transplant.1999; 8: 477-488.CrossrefMedlineGoogle Scholar
67He H, Matsuda T. 微細加工エラストマーフィルムで包んだコンプライアントハイブリッド人工血管-II: 形態形成と移植時のコンプライアント変化.Cell Transplant.2002; 11: 75-87.CrossrefMedlineGoogle Scholar
67コンプライアント・ハイブリット人工血管を用いた人工血管置換術:生体力学的適応と失敗例.2002; 8: 213-224.CrossrefMedlineGoogle Scholar
69Berglund JD, Mohseni MM, Nerem RM, Sambanis A. A biological hybrid model for collagen-based tissue engineered vascular constructs.Biomaterials.2003; 24: 1241-1254.CrossrefMedlineGoogle Scholar
70Girton TS, Oegema TR, Grassl ED, Isenberg BC, Tranquillo RT.グリケーションを利用して作製された媒体等価物の硬化および強化のメカニズム。J Biomech Eng. 2000; 122: 216-223.CrossrefMedlineGoogle Scholar
71L'Heureux N, Paquet S, Labbe R, Germain L, Auger FA.完全に生物学的な組織工学的なヒト血管。FASEB J. 1998; 12: 47-56.CrossMedlineGoogle Scholar
72Barron V, Lyons E, Stenson-Cox C, McHugh PE, Pandit A. Bioreactors for cardiovascular cell and tissue growth: a review.このように、バイオリアクターは心臓血管の細胞や組織を増殖させるためのものである。
73Kladakis SM, Nerem RM.内皮細胞単層膜形成:基質および流体せん断応力の効果。Endothelium.2004; 11: 29-44.CrossrefMedlineGoogle Scholar
74Seliktar D, Nerem RM, Galis ZS.マトリックスメタロプロテアーゼ-2の役割は、周期的なひずみにさらされた細胞播種血管構築物のリモデリングにある。このような場合、臓器移植が必要です。
75Efendy JL, Campbell GR, Campbell JH.腹膜肉芽組織の筋線維芽細胞の分化に及ぼす環境的手がかりの影響。J Pathol.2000; 192: 257-262.CrossrefMedlineGoogle Scholar
76Ogle BM, Mooradian DL.組織工学的血管の力学的特性を向上させるためのリモデリング経路の操作。2002; 124: 724-733.CrossrefMedlineGoogle Scholar
77Leung DY, Glagov S, Mathews MB.サイクリックストレッチは、in vitroの動脈平滑筋細胞によるマトリックス成分の合成を刺激する。Science.1976; 191: 475-477.CrossMedlineGoogle Scholar
78Kim BS, Nikolovski J, Bonadio J, Mooney DJ.周期的な機械的ひずみが、人工平滑筋組織の発達を制御する。Nat Biotechnol.1999; 17: 979-983.CrossrefMedlineGoogle Scholar
79Baguneid M、Murray D、Salacinski HJ、Fuller B、Hamilton G、Walker M、Seifalian AM.シアストレスプレコンディショニングと組織工学に基づく動脈代替物生成のためのパラダイム。Biotechnol Appl Biochem.2004; 39: 151-157.CrossrefMedlineGoogle Scholar
80Howard AB, Alexander RW, Nerem RM, Griendling KK, Taylor WR.サイクリックストレインが内皮細胞に酸化的ストレスを誘発する。Am J Physiol:C421-C427.CrossrefMedlineGoogle Scholar
81Kakisis JD, Liapis CD, Sumpio BE.血管細胞に対する周期的ひずみの影響。Endothelium.2004; 11: 17-28.CrossrefMedlineGoogle Scholar
82Campbell GR, Ryan GB.腹腔内遊離血栓周囲の無血管カプセルの筋線維芽細胞の起源。病理学。1983; 15: 253-264.CrossrefMedlineGoogle Scholar
83Verhagen HJ, Heijnen-Snyder GJ, Pronk A, Vroom TM, van Vroonhoven TJ, Eikelboom BC, Sixma JJ, de Groot PG.中皮細胞におけるトロンボモジュリン活性:人工血管への細胞播種における内皮細胞の代替としての中皮細胞への展望。Br J Haematol.1996; 95: 542-549.CrossrefMedlineGoogle Scholar
84Campbell JH, Efendy JL, Campbell GR.レシピエント自身の腹腔内で成長させた新しい人工血管。このような場合、「臓器移植」と呼ばれる。
85Opitz F, Schenke-Layland K, Cohnert TU, Starcher B, Halbhuber KJ, Martin DP, Stock UA.大動脈組織の組織工学:in vivoでの弾性繊維合成が最適でないことの悲惨な結果。CARDIOVASCRES.2004; 63: 719-730.CrossMedlineGoogle Scholar
86Walles T, Herden T, Haverich A, Mertsching H. Scaffold thickness and scaffold composition on bioartificial graft survival(生体人工グラフトの生存率に及ぼすスキャフォールドの厚みおよびスキャフォールドの組成の影響)。Biomaterials.2003; 24: 1233-1239.CrossrefMedlineGoogle Scholar
87Wong AH, Waugh JM, Amabile PG, Yuksel E, Dake MD.In vivo vascular engineering: Directed migration of smooth muscle cells to limit neointima.このような場合、「臓器移植」と呼ばれる。
88Chue WL, Campbell GR, Caplice N, Muhammed A, Berry CL, Thomas AC, Bennett MB, Campbell JH.このような場合、「臓器移植のためのバイオリアクター」としての犬の腹膜腔および胸膜腔を使用することができます。J Vasc Surg. 2004; 39: 859-867.CrossrefMedlineGoogle Scholar
89Campbell JH, Efendy JL, Han C, Girjes AA, Campbell GR.異物に反応して腹腔内に形成された筋線維芽細胞の造血器官起源。J Vasc Res. 2000; 37: 364-371.CrossMedlineGoogle Scholar
90Campbell JH, Han CL, Campbell GR.循環骨髄細胞による新生内膜形成。2001; 947:18-25.MedlineGoogle Scholar
91Ross R. The pathogenesis of atherosclerosis: a perspective for the 1990s.Nature.1993; 362: 801-809.CrossrefMedlineGoogle Scholar
92佐多正彦、西浦明彦、國里明彦、東條明彦、岡田聡、徳久徹、平井秀夫、幕内雅彦、平田洋一、永井良夫:造血幹細胞から血管系細胞への分化と動脈硬化の病態形成に関わる。Nat Med.2002; 8: 403-409.CrossrefMedlineGoogle Scholar
93清水和彦、杉山茂樹、相川雅之、福本祐史、Rabkin E、Libby P、Mitchell RN.マウス大動脈移植動脈症において、宿主骨髄細胞はドナー内膜平滑筋様細胞の供給源である。Nat Med.2001; 7: 738-741.CrossrefMedlineGoogle Scholar
94Religa P, Bojakowski K, Maksymowicz M, Bojakowska M, Sirsjo A, Gaciong Z, Olszewski W, Hedin U, Thyberg J. 骨髄由来の平滑筋前駆細胞がラット大動脈移植片および損傷ラット頸動脈における新内膜肥厚の発生に寄与している。Transplantation.2002; 74: 1310-1315.CrossrefMedlineGoogle Scholar
95Quaini F, Urbanek K, Beltrami AP, Finato N, Beltrami CA, Nadal-Ginard B, Kajstura J, Leri A, Anversa P. Chimerism of the transplanted heart(移植心臓のキメラ).N Engl J Med.2002; 346:5-15.CrossrefMedlineGoogle Scholar
96Grimm PC, Nickerson P, Jeffery J, Savani RC, Gough J, McKenna RM, Stern E, Rush DN.慢性腎移植片拒絶反応におけるレシピエント間葉系細胞による新生内膜および尿細管間質への浸潤(Negointimal and tubulointerstitial infiltration in chronic renal-allograft rejection).N Engl J Med.2001; 345: 93-97.CrossrefMedlineGoogle Scholar
97Feigl W, Susani M, Ulrich W, Matejka M, Losert U, Sinzinger H. 実験的血栓症の血球による組織化。単核細胞から筋線維芽細胞および内皮細胞への転換の証拠。Virchows Archiv A Pathol Anat Histopathol.1985; 406: 133-148.CrossrefMedlineGoogle Scholar
98Cebotari S, Walles T, Sorrentino S, Haverich A, Mertsching H. 腹腔内における人工血管の誘導性組織再生。2002; 90: e71.LinkGoogle Scholar
99Rehman J, Li J, Orschell CM, March KL.末梢血「内皮前駆細胞」は単球/マクロファージに由来し、血管新生成長因子を分泌する。Circulation.2003; 107: 1164-1169.LinkGoogle Scholar
100Simper D, Stalboerger PG, Panetta CJ, Wang S, Caplice NM.ヒト血液中の平滑筋前駆細胞。Circulation.2002; 106: 1199-1204.LinkGoogle Scholar
101Zhao Y, Glesne D, Huberman E. ヒト末梢血単球由来サブセットは多能性幹細胞として機能する。また、このような細胞は、細胞分裂の初期段階において、多能性幹細胞として機能する。
102Fernandez Pujol B, Lucibello FC, Gehling UM, Lindemann K, Weidner N, Zuzarte ML, Adamkiewicz J, Elsasser HP, Muller R, Havemann K. ヒトCD14陽性単球由来の内皮細胞様細胞。Differentiation.2000; 65: 287-300.CrossrefMedlineGoogle Scholar
103Arras M, Ito WD, Scholz D, Winkler B, Schaper J, Schaper W. Monocyte activation in angiogenesis and collateral growth in the rabbit hindlimb.J Clin Invest.1998; 101: 40-50.CrossrefMedlineGoogle Scholar
104Manka DR, Wiegman P, Din S, Sanders JM, Green SA, Gimple LW, Ragosta M, Powers ER, Ley K, Sarembock IJ.動脈損傷は、炎症性サイトカインの発現を増加させる。動脈損傷は、アポリポ蛋白E欠損マウスの頸動脈における炎症性接着分子の発現を増加させる。J Vasc Res. 1999; 36: 372-378.CrossrefMedlineGoogle Scholar
105Heil M, Ziegelhoeffer T, Pipp F, Kostin S, Martin S, Clauss M, Schaper W. Blood monocyte concentration is critical for enhancement of collateral artery growth.2002; 283: H2411-H2419.CrossMedlineGoogle Scholar.
106Bayes-Genis A、Campbell JH、Carlson PJ、Holmes DR, Jr.、Schwartz RS.冠動脈の損傷および修復後のマクロファージ、筋線維芽細胞および新生内膜過形成。Atherosclerosis.2002; 163:89-98.CrossrefMedlineGoogle Scholar
107Labat ML, Bringuier AF, Seebold-Choqueux C, Moricard Y, Meyer-Mula C, Delepine N, Delepine G, Desbois JC, Strauss P. Possible monocytic origin of chondrosarcoma: in vitro transdifferentiation of HLA-DR blood monocyte-like cells from a patient with chondrosarcoma, to neo fibroblasts and chondrocyte-like cells.Biomed Pharmacother.1997; 51: 79-93.CrossrefMedlineGoogle Scholar
108Abe R, Donnelly SC, Peng T, Bucala R, Metz CN.末梢血線維細胞:分化経路と創傷部位への移動。J Immunol.2001; 166:7556-7562.CrossrefMedlineGoogle Scholar
この記事が気に入ったらサポートをしてみませんか?
