高周波電磁波の脳内神経伝達物質への影響
フロント公衆衛生
2021年8月17日
第2部 放射線と健康
第9巻 - 2021年|
この記事は、研究トピックの一部です
新たに出現した電気・磁気・電磁波の人体への曝露について
Cuicui Hu1,2, Hongyan Zuo2* and Yang Li1,2*
1安徽医科大学生命科学院、中国、合肥市
2北京放射線医学研究所実験病理学部
はじめに
過去30年間の電子情報の急速な発展に伴い、電磁気学に基づく技術的成果は、人間の生産と生活に関わる様々な分野で広く利用されるようになりました。その結果、電磁波は現代文明における実質的な新しい汚染源となっている。電磁波の生物学的影響は、世界的に注目されている。現在、最も注目されているのは、電磁波と人間の臓器、特に脳との相互作用の可能性である。神経系が電磁波の影響を受けやすい重要な標的臓器であることは、多くの研究によって示されている。近年、神経伝達物質の代謝や輸送など、EMRの神経生物学的影響に注目する研究が増えている。神経伝達物質は、シナプス伝達のメッセンジャーとして、認知行動や情動行動に重要な役割を担っている。ここでは、脳内の神経伝達物質の代謝や受容体に対するEMRの影響についてまとめている。
背景
電磁波は、携帯電話、電子レンジ、通信基地局、高圧線、電子楽器などの様々な電気機器から発生し、人間の生活と密接に関係している。
電磁波は周波数の異なるさまざまな電磁波を発生させ、その結果、人間の生活空間における電磁波強度が高まっている。宇宙線、ガンマ線、X線などの高周波は、電離を引き起こすのに十分なエネルギーを持っています。紫外線、可視域、赤外線、マイクロ波、電波などの非電離性電磁波は日常生活で頻繁に利用されており、特に通信用の高周波電磁界(RF-EMF、30kHz-300GHz)、電気で発生する極低周波電磁界(ELF-EMF、3Hz-3kHz)などは、その代表例です。
RFは一般にマイクロ波(MW)放射とも呼ばれる。電磁波の人体への影響も徐々に注目されるようになり、人体では脳機能連関の変調が観察されるようになった(1-3)。
本総説では、RF-EMFの脳内神経伝達物質への影響についてまとめている。
電磁波の生体への影響は、放射線の周波数、強度、電力に依存する可能性があり、電磁波のパラメータは、文献レビューのための課題となる。比吸収率(SAR)は、100 kHzから10 GHzの電磁波にさらされたときに、人体が吸収するエネルギーの割合を測定するものである。単位はワット毎キログラム(W/kg)で、SARは組織の質量当たりに吸収される電力を反映しています。SARの値は、周波数、入射方向、E偏波方向、組織の構造によって異なります。これまで、マイクロ波放射の生体影響に関する研究報告では、SARの値は10-4~35W/kgの範囲にあります。多くの研究が、神経系が電磁波に敏感な重要な標的臓器系であることを示している。電磁波への曝露は、神経系に構造的および機能的な変化をもたらす可能性がある(4-7)。神経伝達物質は、神経系内のシナプス伝達の際にメッセンジャーとして作用する特定の化学物質である。多くの研究が、電磁波が神経伝達物質の代謝と輸送に影響を与えることを示している(8)。神経回路は脳機能の構造的基礎であり、脳は様々な脳領域と多くの神経伝達物質の相互作用によって機能していることがよく理解されている。従って、様々な脳領域における神経伝達物質レベルに対する電磁波の調節効果は、脳機能において重要な役割を果たす可能性がある。多くの研究によると、RF-EMR曝露は、脳の様々な部位でアミノ酸の神経伝達物質の不均衡を誘発する可能性がある(9, 10)。
神経伝達物質は、神経細胞で合成され、シナプス前細胞のシナプス小胞に輸送される。伝達物質はシナプス間隙を拡散し、シナプス後神経細胞やエフェクター細胞の受容体に作用し、シナプス前細胞からシナプス後細胞へ情報が伝達される(11)。神経伝達物質の作用は、リサイクルによって停止することができる。すなわち、シナプス間隙の過剰な神経伝達物質は、シナプス前ベクターの作用によってシナプス前細胞にリサイクルされ、小胞に貯蔵されるのである。例えば、ドーパミン(DA)は、ミトコンドリアに存在するモノアミン酸化酵素と細胞質に存在するカテコール-O-メチルトランスフェラーゼ(COMT)の作用により代謝的に不活性化される(12)。神経伝達物質は、神経伝達、分化、神経回路の形成など、脳の発達の過程に関与している。また、特定の神経伝達物質のレベルの変化は、うつ病、統合失調症、アルツハイマー病、パーキンソン病など、様々な神経疾患と関連している(13)。中枢神経系に存在する神経伝達物質は、その化学的構造から通常4種類に分類される。生体アミンは、DA、ノルエピネフリン(NE)、エピネフリン(E)、5-ヒドロキシトリプタミン(5-HT)などを含む。アミノ酸類としては、γ-アミノ酪酸(GABA)、グリシン、グルタミン酸、アセチルコリン(Ach)等が挙げられる。ペプチド系神経伝達物質としては、内因性オピオイドペプチドが挙げられる他、様々な種類がある。残りの伝達物質には、一酸化窒素(NO)、サブスタンスPなどがある。本総説では、上記の4つのカテゴリーの脳内神経伝達物質について、電磁波曝露時に光を当てた重要な研究を取り上げ、これらの神経伝達物質の代謝と受容体の変化を概観している。
文献検索では、NCBI PubMedデータベースのすべての論文を、「神経伝達物質」と「電磁場」または「高周波電磁場」それぞれのキーワードで検索し、英語で書かれ、RF-EMR曝露に遭遇した脳内の神経伝達物質測定に言及している公表論文を選択した。その結果、短期電磁波曝露による神経伝達物質に関連する21件の論文が本文中で取り上げられ、表1にまとめられ、長期電磁波曝露による神経伝達物質に関連する19件の論文が本文中で取り上げられ、表2にまとめられました。
電磁波の生体内アミン神経伝達物質への影響
電磁波によるドーパミン(DA)への影響
ノルエピネフリンの前駆体として、視床下部および下垂体において重要な神経伝達物質である。主に報酬、学習、感情、運動制御、実行機能に関連する脳内の活動に関与しています。DAはまた、パーキンソン病、多発性硬化症、ハンチントン病などの精神・神経疾患とも相関があります(13)。DAはゴナドトロピン放出ホルモンの分泌を抑制し、神経終末におけるゴナドトロピン放出ホルモンとDAの間には軸索接続と相互作用があることが示唆されている(49)。大脳基底核におけるDAの欠乏は、パーキンソニズムの患者に見られる(50)。DAはまた、統合失調症においても何らかの役割を担っており、線条体のDAは増加し、皮質のDA伝達は変化している(51, 52)。
いくつかの研究で、DA に対する EMR の影響が報告されている。例えば、成体ラットに毎日 1 時間、電磁波周波数 1,800 MHz、比吸収率 (SAR) 値 0.843W/kg、電力密度 0.02 mW/cm2 の電磁波曝露を行ったところ、曝露 2 ヶ月後および曝露停止 1 ヶ月後に海馬の DA が有意に低下した。この研究により、EMR曝露は海馬のDA産生を低下させ、ラットの覚醒に影響を与え、EMR曝露後の学習・記憶能力の低下に寄与する可能性が示唆された(14)。Maaroufiらは、ラットを900 MHzの電磁波に21日間連続で1時間/日、フィールド内のラットの位置に応じて最小SAR 0.05 W/kg、最大SAR 0.18 W/kgで曝露している。EMR曝露群の海馬では、DAの減少が観察された。さらに、EMR曝露群では海馬と線条体の間でDAとジヒドロキシフェニル酢酸(DOPAC)の有意差が認められる(34)。さらに、835MHz、SAR値4.0W/kgのRF-EMRを5時間/日、12週間曝露すると、C57BL/6マウスの線条体のDA濃度が低下することがわかった(33)。以上の研究により、ある強度のマイクロ波放射が海馬と線条体のモノアミン神経伝達物質の代謝異常を引き起こすことが示唆された。
Inabaらは、周波数2,450 MHz、電力密度5および10 mW/cm2で、成体ラットを1時間マイクロ波照射した。電力密度10 mW/cm2では線条体と大脳皮質のみで、大脳皮質と延髄のDOPAC量、DA回転率、DOPAC:DA比が有意に増加したが、電力密度5 mW/cm2では脳のどの領域のDA量にも有意性は認められなかった(15)。また、妊娠中の Wistar ラット 32 匹を対照群、低線量群(携帯電話照射を 10 分間受ける)、中線量群(携帯電話照射を 30 分間受ける)、高線量群(携帯電話照射を 60 分間受ける) に分けた。ラットは、妊娠当日から1日3回、20日間継続して放射線を浴びました。そして、中心周波数900MHz、SAR値0.9W/kgで、携帯電話の放射線がマウス胎児の脳組織中のモノアミン神経伝達物質に与える影響を調べた。
その結果、胎児マウスの脳組織中のDA含量は低線量群で増加したが、高線量群では減少し、中線量群では有意な変化が認められなかったことから、携帯電話の長時間照射は胎児マウスの中枢神経系にDA含量の異常を引き起こし、マウスの脳の発達に影響を与える可能性が示唆された(35)。
以上のことから、電磁波は被曝の強さに応じて脳内のモノアミン神経伝達物質の代謝障害を引き起こし、理論的には異常な情動行動を引き起こす可能性があることが示唆された。
ノルエピネフリンとエピネフリンに対する電磁波の影響
神経伝達物質であるノルエピネフリンは、主に交感神経節後神経細胞および脳内アドレナリン作動性神経終末で合成、分泌される。副腎髄質では、ホルモンとして少量のノルエピネフリンが産生される(53)。アドレナリン受容体にはαとβの2種類があるが、主にα受容体(α1、α2を含む)に結合する。ノルエピネフリンは、N-メチル化によりエピネフリンに変換される(54)。脳内のノルエピネフリンの放出は、ストレス、注意、睡眠、炎症、自律神経系の反応など、様々なプロセスに関与している(13)。Megha らは、1,800 MHz、1 mW/cm2 のマイクロ波を 30 日間(2 時間/日、5 日/週)連続照射したところ、ラット海馬組織のノルエピネフリンとエピネフリン の濃度が著しく低下したことから、マイクロ波照射のある条件が脳内のノルエピネフリンとエピネフリン含有量の減少につながる可能性があることを示した(36).Cao らは、雄の LACA マウスに 900 MHz のマイクロ波を照射した。使用した放射強度は 0, 1, 2, 5 mW/cm2、SAR 値はそれぞれ 0, 0.22, 0.44, 1.1 W/kg、マウスは 1 時間/日、35 日間連続で曝露された。その結果、電磁波強度が 1 mW/cm2 の場合、脳内ノルエピネフリン量が有意に増加したが、曝露強度が 2、5 mW/cm2 の場合は、ノルエピネフリン量に明らかな変化が見られなかった(37)。このことは、低強度の電磁波曝露が脳内のノルエピネフリン含量を増加させ、理論的にはエピネフリン含量に影響を与え、神経伝達物質の生成障害を引き起こす可能性があることをさらに示唆するものである。
さらに、Jiらは妊娠中のラットにSAR値0.9W/kgの900MHz携帯電話のマイクロ波放射を照射する実験を行った。対照群、低線量群、中線量群、高線量群にそれぞれ1回0分、10分、30分、60分の放射線を照射した。放射線は妊娠初日から1日3回、連続20日間照射した。その結果、低線量群のラット胎児のノルエピネフリン含量は対照群のそれと比較して増加し、高線量群のラット胎児のノルエピネフリン含量は有意に減少していた(35)。これらの結果を総合すると、EMRへの長期曝露により、放射線の線量によっては、脳内のノルエピネフリンおよびエピネフリン含量に異常が生じる可能性があることが示唆される。
5-ヒドロキシトリプタミン "セロトニン "に対する電磁波の影響
5-ヒドロキシトリプタミン(5-HT)は、消化管(主にエンテロクロマフィン細胞)で大量に合成されるが、神経系内ではごくわずかしか生成されない。脳内では、5-HTの細胞体は主にラペ核に局在し、ほぼすべての脳部位に軸索を送っています(55)。抑制性神経伝達物質である5-HTは、主に松果体や視床下部、特に大脳皮質や神経シナプスに分布しています。5-HTは、気分、摂食、認知、記憶、痛み、睡眠、体温維持などの生理機能の調節に寄与しており(56)、これらの生理機能は、電磁波による脳損傷の指標として報告されている(57)。従って、5-HTは電磁波の神経生物学的影響に重要な役割を担っている可能性がある。マイクロ波放射が 5-HT に及ぼす影響について報告した研究はほとんどない。ラットに対して、周波数 2,450 MHz、電力密度 5 および 10 mW/cm2 のマイクロ波放射を 1 時間照射したときの結果が報告されている。大脳皮質の5-hydroxyindoleacetic acid(5-HIAA)含量は、電力密度5および10 mW/cm2のマイクロ波照射後、有意に増加した。大脳皮質の5-HTターンオーバー率および5-HIAA:5-HT比は,パワー密度5 mW/cm2で有意に増加した.しかし、マイクロ波曝露ラットの脳内5-HT含量には明らかな変化は見られなかった。一貫して、5-HTターンオーバー率は、電力密度10 mW/cm2で大脳皮質、延髄、視床下部において有意に増加した(15)。
Liらは、Wistarラットを平均電力密度5、10、20、30mW/cm2の2.856GHzマイクロ波放射に、それぞれ週3回、最長6週間まで曝露した。最終照射後、ラットの空間学習・記憶機能、海馬の形態構造、脳波データ、神経伝達物質含有量を検査した。その結果、各放射線群のラットの海馬および脳脊髄液中の5-HTの含有量は、曝露後28日から2カ月にかけて有意に増加し、これらの変化は、マイクロ波照射によって引き起こされる学習・記憶能力の低下、海馬の形態異常、脳波結果の異常に関連していることが明らかになった(38)。Maaroufiらは、900MHzの電磁波を1日1時間、21日間連続、最小SAR0.05W/kg、最大SAR0.18W/kgで曝露したラットの小脳における5-HT増加、5-HIAA減少、5-HIAA/5-HT比減少を報告している(34)。さらに、成体ラットの海馬、視床下部、中脳において、1,800 MHz、1日1時間、1ヶ月、2ヶ月、4ヶ月の電磁波曝露後に、それぞれSAR値0.843 W/kg、電力密度0.02 mW/cm2で5-HT増加が認められた(14)。これらの研究は、マイクロ波への長期的な曝露が、脳内の5-HTの増加をもたらし、神経伝達物質の代謝の障害を示唆するものである。
さらに、ラット脳の大脳皮質、線条体、海馬において、最大出力レベル 5 kW、2,450 MHz、照射時間 0.5 秒および 1.5 秒のマイクロ波放射のモノアミン代謝への影響を調べ、電気化学検出器付き高速液体クロマトグラフィー (HPLC)で脳内モノアミンおよびその代謝物濃度を測定した。ノルエピネフリン、DA、5-HIAAの濃度は0.5秒間の照射で減少した。一方、1.5秒の放射線照射では、これらのモノアミン濃度が上昇した(16)。一方、900MHzの携帯電話に曝露した妊娠ラットの別の研究では、マイクロ波放射強度の異なるグループ間で、ラット胎児の5-HTの含有量に有意な差は見られなかった(35)。以上より、電磁波による学習・記憶障害や脳の形態変化における 5-HT の役割を明らかにするためには、さらなる研究が必要である。
電磁波の興奮性アミノ酸神経伝達物質への影響
グルタミン酸は、神経系における主要な興奮性神経伝達物質である。グルタミン酸受容体は、脳や脊髄の神経細胞やグリアに分布しています。グルタミン酸のC末端と炭素骨格は、グルコースに由来する。グルコースはアストロサイトのエンドフィートを介して血液脳関門を通過した後、細胞質で解糖によりピルビン酸に分解される。その後、ピルビン酸はトリカルボン酸サイクル(TCA)に入り、α-ケトグルタール酸が生成される。ピルビン酸は最後にロイシン、イソロイシン、バリン、アスパラギン酸、γ-アミノ酪酸(GABA)、アラニン等から供与されたアミノ基を受け取るように伝達される(58)。さらに、グルタミン酸はGABAの代謝前駆体として、また抗酸化物質であるグルタチオンなど様々なアミノ酸系誘導体の成分としても作用する。代謝研究により、すべてのグルコースは最終的にCNSでグルタミン酸に変換されることが示されており、これは脳生理学の多方面においてグルタミン酸が重要な役割を果たすことを示している(59, 60)。
グルタミン酸に加え、アスパラギン酸もCNSに高濃度に存在する興奮性神経伝達物質である。グルタミン酸とアスパラギン酸の合成・代謝酵素は、神経細胞とグリア細胞に局在し、特にグルコース代謝のTCAサイクルに関与する神経細胞のミトコンドリアには多く存在する。オキサロ酢酸を原料として、アミノトランスフェラーゼの触媒作用により、アスパラギン酸が合成され、軸索末端に貯蔵される。神経インパルスが軸索末端に伝わると、グルタミン酸とアスパラギン酸はシナプス前膜から放出され、速やかにシナプス後膜に拡散し、ここで対応する受容体に結合してナトリウムとカリウムチャネルのゲートを開き、興奮作用が生じる。シナプス前膜とグリア細胞は、少量のグルタミン酸とアスパラギン酸を再吸収する。
Wistar ラットに 30 mW/cm2 のマイクロ波を 10 分間照射し、照射後 1、7、14、28 日目に海馬のア スパルト酸やグルタミン酸などの神経伝達物質の量の変化を HPLC で検出した。その結果、放射線照射1日後にアスパラギン酸やグルタミン酸の含量が減少しており、急性電磁波被曝が海馬の興奮性アミノ酸の量を減少させることが示唆された(17)。Ahmedらは、幼若ラットの海馬、線条体、視床下部におけるアミノ酸神経伝達物質濃度に及ぼすEMRの影響を一貫して調査している。対照群と曝露群に分け、曝露群にはSAR値0.843W/kg、電力密度0.02mW/cm2の1,800MHz EMRを1日1時間、1、2、4ヶ月間照射した。その結果、EMRは1ヶ月後に海馬のグルタミン酸とグルタミンレベルの有意な減少を誘発した(39)。これらのデータは、EMRが海馬の興奮性アミノ酸神経伝達物質の減少をもたらし、神経細胞の興奮性-抑制性バランスに影響を与え、その結果、学習・記憶能力の低下を引き起こす可能性があることを示唆している。
一方、いくつかの研究では、放射線照射後に脳内のグルタミン酸が増加することが報告されている。Wangらは、160匹のWistarラットに30 mW/cm2のマイクロ波を5分/日、5日/週、2ヶ月間照射した。そして、学習・記憶能力、海馬と脳脊髄液中のアミノ酸含有量、N-methyl D-aspartate receptor (NMDAR) subtype 2B (NR2B) の発現を調査した。マイクロ波曝露後、ラットは7日目に学習・記憶能力の有意な低下を示し、海馬と脳脊髄液中のグルタミン酸含量は増加したが、NR2Bタンパク質の発現は減少した(20)。Zhaoらは、184匹の雄のWistarラットに、平均電力密度2.5、5、10mW/cm2で、1日6分、1ヶ月間マイクロ波曝露を行った。学習・記憶能力を調べるために、モリス水迷路が適用された。海馬の神経伝達物質濃度はHPLCで検出した。ラットの学習・記憶能力は、3種類のマイクロ波長期曝露のいずれにおいても、7、14、1ヶ月で有意に低下した。海馬のグルタミン酸、アスパラギン酸、グリシン、GABAの濃度は、2.5mW/cm2群、5mW/cm2群ともに上昇したが、10mW/cm2群ではこれら4種のアミノ酸が減少した(40)。これらのデータはさらに、海馬の神経伝達物質の乱れが、長期間のマイクロ波曝露による認知機能の障害をもたらすかもしれないことを示唆している。
グルタミン酸受容体は主に2つのタイプの構成的な受容体である。第一のタイプは、NMDAR、カイネート受容体(KAR)、α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾール受容体(AMPAR)などのイオン性受容体で、イオンチャネルと結合して受容体チャネル複合体を形成し、高速な信号伝達を行います。第二のタイプは代謝性受容体(mGluR)を包含し、これは膜のGタンパク質と共役している。これらの受容体は活性化された後、脳内でGタンパク質エフェクター酵素とセカンドメッセンジャーからなるシグナル伝達系を介して作用し、ゆっくりとした生理的反応を引き起こします。各NMDARには、受容体の特異的な活性化因子であるグルタミン酸とグリシンの2つの結合認識部位が存在する(61)。NMDARは2つのNR1サブユニットと2つのNR2サブユニットから構成されていることが多く、Ca2+に対して高い透過性を持っています。NR1 は NMDAR の基本サブユニットである。NR2サブユニットには、NR2A, NR2B, NR2C, NR2Dの4つのサブタイプが存在します。グルタミン酸はNR2サブユニットに結合し、グリシンはNR1サブユニットに結合する。NMDAR の機能は主に NR2 サブユニットの N 末端ドメインに依存している (61, 62)。いくつかの研究では、脳内のNMDARの発現に及ぼす電磁波の影響について検討されている。
Wangらは、220匹の雄のWistarラットに、周波数2.856GHzのマイクロ波を5分/日、5日/週、6週間にわたって照射し、平均電力密度をそれぞれ0、2.5、5、10mW/cm2に設定した。10 mW/cm2 の群では、照射後 7 日、1、3、9 ヶ月で、モリス水迷路のナビゲーションテストにおけるラットの逃避潜時が有意に延長された。放射線照射後 3 日目には、10mW/cm2 群でプローブ試験におけるラットの有意な障害が認められた。さらに、NR2A、NR2B、p-NR2Bのタンパク質レベルは、放射線後1日から12カ月まで10 mW/cm2群で有意に低下し、NR1発現については有意な変化は認められなかった。このことから、NR2A、2B、p-NR2Bの減少がマイクロ波照射による認知機能障害に寄与している可能性が示唆された(41)。
Mausset らは、ラットの頭部専用曝露装置を用いて、SAR 値 6 W/kg の 900 MHz パルス状マイクロ波に 15 分間曝露すると、脳内で強いグリア反応が起こり、大脳皮質で NR1 サブユニットが著しく減少し、皮質と海馬で NR2A が減少し、線条体で NR2B が減少することを発見している。このことは、900 MHz の高出力パルスマイクロ波への曝露が、特定の NMDAR 分解過程を促進することを示唆している(18)。さらに、Huang らは、4 週齢の雌の Wistar ラットを、電力密度 0.5 mW/cm2 または 1.0 mW/cm2 の 1800 MHz マイクロ波に、21 日間、毎日 12 時間曝露した。海馬CA1、CA3、歯状回(DG)におけるNR2AおよびNR2Bの発現を免疫組織化学的に測定した。NR2Aについては、0.5 mW/cm2群では、CA3において0 mW/cm2群より有意に発現が低下したが、CA1とDGでは有意な変化は見られなかった。1.0 mW/cm2群では、CA1とCA3において有意に発現が低下したが、DGでは有意な変化は見られなかった。NR2Bについては、0.5mW/cm2群ではCA1とCA3において0mW/cm2群に比べ有意に発現が低下した。1.0 mW/cm2群では、CA1、CA3、DGで発現が有意に低下した(42)。このことから、マイクロ波照射によるNR2AとNR2Bの減少は、照射量と海馬の部位に依存することがさらに示唆された。
また、65 mW/cm2 のマイクロ波を 20 分間照射したところ(SAR 値 12.0 W/kg)、海馬の NR1 サブユニット の mRNA 発現が 3、24 時間および 3 日後に減少し、NR2A サブユニットの発現が 0 時間、3 時間および 12 時間後に減少した。NR2CサブユニットのmRNA発現は0時間後と24時間後に減少したが、NR2Dサブユニットの発現は照射後0、12、24時間、3日目に増加した。NR2B mRNAの発現には有意な変化は見られなかった(19)。しかし、Xiongらは、48匹の雄のWistarラットに2.856 GHz、30 mW/cm2のマイクロ波を隔日で10分間、3回照射した。その結果、マイクロ波照射後7日目にNR2AサブユニットのmRNA発現が顕著に増加し、1日目にNR2Bサブユニットのラット海馬におけるmRNA発現が増加した(21)。これらの結果は、NMDAR を構成するサブユニットの組成が変化し、マイクロ波照射後のラット海馬で NMDAR の自動調節機能が破壊される可能性があることを示している。さらに、マイクロ波照射は、興奮性アミノ酸の発現に影響を与える可能性がある。
抑制性アミノ酸の神経伝達物質に対する電磁波の影響
GABAとグリシンは脳内の主要な抑制性神経伝達物質であり、GABAは中枢神経系におけるシナプス部位の約50%を占める重要な神経伝達物質である。GABAは大脳皮質、海馬、視床、基底核、小脳で重要な役割を果たし、情動、記憶、睡眠の調節、抗高血圧、抗疲労、鎮痛など、生体の様々な機能調節に関与している(63).GABAは、グルタミン酸脱炭酸酵素の触媒作用により、神経終末で産生される。シナプス前膜から放出されたGABAの大部分は、シナプス後膜に拡散し、シナプス後膜に抑制作用をもたらす。シナプス前膜とグリア細胞は数分子のGABAを再吸収し、ミトコンドリアでコハクセミホルムアルデヒドに変換された後、コハク酸に変換されてトリカルボン酸サイクルに参加し、グリア細胞と神経端末のエネルギーのごく一部を供給する(64, 65)。Qiaoらは、Wistarラットに平均電力密度30 mW/cm2のマイクロ波を5分間照射した。その後、HPLCを用いて、照射6時間後に海馬のシナプトソームから放出されるGABA含量を測定した。その結果、海馬のシナプトソームから放出されるGABA量は、放射線被曝後に有意に減少することが示された(22)。Zhangらは、周波数1.8GHz、期間4週間のEMR曝露が、思春期の雄マウスの情動行動と空間記憶に及ぼす影響を調査している。その結果、大脳皮質と海馬のGABAとアスパラギン酸の濃度がEMR曝露後に有意に減少することを見出した(66)。これらの結果は、EMRがGABAの神経伝達を低下させる可能性を示唆している。
Wangらは、80匹のWistarラットに2.856GHzのパルスマイクロ波を50mW/cm2の出力密度で6分間照射した。マイクロ波曝露後1、3、6、9、12、18ヶ月目に海馬のアミノ酸神経伝達物質の含有量を検出した。その結果、曝露後6ヶ月でグルタミン酸とGABAの比率が有意に減少した(23)。Noorらは、周波数900Mz、SAR値1.165W/kg、電力密度0.02mW/cm2の電磁波を毎日1時間曝露した場合の、成熟雄アルビノラットの中脳、小脳、髄質のアミノ酸神経伝達物質レベルへの影響を調査している。アミノ酸レベルの評価は、1時間、1ヶ月、2ヶ月、4ヶ月の放射線被曝後に適用された。中脳では、1ヶ月後にグリシンの有意な増加が観察され、次いで4ヶ月後にGABAの有意な増加が観察された(9)。これらの結果はさらに、マイクロ波放射がGABAの神経調節機能に影響を与え、中枢神経系における興奮と抑制のバランスを崩す可能性を示唆している。
中枢神経系では、GABA は抑制性の伝達物質として働いています。GABA 受容体には、リガンドゲート GABA (A) チャネルと G タンパク質共役型 GABA (B) 受容体があり、神経系全体で抑制性シナプス後伝達を媒介します (67)。ある研究では、初代培養ラット皮質ニューロンを、平均電力密度 6 mW/cm2、SAR 値 2.23 W/kg の 900 MHz マイクロ波放射に曝露した。その結果、神経細胞の GABA 受容体タンパク質の発現が有意に上昇した (24)。EMRのGABA受容体への影響について報告した研究はほとんどない。今後、EMR曝露時のGABAおよびその受容体の役割を明らかにするためのさらなる研究が必要である。以上のことから、EMRは抑制性神経伝達物質であるGABAやグリシンの代謝障害を引き起こし、神経細胞の興奮-抑制バランスに影響を与えることで神経機能障害を引き起こす可能性が示唆された。
電磁波のアセチルコリン(Ach)に対する影響
前脳基底部から大脳皮質、海馬に至るコリン作動性線維投射は、脳内で最も重要なコリン作動性システムであり、コリン作動性システムは行動認知に重要な役割を担っている。Achはコリン作動性神経終末から放出され、脳内で最初に測定された神経伝達物質である。脳の細胞外液中のAchの変化は、中枢神経系の機能変化と密接に関連しています。Achはコリンアセチルトランスフェラーゼ(ChAT)の触媒作用のもとコリンとアセチルCoAによって合成され、小胞に取り込まれ貯蔵されます。神経細胞のシナプス前膜が興奮すると、シナプス小胞内のAchがシナプス間隙に放出され、Gタンパク質結合型ムスカリン性アセチルコリン受容体(mAChR)やリガンド結合型ニコチン性アセチルコリン受容体(nAChR)に作用する。シナプス伝達の効果は、受容体を介した膜の脱分極や下流のシグナル伝達により変化し、学習や記憶に影響を与える。作用後のAchは、アセチルコリンエステラーゼ(AChE)によりコリンと酢酸に加水分解され、不活性化されます(68)。Achの学習・記憶における作用様式は、活性化する受容体の種類に依存する(69)。
電磁波に曝露された脳におけるAchの代謝については、これまでほとんど報告されていない。Fujiwara らは、2.45 GHz の高出力マイクロ波照射により、マウス脳内の Ach 含有量が一過性に上昇することを見出した(25)。Laiらは、2.45GHz、0.6W/kgのマイクロ波を20分間急性曝露すると、ラットの前頭葉皮質、海馬、視床下部においてコリンの取り込み活性が上昇することを見出した(26)。一方、2.45GHz、0.6W/kgのマイクロ波を20分/日、10日間連続で照射すると、ラット前頭葉皮質と海馬のmAChR濃度が低下し、45分/日、10日間連続で照射すると、ラット海馬のmAChR濃度が上昇し、いずれも学習・記憶能力の低下と一致しています。また、Krylova らは、2.35GHz、1mW/cm2 のマイクロ波照射により、ラット大脳皮質の mAChR 受容体の数は増加するが、機能活性は低下することを見出した(27)。我々は、ラット海馬において、周波数 2.856 GHz、平均電力密度 30 mW/cm2 で 15 分間のマイクロ波照射後、6 時間と 3 日目に Ach、ChAT および AChE の増加を認めたが、ChAT および AChE の活性には有意な影響を与えなかった。さらに、放射線照射後、M1-、M3-、β2-型AChR mRNAの発現が低下し、α4-、α7-型AChR mRNAの発現が上昇することを見いだした。このことは、マイクロ波急性被曝の初期には、Achの合成・代謝の亢進とAch受容体の発現の乱れにより、コリン作動性システムの機能障害と認知機能の低下が生じる可能性を示している。
さらに、Testylierらは、2.45GHz、4mW/cm2のマイクロ波を1時間照射すると海馬CA1野で放出されるAchが減少し、照射後6時間で細胞外Ach濃度が照射前の約60%と最低レベルになることを見出した(28)。他の研究では、2.45 GHz の長期・低用量マイクロ波照射により、海馬で AChR の M1 型が発現上昇し、AChE の活性が上昇し、細胞内カルシウム濃度が上昇することが示されている (44, 70)。Derin らは、Wistar ラットを偽被曝群、45 および 65 V/m 被曝群に分け、被曝群には周波数 2.1 GHz で 1 週間の被曝を経験させた。海馬におけるAChE、ChAT、VAChTのタンパク質およびmRNAの発現レベルを、ウェスタンブロットおよびリアルタイムPCRを用いて調べた。65V/mに曝露したラット海馬では、AChE、ChAT、VAChTのレベルが他の部位に比べ有意に低かった(45)。さらに、ラットの線条体、前頭皮質、海馬、視床下部において、円筒導波管内のパルス状(2μs、500パルス/秒)または連続2,450MHzマイクロ波に45分間短時間曝露した後、ナトリウム依存性の高親和性コリンの取り込みを測定した。すべての曝露条件において、全身平均SAR値は0.6W/kgであった。すべての照射条件において、マイクロ波曝露後に前頭葉皮質でコリンの取り込みが減少した(29)。Gupta らは、2.45 GHz、1 日 1 時間、28 日間連続のマイクロ波照射によるラット海馬の Ach 含有量の低下と AChE 活性の上昇を報告した(46)。Kunjilwar と Behari は、周波数 147 MHz、サブハーモニクス 73.5 MHz、振幅 36.75 MHz、16 および 76 Hz で変調した RF-EMF を 3 h/day で 30-35 日間連続して照射し、発達中のラット脳のコリン作動性システムに対する長期曝露の影響を調査した。曝露したラットでは、対照ラットに比べてAChE活性の有意な低下が認められた(71)。これらの研究はさらに、Achの合成と代謝の障害がEMRによる認知機能障害の重要な部分であることを示唆した。
ペプチドなどの神経伝達物質に対する電磁波の影響
オピオイドペプチドには、β-エンドルフィン、エンケファリン、ダイノルフィンなどがあり、脳内でモルヒネ様活性を有するペプチドである。オピオイド受容体は、Gタンパク質共役型受容体である。内因性オピオイド受容体は、アデノシンシクラーゼの阻害、電位依存性カルシウムチャネル電流の減少、あるいはカリウムチャネルの活性化をもたらし、その結果、膜興奮性の低下と伝達物質の放出をもたらし、学習と記憶のプロセスの制御に関与している(72)。Laiらは、パルスマイクロ波(2,450MHz、1mW/cm2、SAR値0.6W/kg)に45分間短期暴露したラット脳のコリン作動性活性に対する脳内のオピオイド受容体のサブタイプについて調査している。その結果、3種類のオピオイド受容体サブタイプがマイクロ波照射による海馬のコリン作動性活性の低下をブロックしたことから、マイクロ波による海馬のコリン作動性活性低下にオピオイド系が関与していることが示唆された(30)。ペプチド神経伝達物質に対するEMRの影響については、ほとんど報告がない。Lai らは、パルス状の 2,450 MHz マイクロ波 (1 mW/cm2, SAR 値 0.6 W/kg) に 45 分間曝露した後、ラットが餌の報酬を得るための放射状腕迷路を行う際に学習障害を示したと報告している。これは、電磁波曝露後の空間ワーキングメモリ機能の欠損を示唆するものである。マイクロ波によって誘発された放射状腕迷路の学習障害は、アヘン拮抗薬ナルトレキソンまたはコリン作動薬で前処理することによってブロックされた。このことはさらに、脳内の内因性オピオイド神経伝達系とコリン作動系の両方がマイクロ波誘発の空間記憶障害に関与していることを示唆している(31)。
一酸化窒素(NO)は、シナプス可塑性の変化や長期増強効果において逆行性メッセンジャーとして働く(48)。マウスをコンピュータ電磁波(30×1014-715×1014Hz)、強度0.9V/m(電力密度0.22μw/cm2)で6、12、18時間/日のいずれかに30日間連続照射した。その結果、マウス脳内のNO濃度は、照射時間の延長とともに徐々に増加することがわかった(73)。NOは親油性により細胞膜を通過することができるが、エキソサイトーシスという形で放出されることはなく、化学反応を経て不活性化されることで作用する。また、NOは他のフリーラジカルや遷移金属のd軌道と反応することがある。後者で最も一般的なのは、NOと鉄の相互作用である。鉄は、多くの生理的プロセスに関与する豊富なタンパク質、特にヘムタンパク質の主要成分として作用するためである。Burlakaらは、Volna(ウクライナ)の発電機を用いて、インパルス変調、パルス時間2ms、パルス間隔10ms、搬送周波数0.465GHz、曝露時間17.5分の条件で非熱スペクトルの超高周波EMRに動物を曝露している。照射領域のエネルギー束密度は1.0-6.0mW/cm2であった。超高周波EMRは、動物脳組織の神経細胞のミトコンドリアにおけるNO合成レベルの有意な上昇と、ミトコンドリアNO合成酵素の活性の有意な上昇をもたらした(32)。高濃度のNOが細胞に与える毒性を考えると、NOの増加は神経細胞の障害を引き起こし、それがマウスの学習・記憶能力の低下につながる可能性がある。
電磁波による神経伝達物質の変化のメカニズムと考えられるもの
電気生理的変化
神経生理学的メカニズム、特に電気生理学的変化は、電磁波曝露に伴う神経伝達物質の変化をより良く理解することにつながる。脳の電気的活動と電磁波の干渉を明らかにするために、いくつかの神経画像法が用いられている。例えば、大脳皮質の細胞外電位の変化は脳波法で測定でき、神経心理学的パフォーマンス中の血液酸素利用率の領域変化は機能的磁気共鳴画像法(fMRI)で検出でき、ポジトロン放射断層法(PET)は脳代謝を反映する(43、74-76)。脳の電気活動は,神経細胞の膜電位の変動に由来する.神経インパルスが伝達されると,シナプス後電位が生じ,それに続くシナプス伝達が行われ,神経伝達の調節が反映されると考えられる.
多くの研究で、電磁波曝露時に大脳皮質の興奮性または効率が上昇し、この電気活動の変化は曝露後数分間持続することが示されている。また、EMR曝露により、脳代謝の増加(PET)、アルファ活動の減少、高ベータおよびガンマ周波数の活動の増加、反応時間の増加、睡眠脳波の乱れなどが誘発された(77-82)。fMRI、PET、電磁波誘発事象関連電位(ERP)(83、84)、事象関連脱同期(ERD)、半球間同期などいくつかの方法論から、前頭部と側頭部が影響を受けやすいようだ(76、81、82、85〜87)。EMFによる皮質の興奮性や効率への影響については、依存性Na-K膜貫通イオンチャネルの変化、細胞カルシウムホメオスタシスの変化、細胞興奮性の増加、ストレスに対する細胞応答の調節など、いくつかの要因が提案されている (86, 87)。しかし、いくつかの矛盾した知見が存在し、結果の異質性は、方法論の違い、統計的検出力、解釈基準によるものと思われる(88)。総じて、脳の電気的活動の異常は、電磁波によって引き起こされる神経伝達の変調を反映し、結果として神経伝達物質の変化をもたらすと考えられる。
細胞膜の損傷
細胞膜は、電磁波の最初の重要なターゲットであることが知られている。細胞膜の損傷は、脳内の神経伝達物質の変化を引き起こす可能性がある。神経伝達物質に対する電磁波の影響を理解することは、電磁波の細胞内における標的をさらに特定するために重要である。EMR は、カルシウム、イオン分布、イオン透過性の変化など、細胞膜の透過性を変化させることができる(89)。カルシウムは重要なシグナル伝達物質の一つであり、カルシウムのホメオスタシスのバランスが崩れると、細胞の多くの機能を変化させる。これまでの研究により、電磁波曝露は、細胞膜上のカルシウムチャネルおよび受容体を変化させ、細胞膜上のカルシウムイオンの輸送に影響を与え、それが細胞のシグナル伝達経路に重要な役割を果たし、ひいては神経伝達物質の反応に影響を与える可能性があることが示されている(90, 91)。電磁波の存在により、カルシウムチャネルの開口数が増加することが報告されており、電磁波曝露により細胞内カルシウム濃度が上昇する可能性がある(92)。また、細胞内カルシウム濃度の変化は、シナプスの異常な作用を誘発したり、神経細胞のアポトーシスを引き起こしたりする。このことは、学習・記憶過程の神経伝達に影響を及ぼす可能性がある(93)。
さらに、電位依存性カルシウムチャネル(VGCC)の活性が、多くの細胞種で EMR に曝露された後に亢進することが明らかにされている(94-96)。これまでの研究では、VGCC の活性を、マイクロ波放射によって誘発されたイオンチャネルの変化の指標として用いている (96, 97)。神経伝達物質のレベルは、シナプス小胞関連タンパク質の発現レベルなどの膜特性を示すことができ、シナプス小胞膜の機能を示すことができる(22, 98)。EMRによるVGCCの活性化は、細胞内カルシウム、一酸化窒素、ペルオキシナイトライトの急激な上昇を引き起こすことが報告されている(99)。しかし、海馬の初代神経細胞における2.856GHzパルスマイクロ波の影響に関する最近の研究では、マイクロ波照射後に細胞内の総カルシウム、小胞体およびミトコンドリア内のカルシウムレベルがすべて減少したことが報告されており、マイクロ波照射中のカルシウム流出が示唆されている(100).神経細胞におけるカルシウムの流出・流入に対する電磁波の影響については、多くの動物実験で示唆されているが(101-103)、膜の完全性・透過性に対する電磁波の影響については、まだ不明である。膜透過性の変化は、膜の完全性の損傷につながり、脳内神経伝達物質の不均衡を変化させる可能性がある。この点で、神経伝達物質と細胞膜透過性の関係に対するEMRの影響を調査するために、様々な期間と量のEMRによるさらなる研究が必要である。
シグナル伝達の異常
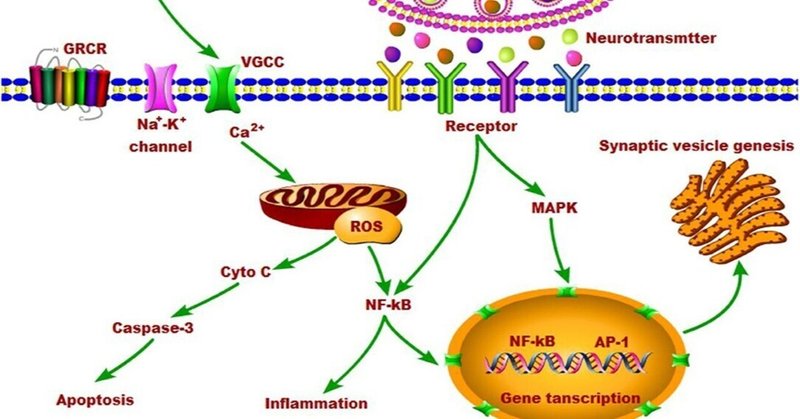
神経伝達物質とその受容体は、細胞の増殖、アポトーシス、分化、炎症などに関わる様々なシグナル伝達に関与していることが知られています。神経伝達と細胞シグナル伝達のクロストークは、ひいては神経伝達物質の代謝と輸送に影響を与える可能性があります。EMR曝露は、過剰なカルシウムシグナルとペルオキシナイトライト経路を介して主な病態生理学的効果を生み出し、EMRの多様な非熱的効果はVGCC活性化を介して生み出される(104)。細胞のエネルギー源であるミトコンドリアのカルシウム反応は、EMR曝露の影響に応じたカルシウムシグナル伝達経路の変化により影響を受けた(90)。カルシウムシグナル伝達の変化に加えて、EMRは神経細胞においてフリーラジカルプロセスの活性化と活性酸素種(ROS)の過剰生産を引き起こす可能性がある(53, 104-108)。神経細胞は、エネルギーを酸化的リン酸化に依存しているため、他の細胞と比較して酸化ストレスに対して脆弱である。電磁波曝露中、脳内では酸化剤と抗酸化剤のバランスが崩れ、酸化ストレスが発生する(109)。カルシウムの増加によりNOとスーパーオキシド(O-2)の両方が上昇し、ペルオキシナイトライト(ONOO-)レベルが増加する。様々な酸化物質は、大きく上昇したNF-κB(NF-κB)活性を生み出すように作用し、炎症を引き起こす(110)。また、NF-κBシグナルは、神経免疫反応、シナプス可塑性、学習・記憶、神経保護、神経変性に関与することが報告されている(111, 112)。EMR曝露により、アポトーシス経路に属する因子の発現が上昇し、その結果、神経細胞のアポトーシスが起こることが示されている(113, 114)。このメカニズムは、主にEMR曝露に伴う活性酸素の発生が原因であると考えられている。
非電離放射線のエネルギーは、化学結合を直接切断するほどではないので、非電離放射線の被ばくによるDNA損傷の発生は、主として活性酸素の生成、次いで酸化ストレスの結果である。数多くの動物実験により、非熱的電磁波が酸化ストレスを引き起こすこと(115, 116)、特に脳において顕著であること(3, 117-119)が明確に示されている。900 MHzまたは2.45 GHzの非熱的EMRをラットに短期間または長期間照射すると、酸化ストレスの誘導により海馬錐体細胞の神経機能障害やアポトーシスを誘発する(117, 120)、小脳プルキンエ細胞 (121) があることが報告されている。また、マイトジェン活性化ホスホキナーゼ(MAPK)経路は、細胞の増殖や代謝に重要な役割を担っている。MAPKカスケード経路の活性化の後、下流の転写因子のリン酸化が起こる(89, 122)。異なる種類の細胞の増殖と生存は、低濃度のフリーラジカルによって刺激されることがある。活性酸素の細胞増殖への影響は、生理学的プロセスにおける重要な二次メッセンジャーであり、活性酸素は細胞質カルシウムのホメオスタシスの調節において重要な役割を果たす。AP-1ファミリー因子や核因子κB(NF-κB)のタンパク質リン酸化と活性化は、細胞質カルシウムのレベルによって制御される(123)。プロテインキナーゼ経路の活性化は、神経伝達物質の不均衡を含む電磁波曝露に対する生理的反応を制御しているが、その詳細なメカニズムはまだ不明である。
考察
電磁波曝露の期間に応じて、脳内神経伝達物質測定を含むすべての文献を短期(1週間以内)曝露群と長期(1週間以上)曝露群の2群に分けた。表1、表2に示した文献から明らかなように、短期(表1)と長期(表2)の電磁波曝露の間で神経伝達物質の変化には明らかな差は見られなかった。非熱的電磁波に対する反応は、出力密度と曝露時間の両方に依存することが知られている。短期間の固定されたEMR曝露では影響がないことを示す研究もあるが、これは長期の曝露では影響がないことを意味しない(5, 124)。最近のレビューで、Leachらは、データベースに収められた2,653の論文を分析し、300 MHz~3 GHzの範囲における生物影響の結果を調べた。その結果、「影響あり」の論文の方が「影響なし」の論文よりも3倍も多いことが分かりました(125)。
また、「影響なし」とした論文もありますが、「影響あり」とした論文も多くあります。このような矛盾は、研究間の再現性の欠如に起因している可能性がある。文献レビューや関連する論文間の比較は、対象、実験方法、曝露パラメータが異なるため、困難である。しかしながら、動物モデルはヒトへのリスクを強く示唆するものでしかなく、動物実験とヒトの生物学的影響との交換式や換算規則が明らかになるには程遠い。信頼できる安全基準の開発は、パワー密度、線量、曝露時間などのパラメータを分析し、これが非熱的強度の電磁波曝露による健康への有害な影響から保護することになる。
電磁波が細胞内のカルシウム機能のいくつかの側面を変化させることは、多くの証拠から示されている。高周波電磁界への曝露によるカルシウム代謝の変化を報告する研究は数多くあるが、これらの影響の根本的なメカニズムはまだ明らかではない。
しかし、いくつかの研究では、カルシウムの活性化がタンパク質構成の変化をもたらす最初のイベントであり、次いで活性酸素が発生し、最終的に分子的なアポトーシス経路が活性化される可能性が示唆されている(101)。Lushchakらは、電磁波曝露により、まず脳内でフリーラジカルが生成され、その後活性酸素に変換されると報告している(126)。活性酸素の増加は、細胞内の様々な生体分子を攻撃することができる。上昇した活性酸素はまた、カルシウムの放出を誘発し、DNA損傷につながる遺伝的因子を活性化することができる(110)。特にミトコンドリア依存性のカスパーゼ3経路は、神経細胞のアポトーシスを引き起こし(113, 127)、脳の行動変化や病態生理学的変化を引き起こす可能性がある。
つまり、EMRは細胞内カルシウムを増加させ、活性酸素を生成し、最終的には細胞機能を変化させ、神経伝達物質のアンバランスを含む多くの生物学的影響を引き起こすと考えられる。EMRの脳内神経伝達物質への影響とそのメカニズムについて、図1にまとめた。
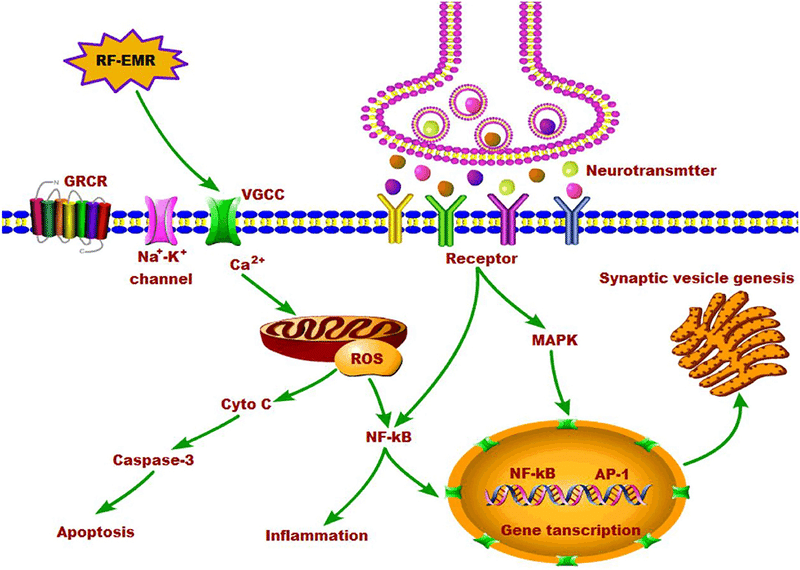
各神経伝達物質の変化を説明するために生化学的不均衡に絞り込んでいるが、神経伝達物質の複合的な影響に注目する必要がある。また、電磁波曝露後の様々な神経伝達への影響は、神経生理学的変化、カルシウムや活性酸素の増加、それによる細胞膜損傷や下流のシグナル伝達の変化など、脳の様々な部位での複合的な影響による可能性も考えられる。神経伝達物質の変化に起因する神経細胞の興奮と抑制のアンバランスは、行動を変化させるだろうし、それは明らかな構造的変化を伴わずに行われるかもしれない。現在のところ、電磁波曝露の神経化学的メカニズムはまだ不明である。この点に関するさらなる研究が必要であり、そうすればEMRによる脳のメカニズムがより明確になるであろう。
まとめ
以上のように、EMRによる脳内神経伝達物質の合成、代謝、輸送に関する研究は徐々に増えているが、EMRのパラメータ、実験対象、条件などが異なるため、実験結果の整合性、比較はあまりなされていないのが現状である。
そのため、EMRが神経伝達物質の代謝・輸送に及ぼす影響については明らかにされていない。また、EMRによる神経行動障害における神経伝達物質の役割とそのメカニズムも明らかにされていない。さらなる詳細な研究が必要である。
一方、脳内の神経伝達物質は複雑に多様化しているため、神経伝達物質の相互作用、共伝達、共調性により、各神経伝達物質の一次的変化と二次的変化の区別が困難である。また、脳内の異なる神経核の相互作用は高度な神経回路を構成しており、これが脳機能の基本的な基盤となっている。従って、電磁波による脳の神経伝達物質の異常には、神経回路の調節が関与している可能性がある。
今後の展望
近年、神経ウイルストレーサー、神経画像、神経電気生理など、脳科学における新しい技術が急速に発展している。これらの技術は、特にオプトジェネティクスや化学遺伝学などの脳介入技術を開発し、広く応用するために考案されたものである。さらに、これらの進歩は、電磁波の神経生物学的影響を神経回路レベルで研究するための新しい方法を提供した。
注目すべきは、Gタンパク質共役型受容体活性化ベース(GRAB)センサーは、神経伝達物質の放出を直接測定し、生体内の神経伝達の活性をモニターできることである(128)。GRABセンサーは、ファイバーフォトメトリー記録と組み合わせることで、様々な行動を行っているマウスの複数の脳領域における1回の神経伝達物質動態を高感度に検出することができる(82)。このような神経科学の新しい技術により、神経回路レベルでの神経伝達物質代謝や神経伝達物質の輸送に対する電磁波の影響を研究することは、電磁波の神経生物学的影響とそのメカニズムの研究に固有の課題を克服し、予防標的や介入策の探索のための新しい道を開くと期待される。
著者による貢献
CHが論文を執筆し、この原稿の概要を説明した。HZとYLは、論文全体を通して詳細な指導を行った。最終原稿は全著者が読み、承認した。
資金提供
本研究は、中国国家自然科学基金会(81472951)の支援により行われた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるいかなる商業的または金銭的関係もない状態で行われたことを宣言する。
出版社からのコメント
本論文で述べられたすべての主張は、著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはそのメーカーが行う可能性のある主張は、出版社によって保証または承認されるものではありません。
参考文献
1.Wei YW, Yang JY, Chen ZY, Wu TN, Lv B. Modulation of resting-state brain functional connectivity by exposure to acute fourth-generation long-term evolution electromagnetic field(第四世代長期進化電磁場急性曝露による安静時脳機能連関の変化。fMRI 研究。バイオエレクトロマグネティクス.(2019) 40:42-51. doi: 10.1002/bem.22165.
PubMed Abstract|CrossRef Full Text|Google Scholar
2.Yang L, Zhang C, Chen ZY Li CS, Wu TN.(ヤン・エル、チャン・シー、チェン・ジー、リ・シーエス、ウー・ティーエヌ)。2. Yang L. Zhang C. Chen ZY Li CS, Wu TN. 長期進化信号へのヒト曝露の機能およびネットワーク解析を参照。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
3.Megha K, Deshmukh PS, Banerjee BD, Tripathi AK, Ahmed R, Abegaonkar MP.低強度マイクロ波が誘発するラット脳の酸化ストレス、炎症反応、DNA 損傷。Neurotoxicology.(2015) 51:158-65. doi: 10.1016/j.neuro.2015.10.009
PubMed Abstract|CrossRefフルテキスト|Google Scholar
4.Saikhedkar N, Bhatnagar M, Jain A, Sukhwal P, Sharma C, Jaiswal N. Effects of mobile phone radiation (900 MHz radiofrequency) on structure and functions of rat brain.(ラット脳の構造と機能に対する携帯電話照射の影響)。ニューロール・レズ (2014) 36:1072-9. doi: 10.1179/1743132814Y.0000000392
PubMed Abstract|CrossRefフルテキスト|Google Scholar
5.Belpomme D, Hardell L, Belyaev I, Burgio E, Carpenter DO.(ベルポムD、ハーデルL、ベリャーエフI、ブルジオE、カーペンターDO)。低強度非電離放射線の熱的および非熱的健康影響。国際的な視点。エンバイロン・ポルート. (2018) 242:643-58. doi: 10.1016/j.envpol.2018.07.019
PubMed Abstract|CrossRef Full Text|Google Scholar
6.Zhi WJ, Wang LF, Hu XJ.マイクロ波放射の脳への影響に関する最近の進歩。Mil Med Res. (2017) 4:29. doi: 10.1186/s40779-017-0139-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
7.Comelekoglu U, Aktas S, Demirbag B, Karagul MI, Yalin S, Yildirim M, et al. 低レベル1800MHz高周波放射のラット坐骨神経への影響とパリカルシトールの保護的役割.Bioelectromagnetics.(2018) 39:631-43. doi: 10.1002/bem.22149.
PubMed Abstract|CrossRef Full Text|Google Scholar
8.Eris AH, Kiziltan HS, Meral I, Genc H, Trabzon M, Seyithanoglu H, et al. Short-term 900 MHz low level electromagnetic radiation exposure on blood serotonin and glutamate levels.(短期900 MHz低レベル電磁波曝露の血中セロトニンおよびグルタミン酸レベルへの影響。ブラティスル レック リスティー. (2015) 116:101-3. doi: 10.4149/BLL_2015_019
PubMed Abstract|CrossRefフルテキスト|Google Scholar
9.Noor NA、Mohammed HS、Ahmed NA、Radwan NM.携帯電話への曝露による、成体および若い雄のアルビノラットのいくつかの脳領域におけるアミノ酸神経伝達物質の変動。Eur Rev Med Pharmacol Sci. (2011) 15:729-42.
PubMed Abstract|Google Scholar
10.Ferreri F, Curcio G, Pasqualetti P, De Gennaro L, Fini R, Rossini PM.携帯電話の電波とヒトの脳の興奮性。Ann Neurol.(2006) 60:188-96.
PubMed Abstract|CrossRef Full Text|Google Scholar
11.Tuszynski J, Tilli TM, Levin M. Ion Channel and Neurotransmitter Modulators as Electroceutical Approaches to Control of Cancer(癌抑制のための電気生理学的アプローチとしてのイオンチャネルおよび神経伝達物質調節剤). Currend Pharm Des.Curr Pharm Des.(2017) 23:4827-41. doi: 10.2174/1381612823666170530105837
PubMed Abstract|CrossRefフルテキスト|Google Scholar
12.Ng J、Heales SJ、Kurian MA.小児モノアミン神経伝達障害の臨床的特徴および薬物療法。Paediatr Drugs.(2014) 16:275-91. doi: 10.1007/s40272-014-0079-z
PubMed Abstract|CrossRefフルテキスト|Google Scholar
13.シェフラーZM、レディV、ピラリゼッティLS。生理学、神経伝達物質。フロリダ州トレジャーアイランド。StatPearls 出版 (2021).
Google Scholar
14.Aboul Ezz HS, Khadrawy YA, Ahmed NA, Radwan NM, El Bakry MM.携帯電話からのパルス電磁波がラット脳の4つの異なる領域におけるモノアミン神経伝達物質のレベルに及ぼす影響。Eur Rev Med Pharmacol Sci. (2013) 17:1782-8.
Google Scholar
15.マイクロ波の全身照射がラットの脳内生合成アミンに及ぼす影響。Eur J Appl Physiol Occup Physiol. (1992) 65:124-8.
PubMed Abstract|CrossRef Full Text|Google Scholar
16.石川和彦、柴乃木希典、斉藤聡、McGaugh JL.マイクロ波照射がラット解剖脳におけるモノアミン代謝に及ぼす影響。脳研究(1982) 240:158-61.
PubMed Abstract|CrossRef Full Text|Google Scholar
17.Karri V, Schuhmacher M, Kumar V. 重金属(Pb, Cd, As および MeHg)は認知機能障害の危険因子として。脳における金属混合メカニズムの総説。エンバイロン・トキシコール・ファーマコル.(2016) 48:203-13. doi: 10.1016/j.etap.2016.09.016
PubMed Abstract|CrossRef Full Text|Google Scholar
18.Mausset-Bonnefont AL, Hirbec H, Bonnefont X, Privat A, Vignon J, de Sèze R. GSM 900-MHz電磁界への急性曝露は、ラット脳におけるグリア反応性と生化学的修飾を誘発する。Neurobiol Dis.(2004) 17:445-54. doi: 10.1016/j.nbd.2004.07.004
PubMed Abstract|CrossRef Full Text|Google Scholar
19.Zhang YW Yu ZP, Xie Y, Fang Q. Effects of microwave irradiation on NMDA receptor subunits mRNA expressions in rat hippocampus.(ラット海馬におけるマイクロ波照射の NMDA 受容体サブユニット mRNA 表現への影響).J Hygiene Res. (2008) 37:25-8.
PubMed Abstract|Google Scholar
20.Wang LF, Tian DW Li HJ, Gao YB, Wang CZ, Zhao L, Zuo HY, et al. 新しいラット NR2B サブユニット遺伝子プロモーター領域の変異の同定とマイクロ波誘発神経細胞障害との関連性。Mol Neurobiol.(2016) 53:2100-11. doi: 10.1007/s12035-015-9169-3
PubMed Abstract|CrossRefフルテキスト|Google Scholar
21.Xiong L, Sun CF, Zhang J, Gao YB, Wang LF, Zuo HY, et al. マイクロ波曝露は、NMDA受容体シグナル伝達経路の過剰活性化を通じてラット海馬およびPC12細胞におけるシナプス可塑性を損ねる。バイオメッド・エンバイロメント・サイエンス(2015)28:13-24. doi: 10.3967/bes2015.002
PubMed Abstract|CrossRefフルテキスト|Google Scholar
22.Qiao SM, Peng RY, Yan HT, Gao YB, Wang CZ, Wang SM, et al. リン酸化シナプシン I (ser-553) の減少は、Wistar ラットのマイクロ波曝露後の GABA 放出を減衰させることにより空間記憶障害につながる。PLoS ONE.(2014) 9:e95503. doi: 10.1371/journal.pone.0095503
PubMed Abstract|CrossRefフルテキスト|Google Scholar
23.Wang H, Peng RY, Zhao L, Wang SM, Gao YB, Wang LF, et al. NMDA受容体とマイクロ波による学習・記憶障害との関係:Wistarラットの長期観察.Int J Radiat Biol. (2015) 91:262-9. doi: 10.3109/09553002.2014.988893.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
24.Wang Q, Cao ZJ, Bai XT.900 MHz電磁波が生後間もないラットの大脳皮質神経細胞のGABA受容体の発現に及ぼす影響。J Hygiene Res. (2005) 34:546-68.
PubMed Abstract|Google Scholar
25.高出力マイクロ波照射によるマウス脳内アセチルコリン分析への応用.Eur J Pharmacol.(1978) 51:299-301. doi: 10.1016/0014-2999(78)90416-8
PubMed Abstract | CrossRef Full Text | Google Scholar
26.Lai H, Carino MA, Horita A, Guy AW.低レベルマイクロ波照射と中枢性コリン作動性システム。薬理学生物化学行動学。(1989) 33:131-8. doi: 10.1016/0091-3057(89)90442-5
PubMed Abstract|CrossRef Full Text|Google Scholar
27.Krylova IN, Dukhanin AS.Il'in AB, Kuznetsova EIu, Balaeva NV, Shimanovskii NL, Pal'tsev IuP, Iasnetsov VV.超高周波電磁波の学習・記憶過程への影響。Biull Eksp Biol Med. (1992) 114:483-4. doi: 10.1007/BF00837653
PubMed Abstract|CrossRef Full Text|Google Scholar
28.Testylier G, Tonduli L, Malabiau R, Debouzy JC.低レベル高周波磁場への曝露が自由行動下ラットの海馬におけるアセチルコリン放出に及ぼす影響。Bioelectromagnetics.(2002) 23:249-55. doi: 10.1002/bem.10008
PubMed Abstract|CrossRef Full Text|Google Scholar
29.Lai H, Horita A, Guy AW.急性低レベルマイクロ波曝露と中枢性コリン作動性活性:照射パラメータに関する研究。バイオエレクトロマグネティックス。(1988) 9:355-62.論文番号: 10.1002/bem.2250090405
PubMed Abstract|CrossRef Full Text|Google Scholar
30.Lai H, Carino MA, Horita A, Guy AW.マイクロ波によって誘発されるラットの中枢性コリン作動性活性の減少を媒介するオピオイド受容体サブタイプ。Bioelectromagnetics.(1992) 13:237-46. doi: 10.1002/bem.2250130308.
PubMed Abstract | CrossRef Full Text | Google Scholar
31.Lai H, Horita A, Guy AW.マイクロ波照射がラットの放射状腕力迷路の成績に影響を与える。バイオエレクトロマグネティックス。(1994) 15:95-104.論文番号: 10.1002/bem.2250150202
PubMed Abstract | CrossRef Full Text | Google Scholar
32.Burlaka AP、Druzhyna MO、Vovk AV。Lukin SM.低線量の電離放射線またはUHF電磁波に曝露したラットの脳細胞の酸化還元代謝の乱れ。Exp Oncol.(2016) 38:238-41. doi: 10.31768/2312-8852.2016.38(4):238-241.
クロスレフフルテキスト|Google Scholar
33.キムJH、イCH、キムHG、キムHR。線条体のドーパミンの減少、および高周波電磁場曝露後のMPTP障害からの運動回復の困難さ。サイ・レップ(2019) 9:1201. doi: 10.1038/s41598-018-37874-z
PubMed Abstract|CrossRef Full Text|Google Scholar
34.Maaroufi K, Had-Aissouni L, Melon C, Sakly M, Abdelmelek H, Poucet B, et al. 900 MHz電磁界と鉄過剰負荷の組み合わせに曝露したラットの空間学習、モノアミンおよび酸化ストレス。Behav Brain Res. (2014) 258:80-9. doi: 10.1016/j.bbr.2013.10.016.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
35.Ji J, Zhang YH, Yang XQ, Jiang RP, Guo DM, Cui X.携帯電話からのマイクロ波放射のラット胎児脳への影響。Electromagn Biol Med. (2012) 31:57-66.
PubMed Abstract|CrossRef Full Text|Google Scholar
36.Megha K, Deshmukh PS, Ravi AK, Tripathi AK, Abegaonkar MP, Banerjee BD.ラット脳のモノアミン神経伝達物質とその重要な調節酵素に対する低強度マイクロ波放射の影響。セルバイオケムバイオフィーズ(2015)73:93-100. doi: 10.1007/s12013-015-0576-x
PubMed Abstract|CrossRefフルテキスト|Google Scholar
37.Cao Z, Zhang H, Tao Y, Liu J. Effects of microwave radiation on lipid peroxidation and the content of neurotransmitters in mice(マウスにおけるマイクロ波放射の過酸化脂質および神経伝達物質含有量への影響)。J Hygiene Res. (2000) 30:28-9.
PubMed Abstract|Google Scholar
38.Li HJ, Peng RY, Wang CZ, Qiao SM, Yong Z, Gao YB, et al. マイクロ波長期暴露後のラットにおける認知機能と 5-HT システムの変化。Physiol Behav.(2015) 140:236-46. doi: 10.1016/j.physbeh.2014.12.039
PubMed Abstract|CrossRefフルテキスト|Google Scholar
39.アハメドNA、ラドワンNM、アブールエズHS、カドローウィYA、サラマNA.幼若ラット脳の3つの異なる領域におけるアミノ酸神経伝達物質に対するパルス1800MHz電磁放射の慢性的影響。Toxicol Ind Health.(2018) 34:860-72. doi: 10.1177/0748233718798975
PubMed Abstract|CrossRef Full Text|Google Scholar
40.Zhao L, Peng RY, Wang SM, Wang LF, Gao YB, Dong J, et al. 長期マイクロ波曝露後の認知機能と海馬の構造との関係。Biomed Environ Sci. (2012) 25:182-8. doi: 10.3967/0895-3988.2012.02.009
PubMed Abstract|CrossRef Full Text|Google Scholar
41.Wang H, Tan SZ, Xu XP, Zhao L, Zhang J, Yao BW, et al. マイクロ波連続暴露後の認知機能の長期障害と NMDAR サブユニットの変化。Physiol Behav.(2017) 181:1-9. doi: 10.1016/j.physbeh.2017.08.022
PubMed Abstract|CrossRef Full Text|Google Scholar
42.Huang CT, Liu P, Wu HX, Wang JL, Wu XN.を用いた海馬におけるNMDA受容体発現の影響。Zhonghua Yu Fang Yi Xue Za Zhi.(2006) 40:21-4.
PubMed要旨|Google Scholar
43.Zhang J, Sumich A, Wang GY.携帯電話から放射される高周波電磁界の脳機能への急性影響。Bioelectromagnetics.(2017) 38:329-38. doi: 10.1002/bem.22052.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
44.Kumar M, Singh SP, Chaturvedi CM.マウスにおける慢性的な非変調マイクロ波放射は、不安様行動とうつ様行動、および脳におけるカルシウムと NO に関連した生化学的変化をもたらす。Exp Neurobiol.(2016) 25:318-27. doi: 10.5607/ja.2016.25.6.318
PubMed Abstract|CrossRefフルテキスト|Google Scholar
45.Gökçek-Saraç Ç, Akçay G, Karakurt S, Ateş K, Özen S, Derin N. Possible effects of different doses of 2. 1 GHz electromagnetic radiation on learning, and hippocampal levels of cholinergic biomarkers in Wistar rats.(異なる線量の2.1GHz電磁波が学習および海馬レベルのコリン性バイオマーカーに及ぼす影響。Electromagn Biol Med. (2021) 40:179-90. doi: 10.1080/15368378.2020.1851251.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
46.Gupta SK, Mesharam MK, Krishnamurthy S. Electromagnetic radiation 2450 MHz exposure causes cognition deficit with mitochondrial dysfunction and activation of intrinsic pathway of apoptosis in rats.(電磁波2450 MHz曝露は、ラットのミトコンドリア機能障害とアポトーシス内在経路の活性化を伴う認知障害を引き起こす)。J Biosci. (2018) 43:263-76. doi: 10.1007/s12038-018-9744-7
PubMed Abstract|CrossRef Full Text|Google Scholar
47.Kunjilwar KK, Behari J. Effect of amplitude-modulated radio frequency radiation on cholinergic system of developing rats.(発育期のラットのコリン作動性システムに対する振幅変調ラジオ周波数放射の影響)。脳研究 (1993) 601:321-4.
PubMed Abstract|CrossRef Full Text|Google Scholar
48.コンピュータの電磁波がマウスの学習・記憶能力および大脳ニューロンの伝達物質に及ぼす影響。J Radiat Res. (2010) 28:185-9.オンラインで利用可能: https://kns.cnki.net/kcms/detail/detail.aspx?
49.Kasture AS, Hummel T, Sucic S, Freissmuth M. Big Lessons from tiny flies: drosophila melanogaster as a model to explore dysfunction of dopaminergic and serotonergic neurotransmitter systems.小さなハエからの大きなレッスン:ショウジョウバエを用いたドーパミン系とセロトニン系の神経伝達システムの機能障害。Int J Mol Sci. (2018) 19:1788. doi: 10.3390/ijms19061788
PubMed Abstract|CrossRefフルテキスト|Google Scholar
50.Gilman AG, Goodman LS, Gilman A. Goodman and Gilman's The Pharmacological Basis of Therapeutics.第6版。New York:Macmillan Publishing Co.1980; 476.
PubMed Abstract|Google Scholar
51.Davis KL, Kahn RS, Ko G, Davidson M. 統合失調症におけるドーパミン:レビューと再概念化(Dopamine in schizophrenia: a review and reconceptualization).Am J Psychiatry.(1991) 148:1474-86.論文番号: 10.1176/ajp.148.11.1474
PubMed Abstract|CrossRef Full Text|Google Scholar
52.ベッドサイドからベンチへ、そして戻る。統合失調症におけるドーパミン機能不全の研究へのトランスレーショナルアプローチ。Neurosci Biobehav Rev. (2020) 110:174-9. doi: 10.1016/j.neubiorev.2018.12.003.
PubMed Abstract|クロスリファレンス全文|Google Scholar
53.シルバーバーグAB、シャーSD、ヘイモンドMW、クライヤーPE。ノルエピネフリン:ヒトにおけるホルモンおよび神経伝達物質。このような場合、「臓器移植」を行う必要があります。
PubMed Abstract|CrossRef Full Text|Google Scholar
54.Zhu ZJ, Cheng CC, Chang C, Ren GH, Zhang JB, Peng Y, et al. Broadband terahertz time-domain spectroscopy with neurotransmitter norepinephrine Characteristic fingerprint spectrum of the neutransmitter norepinephrine.Analyst.(2019) 144:2504-10. doi: 10.1039/C8AN02079E
PubMed Abstract|クロスリファレンス全文|Google Scholar
55.Charnay Y, Léger L. Brain serotonergic circuitries.この論文では、脳内セロトニン作動性神経回路について解説しています。
クロスレフフルテキスト|Google Scholar
56.Petkov VD, Konstantinova E. Effects of the ergot alkaloid elymoclavine on the level and turnover of biogenic monoamines in the rat brain(エルゴットアルカロイド、エリモクラビンのラット脳内における生体モノアミンレベルとターンオーバーへの影響).Arch Int Pharmacodyn Ther.(1986) 281:22-34.
PubMed Abstract|Google Scholar
57.Lai YF, Wang HY, Peng RY.マイクロ波放射による生物学的影響の研究における損傷モデルの確立。Mil Med Res. (2021) 8:12. doi: 10.1186/s40779-021-00303-w
PubMed Abstract|CrossRefフルテキスト|Google Scholar
58.ペレリンL、マジストレッティPJ。神経エネルギー学:空腹なニューロンを満足させるためにアストロサイトに呼びかける。Neuroscientist.(2004) 10:53-62.論文番号: 10.1177/1073858403260159
PubMed Abstract|CrossRef Full Text|Google Scholar
59.Shen J, Petersen KF, Behar KL, Brown P, Nixon TW, Mason GF, et al. in vivo 13C NMRによるヒト脳におけるグルタミン酸・グルタミン酸サイクルの速度決定.Proc Natl Acad Sci U S A. (1999) 96:8235-40. doi: 10.1073/pnas.96.14.8235
PubMed Abstract|CrossRef Full Text|Google Scholar
60.Niciu MJ, Kelmendi B, Sanacora G. Overview of glutamatergic neurotransmission in the nervous system(神経系におけるグルタミン酸神経伝達の概要)。Pharmacol Biochem Behav.(2012) 100:656-64.論文番号: 10.1016/j.pbb.2011.08.008
PubMed Abstract|CrossRef Full Text|Google Scholar
61.Rebola N, Srikumar BN, Mulle C. NMDA受容体の活動依存的なシナプス可塑性。J Physiol. (2010) 588:93-9. doi: 10.1113/jphysiol.2009.179382
PubMed Abstract|CrossRef Full Text|Google Scholar
62.Chater TE, Goda Y. The role of AMPA receptors in postsynaptic mechanisms of synaptic plasticity.Front Cell Neurosci. (2014) 27:401. doi: 10.3389/fncel.2014.00401
PubMed Abstract|クロスリファレンス全文
63.Stone E, Haario H, Lawrence JJ, A. kinetic model for the frequency dependence of cholinergic modulation at hippocampal GABAergic synapses.(海馬GABA作動性シナプスにおけるコリン作動性モジュレーションの周波数依存性に関する運動モデル)。数学バイオサイエンス. (2014) 258:162-75. doi: 10.1016/j.mbs.2014.09.013
PubMed Abstract|CrossRefフルテキスト|Google Scholar
64.ローレンス JJ.GABA放出のコリン作動性制御:新皮質と海馬の間の新たな類似性。このような場合、「神経細胞」と「神経伝達物質」の区別がつきにくくなります。
PubMed Abstract | CrossRef Full Text | Google Scholar
65.Fedotcheva NI, Sokolov AP, Kondrashova MN.酸化ストレス下のミトコンドリアにおけるコハク酸の非酵素的生成。フリーラディックバイオルメッド(2006) 41:56-64.
PubMed Abstract|CrossRef Full Text|Google Scholar
66.1.8GHz の高周波電界が思春期マウスの情動行動と空間記憶に与える影響。Int J Environ Res Public Health.(2017) 14:1344. doi: 10.3390/ijerph14111344
PubMed Abstract|CrossRefフルテキスト|Google Scholar
67.Stein V, Nicoll RA, GABA.は興奮を生み出す。Neuron.(2003) 37:375-8. doi: 10.1016/S0896-6273(03)00056-4
PubMed Abstract|CrossRef Full Text|Google Scholar
68.Li XN Yu B, Sun QT, Zhang YL, Ren M, Zhang XY, et al. Generation of a whole-brain atlas for the cholinergic system and mesoscopic projectome analysis of basal forebrain cholinergic neurons.前脳コリン作動性ニューロンの全脳アトラスの作成とメソスコピックプロジェクトーム解析。Proc Natl Acad Sci U S A. (2018) 115:415-20. doi: 10.1073/pnas.1703601115
PubMed Abstract|CrossRefフルテキスト|Google Scholar
69.Dannenberg H, Young K, Hasselmo M. Modulation of hippocampal circuits by muscarinic and nicotinic receptors(ムスカリン受容体とニコチン受容体による海馬回路の調節)。Front Neural Circuits.(2017) 13:102. doi: 10.3389/fncir.2017.00102.
PubMed Abstract|クロスリード フルテキスト
70.Hassanshahi A, Shafeie SA, Fatemi I, Hassanshahi E, Allahtavakoli M, Shabani M, et al. 雄ラットのユニモーダルおよびマルチモーダル物体認識タスクにおけるWi-Fi電磁波の影響。Neurol Sci. (2017) 38:1069-76. doi: 10.1007/s10072-017-2920-y
PubMed Abstract|CrossRefフルテキスト|Google Scholar
71.Shang Y, Filizola M. Opioid Receptor:薬理学とシグナル伝達における構造的および機構的な洞察。Eur J Pharmacol.(2015) 763:206-13. doi: 10.1016/j.ejphar.2015.05.012
PubMed Abstract|CrossRefフルテキスト|Google Scholar
72.Kirichuk VF, Ivanov AN, Kirijazi TS.急性ストレス条件下におけるアルビノラットの一酸化窒素周波数でのテラヘルツ電磁波による微小循環障害の修正。(2011) 151:288-91. doi: 10.1007/s10517-011-1311-2
PubMed Abstract|CrossRef Full Text|Google Scholar
73.携帯電話の信号が認知タスク実行中のBOLD反応に及ぼす影響。臨床神経生理学 (2012) 123:129-36.
PubMed Abstract|CrossRef Full Text|Google Scholar
74.Berger A. How does it work?陽電子放射断層撮影法(Positron Emission Tomography)。BMJ。(2003) 326:1449。
PubMed Abstract|CrossRef Full Text|Google Scholar
75.Wang GY, Kydd R, Russell BR.メタドン代替アヘン使用者における聴覚事象関連電位。J Psychopharmacol.(2015) 29:983-95. doi: 10.1177/0269881115587929
PubMed Abstract|CrossRef Full Text|Google Scholar
76.Volkow ND, Tomasi D, Wang GJ, Vaska P, Fowler JS, Telang F, et al. Cell phone radiofrequency signal exposure on brain glucose metabolism(携帯電話の高周波信号への曝露が脳の糖代謝に与える影響)。JAMA.(2011) 305:808-13. doi: 10.1001/jama.2011.186
PubMed Abstract|CrossRef Full Text|Google Scholar
77.携帯電話関連症状を持つ被験者における携帯電話曝露後の睡眠。バイオエレクトロマグネティックス。(2011) 32:4-14.
PubMed Abstract|CrossRef Full Text|Google Scholar
78.Schmid MR, Loughran SP, Regel SJ, Murbach M, Bratic Grunauer A, Rusterholz T, et al. Sleep EEG alterations: effects of different pulse-modulated radio frequency electromagnetic fields.睡眠脳波の変化:異なるパルス変調無線周波数電磁場の効果.JスリープRes.(2012)21:50-8.DOI:10.1111/j.1365-2869.2011.00918.x
PubMed Abstract|CrossRef Full Text|Google Scholar
79.Schmid MR、Murbach M、Lustenberger C、Maire M、Kuster N、Achermann P、ら睡眠脳波変化:パルス磁場対パルス変調無線周波数電磁場の効果。Jスリープ研究(2012)21:620-9.DOI:10.1111/j.1365-2869.2012.01025.x
PubMed Abstract|CrossRef Full Text|Google Scholar
80.Ghosn R, Yahia-Cherif L, Hugueville L, Ducorps A, Lemaréchal JD, Thuróczy G, et al. Radiofrequency signal affects alpha band in resting electroencephalogram.日本神経生理学会誌(1994)によると、高周波信号は安静時脳波のアルファバンドに影響を与える。J Neurophysiol. (2015) 113:2753-9. doi: 10.1152/jn.00765.2014
PubMed Abstract|CrossRefフルテキスト|Google Scholar
81.Roggeveen S, van Os J, Viechtbauer W, Lousberg R, EEG.実験的に誘発された3g携帯電話の放射線による変化。PLoS ONE.(2015) 10:e0129496. doi: 10.1371/journal.pone.0129496.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
82.Carrubba S, Frilot C. 2nd, Chesson AL Jr, Marino AA.携帯電話のパルスは誘発電位を誘発する。神経科学レッツ(2010) 469:164-8.
PubMed Abstract|CrossRef Full Text|Google Scholar
83.Carrubba S, Marino AA.低周波環境強度の電磁場が脳の電気活動に及ぼす影響:文献の批判的レビュー。エレクトロマン・バイオル・メッド(2008)27:83-101.doi: 10.1080/15368370802088758
PubMed Abstract|CrossRef Full Text|Google Scholar
84.Roggeveen S, van Os J, Lousberg R. Does the brain detect 3G mobile phone radiation peaks?実験的研究の探索的詳細分析。PLoS ONE.(2015) 10:e0125390. doi: 10.1371/journal.pone.0125390.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
85.Vecchio F, Buffo P, Sergio S, Iacoviello D, Rossini PM, Babiloni C.(ベッキオF、ブッフォP、セルジオS、イアコビエロD、ロッシーニPM、バビローニC。携帯電話の発光は、健常者におけるαリズムの事象関連非同期と認知運動能力を変調させる。臨床神経生理学 (2012) 123:121-8.
PubMed Abstract|CrossRef Full Text|Google Scholar
86.Vecchio F, Tombini M, Buffo P, Assenza G, Pellegrino G, Benvenga A, et al. Mobile phone emission increases inter-hemispheric functional coupling of electroencephalographic α rhythms in epileptic patients.2012)84:164-71.
PubMed Abstract | CrossRef Full Text | Google Scholar
87.携帯電話電磁界の精神運動への影響に関する系統的レビューとメタ分析。(2010) 67:708-16. doi: 10.1136/oem.2009.047027.
PubMed Abstract|CrossRef Full Text|Google Scholar
88.電磁界への曝露が脳内ホルモンや酵素活性に及ぼす影響に関する懐疑的なアプローチ(Warille AA, Altun G, Elamin AA, Kaplan AA, Mohamed H, Yurt KK, et al.J Microsc Ultrastruct.(2017) 5:177-84. doi: 10.1016/j.jmau.2017.09.002.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
89.Walleczek J. Electromagnetic Field Effect on cells of the immune system: the role of calcium signaling.FASEB J. (1992) 6:3177-85. doi: 10.1096/fasebj.6.13.1397839
PubMed Abstract|CrossRef Full Text|Google Scholar
90.Bauréus Koch CL, Sommarin M, Persson BR, Salford LG, Eberhardt JL.弱低周波磁場と細胞膜の相互作用。Bioelectromagnetics.(2003) 24:395-402.論文番号: 10.1002/bem.10136
PubMed Abstract|CrossRef Full Text|Google Scholar
91.ナラヤナンSN、モハパトラN、ジョンP.K N、クマールRS、ナヤックSB、バットPG。ラットの扁桃体形態、場所選好行動、脳内カスパーゼ-3活性に対する高周波電磁波曝露効果。エンバイロン・トキシコール・ファーマコル。(2018) 58:220-9. doi: 10.1016/j.etap.2018.01.009
PubMed Abstract|CrossRef Full Text|Google Scholar
92.Zhang YH, Zhan Y, Zhao TJ, Han YR, Liu H.磁場によるカルシウムチャネルの活性化における透過のメカニズム。
PubMed Abstract|CrossRef Full Text|Google Scholar
93.マウスの海馬に835MHzの高周波を慢性的に照射すると、カルビンジンとGFAPの免疫反応分布が変化する。脳研究 (2010) 1346:237-46.論文番号: 10.1016/j.brainres.2010.05.045
PubMed Abstract|CrossRef Full Text|Google Scholar
94.Papatheofanis FJ.磁気防護剤としてのカルシウムチャネル拮抗薬の使用。放射線医学 (1990) 122:24-8.
PubMed Abstract|CrossRef Full Text|Google Scholar
95.Catterall WA.電位依存性Ca2+チャネルの構造および制御。(2000) 16:521-55. doi: 10.1146/annurev.cellbio.16.1.521.
PubMed Abstract|CrossRef Full Text|Google Scholar
96.ポールML.電磁場は、電位依存性カルシウムチャネルの活性化を介して作用し、有益または有害な効果をもたらす。J Cell Mol Med. (2013) 17:958-65. doi: 10.1111/jcmm.12088
PubMed Abstract|CrossRef Full Text|Google Scholar
97.2.1GHz電磁場は、ラット心室筋細胞の収縮力と細胞内Ca2+過渡を変化させないが、一酸化窒素シグナルを介してβ-アドレナリン反応性を低下させる。Int J Radiat Biol. (2015) 91:851-7. doi: 10.3109/09553002.2015.1068462.
PubMed Abstract|CrossRef Full Text|Google Scholar
98.Wang LF, Peng RY, Hu XJ, Gao YB, Wang SM, Zhao L, et al. Abnormality of synaptic vesicular associated proteins in cerebral cortex and hippocampus after microwave exposure.大脳皮質と海馬におけるシナプス小胞関連タンパクの異常。Synapse.(2009) 63:1010-6. doi: 10.1002/syn.20684
PubMed Abstract | CrossRef Full Text | Google Scholar
99.がん誘導経路と高周波・電磁波照射。このような場合、「がんを予防する」ことが重要です。
クロスレフフルテキスト|Google Scholar
100.Wang H, Zhang J, Hu SH, Tan SZ, Zhang B, Zhou HM, et al. Real-time microwave exposure induces calcium efflux in primary hippocampal neurons and primary cardiomyocytes.マイクロ波リアルタイム照射は、海馬初代ニューロンと心筋細胞のカルシウム流出を誘発する。Biomed Environ Sci. (2018) 31:561-71. doi: 10.3967/bes2018.077
PubMed Abstract|CrossRefフルテキスト|Google Scholar
101.Adey WR, Bawin SM, Lawrence AF.覚醒猫大脳皮質からのカルシウム流出に対する微弱な振幅変調マイクロ波磁場の効果。Bioelectromagnetics.(1982) 3:295-307. doi: 10.1002/bem.2250030302
PubMed Abstract | CrossRef Full Text | Google Scholar
102.Dutta SK, Ghosh B, Blackman CF.培養中のヒトおよび他の神経芽細胞腫細胞からの高周波放射線誘発カルシウムイオン流出促進。Bioelectromagnetics.(1989) 10:197-202. doi: 10.1002/bem.2250100208.
PubMed Abstract|CrossRef Full Text|Google Scholar
103.Dutta SK, Subramoniam A, Ghosh B, Parshad R. Microwave radiation-induced calcium ion efflux from human neuroblastoma cells in culture(マイクロ波照射によるヒト神経芽腫細胞からのカルシウムイオン流出)。Bioelectromagnetics.(1984) 5:71-8. doi: 10.1002/bem.2250050108.
PubMed Abstract|CrossRef Full Text|Google Scholar
104.Pall ML Wi-Fi.は人間の健康に対する重要な脅威である。エンバイロン・レズ(2018)164:405-16. doi: 10.1016/j.envres.2018.01.035
PubMed Abstract|CrossRef Full Text|Google Scholar
105.Friedman J, Kraus S, Hauptman Y, Schiff Y, Seger R. Mechanism of short-term ERK activation by electromagnetic fields at mobile phone frequencies(携帯電話周波数の電磁界による短期的なERK活性化のメカニズム)。生化学雑誌 (2007) 405:559-68.
PubMed Abstract | CrossRef Full Text | Google Scholar
106.電磁場は生きた細胞にストレスを与える。病態生理学。(2009) 16:71-8. doi: 10.1016/j.pathophys.2009.01.006
PubMed Abstract|CrossRefフルテキスト|Google Scholar
107.Bilgici B, Akar A, Avci B, Tuncel OK.ラット脳および血清中の酸化ストレスに対する900 MHz高周波放射の影響。Electromagn Biol Med. (2013) 32:20-9. doi: 10.3109/15368378.2012.699012.
PubMed Abstract|CrossRef Full Text|Google Scholar
108.Stein Y, Udasin IG.電磁波過敏症(EHS、マイクロ波症候群) - メカニズムのレビュー。エンバイロン・リサーチ (2020) 186:109445.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
109.ナラヤナンSN、ジェッティR、ケサリKK、クマールRS、ナヤックSB、バットPG.高周波電磁波誘発性行動変化とその可能な根拠。Environ Sci Pollut Res Int. (2019) 26:30693-710. doi: 10.1007/s11356-019-06278-5.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
110.Görlach A, Bertram K, Hudecova S, Krizanova O. Calcium and ROS: A mutual interplay.レドックス・バイオロジー (2015) 6:260-71. doi: 10.1016/j.redox.2015.08.010
PubMed Abstract|CrossRefフルテキスト|Google Scholar
111.Kaltschmidt B, Widera D, Kaltschmidt C. 神経系におけるNF-kappaBを介したシグナル伝達。Biochim Biophys Acta.(2005) 1745:287-99.論文番号: 10.1016/j.bbamcr.2005.05.009
PubMed Abstract|CrossRef Full Text|Google Scholar
112.Kopitar-Jerala N. 脳の自然免疫反応、NF-Kappa Bシグナルとシスタチン.Front Mol Neurosci. (2015) 8:73. doi: 10.3389/fnmol.2015.00073.
PubMed Abstract|CrossRef Full Text|Google Scholar
113.Zuo HY, Lin T, Wang DW, Peng RY, Wang SM, Gao YB, et al. ミトコンドリア依存性カスパーゼ3経路を通じてマイクロ波曝露により誘発される神経細胞のアポトーシス。Int J Med Sci. (2014) 11:426-35. doi: 10.7150/ijms.6540
PubMed Abstract|CrossRefフルテキスト|Google Scholar
114.Zuo HY, Lin T, Wang DW, Peng RY, Wang SM, Gao YB, et al. RKIPは、マイクロ波照射によって誘発される神経細胞のアポトーシスを、MEK/ERK/CREB経路を一部介して制御している。Mol Neurobiol.(2015) 51:1520-9. doi: 10.1007/s12035-014-8831-5
PubMed Abstract|CrossRefフルテキスト|Google Scholar
115.Esmekaya MA, Ozer C, Seyhan N. 900 MHz pulse-modulated radiofrequency radiation induces oxidative stress on heart, lung, testis and liver tissues.(900MHzパルス変調高周波放射は心臓、肺、精巣、肝臓の組織に酸化ストレスを誘発する。Gen Physiol Biophys. (2011) 30:84-9.
PubMed Abstract|CrossRef Full Text|Google Scholar
116.Burlaka A, Tsybulin O, Sidorik E, Lukin S, Polishuk V, Tsehmistrenko S, et al. 低強度の高周波に曝露した胚性細胞におけるフリーラジカル種の過剰産生。Exp Oncol.(2013) 35:219-25.
PubMed Abstract|Google Scholar
117.Shahin S, Banerjee S, Swarup V, Singh SP, Chaturvedi CM.表紙から: 2. 45GHz マイクロ波放射は海馬の学習と空間記憶に影響を与える。局所ストレス機構によるiGluR/ERK/CREBシグナル伝達の抑制の関与.Toxicol Sci. (2018) 161:349-74. doi: 10.1093/toxsci/kfx221
PubMed Abstract|CrossRefフルテキスト|Google Scholar
118.Dasdag S, Akdag MZ, Kizil G, Kizil M, Cakir DU, Yokus B. Effect of 900 MHz radio frequency radiation on beta amyloid protein, protein carbonyl, and malondialdehyde in the brain.(900MHz無線周波数放射の脳内βアミロイド蛋白、蛋白カルボニル、マロンジアルデヒドへの影響)。Electromagn Biol Med.(2012)31:67-74.
PubMed Abstract|CrossRef Full Text|Google Scholar
119.Furtado-Filho OV, Borba JB, Maraschin T, Souza LM, Henriques JA, Moreira JC, et al. 950 MHz超高周波電磁波への慢性曝露が異なる年齢の若いラットの右および左大脳皮質における活性酸素種代謝に及ぼす影響.Int J Radiat Biol. (2015) 91:891-7. doi: 10.3109/09553002.2015.1083629.
PubMed Abstract|CrossRef Full Text|Google Scholar
120.Bas O, Odaci E, Kaplan S, Acer N, Ucok K, Colakoglu S. 900 MHz電磁場曝露は、成体雌ラットの海馬錐体細胞の質的および量的特徴に影響を与える。脳研究 (2009) 1265:178-85.
PubMed Abstract|CrossRef Full Text|Google Scholar
121.Sonmez OF, Odaci E, Bas O, Kaplan S. Purkinje cell number decreases in the adult female rat cerebellum following exposure to 900 MHz electromagnetic field(900MHzの電磁場に曝された成熟雌ラットの小脳におけるプルキンエ細胞数の減少)。脳は、(2010)1356:95-101。
PubMed Abstract|CrossRef Full Text|Google Scholar
122.NF-kappaB阻害細胞における磁場(60Hz、5mT)曝露によるX線誘発突然変異の増加。Biochem Biophys Res Commun.(2000) 276:238-43. doi: 10.1006/bbrc.2000.3455
PubMed Abstract|CrossRef Full Text|Google Scholar
123.Storz P. Reactive oxygen species in tumor progression(腫瘍の進行における活性酸素種)。フロントバイオサイエンス(2005) 10:1881-96.
PubMed Abstract | CrossRef Full Text | Google Scholar
124.Choi SB, Kwon MK, Chung JW, Park JS, Chung K, Kim DW.WCDMA携帯電話から放射される短期放射線の10代と成人に対する影響。BMC Public Health.(2014) 14:438. doi: 10.1186/1471-2458-14-438.
PubMed Abstract | CrossRef Full Text | Google Scholar
125.Leach V, Weller S, Redmayne M, A. novel database of bio-effects from non-ionizing radiation(非電離放射線の生体影響に関する新規データベース)。Rev Environ Health.(2018) 33:273-80. doi: 10.1515/reveh-2018-0017.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
126.Lushchak VI.フリーラジカル、活性酸素種、酸化ストレスとその分類。ケム・バイオル・インタラクト。(2014) 224:164-75. doi: 10.1016/j.cbi.2014.10.016.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
127.Liu B, Jian Z, Li Q, Li K, Wang Z, Liu L, et al. Baicalein protects human melanocytes from H2O2-induced apoptosis via inhibiting mitochondria-dependent caspase activation and the p38 MAPK pathway.バイカレインは、ミトコンドリア依存性のカスパーゼ活性化とp38 MAPK経路の阻害を介して、ヒトメラノサイトの酸化劣化を抑制する。フリーラディックバイオルメッド(2012)53:183-93。
PubMed Abstract|CrossRef Full Text|Google Scholar
128.Jing M, Li YX, Zeng JZ, Huang PC, Skirzewski M, Kljakic O, et al. in vivoコリン作動性活性をモニターするための最適化されたアセチルコリンセンサー。Nat Methods.(2020) 17:1139-46. doi:10.1038/s41592-020-0953-2
PubMed Abstract|CrossRefフルテキスト|Google Scholar
キーワード
電磁波、脳、神経伝達物質、代謝、伝達、受容体
引用元
Hu C, Zuo H and Li Y (2021) Effects of Radiofrequency Electromagnetic Radiation on Neurotransmters in the Brain.Front.Public Health 9:691880. doi: 10.3389/fpubh.2021.691880.
Received:2021年4月07日; Accepted:13 July 2021;
公開:2021年8月17日
編集者
中国第三軍医科大学・張磊(Lei Zhang)氏
レビュー執筆者
Yael Stein, Hadassah Medical Center, イスラエル
Sareesh Naduvil Narayanan, ラスアルカイマ医療健康科学大学(アラブ首長国連邦
Gui Rong Ding, 中国・第四軍事医科大学
Copyright © 2021 Hu, Zuo and Li.これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権所有者のクレジットを記載し、本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可するもので、学術的に認められた慣習に従っている。本規約に従わない使用、配布、複製は認められません。
*Correspondence:Hongyan Zuo, zuohy2005@126.com; Yang Li, leeyoung109@hotmail.com
免責事項:この記事で表明されたすべての主張は,著者のものであり,必ずしも所属組織のもの,あるいは出版社,編集者,査読者のものを代表するものではありません。この記事で評価される可能性のある製品やそのメーカーによる主張は,出版社によって保証または承認されたものではありません。
以下のものも見られています。
●数値シミュレーションによる2匹のフリーラットの1.8GHzにおける電磁波被ばく線量測定研究
https://www.frontiersin.org/articles/10.3389/fpubh.2021.721166/full
王向慧,夏成杰,盧魯,斉紅心,張潔
●900 MHz高周波磁場によるマウス骨髄幹細胞のミトコンドリア・アンフォールドタンパク質反応の誘導
https://www.frontiersin.org/articles/10.3389/fpubh.2021.724239/full
Wen Xie、Rui Xu、Caiyun Fan、Chunyu Yang、Haiyan Chen、Yi Cao
●COVID-19の時代における野菜摂取量の変化-国際市民科学プロジェクトからの最初の知見
https://www.frontiersin.org/articles/10.3389/fnut.2021.686786/full
Irmgard Jordan, Gudrun B. Keding, Lena Stosius, Iwona Hawrysz, Katarzyna Janiszewska and Eleonore A. Heil
●マイクロ波広帯域電磁波パルスに曝された各種人体の線量測定
https://www.frontiersin.org/articles/10.3389/fpubh.2021.725310/full
ジェルディサノップ・チャカロタイ、和気香奈子、藤井克己
●ワイヤレス技術はヘルスケアにおいて新たな理解とアプローチを必要とする環境ストレッサーである
https://www.frontiersin.org/articles/10.3389/fpubh.2022.986315/full
ジュリー・E・マクレデン、ナオミ・クック、スティーブン・ウェラー、ビクター・リーチ
この記事が気に入ったらサポートをしてみませんか?
