重症患者におけるβ-ラクタム系抗菌薬の目標達成率の低下とその危険因子は?
本記事は、医療従事者向けに記載をしております。また、本記事の内容は、私の所属している施設などとは一切関係がないことを併せてご承知の上、記事をご覧ください。
今回は、重症患者(=ICUに入室するような重症患者)での、抗菌薬のPK/PDパラメータの達成率低下とその低下に関わる因子は何かを前向き研究で行った報告を読みましたので、この内容について少し触れていきます。
抗菌薬は、それぞれの抗菌活性、薬物動態、薬力学的な作用の特徴などにより、それぞれ適切な投与方法や投与量、濃度等がある程度どうすれば良いかわかってきています。いわゆる、PK/PD理論です。
PK/PDのことについては、下記のリンクの内容が非常に参考になると思います。
一つ目は英語です。
2つ目は日本語の総説です
抗菌薬のうち、β-ラクタム系抗菌薬(ペニシリン系、セフェム系、カルバペネム系など)は、その特性から、時間依存性抗菌薬とされています。
PK/PDパラメータは、%T>MICと記載をされるパラメータで示されます。これは何を意味しているかといいますと、MICはMinimum Inhibitory Concentration(最小発育阻止濃度)のことで、その名のとおり、細菌の発育を阻止するための最小濃度です。%T>は、%Time aboveという記載をされることもあり、MICと組み合わせると、MICを超えている時間という意味となります。
ペニシリン系、セフェム系、カルバペネム系で%T>MICの目標値は異なると言われております。下記図は私が昔、院内勉強会用に作成したスライドから抜粋したものです。
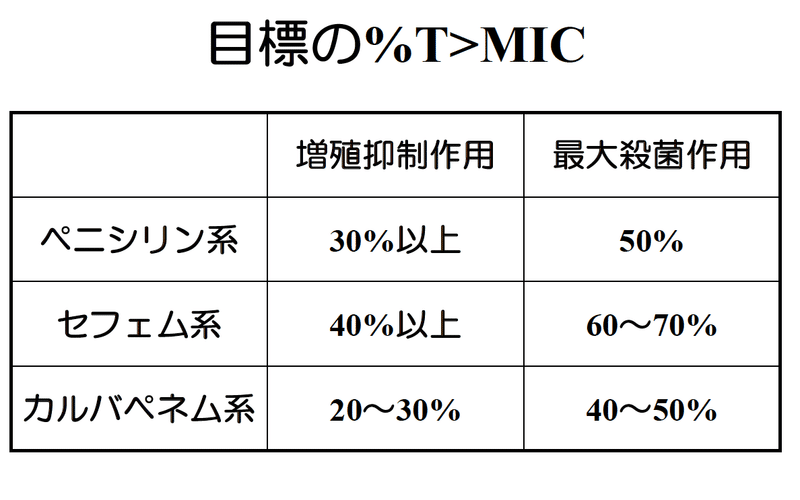
β-ラクタム系抗菌薬は、半減期の短い薬剤が多く、1〜2時間程度の薬剤が多いです。このため、1回に1日量を一気に投与すると、MICを超えている時間が非常に短くなり、効果が薄れます。
このため、β-ラクタム系の多くは(セフトリアキソンを除く)、腎機能障害がない症例では、1日3-4回投与(疾患によっては6回投与などもあり得る)を行い、分割投与を行い、抗菌薬の濃度が、MICを超える時間が長くなるように投与を行っています。
一方、重症患者では、見かけ以上に腎機能が亢進をしてしまう症例がいます。これは、ARC(Augmented Renal Clearance)と言われ、心拍出量増加・血管拡張や腎血流増加などにより過大腎クリアランスとなることが知られています。
非常にご高名な平田先生のブログに記事がありますので、そちらをみていただく方が遥かにどういうことかわかりやすいかと思います(下記リンク参照)
このため、一般的に、ICUに入室するような患者で、腎機能が保たれている場合、β-ラクタム系抗菌薬のような腎排泄型薬剤のクリアランスが増大し、血中濃度が十分に上がらないと言われています。
今回読んだ論文は、どういう条件で血中濃度が十分に上がらないのか、複数のβ-ラクタム系抗菌薬で血中濃度を測定して確認して、濃度を十分に得られない患者背景、危険因子を確認したよという内容です。
キーポイントが書いてありますが、
100%ƒT>MIC(ECOFF)の目標を達成したのは3分の2以下であり,100%ƒT>4×MIC(ECOFF)の目標を達成したのは3分の1にすぎなかった。
男性、高BMI、eGFR≧90mL/min/1.73m2は目標未達成と有意に関連しており、CRRTの使用と高血清尿素は目標達成の確率を高めた。
100% ƒT > MIC(ECOFF)回帰モデルでは、目標未達成は臨床アウトカムであるICU滞在期間と有意に関連していたが、30日生存期間には有意な関連は認められなかった。
ということです。
100%ƒT>MIC(ECOFF) などの定義は、本文を読んでいただければわかるかと思いますが、ƒT>MICは、未結合(遊離、ƒ)の血清抗菌薬の濃度がMICを超えている時間。100%ということは、規定したMICの濃度を超えている時間が100%を超えているという意味になるのではないかと思います。
こういう研究は国内でも、大学病院の薬剤師の先生が中心となりやっていただいているようです(学会や論文等をみていると)。市中の病院では、設備等も無かったりするので、実際にTDMをやるのは難しいですが、”どういう症例には十分な濃度にならない可能性があるので、増量することも考える”という概念がわかるのではないでしょうか。
では論文の内容を和訳していきます。
Failure of target attainment of beta-lactam antibiotics in critically ill patients and associated risk factors: a two-center prospective study (EXPAT)
重症患者におけるβ-ラクタム系抗菌薬の目標達成率の低下とその危険因子:2施設共同前向き研究 (EXPAT)
Abdulla, A., Dijkstra, A., Hunfeld, N.G.M. et al. Crit Care 24, 558 (2020).
https://doi.org/10.1186/s13054-020-03272-z
上記リンクから無料で論文本文を閲覧可能です(2020年9月時点)。図表などは本文をご覧になっていただく方がわかりやすいと思います。
要旨
背景
早期かつ適切な抗菌薬の投与は、重症患者の臨床転帰の改善と関連しているが、目標達成は依然として課題である。重症患者は抗菌薬曝露に強く影響する生理的変化を受けるため、従来の抗菌薬投与は重症患者には適していない。β-ラクタム系抗菌薬については,投与間隔の100%(100%ƒT>1-4×MIC)における最小阻害濃度(MIC)の1~4倍以上の未結合血漿中濃度が,細菌学的および臨床的反応を最大化するための薬力学的標的(PDT)として提案されている。本研究の目的は,重症患者におけるPDTの達成度を明らかにし,目標未達成の危険因子を明らかにすることである。
方法
この前向き観察研究は、オランダの2つのICUで実施された。β-ラクタム系抗菌薬であるアモキシシリン(クラブラン酸の有無にかかわらず)、セフォタキシム、セフタジジム、セフトリアキソン、セフロキシム、メロペネムを投与された成人患者を登録した。治療開始2日目の投与間隔内の5検体に基づき、疫学的カットオフ(ƒT > MICECOFFおよびƒT > 4×MICECOFF)を超える時間未拘束濃度を決定した。副次的エンドポイントは多変量二項回帰モデルおよび二項ロジスティック回帰モデルを用いて推定し,PDTの達成と患者特性および臨床転帰との関連を検討した。
結果
合計147患者を組み込み, そのうち63.3%が100%ƒT以上MICECOFF,36.7%が4×MICECOFF以上のPDTを達成した。回帰分析により,男性,推定糸球体濾過率(eGFR)90mL/min/1.73m2以上,高体格指数(BMI)が目標未達成の危険因子として同定された.持続的腎代替療法(CRRT)の使用と高血清尿素は目標達成の確率を有意に高めた。また,目標達成率100%>MICECOFFとICU滞在期間(LOS)との間には有意な相関が認められたが,30日生存率については有意な相関は認められなかった。
結論
従来のβラクタム投与では、重症患者の大多数では目標達成率が低い。男性、高BMI、高eGFRは目標未達成の有意な危険因子であった。これらの予測因子は、治療薬のモニタリングと合わせて、ICUの臨床医が重症患者のβラクタム投与を最適化するのに役立つ可能性がある。
Key messages
100%ƒT>MICECOFFの目標を達成したのは3分の2以下であり,100%ƒT>4×MICECOFFの目標を達成したのは3分の1にすぎなかった。
男性、高BMI、eGFR≧90mL/min/1.73m2は目標未達成と有意に関連しており、CRRTの使用と高血清尿素は目標達成の確率を高めた。
100% ƒT > MICECOFF回帰モデルでは、目標未達成は臨床アウトカムであるICU滞在期間と有意に関連していたが、30日生存期間には有意な関連は認められなかった。
Introduction
大規模な多施設共同研究では、集中治療室(ICU)に入院している患者の64~71%が抗菌薬を使用していることが報告されている [1, 2]。重症患者の重篤な感染症を適切に予防し治療するためには、患者に適切な抗菌薬の投与レジメンを用いて治療することが重要である [3,4,5]。しかし、用量確認の研究は典型的にはICU以外の患者を対象としているにすぎない。様々な研究により、重症患者に関連した病態生理学的変化(すなわち、体液状態の変化、血清アルブミン濃度の変化、腎・肝機能障害、全身性炎症反応症候群、微小血管障害)が薬物動態(PK)を大幅に変化させ、それによって抗菌薬への曝露量を変化させることが示されている[6, 7]。さらに、重症患者は、患者の年齢、病状の重症度、併存疾患、感染源、および転帰が広範囲に分布する非常に異質な集団である[8]。このような困難な状況は、β-ラクタム系抗菌薬の標準的な投与レジメンを使用する際に、重症患者に最適な曝露を達成することを困難にしている。
ベータラクタム系抗菌薬はICUの設定で最も一般的に使用されている抗菌薬の一つである。これらの抗菌薬は時間に依存して細菌を殺す作用を示す。転帰の成功は、投与間隔のうち、未結合(遊離、ƒ)の血清抗菌薬濃度が最小阻害濃度(ƒT > MIC)を超えている時間(T)の割合と関連している。これらの抗菌薬について、殺菌活性に必要なƒT > MIC値は、in vivo感染モデルでは40~70%であるが [9, 10]、臨床データでは、重篤な患者では100%のƒT > MICで最適な効果が得られることが示唆されている [10,11,12]。100% ƒT > MICを達成した患者では、臨床的治癒率と細菌学的除菌率が有意に高い [12,13,14,15]。重症患者における臨床的有効性を最大化するためには、投与間隔の100%(ƒT100%>1-4×MIC)でMICの1~4倍の未結合血漿中濃度が薬力学的標的(PDT)として同定されている[16,17,18,19]。曝露量をさらに増加させても、細菌死滅の速度または範囲を増加させることはないようである[20]。
目標達成率は、β-ラクタム系抗菌薬で治療された重症患者の40~60%に過ぎないと報告されている[21, 22]。そのため、特に従来のβ-ラクタム系抗菌薬投与レジメンが使用されている場合、高いICU目標を達成することは容易ではない。すべての重症患者におけるこのグループの抗菌薬の標準投与量を単純に増やすことは、最適な戦略ではない。なぜならば、高用量投与レジメンは過剰投与と毒性に関連したトラフレベルをもたらす可能性があるからである[23]。したがって、重症患者におけるβ-ラクタムの投与レジメンを個別化する必要があるように思われる。したがって、リスクのある患者を特定することで、臨床医はより個別化された投与レジメンと定期的な治療薬モニタリング(TDM)を検討するように促される可能性がある。
我々の知る限りでは、重症患者におけるβ-ラクタム系抗菌薬の目標達成の潜在的な予測因子として患者の特徴を定量化しようとした研究は他に数件しかない[14, 24, 25, 26, 27]。これらの研究のいくつかでは、限られた患者数および/または異なるβ-ラクタム系抗菌薬を調査したが、目標達成度と臨床転帰に関連する因子を調査したのは2件のみである[24, 27]。しかし、目標達成度と臨床アウトカムであるICU滞在期間(LOS)や死亡率との関連はまだ明らかにされていない。そこで、本研究の目的は、欧州のICUで使用頻度の高い6種類のβ-ラクタム系抗菌薬の目標達成率を調査し、目標未達成に関連する危険因子と臨床転帰を明らかにすることである。
Methods
Study design
本試験は、オランダのロッテルダムにあるErasmus大学医療センターとMaasstad病院のICU部門を対象としたプロスペクティブ、観察的、2施設間の薬物動態/薬力学(PK/PD)試験である。試験計画書(EXPAT、NL53551.078.15)はthe Erasmus MC医療倫理委員会の承認を得た。
Study population and size
2016年1月から2017年6月の間にICUに入院し、アモキシシリン(クラブリン酸の有無にかかわらず)、セフォタキシム、セフタジジム、セフトリアキソン、セフロキシム、またはメロペネムを静脈内投与した感染症(と推定される)の治療を受けたすべての患者が、本試験に含まれるかどうかを評価した。登録資格は、(1)年齢が18歳以上、(2)予想されるICU滞在時間が72時間以上、(3)試験用抗菌薬の静脈内間欠療法を受けている患者であった。抗菌薬の投与開始、投与量、治療期間は、主治医と感染症専門医による日常的な集学的コンサルテーションの中で選択した。患者は、(1)書面によるインフォームドコンセントが得られていない場合、(2)抗菌薬がサンプリング前に中止されている場合、(3)熱傷でICUに入院している場合には除外された。抗菌薬治療開始後 3 日以内の入院中の人口統計学的データ、臨床データ、検査データ、抗菌薬投与データを含む患者情報を収集した。
本研究は記述的で非比較的な設定であるため、正式なサンプルサイズの計算は必要なかった。我々のプロトコールでは、対象となる抗菌薬のうち少なくとも4つの抗菌薬については、我々の研究施設での処方データに基づいて最低20人の患者を含めることができる可能性が高いと事前に予想されていた。PDTの達成度と関連する臨床転帰の分析には、少なくとも140人のサンプルサイズが適切であると予想された [28]。
Sample collection and analysis
抗菌薬による治療開始後2日目に、投与開始前15〜30分前(トラフ濃度、Cmin)、15〜30分前(ピーク濃度、Cmax)、輸液終了後1時間後および3時間後、次の投与開始前15〜30分前(2回目のCmin)に、合計5回の静脈血液サンプルを採取した。正確なサンプリング時間および投与量を記録した。血液サンプルは、完全性を維持するために描画後直接2〜8℃で保存し、収集後24時間以内に30000rpmで6分間遠心分離した。血漿をクライオバイアルに移し、分析まで凍結保存(-80℃)した。血漿中の濃度は、多成分UPLC-MS/MS [29]を用いて決定した。この方法は、生物学的分析法の検証に関する食品医薬品局(FDA)のガイダンス[30]に従って総合的に検証された。観察されたすべての濃度は、重篤な患者におけるタンパク質結合のために、血漿タンパク質結合(PPB)の平均値を用いて補正した[31]。血漿中濃度-時間データのノンコンパートメントPK分析は、PKSolver(バージョン2.0)[32]を用いて実施した。
Primary endpoints
PK/PDの評価項目は、投与間隔(ƒT>MICおよびƒT>4×MIC)の100%(ICU目標)におけるMICを超える未結合濃度とした。ƒT>MICの割合は,MIC値の切片を濃度-時間曲線で計算することにより決定した。各抗菌薬について、推定病原体の疫学的カットオフ(ECOFF)、すなわち、欧州抗菌薬感受性試験委員会(European Committee on Antimicrobial Susceptibility Testing:EUCAST)で定義された、表現型的に検出可能な後天的耐性機構を持たない生物の最高MICを使用した[33]。
EUCAST疫学的カットオフ(MICECOFF)値として、アモキシシリン8mg/L(Enterobacterales)、セフォタキシム4mg/L(黄色ブドウ球菌)、セフタジジム8mg/L(緑膿菌), ceftriaxone 0.5 mg/L(Enterobacterales),cefuroxime 8 mg/L(Escherichia coli),meropenem 2 mg/L(Pseudomonas aeruginosa)を使用した。ƒT>MICおよびƒT>4×MICを考慮した経験的固定投与法の妥当性を評価するために,各抗菌薬の目標達成度を0.03125-128 mg/LのMIC分布で検証した。
Secondary endpoints
我々は副次的エンドポイントとして、ICU滞在期間(LOS)と治療開始(登録)からの30日生存期間を定義した。これら2つの転帰に寄与する可能性の高い因子を、臨床的関連性と以前に報告された関係 [14, 24, 25, 26, 27] に基づいて関連性を解析した。これらには、患者の特徴(年齢、性別、体格指数(BMI))、疾患重症度スコア(標的抗菌薬投与開始時のSOFAスコア)、血清アルブミン、血清尿素、敗血症、推定糸球体濾過率(eGFR≧90mL/min/1.73m2)、および継続的腎代替療法(CRRT)の有無が含まれていた。
Statistical analysis
すべての統計解析は、IBM-SPSS(バージョン24.0、IBM Corp.、ニューヨーク、ニューヨーク、米国)およびRソフトウェア(バージョン3.3.3.3、R Project for Statistical Computing)を用いて実施した。正規性は、Shapiro-Wilk検定を用いて評価した。我々は、以下の3つのステップを用いてデータを分析した。最初に、範疇変数を度数(パーセンテージ)として表現し、連続変数は、四分位間範囲(IQR; 25-75 パーセンタイル)の中央値として記述しました。カテゴリ変数の差は、Pearson カイ二乗検定またはFisherの厳密検定を用いて計算した。連続変数の比較には、Mann-Whitney U 検定を用いた。
主要アウトカムであるPDT達成について、多変量二値ロジスティック回帰分析を推定し、オッズ比(OR)と95%信頼区間(95%CI)を提示した。臨床的および関連するベースライン特性に関するすべての回帰分析をコントロールするために、多変量解析にSOFAスコアを含めることにした。
副次的転帰については、PDTの達成とICUのLOSおよび30日生存率との関連を検討するために、それぞれ多変量負の二項回帰および二項ロジスティック回帰モデルを推定した。これらの回帰については、ORと95%CIを提示した。統計的有意性はp ≤ 0.05で認められた。
Results
全体では、合計 147 例の患者が本研究に含まれ、712 例の血清サンプルが分析された。ベースラインの患者の人口統計学的および臨床的特徴を、目標達成度別に層別化してTable 1 にまとめた。患者の年齢中央値は63歳で、61%が男性であった。ICU の LOS 中央値は 9 日、30 日間の全死因死亡率は 19.7%であった。
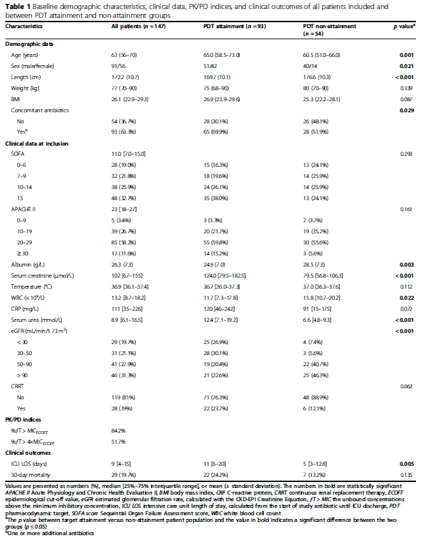
Pharmacokinetic parameters
抗菌薬ごとに観察されたアンバウンドトラフ(ƒCmin)血漿中濃度のは箱ひげ図をFigure 1に、ピーク(ƒCmax)血漿中濃度のプロットを追加ファイル1に示した。各抗菌薬の血漿中濃度には患者間で大きなばらつきが認められ,例えばセフォタキシムのƒCminは0.14~26mg/Lであった。プールされた抗菌薬の投与量およびPK/PD指標を記述した詳細なデータは、追加ファイル2に記載されている。
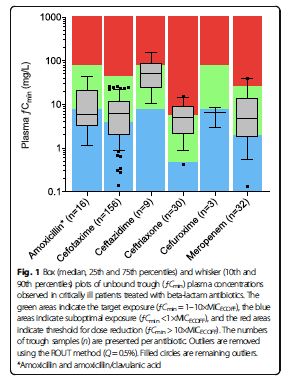
Target attainment
100% ƒT > MICECOFFおよび100% ƒT > 4×MICECOFFのPDTを達成した患者の割合は,それぞれ63.3%(93/147)および36.7%(44/147)であった(Table 1および追加ファイル2).目標を達成した患者と比較して、クレアチニンクリアランスが高く、血清アルブミンが高く、白血球数が高く、体長が高く、尿素が低い若年男性患者と、抗菌薬を併用している患者では、PDTを達成しない可能性が高かった。また,ベースライン時および2日目のeGFR≧90mL/min/1.73m2の人の45.7%(21/46例)および31%(16/51例)が,それぞれ100%ƒT>MICECOFFの目標値を達成した。全患者のうち、28人(19%)がCRRTによる治療を受けた。統計的には有意ではなかったが、CRRT治療を受けた患者数は、PDTを達成した群と達成しなかった群でそれぞれ23.7%と12.1%の臨床的に有意な差があった(p=0.06)。アモキシシリン、セフォタキシム、セフタジジム、セフトリアキソン、セフロキシム、メロペネムの100%ƒT>MICECOFF目標達成率は、それぞれ44.4%、57.0%、100%、94.1%、0%、71.4%であった(追加ファイル2)。アモキシシリン,セフォタキシム,セフロキシムでは,目標とする100%ƒT>4×MICOFFに到達する確率は25%以下であり,これらの薬剤はいずれも高いMICを有する病原体に対して十分な薬剤濃度が得られていないことが示唆された。さまざまなベータラクタム抗菌薬の目標達成と、MICの範囲(0.03125〜128 mg / L)で100%ƒT> MICおよび100%ƒT> 4×MICのPDTに到達するための投与計画を図2に示す。

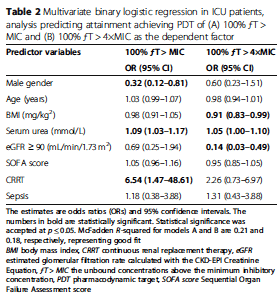
Predictors for target (non-)attainment
目標達成率の予測変数を多変量二値ロジスティック回帰で検討した(Table 2)。100%ƒT>MICECOFFの目標達成と関連する変数は、CRRT治療(OR 6.54、95%CI 1.47-48.61)と高血清尿素(OR 1.09、95%CI 1.03-1.17)であった。一方、男性の性別は、目標不達成と有意な相関が認められた(OR 0.32、95%CI 0.12-0.81)。PDT 100% ƒT > 4×MICECOFFでは、ベースラインeGFR≧90 mL/min/1.73 m2(OR 0.14、95%CI 0.03-0.49)、高BMI(OR 0.91、95%CI 0.83-0.99)の患者で目標不達成率が有意に高かった。高血清尿素は、100%ƒT>4×MIC目標達成と有意な関連性を示した(OR 1.05、95%CI 1.00-1.10)。
Predictors for clinical outcomes
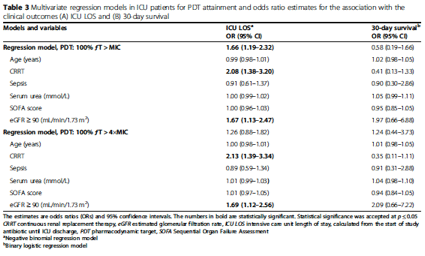
表3は、目標達成とICU LOSおよび30日生存率との関連を検討した多変量二項回帰モデルおよび二元ロジスティック回帰モデルの推定値をそれぞれ示したものである。100%ƒT>MICECOFFのPDTは臨床アウトカムであるICU LOSと有意に関連していた(OR 1.66、95%CI 1.19-2.32)。多変量モデルでは、CRRTの存在は両PDTともにICU LOSの上昇と有意に関連していた(OR、2.08 [95% CI、1.38-3.20]、OR、2.13 [95% CI、1.39-3.34])。さらに、eGFR≧90mL/min/1.73m2は、両PDTモデルにおいてICU LOSの増加と関連していた(OR、1.67[95%CI、1.13-2.47]、OR、1.69[95%CI、1.12-2.56]、それぞれ)。最後に、両モデルとも30日生存アウトカムとの有意な関連は認められなかった(OR、0.56 [95% CI、0.19-1.66]、OR、1.24 [95% CI、0.44-3.73]、それぞれ)。
Discussion
本研究では,使用頻度の高い6種類のβ-ラクタム系抗菌薬の詳細な目標達成度と,重症患者における目標未達成の危険因子について検討した。本研究で解析したβ-ラクタム系抗菌薬のPK/PD目標達成率には大きなばらつきがあり(Figure 1),β-ラクタム系抗菌薬の100%ƒT>MICECOFFの目標達成率は63.3%であった。本研究では,男性,高BMI,高eGFRを目標未達成のリスク因子として同定した。また,目標達成率100%>MICECOFFとICU LOSとの間には有意な相関が認められたが,30日生存率には有意な相関は認められなかった。
Robertsらは、最も保守的なβ-ラクタム曝露目標である50% ƒT > MICを達成できなかった重症患者は、臨床的転帰(抗菌薬治療の変更や追加なしに治療コースを終了したと定義される)が32%減少したことを明らかにした[21]。さらに、臨床転帰陽性と100%ƒT>MIC比の増加との間には関連性があることも明らかにした(OR 1.53、p = 0.03)[21]。重症患者は最適以下の投与量に脆弱であり、抗菌薬に対する耐性菌の選択の源となることを考慮して、我々は100%ƒT>4×MICECOFFの目標達成確率も評価した[34,35,36]。我々の研究では、100%ƒT > 4×MICECOFFの目標が達成されたのは36.7%の患者のみであった。
重症患者への抗菌薬投与では,末梢臓器障害,体液状態の変動,薬物相互作用などを考慮した薬剤の投与が必要である。しかし、本研究の結果は、重症患者におけるβ-ラクタム療法の目標達成は、抗菌薬の投与開始前にベッドサイドで予測できることを示唆している。多変量解析では、目標不達成のオッズの増加と関連する予測変数は、男性の性別とeGFRであった(Table 2)。β-ラクタム系抗菌薬で治療された重症患者におけるこれらの関連性は、先行研究[25,26,27]と一致している。
薬物曝露に対する性別の効果は、平均的に男性の方が分布量(血漿量および細胞内/細胞外水分)が多く、薬物クリアランスが高いという事実によって説明できる[37]。性別は目標不達成のリスク因子モデルに実装しやすいが、今後の研究は、性別の違いの基本的なメカニズムと臨床管理への意味合いをよりよく理解するために、このトピックに主眼を置いて設計されるべきである[37]。
本研究では、100%ƒT>4×MICの目標不達成の確率は、包含時のeGFR≧90 mL/min/1.73 m2(OR 0.14, 95% CI 0.03-0.49)と有意に関連していた。血清クレアチニンで計算されたeGFRは、腎クリアランスの最良の代替指標である。eGFR≧90mL/min/1.73m2の人は31.3%であったが、非達成群では46.3%であった(Table 2)。つまり、「正常」または腎機能が上昇していると推定される患者は、目標未達成のリスクがあり、適切な投与量の調整ができるように早期に発見する必要があるということです。さらに、ImaniらはROC曲線を用いて目標非達成の独立した予測因子としてのeGFRの性能を評価し、71.5 mL/min/1.73 m2以上のeGFR閾値は、感度が77%、特異度が65%であることを発見した[26]。β-ラクタム系抗菌薬は主に腎臓で排泄されるため、拡張腎クリアランス(ARC)で観察されるような高い腎機能(eGFR≧130mL/min)は、最適でないPK/PD目標達成にさらに寄与している。ARCはICUでの最初の1週間に30~65%の患者で観察されており[14, 38, 39]、年齢と男性の両方がARCと独立して関連している[39]。さらに、ARCは1つ以上の検出不能なトラフ濃度の強力な予測因子である[OR 3.3, 95% CI 1.11-9.94] [14]。Carriéらは、eGFR≧170mL/minがT<4×MICと有意に関連していることを報告した[OR 10.1;(2.4-41.6); p = 0.001][24]。利用可能なeGFRを用いてARC患者の目標不達成リスクを迅速に予測する能力は、臨床的にかなりの価値がある。
さらに、多変量解析では、目標達成度とCRRT治療との間に強い有意な関連が認められた。我々の知る限りでは、多変量解析でこのような関連性が示された唯一の研究である。β-ラクタムは主に腎からの排泄を介して排泄されることを考えれば、驚くべきことではない。同時に、これらの患者は、排泄が減少しているため、過剰曝露や毒性のリスクがあるかもしれない。しかし、CRRTによる治療中のβ-ラクタム濃度を予測することは困難であり、分布量と総薬物クリアランスの両方が影響を受け、重症時には両方のパラメータが大きく乱される可能性がある。さらに、目標達成に対するCRRTの効果は、例えば膜の種類、装置の設定、強度などによって予測できないほど影響を受ける可能性があることを認識することが重要である[40]。
重症患者の臨床転帰に関連する予測変数に関するエビデンスはまだ限られている。Huttnerらは、ARCが検出不能なβ-ラクタム系抗菌薬のトラフ濃度と関連していることを発見したが、ARCまたは低β-ラクタム系抗菌薬のトラフ濃度と臨床不全との関連を示すことはできなかった[14]。対照的に、Carriéらは、β-ラクタムの過少曝露は、敗血症の重篤な患者における治療失敗の高率と関連していると報告している[24]。我々の集団では、100% ƒT > MICECOFF PDTモデルが臨床転帰であるICU LOSと有意な関連を示した。この転帰との関連は新しい知見である。興味深いことに、100% ƒT > MICが達成されると、ICUのLOSは増加する。これは両群の入院日数中央値の有意差にも反映されている(Table 1)。目標達成度とICUのLOSとの関連を説明するために、我々の集団の中で高齢者や最も病気の多い患者がICUに長く滞在しているという事実が考えられる。これらの患者は比較的末梢臓器機能(腎クリアランスを含む)が悪いため、曝露量が多く、オンターゲット性 (目標達成という意味?)が高い。死亡した患者は、予測LOSモデルの結果に影響を与えた可能性がある。そのため、非生存者(データは未提示)を除外しながら二項回帰モデルも実施した。しかし、これは両方のPDTモデルで見つかった有意な変数には影響を与えなかった。さらに、両PDTモデルにおいて、CRRTはより高いICU LOSと有意に関連していた。さらに、eGFR≧90 mL/min/1.73 m2は、両PDTモデルにおいてICU LOSの増加と独立した説得力のある関連性を示した(Table 3)。抗菌薬治療中にCRRTを受けている患者(n = 28)は、この解析から除外されなかったことに留意すべきである。しかし、CRRT患者を除外した場合、eGFR≧90mL/min/1.73m2は依然として独立してICU LOSの増加と関連していた(データは示されていない)。腎クリアランスの増加とARCは重症患者では非常に一般的であるが、実際には、臨床医はこれを危険因子として扱わず、標準的なβラクタム投与量を処方することがある。実際、重症患者の複雑で動的な性質と薬物動態反応の不均一性により、臨床変数とβラクタム系抗菌薬の目標不達成のリスクの計算値との関連付けは、支援ツールなしでは適用が困難である。
治療薬モニタリング(TDM)は、適切な共変数を持つ集団PKモデルと組み合わせることで、重症患者の複雑なPKを解釈し、事前に定義された目標を改善するための個々の投与量の最適化をサポートするために使用することができます[41,42,43]。しかし、ガイドラインの欠如、長いターンアラウンドタイム、およびβ-ラクタムTDMサービスへのアクセスが限られていることが、実施への潜在的な障壁となっている[44]。より一般的に使用されているクロマトグラフィー法よりもイムノアッセイ法を用いた当日の抗菌薬投与量の適応を伴うルーチンTDMは、ルーチンの臨床現場でのこれらの障壁を克服することに貢献する可能性がある[45]。しかし、重症患者の臨床転帰に対するβ-ラクタム系抗菌薬のTDMの効果を調査した大規模無作為化試験が待たれている[46]が、この戦略を用いた場合の患者の予後への臨床的影響はまだ十分には示されていない。抗菌薬を投与されている重症患者の約60~65%にしか目標達成率が認められておらず、世界的に抗菌薬に対する耐性が高まっていることを考慮すると、TDMが利用できない場合には、これらの患者への高用量投与がより良い目標達成率を得るための代替戦略となる可能性がある。Carrieらは、ARCの重症患者において、β-ラクタム系抗菌薬の認可された投与量よりも多い投与レジメンが安全であり、治療失敗率の低下に効果的である可能性があることを示した[47]。さらに、Imaniらは、抗菌薬の1日投与量が製品情報の推奨量の1.5倍以上であれば、目標達成度が高いことを明らかにしている[26]。薬物の蓄積による毒性の懸念はあるが、β-ラクタム系抗菌薬の毒性閾値が高いことを考えると、その懸念はあまり適切ではない[23]。しかし、過度に高い血清レベルに関連した重篤な副作用が最近報告されており、これは重篤な患者におけるTDMの潜在的な付加価値をさらに強調している[48,49,50,51]。さらに、β-ラクタム系抗菌薬の高(ピーク)血清レベルを回避するために、目標達成度を最大化するための代替投与戦略として、長時間または継続的な輸液があり、重症患者の臨床転帰を改善する可能性がある [52]。
今回の研究では、注意すべき点がいくつか制限されている。まず、文献に基づいてタンパク質の結合を補正した総薬物濃度を測定した。重症患者においては、これらの患者の疾患特性のために、結合した薬剤と結合していない薬剤の比率が変化することがあるので、結合していない薬剤の濃度を測定することが望ましい。しかし、セフトリアキソンを除いて、本研究のほとんどの抗菌薬のタンパク質結合は低すぎて、例えば、血清アルブミンの減少によって臨床的に影響を受けることができない。さらに、我々は、重症患者の別のコホートにおけるセフトリアキソンの未結合濃度を分析した[46]が、平均PPB値を用いて未結合分画を計算することの臨床的実現可能性を支持した。0.05~40mg/Lの範囲のセフトリアキソン未結合血漿中濃度(n = 34)の平均画分率は12.3%[IQR 8.5~20](未発表の観察)であり、これは本研究で使用した計算された未結合濃度および以前に発表されたデータ[31]に匹敵するものであった。次に、目標達成度を算出するために、人口推計値(ECOFF値)からMIC値を仮定した。このようなアプローチにより、本研究では目標達成度が過小評価されている可能性がある。さらに、1回のMIC測定で得られた測定済みのMICを使用することは議論の余地がある。なぜなら、日常の臨床検査では、MIC試験に内在する定量のばらつきや、あらゆるMIC測定におけるばらつきのために、十分な精度でMICを決定することができないからである[53]。ECOFFは臨床ブレイクポイントと似たような状況が多いとはいえ、局所薬剤耐性の疫学に対してPK/PDターゲットを綿密に評価することが重要であることに変わりはありません。第三に、24時間採尿に基づく尿中クレアチニンの直接測定はできませんでした。重症患者には有効ではないCKD-EPIクレアチニン式を用いて血清クレアチニンクリアランスを推定した。しかし、eGFR≧90mL/min/1.73m2の試験集団は、尿中クレアチニンで計算した場合、実際には腎機能に障害があったとは考えにくい。したがって、クレアチニンクリアランスの誤分類の可能性は、我々の主要な観察を無効にしなかったと仮定した。第四に、我々の回帰モデルでは、ベースライン特性と目標達成度は、試験期間中の2つの時点で、それぞれ包含時とサンプリング日に測定されていることを認識している。しかし、患者のベースライン特性を反映したいくつかの対照変数を含めることが重要である。最後に、研究集団において、セファロスポリン、特にセフォタキシムは、他のクラスのβラクタム系抗菌薬と比較して過剰に存在していた。このように、この文脈における異なる抗菌薬の目標達成度と関連するリスク因子は、より具体的な研究によって決定されるべきである。
Conclusions
本研究では、重症患者におけるβ-ラクタム抗菌薬の投与をサポートするために、PDT達成度データと目標未達成に関連する危険因子を追加で提供している。従来のβ-ラクタム系抗菌薬の投与では、目標達成率が低く、100%ƒT>MICECOFF目標を達成した人は3分の2以下、100%ƒT>4×MICECOFF目標を達成した人は3分の1に過ぎなかった。重症患者におけるβ-ラクタム系抗菌薬による治療中の目標達成度は、予測変数を用いてベッドサイドで予測することができる。腎機能が明らかに正常または亢進している男性患者とCRRTの使用は、β-ラクタム系抗菌薬曝露の強力な予測因子であった。我々のデータは、eGFRが90 mL/min/1.73 m2以上の患者は、目標未達成のリスクがあり、これはICUのLOSの増加と関連していることを示唆している。これらのデータをもとに、重症患者のβラクタム治療の初期段階では、上記の危険因子に基づいて選択的にTDMを適用することを推奨する。これらの患者がより個別化された投与レジメンの恩恵を受けるかどうかは、ランダム化比較試験によって評価されるべきである。
よろしければサポートお願いします。 サポートいただいた費用で、論文の取り寄せ等に使わせていただき、記事を充実させていきます。
