個々の患者におけるバンコマイシンの到達を最適化するための革新的なアプローチ
先日、米国で公表された、VCMのTDMガイドラインの改訂に関する内容を記事にしたところです。
その記事は下記リンクをご参照ください(是非見てください)
2009年に公表された、トラフ値を指標とするガイドラインの歪みというか、問題点というか、そういったところを払拭するためのようなガイドラインの改訂でした。改訂では、トラフ値を代替指標としては使用せず、何らかの方法を用いて、AUCを算出して、AUC>400-600を目指しなさいという内容にシフトしています。
AUCは1ポイント採血では、ベイジアン法に基づくソフトによる解析で算出する方法が国内では一般的(某メーカーが提供しているソフトにはAUCの算出が実装されています)です。ソフトがなければ、2ポイント採血し、計算式を用いて算出は可能ですが、計算式が複雑です。この場合は、計算式を組み込んだ様式 (エクセルなどで)を作成し、自動で計算するようにしないと実業務を行いながらでは困難なのではないでしょうか?(誰がその式を組み込んだ様式を作成する問題がありますが・・・)
今回のガイドラインの改訂まで、10年以上が経過している訳です。実はその間に、トラフのみの評価で有効性を評価するのは難しい、腎機能障害の問題があるということが明らかになってきていたようです。
そんな中で書かれた総説を今回読んだので、和訳しています。
概ね、ガイドラインで記載されていることを述べられていますね。
今後、実臨床で、AUC算出のアプローチを日本化学療法学会が公表するガイドラインが出た段階でこぞって方法を各施設が変更していくと思いますが、その際は、学会が提供するソフトの恩恵をうけることでしょう(某九州にある大学病院の有名な先生が作成しています).
では、総説の中身を見ていきます。
Innovative approaches to optimizing the delivery of vancomycin in individual patients
個々の患者におけるバンコマイシンの到達を最適化するための革新的なアプローチ
Pai MP, Neely M, Rodvold KA, Lodise TP. Innovative approaches to optimizing the delivery of vancomycin in individual patients. Adv Drug Deliv Rev. 2014;77:50-57. doi:10.1016/j.addr.2014.05.016
本文は下記リンクから見れます。
図表はできる限り貼り付けていますが、リンクから見ていただく方が良いと思います。
抄録
個別化された抗菌薬治療の到達は、侵襲性感染症の患者の治療において重要な要素である。バンコマイシンは、メチシリン耐性黄色ブドウ球菌による感染症のために選択される薬剤であり、最適な治療を行うためには、治療薬モニタリング(TDM)の使用が必要である。バンコマイシンの TDM に関する現在のガイダンスには、微量希釈法による AUC と最小阻害濃度(MIC)の比(AUC/MICBMD)≧400 を達成するための代替指標としてのトラフ濃度の測定が含まれています。トラフのみのモニタリングは臨床現場に広く取り入れられているが、測定されたトラフ濃度と実際の AUC 値との間には個人差が大きい。AUCとトラフ値の間の治療上の不一致は、感受性の低い病原体による感染症の患者の転帰を最適化することにつながり、あるいは他の患者の急性腎障害(AKI)の可能性を不必要に高めることになりかねない。最適な効果と最小のAKIのためのバンコマイシンのAUC範囲が狭くなる可能性があることを考えると、臨床家は限られた薬物動態(PK)サンプリングで正確にAUCを予測する「リアルタイム」システムを必要としている。この記事では、1つまたは2つの薬物濃度に基づいて臨床現場でバンコマイシンのAUCを計算するための2つの革新的なアプローチをレビューする。そのようなアプローチの1つは、最小限のPKサンプリングで「真の」バンコマイシンAUC値を推定し、ベッドサイドでAUCガイド付きの投与推奨を提供するためのベイズコンピュータソフトウェアプログラムの使用を含む。もう一つの方法は、AUC値を推定するために2つの濃度(ピークとトラフ)と単純な分析式を使用することです。どちらのアプローチも、現在のトラフのみの濃度モニタリング方法に比べてかなりの改善が見られる。
1. Introduction
バンコマイシンは、世界で最も普及している多剤耐性菌であるメチシリン耐性黄色ブドウ球菌(MRSA)による侵襲的な感染症発症患者に対する治療の要である[1]。MRSAの発生率の上昇は、バンコマイシンの使用量の大幅な増加と一致している。米国だけでも、年間2000万days以上のバンコマイシンが使用されている[2]。半世紀以上前にバンコマイシンが導入されたにもかかわらず、バンコマイシンの最適な投与戦略はまだ定義されていない。現代のバンコマイシン投与法は、MRSAによる重篤な感染症に対して、曲線下面積(AUC)対最小阻害濃度(MIC)(AUC/MIC)比が400以上になるように設計されている [3], [4]。AUC/MIC比≧400は、微量希釈法(AUC/MICBMD)で決定されたMICに基づくバンコマイシン曝露目標であるが、AUCの計算が困難であることが認識されているため、臨床現場ではAUCは日常的に計算されていない[3], [4]。歴史的には、臨床医は複数の薬物動態(PK)サンプルを収集し、線形台形ルールを適用して特定の患者のAUCを決定しなければいけなかった[5]。バンコマイシンのAUC値を「リアルタイム」で決定することの難しさを認識していたため、専門家ガイドライン委員会は、MRSAによる重篤な感染症のAUC/MICBMD比≧400の代替指標として、バンコマイシンのトラフ濃度を15~20mg/Lの間に維持することを推奨するようになった[3], [4]。この推奨事項は広く臨床現場に取り入れられている。しかし、バンコマイシンのトラフ値を高く維持することの臨床的利益は十分に説明されていない[6], [7], [8], [9], [10], [11]。さらに、15mg/Lを超えるトラフ値を達成するためにバンコマイシンを集中的に間欠投与するレジメンは、急性腎障害(AKI)率の増加と関連している可能性があるという証拠が出てきている [12]。
トラフ濃度のモニタリングは、ほとんどの実践環境では比較的簡単であるが、測定されたトラフ濃度と実際の AUC 値との間には高い個人間ばらつきがある [13], [14]。AUCとトラフ値の間の数学的な不一致は驚くべきことではなく、文献[13]によく記述されている。簡単に言えば、AUCは定義された期間(例えば、0-24時間)の累積曝露量を反映している。対照的に、トラフは投与間隔の終了時の一点曝露の測定値である。いくつかの共変量(複数可)およびパラメータの仮定を組み込まずに、投与間隔の終了時の単一の測定が全体の濃度-時間プロファイルを代表すると期待することは不合理である [13], [14]。AUCとトラフ値の間のこの不一致は、臨床の実践に明確な意味を持つ。15~20mg/Lのトラフ値は、バンコマイシンのMIC値が1mg/Lを超えるMRSAによる感染症患者における最適なAUC/MICBMD曝露を保証するものではない。逆に、15~20 mg/Lのトラフ値は、AKIのリスクの増加と関連しているAUC値につながる可能性がある。
バンコマイシンのトラフ濃度とAUCとの間に治療上の不一致があることから、実際にAUCを計算することへの関心が新たに高まっている。AKIの可能性を最小限に抑えながら有効性の確率を測定するためのAUCとトラフのみのモニタリングの明確な利点にもかかわらず、臨床医はトラフのみのモニタリングから離れることにかなりの消極的な姿勢を示している。線形台形式によるAUCの算出は比較的簡単であるが [5] 、臨床現場では1回の投与間隔で複数のレベルを収集するのは面倒であることが多い。この問題に対処するために、我々のグループは最近、1つまたは2つの抗菌薬濃度のみを用いて低バイアスで高精度なAUC値を推定するための2つの簡略化されたアプローチを同定した[14], [15]。本論文では、バンコマイシンの薬物動態/薬力学(PK/PD)プロファイルに関する現代的な理解をレビューし、1つまたは2つのサンプルに基づいて臨床現場でのAUCを計算するための2つの革新的な方法を説明する。また、将来の患者におけるバンコマイシンのデリバリーを改善するために必要な追加情報についても議論する。
2. Pharmacodynamic profile of the “15–20 mg/L” target serum vancomycin concentration
バンコマイシンのPK/PDプロファイルに関する我々の現在の理解は、米国感染症学会、感染症薬剤師会、および米国健康システム薬剤師会による2009年のコンセンサスレビューに最もよく要約されている[4]。彼らの声明は、バンコマイシンの投与とモニタリングに関する最初の全国的なエビデンスに基づいた勧告のセットを表している。バンコマイシンには様々なPK/PDターゲットが提案されているが、専門家らはAUC/MICBMD比が利用可能な最良のデータに基づいたバンコマイシンの有効性の最適な予測因子であると結論付けている[4]。動物モデル、in vitro試験、および限られたヒト試験から得られたデータを総合すると、バンコマイシンのAUC/MICBMD比が400を超えると微生物学的成功が最適化されることが示唆されている[3], [4], [16], [17], [18], [19]と専門家は提案した。
臨床現場では、AUCを決定し、その後AUC/MICBMD比を計算するために複数のバンコマイシン血清濃度を取得することは困難であるため、専門家のガイドラインでは、AUCの代替マーカーとしてトラフ血清濃度のモニタリングを推奨している[3], [4]。専門家ガイドラインの結論は以下の通りである。"菌血症、心内膜炎、骨髄炎、髄膜炎、S. aureusによる院内肺炎などの複雑な感染症では、移行性を改善し、最適な血清バンコマイシン濃度が得られる確率を高め、臨床転帰を改善する可能性があることから、血清バンコマイシンの総トラフ濃度は15~20mg/Lが推奨される” [3], [4]。
その後、バンコマイシンのトラフ値を高く維持することの臨床上の利点は、臨床現場で広く取り入れられているにもかかわらず、十分に説明されていなかった。今日までに、バンコマイシンのトラフ値と臨床転帰との関係を評価した7件の研究が発表されている[6]、[7]、[8]、[9]、[10]、[11]、[20]。この関係を検討した7件の研究のうち6件では、臨床的成功とバンコマイシンのトラフ値との関連は認められなかった[6], [7], [8], [9], [10], [11]。Kullarらによる7件目の研究では、バンコマイシンのトラフ値が15mg/L未満の患者(58~66%)では、トラフ値が15~20mg/Lの患者(40%)と比較して、バンコマイシンの失敗(菌血症の持続期間、再発、死亡率を含む複合エンドポイント)が高いことが示された。しかし、トラフ連続体の上端では、バンコマイシンのトラフ濃度が20mg/Lを超える患者では、治療の失敗が再び増加した[20]。
PK/PD の観点から、バンコマイシンの血清トラフ濃度 15~20 mg/L の範囲を支持する臨床データが少ないことは驚くに値しない。現在の臨床検査基準協会(CLSI)および食品医薬品局(FDA)のS. aureusに対するバンコマイシンの感受性のブレークポイントは2 mg/L以下である [21], [22]。しかし、バンコマイシンのトラフ濃度を 15~20 mg/L の間に維持することで、バンコマイシンの MIC 値が 1 mg/L 以下の S. aureus 分離株に対して AUC/MICBMD 比 > 400 を達成する可能性が高い(90%以上)ことが保証されているだけである [13], [23]。腎機能の程度の異なる患者のバンコマイシンのPKデータを用いて、MIC値が2 mg/LのS. aureus分離株に対して、トラフバンコマイシン濃度が15~20 mg/wの場合、AUC/MICBMD比>400を達成する確率は最適ではなく、1日の総投与量の関数であることを明らかにした(図1)[13][23]。一方,MIC値が1 mg/L以下の場合,AUC/MICBMDが400を超える確率は100%であった(図1)。さらなる検討が必要であるが,これらのデータは,トラフバンコマイシン濃度を15~20 mg/Lに維持するという現在の投与方法では,抗菌薬感受性範囲の上限(例えば,1.5~2 mg/L)の微量微希釈法による野生型MIC値を有するMRSAによる感染症に対して成功する確率が低いことを示唆している。
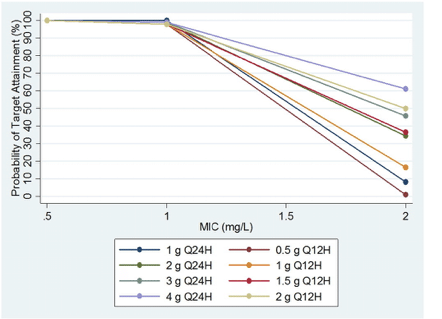
Fig. 1. Probability of achieving an AUC/MIC ratio ≥ 400 for vancomycin dosing regimens of varying intensity when trough vancomycin concentrations are between 15 and 20 mg/L.
3. Mathematical relationship between trough and AUC
前述したように、トラフは、投与間隔の終了時の 1 回の曝露点の推定値である。バンコマイシンおよびほとんどの薬剤では、次の投与直前のトラフ濃度は、投与間隔で観察される最低濃度である。そのため、トラフ濃度が 15~20 mg/L の場合の 24 時間 AUC 値(AUC24)は、ほぼ常に 400 mg∗L/h を超える AUC24 となる。例えば、バンコマイシンのトラフ濃度を 17.5 mg/L に維持すると、AUC24>420 mg∗L/h(17.5 mg/L × 24 時間)となる。したがって、バンコマイシンのトラフ濃度が15~20mg/Lの場合、MICが1mg/L以下の場合、AUC/MICBMD比≧400を達成する確率は常に100%となる。しかし、トラフ濃度が15~20 mg/Lであれば、少なくとも400 mg∗L/h以上のAUC値が得られるが、AUC値の上限範囲にはかなりのばらつきがある。このことは、確立された母集団PKモデルを用いて、バンコマイシンの濃度-時間プロファイルのモンテカルロシミュレーション(n=5000)を行った結果からも明らかになった[13]、[24]、[25]。3回目投与後のトラフ濃度とAUC24(図2)の関係をみると、トラフ濃度はAUCの個人間変動の約50%以上を説明しない(R2 = 0.409)。したがって,MIC値が1 mg/Lを超えるS. aureus分離株のAUC/MICBMD比≧400を達成するためには,バンコマイシンの「15~20 mg/L」のトラフ濃度範囲だけに頼ることはできない。
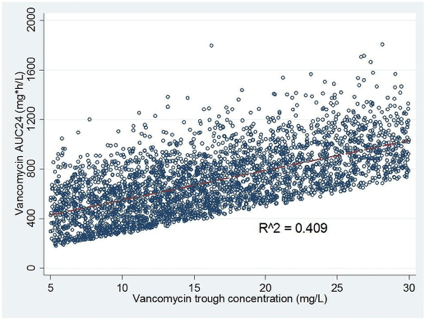
Fig. 2. Scatter and linear fit plot of vancomycin area under the curve over 24 h (AUC24) versus trough vancomycin concentration from 5000 subject Monte Carlo simulation.
4. Concerns of acute kidney injury with trough vancomycin concentrations of 15–20 mg/L
ベッドサイドでのAUC値の推定には消極的であるため、バンコマイシン血清トラフ濃度の15~20mg/Lの範囲を支持するデータが限られていることから、臨床現場ではさらに高いトラフ値を維持する必要があるのかという疑問が生じている。薬物療法を評価する際には、考慮すべきことが2つある。第一に、薬物は有効でなければならない。第二に、薬物は無毒でなければならない。20mg/Lを超えるトラフ濃度を維持すれば、MIC値が1mg/Lを超えるS aureus分離株に対してAUC/MICBMD比>400を達成する確率は高くなるが、バンコマイシン関連の毒性のリスクを患者に負わせなければ、これは不可能かもしれない。最も顕著なのは、AKIである[6],[7],[8]、[9]、[11]、[19]、[20]、[26]、[27、[28]、[29]、[30]、[31]、[32]、[33]、[34]、[35], [36], [37], [38], [39], [40], [41], [42], [43], [44], [45], [46], [47], [48], [49], [50], [51], [52], [53], [54], [55]。 腎毒性は、長年バンコマイシンの投与に関連した、まだ非常に議論されている副作用である[56], [57]。今日までに、14の研究 [6], [7], [8], [9], [11], [20], [22], [26], [27], [30], [32], [33], [34], [36], [47] が、臨床現場でバンコマイシンのトラフ濃度を低いトラフ濃度(<15mg/L)に比べて高い(>15mg/L)に維持することによるAKIの可能性を比較的に評価しており、これらの研究の結果は、Van Halらによる系統的な文献レビューによく要約されています。[12]. 全体的に、トラフ濃度を15 mg/Lを超えて維持すると、トラフ濃度<15 mg/Lと比較して腎毒性イベントのリスクが大幅に増加することが判明しました(OR 2.74; 95% CI 1.94-3.88、p < 0.01)。腎毒性イベントの確率はまた、治療期間の関数として増加することが発見され、ほとんどのエピソードは治療の7日後に発生した [12]。これらのデータをまとめると、最近の専門家ガイドライン[3]、[4]で推奨されているバンコマイシン血清トラフ濃度の遵守は、バンコマイシン誘発性AKIのリスクを高める結果となる可能性があることを強く示唆している。
上述のように、測定されたトラフ濃度と実際のAUC値との間には高い個人間ばらつきがある[13]。したがって、与えられたトラフ濃度に関連するAUC値の範囲が広いため、それに関連するAKIの程度を推定することは困難である。AUCとAKIの確率との関係を定量化する試みは文献に限られている [32], [58]。データは乏しいが、700-1300 mg h/LのAUC範囲は、腎毒性のリスクを増加させることが示唆されている[14]、[32]、[58]、[59]。Suzukiらは [58]、最近の症例対照研究で nephrotoxic および非 nephrotoxic であった患者の平均バンコマイシン AUC を比較しました。nephrotoxic グループのほとんどの患者には、非 nephrotoxic のままの患者は 400 と 600 mg∗h/L の間にあったが、600 と 800 mg∗h/L の間の AUC24 値があった(p = 0.014)。我々のグループも最近、バンコマイシンを投与されている入院患者のAUCとAKIの発生との関係を検討した[32]。Suzukiら[58]とは対照的に、AUCが1300 mg∗h/L以上の患者では、それ以下の患者に比べてAKIの発生確率が2.5倍(30.8%対13.1%、p=0.02)に増加することが示された[32]。興味深いことに、AUCが1300mg∗h/Lを超えるとAKIの大幅な増加と関連していたが、AUC曝露と反応性の関係が存在していた(図3)[59]。特に、腎毒性イベントの発生確率は、AUCと患者の体重の関数として増加した[59]。これらの限られたデータをまとめると、バンコマイシン誘発性AKIは連続的に発生し、特定の集団が特定のリスクにさらされている可能性があることを示唆している。
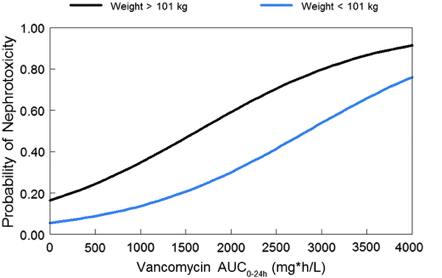
Fig. 3. Probability of nephrotoxicity versus vancomycin area under the curve from time 0 to 24 h (AUC0–24) by body weight breakpoint.
5. Innovative AUC-guided approaches to individualizing vancomycin delivery
有効性のデータとAKIの所見を組み合わせると、トラフのみのモニタリングではバンコマイシンの投与を導くには十分ではなく、AUCを考慮した投与が必要であることが示唆されている[13]。最近まで、AUCの決定には、複数のPKサンプルを収集し、線形台形式でAUCを計算する必要があった。このアプローチに関連する実用的な難しさを認識し、我々のグループは最近、1つまたは2つの血清抗菌薬濃度のみを使用して、実際に低バイアスで高精度なAUC値を推定する2つの簡略化された方法を発見した[14], [15]。1つのアプローチでは、母集団モデルとベイズソフトウェアプログラムを使用して、1つのバンコマイシントラフ濃度の収集に基づいてバンコマイシンの達成を最適化する [14]。もう一つのアプローチは、AUC値を推定するために2つの時限定常状態の血清バンコマイシン濃度の収集に基づく一次薬物動態方程式に依存している[15]。それぞれについて順番に議論する。
5.1. Bayesian approach
ベイズ的投与法はベイズの定理に基づいています。PK/PDの文脈では、ベイズの定理は、以下の間の重要な逐次的関係を定量的に記述しています。(1) 薬物を投与する前の患者のPKパラメータ値(例えば、体積やクリアランス)の推定確率分布を、先行患者での薬物の挙動に基づいて推定する(ベイズの先行値)。(2) 所与の薬物レジメンの投与後に患者から収集される測定された薬物濃度。(3)投与後の患者の PK パラメータ値の修正された確率分布と薬物濃度データが考慮される(ベイズ条件事後処理)。ベイジアン条件付き事後処理により、バンコマイシンのAUC値を低いバイアスで推定することができ、その後のAUC最適化された投与の推奨をリアルタイムで提供することができる[60]、[61]、[62]、[63]。
ベイズ的アプローチを説明するためによく使われるアナロジーは、次のようなものです。ある人が自宅で携帯電話を紛失したとする。標準的なアプローチは、別の回線から電話番号に電話をかけ、着信音が紛失した携帯電話の位置を特定するのに十分な音量であることを期待することかもしれない。ベイズ的アプローチでは、事前の経験(先験的確率)から、その人が寝室に携帯電話を置き忘れてしまうことが多いことを認識する。この情報が与えられると、電話を見つける確率(事後確率)を最大にするために、家族に寝室に近いときに電話をかけるように依頼する。寝室で電話が見つからなかった場合は、次の確率の高い場所に移動してステップを繰り返す(2回目の反復)。同様の反復アプローチは、限られたデータで個々のPKプロファイルを識別するために使用することができる。
腎機能の異なる47人の成人からなる3つの研究から豊富にサンプリングされた血清バンコマイシン濃度時間データを使用して、我々のグループは、豊富にサンプリングされたバンコマイシンデータに基づくPKモデルをベイズ先行(ベイズ推定技法)として組み込んだベイズソフトウェアプログラムを使用して、トラフのみのデータを使用して、1日のAUCの正確で信頼性の高い推定値を生成できることを決定した[14]。フルデータから推定されたAUCが「ゴールドスタンダード」であると仮定すると、トラフのみのデータを用いたベイズアプローチは、97%(93%~102%、p=0.23)の正確なAUC推定と関連していた[14]。対照的に、従来のトラフのみのPKアプローチでは、真のAUCを約25%過小評価していました。注目すべきは、トラフのみのデータを用いたベイズ法では、ベイズ法の優先順位として、豊富にサンプリングされたPKデータに基づいたPKモデルを使用する必要があるということです。ピークとトラフの血清バンコマイシン濃度に基づいた集団PKモデルをベイズの優先順位として使用した場合、バンコマイシンのトラフから真のAUCを予測するには最適ではなかった。多くの発表されているバンコマイシン集団モデルは、ピークおよびトラフ濃度データのみから導出されているため、我々はこのような区別をしている [14]。
ベイズ式投与量最適化ソフトウェアは現在すぐに入手可能であり、ベッドサイドで使用して、事前に定義されたAUC目標を達成する最適なバンコマイシン投与量を特定することができる [64]。ベイズプログラムは、従来の一次方程式アプローチよりも多くの利点を提供する。バンコマイシン濃度は、異なる投与間隔であっても、いつでも得ることができる。ベイズ法の一般性は、様々な薬物動態モデル(この場合、バンコマイシンのための2-コンパートメントモデル)および投与パターンの適用を可能にします。さらに、このアプローチはトラフのみのサンプリングに限定されず、サンプルは必ずしも定常状態の条件下で採取する必要はない。
投与履歴に基づいてAUCを推定し、その後のAUCと用量の最適化された推奨を提供するために、ベイズソフトウェアは4つの特定のコンポーネントのみを必要とする。(1) 与えられた薬剤の薬物動態を最もよく記述する構造数学モデル。(2)埋め込み構造PKモデル(ベイズ先行)のパラメータ推定値と関連する分散を含む密度ファイル。(3) 患者の投薬量と収集したPKデータを含む患者ファイル。と、(4)患者の「ターゲット」ファイルであり、このファイルには、ターゲット暴露プロファイルと将来の投与レジメンの初期推定値が含まれている。要するに、投与量最適化ソフトウェアは、構造数学モデルファイルの方程式と密度ファイルの母集団ベイズ事前分布を、データファイルの個々の患者の観察された薬物濃度と一緒に使用して、その患者のベイズ事後パラメータ値分布を計算する。次に、用量最適化ソフトウェアは、ターゲットファイル内の指定された曝露プロファイルに基づいて、最適な投与レジメンを計算する[61], [62], [64]。簡単に言えば、利用可能な情報に基づいて「行方不明の携帯電話」を見つける確率を高める段階的な数学的アプローチである(上記の類推を参照)。
このアプローチのさらなる利点は、適応プログラムに変更できることである [61]。低維持投与レジメンへの移行を伴う先行負荷投与などの革新的な治療スキームは、重篤な患者の間で最初の24時間から48時間以内に目標濃度を迅速に達成するように設計することができる。さらに、濃度時間情報は「定常状態」(3回目または4回目の投与後)で収集する必要はない。PKプロファイルの動的な変化は、患者、特に「定常状態」濃度モニタリングの能力を制限する重症患者の設定で容易に発生する。ベイズ法では、定常状態を待つのではなく、最初の24時間から48時間以内にバンコマイシン濃度を収集することができ、この情報は、その後の投与(適応フィードバック制御)を通知するために使用することができる。さらに、ベイズ法は、クレアチニンクリアランスなどの共変量を構造的PKモデル(ベイズの事前密度ファイル)に含めることができ、重症患者に起こりやすい病態生理学的変化を考慮することができます。これらの「動的な」変化を説明する共変量を組み込むことは、効果を最適化し、進化するPKプロファイルを持つ患者の将来の投与を予測する投与スキームを特定する方法として有用である[61]。これは、さらなる研究が必要であるが、風速や風向などの動的な条件の影響を受けて入ってくるミサイルを標的にするための軍事など、他の分野で一般的に使用されているアプローチである。あるいは、上記のように、より実用的なアプローチとしては、観測と調整の間の遅延を最小限に抑えて、頻繁に観測し、投与量の調整(アダプティブ・フィードバック制御)を行うことが考えられる。
5.2. Equation-based approach
ベイズソフトウェアプログラムを使用する代わりに、最近、分布後のピーク(輸液後1-2時間)とトラフ濃度を使用することで、単純な1次PK式を使用して合理的な精度と低いバイアスで1日のAUC値を決定できることを実証した[15], [65]。ピーク濃度とトラフ濃度のような同じ投与間隔で2つのPKサンプルを収集することで、その投与間隔の濃度-時間プロファイルを単純な単指数曲線として特徴付けることができる。単純な算術式を適用して、この方法でAUCを計算することができる。重要なことは、このアプローチを電子医療システムにプログラムして、自動的にAUCを計算することができるということである。このアプローチの主な利点は、より少ない仮定に依存し、迅速な臨床翻訳性のために患者レベルの情報の「実世界」スナップショットを提供することである。このアプローチの主な制限は、ベイズ法のように適応性がなく、サンプリング期間のAUCのスナップショットしか提供できないことである。このAUC計算は、サンプリング期間中またはサンプリング期間後に腎機能障害などの生理的変化が発生した場合には正しくない。
2つのサンプルからAUCを計算するための方程式は、アミノグリコシド[66]のためにBegg, Barclay, and Duffullによって提案されたオリジナルのアプローチに部分的に基づいており、PaiとRodvold[15]によって修正されています。このアプローチは最近、ダプトマイシンのAUCを計算するために検証されている [65]。しかし、これらの先行研究は、これらの薬剤を1日1回のアプローチで投与することを前提としている。腎機能が良好な患者では1日2回、1日3回の投与が一般的であるため、バンコマイシンの場合はそうではないことが多い。AUCの計算は、以下のように2つの濃度に基づいて修正することができる。
図4は、バンコマイシン1000mgを8時間毎に投与(1時間点滴静注)した場合の濃度-時間プロファイルを反映したものであり、TDMが多用されるプロファイル(3~4回目の投与前後[24時間~32時間の治療時点])に焦点を当てたものである。図示されているように、「真の」バンコマイシン濃度は、少なくとも二指数関数的な低下をたどる(2-コンパートメントモデル)。輸液終了から輸液開始から2〜3時間後に発生する曲線の瞬間までの間の濃度を測定しなければ、初期(α相)濃度-時間プロファイルを正確に特徴付けることは不可能である。濃度-時間減少の同じ相(β相)の間に2つの濃度が測定される可能性があるので、注入の開始(人工時間)から投与間隔の終了までのこのプロファイルを特徴付けるために、単指数減少関数を適合させることが可能である。このフィットは、図4にも示されている。
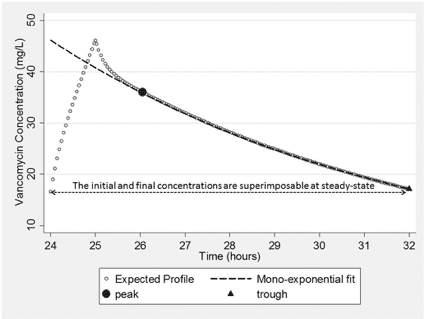
Fig. 4. Expected concentration-time profile after administration of the 4th dose of a 1000 mg every 8 hour regimen of vancomycin with a peak and trough concentration fit with a mono-exponential decline function.
この単指数フィットには、次の式を用いて消去率定数(Ke)を計算することで、Sawchuk-Zaske法[67]を用いることができます。
式(1)![]()
ここで、C1は「ピーク」濃度と呼ばれる投与後の最初の濃度であり、C2は投与間隔の終わりに向かって収集された第2の濃度または「トラフ」濃度であり、tはこれら2つの濃度の間の時間差である。Keが計算されると、この情報を使用して、逆外挿法(輸液終了時または輸液開始時の値)により理論的な濃度を計算することができる。この方法は、投与間隔の終了時の「真の」トラフ濃度(Ct)への濃度の前方外挿にも使用することができる。投与間隔の終了時にトラフ濃度を正確に測定することは臨床的に不可能であることが多いため、この方法が必要となる場合がある。
輸液終了時(Ceoi)、輸液開始時(Csoi)、およびCtにおける理論的な(すなわち、測定されていない)濃度がわかれば、算術関数を用いてAUCを計算することができる。第1のシナリオ(図5)では、輸液終了濃度を推定する。輸液開始濃度とトラフ濃度は、ほぼ定常状態(図4)であるため、重ね合わせが可能であることから、同じであると考えることができる。あるいは、投与前(トラフ)と投与後(ピーク)にサンプルを採取して、AUC計算を迅速に行うこともできる(投与間隔の終了を待つのではなく)。
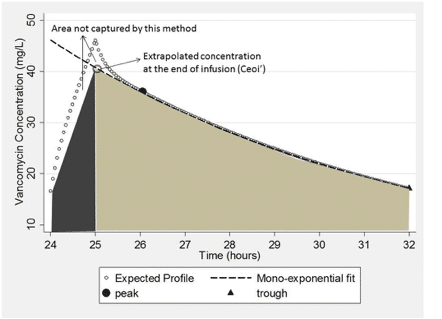
Fig. 5. Expected area under the curve captured using Eq. (4) based on an expected vancomycin concentration time profile.
所定の輸液時間(t′)に対する輸液開始(Ctと同じ)と理論的な輸液終了(Ceoi′)との間の面積を台形の面積として関連付けることができる。
式(2)
![]()
輸液終了時刻(t1)から投与間隔終了時刻(t2)までの単指数曲線の下の面積をいう。
式(3)
そのため、シナリオ1の下の面積は次のように簡略化できます。
式(4)
![]()
図5に示すように、この方法は面積の大部分を捉えますが、輸液終了までの濃度上昇が完全に直線的ではなく、この方法ではα相が無視されるため、真のAUCを過小予測することになります。この限界を克服するための代替案は、濃度を理論的な輸液開始時(Csoi′)まで逆算することであろう。この第2のシナリオ(図6)の下では、式は次のように単純化することができる。
式(5)
![]()
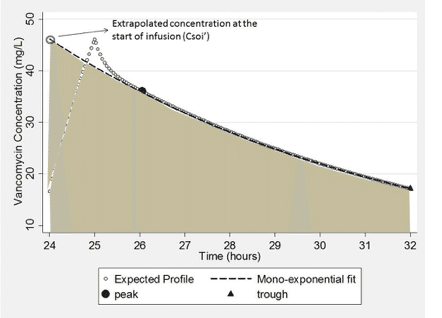
Fig. 6. Expected area under the curve captured using Eq. (5) based on an expected vancomycin concentration time profile.
示されているように、このアプローチは、より大きなAUCの計算につながり、式(4)で捕捉されていないAUCの代わりになります。しかし、図示されているように、このアプローチは真のバンコマイシンのAUCをわずかに過大に予測します。これらのすべてのシナリオの下で、AUC24は、その間隔で投与された同一線量の数の関数となる。したがって、提示された特定の実施例では、計算は、8時間の間隔(AUC8)にわたるAUC推定をもたらす。AUC24は、この推定値に3(AUC8 × 3)を乗算することによって計算されます。
5.3. Comparison of the equation-based to Bayesian based approach to AUC calculation
我々の最近のグループ[14]の原稿からのデータを用いて、シングル測定に基づくベイズのAUC計算を検証するために使用したデータセットについては、以前に述べたとおりである。
輸液開始から1.5~3時間の間に採取した濃度をCpとし、投与間隔の終了に近い濃度をCtとした。バンコマイシンAUCは、式(4)、(5)を用いて個別に算出した。式で計算されたAUCは、完全な濃度-時間プロファイル(AUCf)とトラフのみの測定に基づく値(AUCt)を使用してベイズ的AUCと比較された。表1は、中央値[5番目および95番目]のパーセンタイルAUC値、およびトラフのみまたはピークとトラフに基づくAUC計算の基準基準値(AUCf)に対する比率をまとめたものである。表1に示すように、提案された手法は、基準となるAUCf値を正確に(低バイアス・高精度に)反映している。(4), (5)の記述から予想されるように、(4)はAUCfを過小予測する傾向があり、(5)は過大予測する傾向がある。(5)はAUCfを過大予測する傾向があるが、中央値の誤差は2%以下であり、臨床的には有意ではない。

方程式に基づいたアプローチを適用する際に考慮すべき重要な問題は、ピーク濃度を収集するための最適なサンプリングウィンドウです。
例えば、あまりにも早く収集されたサンプルは、α期にあり、誤ったKeの推定値につながる可能性があります。
最適なピークサンプリング時間点を特定するために輸液終了後に複数のサンプルを収集することは現実的ではないことを考慮して、我々はこの問題に対処するために母集団シミュレーションを使用しました。
我々は、バンコマイシン1500mg(1.5時間注入)を3回投与した場合の5000の濃度-時間プロファイルをシミュレーションした。輸液終了(15分刻み)から1時間から3時間の間の9つのCp値と、投与間隔終了前の1時間以内の15分刻みの5つのCt値を含む45のCp-Ctペアをテストした。このシミュレーションの結果、Cp値を輸液終了後1.75時間から3時間後までに収集した場合、式(4)、(5)を用いたAUC計算における平均パーセンテージ誤差は2%未満であることが明らかになった。
6. Future directions
このレビューから得られた知見を解釈して適用する際には、いくつかの点に注意が必要である。現代のバンコマイシンの投与は、AUC/MICBMD比≧400を達成することに焦点を当てている。バンコマイシンのAUC/MICBMD≧400のPK/PDターゲットが一般的なPK/PDターゲットであるが [3]、[4]、[16]、[17]、[18]、[19]、このターゲットを支持するデータの多くは好中球減少マウス大腿部感染モデルのデータに由来しており[16]、このターゲットを支持する臨床データは限られている[3]、[4]、[18]、[47]、[68]。
さらに、バンコマイシンのクリティカルな PK/PD ターゲットとして AUC/MICBMD ≥ 400 を同定したこれまでに実施されたほとんどの臨床評価では、AUC 値を推定するためにバンコマイシンの 1 日量と推定腎機能に基づく単純な式を使用していました [18], [47], [68]。ほとんどの場合、彼らはCockcroft-Gaultのクレアチニンクリアランス式を使用した[69]。この原稿で強調されているように、臨床現場ではバンコマイシンの曝露プロファイルには患者間でかなりのばらつきがあり、糸球体濾過推定式だけに基づいて、特定の個人の曝露変数の有効な推定値を作成することは困難である [9], [10], [11]。
この原稿に記載されている有効なベイズ法を用いて、限られたバンコマイシン血中濃度データを用いてバンコマイシン曝露プロファイルを推定した[14]が、我々のグループは、AUC/MICBMDが成人MRSA血流感染症患者におけるバンコマイシンの転帰に最も密接に関連する薬力学的指標であることを決定した[70]。報告されているAUC/MICBMD比400 [18], [47], [68]とは対照的に、分類回帰木(CART)分析によって同定された1日目および2日目のAUC/MICBMD比の臨界値は、AUC0-24h/MICBMD≧521およびAUC0-24h/MICBMD≧650であった。1日目と2日目のAUC/MICBMD値がいずれもCARTの基準値を超えた場合、成功率は80~85%となり、MRSA BSI患者に期待される効果の最大化に近い結果となった; CART 由来の AUC/MIC 曝露閾値を達成できなかった場合、成功率は 60%以下であった。これらの知見をまとめると、バンコマイシン療法の最初の2日間における1日のAUC/MICBMD比の個別化された推定値の重要性が明らかになった[70]。本試験はレトロスペクティブな研究であるため、これらのデータは、これらの知見をプロスペクティブに検証し、最大効果に関連するバンコマイシンの薬物動態/薬力学(PK/PD)プロファイルを決定するための、より大規模な多施設共同臨床試験を支持する正当な理由ともなります。どのような薬剤であっても、最大効果に関連するPK/PDターゲットを明確に理解することは、臨床現場で最適な投与を行うために必要である。
”有効性”の曝露-反応データと同様に、バンコマイシン曝露とAKIの確率との関係についての理解は限られている。これまでに行われた研究のほとんどは、あらかじめ定義された閾値でバンコマイシンのトラフ濃度とAKIの関係を調べたものである [12]。より定量的な解析では、バンコマイシン誘発性AKIは連続的に発生し、その可能性は患者集団によって異なることが示されている [32]、[58]、[59]。しかし、その知見にはばらつきがある。バンコマイシンの投与量を真に最適化するためには、最大の効果と最小のAKIに関連するPK/PDターゲットをより深く理解する必要があります。
モデルは証明されるものではなく、反証されるものでしかありません。そのため、より広い患者集団に対するAUC/MICターゲットの汎用性を確保するためには、常に追加の作業が必要である。
バンコマイシンのTDMが臨床で日常的に起こることを考えると、最適な投与量の改善に関わる臨床医は、この目標を達成するためのツールを持っていなければならない。動的な患者の状態に適応する最先端のアプローチは、ベイズ法[14]、[60]、[61]、[62]である。臨床現場でバンコマイシンのためのこのアプローチを採用するために、臨床家に力を与えるためのいくつかのソフトウェアプログラムおよびトレーニングモジュールが存在する [64]。今後の重要な方向性としては、バンコマイシンTDMを行う臨床医が、1点測定(バンコマイシン血清トラフ濃度)のみに頼りたい場合に、投与量最適化のためのこのツールを習得することが挙げられる。このソフトウェアツールと結合していない場合の一点測定の誤りを明確に示しました。
代替案(ただし、理想的ではない解決策)は、現在アミノグリコシド投与に適用されているピーク濃度とトラフ濃度を含むアプローチを適用することであろう [15], [65], [71]。これらの2つの値を独立した項として扱うのではなく、分析的な解によって統合し、バンコマイシンAUCの合理的な推定値を導き出すことができます。このAUCの推定値は、特定のサンプリング期間の情報を静的に表現したものになりますが、トラフオンリーまたはピークオンリーの濃度解釈の一歩上をいくものである。投与時間を正確に(またはそれに近い時間に)スキャンして投与し、採取したサンプルを採取する技術を含む電子医療システムの使用が増加していることは、この計算を自動化する機会を提供しています。(1), (4), (5)式を用いて臨床現場でピーク濃度とトラフ濃度を測定すれば、バンコマイシンのAUC出力値の自動化が可能になるかもしれない。
7. Conclusions
我々は、薬の安全性と有効性を高めるために、個別化医療や個別化治療がモダリティとして認められている時代に生きている。薬物投与のためのワンサイズフィットのアプローチは、もはや合理的ではない。投与量デリバリーの最適化には測定が必要であり、バンコマイシンの場合、現在はトラフ濃度の測定が含まれている。トラフ濃度を独立した値として解釈すると、特定の患者の真の濃度-時間プロファイルが無視される。ベイズ的アプローチは、トラフのみの測定をより現実的なプロファイルに適合させるために、事前の確率的情報を使用することで、この大きな制限を克服することができる。このアプローチでは、バンコマイシンのために存在する豊富なデータリポジトリから生成されたベイジアン事前処理を必要とします。あるいは、臨床使用のためにより容易に自動化され得るそれほどでもない溶液は、分析溶液の適用を含むが、ピークおよびトラフ濃度の測定を必要とする。これらのアプローチの実施には常に障壁があるだろうが、それは「大部分がロジスティックと教育的なものであり、技術的なものではない」[14]。バンコマイシンTDMを日常的に使用している臨床医は、最終的には彼らの臨床実践のための最良の解決策を決定しなければならない。最良の解決策はベイジアンアプローチであると考えていますが、このアプローチを実施するための専門知識をまだ持っていないセンターには、代替案を提供しています。
よろしければサポートお願いします。 サポートいただいた費用で、論文の取り寄せ等に使わせていただき、記事を充実させていきます。
