
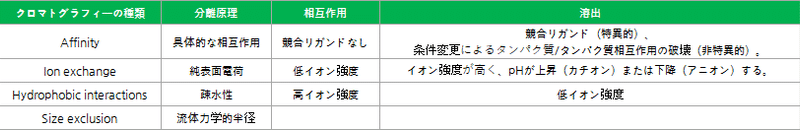
クロマトグラフィー樹脂の原理
クロマトグラフィー樹脂は、mAbや抗体フラグメント、ワクチンなどの生体分子を捕捉・精製するための固定相とし使用されます。移動相がクロマトグラフィー樹脂の中を流れると、クロマトグラフィー樹脂と結合力の弱い標的分子がからから順に移動相へと分離し、その分離する速度の差で各成分が分離されます。クロマトグラフィーの種類によって、それぞれ適切な樹脂を選択する必要があります。
クロマトグラフィー樹脂の種類
クロマトグラフィーには、大きく分けて4つの種類があります。
1. アフィニティークロマトグラフィー
2. イオン交換クロマトグラフィー
3. 疎水性相互作用クロマトグラフィー(HIC)
4. サイズ排除クロマトグラフィー
精製にあたり、ダウンストリーム工程で要求される純度を達成するために、複数のタイプのクロマトグラフィーが使い分けられています。 また、最適なタンパク質の精製を実現するためには、使用するクロマトグラフィーの種類とその使用順序が重要です。下記のクロマトグラフィー樹脂の各特徴を踏まえ、最適な条件を考慮することが必要です。
1. アフィニティークロマトグラフィーは、樹脂に結合したリガンドにタンパク質が特異的かつ可逆的に結合することを利用したクロマトグラフィーです。リガンドへは、目的のタンパク質や、タンパク質に付いているタグ(ヒスチジン、GSTなど)が結合することができます。アフィニティークロマトグラフィーは最も堅牢な精製方法であることが多く、一般に精製の初期段階で使用されます。ダウンストリームの仕様によっては、十分な純度を満たすための唯一の選択肢となる場合もあります。
タンパク質は、選択的または非選択的にアフィニティークロマトグラフィーによって精製することができます。選択的アフィニティークロマトグラフィーでは、目的のタンパク質またはタグに特異的に結合するリガンドが使用されています。免疫グロブリンのプロテインA、G、L、DNA結合タンパク質のヘパリン、糖タンパク質のレクチンなどの非選択的アフィニティークロマトグラフィーでは、類似のタンパク質群に結合するリガンドが使用されています。
2. イオン交換クロマトグラフィー(IEX)樹脂は、大きなタンパク質、小さなヌクレオチド、アミノ酸などの分子を、その電荷に応じて分離する際によく使用されます。IEX樹脂に含まれる官能基は、反対の電荷を持つ分子と結合し、その電荷の濃度を上げることによる電荷置換によって、樹脂に結合した分子は放出されます。
IEX樹脂は、ビーズサイズ、ポアサイズ、官能基、個々のベースマトリックスの機械的強度に応じて、大量のサンプルからバルク量の目的物や不純物を捕捉するための中間段階、または高分解能精製のための最終段階に使用されます。
3. 疎水性相互作用クロマトグラフィー (HIC) 樹脂
ProteoHIC Butyl, Pentyl, Hexyl, Phenyl, Heptyl, Octylは、それぞれC4、C5、C6、ベンゼン環、C7、C8の炭素鎖を有する疎水性相互作用クロマトグラフィー(HIC)吸着剤です。これらは、バイオロジカルな分子を精製するため、対象となる分子の疎水性プロファイルに基づいて開発されています。
HICは汎用性の高い技術であり、表面の疎水性部位が、標的のタンパク質に対して高い選択性を示します。精製工程の中でも、特に中間段階と最終段階の精製に有用です。HIC樹脂は通常、中~高の塩濃度の条件で標的のタンパク質と結合します。そのため、精製後に高塩条件となるIEXの後に、よくHICが実施されます。
4. サイズ排除クロマトグラフィー(SEC)は、分子のサイズと形状により、タンパク質を分離します。他のクロマトグラフィーとは異なり、SECでは標的のタンパク質は固定相には結合せず、タンパク質が樹脂の隙間を通過する速度の差によって分離されます。
SECは、異なるタンパク質を分離することができるため、精製工程の最終段階で最もよく使用されます。オリゴマー、アンフォールドタンパク質、不完全なタンパク質はすべて、目的のタンパク質から分離することができ、同時にバッファー交換もできます。サイズ排除クロマトグラフィーは、複数の溶媒で使用でき、精製に必要なバッファー量が少なくてすむため、透析よりも迅速かつ信頼性の高いバッファー交換法としてよく使用されます。一般的に使用されるほとんどの緩衝液において使用可能で、精製には単一の溶媒が用いられます。

Avantorのエキスパートが、皆様をお待ちしています。バイオ医薬品向けのクロマトグラフィーに関して、お気軽にご相談下さい。


この記事が気に入ったらサポートをしてみませんか?
