
添付文書とは・・?!
どうも、MEです。
今日は、なかなか分かりづらい添付文書について記載したいと思います。
添付文書とは、医薬品や医療機器に添付されている”使用上の注意”や”用法・用量””服用した際の効能””副作用”などの重要事項を記載した書面のこと。
添付文書は、薬機法に基づいて作成される公文書であり、添付文書は電子化され公開されなければならないと定められています(薬機法第52条,63条の2)。
添付文書の作成と添付が義務付けられている製品は”医薬品”と”医療機器”です。ちなみに”化粧品”と”医薬部外品”にも添付文書はありますが、作成と添付は義務付けられてはいません。
また、添付文書は効能・効果・再審査の結果、副作用の情報などの項目に修正が加わると改訂されるため、その都度、最新のものか確認する必要があります。
<添付文書にかかる法律上の規定>
• 医薬品の製造販売業者が作成
• 医薬品は、これに添付する文書又はその容器若しくは被包に、当該医薬品に関す る最新の論文その他により得られた知見に基づき、次にあげる事項が記載されて いなければならない。
<医療用医薬品の添付文書に記載しなければいけない項目>
・作成、もしくは最新の改訂年月
・日本標準商品分類番号
・薬効分類名
・規制区分
・名称
・警告
・禁忌
・組成・性状
・効能または効果
・用法・用量
・使用上の注意(副作用や相互作用もここに記載する)
・薬物動態(薬物が体内に入ってからの吸収、分布、代謝、排泄に関する濃度や速度の過程を調査したものを記載する)
・臨床成績
・薬効薬理
・有効成分に関する理化学的知見
・取り扱い上の注意
・承認条件
・包装
・主要文献および文献請求先
・製造業者または輸入販売業者名または名称・住所
<医療用医薬品添付文書の記載要領>
(1997(平成9)年4月25日厚生省薬務局⻑通知)
• 原則,A4版4ページ以内
• 警告、禁忌、慎重投与,基本的な注意,併用禁忌と重要度の高い情報から記載
• 効能・効果,用法・用量に続けて関連する使用上の注意を併記
• 副作用の頻度は可能な限り数値化して記載
(平成9年4月25日薬発第606号)
• 安全を確保し適正使用を図るために、医師、 ⻭科医師及び薬剤師に対して必要な情報を提供する目的
• 記載すべき内容は、原則として当該医薬品 が承認された範囲で用いられる場合に必要とされる事項
• 既に記載している内容の削除又は変更は、十分な根拠に基づいて実施
記載要領を「医療用医薬品の添付文書等の記載要領について」(平成29年6 月8日付け薬生発第1号厚生労働省医薬・生活衛生局長通知),「医療用医薬品の添付文書等の記載要領 について」(平成29年6月8日付け薬生安発第1号厚生労働省医薬・生活衛生局安全対策課長通知)(以 下「改正記載要領」)により改定されています。
主な改正内容については以下の通りです。
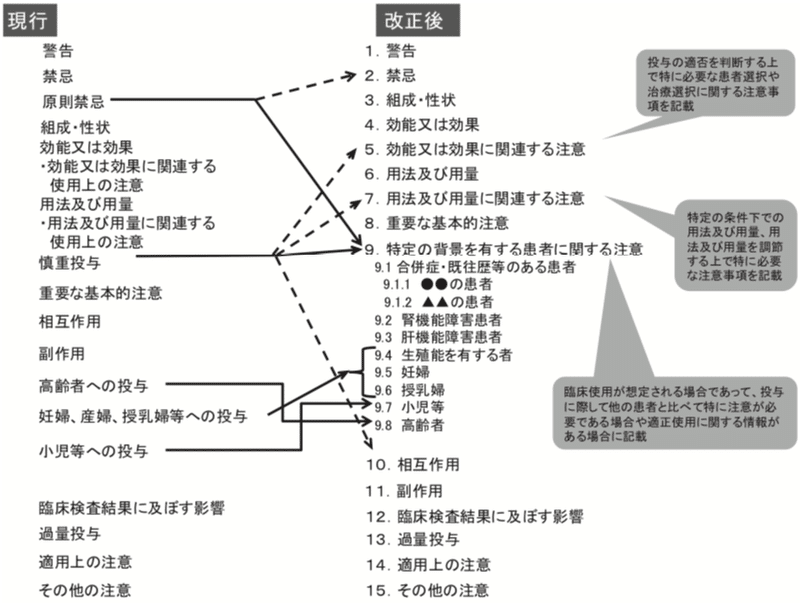
1)「原則禁忌」の廃止
2)「慎重投与」の廃止
3)「高齢者への投与」,「妊婦,産婦,授乳婦等への投与」,「小児等への投与」の廃止
4)「特定の患者集団への投与」の新設
5)項目の通し番号の設定
旧記載要領と改正記載要領での添付文書の項目比較
(引用:https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/1_14.pdf)
類別及び一般的名称等について
平成 16 年厚生労働省告示第 298 号(以下「クラス分類告示」)によると、 医療機器の一般的名称、JMDN コード、高度管理医療機器・管理医療機器・一般医療機器の別、特定保守管理医療機器・設置管理医療機器の別を記載すること。
なお、一つの承認、認証又は届出に係る医療機器に該当する一般的名称が複数にな る場合、承認書、認証書又は届出書の一般的名称欄に記載した一般的名称等を記載するとともに、括弧書きで、承認書等の備考に記載されている一般的名称を記載する こと。
(引用:https://www.pmda.go.jp/files/000147825.pdf)
上記の項目を考えると、このような形になるでしょうか。
添付文書の記載項目は決まっているもののメーカーによって記載仕方が若干異なっているような気もするので、そこらへんについては注意が必要かもしれません。

<参考文献>
・添付文書の記載 それってどういう意味?
この記事が気に入ったらサポートをしてみませんか?
