マウスの精子の運動性 ~違いを生み出すX染色体~ 論文紹介
マウスの精子の運動性 ~違いを生み出すX染色体~
論文掲載年 2019年
掲載雑誌 PLOS Biology
論文タイトル Activation of Toll-like receptor 7/8 encoded by the X chromosome alters sperm motility and provides a novel simple technology for sexing sperm
和文タイトル 遺伝子がX染色体にあるToll様受容体7/8の活性化は精子の運動性を変化させ、オスメスの産み分けのための新しい簡単な技術を提供する
著者 Takashi Umehara, Natsumi Tsujita, Masayuki Shimada
論文へリンク https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3000398
精子の性染色体の違いがもたらす運動性の違いに着目した2019年の論文です。
生物の性は、基本的には遺伝子的に決定されます。細胞にはDNAの塊である染色体が決まった数だけあり、その染色体のうち一組は性を決定することから、性染色体と呼ばれています(漫画参照)。ヒトの場合は性染色体としてX染色体とY染色体があり、この組み合わせがXYの場合に男性、XXの場合に女性となります。つまり、Y染色体に男性を決定する遺伝子があります。有性生殖の場合には、染色体が半分ずつ含まれる精子と卵が受精することで子孫が産まれます。染色体が半分である精子や卵では、性染色体もどちらか1本になっています。卵を作る女性はXXの組み合わせであるため、卵に含まれる性染色体は必ずX染色体になり、精子を作る男性の場合はXYの組み合わせであるため、精子に含まれる性染色体はXかY染色体のどちらかになります(漫画参照)。精子には染色体が違う2種類があることが分かります。今回は、この性染色体の違いが精子の違いを生み出しているのではないかという点に注目した研究になります。
ヒトと同じXYでオスが決定するマウスの精子を使い、X染色体を持つ精子(X精子)とY染色体を持つ精子(Y精子)が環境の変化に対応した運動性が違うことを発見しています。ある条件では、X精子とY精子の運動性に違いが出るということは、条件によってはオスが増えたりメスが増えたりすることに繋がります。オスメスに偏りが出来ることが、生物としてどのような意味があるのか非常に興味深いです。
更に、この運動性の違いを使って、X精子とY精子分離し、オスメスの産み分けに技術に応用することが出来ることを示しています。このサイトでは、基本的に応用などを考えない基礎研究を紹介してきましたが、応用や実用に繋がる基礎研究の一つの例として読んでいただければと思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・X染色体にある遺伝子から翻訳されたTLR7/8たんぱく質は、Y精子にはなく、X精子の中片と尾部に発現する。
・TLR7/8リガンドは精子の受精能力を減少させることなくX精子の運動性を抑制する。
・TLR7/8リガンドを使うことで、X精子とY精子を簡単に分離し、オスメスを産み分けることが出来る。
[背景]
オスの生殖細胞は一次精母細胞へと分化し、最終的に減数分裂によって成熟した精子になります。(補足:減数分裂とは核にある染色体の数を半分にするために、行われる細胞分裂のこと。精子や卵を作るために行われる。)最初の減数分裂では、一次精母細胞が2つの二次精母細胞に分裂し、その後、X染色体またはY染色体のいずれかを含む4つの半数体の丸い精子細胞が生成されます(漫画参照)。続けて起こる丸い精子細胞から精子への分化は精子形成と呼ばれ、この過程で、丸い精子細胞には核凝縮、先体形成、精子べん毛(尾部)の伸長などのダイナミックな形態の変化が起こります。マウスを使った研究によって、精子形成に関連する形態の変化は、丸い精子細胞でのTekt遺伝子、Tnp遺伝子、Gba2遺伝子を含むさまざまな遺伝子の発現と関連しています。そのため、活発な遺伝子の転写が、染色体の数が半分になったオスの生殖細胞にある性染色体を含む染色体上で起こります。また、この遺伝子の転写の一部は、生殖細胞が生きるために不可欠なものです。精子細胞間の細胞質ブリッジを使用して、RNAおよびたんぱく質を含む細胞質は、Y染色体保有精子(Y精子)を助けるために共有されています。(補足:精子細胞は細胞質ブリッジによってつながっており、このブリッジを通して細胞質が行き来している(漫画参照)。)このブリッジは、精子形成の初期段階の精子細胞で働き、多量のRNAポリメラーゼIIがこの時期に精子細胞から検出されることが報告されています。(補足:RNAポリメラーゼIIはmRNAの転写のために必要な酵素なので、この時期に転写が起きていると考えられる。)しかし、精子形成の後期まで、RNAポリメラーゼIIは検出されることから、精子の特徴はX染色体またはY染色体の存在だけでなく、これらの性染色体にある遺伝子の発現によっても区別できることを示しています。
マウスのY染色体には700未満の遺伝子がありますが、マウスのX染色体には3,000を超える遺伝子があります。 X染色体には、物理刺激によって活性化される転写調節因子であるTaz遺伝子、アポトーシスシグナル伝達の活性化を抑制するXiap遺伝子、酸化的ペントース-リン酸経路を触媒するG6pdx遺伝子などのいくつかの特徴的な遺伝子が含まれています。そのため、常染色体と同様に、X染色体は、体細胞と生殖細胞の機能の調節に重要な役割を果たすと考えられます。しかし、X染色体保有精子(X精子)とY精子の両方が形成され、体内受精または従来の体外受精法では、X精子とY精子の間に明らかな違いが見られることは無く、両精子は同じように働きます。
このように同じ機能があるにもかかわらず、X精子とY精子の運動性には違いが観察されています。例えば、流れのない液体の中では、ヒトの精子の運動性はX精子とY精子で差がないことが報告されていますが、流れのある液体の中では、X精子の動きはより直線的なものに変わりました。さらに、酸性、高温、高酸化ストレスなどの特定の生体外条件では、Y精子の運動性がX精子と比較して急速に低下した一方で、アルカリ性ではX精子の運動性が低下しました。これらの観察は、特定の生体外(おそらく生体内でも)条件下でX精子とY精子の運動性パターンが違うこと、X精子またはY精子の特徴的な運動性パターンに影響する特定の遺伝子の転写に関連する可能性があることを示しています。しかし、これらの研究はまだ行われていません。
これまでの研究で、特定のリガンドに応答できるToll様受容体が精子に発現していることが分かりました。(補足:リガンドは受容体に結合する物質。)そのため、精子がX染色体またはY染色体にある特定の環境センサー(言い換えれば受容体)遺伝子を発現し、これらのセンサーが特定の条件によって選択的に活性化された場合、X精子とY精子の間で運動性の違いが明確になる可能性があります。本研究では、精子の性染色体にあり、X精子とY精子の間の潜在的な機能の違いを説明できる可能性のある遺伝子を発見することを試みました。今回の結果に基づいて、複雑な分離システムを使うこと無く、Y精子またはX精子を選択的に分け、マウスでオスメスの産み分けを可能にする迅速で簡単な新しい技術を開発しました。
[結果]
TLR7/8遺伝子はマウス精子のX染色体にある
マウス精子のRNA配列データより、492遺伝子をマウス精子のX染色体からの発現遺伝子として選びました。そのうちの18遺伝子が受容体でした。これらの受容体のうち6つ(Tlr8遺伝子、Ar遺伝子、Gpr174遺伝子、Tlr7遺伝子、Gpr34遺伝子、Edr2a遺伝子)には特異的なリガンドがあります。残りの12の受容体には、常染色体にある受容体にも結合する共通のリガンドがあります。これらの6つの受容体のmRNAは、RT-PCRによって精子にあることが確認されました。(補足:RT-PCRについては図1参照。)
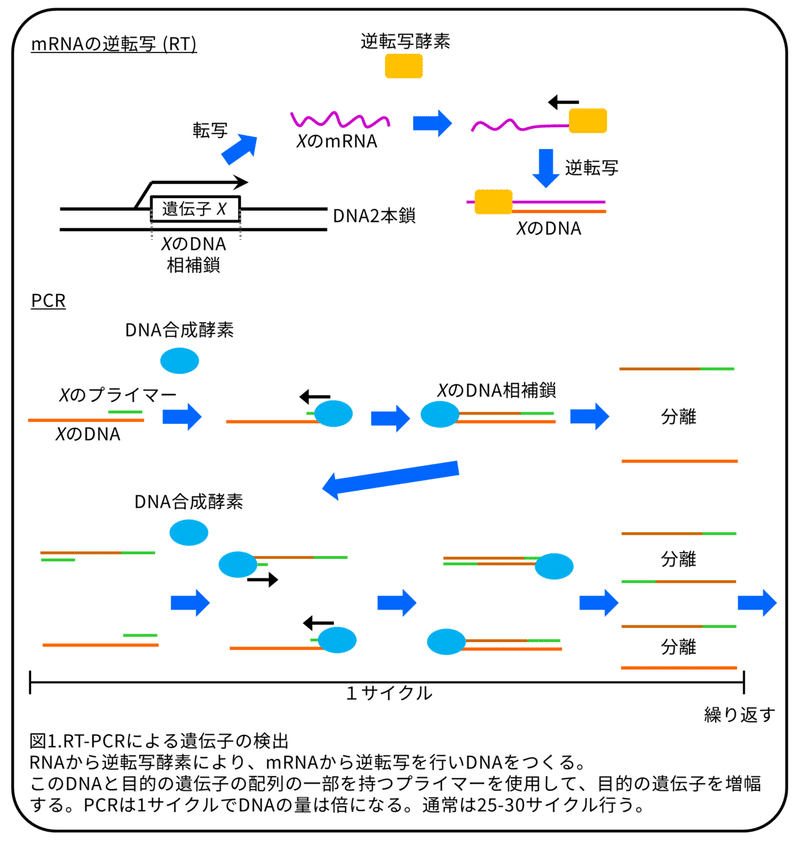
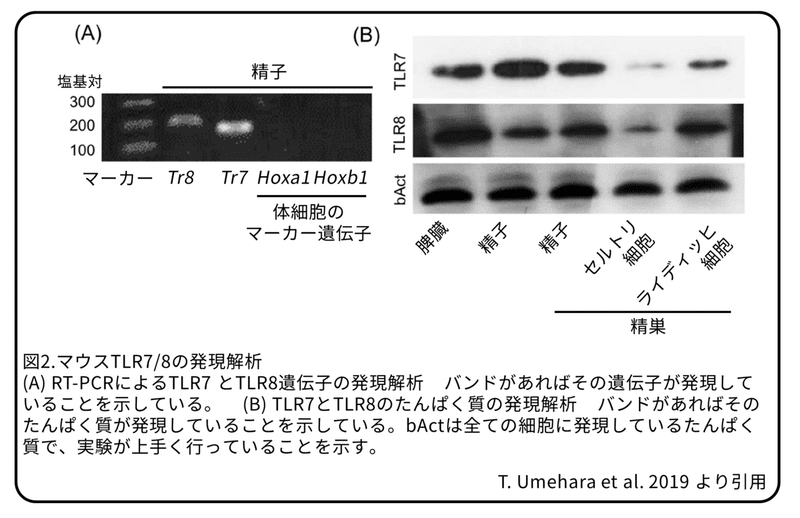
これまでの研究では、TLR2たんぱく質とTLR4たんぱく質がヒト、イノシシ、およびマウスの精子に発現し、そのリガンドは、哺乳類の精子の生存率、運動性、および受精能力を抑制することが分かりました。しかし、X染色体にあるTLR7/8遺伝子の機能は不明のままでした。(補足:TLR7/8はTLR7とTLR8のこと。)そのため、本研究では、X精子とY精子の潜在的な違いを理解し、新しい産み分け技術を開発するための候補としてTLR7/8に注目しました。RT-PCRによって、精子からTLR7/8遺伝子のmRNAは検出されましたが、一方で、Hoxa1遺伝子およびHoxb1遺伝子の mRNAは検出されませんでした(図2A)。(補足:Hoxa1遺伝子とHoxb1遺伝子は体細胞のマーカー遺伝子。この遺伝子が検出されていないことから体細胞が混入していないことが分かる。)TLR7/8たんぱく質の発現は、ウェスタンブロットと免疫染色法によって解析しました。(補足:ウェスタンブロットはたんぱく質を大きさによって分けたあとに、抗体によってたんぱく質を検出する方法。免疫染色法については図3参照。)TLR7/8たんぱく質は、両方とも脾臓で発現していますので、ウェスタンブロットでは対照群として使用しました。TLR7/8たんぱく質は精巣上体にある精子、精巣にある精子、ライディッヒ細胞に発現していましたが、セルトリ細胞での発現は弱いものでした(図2B)。(補足:ライディッヒ細胞とセルトリ細胞は精子形成を助ける細胞。)
免疫染色法により、精子形成過程の丸い精子細胞のマーカーであるSp56たんぱく質を発現する細胞の約半分でTLR7陽性シグナルが観察されました(図4A)。Sp56たんぱく質発現する細胞のうち、TLR7たんぱく質を発現する細胞の割合は45.2%±3.7%でした(図4A)。TLR8陽性シグナルも、丸い精子細胞で検出されました(図4B)。Sp56たんぱく質発現する細胞のうち、TLR8たんぱく質を発現する細胞の割合は46.3%±1.7%でした(図4B)。
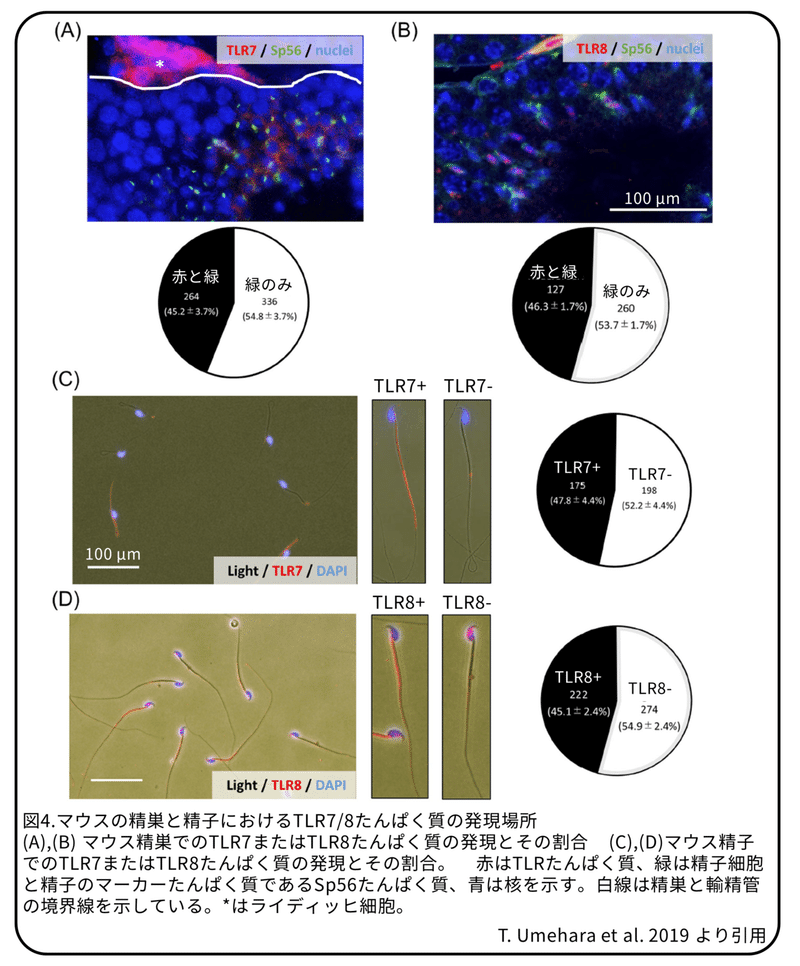
精巣上体尾部から集めたマウスの精子では、TLR7陽性シグナルが精子の鞭毛(尾部)に、一方で、TLR8陽性シグナルは中片で検出されました(図4C,D)。TLR7陽性およびTLR8陽性精子の割合はそれぞれ約50%でした(TLR7:47.8%±4.4%、TLR8:45.1%±2.4%; 図4C,D)。
TLR7/8のリガンドはX染色体を持つ精子の運動性を抑制した。
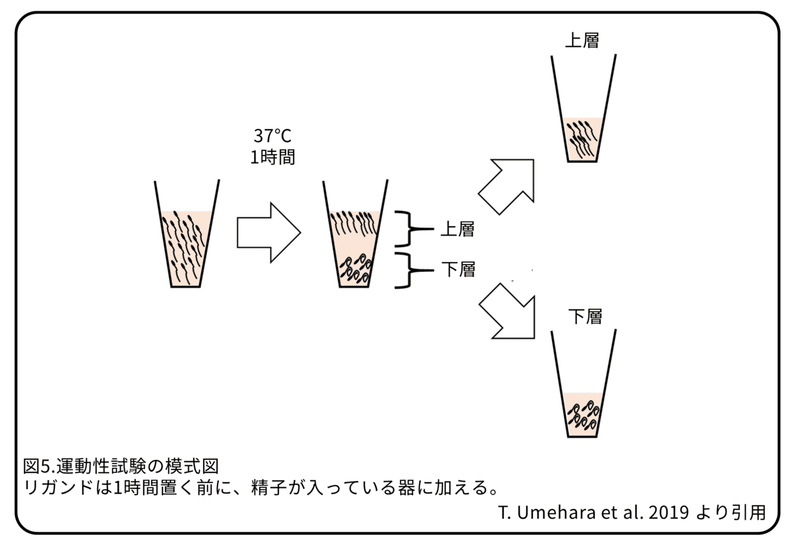
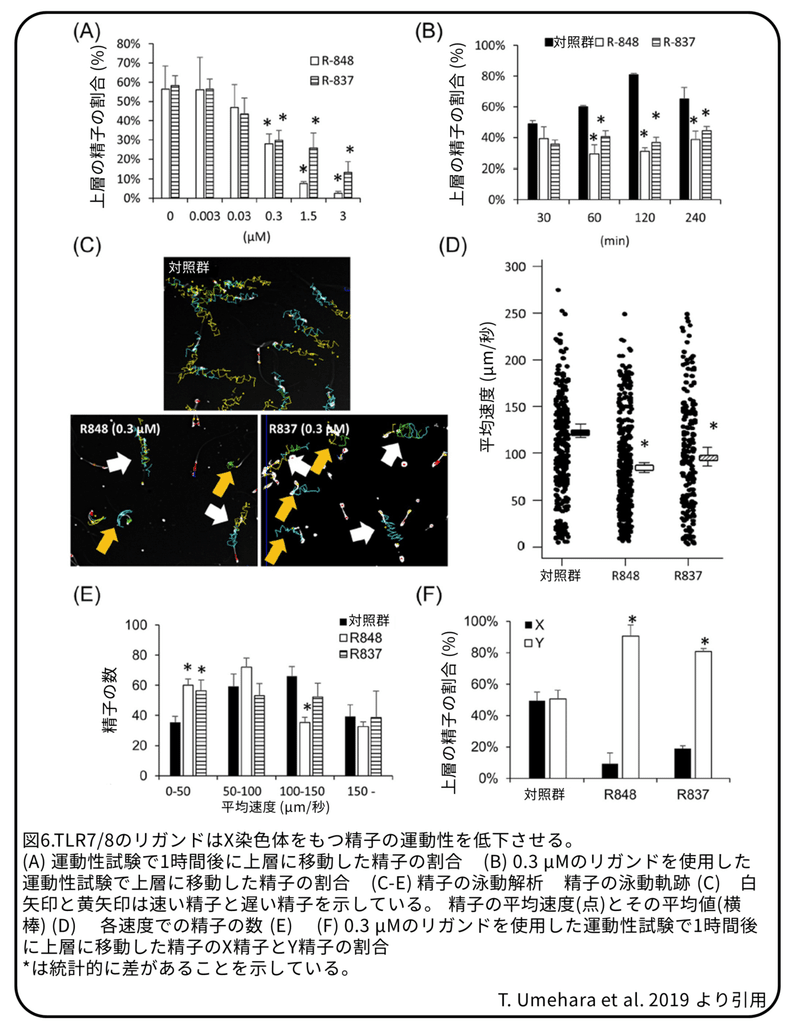
X染色体に遺伝子があるTLR7たんぱく質とTLR8たんぱく質は精子で発現し、両たんぱく質は共通のリガンドがあるため、TLR7たんぱく質とTLR8たんぱく質の両方に結合するR848(レシキモド)またはTLR7たんぱく質に結合するR837(イミキモド)を精子に使いました。運動性試験を行うと(図5)、0.3 μMから 3μMまでどちらかのリガンドを加えることで、上層へ泳ぐ非常に活発な精子(スイムアップ精子)の割合は濃度依存的に減少しました(図6A)。0.3 μMのリガンドを加えて1時間以上たった精子でも、運動性の低下は見られました(図6B)。精子の泳動軌跡を分析した結果、0.3 μMのR848またはR837を加えた精子の一部は、リガンドを加えていない精子よりも泳動軌跡は短くなりました(図6C)。R848またはR837によって、精子の平均速度は明らかに減少しました。平均速度が約50〜100 μm/秒または150 μm/秒を超えるグループに入る精子の数は、R848を加えても変化しませんでしたが(図6D,E)、50 μm/秒未満の精子の数は明らかに増加し、100 ~150 μm/秒の精子の数は明らかに減少しました(図6E)。さらに、R837を加えることにより、50 μm/秒未満の精子の数は同様に増加したことから(図6E)、TLR7/8は、すべてではないが一部の精子の速度を低下させることを示しています。R848またはR837のいずれかを加えて60分間置くことにより、スイムアップ精子内のX精子の割合は劇的に減少し、Y精子の割合は劇的に増加しました(図6F)。重要なことに、R848を加えても、精子の生存率または先体の状態に影響しないことから、R848を加えた後の精子は受精能力を維持していることを示しています。さらに、R848によって運動性が低下した精子は、R848を取り除くことで、その運動性はもとに戻りました。
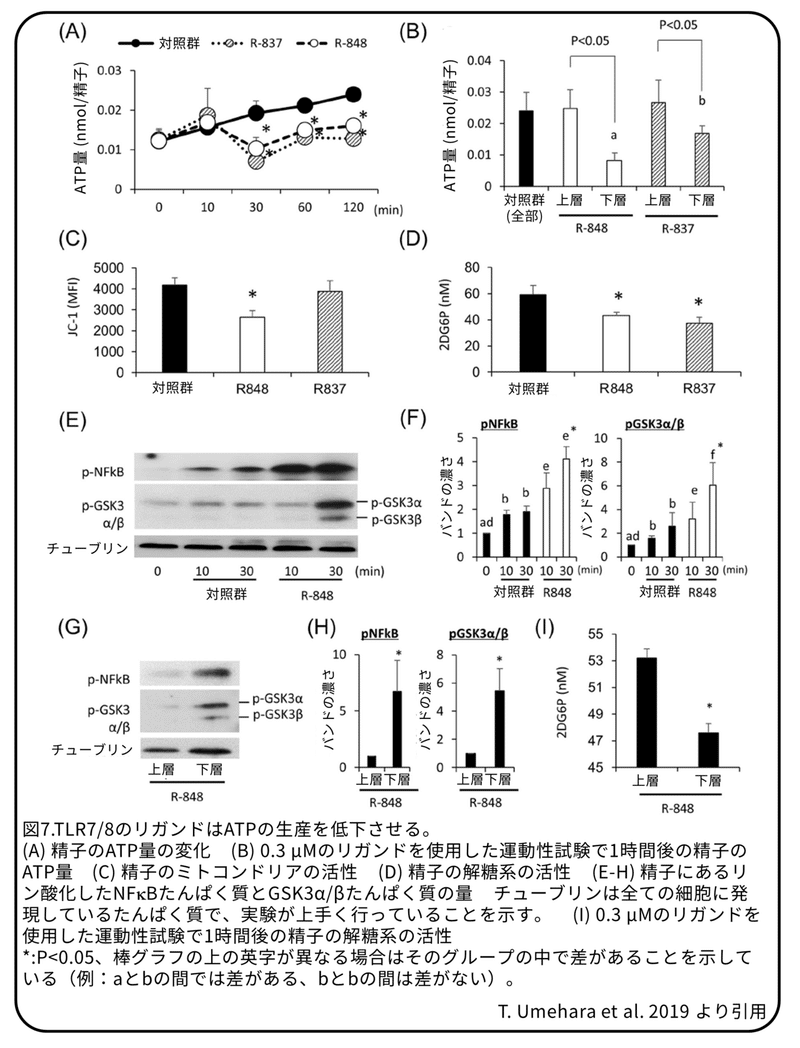
TLR7/8のリガンドは、GSK3α/β-ヘキソキナーゼ経路を介した解糖によるATP生産を抑制する。
精子の速度は細胞内のATP量によって調節されているため、TLR7/8のリガンドが精子でのATPの生産に与える影響を調べました。TLR7/8のリガンドを加え、30分間もしくはそれ以上おくことで、精子内のATP量が明らかに減少しました(図7A)。この変化は、TLR7/8のリガンドを使用した運動性試験後の下層の運動性が低下した精子で主に観察され、R848を加えた場合のATP量はR837を加えた場合よりも明らかに少なくなりました(図7B)。ATPの生産はミトコンドリアのトリカルボン酸(TCA)サイクルとβ酸化、細胞質の解糖系の両方またはその一方によって調節されているため、ミトコンドリア活性および解糖活性を測定しました。R837ではなくR848を加えることで、ミトコンドリア活性のマーカーであるJC-1は明らかに減少しました(図7C)。解糖系の律速酵素であるヘキソキナーゼの活性を調べるために、2D6PG(2-deoxy-6-phosphate-glucose)の量を測定したところ、両方のTLR7/8のリガンドによって明らかに減少したことから(図7D)、ミトコンドリアの活性抑制はTLR8の活性化によって特異的に起こり、解糖系の活性抑制は、TLR7とTLR8の両方で共通に起こることを示しています。結果として、TLRシグナルの標的であるNFκBたんぱく質のリン酸化と、解糖系を阻害するGSK3α/βたんぱく質のリン酸化は、R848によって増加しました(図7E,F)。これらの変化は、R848を使用した運動性試験後の下層の運動性が低下した精子で観察されました(図7G-I)。
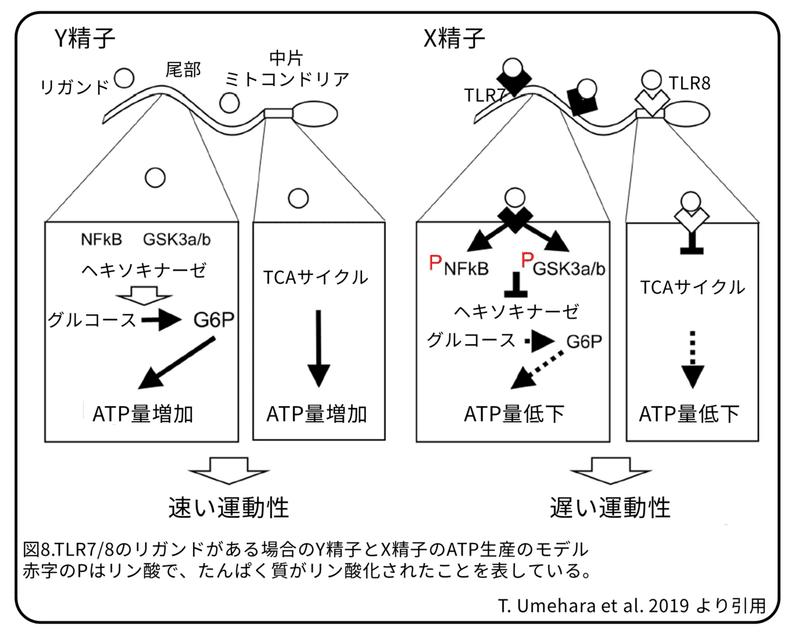
したがって、精子の中片に発現するTLR8たんぱく質の活性化はミトコンドリア活性を抑制し、尾部に発現するTLR7たんぱく質の活性化は細胞質の解糖系を抑制します(図8)。
TLR7/8のリガンドによるTLR7/8の活性化は体外受精の性別事前選択を可能にする。
運動性試験によってX精子とY精子を分離します(図5)。R848で分離されたX精子またはY精子が集められ、体外受精に使用されました。成熟卵母細胞の受精率と、受精卵あたりの胚盤胞の割合は、対照精子とR848を使用した上層精子、または下層精子の間で変わりはありませんでした(図9)。(補足:胚盤胞は発生がある程度進んだ胚で、この時期まで体外で育てることが出来る。)
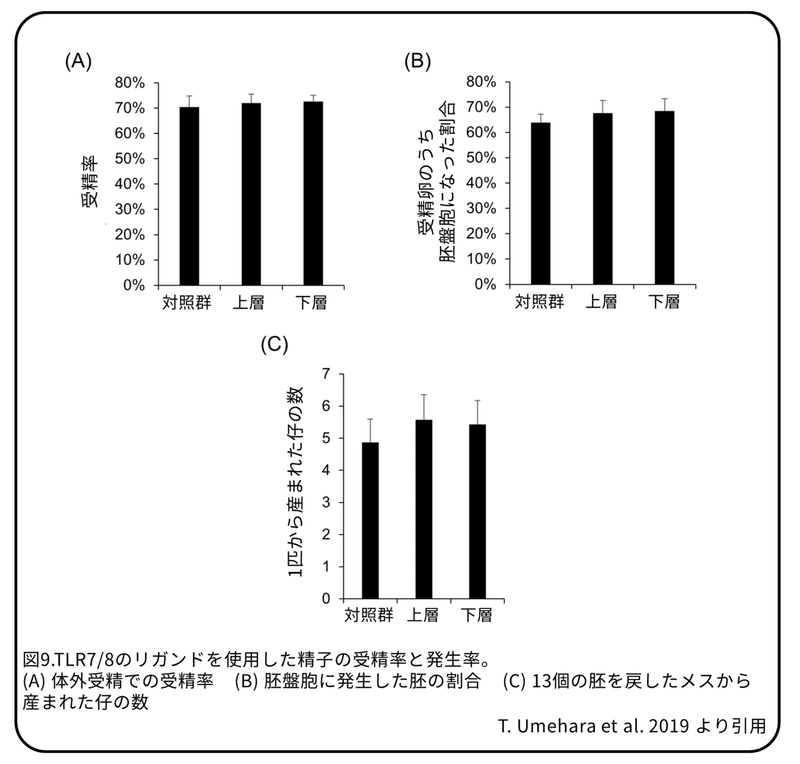
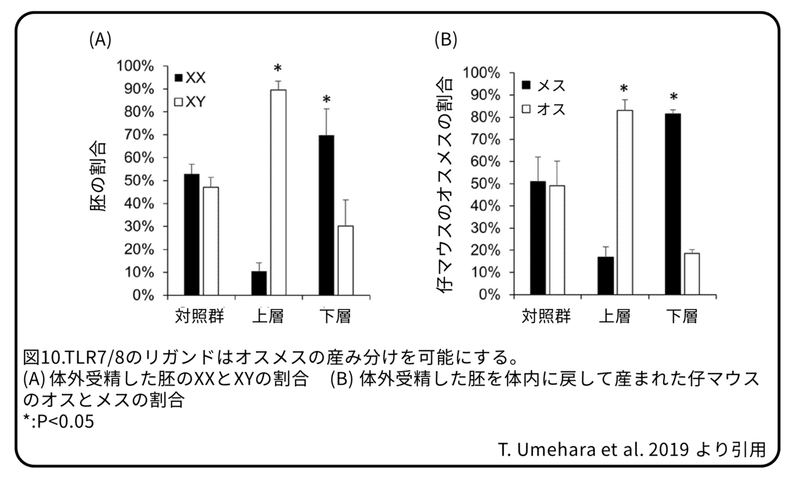
体外受精により、上層の精子を使って、77個の胚盤胞が得られました。これらのうち68個はXY胚で、9個はXX胚でした(XY:XX=89.6%±3.7%:10.3%±3.7%)(図10 A)。下層の精子を使って83の胚盤胞が得られました。これらのうち58個はXX胚で、25個はXY胚でした(XX:XY= 69.8%±11.4%:30.1%±11.4%)(図10A)。上層の精子と下層の精子を使用した胚盤胞から分娩された母マウス1匹あたりの仔マウスの数は対照群と明らかな違いはありませんでした(図9)。上層の精子を使用した胚を体内に戻した場合、総仔マウスの83.1%±4.6%がXYのオスでした。下層の精子を使用した胚を体内に戻した場合、総仔マウスの81.4%±1.9%はXXのメスでした(図10B)。
[考察]
特定の遺伝子の発現の変化が精子形成のいろいろな時期で起こることが分かっています。しかし、おそらく性的偏りを説明することが可能だと考えられるX精子とY精子に固有の異なる特性を比較することが出来るXおよびY染色体に固有の転写産物情報は、徹底的に調査されてはいません。そのため、本研究では、精子の性染色体にある遺伝子のRNAについて、定量的ではなく定性的な検出に注力しました。RNA配列決定データから、マウスの精子のX染色体にある492の遺伝子とY染色体にあるわずか15の遺伝子が特定されました。これらの遺伝子の中には、ケモカイン、クレアチニン、プロゲステロン、病原菌などの外部の要因に対する精子の応答に関連する可能性を持つ異なる種類のメンバーの受容体があります。したがって、X精子とY精子の機能の違いを発見することで、X精子またはY精子だけを選択するための新しいアプローチを提供することが出来ます。
精液または子宮が細菌とウイルスの両方または一方に感染している場合は、哺乳類の精子で発現し、特定の病原体を認識するTLRファミリーのメンバーが、精子の受精能力を変化させたり過剰な運動を起こしたりすることによって受精を出来なくさせます。そのため、X染色体にあるセンサーとして機能する受容体遺伝子に注目しました。
TLR7/8たんぱく質はマウスの精子で発現し、これらの受容体の活性化は、マウスとヒトの精子の運動性を抑制することが分かっています。これらの研究は、X染色体にある受容体遺伝子が、X精子とY精子の間の機能的な違いを生み出す可能性があることを示していますが、これまでに調べられていませんでした。そのため、本研究の結果は初めてTLR7/8たんぱく質が丸い精子細胞と精子の半分で発現し、TLR7/8の特異的リガンドを精子に加えることで、Y精子には影響ありませんが、X精子の速度が劇的に低下することを明らかにしました。これらの新しい観察結果は、X染色体にあるTLR7/8遺伝子から翻訳されるTLR7/8たんぱく質が、特異的な活性化に応答することでX精子とY精子の機能的な違い生み出していることを示しています。
しかし、丸い精子細胞の細胞質はX染色体をもつ精子細胞(X精子細胞)とY染色体を持つ精子細胞(Y精子細胞)の間で共有されていると考えられています。さらに、いくつかの生存因子遺伝子がX染色体のみにあるため、X精子細胞とY精子細胞間で共有されている細胞質はY精子細胞の生存のために必要です。これらのRNA /たんぱく質は細胞質ブリッジを通って丸い精子細胞の間を輸送されます。一方で、本研究では、TLR7/8たんぱく質はX精子細胞のみに発現し、TLR7/8陽性細胞はすべて先体のマーカーであるsp56たんぱく質を発現していたことから、これらの受容体は精子形成の後期の精子細胞で発現すると考えられます。丸い精子細胞の間にある細胞質ブリッジを作るたんぱく質を観察しませんでしたが、精子形成の後期に発現するTLR7/8遺伝子を含むX染色体にある遺伝子から翻訳されるたんぱく質は、X精子細胞とY精子細胞の間で共有されない可能性があります。(補足:精子形成の後期では細胞質ブリッジが消失している可能性が考えられるため。ブリッジがあるかどうかはこの論文では確認していない。)
TLR7/8たんぱく質の活性化が精子の運動性を変化させるメカニズムは、ATPの生産によって引き起こされているように見えます。TLR7/8のリガンドを加えると、精子の泳動軌跡は対照群の精子よりも比較的短くなりました。これは精子のATP量の減少とTLR7/8シグナルの下流にあることが知られているGSK3α/βたんぱく質とNFκBたんぱく質のリン酸化と関係していました。精子におけるTLR7/8たんぱく質とATPの産生との関係についての報告はありませんが、樹状細胞ではGSK3α/βたんぱく質のリン酸化はヘキソキナーゼ酵素の活性を低下させ、ATP量を減少させます。ヘキソキナーゼは解糖系の酵素で、グルコースをグルコース-6-リン酸(2D6PG)へ変換します。精子の尾部に発現するこの酵素は、樹状細胞では、TLR7/8たんぱく質の活性化により抑制される可能性があります。一方で、GSK3たんぱく質のリン酸化は、精子の運動性に影響を与えるリン酸化たんぱく質脱リン酸化酵素ファミリーを活性化させることが報告されています。したがって、本研究はTLR7/8たんぱく質の活性化が、ヘキソキナーゼ活性の抑制を介してATPの産生を低下させることを初めて明らかにしました。しかし、TLR7/8たんぱく質が精子でどのようにヘキソキナーゼ活性を調節するかについては、さらなる研究が必要です。
興味深いことに、TLR7とTLR8の両方を活性化するR848は、精子のヘキソキナーゼ活性だけでなく、ミトコンドリア活性も抑制しました。TLR7たんぱく質を選択的に活性化させるR837は、解糖系の活性のみを減少させました。TLR7たんぱく質は精子尾部で検出されましたが、TLR8たんぱく質はミトコンドリアが存在する精子の中片に発現していることは、TLR8たんぱく質の活性化はミトコンドリア活性を直接抑制し、TLR7たんぱく質はヘキソキナーゼ活性を抑制することを示しています(図8)。これまでの研究から、解糖系とは独立的に、ミトコンドリアでのATP生産が精子の運動性を制御することが分かっています。精子の運動性とATP量は、R837よりもR848でより減少するため、TLR7たんぱく質とTLR8たんぱく質の両方が、精子の運動性に影響を与えるATPの生産を調節すると推定されます。
精子のTLR7/8受容体の活性化の生理学的理由は、十分に検討されていません。しかし、TLR7/8受容体は、C型肝炎、HIV、ジカなどの女性の生殖管、特に子宮と卵管に感染すると報告されているRNAウイルスから放出された一本鎖RNAによって活性化されます。生殖管でのRNAによるTLR7/8受容体の活性化は、XX胚に対するXY胚の比率を増加させる可能性があります。しかしながら、RNAウイルス感染と新生児の性比との関係は分かっていません。興味深いことに、B型肝炎ウイルス(HBV)に感染したカップルから産まれた新生男児の数は、通常のカップルから産まれた新生男児の数より多いことが報告されています。HBVはDNAウイルスであり、TLR7/8受容体に直接結合しませんが、TLR7受容体の合成リガンドは、T細胞およびナチュラルキラー細胞のHBVに対する応答を増加させます。(補足:DNAではなく、HBVウイルスの何かがTLR7受容体を活性化させている可能性があるということ。)HBVとTLR7/8作動薬による予防接種は、HBV遺伝子を持ったマウスでは抗原特異的免疫反応を誘導します。HBVとTLR7/8たんぱく質の相互作用の分子メカニズムは不明ですが、TLR7/8たんぱく質とHBVの関係はHBVに感染したカップルの新生児において性比が男性に偏る理由の1つである可能性があります。性比の偏りとRNAウイルス感染との関係に関する疫学的研究は、精子のTLR7/8たんぱく質にそのような生体内での機能があるかどうかを確かめることにつながるでしょう。
これらの観察に基づいて、TLR7/8のリガンドによる活性化を利用することでX精子の速度を下げることにより、X精子からY精子を選択的に分離するための、便利で、効率的で、迅速で、簡単な方法を考えました。少なくとも生体外では、TLR7/8リガンドを精子に加えて1時間置くことで、受精能力を減少させることなく、X精子とY精子を効率的に分離出来ました。これまでに、性染色体の長さに焦点を当て、ヘキスト 33342染色された精子を蛍光の強さによってX精子とY精子を分離する方法が開発されました。(補足:ヘキスト染色によって紫外線を当てるとDNAが蛍光を放つ。X染色体のほうが大きいため、Y染色体より蛍光が強くなる。)しかし、フローサイトメトリーと細胞選別に基づいたこの方法はいくつかの制限があります。(補足:フローサイトメトリーは細胞を1個ずつ管に流し、流れてきた細胞を光学的に分析する機械。)フローサイトメトリーにより精子の蛍光を検出するために使用される紫外線は精子の受精能力を低下させます。さらに、細胞選別が出来るフローサイトメトリーシステムは高価すぎて、各地のマウス飼育施設に導入できません。(補足:一台数千万円から。)Tlr7/8遺伝子の発現は哺乳類のX染色体で高度に保存されているため、TLR7/8リガンドによる活性化を使った方法は、コストが低く、精子にダメージを与えること無く、短時間でX精子とY精子を分離するための技術として、哺乳類の生殖技術に適用されると確信できます。
結論として、X染色体にある遺伝子から翻訳されたTLR7/8たんぱく質は、Y精子ではなく、X精子の中片と尾部に発現します。TLR7/8リガンドを加えることで、精子の受精能力を減少させることなくX精子の運動性を抑制します。それにより、TLR7/8リガンドは、体外受精では、XYの選択で90%以上を達成したX精子とY精子の簡単な分離を可能にします。したがって、TLR7/8たんぱく質は、X精子の機能に異なる影響を与えるがY精子には影響を与えない特異的な受容体といえます。
よろしくお願いします。
