
心アミロイドーシス
高齢者のHFpEFの中に意外と多く隠れているかもしれないと言われています。新薬の開発も進んでおり、今後、有病率は増えてくると思いますので早期に診断すれば治療につなげられるかもしれません。
AIM Review 2023(PMID: 36913688)、ECS guidelines 2021(PMID: 33825853)、AHA guidelines 2020(PMID: 32476490)、JCS 心アミロイドーシス診療ガイドライン 2020より
【Take home message】
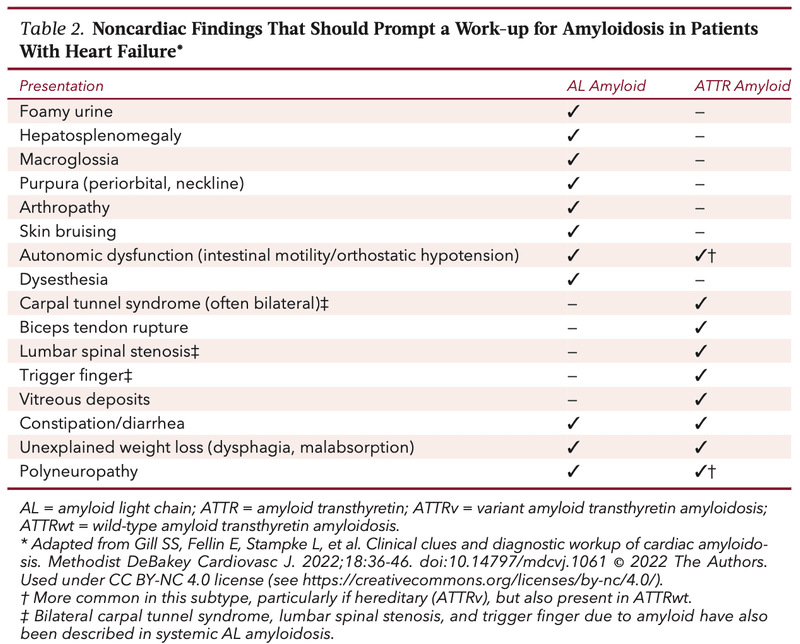
・左室壁肥厚(≧12mm)に加えて、血圧が低い、低電位、異常Q波、心臓外症状(末梢神経・自律神経障害、蛋白尿、巨舌、pinch purpura、raccoon eye、両側手根管症候群、上腕二頭筋腱断裂、脊柱菅狭窄症・変形性膝関節症に対して手術歴)などで疑う
・心エコー、ECG(+CMR)で疑わしければ、ピロリン酸シンチとM蛋白スクリーニング(血清・尿免疫固定法、血清FLC)を行う
・ピロリン酸シンチ grade 2-3で陽性+M蛋白スクリーニング陰性ならATTR-CMの診断
・それ以外では、生検でアミロイドの証明が診断に必要
<総論>
・アミロイドーシスは、組織内のミスフォールド蛋白の不溶性凝集体の蓄積による病理学的、臨床的状態を指す
・心筋におけるアミロイド線維の細胞外沈着は、心アミロイドーシスをきたす
・しばしば拡張不全の心不全(いわゆるHFpEF)の原因として見逃される
・心アミロイドーシスは予後不良と考えられてきたが、診断と治療の進歩により、早期発見の重要性が強調されるようになり、マネジメントが変化してきている
<アミロイドーシスについて>
・アミロイドは均質な物質で、主に細胞外に認められ、生検で同定される
・アミロイド沈着は、病理検査で特定の色調変化を示す(Congo Red染色でオレンジ色、偏光顕微鏡でApple green)
・異なるアミロイド蛋白の命名法には、アミロイドを示す「A」の後に固有のサブユニット蛋白の略語が続く
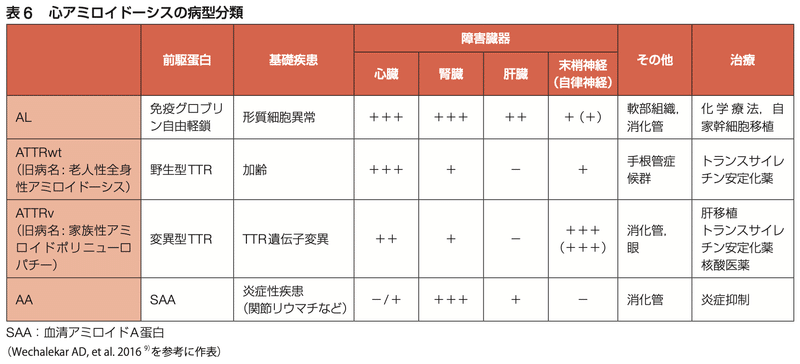
・「AL」はサブユニット蛋白が免疫グロブリン軽鎖であることを意味し、「ATTR」はサブユニット蛋白がトランスサイレチンであることを意味する
・さらに、サブユニット蛋白が正常である場合は「wt(野生型を示すwild typeを意味)」、変異を含む(通常は単一塩基の置換)場合は「v(バリアント)」「m (ミューテーション)」と修飾される(ATTRwtやATTRvなど)
<ALアミロイドーシス>
・ALアミロイドーシスは、心臓やその他の臓器に影響を与える全身性疾患
・この疾患は、免疫グロブリンの軽鎖が沈着することにより生じる(MGUSなどの形質細胞異常を背景に発症する)
・健常な人では、軽鎖の2/3カッパー型、1/3がラムダ型であるが、ALアミロイドーシスではこの比が変化する
・40歳以上で発症する
・ALアミロイドーシスの50-70%で心アミロイドーシスを合併する
・最終的にALアミロイドーシスと診断される患者の一部はMGUSの所見を示す
・ALアミロイドーシスと診断されるとMGUSとは見なされなくなる
<ATTRアミロイドーシス>
・ATTRアミロイドーシスも全身性アミロイドーシスの1つ
・トランスサイレチン(TTR)は、電気泳動でアルブミンよりわずかに速く走るプレアルブミンバンドの大部分を占める(それゆえにプレアルブミンと呼ばれる)
・TTRは、二量体の二量体であるホモ四量体タンパク質であり、チロキシンの非必須輸送蛋白、レチノール結合蛋白とビタミンAの主要な輸送体として機能している
・TTRの約80-90%は肝臓で合成され、その他は網膜色素上皮や脈絡叢で合成される
・野生型ATTR(ATTRwt)は、以前は「全身性老人性アミロイドーシス」として知られていた加齢性アミロイドーシスだったが差別的な用語のため使用されなくなった
・この形態のアミロイドーシスにおけるTTRは正常なアミノ酸配列を持ち、主に高齢男性に発症しやすいが理由は不明
・典型的には60歳以上、より一般的には70歳以上で発症
<心アミロイドーシスの頻度>
・いくつかの種類のアミロイドが心臓に影響を与える可能性があるが、ほとんどの心アミロイドーシスは、AL、ATTRwt、ATTRvの全身性アミロイドーシスによるもの
・生検で心アミロイドーシスと診断された101人を対象とした研究では、54%がALアミロイドーシス、42%がATTRアミロイドーシス、5%が未分類のアミロイドーシスであった
・近年、診断のきっかけとなるred flagの認識の高まり、診断的検査の使用が増加、新しい治療法が使用可能になったことから発生率が上昇している(米国では2007年15.5/100万人→2015年40.5/100万人)
<心アミロイドーシスの病態生理>
・アミロイドは心臓の細胞外構造に沈着し、早期に拡張障害を引き起こし、最終的には拘束型心筋症に至る
・アミロイド沈着は、心臓中隔と自由壁を硬化させ、心室充満圧の上昇と心不全を引き起こす
・主に左心室に関与する高血圧性心筋症とは対照的に、心アミロイドーシスは両心室と心室中隔に影響を及ぼすため、腹水、うっ血性肝障害、心臓肝硬変などの右心不全を呈する患者もいる
・心房におけるアミロイドの沈着は、異常な洞結節機能および異常な伝導を伴う収縮性の変化につながり、徐脈、洞不全症候群、心ブロック、動悸、失神を引き起こす可能性がある
・心房細動は、診断時に約70%の患者に見られる
・心臓充満圧の上昇は、心房拡張を引き起こし、心房収縮性の消失は、血栓形成と脳塞栓症を引き起こす可能性があり、これらは同年齢の対照群よりも心アミロイドーシス患者でより頻繁に発生する
・自律神経障害は、ALアミロイドーシスでよく見られ、ATTRでは約28%で見られる
・交感神経節と副交感神経節の浸潤によるもので、起立性低血圧や失神を引き起こす可能性がある
・心筋トロポニンのわずかな上昇は、小血管閉塞または筋へのアミロイド沈着を意味する可能性がある
・心内膜へのアミロイド沈着は、弁膜症を引き起こす
・さらにいくつかの研究では、ATTR-CMと大動脈弁狭窄症の関連性が認められているが、その理由は明らかにはなっていない
<心アミロイドーシスのスクリーニングを行うべき患者は?>
ECS 2021では、スクリーニング対象として以下を挙げてます。
左室壁≧12mmに加えて、次の1つ以上ある場合
65歳以上の心不全、65歳以上の大動脈弁狭窄症、以前高血圧だったが低血圧・正常血圧、感覚障害、自律神経障害、ポリニューロパチー、蛋白尿、皮膚のあざ、両側手根管症候群、上腕二頭筋断裂、心膜下・中隔のLGE、細胞外容積の増大、心尖部以外の長軸方向の収縮低下、壁肥厚に比した低電位、異常Q波、房室結節の伝導異常、家族歴の可能性

・HFpEFの約15%がアミロイドーシスであったという報告もある
・特に高血圧、弁膜症がない場合の左室肥大の患者や心エコーで左室肥大所見に比して心電図が低電位である患者に対して心アミロイドーシスを鑑別疾患として考慮すべき
・AL-CMを疑うべき所見としては、形質細胞異常の既往、歯による凹みによって生じる舌の横隆起を伴う巨大舌、顔と首の軽度の外傷によって生じる「pinch purpura」、直腸鏡検査などの処置中のいきみで誘発される眼窩周囲紫斑「raccoon eyes」、多量の蛋白尿、異常感覚、起立性低血圧、早期膨満感を含む慢性的な消化器症状がある
・ATTR-CMを疑うべき所見としては、脊柱菅狭窄症(典型的にはATTR-CMの診断8-10年前に椎弓切除術を行われている、腰椎>頚椎)、関節置換術を伴う重度の変形性関節症(通常は診断の5-10年前)、上腕二頭筋腱断裂・腱肥大・拘縮がある
・手根管症候群は、AL、ATTR両方の早期症状である可能性があり、開放手術は心病変の認識の5-10年先行して施行される
・組織が以前の手術または生検で病理学的検査のために採取されている場合は、標本のアミロイドをさかのぼって調べることができる
<心アミロイドーシスの診断>
ECS 2021の診断アルゴリズムです。
①臨床症状、ECG、心エコー ± CMRから心アミロイドーシスを疑う
②ピロリン酸シンチ+M蛋白スクリーニング(血清・尿の免疫固定法、血清FLC)
③②の結果に応じて追加で生検
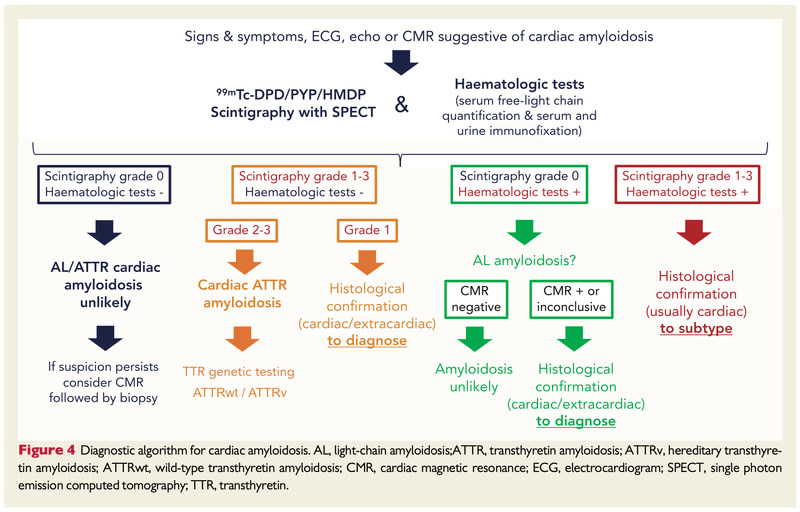
ポイント
・ピロリン酸シンチgrade2-3で陽性かつM蛋白スクリーニング陰性のときのみ生検なしで診断可能(ATTR-CM)
・それ以外の状況では生検が必要になるため、侵襲の低い部位(腹壁皮下脂肪、骨髄、唾液腺、消化管)などからの生検を行いつつ、心筋生検を検討する
<M蛋白スクリーニングについて>
・血清および尿の免疫固定と血清フリーライトチェーン(FLC)の測定は、ALアミロイドーシスを検出する感度95%を超える
・患者にMGUSがある場合は、ALアミロイドーシスの診断は複雑になる
・MGUSは、一般集団の最大5%に存在する可能性があり、年齢とともに増加し、ATTRwtおよびATTRvの40-50%で報告されている
・免疫固定法やFLCの異常が検出された場合は、血液内科医に紹介し、骨髄検査、フローサイトメトリー、細胞遺伝子学的検査を行う必要がある
・これらの検査により、クローナルな形質細胞、アミロイド、ALアミロイドーシスで多い転座(t(11,14)など)を特定できる
<心アミロイドーシスの心電図所見>
・心エコーでの左室壁肥厚とECGでのQRS電位の不一致は、歴史的に診断と予後予測の補助として使用されてきた
・しかし、低電位の所見の有病率はアミロイドのタイプに依存するため、この所見がなくても除外はできない
・低電位は、ALアミロイドーシスの約50%、ATTRアミロイドーシスの25%に見られる
・心筋梗塞と関連のない異常Q波が見られることもある(ALの15-69%、ATTRwtの18-71%、ATTRvの18-69%)
・伝導遅延や心ブロックも検出されることがある
・これらの所見を伴う患者では、特に左室肥大所見がある場合に心アミロイドーシスの精査を検討するきっかけになる
<心アミロイドーシスの画像検査>
・主要なモダリティとしては、経胸壁心エコー(TTE)(ストレインエコー法を含む)、心臓MRI(CMR)、核医学検査(ピロリン酸シンチ:99m Tc-PYP)がある
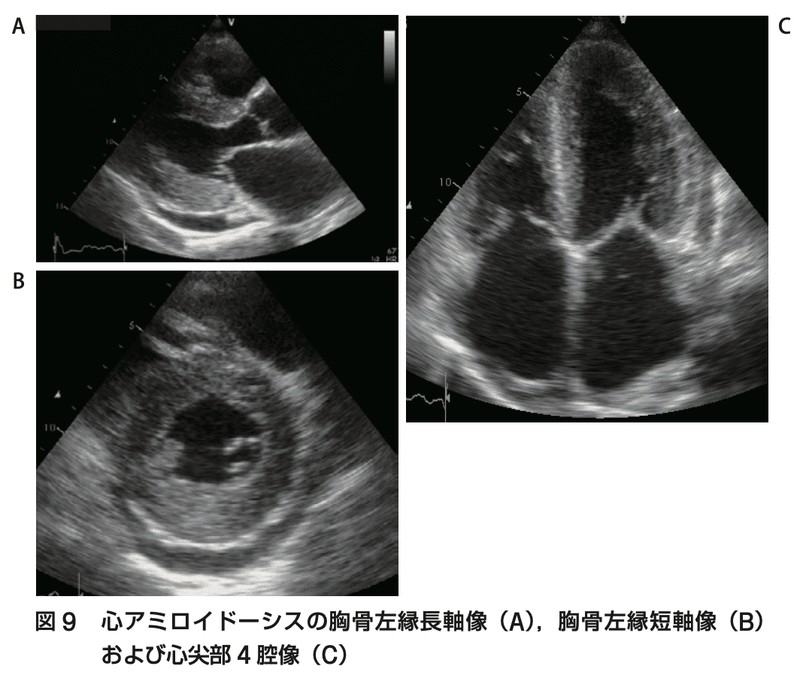
●心エコー
・TTEの典型的な所見では、原因不明の左室壁肥厚(≧1.2cm)がある
・ストレインエコー法では、心尖部以外の長軸方向の収縮障害を認める「cherry on top(Bull's eye)」
・この所見はATTR-CMに特異的であるが、感度は高くない
・ただし、高血圧性心筋症でもこの所見を伴うことがある
・その他の所見としては、正常〜小さい左室腔、心筋の不均一な顆粒状の高輝度エコー「granular sparkling」、心房・中隔の肥厚、弁の肥厚、両房の拡大、拘束性障害の拡張障害パターン、心嚢液貯留など

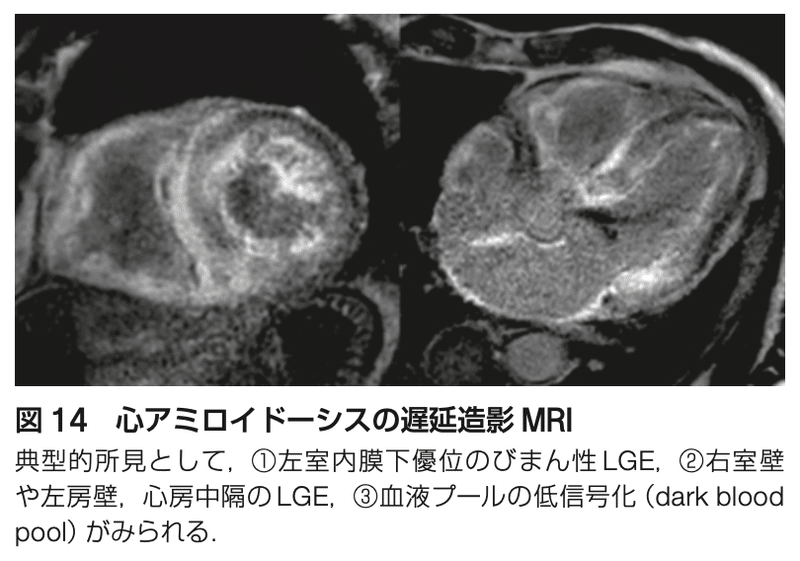
●CMR
・CMRは、心筋の構造と機能に関する情報を提供し、アミロイドを他の心肥大の疾患と区別するのに役立つ
・典型的なCMR所見には、びまん性の心内膜下の遅延ガドリニウム造影(LGE)がある
・T1 mappingでは、細胞外容積の拡大とアミロイド沈着を測定し、T2 mappingは、心筋浮腫と炎症を強調する
・CMRのみでは心アミロイドーシスの診断はできないが、所見は非常に特異的である
・CMRではALとATTRの区別はできない
・M蛋白検査や核医学検査の結果がグレーで、心アミロイドーシスの可能性が残る場合や心エコーが技術的に困難な場合にもCMRは役立つ
・CMRは、アミロイドーシスの治療効果をフォローするために定期的に施行される
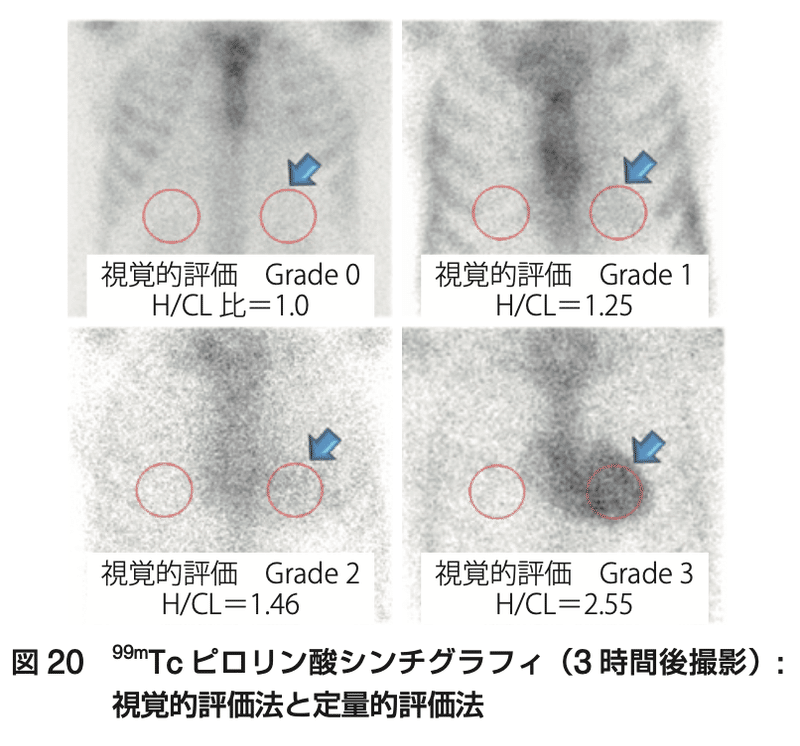
●ピロリン酸シンチ(99m Tc-PYP)
・Perugini grading systemで評価(グレード0:心臓への取り込みなし、グレード1:肋骨よりも少ない取り込み、グレード2:肋骨と同程度の取り込み、グレード3:肋骨よりも多い取り込み)
・適切な臨床状況で、M蛋白スクリーニング陰性なら、グレード2,3ではATTR-CMの診断となる
・しかし、ピロリン酸シンチは完璧な検査ではなく、グレード1の取り込みはAL-CMの約40%でも見られる
・ピロリン酸シンチを実施する際の適切な症例を選択するための「Kumamoto Criteria」が報告されている(以下)
高感度TnT≧0.03、左室壁肥厚≧13.6mm、QRS幅≧120msのうち
ピロリン酸シンチ陽性率は、2項目で63%、3項目で96%とされる
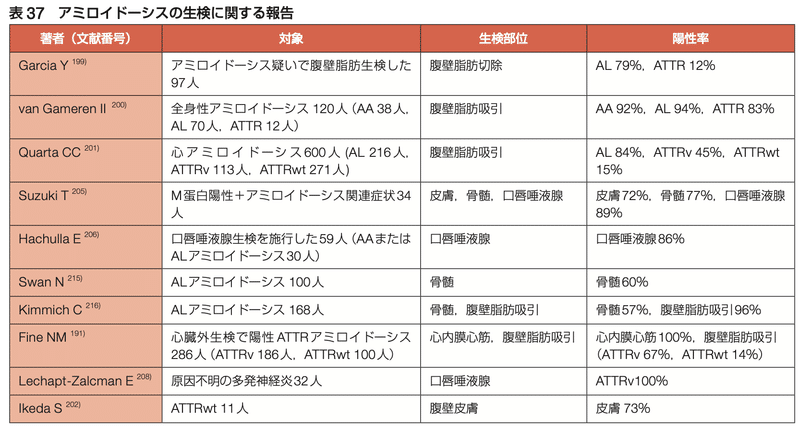
<生検について>
・心内膜心筋生検は、依然として心アミロイドーシスの診断と分類のゴールドスタンダード
・AHAでは、99m Tc-PYPスキャンが陽性で、形質細胞異常の所見もある場合、99m Tc-PYPスキャンが陰性もしくはグレーであるが臨床的に疑いが強い場合、99m Tc-PYPが使用できない場合に心筋生検を推奨している
・生検検体の質量分析を行い、主要な原線維サブユニット蛋白をカッパ、ラムダ、TTRとして識別し、ATTRvのペプチドの配列異常を識別することで、アミロイドの分類が可能
・心筋生検は一般的に安全だが、特に合併症のリスクが高い高齢者では施行できないこともある
・代替の生検部位としては、腹壁皮下脂肪、小唾液腺、胃・十二指腸・結腸、前立腺・膀胱がある
・ポリニューロパチーが存在する場合は、適切な部位の皮膚、神経、骨格筋の生検を行う必要がある
・過去に採取された組織は遡って病理学的な検査を行うことができる
・診断率は部位や状況によって異なり、一般的にはATTR-CMよりもAL-CMの方が陽性率は高い
●ALアミロイドーシス
・ALアミロイドーシスの場合は、骨髄生検を施行されることが多いが陽性率はやや低い
・しかし骨髄生検をする場合にはCongo Red染色による評価も行うべき
・肝脾の陽性率は高いが、侵襲が高く、出血合併症が懸念されるため避けられる
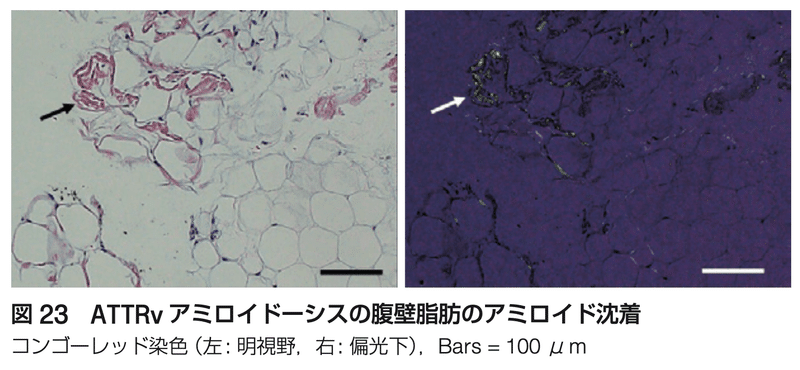
・腹壁皮下脂肪吸引はALアミロイドーシスに対しては陽性率が高い
●ATTRアミロイドーシス
・ATTRwtでの生検陽性率は、腹壁皮下脂肪で14-15%、消化管で38%と高くない
・腹壁皮膚生検では陽性率が73%と報告されており、皮膚生検により診断率の向上が望まれる
・腱・靭帯のみに沈着する限局性ATTRwtが存在するため、腱・靭帯の病理所見のみで全身性ATTRwtの診断は避けるべきである
・ATTRにおける心筋生検の陽性率は100%と報告されており、サンプリングエラーの頻度はきわめて低い
・特に病初期では心筋以外の生検でのアミロイドの検出率は高くない
<治療>
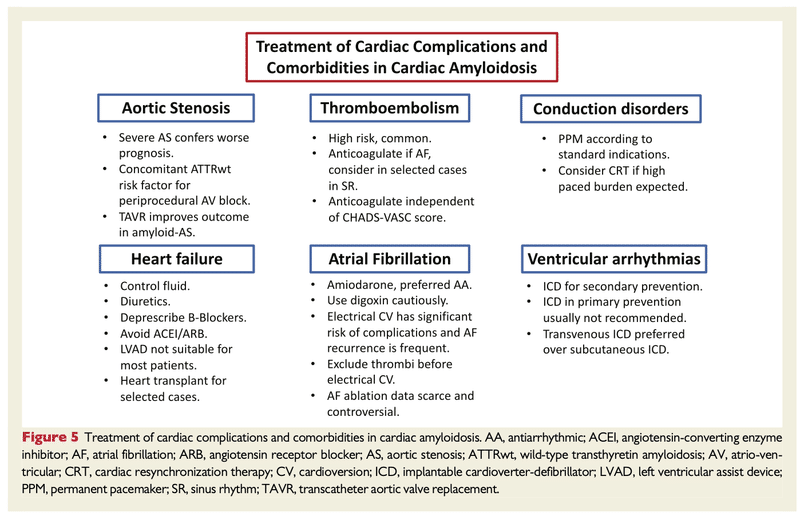
・心アミロイドーシスの現在の治療は、心不全・不整脈の管理とアミロイド前駆体のレベルを下げてアミロイド沈着を遅らせることに焦点を当てている
<心アミロイドーシスの心不全をどう管理すべきか?>
・心アミロイドーシスの患者は体液量の変化に敏感であり、うっ血の緩和と適切な前負荷のバランスを取る必要がある
・ループ利尿薬は、正常体液量を維持するために必要になることがあるが、注意して使用する必要がある
・ACEi/ARBなど後負荷を減少させる薬剤に耐用能がないこともよくある
・β遮断薬は、右心不全と心拍出量低下により、耐用性が低い
・心アミロイドーシスに対する強心薬の役割を支持するデータは乏しく、ジギタリスはアミロイド線維に結合して毒性を高めるため、注意して使用する必要がある
・ジルチアゼムやベラパミルなどのカルシウム遮断薬は、陰性変力作用があるため使用すべきではない
・SGLT-2の役割は不明
<心アミロイドーシスにおける心房細動>
・心房細動は、特にATTR-CM患者では70%に存在すると推測されている
・心アミロイドーシスの診断よりも数年先行することがあり、内科治療やアブレーション治療が難治性を示す可能性がある
・左房血栓の発生率が高いため、CHA2DS2-Vascに関係なく、抗凝固療法を開始すべき
<ALアミロイドーシスの治療>
・重度の心不全を来すALアミロイドーシスでは、診断後6ヶ月で死亡することが多かったが、現在の平均生存期間は5.5年
・治療は、ダラツムマブ(抗CD38)、ボルテゾミブ(プロテオーム阻害薬)、シクロフォスファミド、高用量デキサメサゾン(Dara-CyBorD)の併用療法を行う
・進行した心不全では化学療法に耐えられない可能性がある
・自家幹細胞移植を検討することもできるが、誘導剤への耐性が低いため、適格な患者は20%未満
<ATTRアミロイドーシスの治療>
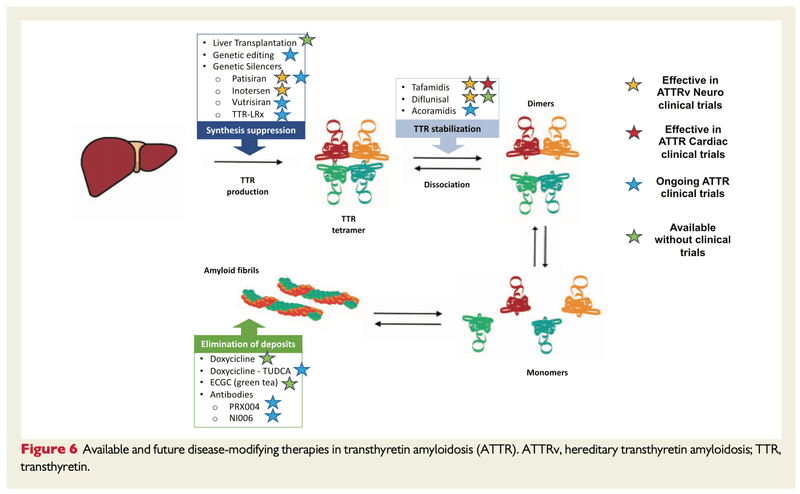
・治療のオプションには、TTRスタビライザー、TTRサイレンサー、TTRディスラプターがある
・タファミジスは、チロキシン結合部位と相互作用する経口低分子TTRスタビライザー
・ATTRwt/ATTRv-CMの治療においてFDAから認可されており、治療開始から18ヶ月ほど死亡率が低下する可能性がある
<心アミロイドーシスの予後>
・全身性アミロイドーシスにおける心アミロイドーシスの合併は、予後の規定因子となる
・歴史的に診断後の生存期間は、ATTRwt-CMで3.6年、ATTRv-CMで2.6年、重度の心不全を持つAL-CMで6ヶ月であった
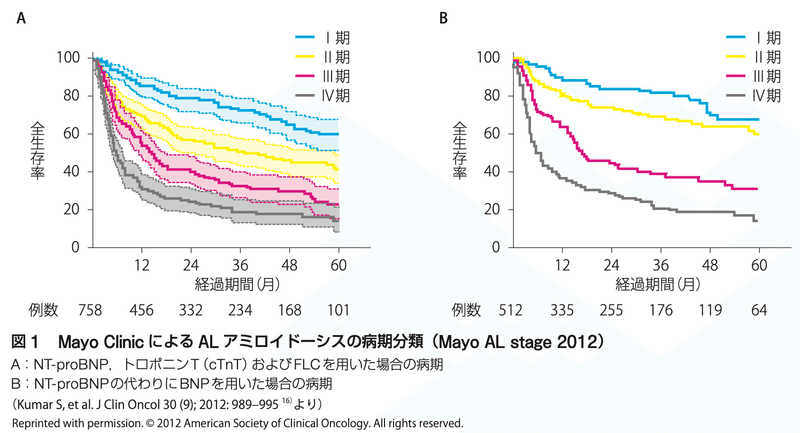
・Mayo Clinicによる病期分類と予後
Mayo AL stage 2012(以下3項目で0-3点で評価)
difference FLC(FLCの差) ≧ 180 mg/L、TnT ≧ 0.025 ng/mL、NT-proBNP ≧ 1,800 pg/mL
Ⅰ期(0点)94.1ヶ月 Ⅱ期(1点)40.3ヶ月 Ⅲ期(2点)14.0ヶ月 Ⅳ期(3点)5.8ヶ月
<ポイント>
・スクリーニングの時点で、他の心筋症との鑑別の意味合いも含めてCMRは施行しておいた方がよさそうです
・心アミロイドーシスの疑いが強いようであれば、感度・特異度共に高いようなので速やかに心筋生検を行うのが診断への近道だと思われます
この記事が気に入ったらサポートをしてみませんか?
