金魚の発生学実験#05 受精卵の観察方法
1.受精卵の観察方法について解説します。
水生動物学研究室主宰の太田欽也です。今回も金魚の発生学の実験方法について解説してゆきます。このNoteは私のYoutube動画のテキスト版です。文章で見たほうが早いと思う方や、確認したい方向けです。でも、動画の方が情報量が多いので、そちらをご覧になることをお勧めします。上の画面をクリックしていただくとみていただけます。
今までの動画で何度か説明してきましたが、金魚の卵は何かにくっつく性質があります。もっと正確に言うと、金魚の卵膜の表面が何かにくっつきやすい性質があります。この性質は便利な点もあるのですが、研究を進める上で問題となる場合があります。なので、我々の研究室では、こうした小道具や試薬を使って、金魚の卵を操作、観察できるようにしております。今回の動画ではこれらの方法について解説します。
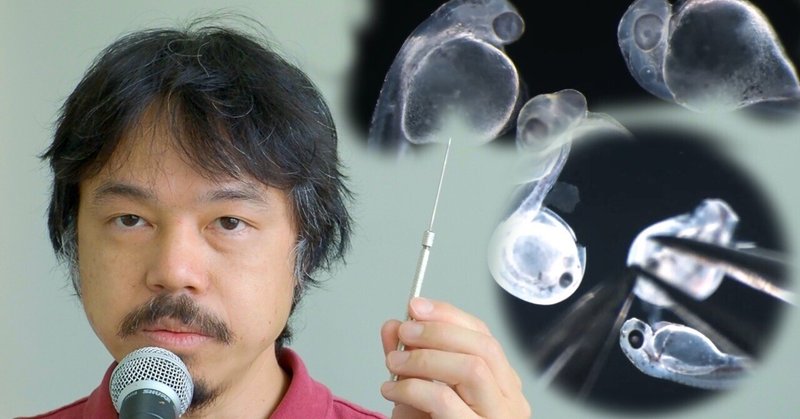
2:タングステンループ
2-1:死んだ卵
健康な金魚の受精卵はこのように透明で、順調に胚発生が進み、やがて孵化します。しかし、中には途中で死んでしまう卵も出てきます。この様に白くなってしまった卵は死んだ卵です。こうした卵を長く放置していると細菌やカビが発生する原因となります。そうなると、元気な卵も水質の悪化やカビの感染で死んでしまいます。なので、速やかに取り除かないといけません。
2-2:死んだ卵の処理
そうした時に、このタングステンのループを使って卵をディッシュから取り外すようにしています。このディッシュはお茶で表面をコートしており、金魚の卵がそれほど強烈にくっつかないようにしております。なので、このように、タングステン線を卵とディッシュの間に持っていってゆっくりと動かしてやると卵はディッシュから外れます。
2-3:胚をディッシュからはがす
そして、このタングステンループは生きた受精卵にも使えます。発生の途中の状態を角度を変えて胚の様子を詳しく観察したい場合などは、先ほどと同様に生きた受精卵とディッシュの間にタングステンループを持っていってゆっくりと引っ張ってあげると剥がれます。
2-4:タングステンループの作り方
さて、このタングステンループは得付き針の柄に、タングステン線で出来たループを取り付けたものです。このツールはちょっと工作が得意な人であれば簡単に作ることができると思いますが…もし、どうしても作り方を知りたいという人がいれば、ご意見ください。
3.卵膜を取り除く
3-1:ピンセットを使う
さて、ディッシュから取り外された受精卵ですが、やはりこのままでは中が見えずらいのですね。なので、どうしてもこの邪魔な卵膜を取り除きたくなってまいります。
そこで、簡単に思いつく方法の一つが物理的に取り去ってしまう方法です。単純に鋭いピンセットで集中して操作して卵膜を取り除くというものです。よく研いだピンセットで卵膜だけをつまんで一部を破ります。そして、破れたところを起点に丁寧に卵膜を取り除いていきます。
3-2:酵素を使う
しかし、この方法だと、たくさんの受精卵の卵膜をとるには非常に時間がかかります。なので、たくさんの受精卵から卵膜を取り除きたいときは酵素、プロネースを使います。はい、このプロネースを使った方法は私たちが独自に考えたものではありません。もともとはゼブラフィッシュの研究者コミュニティーの間でよく使っている方法で、私たちはその方法を参考にさせてもらっているわけです。ちなみに、このゼブラフィッシュは熱帯魚屋さんでもよく見かける丈夫なインド原産の熱帯魚です。金魚と違って上手に飼えば、好きな時に卵が得られますし、卵も透明でお互いにくっつく性質も無いので非常に発生学研究に適した魚です。なので、この生き物を使って研究している研究者が非常に多いので新しい技術がすぐに開発されます。また、金魚もゼブラフィッシュもコイの仲間でいろいろと共通点が多いので、そのまま使える技術も多いんですね。なので、我々も、良くゼブラフィッシュの実験方法を参考にしています。
さて、このプロネースですが。私たちの研究室では粉末の状態で購入してE3バッファーに溶かして使います。ちなみにE3バッファーの組成はこんな感じです。詳しく知りたい方は、Zebrafish, E3, Embryoのキーワードで検索していただけるといろいろとより詳しい情報が見つかるかと思います。もしも、どうしてもこのチャンネルで詳しい方法を説明してほしい方がおられたらコメントくださいね。
そして、先ほどのタングステンループを使って取り外した卵を小さなプラスチックディッシュに移します。このプラスチックディッシュなのですが、そのまま使ってもよいのですが、早い発生段階の受精卵を用いる場合は0.5%前後のアガロース(寒天)を薄く敷いたものを使います。
そして、先ほどのプロネースを入れて、10分ほど待ちます。そうすると、徐々に卵膜が解かされてきます。このように卵膜の一部が溶かされ、胚が出始めたところで、別のディッシュに移します。このディッシュにはプロネースが入っていないE3バッファーが入っています。
そうすると、半分ぐらい卵膜が溶かされた状態で酵素の働きを抑えることができます。あとは、優しくピペットでE3を吹き付けてやり、機械的に卵膜を外します。このE3バッファーの中であれば受精して間もない胚胎でもちゃんと発生が進み観察が続けられます。
4:時計皿に載せて観察
観察しやすいように時計皿の上に載せます。時計皿は真ん中がくぼんでいるので、胚胎は中央に集まります。これで、顕微鏡下での観察や撮影が容易になります。
5:まとめ
はい、これで、金魚の胚を詳しく観察できるようになりました。この方法を用いて我々の研究室から2013年と2019年に、金魚の胚発生過程を記述した論文を発表しております。これらは何度もこのシリーズで紹介してきた論文ですね。なので、今回、解説した胚発生の方法は皆さまがご自身でなさらなくても、これらの論文を見ていただければ胚発生過程の詳細を見ていただくことができます。我々が頑張って撮影した沢山の金魚の胚の写真が載っている論文です。そして、何よりタダでご覧いただけます。なので、もし、詳しい金魚の胚発生に興味のある方はご参考ください。概要欄にリンクを張っておきます。
さて、次回は、孵化仔魚の観察方法について説明していきます。孵化した後の金魚が大きくなるまでの様子を一匹一匹、観察する方法をご説明します。お楽しみに。それではまた。
文献
Tsai, H.-Y., Chang, M., Liu, S.-C., Abe, G. and Ota, K.G. (2013), Embryonic development of goldfish (Carassius auratus): A model for the study of evolutionary change in developmental mechanisms by artificial selection. Dev. Dyn., 242: 1262-1283.
https://doi.org/10.1002/dvdy.24022
Li, I.-J., Chang, C.-J., Liu, S.-C., Abe, G. and Ota, K.G. (2015), Postembryonic staging of wild-type goldfish, with brief reference to skeletal systems. Dev. Dyn., 244: 1485-1518.
https://doi.org/10.1002/dvdy.24340
Li, I.-J., Lee, S.-H., Abe, G. and Ota, K.G. (2019), Embryonic and postembryonic development of the ornamental twin-tail goldfish. Dev Dyn, 248: 251-283. https://doi.org/10.1002/dvdy.15
この記事が気に入ったらサポートをしてみませんか?
