
人気講師ノート9 赤外のスペクトル解析に必要な知識はもうちょっと続きます
前回,赤外吸収スペクトルを考えるうえで大事な式を説明したのち,その式中の変数を変更することで吸収スペクトルのピーク位置が変更することを学びました。
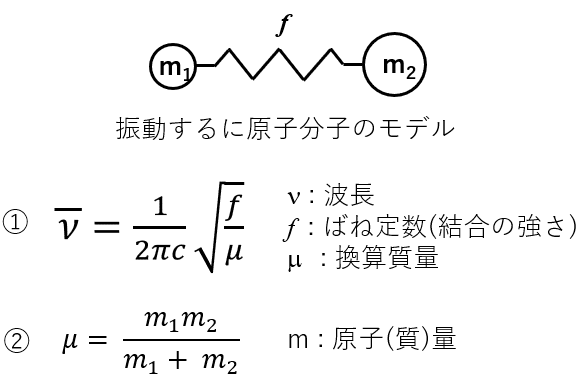
これっす!この①の式は大事だし,その式中の変数を変更することでどうなるかを考える思考の順序がとても大事になります。
前回は,「結合の強さ(f)による効果],「換算質量(μ)による効果」,「水素結合の影響」について解説しました。
本Noteでは,「隣接する官能基(隣接基)の影響」について解説します。
1-1. 隣接基の影響
二原子分子の振動は,隣接する振動から影響を受けます(以下参照)。
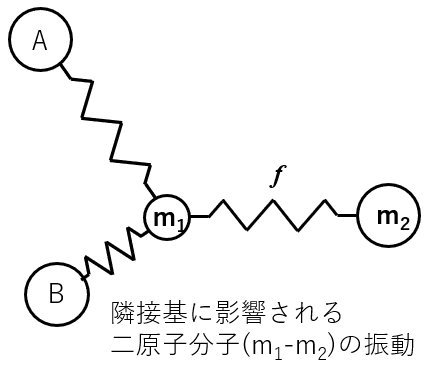
m1とm2の間の振動は,AとBに影響されることが予想されますよね。隣接基による影響の際に,「誘起効果」や「共鳴効果」も一緒に学ぶのですが,誘起や共鳴は,軌道のイメージがないと説明できないので,次のUV-vis編で書いていきますね。
では,「隣接基の影響」についてですが,「綱引き」を使って解説します。
その前に,赤外吸収スペクトルでは必ずといっていいほど説明に使われる分子があります。
アセトン (acetone,propan-2-one)
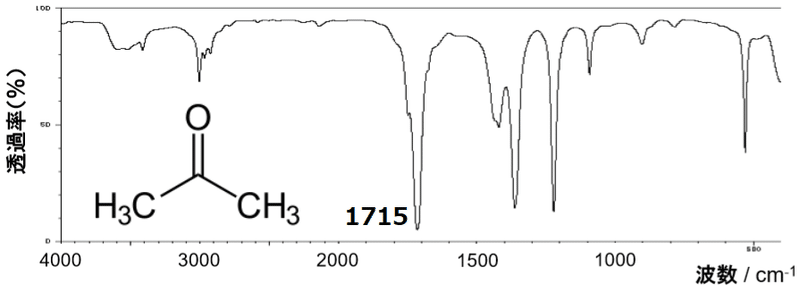
1715cm-1の位置に「C=O基の伸縮振動」が観測されます。
このC=O官能基が,隣接する置換基によってどのように変化するかを考察しましょう。
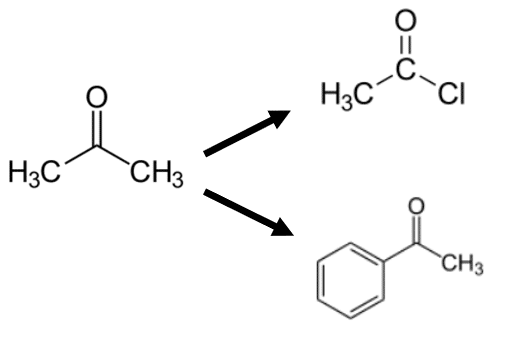
1-2. アセトンから塩化アセチル (CH3基からCl基への変化)
C=O基に隣接する官能基が「CH3からClに変化する」場合,ハロゲン官能基による電気陰性度の違いが表れます。CH3に比べて,電子を引き付ける力が強いCl(塩素)があることで,C=O基の結合電子が影響を受けます。
1.電子を引き付ける力が強いCl(塩素)によって,C=O基のC(炭素)周りの電子が不足する。(実際に減るわけではない)
2.C=O基のC(炭素)はCl(塩素)に減らされた電子(密度)を,C=O基のO(酸素)から補おうとします。つまり,結合距離が短くなります。
3.結果として,C=O基の結合力(f)は強くなると考えられます。
CH3をClに変更することで,結合力(f)が強くなるということは式①から,高波数側にシフトすることが予想されます。以下に,塩化アセチルのFTIRを示します。(出典はSDBS_No1278)
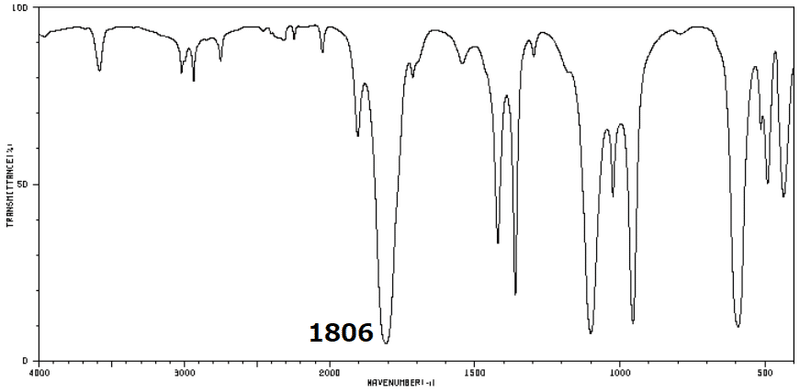
CH3をClに代わることで,C=O伸縮振動は1715cm-1から1806cm-1に高波数シフトしています。
つまり,隣接基に電気陰性度が高い官能基になると高波数シフトします(傾向が高い)。
1-3. アセトンからアセトフェノン (CH3基からC6H5基への変化)
結論から言うと,先ほどの逆です。C6H5は電子(π電子)を豊富に持っており,先ほどの塩素とは逆に電子を与えやすい官能基といえます。
1.電子が豊富なベンゼン環(C6H5)によって,C=O基のC(炭素)周りの電子が豊富になる。(実際に増えるわけではない)
2.C=O基のC(炭素)はベンゼン環(C6H5)に増えた電子(密度)を,C=O基のO(酸素)に供給しようとします。つまり,結合距離が長くなります。
3.結果として,C=O基の結合力(f)は弱くなると考えられます。
CH3をベンゼン環(C6H5)に変更することで,結合力(f)が弱くなるということは式①から,低波数側にシフトすることが予想されます。以下に,アセトフェノンのFTIRを示します。(出典はSDBS_No722)

CH3をベンゼン環(C6H5)になることで,C=O伸縮振動は1715cm-1から1686cm-1に低波数シフトしています。
つまり,隣接基に電子リッチな官能基になると低波数シフトします(傾向が高い)。
本noteは以上です。
これは役に立ちそうだと感じたら,おひねりください。学生に焼肉でもおごります。本ノートの課題は後日に追記します。
ここから先は
¥ 100
学生から大好評だった授業ノートを公開します。役立てていただければ幸いです。また,家でできる実験も書いていきますね。
