血流解析Note
血流解析については、こちらにまとめていきます。
血流解析に挑戦するきっかけ
初めましての方は、ぜひ自己紹介noteからどうぞ。
https://note.com/laphroaig_777/n/n2d6a6b4b48c7#5b8251a3-7977-40a6-a92a-15a0a769fef3
血流解析の存在自体は以前から知ってはいたのですが、2021年1月末にClub houseの医療部屋に参加したことが大きな契機になりました。
当時はClub houseへの招待が1人につき2名までしかできず、参加することがプレミア化していた状態だったのは記憶に新しいです。そんな中で幸運にもいちごろさんに招待いただけることになり、参加できる流れとなりました。
その時に出会ったのがIkeno先生・Onyo先生ら心臓血管の外科医・研究者の方々です。
医療部屋ルームで流体解析の話をしたときに、心臓血管でも血流解析が注目されていることを知り、それならばまずはお互いのことを知ろうということで、論文の読み合わせが始まりました。
しかし、私は医療知識は全然なくて、大動脈の構成はもちろんAortaの読み方すら知らない状態(苦笑)。
論文の読みあわせを通じて、自分は先生たちに流体の基礎知識を、先生たちは自分に心臓血管の基礎知識を相互に与えることになります。私にとっては、医療と工学の当たり前の違いを知ることにかなり役に立ちました。
これをほぼ1年ほど続けましたが、今思うとやって大正解でしたね。
なぜなら、全く分野の違う人間が何かを生み出すとき、双方のバックグラウンドを知らないとプロジェクトが明後日の方向に行ってしまうからです。
今回の取組は、いきなり仕事として始めるのではなくて、雑談から始まったのがよかったのではないかと思っています。ワイガヤ大事。
2021年の後半からはフリーソフト(現在は有料化)で様々な試し計算を実施。「これ論文書けるんじゃない?」という流れになりました。
試し計算のnoteは下記になります。
会社と交渉をして論文作成などの活動が認めてもらったのが、2022年2月。その後の流れは2023.10現在において下記のようになります。
2022.3 第35回日本血管外科学会近畿地方会(Web発表, 共同演者)
2022.10 第75回日本胸部外科学会定期学術集会(ポスター)
2023.1 JTCVS Techniques 論文アクセプト(医療初論文,共著)
Utility of computational fluid dynamics for prediction of efficacy of the surgical interventions for aortic coarctation in adults
https://doi.org/10.1016/j.xjtc.2023.01.007
2023.3 第53回日本心臓血管外科学会学術総会(口頭演題2件, 共同演者)
2023.8 JTCVS Open 論文アクセプト(共著論文)
Computational fluid dynamics simulate optimal design of segmental arteries reattachment: Influence of blood flow stagnation
https://doi.org/10.1016/j.xjon.2023.07.008
2023.8 GTCC 論文アクセプト(共著論文)
Computational fluid dynamics-based prediction of aortic aneurysm rupture in a patient with chronic aortic dissection
https://doi.org/10.1186/s44215-023-00091-w
2023.10 第76回日本胸部外科学会定期学術集会(口頭演題1件, 共同演者)
数値流体力学とは
もしこの章を読んで「ちょっと何言ってるかわからない」と思っても、一緒にタッグを組む先生にはしっかり説明しますので、安心して流し読みしてください。
日本機械学会の機械工学辞典から引用すると、下記となります。
数値流体力学では,まず実在の流れに対して近似あるいは流れモデルを用いて基礎方程式を導き,さらに各種数値スキームを用いて基礎方程式を離散化することによって代数式に表現する.これの式を計算アルゴリズムを用いてコンピュータ上で解析することにより,流れの物理現象を再現する.
日本機械学会. ”数値流体力学(計算流体力学)”. 機械工学辞典. 2017.7.19.
https://www.jsme.or.jp/jsme-medwiki/doku.php?id=09:1006339
(参照2023-10-22)
ChatGPTにも活躍してもらいましょう。
-引用ここから-
数値流体力学(CFD)は、流体の挙動をコンピューターを使ってモデル化し、解析するための方法です。初学者向けに簡単に説明すると、以下のようになります:
CFDは、水、空気、または他の流体の動きを理解し、予測するためにコンピューターシミュレーションを使用する技術です。
流体のモデル化: まず、私たちは興味のある流体(液体または気体)の挙動を数学的にモデル化します。これには、流体の速度、圧力、温度、密度などの特性を考慮します。通常、ナビエ–ストークス方程式と呼ばれる方程式が使用されます。
領域の分割: 次に、流体の流れをシミュレーションする領域を格子に分割します。この格子は、計算を行うための小さなセルや要素から成ります。この格子によって、領域全体が細かい部分に分けられ、それぞれの部分の流体特性を計算することができます。
数値計算: 格子に分割された領域内で、時間にわたる流体の挙動を数値的に計算します。これには、差分方程式や有限要素法など、さまざまな数値手法が使用されます。コンピューターは、各セルや要素の速度、圧力、温度などを更新し、時間が経つにつれて流体の挙動を予測します。
結果の解釈: 計算が完了すると、我々は流体の挙動に関する情報を得ることができます。これには、流体の速度分布、圧力分布、温度分布、流れのパターンなどが含まれます。これらの情報は、工学、気象学、医学、環境科学などのさまざまな分野で役立ちます。
要するに、CFDはコンピューターを使って流体の挙動を予測し、理解するためのツールであり、実世界の問題に対する洞察を提供するために幅広く使用されています。初学者は、数学的な背景やプログラミングスキルが必要ですが、CFDはさまざまな分野で非常に有用なツールです。
(出典: ChatGPT, 2023.10.23)
-引用ここまで-
ちなみに離散化とは、連続なデータを離散(とびとび)なデータに落とすことを意味します。実際の現象は時間・空間共に連続的な変化をしますが、そのままでは計算できないので計算機内で空間を格子で分割します。
例えば、私の共著論文である"Utility of computational fluid dynamics for prediction of efficacy of the surgical interventions for aortic coarctation in adults"のFigure E1.に示されているように、3次元の大動脈モデルは格子に分割されます。分割された格子はセルと呼ばれ、各セルや境界面には速度や圧力などの代表的な値が与えられます。
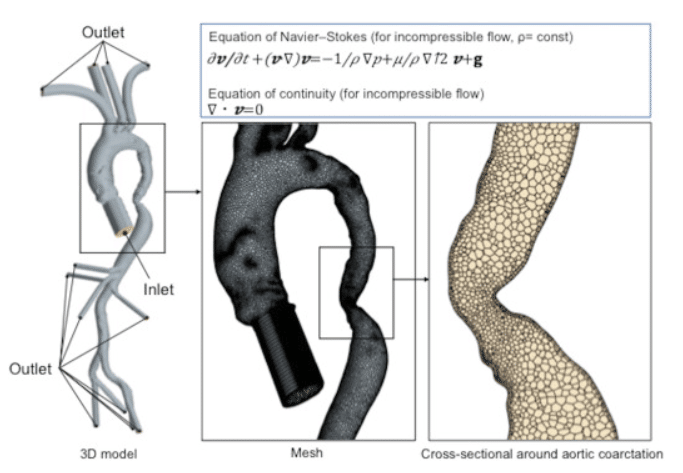
アクセプトされた論文の概要
1.Utility of computational fluid dynamics for prediction of efficacy of the surgical interventions for aortic coarctation in adults
https://doi.org/10.1016/j.xjtc.2023.01.007
CENTRAL MESSAGE
Computational fluid dynamics could predict postoperative energy loss and compare surgical repairs in a patient with coarctation of the descending aorta.
https://doi.org/10.1016/j.xjtc.2023.01.007
大動脈縮窄の患者2ケースそれぞれでエネルギーロスが少ないバイパス手法が異なったことを数値流体力学(Computational Fluid Dynamics)によって示した論文です。
入口境界となる大動脈弁の下流部におけるTotal Pressure(全圧)を比較することで、エネルギーロスを評価しています。下図はその1例です。
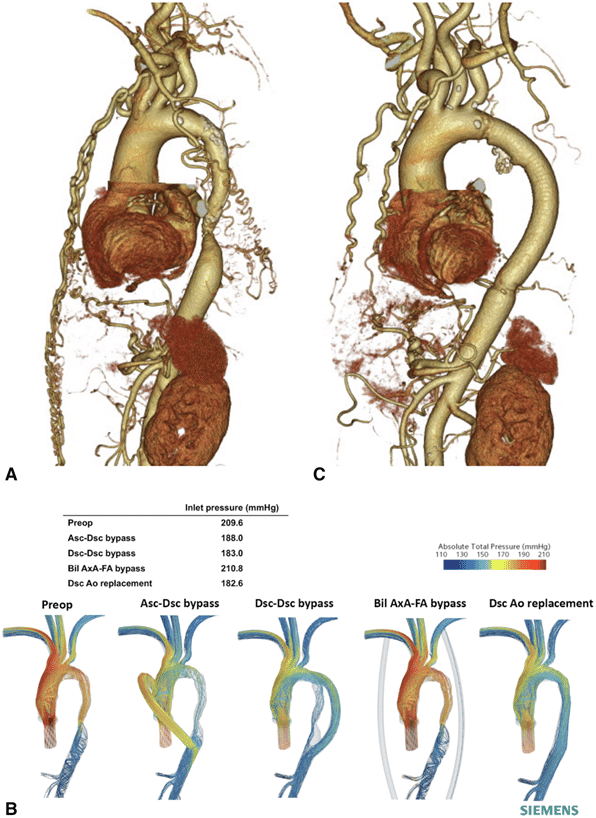
同じ入口・出口形状で途中の形状が異なる条件であることが、今回のシミュレーション視点での論文のポイントになります。
流量条件が同じであるため、全圧が高くなる=血圧が高くなる(心負荷大)を意味するので、これを小さくすることができる形状をチョイスすることになります。
本論文は患者さんの血管形状によって最適な経路が異なる可能性を示唆したものであり、まだまだLimitationはありますが、技術の発展によりオーダーメイド手術が将来可能になったときの礎になる論文の一つになるのではと思います。
ご参考までに、全圧に関する考え方はAPPENDIX E1. METHODS AND CONDITIONS OF CFD ANALYSISに、これでもかというくらい記述しています。
アクセプトされたときのツイートはこちら。Ikeno先生にのっかってます。
CFDを用いた血流解析の共著論文が出ました!CFDの使い所は様々なところにあり、4D-FLOW MRIとの良いとこ取りもできると思っています。
— らふさん@血流解析 (@laf_eng) January 14, 2023
この論文が大動脈のオーダーメイド手術のきっかけの一つになれば嬉しいです! https://t.co/xyXp3MAmiB
こちらは余談ですが、やっぱりこういうのは嬉しいです。
JTCVS techniquesに載るワイの医療系初共著論文、Most Read (Last 30 Days)に載ってた。。沢山の人が読んでくれてるんだなと思ったら、ちょっと感動してしまった🥺
— らふさん@血流解析 (@laf_eng) February 8, 2023
これを日常の風景にできたらいいな。
2.Computational fluid dynamics simulate optimal design of segmental arteries reattachment: Influence of blood flow stagnation
https://doi.org/10.1016/j.xjon.2023.07.008
CENTRAL MESSAGE
Computational fluid dynamics can simulate blood flow stagnation, which is a promising indicator to evaluate optimal design of segmental artery reattachment.
https://doi.org/10.1016/j.xjon.2023.07.008
胸腹部大動脈手術時の最適な肋間動脈再建法とその形状について、数値流体力学(CFD)を用いて明らかにすることを目的とした論文です。
収縮期を模擬した3次元モデルで肋間動脈の血流をシミュレーションし、4群について評価しました。既存の臨床研究に基づいて、解剖学的再建法は最も高い開存率を有し、血流の停滞は開存率と負の相関があると仮定し、CFDにて経時的な血流速度の変化を評価しています。
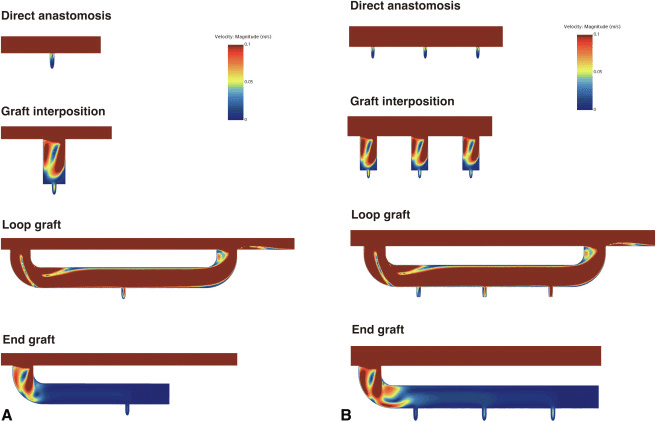
シミュレーションの結果として、解剖学的再建法では低速度領域が最も少なかった一方、エンドグラフトは最も低速域が大きい結果でした。グラフトインターポジションでは細く短いグラフトを使用することが望ましいと考えられ、ループグラフトは折れ曲がり状態により結果が変わることを示唆しています。
シミュレーション視点での論文のポイントは、低速度領域を時系列に抽出したことです。本論文では低速度領域の基準は血液のずり速度が下がったときに粘度が劇的に上昇し始めるポイントをしきい値に定めましたが、ずり速度と粘度は文献によってばらつきがあります。
そのため、しきい値の考え方、決め方については今後も議論の余地があると思います。しかし、しきい値の変更で定性的な逆転まで起きるかというとそれは考えにくく、大凡は形状要因で整理できるのではないかと現時点では考えています。
本筋からは外れますが、この論文は開存率に関するクリニカルデータを新たに提示したわけではなく、CFDのみの論文で(最後は姉妹誌のOpenにトランスファーされてしまいましたが)JTCVSに出せるポテンシャルを見いだせたのは個人的にとても大きかったです。
この論文がアクセプトされたことは非常に大きいです。なぜなら、メソッドと結果は流体解析だけで構成されているからです。
— らふさん@血流解析 (@laf_eng) July 14, 2023
つまり、クリニカルデータを含めた仮説検証と、メソッド・結果・考察がしっかりと噛み合えば、流体解析だけでここまでいけるということ。 https://t.co/lvC4Et4J7C
3.Computational fluid dynamics-based prediction of aortic aneurysm rupture in a patient with chronic aortic dissection
https://doi.org/10.1186/s44215-023-00091-w
Conclusions
CFD could retrospectively predict a significant postoperative increase in false lumen pressure and WSS of chronic dissections after TAR, potentially leading to aneurysm rupture, virtual simulation of elephant trunk insertion might be able to reduce false lumen pressure and WSS, and CFD may provide helpful information for decision-making regarding the optimal timing and procedure.
https://doi.org/10.1186/s44215-023-00091-w
本論文は、弓部置換術後の慢性解離の術後における偽腔圧と壁面せん断応力(WSS)の有意な上昇をレトロスペクティブに予測することができ、術後の流れ方向の変化によっては小さな動脈瘤であっても動脈瘤の破裂につながる可能性があることを示唆した論文です。
まだ末梢血管抵抗や血管弾性などを考慮できていないLimitationはあるものの、患者特有の形状からなるCFDの所見は破裂前の早期介入を促進できる可能性があり、動脈瘤の直径、面積、偽腔の状態などの形態学的特徴に加えて、流体力学的な要素も考慮すべき可能性を示しています。
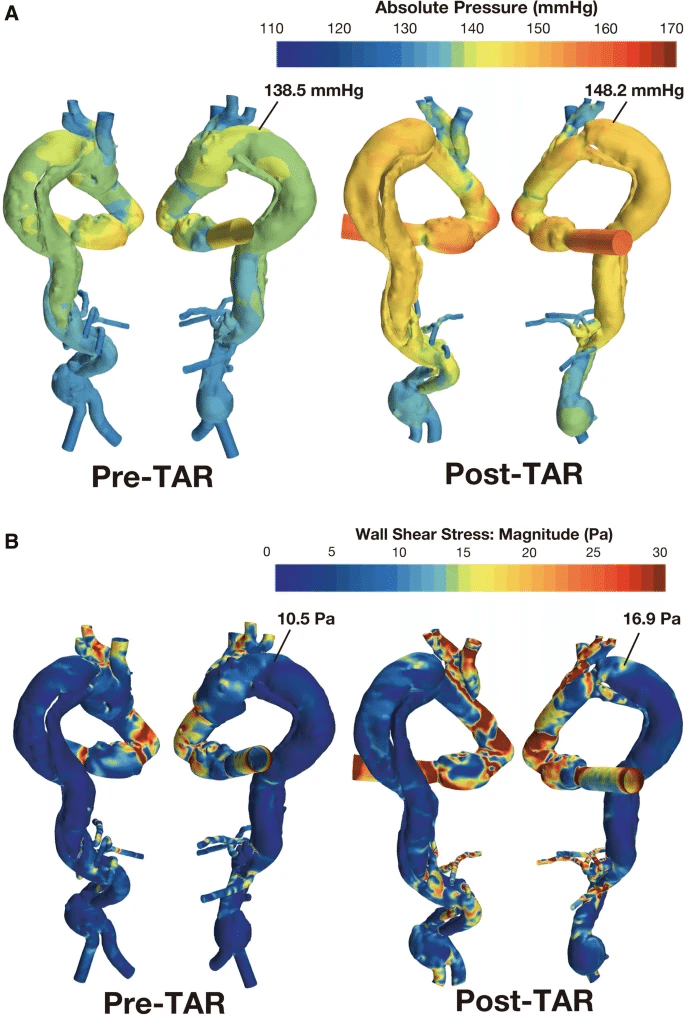
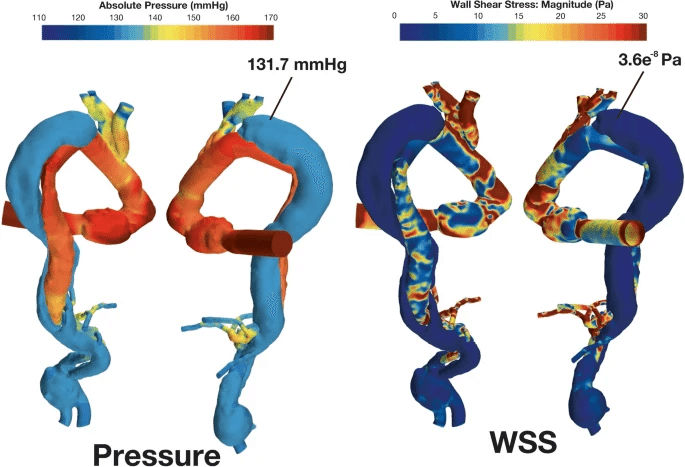
シミュレーション視点での論文のポイントは、巷でよく使われるWall Share Stress(壁面のせん断応力)だけでなく、壁面に対して垂直にかかるPressure(圧力)を分析に加えたことです。この症例報告では、圧力とWSSのカットオフ値は示されていませんが、術前パラメータと比較すると、術後の圧とWSSの上昇は動脈瘤破裂の危険因子となりうると考えたからです。
また、この論文ではElephant trunkを入れたらどうなったかという仮想の計算も実施しています。シミュレーションの結果として、偽腔圧とWSSが下がっています。
アクセプトされたときのツイートはこちら。
瘤を押す力(Pressure)と擦る力(Wall Shear Stress)が血流の向きによって、大きく変わりうる現象を可視化しました。各患者さんに合わせた術式検討のポテンシャルをこの論文で示せたと思います。立て続け論文アクセプトは嬉しい! https://t.co/FZ7HRDa3ke
— らふさん@血流解析 (@laf_eng) July 19, 2023
まだまだLimitationはありますが、さらなる技術発展により、CFDは術前予測にも使えるようになってくるのではと思います。
もし、血流解析のご相談があれば、下記からお気軽にご連絡ください。何ができそうか、一緒に考えていきたいと思います。
この記事が気に入ったらサポートをしてみませんか?
