炎症性腸疾患における病原体: 炎症性腸疾患における病原体:起源、基礎メカニズム、および臨床ケアへの影響
メインコンテンツへスキップ
消化器内科
ログイン
検索
基礎および臨床消化器病学および肝臓病学のレビュー|166巻、1号、p44-58、2024年1月
全号ダウンロード
炎症性腸疾患における病原体: 炎症性腸疾患における病原体:起源、基礎メカニズム、および臨床ケアへの影響
https://www.gastrojournal.org/article/S0016-5085(23)05010-2/fulltext
アシュリー・ギランド
ジョセリン・J・チャン
トラビス・J・デ・ウルフ
ヤン・ヒョンジュン
ブルース・A・バランス
オープンアクセス掲載:2023年9月19日DOI:https://doi.org/10.1053/j.gastro.2023.09.019
PlumXメトリクス
腸内細菌叢は、炎症性腸疾患(IBD)、すなわちクローン病(CD)と潰瘍性大腸炎(UC)の両方の病態において重要な役割を果たしている。腸内細菌叢の異常や有益な微生物種の消失がIBDを悪化させることを示唆する証拠はあるが、多くの新しい研究により、IBD患者の腸内に「病原性微生物」と呼ばれる病原性を持つ微生物が同定されている。病原性微生物がIBDを発症させる、あるいは慢性化させるという概念は、主にCDにおいて付着性の侵入性大腸菌がIBDを悪化させるという役割に焦点を当ててきた。しかし、最近の研究では、CDやUC患者におけるその他の細菌や真菌の病原体が同定されている。本総説では、これらの病原細菌の特徴とIBD治療への影響を明らかにする。CD患者におけるクリーピングファット(Clostridium innocuum)や創傷治癒障害(Debaryomyces hansenii)、UC重症度のバイオマーカーとして見られる糞便タンパク質分解活性の亢進(Bacteroides vulgatus)などである。最後に、現在のIBD治療に対する病原性細菌の潜在的影響と、現在開発の初期段階にある病原性細菌を標的としたいくつかの新しいアプローチについて検討する。IBDの病態形成に病原因子が関与している可能性は高いが、その作用機序を明らかにするためにはさらなる研究が必要である。病原性因子と特定の疾患特性との間に因果関係が存在するかどうかを明らかにすることは、患者、特に現在のIBD治療が奏効しない患者に対する治療を改善する道を開く可能性がある。
キーワード
クローン病
炎症性腸疾患
病原体
潰瘍性大腸炎
本稿で使用した略語:
AIEC(adherent-invasive Escherichia coli)、CD(クローン病)、DAEC(diffusely adherent Escherichia coli)、ExPEC(extraintestinal pathogenic Escherichia coli)、FMT(fecal microbiota transplantation)、 H2S(硫化水素)、IBD(炎症性腸疾患)、IEC(腸上皮細胞)、Ig(免疫グロブリン)、IL(インターロイキン)、MAT(腸間膜脂肪組織)、TNF-α(腫瘍壊死因子α)、UC(潰瘍性大腸炎)
炎症性腸疾患(IBD;クローン病[CD]および潰瘍性大腸炎[UC])の罹患率は、ほとんどの先進国で増加している1。IBDの病因は複雑であるが、腸内細菌を含む有害な環境刺激に曝された後、遺伝的に感受性の高い個体で発症する免疫調節異常を反映していると考えられている。ゲノムワイド関連研究により、200以上のIBD遺伝子2,3(例えば、NOD2、ATG16L1)が同定されており、その多くは、オートファジー、酸化ストレス、上皮バリアー、パネス細胞や免疫細胞の機能など、侵入微生物を制御または排除することを目的とした宿主プロセスの根底にある重要なタンパク質をコードしている4,5。興味深いことに、腸内病原体による急性感染の既往とそれに関連する抗生物質への暴露は、IBDの危険因子であることが繰り返し示されている6。
腸内細菌異常症と炎症
腸内細菌異常症は、IBDの特徴として確立されている7,8。以前は、「環境および宿主関連因子によって引き起こされる微生物叢の組成的および機能的変化」と定義されていたが、炎症、感染、遺伝、食習慣などの要因によって引き起こされ、一般的に、有益微生物の減少、潜在的に病原性のある微生物の大発生、微生物多様性の全体的な喪失のうち1つ以上を特徴とする9,10。このような特徴はIBD患者の微生物叢にしばしば見られるが、腸の炎症と同時に起こる微生物異常症の双方向性については、最近になってようやく調査されるようになった。歴史的に、多くの研究がコホート解析のために患者を集め、健常対照と比較して腸内細菌叢の変化を同定しており、微生物多様性の減少や時間的・組成的変動性の増加を示している。これらの研究のほとんどは、炎症部位と非炎症部位との間で微生物分類群に有意差(例えば、腸内細菌科とバクテロイデス属の増加、またはファーミキューテス属の減少)を同定したが、同定された特定の分類群は、研究間や同一研究内の患者間で異なっていた13,15、 16, 17 これらの過去のIBDマイクロバイオーム研究の限界には、微生物叢の研究に関連する固有の複雑さ9(微生物叢の組成、機能性、微生物間の相互作用、宿主因子の考慮など)にもかかわらず、属レベルを超えることはほとんどない比較的浅い配列決定深度やコホート規模の小ささなどがある。これらの限界にもかかわらず、これらの所見は、微生物叢組成の違いが患者特異的であることを示しており、CDやUCに対して同定された単一の細菌はなく、多様な微生物叢のメンバーが疾患の進行を促進しうるという考えを裏付けている。
原因か副産物か?
IBD患者において、炎症と微生物叢異常が共存していることは明らかであるが、微生物叢異常がIBDの原因であるのか、それとも単に炎症の副産物であるのかを調べることは困難であった。プロスペクティブ・コホート研究は、実施するのが難しいことで有名である。しかし、最近の研究では、クローン病・大腸炎カナダ遺伝環境微生物プロジェクトが収集した、現在健康なCD患者の第一度近親者のサンプルを用いて、将来のCD発症に関連する主要な微生物分類群を同定した18。機械学習を用いて、CDを発症した70人の患者(全参加者3483人のうち)についてマイクロバイオームリスクスコアが作成され、CD発症の予測因子としてRuminococcus torquesとBlautia(いずれもムチン分解菌)、Colidextribacter、Oscillospiraceae、Roseburiaが同定された18。さらに、細菌のタンパク質分解活性の上昇を含む機能的な微生物叢の変化が、後にUCを発症した健常人において以前に同定されている19。これらの先駆的な研究は、リスクのあるグループにおける発症前の微生物叢の変化や、疾患の自然な進行全体を通しての微生物叢の変化を追跡する、将来の縦断的研究の足がかりとなる。このような情報は、IBD発症に関与する可能性のある重要な移行段階や微生物叢のメンバーを特定するのに役立つであろう。
多くの動物実験で、腸の炎症が腸内細菌叢の異常を促進し、腸内細菌叢の異常が炎症を悪化させることが示されている。たとえそうであっても、微生物異常症は、細菌と宿主の相互作用が複雑に絡み合って生じたものであり、その病態やベースラインの微生物叢によって患者間で異なる可能性が高い。ある一般的な仮説によると、腸内細菌叢の異常や炎症などのIBDの進行は、有益な常在菌24やその代謝産物(短鎖脂肪酸の酪酸を含む)の減少によって促進されると考えられている25。酪酸レベルの低下は、大腸細胞の代謝を酸化的リン酸化から解糖へとシフトさせ、内腔の酸素レベルを上昇させ、厳密な嫌気性菌の減少を加速させる25。これに対応して、大腸菌を含む通性嫌気性常在菌は、この酸素の豊富な環境を生き延び、空いたニッチを占領し、栄養を獲得し、数を増やすことができることがわかっている25,26。
病原体: 原型としての付着性侵入性大腸菌
常在性大腸菌のほかにも、IBD患者の腸内で増殖する、あるいは炎症に関与する可能性のある微生物が存在する。これらの微生物は「病原性微生物」と呼ばれ、IBDの発症や悪化に関与していると考えられている27。「病原性微生物」という用語は、2008年にヘリコバクター・ヘパティカス(Helicobacter hepaticus)に関する研究で初めて導入され、病原性を有する腸内常在菌と定義された28。この最初の定義を拡大し、多様な病原性細菌の機能メカニズムを説明するために、29, 30, 31, 32では、「IBD病原性細菌」を、病原性やニッチ探索傾向によってIBDを引き起こしたり悪化させたりする常在微生物として定義する。最初に同定され、最もよく特徴付けられているIBD病原体は、付着浸潤性大腸菌(AIEC)である。1998年にCD患者の炎症回腸粘膜から初めて単離された33が、これらの細菌は遺伝的に多様であり、遺伝子マーカーよりもむしろその機能(浸潤など)に基づいて特徴づけられ、毒素やその他の病原性因子を多様に発現する。AIECのLF82株は、そのアドヘシンFimHを用いて、レセプターcarcinoembryonic antigen-related cell adhesion molecule 6を発現する腸管上皮細胞(IEC)に接着する34,35。carcinoembryonic antigen-related cell adhesion molecule 6の発現は炎症によってアップレギュレートされるため、このことはAIECが粘膜の炎症部位に優先的に接着することを説明できるかもしれない。さらに、LF82はマクロファージを含む宿主細胞内で生存し、炎症性サイトカインの放出を誘発する36。最近、他の大腸菌株と比較して、AIECの浸潤がマウスの炎症レベルや大腸炎の増強と相関することが判明し、AIEC株が実際に腸の炎症に原因的な役割を果たしている可能性が示唆された37。最近、AIECのFimHアドヘシン阻害に成功したことから、病原体を同定して標的化することが、将来的にIBD症状の治療に有効であることが示唆された38。
AIECの研究はIBDの病原体に関する現在の理解を深めるのに役立っているが、これらの微生物についてはすでに過去の総説で十分説明されている。微生物異常や炎症などの擾乱状態下では、これらの病原体は、新たなニッチを探し求め、病原性因子を発現し、あるいは炎症性表面構造や代謝産物を産生することによって宿主の病態を変化させ、病気の重症度を悪化させる可能性がある。病原体の起源、疾患病態に関連するメカニズム、潜在的な病原体間相互作用、および想定される治療法を取り上げることにより、いくつかの病原体がIBDの発症、重症度、慢性化に積極的な役割を果たしている可能性があり、それらの作用が治療不成功例や頻繁な再発の根底にある可能性があるという概念を強調する。
IBD病原細菌の発生源の特定
腸内細菌叢
ヒトの腸内細菌叢はIBD病原体の最も顕著な供給源である。これらの病原因子は健常人の微生物叢44, 45, 46の中に存在し、検出可能な疾患を引き起こすことなく生息していることから、病原因子の病原性を決定する上で腸内環境が最も大きな役割を果たしていることが示唆される。腸内環境が乱れると9、常在菌と環境とのバランスが崩れ、病原性微生物の増殖や有害な代謝副産物の産生、病原性因子の発現が助長される可能性がある。炎症は、大腸菌の大発生における役割と同様に、病原性細菌の出現と拡大の基盤となる環境擾乱の顕著な原因である可能性が高い9,26。しかし、IBD発症時に微生物異常が炎症に先行している場合18には、病原性細菌の作用または拡大が微生物異常の炎症促進作用の根底にあるという仮説が成り立つが、これについては調査が必要である。
垂直伝播
腸内細菌叢がIBDの最も重要な環境要因であることは間違いないが、腸内細菌は遺伝的要因48に基づくか、垂直伝播49,50によっても遺伝する47ことに留意しなければならない。乳児のマイクロバイオームは母親のマイクロバイオームに強く影響されることが知られており49,51、小児がIBDと診断される年齢が若くなる一方で、以前よりも症状が重くなっている24,52、このことは、マイクロバイオータの家族伝播または周産期伝播による病原性微生物の獲得を反映している可能性がある。2019年の研究では、IBDの母親は細菌の多様性が低く、組成が変化しており、それは乳児の便からも検出された49。機能的な影響を評価したところ、IBDの母親と乳児の便から得た微生物叢は、レシピエントである無菌マウスの適応免疫系に不均衡を引き起こした。大腸辺縁前膜の細胞は、クラススイッチメモリーB細胞、免疫グロブリン(Ig)A+ B細胞、制御性T細胞(母親の便のみ)の減少を示した49。
また、垂直伝播の裏付けとして、IBDの母親から生まれた乳児では糞便カルプロテクチン値が上昇していることが判明しており、これは、微生物叢の組成の変化と相関して、低レベルの炎症が生後早期に経験されることを示唆している50。これらの概念をIBDの病態伝播に拡張すると、マウスを用いた研究で、AIECの母体から新生児への垂直伝播により、AIECでコロニー形成された成体マウスと比較して、大腸炎感受性が上昇することが示された53。現在、進行中の臨床試験では、その後のIBDリスクを判定するために、母体から新生児への子宮内細菌伝播を調査している(ClinicalTrials.gov Identifier: NCT03116568)。微生物や潜在的な病原体は遺伝することがわかっているが、病原体が乳児の垂直伝播によって獲得され、IBDの発症を促進する可能性があるかどうかを調べるには、ヒトを対象とした大規模で注意深い対照試験が必要である。病気の親からの伝播は家族にとって困難な概念であるため、有効な介入方法が確立されるまでは、慎重に議論する必要がある。
口腔微生物叢
54、55、56、57、58 口腔内常在微生物叢のひとつであるAtopobium parvulumは、腸に定着し、硫化水素(H2S)産生を介して大腸炎を悪化させる可能性があり、その存在は患者のCD重症度を示す31。あるいは、歯周炎59と抗生物質の使用60は、いずれも口腔粘膜から腸粘膜へのKlebsiella/Enterobacter種の移行を促進し、マウスの腸炎を引き起こす可能性がある。
宿主内進化
宿主内進化32,61により、病原性細菌も時間をかけて発生する可能性がある。マウスでは、病原性腸球菌Enterococcus gallinarumが宿主内で進化し、粘膜環境に適応して他の臓器に移行することがわかった32。さらに、腸内病原細菌Clostridium innocuumの異なる系統が、CD患者において周囲の脂肪組織に優先的に生息するように適応していることが判明した30。このように、IBDのような慢性炎症状態は、炎症腸内に優先的に定着し、炎症腸内環境の維持に役立つ病原細菌を含むディスバイオティック微生物叢の進化を促進する可能性がある。しかし、このことを確認するには、疾患活動期と寛解期の微生物の安定性を調べた先行研究と同様に、患者内の特定の微生物叢メンバーが経時的に変化するかどうかを縦断的に調査する必要がある14。このような微生物の変化の評価には、微生物叢の組成と機能性を把握するためのメタゲノム解析とメタボローム解析を含める必要があり、その結果、宿主の健康と疾患の状態に重大な影響を及ぼす可能性のある微妙な進化(すなわち菌株)の変化に関する知見が得られる。
病原微生物とクローン病
クロストリジウム菌
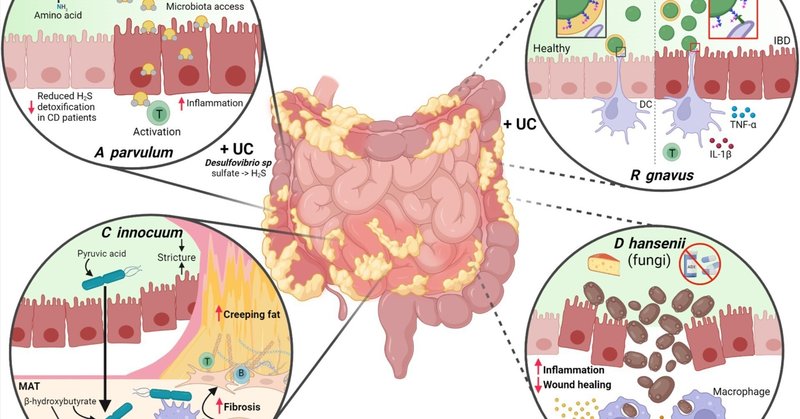
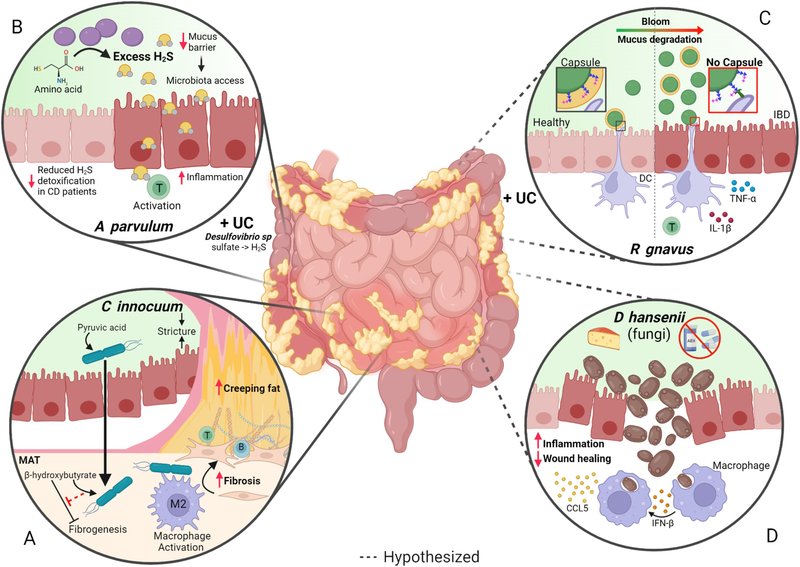
クローン病は、しばしば小腸に生じる経粘膜的な炎症性病変で知られ、腸間膜脂肪組織(MAT)が炎症を起こした腸を包み込むように拡張するクリーピングファットなどの重篤な合併症を引き起こす。クリーピングファットは細菌の腸外への移行を防ごうとする局所的な試みとして生じる可能性が高いが、クリーピングファットが長期化し重症化すると、腸の線維化や狭窄を引き起こし、手術が必要となる最も一般的なCD合併症となる。2020年の研究において、CD患者のMATから5種の生菌が分離され、C innocuumが最も多かった30。C innocuumは腸管外感染症や抗生物質関連下痢症を引き起こすことが知られている63、 64, 65 興味深いことに、これらのMAT分離株は管腔株とは機能的にも遺伝学的にも異なっており、脂質とβ-ヒドロキシ酪酸を代謝するように適応しているように見えた。これは組織のリモデリングを直接引き起こすのではなく、M2マクロファージの動員を促進し、MATを拡大した(図1A)。このように、C innocuumは腸管内腔の競争的環境から逃れようとする努力に呼応して、免疫系を活性化し、MATを拡大させて腸を包み込み、細菌のさらなる移動を防いでいるようである。これらの知見に続き、IBD患者90人を対象としたレトロスペクティブ研究で、C innocuumの存在は腹腔内膿瘍の発生頻度の低下と関連していることが明らかになった66。この微生物は抗生物質耐性65であり、従来の培養技術や市販のキットでは容易に同定できないため、下痢を繰り返すIBD患者が典型的な病原体のスクリーニングを受ける際に「レーダーの下をくぐって」しまい、その結果、局所免疫系を変調させる時間を与え、クリーピングファットのような合併症を引き起こす可能性がある。クリーピングファットの発生にC innocuumや他の微生物が関与していることを確認するためには、コホート研究や前向き研究が必要であるが、これらの研究は原理を証明するものであり、CDにおける微生物病原の機序を浮き彫りにするものであり、さらなる研究が必要である。
図のサムネイルgr1
図1CDを促進する可能性のある病原微生物による多様なメカニズム。(A) C innocuumは回腸内腔からMATに移動し、そこでピルビン酸の代わりに脂肪細胞から産生されるβ-ヒドロキシブトリン酸を利用する。(B)パルビュラムは硫黄含有アミノ酸を発酵させ、過剰なH2Sを産生する。その結果、粘液中のジスルフィド結合が減少し、微生物群が上皮層にアクセスできるようになり、T細胞が活性化して炎症が引き起こされる31,70,72。これは、硫酸塩を還元することで高レベルのH2Sを産生する、以前にUC患者の病原細菌として報告されたデスルホビブリオ種の作用とは異なる67,69 (C) R gnavusは一般的な腸内常在菌であるが、CD患者では株の変異が大きく、粘液分解が亢進する結果、大発生する77。カプセルを持たず、炎症性多糖類を保有するR gnavus種は、樹状細胞との相互作用を通じて炎症反応を誘導することができる。赤の矢印は、病原体の作用機序から効果が増加するか減少するかを示す。破線は、他の研究グループやより大規模なコホート/患者研究によってさらなる検証が必要な仮説的メカニズムを示す。DCは樹状細胞、TはT細胞。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
アトポビウム・パルビュラム
病原体や日和見微生物は毒素やその他の病原性因子を産生することが多いが、病原体はその代謝産物のために腸内環境が乱れた場合に疾患の重症度を悪化させることもある。その例として、H2S産生菌が挙げられ、その相対的な存在量からCDの重症度が予測できるとされている31(図1B)。通常口腔内に存在する寄生虫は、新規発症のCD31を有する小児患者に見られるH2S産生菌の中心的なネットワークハブとして同定された。寄生虫は硫酸を還元するのではなく、アミノ酸発酵を介してH2Sを産生する(すなわち、UCに関連するDesulfovibrio種)。 31,67,68,69に感受性の高いインターロイキン(IL)-10欠損(-/-)マウスにA parvulumを経口投与すると膵炎が誘発されたが、これは常在腸内細菌叢が存在する場合に限られたことから、A parvulumは単独では疾患を誘発しないことが示唆された31。さらに、H2Sスカベンジャーとして知られるビスマス(III)-サリチル酸塩は、アトポビウム誘発大腸炎を緩和した。これまでの研究から、H2Sの産生は粘液層のS-S結合の分裂を引き起こし、常在微生物により分解されやすくなることが示されている70。注目すべきことに、過剰なH2Sは、CD患者31の大腸組織におけるH2S解毒酵素のミトコンドリア発現の減少、ラットモデル71における炎症関連遺伝子の発現の増加、in vitroにおけるT細胞の活性化の増加と相関している72,73(図1B)。最近、2つのA parvulumシステイン脱硫酵素(ApSufSとApcsdB)の特徴が明らかにされ74、腸内の過剰なH2S産生が影響するCD患者において、これらの酵素が治療標的となる可能性が高まった。
ルミノコッカス(Ruminococcus gnavus
2つの独立したコホートにおいて、R gnavusは20人中8人、86人中26人で開花し、CD患者の腸内細菌叢を支配しているとして、発現量の異なる種の中で際立っていることが示された。IBD患者から分離されたR gnavus株は、粘液77, 78, 79および細胞外マトリックスを分解することが示されており80、腸管粘液層を分解することによって疾患を促進し、粘膜保護を低下させる可能性が示唆されている。IgG結合をin vitroで調べたところ、IBDでない対照群と比較して、CDの小児患者から分離されたルミノコッカス属が有利であり、CDに関連した分離株はより大きな浸潤性を示すことがわかった81。コホート研究における検証が必要であるが、Clardyの研究室は、R gnavusの細胞表面からの炎症性多糖類が、培養樹状細胞から炎症性サイトカインである腫瘍壊死因子α(TNF-α)の発現を誘導することを示した82(図1C)。このことは、カプセルが炎症性多糖類と宿主細胞との相互作用を阻害していることを示唆している83。これらを総合すると、存在するRグナバスの菌株によっては、腸内におけるその開花が患者の健康にとって取るに足らないものであったり、逆に有害なものであったりする可能性がある。したがって、マウスモデルを用いてCD患者におけるRグナバスのブルームの原因を調べることは、RグナバスがCDに見られる炎症に寄与しているという現在の仮説を支持する可能性がある。Rグナバスは、IBD症状に関連する病原体を特定するには、もはや菌種レベルの同定では不十分であり、大腸菌以外の細菌種も、その遺伝子型によって疾患の後遺症に変化をもたらす可能性があることを強調している。重要なことは、このような菌株を将来的に区別することが、効果的な介入法の開発に不可欠であるということである。
デバリオマイセス・ハンセニー(真菌類)
IBDの病原微生物として同定されたのは細菌だけではない。最近になって腸内マイコバイオームの特徴が明らかにされ始めたが、真菌の病原体であるDebaryomyces hansenii(別名Candida famata)が最近CD84患者の粘膜治癒障害と関連づけられた(図1D)。D hanseniiは食肉やチーズ産業で表面の熟成を促進するために使用されている。D hanseniiの存在は、大腸炎モデルマウスにおいて、局所マクロファージからインターフェロンβと炎症性サイトカインCCL5を放出させることにより、粘膜治癒を障害することが報告されている84。一般的な真菌の一種であるD hanseniiは、CD患者の一部にみられる粘膜治癒障害の原因となっている可能性があるが、最近の研究では、D hanseniiの個体数が健常対照群と比べて減少している可能性があるなど、当初の臨床所見を再現することができなかったため、さらなる研究が必要である85。
病原体と潰瘍性大腸炎
大腸菌
潰瘍性大腸炎の病原因子には、びまん性付着性大腸菌(DAEC)86や腸管外病原性大腸菌(ExPEC)など、いくつかの大腸菌株が含まれる。興味深いことに、DAECは1998年にCD患者の炎症性回腸組織から分離され、AIEC LF82と同定されたが、DAECは最近までほとんど注目されていなかった。非定型腸管病原性大腸菌は最近、UC患者の疾患活動性とも関連した。91 UC患者からの分離株は病原因子EspVを発現するのに対し、EspG2を発現する株はCD患者からのみ培養されたことから、非定型腸管病原性大腸菌の株はIBDタイプに特異性を示した。以上のことから、病原性大腸菌はCDとUCの両方の病原性候補である可能性が高いことが明らかになった。今後の研究では、複数の異なる病原性大腸菌株が同一個体にどの程度までコロニー形成しているかを調べる必要がある。なぜなら、これらの菌株間の相乗作用がIBDの増強の根底にある可能性があるからである。
図サムネイルgr2
図2UC患者における病原性大腸菌は炎症を促進する可能性がある。(A)ExPECに分類される大腸菌株は、IEC接着のためのFimHや、IECのタイトジャンクションを破壊して樹状細胞(DC)の死と炎症を引き起こすα-ヘモリシンなど、病原性を示す可能性のある遺伝子を保有している87,88 (B)腸内常在菌のB(Phocaeicola)vulgatusは、腸管透過性を亢進させるプロテアーゼやエラスターゼを分泌し、UCの重症度と相関するため、患者のバイオマーカーとして作用する19,97。さらに、ompAという遺伝子の変異は、in vitroでの細胞接着を増加させるため、感受性の高い患者では病原性を悪化させる可能性がある。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
バクテロイデス属
UCの病因に関与しているもう1つの微生物はBacteroides vulgatus(Phocaeicola vulgatusとして再分類)である。最近、プロバイオティクスの可能性が示唆されているが92,93、歴史的には、B vulgatusを含むBacteroides属はUC患者の大腸粘膜微生物叢に非常に多く存在し、B vulgatusの外膜タンパク質OmpAに対する血清抗体価が高い患者もいた94,95(図2B)。最近、研究者らは、臨床的に活動性のUC患者の2つのコホートにおいて、プロテアーゼを産生するB vulgatusが多く存在することを発見し、これらの微生物はマウスにおいて腸管透過性を増加させ、大腸炎を誘発することが示された97(図2B)。著者らは、バクテロイデス属から分泌されるプロテアーゼがUCの主要な促進因子であるという仮説を立て、ジペプチジルペプチダーゼがこれらのバクテロイデス属に豊富に存在し、UCの疾患活動性と高い相関があることを見出した。この仮説は、IL-10-/-無菌マウスに移植されたUC患者由来の(そしてプロテアーゼを豊富に含む)糞便サンプルが明白な大腸炎を引き起こす一方で、プロテアーゼ阻害カクテルを投与したマウスでは大腸炎が顕著に抑制されたことからも支持された97。この研究は、最終的にUCを発症した健常人のコホートにおいて、糞便中のタンパク質分解活性とエラスターゼ活性の上昇を発見するために使用されたマルチオミクスアプローチに基づいている19。このタンパク質分解活性は、B vulgatusを含む特定の分類群と直接相関し、微生物叢のタンパク質分解表現型をマウスに移植することに成功した。さらに、メタ・トランスクリプトミクスデータの解析から、B vulgatusの転写経路と疾患の重症度が強く関連づけられ、B vulgatusが単に存在するだけでなく、腸内におけるB vulgatusの活動が、常在菌としての役割を果たすか、あるいは病原体としての役割を果たすかを決定していることが示唆された98。
B vulgatus(ATCC8482)のような菌株は、CD82(免疫細胞の活性化因子)の発現を制御し、大腸炎に罹患したマウスを保護するプロバイオティクスとしての可能性が示唆されている93。しかし、この菌株が産生するプロテアーゼは、感受性の高いマウス97やモルモットで大腸炎を悪化させることも判明している100。さらに、B vulgatusのATCC 8482株はゲノムの可塑性を高めており、広範なゲノム進化を利用して新しい環境に適応することができる101。
カンジダ・アルビカンス(真菌)
カンジダ・アルビカンスは、全身性の抗真菌IgG産生など免疫系の発達を促進するため、常在腸内細菌叢の重要な真菌の一種である102,103。興味深いことに、このIgG産生は、一部のIBD患者で欠損が知られているCARD9経路に依存している103。C albicansはCDの重症度と関連しているが、85,104最近の研究では、UC105,106,107,108の患者においてC albicansが増加しており、活動性UC患者ではさらに増加していることが示されている109。炎症がCアルビカンスの増殖を促進し、マクロファージにダメージを与えることで大腸炎を悪化させ、菌糸が分泌する毒素カンジダライシン102,110,111を放出する可能性が示唆された(図2C)。この毒素は、in vitroでのIL-1βの産生によって示されるように、腸の炎症を促進し、UCの重症度と強い相関があることがわかった110。腸の炎症に対するカンジダの状況依存的な影響は、大腸炎マウスにカンジダを投与しても、UC寛解導入療法であるプレドニゾロンを投与しない限り効果がなかったという知見によって支持されている110。最近の二重盲検プラセボ対照臨床試験では、抗真菌薬フルコナゾールの投与がカンジダを保有するUC患者の臨床転帰を改善するかどうかが検証された112。主要アウトカムであるMayoスコアの3点以上の低下は認められなかったが、組織学的スコアと便中カルプロテクチン値はフルコナゾール投与群でより低くなることが多く、カンジダによるダメージが軽減されたことが示唆された106。このように、どのC albicans株が疾患を促進するかを決定する上で、株の不均一性と免疫力が重要な役割を果たすと考えられる。
他の微生物叢との相互作用
IBD病原体の中には、疾患の重症度を直接悪化させるものもあるが、特定の腸内細菌叢メンバーが存在する(または存在しない)場合にのみ病原効果を発揮するものもある。このことは、推定される病原体との関連において、個人の常在細菌叢の特徴を明らかにすることの重要性を強調している。最近の研究で、2つの免疫原性細菌種が宿主の生理に与える影響に互いに影響を与えうることが示された113。UC患者から分離されたアロバクラム属細菌は、存在量の「ブルーム」を起こすことなく、マウスの大腸炎を悪化させることが判明した113,114。しかし、腸内共生生物であるAkkermansia muciniphilaの存在下では、Allobaculum属128種によって誘導される大腸炎は抑制された113。逆に、Allobaculum属128種は、A muciniphilaによって通常誘導される適応免疫を変化させ、その結果、全身性の抗A muciniphila抗体反応が鈍化した。従って、これら2種の免疫賦活性微生物の組み合わせは、どちらか一方の微生物種を単独で用いた場合と比較して、異なる宿主応答をもたらした。この研究は、微生物叢の相互作用の複雑さを浮き彫りにし、微生物叢の調節を通じて疾病症状の予測や予防に役立つ、微生物と微生物の相互作用を調べる今後の研究の基礎を築いた。
文脈依存的な微生物間相互作用のもう一つの源として、これまでに同定されたプロバイオティクス常在菌があり、これらは宿主細胞との病原体間相互作用を阻止したり、あるいは悪化させたりする。例えば、ラクタセイバシラス・カゼイDN-114 001株は、IEC株へのAIECの接着を用量および時間依存的に阻害することが示されている115。また、プロバイオティクス乳酸菌(Lactobacillus acidophilus LA1株およびLactobacillus paracasei 101/37株)およびビフィズス菌(Bifidobacterium animalis species Lactis Bi1株およびBifidobacterium breve Bbr8株)が、AIECに誘導される炎症性TNFを減少させるという証拠もある。 なぜなら、B breve Bbr8株は代わりにIBD患者由来のAIEC感染マクロファージにおけるTNF-α産生を亢進させたからである。著者らは、プロバイオティクス株はUCとCDのドナー間で異なる有効性を示し、CD患者のマクロファージをAIECから保護する効果はなかったと指摘した。一方、プロバイオティクスの可能性を持つ粘液分解共生生物A muciniphilaは117,118、L-セリン欠乏環境下で粘液バリアを分解することにより、AIECが腸上皮に到達するのを助けることが判明した119。重要なことに、IBD患者は健常人に比べて腸内のL-セリンレベルが有意に低い119。
これらの例は、病原性細菌がいかに多様なメカニズムでIBD患者の疾患を悪化させるかを浮き彫りにしている。細菌を善玉と悪玉のどちらかに分類することは魅力的に思えるかもしれないが、実際には、局所環境が病原性細菌の行動(すなわち、無害な常在菌として、あるいは明らかな病原性を有する微生物として)に大きく影響する可能性がある。重要なことは、IBDの場合、腸内環境の安定性に個人差があるため、病原性微生物の潜在的な活性が異なる可能性があることである14。さらに、認識されていない菌株の変異や転写活性が、パソビオントによるIBDの増悪に寄与している可能性もある。したがって、治療オプションとして病原性微生物またはその病原性因子を同定し、標的とするには、どの微生物が疾患を増悪させることができるのか、また腸内環境がそれらの微生物の作用様式にどのように影響するのかについての理解を深める必要がある。
IBD病原細菌の単離と特性解析
IBDの発症と重症化を促進する可能性のある微生物を同定するためには、腸内細菌叢からの分離と同定が不可欠である120(図3)。培養に基づく病原微生物の分離・同定法には、選択培地を用いる方法、例えば、便検体をMacConkey寒天培地にプレーティングし、嫌気条件下で培養した後、16SリボソームRNAまたは全ゲノム配列決定、内部転写スペーサー配列決定(真菌)またはMALDI-TOF質量分析法を用いて各分離株を同定する方法がある121。
図のサムネイルgr3
図3この図は、病原微生物の分離と特性解析に用いられる方法をまとめたものである。IBD患者の内視鏡検査で、疾患部位の粘膜洗浄液を採取する。免疫原性株は、フローサイトメトリーを用いて抗体でコートされた微生物を認識することにより選別される。候補株は直接シークエンシングされるか、選択培地上にプレーティングされ、自動コロニーピッキングシステムを用いてピッキングされる。各コロニーはシーケンスまたはMALDI-TOFによって同定される。病原性株は、病原性遺伝子の発現や、付着、侵入、バリア破壊などのin vitroアッセイによって特徴づけられる。さらに、IL-10-/-マウスの自然大腸炎を促進する能力や、デキストラン硫酸ナトリウム誘発大腸炎を起こしたASF(altered schaedler flora)コロニー化グノトビオティックマウスなど、様々な大腸炎モデルを用いて、病原性株の病態を明らかにすることができる。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
病原体の同定における最大の課題の一つは、病原体を腸内の無害な微生物と区別することである。もし病原微生物がIBDに積極的に寄与しているのであれば、それは管腔内ではなく腸粘膜表面近くに存在する可能性が高い。したがって、便検体に頼るのではなく、内視鏡検査中の粘膜洗浄を利用して、粘膜表面近くの検体を採取することができる。ほとんどの病原体は宿主の免疫系によって認識され、病原体特異的抗体の産生を誘発するはずである。この方法には、IgA抗体とIgG抗体の両方を使用することができる。IgA抗体は最も豊富なアイソタイプで、腸管内腔に分泌され、IgG抗体は病原性細菌をより特異的に認識する。
分離された病原性微生物の病原性を特徴付けるには、全ゲノムシークエンシングまたはマルチプレックスポリメラーゼ連鎖反応アッセイを用いて、抗生物質耐性や毒素産生に関与する遺伝子などの病原性関連遺伝子を同定することができる124(図3)。例えば、接着因子、侵入因子、ヘモリシンなどの毒素を含むExPECに関連する遺伝子の存在は、強力な病原性マーカーである。さらに、IL-6やIL-8などのサイトカインの産生を調べることで、免疫の活性化を判定することができる。
通常、IL-10-/-マウスのような遺伝的に感受性の高いマウス系統を用い、A parvulumやAIEC31,89,129,130のような異なる病原体にコロニー形成されると、重篤な腸炎を発症する(図3)。感受性は食餌によってももたらされる。低発酵性繊維を含む食餌を摂取すると、マウスの粘液溶解性常在菌が増加し、粘液層が薄くなり、病原菌や病原体による腸管感染感受性が高まる131,132。デキストラン硫酸ナトリウムの大腸上皮細胞に対する毒性は腸のホメオスタシスを破壊し、病原菌の定着と増殖を促進するからである37。また、このモデルは、食事、遺伝的欠乏、他の常在微生物との相互作用など、他のIBDリスク因子と組み合わせることも容易である37,133。注目すべきことに、最近の多くの研究では、臨床的なIBDの発症時に起こりうる特異的な微生物-微生物相互作用をよりよく反映するために、ヒトの便微生物でコンベンショナル化したマウスを用いている134。マウスモデルは生体内における病原性微生物の病態を研究するために広く用いられているが、マウスモデルは他の常在細菌叢メンバーとの複雑な相互作用やIBD患者に見られる免疫調節障害を完全に模倣するものではないことに留意すべきである。
病原体は現在のIBD治療の妨げになるか?
生物学的製剤やその他の免疫抑制剤などの既存の治療薬に抵抗性を示すか、あるいは宿主の免疫防御の障害から利益を得るためである。
ステロイドと5-アミノサリチル酸塩はIBD治療の第一選択薬と考えられているが、最近の研究では、これらの薬剤の使用が、クリーピングファットや厳格化病の発症に関与している嫌気性病原体であるC innocuum 66の感染の危険因子であることが確認されている30。あるレトロスペクティブな研究では、C albicansとコルチコステロイドの使用との間に正の相関関係があることが確認されている136。一方、ある症例報告では、プレドニゾロンによるステロイド治療を受けていたUCの小児が、C albicansによる大腸炎を発症したことが報告されている137。
治療後の拡大に加えて、病原体が寛解を妨げるもう一つの方法は、「健康な」ドナーの糞便を患者の腸に移植する糞便微生物叢移植(FMT)などの微生物療法の有効性を妨げることである。FMTは有望な治療法であるが、IBDにおけるFMTの臨床試験では、全体の寛解率が約37%と、さまざまな結果が示されている138。興味深いことに、CDに関連する粘液溶解性病原体R gnavus77,82は、持続的な寛解が得られないFMTの失敗と関連している139。UC患者のFMTによる寛解を目指した研究では、レシピエントが再発したドナーは、持続的寛解を達成した患者のドナーと比較して、R gnavusの存在量が3.8倍多いことが判明した139。R gnavusのような病原体の過剰レベルを除外基準として定義すれば、FMT療法は患者の寛解を誘導する上でより効果的である可能性が高い。より一般的には、病原因子のスクリーニングは、疾患の病因や潜在的な治療失敗の効果的な指標となる可能性がある。
過去から学ぶ:どのように病原体をターゲットにするか?
20世紀以降、細菌とIBDとの関連性が証明されたことにより、抗生物質や抗真菌剤を用いて病原体や「有害な」常在菌(現在では病原性常在菌と呼ばれている)を除去することに関心が集まった。IBDの一部の症例で抗生物質が有効であったことから、IBDの病態に細菌が関与していることが示唆されたが、現在のところ、病原性常在菌の除去を目的とした抗生物質の使用を支持するエビデンスはない。
抗生物質は現在もIBD患者に処方されているが、AIEC38のような特定のIBD病原体に対して、その存在量や活性を調節する標的療法の開発は、様々な発展段階にある新しい分野である。その有効性に関するエビデンスはまだ限られているが、FMTのような微生物を用いた広範な治療法、IEC38への病原体の接着を阻害するマンノシドや殺菌性ファージ療法のような特異的な治療法などが考えられる(図4)。
図のサムネイルgr4
図4病原体を標的とした潜在的治療戦略の概要。(1)微生物療法:微生物群集内のバランスを回復させ、ディスバイオシスを緩和し、病原体の影響を軽減するFMTのような介入。(2)抗付着薬:FimHアンタゴニストのようなマンノシド系薬剤は、病原体のIECへの付着と侵入を防ぐ。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
微生物叢の修復
FMTは急速に発展している分野であり、新しい腸内細菌叢を提供することによって間接的に病原体を標的とし、患者の現在のディスバイオシスを調整する可能性がある。現在、90以上の臨床試験がIBDの治療としてFMTを検討している。同様に、メタアナリシスでは、FMT後にUC患者の36%、CD患者の50%で寛解が認められた。146 別の最近の研究では、カプセル化FMTにより、UC患者の57.1%、76.2%でそれぞれ臨床的寛解と臨床的奏効が認められた147。現在、クロストリジウム・ディフィシル(Clostridium difficile)感染症の治療薬として試験中であるが、FMTと同様の効果が得られ、かつ「より安全な」定義された微生物叢を用いることができれば、FMTが病原性IBDに有効であることが証明されるかもしれない。
病原性因子の阻害
例えば、マンノシド系抗菌薬は、FimH(マンノース受容体)アドヘシンを標的とする新しいクラスの抗菌薬であり、AIECなど多くの大腸菌株が宿主IECに結合するのを阻害することを目的としている34,38。FimHアンタゴニストであるTAK-018は最近、培養ヒトIECおよびCD患者の摘出株へのAIECの接着を阻止することが示された38。また、別のFimHブロッカーであるEB8018を、活動性CD患者および健常対照者を対象に試験する小規模臨床試験(ClinicalTrials.gov Identifier: NCT02998190およびNCT03709628)が最近終了したところであるが、その結果はまだ発表されていない。有望な道ではあるが、この治療法の方向性を拡大するためには、IBDの病態生物学的増悪に関連する多様なメカニズムを同定し、特徴づける必要がある。
選択的排除
最後に、IBDの病原体を標的とするファージ療法が最近提案されている。この治療法では、標的とする細菌株に特異的なバクテリオファージ(細菌に感染して死滅させるウイルス)を用いる。ある大規模な研究では、いくつかのIBDコホートでみられる病原細菌である肺炎クレブシエラの患者由来株を標的としたファージカクテルが、大腸炎モデルマウスにおける肺炎クレブシエラの菌量を減少させるのに有効であることが明らかにされた144。マウスでの概念実証とヒトでの安全性が証明されたことで、ファージ療法は将来、IBD患者における正確な病原体除去の選択肢となる可能性がある。
結論
IBDの発症、重症度、慢性化には、細菌が関与している可能性がある。病原性細菌の研究には多くの課題が残されているが(すなわち、病原性細菌の病原性の文脈依存的な性質と、個々の患者ベースで病原性細菌を同定する必要性)、病原性細菌がどのように感染し、ディスバイオシスを促進し、免疫系を回避し、一部のIBD患者において臨床的寛解を達成するための現在の試みの有効性を制限しているのかを探ることは、IBD病態生理学の理解を進める鍵になると考えられる。将来的には、病態を緩和し、IBD患者のQOLを改善するために、病原体を標的とした治療法が次世代の治療選択肢となる可能性がある。
CRediT著者による貢献
Bruce A. Vallance, PhD(概念化: イコール;資金獲得: 主導;監修: 執筆 - 査読と編集: 同等)
Ashley Gilliland, MSc(概念化:同等: 同等、視覚化: 執筆-原案: 執筆-原案:リード、執筆-校閲・編集:同等 同等)
ジョセリン・チャン(理学士)(コンセプト立案: 支援、視覚化: 執筆-原案: 執筆-原案:サポート、執筆-校閲・編集:サポート: サポート)
Travis J. DeWolfe, PhD(概念化: 執筆-原案:支援: 執筆-原案:支持、執筆-校閲・編集:支持 執筆-校閲・編集:支援)
Hyungjun Yang, PhD (概念化: 支援、視覚化: 執筆-原案: 執筆-原案作成:支援、執筆-校閲・編集:支援: 執筆-校閲・編集:支援)
参考文献
ン S.C.
Shi H.Y.
ハミディ N.
他。
21世紀における炎症性腸疾患の世界的発生率と有病率:人口ベースの研究の系統的レビュー。
Lancet. 2017; 390: 2769-2778
論文で見る
スコープス (3344)
PubMed
要旨
全文
全文PDF
グーグル奨学生
イェ B.D.
マクガバンD.P.B.
IBDにおける遺伝的変異:進展、病因への手がかり、臨床的有用性の可能性。
Expert Rev Clin Microbiol. 2017; 12: 1091-1107
論文で見る
Google Scholar
ピーターズ L.A.
ペリグーJ.
モルタ A.
他。
機能ゲノミクス予測ネットワークモデルによる炎症性腸疾患の制御因子の同定。
Nat Genet. 2017; 49: 1437-1449
論文で見る
スコープス (151)
PubMed
クロス
グーグル奨学生
ハンペJ.
フランケ A.
ローゼンスティールP.
et al.
非同義SNPのゲノムワイド関連スキャンにより、ATG16L1におけるクローン病感受性変異が同定された。
Nat Genet. 2007; 39: 207-211
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ユゴー J.
シャマイヤール M.
Zouali H.
他。
NOD2ロイシンリッチリピート変異体とクローン病感受性との関連。
Nature. 2001; 411: 599-603
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
フェイ A.S.
アリン K.H.
アイバーセンA.T.
他。
年齢を超えた炎症性腸疾患の危険因子としての抗生物質の使用:集団ベースのコホート研究。
Gut. 2023; 72: 663-670
論文で見る
スコープス (16)
PubMed
クロス
グーグル奨学生
ゲバース D.
クガタサンS.
ナイツD.
他。
クローン病研究のためのマイクロバイオーム基盤。
Cell Host Microbe. 2017; 21: 301-304
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ミハイル S.
ダービン M.
ターナーD.
et al.
重症潰瘍性大腸炎患児の腸内細菌叢の変化。
Inflamm Bowel Dis. 2013; 18: 1799-1808
論文で見る
Google Scholar
レヴィ M.
Kolodziejczyk A.A.
タイスC.A.
他。
ディスバイオシスと免疫系。
Nat Rev Immunol. 2017; 17: 219-232
論文で見る
スコープス (949)
PubMed
クロス
グーグル奨学生
ティファニーC.R.
バウムラーA.J.
ディスバイオシス:フィクションから機能へ。
Am J Physiol - Gastrointest Liver Physiol: G602-G608
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
松岡恭子
金井 崇
腸内細菌叢と炎症性腸疾患。
Semin Immunopathol. 2015; 37: 47-55
論文で見る
スコープス (533)
PubMed
クロス
グーグル奨学生
コスティッチ A.D.
ザビエルR.J.
ゲバースD.
炎症性腸疾患におけるマイクロバイオーム:現状と今後の展望。
Gastroenterology. 2014; 146: 1489-1499
論文で見る
スコープス (1235)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ライアン F.J.
アハーン A.M.
フィッツジェラルド R.S.
他
炎症性腸疾患における大腸内細菌叢の炎症および宿主エピゲノム変化との関連。
Nat Commun. 2020; 11: 1-12
論文で見る
スコープス (147)
PubMed
クロス
グーグル奨学生
クルーニー A.G.
エッケンバーガーJ.
レーザーナ-メンディエタE。
et al.
炎症性腸疾患におけるマイクロバイオームの変動ランキング:大陸間の大規模縦断研究。
Gut. 2021; 70: 499-510
論文で見る
スコープス (109)
PubMed
クロス
グーグル奨学生
平野明彦
梅野淳一
岡本吉郎
他。
潰瘍性大腸炎患者における炎症部位と非炎症部位の微生物群集構造の比較。
J Gastroenterol Hepatol. 2018; 33: 1590-1597
論文で見る
スコープス(77)
Crossref
グーグル奨学生
モーエン A.E.F.
リンドストローム J.C.
タンネス T.M.
et al.
潰瘍性大腸炎患者の粘膜微生物叢の有病率と転写活性。
サイレポ 2018; 8: 1-12
論文で見る
グーグル・スカラー
ウォーカー A.W.
サンダーソン J.D.
チャーチャー C.
他
粘膜関連微生物叢のハイスループットクローンライブラリー解析により、炎症性腸疾患における腸の炎症部位と非炎症部位との間のdysbiosisおよび差異が明らかになった。
BMC Microbiol. 2011; 11: 1-12
論文で見る
スコパス(561)
PubMed
クロス
グーグル奨学生
レイゴサ・ガライ J.A.
ターピンW.
リー S.-H.
他。
腸内細菌叢の組成は、健康な第一度近親者におけるクローン病の将来の発症と関連している。
Gastroenterology. 2023; 165: 670-681
論文で見る
スコープス (12)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ガリポーH.J.
カミネロ A.
ターピンW.
他。
潰瘍性大腸炎の臨床診断に先行する新規糞便バイオマーカー。
Gastroenterology. 2021; 160: 1532-1545
論文で見る
スコープス (86)
PubMed
要旨
全文
全文PDF
グーグル奨学生
シン V.P.
プロクター S.D.
ウィリングB.P.
コッホの定立、微生物異常症と炎症性腸疾患。
Clin Microbiol Infect. 2016; 22: 594-599
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
グリメナキ M.
シン G.
ブラス A.
et al.
腸粘液微生物叢の組成変化は大腸炎誘発性炎症の発症に先行する。
Inflamm Bowel Dis. 2017; 23: 912-922
論文で見る
スコープス (41)
PubMed
クロス
グーグル奨学生
Ni J.
ウー G.D.
アルベンバーグL.
et al.
腸内細菌叢とIBD:因果関係か相関関係か?
Nat Rev Gastroenterol Hepatol. 2017; 14: 573-584
論文で見る
スコープス (971)
PubMed
クロス
グーグル奨学生
ウォルター J.
アーメットA.M.
フィンレイB.B.
et al.
腸内マイクロバイオームの因果関係の確立または誇張:ヒト微生物関連げっ歯類からの教訓。
Cell. 2020; 180: 221-232
論文で見る
スコープス (271)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Cococcioni L.
パネッリ S.
ヴァロット・ボッカッツィ I.
他。
IBDと小児年齢:その特殊性と微生物叢の関与。
Dig Liver Dis. 2021; 53: 17-25
論文で見る
Google Scholar
ビンドロス M.X.
オルサン E.E.
リベラ-チャベスF.
他。
微生物叢が活性化したPPAR-gシグナルは、腸内細菌科細菌の異常増殖を抑制する。
Science. 2017; 575: 570-575
論文で見る
グーグル・スカラー
バルデッリ V.
スカルダフェッリ F.
プティニャーニ L.
et al.
炎症性腸疾患の腸内細菌叢異常における腸内細菌科細菌の役割。
微生物。2021; 9: 1-15
論文で見る
Google Scholar
Chow J.
タン H.
マズマニアン S.K.
消化管微生物叢の病原体と炎症性疾患。
Curr Opin Immunol. 2011; 23: 473-480
論文で見る
スコープス (309)
PubMed
クロス
グーグル奨学生
マズマニアン S.K.
ラウンドJ.L.
カスパー D.L.
微生物共生因子が腸炎症性疾患を予防する。
Nature. 2008; 453: 620-625
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
シュテッヒャーB.
マイアーL.
ハードW.D.
腸内における "開花":ディスバイオーシスが病原体の進化にどのように寄与するか。
Nat Rev Microbiol. 2013; 11: 277-284
論文で見る
スコープス (262)
PubMed
クロス
グーグル奨学生
ハ C.W.Y.
マーティン A.
セピック-プーアG.D.
ら
腸内細菌叢の腸間膜脂肪への移行が、ヒトにおけるクリーピングファットの形成を促進する。
Cell. 2020; 183: 666-683
論文で見る
日本学術振興会特別研究員
PubMed
要旨
全文
全文PDF
グーグル奨学生
モッタウェアW.
チェン C.K.
ミュールバウアー M.
他。
新規発症クローン病における腸内細菌-宿主ミトコンドリアのクロストークの変化。
Nat Commun. 2016; 713419
論文で見る
Google Scholar
Yang Y.
グエン M.
ケトラパルV.
他。
腸内病原体の宿主内進化が肝臓への移行を促進。
Nature. 2022; 607: 563-570
論文で見る
スコパス (45)
PubMed
クロス
グーグル奨学生
ダルフィーユ=ミショーA.
ヌートC.
バルニッチN.
他。
クローン病患者の回腸粘膜における付着性大腸菌の存在。
Gastroenterology. 1998; 115: 1405-1413
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ドリューN.
デニゾ J.
マルティネス-メディナM.
他
クローン病関連付着性侵入性大腸菌のFimHアドヘシンにおける点変異は、腸の炎症反応を亢進させる。
PLoS Pathog. 2013; 9: e1003141
論文で見る
スコープス (123)
PubMed
クロス
グーグル奨学生
バルニッチ N.
カルバーリョF.A.
グラッサーA.L.
他
CEACAM6は付着性侵入性大腸菌の受容体として働き、クローン病における回腸粘膜のコロニー形成を支持する。
J Clin Invest. 2007; 117: 1566-1574
論文で見る
スコパス (449)
PubMed
クロス
グーグル奨学生
グラッサー A.L.
ブドーJ.
バルニッチN.
et al.
クローン病患者由来の付着性侵入性大腸菌株は、宿主細胞死を誘導することなくマクロファージ内で生存・複製する。
Infect Immun. 2001; 69: 5529-5537
論文で見る
スコープス (346)
PubMed
クロス
グーグル奨学生
キッタナ H.
ゴメス-ネトJ.C.
ヘックK.
他。
腸内炎症における付着侵入性(AIEC)と同定された大腸菌株の原因的役割の証拠。
mSphere. 2023; 8 (e00478-22)
記事で見る
Google Scholar
シュヴァリエG.
ラヴェシエールA.
デサシーG.
et al.
細菌FimHの阻害はクローン病に伴う粘膜炎症を予防する。
Microbiome. 2021; 9: 1-16
論文で見る
Google Scholar
Darfeuille-Michaud A.
付着性侵入性大腸菌:クローン病に関連する推定される新しい大腸菌病型。
Int J Med Microbiol. 2002; 292: 185-193
論文で見る
PubMed
クロス
グーグル奨学生
ロルヒオン N.
Darfeuille-Michaud A.
炎症性腸疾患における付着侵入性大腸菌。
Inflamm Bowel Dis. 2007; 13: 1277-1283
論文で見る
スコープス (210)
PubMed
クロス
グーグル奨学生
マルティネス-メディナ M.
ガルシア-ギルL.J.
慢性炎症性腸疾患における大腸菌:付着性侵襲性大腸菌の病原性に関する最新情報。
World J Gastrointest Pathophysiol.
論文で見る
PubMed
クロス
グーグル奨学生
パルメラ C.
シェバリンC.
シューZ。
他。
炎症性腸疾患における付着侵襲性大腸菌。
Gut. 2018; 67: 574-587
論文で見る
スコープス (316)
PubMed
クロス
グーグル奨学生
マンスール S.
アスラーT.
Elhenawy W.
付着性侵入性大腸菌の多面的病原性。
腸内細菌。2023; 152172669
論文で見る
Google Scholar
ビュッカー R.
シュルツ E.
ギュンツェルD.
et al.
IBDにおける大腸菌のα-ヘモリシン:大腸における炎症活性の増強因子。
Gut. 2014; 63: 1893-1901
論文で見る
スコープス (52)
PubMed
クロス
グーグル奨学生
バタカルジー D.
フローレス C.
ウエルフェル-モンシヴェC.
et al.
ヒト腸内細菌叢におけるClostridium innocuumの多様性と有病率。
mSphere. 2023; 8: 1-16
記事で見る
グーグル・スカラー
ナダリアンB.
ヤデガー A.
Houri H.
他
病原性付着型侵襲性大腸菌の有病率と炎症性腸疾患:系統的レビューとメタアナリシス。
J Gastroenterol Hepatol. 2021; 36: 852-863
論文で見る
スコープス (35)
PubMed
クロス
グーグル奨学生
ターピンW.
ゲーテルA.
ベドラーニL.
他。
IBD遺伝率の決定因子:遺伝子、虫、その他。
Inflamm Bowel Dis. 2018; 24: 1133-1148
論文で見る
スコープス (103)
PubMed
クロス
グーグル奨学生
ターピンW.
エスピン-ガルシアO.
Xu W.
他。
大規模健康コホートにおける宿主ゲノムと腸内微生物組成との関連。
Nat Genet. 2016; 48: 1413-1417
論文で見る
スコープス (311)
PubMed
クロス
グーグル奨学生
トーレスJ.
胡 J.
関 A.
et al.
IBDの母親から生まれた乳児は腸内細菌叢が変化しており、適応免疫系の異常が無菌マウスに移行する。
Gut. 2020; 69: 42-51
論文で見る
スコープス (111)
PubMed
クロス
グーグル奨学生
キム E.S.
タラシシン・L.
アイゼレC.
et al.
炎症性腸疾患の有無にかかわらず、妊婦とその児における便中カルプロテクチン値の縦断的変化。
Gastroenterology. 2021; 160: 1118-1130.e3
論文で見る
スコープス (38)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ワン S.
ライアンC.A.
ボヤバルP.
他。
早期の微生物叢の発達に影響を与える母親の垂直伝播。
Trends Microbiol. 2020; 28: 28-45
論文で見る
スコープス (97)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
デイ A.S.
Lemberg D.A.
小児のクローン病と潰瘍性大腸炎の鑑別と診断。
J Paediatr Child Health. 2020; 56: 1731-1734
論文で見る
Google Scholar
ブランド M.W.
プロクター A.L.
ホステッターJ.M.
他
哺乳動物から新生仔マウスへの付着性大腸菌および浸潤性大腸菌の垂直伝播は、生後大腸炎に暴露された後、より重篤な大腸炎を引き起こす素因となる。
PLoS One. 2022; 17e0266005
論文で見る
Google Scholar
Schirmer M.
デンソンL.
ヴラマキスH.
et al.
小児潰瘍性大腸炎患者の腸内細菌叢における組成および時間的変化は、疾患の経過と関連している。
Cell Host Microbe. 2018; 24: 600-610
論文で見る
スコープス(143)
PubMed
要旨
全文
全文PDF
グーグル奨学生
エルマグラウィ K.
ハッシー S.
モランG.P.
小児IBDにおける口腔マイクロバイオーム:病原体の供給源か、バイオマーカーか?
Front Pediatr.
論文で見る
Google Scholar
Elmaghrawy K.
フレミング P.
フィッツジェラルドK.
他。
未治療の小児IBD患者における口腔内細菌叢は、治療後に消失する疾患重症度に関連したdysbiosisを示す。
J Crohn's Colitis. 2022; jjac155: 1-12
論文で見る
Google Scholar
Read E.
カーティスM.A.
ネヴェスJ.F.
炎症性腸疾患における口腔内細菌の役割。
Nat Rev Gastroenterol Hepatol。2021; 18: 731-742
論文で見る
スコープス (74)
PubMed
クロス
グーグル奨学生
ムウトソプロス N.M.
コンケルJ.E.
健康な口、健康な腸:dysbiotic口腔マイクロバイオームは大腸炎を悪化させる。
Mucosal Immunol. 2020; 13: 852-854
論文で見る
スコープス (4)
PubMed
要旨
全文
全文PDF
グーグル奨学生
北本真一
長尾-北本
Jiao Y.
他。
常在性病原体駆動性大腸炎における口と腸の粘膜間接続。
Cell. 2020; 182: 447-462
論文で見る
スコパス (283)
パブコメ
概要
全文
全文PDF
グーグル奨学生
アタラシK.
須田和彦
ルオ C.
et al.
腸内細菌の異所性コロニー形成がTH1細胞の誘導と炎症を引き起こす。
Science. 2017; 365: 359-365
論文で見る
グーグル奨学生
バレト H.C.
ゴルドI.
腸内細菌叢の宿主内進化。
Nat Rev Microbiol. 2022; 13: 1-18
論文で見る
グーグル奨学生
シャープトン T.
リャリーナ S.
ルオン J.
et al.
炎症性腸疾患の発症は、マウスにおける腸内メタゲノムの縦断的再構築と関連している。
mSystems. 2017; 2e00036-17
記事で見る
グーグル・スカラー
アッカーマン G.
タン Y.J.
Jang S.S.
他。
クロストリジウム・ディフィシル(Clostridium difficile)関連下痢既往患者における下痢再発例からのクロストリジウム・イノキュウム(Clostridium innocuum)の分離。
Diagn Microbiol Infect Dis. 2001; 40: 103-106
論文で見る
スコープス (20)
PubMed
クロス
グーグル奨学生
チア・J.H.
スー L.H.
ウー T.L.
他。
Clostridium innocuumは、腸管外クロストリジウム感染症の重要なバンコマイシン耐性病原体である。
Clin Microbiol Infect. 2017; 23: 560-566
論文で見る
スコープス (33)
PubMed
要旨
全文
全文PDF
グーグル奨学生
チェルニー K.E.
マスカット E.B.
レイナ M.E.
他。
Clostridium innocuum:潜在的新興病原体の微生物学的および臨床的特徴。
Anaerobe. 2021; 71102418
論文で見る
Google Scholar
Le P.H.
チウ C.T.
イエ P.J.
et al.
炎症性腸疾患の入院患者におけるClostridium innocuum感染。
J Infect. 2022; 84: 337-342
論文で見る
スコープス (9)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ローワン F.
ドカティ N.G.
マーフィー M.
他。
潰瘍性大腸炎におけるDesulfovibrio菌種の増加。
Dis Colon Rectum. 2010; 53: 1530-1536
論文で見る
スコープス(228)
PubMed
クロス
グーグル奨学生
クシュケヴィッチI.
ドルデヴィッチD.
コラーP.
大腸炎患者由来のDesulfovibrio株の生理学的パラメータの解析。
オープンライフサイエンス 2018; 13: 481-488
論文で見る
グーグル・スカラー
ギブソン G.R.
カミングス J.H.
マクファーレン G.T.
健常人と潰瘍性大腸炎患者の腸内容物における硫酸還元菌の増殖と活性。
FEMS Microbiol Lett. 1991; 86: 103-112
論文で見る
クロスレビュー
グーグル奨学生
イッセナガー N.
ベルザー C.
Hooiveld G.J.
ら
腸内細菌叢は、大腸の粘液バリアを開くことにより、食事性ヘムによる上皮過増殖を促進する。
Proc Natl Acad Sci U S A. 2015; 112: 10038-10043
論文で見る
スコープス (270)
PubMed
クロス
グーグル奨学生
ボーモント M.
アンドリアミハヤM.
ラン A.
他。
管腔内硫化水素への曝露増加による結腸細胞への有害作用:適応反応。
Free Radic Biol Med. 2016; 93: 155-164
論文で見る
PubMed
クロス
グーグル奨学生
ミラー T.W.
ワン E.A.
グールド S.
他。
硫化水素はT細胞活性化の内因性増強因子である。
J Biol Chem. 2012; 287: 4211-4221
論文で見る
スコープス (104)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ブラキエF.
アンドリアミハヤ M.
ララウフィP.
他
腸内細菌叢と上皮細胞による硫化水素の産生と結腸・直腸粘膜への影響。
Am J Physiol - Gastrointest Liver Physiol: G125-G135
論文で見る
PubMed
クロス
グーグル奨学生
カルナカランG.
ヤン Y.
トレンブレーV.
et al.
クローン病に関連するAtopobium parvulum SufSシステイン脱硫酵素の構造解析。
FEBS Lett.
論文で見る
Google Scholar
ヨーセンス M.
Huys G.
Cnockaert M.
他。
クローン病患者とその非罹患親族における糞便微生物叢のディスバイオーシス。
Gut. 2011; 60: 631-637
論文で見る
日本
PubMed
クロス
グーグル奨学生
クロスト E.H.
コレットE.
ベル A.
他
ルミノコッカス・グナバス:ヒトの健康にとって敵か味方か。
FEMS Microbiol Rev. 2023; 47: 1-23
記事で見る
Google Scholar
ホール A.B.
ヤスール M.
サウク J.
他。
炎症性腸疾患患者に濃縮された新規Ruminococcus gnavusクレード。
Genome Med. 2017; 9: 103
論文で見る
スコープス (395)
PubMed
クロス
グーグル奨学生
テイルフォードL.E.
オーウェンC.D.
ウォルショーJ.
他
ヒト腸内細菌叢における分子内トランスシアリダーゼの発見は、粘膜適応の新たなメカニズムを示唆している。
Nat Commun. 2015; 6: 1-12
論文で見る
グーグル・スカラー
Png C.W.
リンデン S.K.
ギルシェナン K.S.
他。
IBD粘膜における有病率が増加した粘液溶解性細菌は、in vitroで他の細菌によるムチンの利用を増大させる。
Am J Gastroenterol. 2010; 105: 2420-2428
論文で見る
スコパス (970)
PubMed
クロス
グーグル奨学生
ポラス A.M.
Zhou H.
Shi Q.
et al.
炎症性腸疾患関連腸内常在菌は細胞外マトリックスの成分を分解する。
MBio. 2022; 13: 1-18
論文で見る
Google Scholar
アームストロング H.
アリプール M.
ヴァルチェヴァR.
他。
小児炎症性腸疾患における宿主免疫グロブリンGの選択的同定。
Microbiome. 2019; 7: 1-17
論文で見る
スコープス (46)
PubMed
クロス
グーグル奨学生
ヘンケ M.T.
ケニー D.J.
カシリーC.D.
他
クローン病に関連するヒト腸内細菌叢のメンバーであるRuminococcus gnavusは、炎症性多糖類を産生する。
Proc Natl Acad Sci U S A. 2019; 116: 12672-12677
論文で見る
スコープス (391)
PubMed
クロス
グーグル奨学生
ヘンケ M.T.
ブラウン E.M.
カシリーC.D.
ら
莢膜多糖はヒト腸内細菌Ruminococcus gnavusに対する免疫応答と相関する。
Proc Natl Acad Sci U S A. 2021; 118: 1-7
論文で見る
Google Scholar
ジャイン U.
ホイルAM
Xiong S.
et al.
マウスのクローン病腸組織にデバリオマイセスが濃縮され、治癒を阻害している。
Science. 2021; 371: 1154-1159
論文で見る
スコープス (119)
PubMed
クロス
グーグル奨学生
オライセン M.
リチャード M.L.
ベイスヴォーグV.
et al.
回腸真菌叢はクローン病で変化し、病気の経過と関連している。
Front Med. 2022; 9868812
論文で見る
Google Scholar
ヴァルチュクU.
Sobieszczanska B.
ターニャックM.
他。
炎症性腸疾患の小児における粘膜関連びまん性付着大腸菌の有病率。
Adv Clin Exp Med. 2019; 28: 899-905
論文で見る
グーグル・スカラー
ミルセパシ・ラウリッセン H.C.
ドゥ Z.
ストルーヴ C.
他
大腸菌によるα-ヘモリシンの分泌は潰瘍性大腸炎患者のタイトジャンクションを破壊する。
Clin Transl Gastroenterol. 2016; 7: e149
論文で見る
PubMed
クロス
グーグル奨学生
ミルセパシ・ラウリッセン H.C.
ヴァランスB.A.
クログフェルトK.A.
他。
炎症性腸疾患に関連する大腸菌病原体。
. 2019; 32: 1-16
論文で見る
グーグル・スカラー
ヤン・エイチ.
ミルセパシ・ラウリッセン H.C.
ストルーヴェ C.
et al.
潰瘍性大腸炎に関連する大腸菌病原体は、感受性の高い宿主において大腸炎を増強する。
Gut Microbes. 2020; 12: 1-19
論文で見る
Google Scholar
ミルセパシ・ラウリッセン H.C.
Struve C.
ピーターセン A.M.
et al.
炎症性腸疾患のDSSモデルにおける2つの異なるマウス株でのα-ヘモリシン産生大腸菌の影響。
Microorganisms. 2020; 8: 1971
論文で見る
Google Scholar
バウムガルトナー M.
Zirnbauer R.
シュラガー S.
et al.
非定型腸管病原性大腸菌は潰瘍性大腸炎の疾患活動性と関連している。
腸内細菌。2022; 142143218
論文で見る
Google Scholar
Liu L.
Xu M.
Lan R.
et al.
バクテロイデス属細菌は、腸内細菌叢と免疫応答を調節することにより、実験マウスの大腸炎を抑制する。
Front Immunol. 2022; 131036196
論文で見る
スコパス (10)
クロスレビュー
グーグル奨学生
キム J.S.
Kim H.K.
Lee J.
ら。
CD82の阻害は、BRCC3によるNLRP3の脱ユビキチン化を増加させることで大腸炎を改善する。
Cell Mol Immunol. 2023; 20: 189-200
論文で見る
Google Scholar
Lucke K.
ミールケ S.
ヤコブズE.
et al.
潰瘍性大腸炎におけるバクテロイデス属およびプレボテラ属の有病率。
J Med Microbiol. 2006; 55: 617-624
論文で見る
スコープス (187)
PubMed
クロス
グーグル奨学生
バンバ T.
松田英樹
遠藤雅人
潰瘍性大腸炎患者におけるBacteroides vulgatusの病原性役割。
J Gastroenterol. 1995; 8: 45-47
論文で見る
Google Scholar
佐藤和彦
クミタ・W.
大出 毅.
et al.
潰瘍性大腸炎由来Bacteroides vulgatusの付着性に影響するOmpA変異体.
J Med Dent Sci. 2010; 57: 55-64
論文で見る
PubMed
Google Scholar
ミルズ R.H.
ドゥライ P.S.
バスケス-バエサY。
et al.
潰瘍性大腸炎腸内細菌叢のマルチオミクス解析により、バクテロイデス属バルガータス(Bacteroides vulgatus)のプロテアーゼと疾患重症度が関連付けられた。
Nat Microbiol. 2022; 7: 262-276
論文で見る
スコープス (78)
PubMed
クロス
グーグル奨学生
シルマー M.
フランゾーザ E.A.
ロイド-プライスJ。
他。
炎症性腸疾患腸内細菌叢におけるメタ転写の動態。
Nat Microbiol. 2018; 3: 337-346
論文で見る
スコープス(310)
PubMed
クロス
グーグル奨学生
Xu J.
マホワルドM.A.
レイ R.E.
他。
ヒト腸管遠位部における共生細菌の進化。
PLoS Biol.
論文で見る
グーグル・スカラー
ブリーリング J.L.
オンダードンク A.B.
シスネロス R.L.
他
モルモットのカラギーナン誘発大腸炎に関連するバクテロイデス属外膜抗原。
Infect Immun. 1988; 56: 1754-1759
論文で見る
PubMed
クロスレフ
グーグル奨学生
ランゲ A.
バイヤーS.
Steimle A.
et al.
マウス腸内細菌Bacteroides vulgatus mpkにおけるモビローム駆動型の広範なゲノムの多様化。
Genome Biol Evol.
論文で見る
スコープス (20)
PubMed
クロス
グーグル奨学生
シャオ T.Y.
ハスラム D.B.
ベネットR.J.
他
友好的真菌:常在菌カンジダ・アルビカンスとの共生。
Trends Immunol. 2022; 43: 706-717
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ドロンI.
レオナルディ I.
リーX.V.
et al.
ヒト腸内真菌叢は、CARD9依存的な抗真菌IgG抗体の誘導を介して免疫を調整する。
Cell. 2021; 184: 1017-1031
論文で見る
(106件)
PubMed
要旨
全文
全文PDF
グーグル奨学生
スタンダート-ヴィツェA.
センディッドB.
ヨーセンスM.
他。
家族性クローン病におけるカンジダ・アルビカンスのコロニー形成とASCA。
Am J Gastroenterol. 2009; 104: 1745-1753
論文で見る
スコープス(162)
PubMed
クロス
グーグル奨学生
Ksiadzyna D.
ナウロットU.
ヴロダルチクK.
et al.
潰瘍性大腸炎患者におけるインターロイキン10、抗マンナンカンジダ抗体および消化管の真菌コロニー形成の血清濃度。
2009; 54: 170-176
論文で見る
Google Scholar
Zwolinksa-Wcislo M.
ブダックA.
トロヤノフスカD.
et al.
[潰瘍性大腸炎の経過におけるカンジダ・アルビカンスの影響]。
Przegl Lek. 2006; 63: 533-538
記事で見る
Google Scholar
Qiu X.
Ma J.
Jiao C.
et al.
潰瘍性大腸炎患者における粘膜関連真菌微生物叢の変化。
Oncotarget. 2017; 8: 107577-107588
論文で見る
グーグル・スカラー
マー J.S.
ラメール B.J.
リン D.L.
et al.
民族的に異なる潰瘍性大腸炎患者において、疾患の重症度と免疫活性は、異なる領域間腸内細菌叢の状態と関連している。
MBio. 2016; 7e01072-16
論文で見る
スコープス (83)
PubMed
クロス
グーグル奨学生
ズヴォリンカ-ウチスロM.
ブルゾゾフスキT.
ブダックA.
et al.
ヒト潰瘍性大腸炎に対するカンジダコロニーゼの効果と実験的大腸の炎症性変化の治癒。
J Physiol Pharmacol. 2009; 60: 107-118
論文で見る
Google Scholar
リーX.V.
レオナルディ I.
プッツェルG.G.
et al.
炎症性腸疾患における真菌の多様性による免疫制御。
Nature. 2022; 603: 672-678
論文で見る
スコパス (84)
PubMed
クロス
グーグル奨学生
モイズ D.L.
ウィルソンD.
リチャードソンJ.P.
ら
カンジダライシンは粘膜感染に重要な真菌ペプチド毒素である。
Nature. 2016; 532: 64-68
論文で見る
スコープス(554)
PubMed
クロス
グーグル奨学生
イエナ A.
ダッタ U.
シャーJ.
他。
便中カンジダ検出可能な活動性潰瘍性大腸炎患者におけるフルコナゾール経口投与。
J Clin Gastroenterol. 2022; 56: 705-711
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
ライスT.A.
ビーレッカ A.A.
グエンM.T.
他。
種間常在性相互作用は宿主免疫に非線形な影響を及ぼす。
Cell Host Microbe. 2022; 30: 988-1002.e6
記事で見る
要旨
全文
全文PDF
グーグル奨学生
パーム N.W.
ゾーテMRデ
カレンT.W.
et al.
免疫グロブリンAコーティングによる炎症性腸疾患における大腸菌の同定。
Cell. 2014; 158: 1000-1010
論文で見る
スコープス (862)
PubMed
概要
全文
全文PDF
グーグル奨学生
イングラシアI.
レプリンガール A.
ダルフィーユ・ミショー A.
ラクトバチルス・カゼイDN-114 001は、クローン病患者から分離された付着浸潤性大腸菌の腸管上皮細胞への付着および浸潤能力を阻害する。
Appl Environ Microbiol. 2005; 71: 2880-2887
論文で見る
スコープス(80)
PubMed
クロス
グーグル奨学生
レッチェG.
ビビ A.
マッツァS.
他
プロバイオティクス乳酸菌およびビフィズス菌は、潰瘍性大腸炎における付着性浸潤性大腸菌(AIEC)の病原性に対抗し、IL-23/Th17軸を阻害するが、クローン病では阻害しない。
細胞。2020; 9: 1824
論文で見る
スコープス (38)
PubMed
クロス
グーグル奨学生
カニ P.D.
ヴォスWMデ
次世代有益微生物:akkermansia muciniphilaの場合。
Front Microbiol. 2017; 8: 1765
論文で見る
スコープス (632)
PubMed
クロス
グーグル奨学生
Zhang T.
Li Q.
Cheng L.
et al.
アッカーマンシア・ムチニフィラは有望なプロバイオティクスである。
Microb Biotechnol. 2019; 12: 1109-1125
論文で見る
スコープス (400)
PubMed
クロス
グーグル奨学生
杉原和彦
北本 聡
サライソンP.
他。
食餌性栄養制限下において、溶菌が宿主由来の栄養素を獲得するためのライセンス供与を行う。
Cell Rep.
論文で見る
グーグル・スカラー
ブラウン H.P.
ネビル B.A.
フォースター S.C.
他。
腸内細菌叢の伝播:健康の普及。
Nat Rev Microbiol. 2017; 15: 531-543
論文で見る
スコープス (129)
PubMed
クロス
グーグル奨学生
ホウ T.
チアンニ C.
Teng S.
臨床微生物学におけるMALDI-TOF質量分析の現状。
J Food Drug Anal. 2019; 27: 404-414
論文で見る
PubMed
クロスレフ
グーグル奨学生
エリクソン A.R.
カンタレルB.L.
ラメンデッラR.
et al.
統合メタゲノミクス/メタプロテオミクスにより、クローン病のヒト宿主-微生物叢シグネチャーが明らかになった。
PLoS One. 2012; 7e49138
論文で見る
スコープス(337)
クロスフィルム
グーグル奨学生
ツィンマーマン J.
ヒュブシュマンT.
シャッテンベルクF.
et al.
高分解能細菌叢フローサイトメトリーにより、大腸炎に伴う糞便中細菌組成の動的変化が明らかになった。
Eur J Immunol. 2016; 46: 1300-1303
論文で見る
スコープス (47)
PubMed
クロス
グーグル奨学生
ボトキンD.J.
ガリL.
サンカラパニV.
他
志賀毒素産生大腸菌、腸管出血性大腸菌、腸管病原性大腸菌の検出のためのマルチプレックスPCRアッセイの開発。
Front Cell Infect Microbiol. 2012; 2: 1-10
論文で見る
Google Scholar
ピーターセン A.M.
ニールセン E.M.
リトラップE.
他。
活動性左側炎症性腸疾患に関連する大腸菌の系統群。
BMC Microbiol. 2009; 9: 1-7
記事で見る
Google Scholar
ソラ V.M.
メローニ G.
マルティーノ P.A.
他。
腸管外病原性大腸菌:病原因子と抗生物質耐性。
病原体。2021; 10: 1355
論文で見る
Google Scholar
エンゲヴィク M.A.
ダンホフ H.A.
ルアン W.
他。
フソバクテリウム・ヌクレアタムは外膜小胞を分泌し、腸の炎症を促進する。
MBio. 2021; 12: e02706-e02720
論文で見る
(88件)
PubMed
クロス
グーグル奨学生
パチェコ A.R.
スペランディオV.
腸内病原菌は微生物叢が作り出す腸の栄養環境を悪用する。
Microb Spectr.
論文で見る
グーグル・スカラー
シャム H.P.
Yi E.
Yu S.
et al.
TLR/IL-1Rシグナル伝達の負の制御因子であるSIGIRRは、腸内細菌病原体によるコロニー形成に対する微生物叢依存的抵抗性を促進する。
PLoS Pathog. 2013; 9e1003539
論文で見る
Google Scholar
シヴィニョン A.
シェルヴィ M.
シュヴァラン C.
et al.
クローン病における微生物叢標的化戦略を評価するための付着性侵襲性大腸菌コロニー形成マウスモデル。
Dis Model Mech. 2022; 15dmm049707
論文で見る
Google Scholar
ノイマン M.
Steimle A.
グラント E.T.
et al.
特異的病原体フリーマウスにおける食物繊維の欠乏は、腸粘膜病原体Citrobacter rodentiumに対する感受性を促進する。
Gut Microbes. 2021; 13e1966263
論文で見る
Google Scholar
ラウ T.C.
フィービッヒ・コミンA.A.
シェーラーC.R.
et al.
低食物繊維は肥満とは無関係にクローン病関連病態の腸管拡大を促進する。
Am J Physiol Endocrinol Metab. 2023; 321: E338-E350
論文で見る
グーグル学者
リー J.
Lee H.
キム T.K.
ら。
肥満食が誘発する腸管バリア機能障害と病原体の拡大は、実験的大腸炎を悪化させる。
PLoS One. 2017; 12e0187515
論文で見る
Google Scholar
カミネロ A.
マッカヴィル J.L.
ガリポー H.J.
他
十二指腸細菌のタンパク質分解活性は、プロテアーゼ活性化受容体-2を介して食事性抗原に対する感受性を決定する。
Nat Commun. 2019; 10: 1198
論文で見る
スコープス (90)
PubMed
クロス
グーグル奨学生
ダラル S.R.
コーエン R.D.
炎症性腸疾患患者において生物学的製剤が効かない場合の対処法。
Gastroenterol Hepatotol. 2015; 11: 657-665
論文で見る
グーグル・スカラー
トルナー M.
ロフタス E.V.
ハームセン W.S.
他。
炎症性腸疾患患者における日和見感染の危険因子。
Gastroenterology. 2008; 134: 929-936
論文で見る
スコパス(907)
PubMed
要旨
全文
全文PDF
グーグル奨学生
工藤寿夫
青柳雄一
藤井 隆
他.
潰瘍性大腸炎でステロイド治療中の小児におけるCandida albicans大腸炎の発症。
J Pediatr Gastroenterol Nutr.
論文で見る
PubMed
クロスフィルム
グーグル奨学生
カルデイラL.
ボルバ H.H.
トニンF.S.
他。
炎症性腸疾患患者における糞便微生物叢移植:系統的レビューとメタアナリシス。
PLoS One。2020; 15e0238910
論文で見る
スコープス (57)
PubMed
クロス
グーグル奨学生
フエンテス S.
ロッセン N.G.
スペックMJヴァン・デル
他
糞便微生物叢移植後の潰瘍性大腸炎における長期寛解の微生物シフトとシグネチャー。
ISME J. 2017; 11: 1877-1889
論文で見る
スコープス (151)
PubMed
クロス
グーグル奨学生
カーン K.J.
ウルマンT.A.
フォードA.C.
他。
炎症性腸疾患における抗生物質療法:系統的レビューとメタ解析。
Am J Gastroenterol. 2011; 106: 661-673
論文で見る
スコープス (445)
PubMed
クロス
グーグル奨学生
タウンゼント C.M.
パーカーC.E.
マクドナルドJ.K.
他
クローン病における寛解導入と維持のための抗生物質。
Cochrane Database Syst Rev. 2019; 2: CD012730
論文で見る
PubMed
Google Scholar
Blichfeldt P.
ブロムホフJ.P.
Myhre E.
他
クローン病におけるメトロニダゾール。二重盲検クロスオーバー臨床試験。
Scand J Gastroenterol. 1978; 13: 123-127
論文で見る
PubMed
クロス
グーグル奨学生
トゥルネン U.
ファルッキラ M.
Valtonen V.
シプロフロキサシンによる潰瘍性大腸炎の長期治療:前向き二重盲検プラセボ対照試験。
Gastroenterology. 1999; 117: 282-283
論文で見る
PubMed
グーグル奨学生
フェデリーチ S.
クレド・ルッソS.
バルデR.
他
腸内炎症治療のためのファージ・コンソーシアによるヒトIBD関連腸内細菌叢常在菌の標的化抑制。
Cell. 2022; 185: 2879-2898
論文で見る
スコパス(127)
PubMed
要旨
全文
全文PDF
グーグル奨学生
モアイェディ P.
スレットM.G.
キム P.T.
他
無作為化比較試験において、活動性潰瘍性大腸炎患者において、糞便微生物叢移植が寛解を誘導した。
Gastroenterology. 2015; 149: 102-109.e6
論文で見る
スコープス(1111)
PubMed
要旨
全文
全文PDF
グーグル奨学生
パラムソティ S.
パラムソティ R.
ルービンD.T.
et al.
炎症性腸疾患に対する糞便微生物叢移植:系統的レビューとメタ解析。
J Crohn's Colitis. 2017; 11: 1180-1199
論文で見る
スコープス (304)
PubMed
クロス
グーグル奨学生
陳琪。
ファン Y.
Zhang B.
et al.
カプセル化糞便微生物叢移植は、腸内微生物のコロニー形成により潰瘍性大腸炎患者の寛解を誘導する。
Microbiol Spectr.
論文で見る
Google Scholar
Pigneur B.
ソコル・H.
炎症性腸疾患における糞便微生物叢移植:聖杯の探求。
Mucosal Immunol. 2016; 9: 1360-1365
論文で見る
スコープス (60)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
ドレイパー L.A.
ライアン F.J.
スミス M.K.
他。
糞便微生物移植成功後のドナーバクテリオファージによる長期コロニー形成。
Microbiome. 2018; 6: 220
論文で見る
スコープス (92)
PubMed
クロス
グーグル奨学生
クアランタG.
イアニーロG.
マイオFデ
et al.
「細菌コンソーシアム」:Clostridioides difficile感染症治療のための糞便微生物叢移植の進化の可能性。
Biomed Res Int.
論文で見る
グーグル・スカラー
論文情報
出版履歴
オンライン公開 2023年9月19日
受理済み 受理:2023年9月7日
受理:2023年4月1日 受理:2023年4月1日
脚注
利益相反 著者らは利益相反を公表していない。
資金提供 Ashley GillilandはCanadian Institutes of Health Research Canada Graduate Scholarship(CGS-D)の支援を受けている。Travis J. De WolfeはMichael Smith Foundation for Health Research Trainee Awardの支援を受けている。Vallance研究室のIBD研究は、カナダ保健研究所のプロジェクトおよびチーム助成金(PJT-178090およびMT2-168050)、およびカナダCrohn's and Colitis Canadaの助成金の支援を受けている。Bruce VallanceはCH.I.L.D. Foundation Chair in Pediatric Gastroenterologyを務めている。
太字の著者名は共同筆頭著者であることを示す。
身分証明書
DOI: https://doi.org/10.1053/j.gastro.2023.09.019
著作権
© 2024 The Author(s). AGA Instituteの委託によりElsevier Inc.が発行。
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図のサムネイルgr1
図1CDを促進する可能性のある病原体の多様なメカニズム。(A) C innocuumは回腸内腔からMATに移動し、そこでピルビン酸の代わりに脂肪細胞によって産生されるβ-ヒドロキシブトリン酸を使用することができる。(B)パルビュラムは硫黄含有アミノ酸を発酵させ、過剰なH2Sを産生する。その結果、粘液中のジスルフィド結合が減少し、微生物群が上皮層にアクセスできるようになり、T細胞が活性化して炎症が引き起こされる31,70,72。これは、硫酸塩を還元することで高レベルのH2Sを産生する、以前にUC患者の病原細菌として報告されたデスルホビブリオ種の作用とは異なる67,69 (C) R gnavusは一般的な腸内常在菌であるが、CD患者では株の変異が大きく、粘液分解が亢進する結果、大発生する77。カプセルを持たず、炎症性多糖類を保有するR gnavus種は、樹状細胞との相互作用を通じて炎症反応を誘導することができる。赤の矢印は、病原体の作用機序から効果が増加するか減少するかを示す。破線は、他の研究グループやより大規模なコホート/患者研究によってさらなる検証が必要な仮説的メカニズムを示す。DCは樹状細胞、TはT細胞。BioRender.comで作成。
図サムネイルgr2
図2UC患者における病原性大腸菌は炎症を促進する可能性がある。(A)ExPECに分類される大腸菌株は、IEC接着のためのFimHや、IECのタイトジャンクションを破壊して樹状細胞(DC)の死と炎症を引き起こすα-ヘモリシンなど、病原性を持つ可能性のある遺伝子を保有している87,88 (B)腸内常在菌のB(Phocaeicola)vulgatusは、腸管透過性を増加させるプロテアーゼやエラスターゼを分泌し、UCの重症度と相関するため、患者のバイオマーカーとして働く19,97。さらに、ompAという遺伝子の変異は、in vitroでの細胞接着を増加させ、感受性の高い人では病原性を悪化させる可能性がある。BioRender.comで作成。
図のサムネイルgr3
図3この図は、病原体の単離と特性解析に用いられる方法をまとめたものである。IBD患者の内視鏡検査で、疾患部位の粘膜洗浄液を採取する。免疫原性株は、フローサイトメトリーを用いて抗体でコートされた微生物を認識することにより選別される。候補株は直接シークエンシングされるか、選択培地にプレーティングされ、自動コロニーピッキングシステムを用いてピッキングされる。各コロニーはシーケンスまたはMALDI-TOFによって同定される。病原性株は、病原性遺伝子の発現や、付着、侵入、バリア破壊などのin vitroアッセイによって特徴づけられる。さらに、IL-10-/-マウスの自然大腸炎を促進する能力や、デキストラン硫酸ナトリウム誘発大腸炎を起こしたASF(altered schaedler flora)コロニー化グノトビオティックマウスなど、様々な大腸炎モデルを用いて、病原性株の病態を明らかにすることができる。BioRender.comで作成。
図サムネイルgr4
図4病原体を標的とした潜在的治療戦略の概要。(1)微生物療法:微生物群集内のバランスを回復させ、ディスバイオシスを緩和し、病原体の影響を軽減するFMTのような介入。(2)抗接着薬:FimHアンタゴニストのようなマンノシドは、病原体のIECへの付着と侵入を防ぐ。BioRender.comで作成。
関連記事
ホーム
発展途上国へのアクセス
論文・号外
現在の課題
課題一覧
特別号
プレス記事
サプリメント
トピックコレクション
マルチメディア
ビデオ
DDWアブストラクト
CME
著者向け
アブストラクティング
カバーアートの投稿
図に関するFAQ
図表抄録
著者向けガイド
メディカルイラストレーションFAQ
研究者アカデミー
国際的な著者のためのリソース
ソーシャルメディア
スタイルガイド
原稿を投稿する
ジャーナル情報
Gastroenterologyについて
編集委員会
連絡先
アクセス
編集委員会
胃腸ダイジェスト寄稿者 利益相反
広告主情報
再利用の許可
報道差し止め
新着情報
購読申し込み
AGA
AGAホーム
AGAモバイル
AGAに入会する
フォローする
ユーチューブ
X (旧ツイッター)
フェイスブック
このサイトのコンテンツは医療従事者向けです。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ 著作権 © 2024 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&コンタクト
RELX
この記事が気に入ったらサポートをしてみませんか?
