腸粘膜細胞は迷走神経にαシヌクレインを伝達する
腸粘膜細胞は迷走神経にαシヌクレインを伝達する
https://www.biorxiv.org/content/10.1101/2023.08.14.553305v2.full




View ORCID ProfileRashmi Chandra, Arpine Sokratian, Katherine R. Chavez, Stephanie King, Sandip M. Swain, Joshua C. Snyder, View ORCID ProfileAndrew B. West, Rodger A. Liddle
doi: https://doi.org/10.1101/2023.08.14.553305
この論文はプレプリントであり、査読の認証を受けていません。
00001015
要旨全文情報/履歴メトリクスプレビューPDF
概要
疫学的および病理組織学的知見から、ミスフォールドしたα-シヌクレインタンパク質が腸から脳へと広がり、パーキンソン病(PD)のリスクを高める可能性が指摘されている。マウスモデルを用いた過去の実験的研究では、腸から脳へのα-シヌクレインの移行を研究するために、外因性組換えα-シヌクレイン線維の腸内注射に依存してきたが、腸内でミスフォールディングしたα-シヌクレインがどのような起源を持つ可能性があるのかは不明なままであった。我々は最近、腸粘膜の感覚細胞がα-シヌクレインを発現していることを証明した。本研究では、ヒトα-シヌクレインを発現するマウス腸管オルガノイドを用い、α-シヌクレインの発現がない迷走神経節ニューロンと共培養したオルガノイドにおいて、腸管上皮細胞からのα-シヌクレインタンパク質の移行を観察した。病的なヒトαシヌクレインを発現し、マウスαシヌクレインを発現しない無傷マウスでは、αシヌクレイン線維鋳型形成活性が、腸、迷走神経、背側運動核の組織におけるαシヌクレイン播種線維凝集アッセイで出現する。病理学的ヒトαシヌクレイン発現を腸上皮細胞に制限する新しいトランスジェニックマウスでは、αシヌクレイン線維鋳型形成活性は迷走神経と背側運動核に移行する。腸上皮細胞にα-シヌクレイン発現が誘導される前に横隔膜下迷走神経切開を行うと、後脳はα-シヌクレイン線維鋳型形成活性の出現から効果的に保護される。全体として、これらの知見は、腸粘膜細胞で生じる可能性のある、線維状α-シヌクレインタンパク質の新たな非神経細胞源としての可能性を強調するものである。
はじめに
パーキンソン病(PD)は、硬直、安静時振戦、徐脈などの特徴的な運動障害を伴う衰弱性の神経変性疾患である。多くの患者は便秘などの消化器症状にも悩まされ、特徴的な運動障害に10年以上先行することが多い1。PDの病理学的特徴は、脳と末梢神経系の両方に蓄積するα-シヌクレインの線維化した細胞内蛋白質封入体である。PDのドーパミン作動性神経細胞では、レビー小体として知られる封入体が神経細胞の脆弱性と変性に関連している2,3。脳全体では、α-シヌクレインは通常、興奮性ニューロンのシナプス前末端やその他のニューロンサブタイプに存在し、エンドサイトーシスやシナプス小胞機能に関与している4。A53TやA30Pなどのα-シヌクレイン遺伝子(SNCA)の変異やSNCA遺伝子座の増殖は、家族性PDを引き起こす可能性がある5,6。α-シヌクレインタンパク質のより顕著な特徴の一つは、チオフラビンのようなアミロイド色素に高い親和性を持つβシートに富んだタンパク質線維に凝集する本質的な能力である7-9。これらのα-シヌクレイン線維は、プリオン様カスケードという仮説の中で、相互に連結した細胞間に拡散する能力があると提唱されている10-13。転移されたα-シヌクレインは、より大きな線維や封入体を形成しうる付加的な凝集体の播種14-16を行うために、受容細胞内のネイティブα-シヌクレインをリクルートするかもしれない17,18。脳と脳脊髄液におけるα-シヌクレイン線維と鋳型形成活性の存在は、PDにおいて、タンパク質ミスフォールディング環状増幅法(PMCA)とリアルタイムクエーキング誘導転換法(RT-QuIC)を含む新しく開発された播種凝集アッセイ(SAA)を用いて測定することにより、確信をもって証明されている19。α-シヌクレインRT-QuICアッセイでは、PD患者の十二指腸生検で播種活性が認められたが、健常対照者では認められなかった20。このアッセイで活性を引き起こすα-シヌクレインシードの起源は明らかではない。ラットモデルでは、α-シヌクレインの病理学的蓄積の引き金となるシードは、ニューロンや脳で発生して腸に下降するか、あるいは腸のどこかで発生して脳に上昇すると考えられている21。
臨床的および実験的データは、腸がPD感受性に関与している可能性を示している。便秘などの消化器症状がPDの運動症状に先行することが多いだけでなく22-24、実験的には、ネズミのモデルにおいて、腸に導入された外因性αシヌクレイン線維が脳に広がることが示唆されている25-27。異常なα-シヌクレイン凝集体は、PD発症以前に腸管神経系で病理組織学的に同定されている22。α-シヌクレイン病態に腸神経系が関与していることを支持する証拠としては、α-シヌクレイン免疫反応性封入体が粘膜下神経叢のニューロンに局在し、その軸索は腸粘膜28-30および腸管神経叢に投射され、迷走神経の入力と平行していることが観察されている31。A53Tトランスジーンを保有するマウスは、大腸通過時間の延長や便秘と一致する排便量の減少など、腸神経系の機能障害を示した32,33。動物において、α-シヌクレインの迷走神経経路は、α-シヌクレインのミスフォールディングを引き起こす可能性のある環境毒性物質ロテノンへの曝露34や、迷走神経ニューロンでヒトα-シヌクレインを過剰発現するアデノ随伴ウイルスベクターの直接注射35によっても証明されている。さらに最近では、迷走神経切断によって、α-シヌクレイン線維を感受性のあるマウスの腸に注射したときに脳凝集体の形成が阻止されることが証明され、病原性線維が腸の神経末端から脳へと広がる可能性が示された25,36。しかし、迷走神経を脳への(あるいは脳からの)導管として利用するかもしれない、ミスフォールドしたα-シヌクレインタンパク質の生理学的な起源は不明であった。1つの手がかりは、疫学的観察から、患者の迷走神経完全切断がPDのリスク低下と関連することが示唆されていることであろう。このことは、少なくとも一部のPD症例において、腸におけるα-シヌクレインの凝集が後のPDリスクに重要であることを示唆している37-39。
最近、腸管粘膜の腸内分泌細胞(EEC)が培養やマウスの無傷の腸内で神経細胞と結合していることが発見された40。生体内で改良型狂犬病ウイルス追跡法を用いると、PYYを発現するEECと結腸のニューロンとの間にシナプス結合が確認された40。食器での共培養実験では、コレシストキニン(CCK)を含むEECと感覚ニューロンが自発的なシナプス結合を形成している40,41。このように、EECとニューロンとの間には、もともと親和性があるようだ42。EECは腸管内腔に露出しており、食事、マイクロバイオーム、環境からの数多くの化学的・物理的刺激に反応する40,43-45。長い間、EECはもっぱら腸管ホルモンを産生すると考えられてきたが、現在ではEECがニューロン様の性質を持ち、そのニューロン様表現型の一部にはαシヌクレインの内因性発現が含まれることが知られている42,46。EECは神経伝達物質やその他の典型的なシナプス前タンパク質を発現し、時にニューロポッドと呼ばれる軸索様突起を持ち、それを介して近くの神経に接続する40,41。腸から脳への播種活動に寄与するかもしれない、病的αシヌクレインの新たな細胞供給源の可能性を探るため、ここではオルガノイドとトランスジェニックマウスを用いて、αシヌクレインが腸粘膜細胞から迷走神経に広がる可能性があるかどうかを調べた。
結果
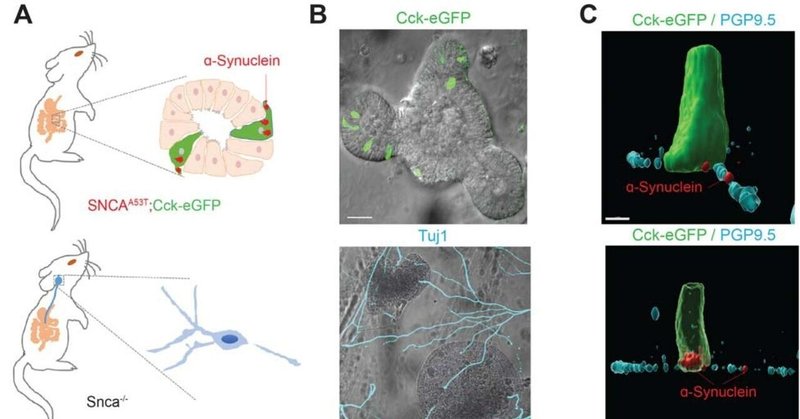
腸管では、EECは細長いまたはフラスコ状の細胞として存在し、過去の免疫組織化学的解析によるとα-シヌクレインタンパク質を高レベルで発現している46。EECの先端面は通常腸管内腔に開口しており、基底面は神経細胞に近いラミナ上にある(図1A)。病的な(すなわちヒトA53Tα-シヌクレイン)α-シヌクレインタンパク質の拡散の可能性を研究するため、内在性Sncaを欠失させ、代わりにヒトA53Tα-シヌクレインをコードするPAC(SNCAA53T)から発現させたα-シヌクレインタンパク質で置換したヒト化α-シヌクレインマウスモデルを樹立した。このマウス系統は、生理的レベルのα-シヌクレインレベルで、軽度だが広範なpS129-α-シヌクレインタンパク質の蓄積を発症することが知られており32,47、生後3ヶ月までに腸管神経節にα-シヌクレイン免疫反応性凝集塊を発症し、早期の胃腸機能障害も発症する32。Cck-eGFPマウス(EECsで増強緑色蛍光タンパク質を発現)を、同じく内因性マウスα-シヌクレインを持たないPAC-Tg(SNCAA53T)48発現マウスと交配し、PAC-Tg(SNCAA53T;Cck-eGFP;Snca-/-)を作製した。以下、このマウス系統をSNCAA53Tと呼ぶ。SNCAA53Tマウスは正常に発育し、ヒトαシヌクレインの発現を示し、主に腸のEECの基底極に局在する(図1B)。Cck-eGFPの発現は、腸管近位部におけるEECの一部を区分している40,41。腸の迷走神経支配は近位腸で最も密で、結腸では減少する49。したがって、α-シヌクレインの神経細胞拡散の可能性を調べるため、私たちは小腸に注目した。ヒトα-シヌクレインタンパク質の高感度ELISA分析によると、迷走神経節でのα-シヌクレインの発現は、十二指腸や上部腸での発現がはるかに高い(組織1mgあたり約140ng、図1D)のに比べ、低い(組織1mgあたり約170pg、図1C)。結節性神経節におけるα-シヌクレインタンパク質のレベルは後脳に比べてはるかに低いにもかかわらず、単離された神経節組織はRT-QuICアッセイで線維播種活性の陽性を示した(閾値までの滞留時間5.79時間/1.43時間、図1F)。RT-QuIC反応における滞留時間は、濃度既知の組換えフィブリルの標準曲線に従って、結節組織からの溶解物中のα-シヌクレインフィブリルシードの可能なフェムトモル濃度を示した(補足図1)。腸組織と後脳組織でも、閾値までの滞留時間19.1時間/5.5時間に対応する同等のRT-QuICシグナルが観察された(図1G,H)。ヒトα-シヌクレインが発現していないマウスの同じ部位から同じ時間に解剖・処理された組織では、同等の線維形成活性は認められなかった(図1F-H)。これらの結果は、もともとPAC-Tg(SNCAA53T)マウス系統の腸管における免疫組織化学的検査で腸管αシヌクレイン病態の存在を証明したKuoらの観察を拡張するものである32。
図1.
図をダウンロードする
新しいタブで開く
図1.
SNCAA53Tマウスにおけるαシヌクレインの発現と播種活性。
(A,B)SNCAA53Tマウスから採取した十二指腸の免疫染色。緑色蛍光タンパク質(緑色)を発現している内分泌細胞(EEC)は他の粘膜細胞(DAPI標識核、青色)の中に散在しており、絨毛の固有層では汎神経マーカーPGP9.5(シアン)で染色された線維を含むαシヌクレイン(赤色)に近接している。Snca-/-マウスおよびSNCAA53Tマウスの(C)十二指腸(結節組織1mgあたりナノグラム単位のα-シヌクレイン定量)、(D)結節神経節(結節組織1mgあたりピコグラム単位のα-シヌクレイン定量)、および(E)後脳(結節組織1mgあたりナノグラム単位のα-シヌクレイン定量)におけるヒトα-シヌクレインのELISA定量。Snca-/-マウスとSNCAA53Tマウスの(F)十二指腸、(G)結節神経節、(H)後脳のRT-QuIC解析。スケールバーはパネルAでは30μm、パネルBでは10μmと1μm(挿入図)。有意性は対応のないt検定で決定し、***P<0.001とした。
病的なα-シヌクレインがEECに発現していること、EECは腸粘膜下神経線維に近接していることから、EECに発現したα-シヌクレインが隣接神経に広がる可能性があるかどうかを検討した。この可能性を検討するため、SNCAA53Tマウス由来の腸管オルガノイドを、α-シヌクレインが全く発現していないSnca-/-マウス由来の結節神経節ニューロンと共培養した(図2)。腸管神経節は低レベルのα-シヌクレインタンパク質をネイティブに発現している可能性があるが(図1C)、Snca-/-マウス由来の神経細胞を培養し、Snca-/-マウスで既に検証されたモノクローナル抗ヒトα-シヌクレイン抗体50を用いることで、腸管オルガノイドから共培養神経への本物のα-シヌクレインの広がりを確実に検出することができる。オルガノイド内では、EEC(eGFP発現で同定)はその先端面が管腔に開いている(図2B)。オルガノイドはマトリゲルマトリックス内で静止したままであることから、Snca-/-マウス由来のPGP9.5またはニューロン特異的クラスIIIチューブリン(Tuj1)が強く発現している神経線維は、EECの基底面に向かって伸長しているように見え、オルガノイドがin vitroで神経線維を引き寄せて連結していることが示された。このような結果は、単離したEECsを用いた以前の観察結果と一致している40,41,51。予想通り、Snca-/-マウスの神経線維は免疫組織化学的にα-シヌクレインを検出できなかった(補足図2)。5日以内に、いくつかの神経線維はオルガノイドに向かって成長し、EECsと密接に接触しているように見えた(すなわち、CCK陽性細胞、図2C-E)。腸オルガノイド内のSNCAA53TマウスのCCK陽性EEC(緑)は、容易に検出可能なαシヌクレイン(赤)を発現している。さらに印象的だったのは、CCK-eGFP陽性細胞近傍のPGP9.5(汎神経細胞特異的マーカー)神経突起伸長部内にα-シヌクレインタンパク質が顕著に認められたことである(図2C)。α-シヌクレインタンパク質はEECの細胞質に分布していたが、Snca-/-マウスの神経突起内では、PGP9.5陽性の神経突起の長さ方向にパッチ状に共局在していた。転写されたα-シヌクレインタンパク質は、EEC細胞に隣接する基底部オルガノイド表面のPGP9.5突起に沿って検出された(図2C)。α-シヌクレインタンパク質はTuj1陽性神経突起でも同様に観察されたが、神経線維染色はより均一に見えた(図2D-E)。オルガノイド系特有の高密度、および共培養神経節の高い連結性と動的な伸長のため、α-シヌクレインの隣接神経線維への移行を促進する臨界距離を確認することはできなかった。たとえ2次元チャンバー細胞を用いた他の研究が、移行には細胞間の直接接触が必要であることを示唆していたとしても42。α-シヌクレインタンパク質は、PGP9.5あるいはTuj1陽性の神経節伸長部と物理的に接触しているEECの基底部および側方領域からも出現しているようであった。
図2.
図をダウンロード
新しいタブで開く
図2.
ヒトA53Tα-シヌクレインタンパク質は腸細胞から隣接する迷走神経細胞へ移行する。
(A)CCK含有細胞が増強型緑色蛍光タンパク質(eGFP)を発現するSNCAA53Tマウスから腸オルガノイドを調製し、内因性αシヌクレインを欠損したSnca-/-マウスから迷走神経節ニューロンを単離した。(B)5日間共培養したオルガノイドとニューロンの代表的な画像。オルガノイド内のeGFP陽性細胞(緑)と、ニューロン突起を強調するβ-チューブリン(シアン)。(C)eGFP陽性EECの代表的な高倍率αシヌクレイン(赤)染色。赤矢印はSnca-/-マウスニューロンにおけるPGP9.5(シアン)陽性過程への局在を示す。(D,E)ニューロン特異的クラスIIIチューブリン(Tuj1、シアン)を用いた代表画像。表面および(隣接する)細胞内共焦点スライスを示す。スケールバーはパネルBで30μm、パネルCで3μm、パネルDとEで5μm。
無傷の哺乳動物において、腸からニューロンへのα-シヌクレイン転移が起こるかどうか、また転移されたα-シヌクレインタンパク質が神経節突起に沿って(例えば背側運動核まで)移動する可能性のある距離を決定するために、ヒト野生型および変異型α-シヌクレインアイソフォームを腸粘膜のみで過剰発現させる新しいトランスジェニック戦略を開発した。このアプローチはvillin-Cre条件的発現に基づいている。凝集しやすい変異型ヒトα-シヌクレイン(すなわちA53T)と野生型タンパク質のどちらがEECから神経へ移行しやすいかは不明であるが、最近報告された「Crainbow」マウスモデリングアプローチを利用して、同じ組織52で病理学的SNCA遺伝子変異体を発現させた。ヒトSNCAの3つの型(野生型、A30P、A53T変異体)を、ROSAターゲットベクターから共発現させたスペクトル分解可能な蛍光タンパク質で蛍光標識し、α-シヌクレイン-Crainbowマウスを作製した(図3A、補足図3)。SNCAbowマウスは、核内TagBFPと共発現したヒト野生型αシヌクレイン(SNCAWT:TagBFP)、核内mTFP1と共発現したSNCAA30P(SCNAA30P:mTFP1)、および核内mKOと共発現したSNCAA53T(SNCAA53T:mKO)をコードする。Cre-recombinase活性がない場合、近赤外Fluorogen Activating Protein(FAP)のみが発現する。SNCAbowマウスとvillin-Cre(Vil-Cre)マウスを交配すると、組換えが起こり、SNCAWT:TagBFP、SNCAA30P:mTFP1、またはSNCAA53T:mKOのいずれかが発現する(図3A)。この遺伝子コンストラクトから、蛍光タンパク質と対応するα-シヌクレインが、翻訳時に2つの異なるポリペプチドを持つ単一のmRNA転写産物として産生された[青色のTagBFP / SNCAWT、ターコイズ色のmTFP1 / SNCAA30P、オレンジ色のmKO / SNCAA53T]。腸オルガノイドを用いて発現を検証したところ、3つの蛍光色(青、ターコイズ、オレンジ)すべてが発現しており、3つのヒトαシヌクレイン遺伝子(野生型、A30P、A53T)すべてが腸粘膜で特異的に発現していることが示された(図3B)。興味深いことに、培養オルガノイドの中には1色しか発現しないものもあれば、複数の色を発現するものもあった。この発現パターンは、多くのオルガノイドで典型的なクローン性増殖と一致する。われわれは以前、免疫組織化学で観察されたように、腸粘膜細胞ではα-シヌクレインはEECにのみ出現することを観察した46。外部刺激やあらかじめ形成されたα-シヌクレイン線維などを加えることなく、培養中の腸オルガノイドでは、SNCAA53Tマウスから培養したオルガノイドで観察されたものとほぼ同等のα-シヌクレイン線維鋳型形成活性が検出された(図3C,D)。対照的に、Snca-/-マウスからマッチングしたオルガノイドでは、観察可能な播種活性は見られなかった。
図3.
図をダウンロード
新しいタブで開く
図3.
条件付きヒトα-シヌクレイン発現は、腸オルガノイドにおいてα-シヌクレインの播種活性を誘導する。
(A)SNCAbow発現構築物は、ニワトリβ-アクチンプロモーター(図示せず)の下流に4つのタンデムカセットを含む。最初のカセット(図示せず)は化学的に誘導可能な近赤外蛍光活性化ペプチド(FAP-Mars1)を発現する。次の3つのカセットはユニークな蛍光タンパク質(TagBFP:青、mTFP1:シアン、mKO:オレンジ)と対応するヒトシヌクレインタンパク質SNCAWT、SNCAA30P、SNCAA53Tをコードする。トランスジェニックマウスをVil-Cre株と交配させると、3対の直交するlox部位(LoxN、Lox2272、LoxP)によるCreを介した組換えにより、任意の粘膜細胞で単一の蛍光タンパク質マーカーと対応するヒトαシヌクレインが発現する。(B)小腸オルガノイドの顕微鏡写真。SNCAbowマウスの粘膜における3つの蛍光タンパク質の発現を示し、SNCAWT:TagBFP(青)、SNCAA30P:mTFP1(青緑)、SNCAA53T:mKO(橙)。スケールバー=30μm。(CおよびD)6ヶ月齢のSnca-/-マウス、SNCAA53Tマウス、SNCAbowマウスの結節神経節のRT-QuICエンドポイントチオフラビンT蛍光分析。(C)これらの遺伝子型の代表的なチオフラビンT蛍光プロファイルを示す。(D)エンドポイント値は、陰性対照に対するRT-QUICの100時間後に収集した。データは、各系統について3匹のマウスから3連で収集し、合計した。有意性は、Snca-/-に対するDunnettのポストホック分析を用いた一元配置分散分析によって決定した。
villin-Cre発現によってα-シヌクレインタンパク質の発現が誘導されたSNCAbowマウスの腸では、免疫蛍光によって腸粘膜細胞にα-シヌクレインタンパク質が検出されたが(図4A,B)、粘膜下腸神経には検出されなかった。ヒトα-シヌクレイン導入遺伝子を4コピー持ち、腸内で生理的レベルで発現しているSNCAA53Tマウスでは、EECにおける顕著なα-シヌクレイン免疫染色が容易に可視化されることを以前に証明した46。しかし、ヒトα-シヌクレインタンパク質(マウスα-シヌクレインタンパク質と交差反応しない)の高感度ELISA法では、SNCAbowマウスの迷走神経に移行したヒトα-シヌクレインタンパク質の存在が検出された(図4C)。注目すべきは、腸内のvillin-Cre発現上皮(EECを含む)から移行したと推定されるα-シヌクレインのレベル(総タンパク質mgあたり約15 pg)は、PAC-ヒトα-シヌクレイントランスジェニックマウス(図1C)の神経節で検出されたα-シヌクレインのレベルの約1/10であったことである。迷走神経に存在するα-シヌクレインは、おそらく腸のvillin-Cre発現細胞から移行したものと思われ、レベルが低いにもかかわらず、線維形成活性を測定するためのRT-QuIC法では、SNCAbow迷走神経における強固な線維形成活性が検出された(図4D,E)。対照的に、迷走神経に正常濃度のマウスαシヌクレインしか存在しない非トランスジェニックマウスでは、有意な鋳型形成活性は確認できなかった。これらの結果は、病的なα-シヌクレインタンパク質の発現を本質的に欠く迷走神経にα-シヌクレインタンパク質を移行させるSNCAbowトランスジェニックマウスでは、病理学的なテンプレーティング陽性のα-シヌクレインタンパク質の種が腸細胞に由来する可能性を示唆している。各発現α-シヌクレイン遺伝子(WT、A30P、A53T)が迷走神経のRT-QUICシグナルに寄与する割合を識別することはできなかった。
図4.
図をダウンロード
新しいタブで開く
図4.
腸粘膜細胞における条件付きヒトαシヌクレイン発現は、結節神経節におけるαシヌクレイン播種活性をもたらす。
(A)SNCAbowマウス十二指腸粘膜細胞(腸細胞およびEEC)における蛍光タンパク質マーカーBFP(青)、TFP(ターコイズ)およびmKO2(オレンジ)の発現を示す。α-シヌクレイン(マゼンタ)免疫染色は、EECと一致する単一の腸粘膜細胞に存在する(スケールバー=10μm)。(B)SNCAbowマウスの十二指腸。腸陰窩と絨毛を支配するPGP9.5陽性神経線維(マゼンタ)を示す(スケールバー=50μm)。(C)非トランスジェニックマウス、Snca-/-マウスおよびSNCAbowマウスの結節神経節におけるヒトα-シヌクレインタンパク質のELISAによる定量。(D)非トランスジェニック(nTg)マウス、Snca-/-マウス、SNCAbowマウスの1ヶ月齢の結節神経節の代表的なチオフラビンT蛍光プロファイル(RT-QuIC)とエンドポイント解析。(E)6ヶ月齢のnTgマウス、Snca-/-マウス、SNCAbowマウスの結節神経節のRT-QuIC解析。有意性はSNCAbowに対する一元配置分散分析(Dunnettのポストホック分析)により決定した。
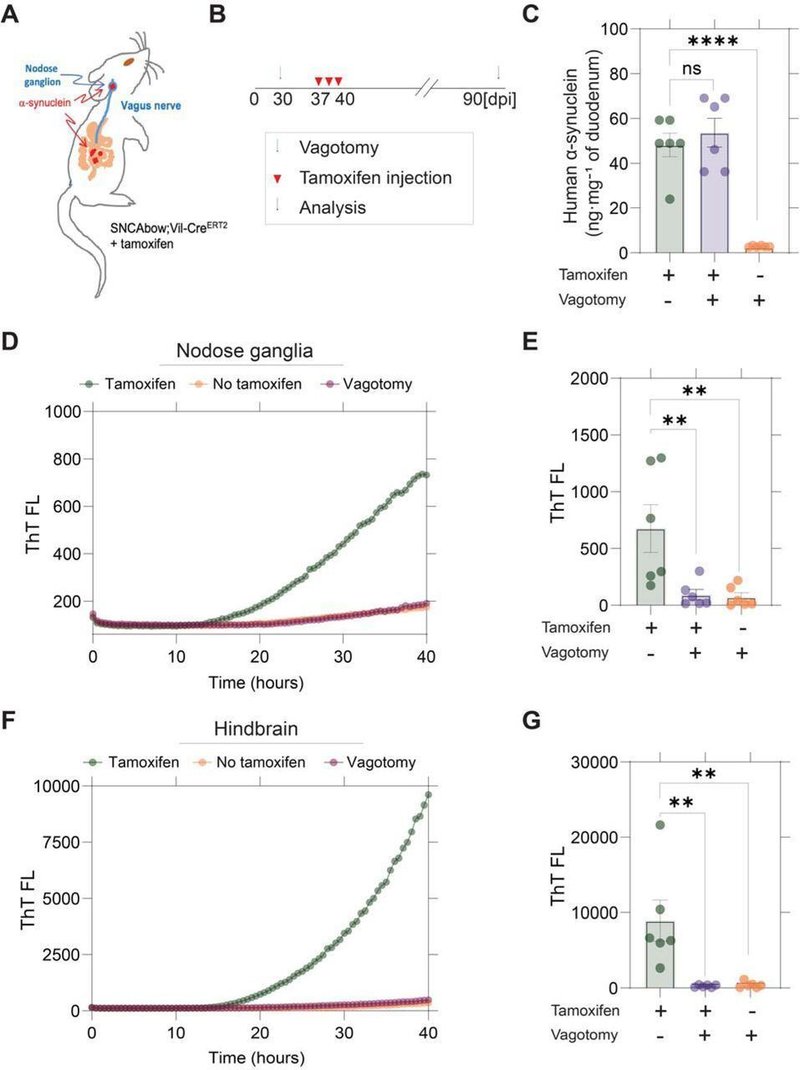
次に、予防的な横隔膜下迷走神経切断術によって、迷走神経、ひいては後脳を、腸細胞からのα-シヌクレインタンパク質の病的移行から守ることができるかどうかを検証した。迷走神経切断成体マウスの腸におけるα-シヌクレインの発現を時間差で誘導するために、SNCAbowマウスとタモキシフェン誘導性Creリコンビナーゼ(SNCAbow;Vil-CreERT2)を交配させ、ヒトα-シヌクレインの発現が誘導される前に老化させ、横隔膜下迷走神経切断術を行った(図5A,B)。タモキシフェン投与3ヵ月後、α-シヌクレインの発現が腸で明らかになったが、迷走神経切断では変化しなかった(図5C)。解剖した迷走神経節における線維形成活性は、タモキシフェン投与後、RT-QuICによって再び検出された(図5D,E)。一方、迷走神経切断術を受けたマウスやタモキシフェン投与を受けなかったマウスでは、鋳型形成活性は検出されなかった。これらの結果は、病的なαシヌクレイン線維活性がSNCAbowマウスの腸細胞から迷走神経を介して後脳に広がっている可能性が高いことを示唆している(図5F,G)。
考察
本研究では、腸粘膜細胞が病理学的なα-シヌクレインタンパク質を腸細胞から神経系に寄与する可能性を探った。オルガノイド・ニューロン混合共培養、SNCAbowマウス、迷走神経切開の有無にかかわらず誘導可能なSNCAbowマウスの3つの実験系から得られたデータが含まれている。これらのデータを総合すると、病的ヒトα-シヌクレインはマウスモデルにおいて、腸粘膜細胞から相互結合神経へ移行することが示された。この研究の主な限界としては、腸におけるトランスジェニックα-シヌクレイン発現に依存していること、変異型ヒト病的α-シヌクレインと野生型α-シヌクレインタンパク質の影響の分離が不十分であることが挙げられる。今後の研究としては、この過程で異なるα-シヌクレインアイソフォームと発現レベルを分離する新しいマウス系統の作製が考えられる。さらに、細胞間移動の分子的性質が、バルクのエキソサイトーシスと取り込みによるものなのか54-57、あるいは、ニューロン間やグリア間の結合に存在するが、腸-脳間のシグナル伝達ではまだ解明されていないトンネル状ナノチューブのような、より精緻な局所的細胞間プロセスなのか、まだ不明である58-61。オルガノイド-ニューロン共培養系は、病的なα-シヌクレインがEECから移行しうるという最初の証拠を提供したが、in vitroモデルとしては限界があった。しかし、SNCAbowマウスにおいてα-シヌクレインの拡散がin vivoでも起こることが確認されたことは、EECからニューロンへの転移の細胞内メカニズムを探るために使用できる共培養システムの妥当性を支持するものである。とはいえ、これらの結果は、病的なα-シヌクレインタンパク質の新たな非神経系の潜在的供給源が存在することを浮き彫りにし、病気のある時点で異常なα-シヌクレインのプールに寄与する可能性を示している。
図5.
図をダウンロード
新しいタブで開く
図5.
膣切開により結節神経節はα-シヌクレインの播種活動から免れ、後脳への拡散が防止される。
(AおよびB)実験モデル。SNCAbow;Vil-CreERT2マウスは、タモキシフェン投与の1週間前に両側横隔膜下迷走神経切断術または偽手術を受けた。(C)タモキシフェン投与3ヵ月後の腸内のα-シヌクレインタンパク質のELISA測定。タモキシフェン投与3ヵ月後の(D,E)迷走神経節神経節および(F,G)後脳のRT-QuIC解析。代表的なチオフラビンT蛍光プロファイルをDおよびFに示す。B、E、Gのデータ点は、タモキシフェン投与群および迷走神経切開なし群に対する有意性を一元配置分散分析(Dunnettのpost hoc分析)により決定した。
**P<0.01、***P<0.0001、n=6。結節神経節のd。すべての画像でバー=20μm。
Braakは、PDの病態は末梢神経で生じ、場合によっては中枢神経系に広がるという仮説を強調した22。脳に出現する前に腸神経でα-シヌクレインの凝集体が同定されたことは、腸から脳への病理学的伝播と一致するかもしれない29,62。しかしながら、疾患(特に疾患モデル)におけるα-シヌクレインに関連したプリオン様活性や、異なるパラダイムで観察されたα-シヌクレインの細胞間移行によれば、破損し、ミスフォールドしたα-シヌクレインは、観察可能な大きな凝集体を形成する細胞で生じる必要はない。本明細書で提示した証拠に基づき、我々は、腸粘膜、特にEECが病的にミスフォールディングしたα-シヌクレインを迷走神経の脆弱な求心性投射に寄与し、それがレビー小体病のリスクの素因になっている可能性があるという仮説を立てた。注目すべきことに、粘膜のEECは、腸管内腔のマイクロバイオームや摂取した農薬などの有害物質の両方と物理的に接触しており、また反対側の神経線維とも接触しているため、PDの脆弱性におけるマイクロバイオームと有害物質曝露の病理生物学をよりよく理解する絶好の機会となっている。
膣切開を行うと、腸から注入された組換え型前形成線維(PFFs)の脳幹への広がりが消失することが知られており、その伝達メカニズムは迷走神経を介して起こる可能性が示唆されている25。ここでは、病的なα-シヌクレインは、あらかじめ形成されたα-シヌクレイン線維の注入によってではなく、野生型あるいは変異型ヒトα-シヌクレインアイソフォームの腸粘膜細胞における過剰発現によって導入された。ELISA分析によると、得られた過剰発現は控えめで、ヒトにおけるα-シヌクレイン発現と生理学的に同等であると報告されているPAC遺伝子導入発現とほぼ同じであった32。EECは消化管全体に分布しているが、迷走神経支配が最も亢進している近位小腸に注目した。
播種増幅法は感度が高いため、PDの初期病態を検出し、PDと非罹患者を区別するために使用される頻度が高まっている63,64。われわれはRT-QuICを用いてα-シヌクレインの早期拡散を検出し、組織溶解液中のα-シヌクレイン量を半定量的に推定した。この方法は、十二指腸や髄液などの組織に対するヒト播種アッセイの結果と類似している20,65。
PD患者から採取した腸内細菌叢をgnotobioticマウスに移植すると、ヒトα-シヌクレイン保有マウスにおけるα-シヌクレイン病態とPDに関連した行動変化が促進される66。不均衡な腸内細菌叢に反応して病的なα-シヌクレインが形成される機序はまだ解明されていないが、微生物や微生物の代謝産物に直接曝露され、反応するEECの役割が標的の可能性があると考えられる67,68。最近、消化管に生息しPDに関連する細菌株であるAkkermansia muciniphilaが、腸内分泌細胞株においてαシヌクレインの凝集を引き起こすことが証明された69。したがって、腸管における病的α-シヌクレインの特異的生息場所は不明であるが、EECにおけるα-シヌクレインの同定と、微生物叢が豊富な腸管内腔と腸管神経線維との境界部にEECが位置していることから、EECが病的α-シヌクレインの形成源であり、拡散する可能性がある46。あるいは、脳内の病的α-シヌクレインがEECに拡散し、病的α-シヌクレインが存在しない神経細胞へと移行する可能性もある。EECが病的なα-シヌクレインを伝達できるかどうかを決定する最初のステップは、オルガノイド培養中のEECからヒトA53Tα-シヌクレインが単離されたSnca-/-結節神経節ニューロンに伝達されることを示したin vitro研究によって確認された。内因性α-シヌクレインを欠く神経とヒトα-シヌクレインに特異的な抗体を用いて、EECが近傍のニューロンに現れるα-シヌクレイン免疫反応性の源であることを立証することができた。この実験により、EECは内因性のα-シヌクレインを隣接する神経に移行させる能力を持っていることが証明された。この過程は、病的なα-シヌクレインが神経系に広がる初期段階である可能性がある。試験管内でEECから結節ニューロンへα-シヌクレインが直接移行しているにもかかわらず、他の細胞型がin vivoでの拡散に寄与しているかどうかは不明である。EECはグリア45と接触し、迷走神経41と同様に腸管ニューロンPMID: 25555217に接続している。α-シヌクレインが腸グリア70に広がり、α-シヌクレインの拡散経路となる可能性はある。迷走神経を含む腸神経へのα-シヌクレインの拡散において、グリアがどのような役割を果たすかは、まだ明らかにされていない。
EECは腸の感覚細胞であり、求心性迷走神経線維と直接連絡している41。これらの細胞におけるαシヌクレイン発現の機能は、まだ明らかにされていない。EECが神経突起に近接していることから、腸管制限モデルの迷走神経でα-シヌクレインを探すことになった。SNCAbowマウスの迷走神経におけるα-シヌクレイン播種活性の検出は、PD患者の迷走神経感覚枝における神経病理学的報告71や、PDの実験モデルにおけるPFFの結節神経節への拡散の可能性27と一致している。しかし、これがPDの一般的な伝播経路であるかどうかはわかっていない。
一般に、病的なαシヌクレインの細胞間伝播を促進するためには、レシピエント細胞におけるαシヌクレインの鋳型化が必要であると考えられている。この点で、α-シヌクレインタンパク質が迷走神経求心性の樹状突起に存在しないことは注目に値する。それにもかかわらず、in vitro共培養実験では、レシピエントニューロン中のα-シヌクレインはα-シヌクレインの取り込みには必要ないことが示された。in vivoでのSNCAbow結節神経節におけるα-シヌクレインの鋳型形成活性の出現は、トランスジェニックヒトα-シヌクレインが少なくとも迷走神経節まで広がることができることを示唆している。したがって、α-シヌクレインが迷走神経求心性神経に移行し、ニューロンの軸索コンパートメントで内因性発現タンパク質による鋳型形成が起こる前に細胞内に広がる可能性は十分にある。迷走神経求心性に沿って起こる伝達が、あるいは脳から腸に戻る伝達が、疾患における疾患表現型を優先的に駆動するのかどうかという疑問は、今後、条件付きで制限されたα-シヌクレイン発現モデルを追加することで、部分的に取り組むことができる主要な問題である。
方法
マウス
すべての実験は、Duke University Institutional Animal Care and Use Committeeの承認を得て行われた。CCK細胞で増強緑色蛍光タンパク質を発現するマウス[Tg(Cck-EGFP)BJ203Gsat](Cck-eGFPと呼ぶ)は、ミズーリ州のMutant Mouse Resource and Research Center(RRID:MMRRC_000249-MU)から入手し、コロニーはスイス・ウェブスター・バックグラウンド(Taconic Biosciences)73で維持した。FVB;129S6-SNCA1NbmTg(SNCAA53T)1NbmTg(SNCAA53T)2Nbm/Jマウス(PAC-SNCAA53T)32およびSnca-/-マウス74はRobert L. Nussbaum (RRID:IMSR_JAX:010788)から入手した。SNCAA53T;Cck-eGFPマウスの作製については前述しており46、本明細書ではSNCAA53Tと呼ぶ。
ヒト野生型、A53TまたはA30P型のα-シヌクレインを、3つの蛍光タンパク質(青、ターコイズ、オレンジ)も保有する改変brainbow遺伝子構築体から発現させた。このようにして、各コピーのコンストラクトからは1つの蛍光タンパク質しか発現させることができなかった。Creリコンビナーゼはビリン・プロモーター(Vil-Cre)により駆動され、消化管の粘膜細胞を標的として発現し、それぞれの幹細胞で異なる蛍光タンパク質が発現する。SNCAbowマウスは、最近報告された技術を用いて作製された52。簡単に説明すると、C末端にタグを付けたα-シヌクレイン遺伝子(V5でタグを付けたSNCA、3XHAでタグを付けたhSNCA-A30P変異体、Mycでタグを付けたSNCA-A53T変異体)をPCRで増幅し、pENTR™プラスミドを作製した。これらのプラスミドはMassachusetts General Hospital Center for Computational & Integrative Biology DNA Core (https://dnacore.mgh.harvard.edu/new-cgi-bin/listing.action)で全塩基配列が決定され、Infusionクローニングによりゲートウェークローニングに適応したROSA26マウスターゲティングベクターにクローニングされた。細菌コロニーから採取したプラスミドDNAを制限酵素消化分析によりマッピングし、陽性コロニーを同定した。プラスミド全体を配列決定し、XhoIで直鎖化し、G4 ES細胞(129/B6NハイブリッドES株、(MMRRC Cat# MMRRC:011986-UCD, RRID:CVCL_E222))にトランスフェクトした。推定陽性ES細胞クローンを処理し、PCRによって相同性アーム全体で検証した。選択された2つのコロニーからのDNAをLA Taq DNAポリメラーゼ(TaKaRa)を用いて増幅し、相同性アーム間の領域を配列決定した。選択したクローンのES細胞をICR/Hsdモルラにマイクロインジェクションし、キメラマウスを作製した。このトランスジェニックマウスをROSA FLPe [Jax-129S4/SvJaeSor-Gt(ROSA)26Sortm1(FLP1)Dym/J (Jackson laboratory, RRID:IMSR_JAX:003946)]と交配し、ネオマイシンカセットを除去した後、Vil-Creマウス(Jax-B6. Cg-Tg(Vil1-cre)997Gum/J(Jackson研究所、RRID:IMSR_JAX:004586))またはVillin-CreERT2(Sylvie Robineの親切な贈り物、RRID:IMSR_GPT:T004829)と交配させ、腸粘膜細胞で蛍光タンパク質および関連するα-シヌクレイントランスジーンを発現させた。
膣切開とタモキシフェン治療
1ヶ月齢の雌雄SNCAbow;Vil-CreERT2マウスに外科的横隔膜下迷走神経切開を行った。マウスはケタミン(50-100mg/kg)で麻酔され、開腹手術が行われた。横隔膜のすぐ下で迷走神経を確認し、周囲の結合組織や血管から分離した。迷走神経の2mm部分を切除し、手術創を手術用クリップで閉じた。マウスには鎮痛剤を投与し、苦痛の徴候がないか5日間毎日観察した。偽手術動物では開腹手術を行い、迷走神経は露出させたが切除はしなかった。迷走神経切断術を受けたマウスは、偽手術を受けたマウスに比べて約15%の体重減少が認められた。手術の1週間後、マウスにタモキシフェン(5mg/kg)またはビヒクルを5日間毎日腹腔内注射した。
マウスオルガノイドの調製と培養
マウス小腸を解剖し、氷冷リン酸緩衝生理食塩水(PBS)(pH7.4)/Primocin(1:1000)(InvivoGen、Cat# ant-pm-1)で穏やかに洗浄し、約0. 5cmに切断したものを、ペニシリン-ストレプトマイシン(Gibco, Cat#15140-122)を含む7.5mLの冷PBS/EDTA(3mM)/Primocin/Y27632(1:1000)(ApexBio, Cat#A3008-200)に入れ、4℃で15分間穏やかに振盪した。腸組織を新鮮なEDTA/PBS/Primocin/Y27632に移し、4℃で25分間振盪し、PBSに移した。次に組織をPBS/Y27632に移し、2分間振盪した後、70μmメッシュで濾過し、顕微鏡で観察し、15μLの成長因子減少マトリゲル(Corning、Cat#354230)中に50クリプトの密度で分注した。懸濁液を1500rpm、4℃で5分間遠心し、ペレットを冷たい成長因子減少マトリゲル中に再懸濁し、48ウェルプレート(Eppendorf、Cat#0030723113)に分注した(1ウェルあたり15μL)。マトリゲルを37℃で30分間重合させた。各ウェルに、プリモシンを含む予め加温した(37℃)Intesticult Media(Stem Cell Technologies、Cat#06005)を200μLずつ加えた。培地は2日ごとに交換し、オルガノイドは毎週分割した。
結節神経節ニューロンの単離と共培養
Snca-/-マウスから結節神経節を摘出し、神経成長因子-2(NGF)(25 ng/mL、Sigma、Cat#N6009)およびリベラーゼ(0.156 mg/mL)を含む300 μLの氷冷マウス腸管培地(StemCell Technologies、Cat#06005)に入れた。37℃で30分間インキュベートした後、上清をNGFを含む500μLのIntesticult培地に交換した。組織をピペッティングで解離し、70μmメッシュで濾過し、800rpmで4分間遠心した。ペレットを新鮮な培地に再懸濁し、成長因子を減少させたマトリゲル(Corning、Cat#354230)と混合し、腸オルガノイド培養物(少なくとも4週齢)に添加した。結節性神経節/オルガノイド混合物を8ウェルチャンバースライド中で37℃、30分間インキュベートし、重合させた。その後、NGFを含む予め加温したIntesticult培地を加え、細胞混合物をイメージング前にさらに5~8日間培養した。
オルガノイドの免疫染色
全マウントオルガノイドの染色は、若干の修正を加えて、前述75と同様に行った。培地を除去した後、オルガノイドをPBS中4%パラホルムアルデヒドで室温20分間固定した(マトリゲルの解重合を防ぐため37℃で予熱)。オルガノイドをPBS中0.5% Triton X-100で予め加温し、100 mMグリシン(Invitrogen、Cat# 10977-023)で3回洗浄した。5%ウシ血清アルブミン/5%ロバ血清/PBSで室温で2時間ブロッキングした後、一次抗体を加え、加湿チャンバー内で4℃で16時間インキュベーションを続けた。免疫染色に用いた一次抗体は以下の通り: ウサギCCK 73、ウサギα-シヌクレイン(Abcam Cat# ab138501、RRID:AB_2537217、1:1000)、モルモットPGP9. 5(Abcam Cat# ab10410、RRID:AB_297150、1:100)、ニワトリβチューブリンIII、Tuj1(Neuromics Cat# CH23005、RRID:AB_2210684、1:100)、ニワトリGFP(Abcam Cat# ab13970、RRID:AB_300798、1:1000)。スライドはIFバッファー(0.1%BSA、0.2% Triton X-100、0.05% TWEEN 20を含むPBS)で20分ずつ3回洗浄した。二次抗体(IF)を暗所、室温で1時間塗布した。二次抗体には以下が含まれる: ロバ抗ニワトリAlexa Fluor 488(Jackson ImmunoResearch Labs Cat# 703-545-155、RRID:AB_234037、1:500)、ロバ抗マウスAlexa Fluor 568(1:500)およびロバ抗モルモットAlexa Fluor 647(Jackson ImmunoResearch Labs Cat# 706-605-148、RRID:AB_2340476、1:250)。スライドを IF バッファーで 3 回洗浄した。DAPIを室温で5分間塗布し、PBSで洗浄し、プロロングゴールド(ThermoFisher、Cat#P36930)でマウントした。
十二指腸および結節組織切片の免疫蛍光分析
導入遺伝子と蛍光タンパク質の発現を特徴付けるために、マウスをキシラジンとケタミンの混合物で麻酔し、氷冷3.5%生パラホルムアルデヒドで灌流した。腸組織を採取し、後固定し、段階的ショ糖溶液で凍結保存した。組織をOCTに包埋し、凍結切片(厚さ10-20μm)をプラス帯電スライドに採取した。免疫染色は前述と同様に行った46。以下の一次抗体を用いた:ニワトリGFP(Abcam Cat# ab13970、RRID:AB_300798、1:1000)、ウサギα-シヌクレイン(Abcam Cat# ab138501、RRID:AB_2537217、1:1000)、ヒツジα-シヌクレイン(Abcam Cat# ab6162、RRID:AB_2192805、1:1000)、ウサギPGP9. 5 (Millipore Cat# AB1761-I, RRID:AB_2868444, at 1:50)。
α-シヌクレインタンパク質の発現および精製
WT-ヒト-α-シヌクレインをコードするプラスミド構築物(pRK172-human-lil-synuclein)をBL21-CodonPlus(DE3-RIL)細胞(Agilent, Cat#230245-41)で発現させた。タンパク質発現は、細胞密度OD(600nm)0.8で0.1mM IPTGで誘導し、18℃で連続的に振盪しながら一晩インキュベートした。細胞ペレットを0.75 M NaCl、10 mM Tris HCl、pH 7.6、1 mM EDTA、1 mM PMSFで溶解し、30%出力(Fisher 500 Dismembrator)で1分間超音波処理した後、細胞懸濁液を15分間煮沸した。遠心し濾過したサンプルを、50mM NaCl、1mM EDTA、1mM PMSFを含む10mM Tris HCl、pH7.6で透析した。この懸濁液をÄKTA pure protein purification system(Cytiva、旧GE Healthcare)のHiPrep Q HP 16/10 Column, 1 x 20 mL (GE Healthcare)に通し、10 mM Tris pH 7.6, 25 mM NaClのランニングバッファーで溶出し、高塩バッファー(10 mM Tris HCl, pH 7.6, 1 M NaCl)のリニアグラジエントで溶出した。α-シヌクレインのシングルバンドを含む画分は、SDS-PAGEゲルのクマシー染色によって同定し、透析して濃縮した。精製したモノマータンパク質は、1mgあたり0.1EU未満になるまで、エンドトキシン除去(エンドトキシン除去キット、GenScript)を2~3回行った。エンドトキシンレベルは、LAL発色エンドトキシン定量キット(GenScript)を用いて測定した。
RT-QuICアッセイ用マウス組織ホモジネートの調製
マウス組織(体積あたり10%重量)を、1% Triton X-100を添加したPBS中で組織をホモジナイズし、次いでプローブチップを10%振幅で1分間(5秒On、15秒Off)超音波処理することにより調製した(Fisher 500 Dismembrator)。超音波処理したサンプルを20,000 x g、4℃で20分間遠心し、上清を分注した。RT-QuIC分析では、ホモジネートの1%を反応液に添加した。
リアルタイムクエーキング誘導変換アッセイ(RT-QuIC)
RT-QuIC分析は、透明底の超低結合性384ウェルプレート(Corning社製)に、1ウェル当たり1個のジルコニアシリカビーズ(2.3 mm、OPS Diagnostics社製)を装填して行った。反応条件は、滅菌PBS中10μMのチオフラビンT(ThT)、20μMのヒトα-シヌクレインモノマー、および10%の組織ホモジネート(容量あたり1%の重量)であった。ヒトα-シヌクレインモノマーをultra-0.5遠心濾過システム(100 kDa MWCO、Amicon)に通し、高分子凝集体を除去した。反応は3連で行い、各技術的および生物学的実験を3回繰り返した。反応の効率、感度、特異性を確認するために、Snca-/-マウスのマトリックスホモジネート1%中の組換えα-シヌクレイン線維の連続希釈液による標準曲線を各反応に含めた(補足図1)。リコンビナント線維の連続希釈液は、Dynamic Light Scaterring測定によって算出されたおおよその分子量と、47. Snca-/-組織からの溶解物を含む陰性対照試料は、組織起源に起因すると思われるバックグラウンドシグナルを除外するために使用した。RT-QuICアッセイは、OMEGA BMGプレートリーダーを用い、700rpmで60秒間振とうし、60秒間静止させながら、15~90時間行った。ThTシグナルは、励起448-10、発光482-10で30分ごとにモニターされた。
ヒトα-シヌクレインの化学発光増強ELISA測定
結節性神経節中のヒトα-シヌクレイン濃度の測定は、メーカーの説明書(Biolegend、Cat#844101)に従って行った。1:10に希釈したサンプルを3連で測定し、基準標準曲線は6.1~1500 pg/mLとした。発光シグナルはクラリオスタープレートリーダー(BMG)で記録した。
著者らの貢献
RCとASは実験デザイン、実験、原稿執筆に貢献した。KRC、SK、SMSは実験を行い、原稿をレビューした。JCSは実験デザインと原稿のレビューに貢献した。ABWは実験デザインと原稿執筆に貢献した。RALは実験デザインと原稿執筆を担当した。
謝辞
本研究は、NIH助成金R01 DK-120555、退役軍人省助成金I01 BX002230、およびR.A.L.へのデューク大学からのHolland-Trice Award、A.B.W.へのNIH助成金R01 NS-064934およびP50 NS-108675、J.C.S.への5K22 CA-212058-03の助成を受けた。本研究の一部は、Michael J. Fox Foundation for Parkinson's Research(MJFF)を通じてAligning Science Across Parkinson's award ASAP-020527の助成を受けた。オープンアクセスを目的として、著者らは本投稿から生じたすべてのAuthor Accepted ManuscriptsにCC BYパブリック著作権ライセンスを適用した。著者らは、デューク大学の光顕微鏡コア施設、トランスジェニックマウス施設、デュークがん研究所の支援に感謝する。
Senthil Karuppagounderの技術サポートに感謝する。
参考文献
1.ȕChaudhuri, K.R., and Schapira, A.H. (2009). パーキンソン病の非運動症状:ドーパミン作動性の病態生理と治療。The Lancet. 神経 8, 464-474. doi:10.1016/S1474-4422(09)70068-7.CrossRefPubMedWebGoogle Scholar
2.ȕBisaglia, M., Mammi, S., and Bubacco, L. (2009). α-シヌクレインの生理学的機能と病理学的影響に関する構造的洞察。FASEB J 23, 329-340. doi:10.1096/fj.08-119784.CrossRefPubMedWeb of ScienceGoogle Scholar
3.↵Soto, C. (2012). 伝達性タンパク質:プリオンの異端を拡大する。Cell 149, 968-977. doi:10.1016/j.cell.2012.05.007.CrossRefPubMedWeb of ScienceGoogle Scholar
4.ȕBendor, J.T., Logan, T.P., and Edwards, R.H. (2013). αシヌクレインの機能。Neuron 79, 1044-1066. doi:10.1016/j.neuron.2013.09.004.CrossRefPubMedWeb of ScienceGoogle Scholar
5.↵ポリメロプロス、M.H.、ラヴェダン、C.、リロイ、E.、イデ、S.E.、デヘジャ、A.、ドゥトラ、A.、パイク、B.、ルート、H.、ルーベンスタイン、J.、ボイヤー、R.、他(1997)。パーキンソン病の家族で同定されたαシヌクレイン遺伝子の変異。Abstract/FREE Full TextGoogle Scholar
6.↵Li, J., Uversky, V.N., and Fink, A.L. (2001). 家族性パーキンソン病点突然変異A30PとA53Tがヒトαシヌクレインの構造特性、凝集、細動に及ぼす影響。生化学 40, 11604-11613.
7.ȕVilar, M., Chou, H.T., Luhrs, T., Maji, S.K., Riek-Loher, D., Verel, R., Manning, G., Stahlberg, H., and Riek, R. (2008). α-シヌクレイン線維の折り畳み。Proc Natl Acad Sci U S A 105, 8637-8642. doi:10.1073/pnas.0712179105.Abstract/FREE Full TextGoogle Scholar
8.Wood,S.J.、Wypych,J.、Steavenson,S.、Louis,J.C.、Citron,M.、Biere,A.L. (1999). α-シヌクレイン線維形成は核形成依存性である。パーキンソン病の病態への示唆。J Biol Chem 274, 19509-19512. doi:10.1074/jbc.274.28.19509.Abstract/FREE Full TextGoogle Scholar
9.↵内木秀樹、樋口和彦、細川正樹、武田俊彦(1989)。蛍光色素チオフラビンT1を用いたin vitroでのアミロイド線維の蛍光定量。Anal Biochem 177, 244-249. doi:10.1016/0003-2697(89)90046-8.CrossRefPubMedWeb of ScienceGoogle Scholar
10.↵Luk, K.C., Song, C., O'Brien, P., Stieber, A., Branch, J.R., Brunden, K.R., Trojanowski, J.Q., and Lee, V.M. (2009). 外因性αシヌクレイン線維は、培養細胞におけるレビー小体様細胞内封入体の形成の種となる。Proc Natl Acad Sci U S A 106, 20051-20056. doi:10.1073/pnas.0908005106.Abstract/FREE Full TextGoogle Scholar
11.Luk, K.C., Kehm, V.M., Zhang, B., O'Brien, P., Trojanowski, J.Q., and Lee, V.M. (2012). 病理学的αシヌクレインの脳内接種により、マウスの神経変性αシヌクレイン症が急速に進行する。J Exp Med 209, 975-986. doi:10.1084/jem.20112457.Abstract/FREE Full TextGoogle Scholar
12.Mougenot, A.L., Nicot, S., Bencsik, A., Morignat, E., Verchere, J., Lakhdar, L., Legastelois, S., and Baron, T. (2012). トランスジェニックマウスモデルにおけるプリオン様シヌクレイン症の加速。この論文では、加齢に伴うシヌクレイン病変のプリオン様加速を、トランスジェニックマウスモデルにおいて明らかにした。
13.↵Olanow, C.W., and Prusiner, S.B. (2009). パーキンソン病はプリオン病か?Proc Natl Acad Sci U S A 106, 12571-12572. doi:10.1073/pnas.0906759106.FREE Full TextGoogle Scholar
14.↵Goedert, M. (2015). 神経変性。アルツハイマー病とパーキンソン病: プリオンの概念とAβ、タウ、αシヌクレインとの関連。Science 349, 1255555. doi:10.1126/science.1255555.Abstract/FREE Full TextGoogle Scholar
15.Li, J.Y., Englund, E., Holton, J.L., Soulet, D., Hagell, P., Lees, A.J., Lashley, T., Quinn, N.P., Rehncrona, S., Bjorklund, A., et al. パーキンソン病患者の移植神経細胞におけるレビー小体型は、宿主から移植細胞への疾患伝播を示唆している。doi:10.1038/nm1746.CrossRefPubMedWeb of ScienceGoogle Scholar
16.ȕKordower, J.H., Chu, Y., Hauser, R.A., Freeman, T.B., and Olanow, C.W. (2008). パーキンソン病における長期胚黒質移植におけるレビー小体様病理。doi:10.1038/nm1747.CrossRefPubMedWeb of ScienceGoogle Scholar
17.ȕAngot, E., and Brundin, P. (2009). パーキンソン病におけるα-シヌクレイン細胞間移動の基盤となる潜在的分子メカニズムの解明。パーキンソン病と関連疾患 15 Suppl 3, S143-147. doi:10.1016/S1353-8020(09)70802-8.CrossRefGoogle Scholar
18.↵Steiner, J.A., Angot, E., and Brundin, P. (2011). 致命的な広がり:αシヌクレイン転移の細胞内メカニズム。細胞死と分化 18, 1425-1433. doi:10.1038/cdd.2011.53.CrossRefPubMedWeb of ScienceGoogle Scholar
19.↵Kang, U.J., Boehme, A.K., Fairfoul, G., Shahnawaz, M., Ma, T.C., Hutten, S.J., Green, A., and Soto, C. (2019). パーキンソン病診断のための脳脊髄液αシヌクレイン播種凝集測定法の比較研究。doi:10.1002/mds.27646.CrossRefGoogle Scholar.
20.ȕVascellari, S., Orru, C.D., Groveman, B.R., Parveen, S., Fenu, G., Pisano, G., Piga, G., Serra, G., Oppo, V., Murgia, D., et al. (2023). パーキンソン病患者の十二指腸生検におけるα-シヌクレイン播種活性。PLoS Pathog 19, e1011456. doi:10.1371/journal.ppat.1011456.CrossRefGoogle Scholar
21.↵Van Den Berge, N., Ferreira, N., Gram, H., Mikkelsen, T.W., Alstrup, A.K.O., Casadei, N., Tsung-Pin, P., Riess, O., Nyengaard, J.R., Tamguney, G., et al. ラットにおけるαシヌクレインの双方向性および経シナプス的な副交感神経および交感神経伝播の証拠。Acta neuropathologica 138, 535-550. doi:10.1007/s00401-019-02040-w.CrossRefMedGoogle Scholar
22.ȕBraak, H., Rub, U., Gai, W.P., and Del Tredici, K. (2003). 特発性パーキンソン病:脆弱なニューロンタイプが未知の病原体による神経浸潤を受ける可能性のある経路。神経伝達ジャーナル 110, 517-536. doi:10.1007/s00702-002-0808-2.CrossRefPubMedWeb of ScienceGoogle Scholar
23.Verbaan, D., Marinus, J., Visser, M., van Rooden, S.M., Stiggelbout, A.M., and van Hilten, J.J. (2007). パーキンソン病における患者報告の自律神経症状。Neurology 69, 333-341. doi:10.1212/01.wnl.0000266593.50534.e8.CrossRefMedGoogle Scholar
24.↵Cersosimo, M.G., and Benarroch, E.E. (2012). パーキンソン病における胃腸機能障害の病理学的相関。神経生物学的疾患 46, 559-564. doi:10.1016/j.nbd.2011.10.014.CrossRefPubMedGoogle Scholar
25.↵Kim, S., Kwon, S.H., Kam, T.I., Panicker, N., Karuppagounder, S.S., Lee, S., Lee, J.H., Kim, W.R., Kook, M., Foss, C.A., et al (2019). 腸から脳への病理学的αシヌクレインの経神経伝播は、パーキンソン病をモデル化する。Neuron 103, 627-641 e627. doi:10.1016/j.neuron.2019.05.035.CrossRefMedGoogle Scholar
26.Holmqvist, S., Chutna, O., Bousset, L., Aldrin-Kirk, P., Li, W., Bjorklund, T., Wang, Z.Y., Roybon, L., Melki, R., and Li, J.Y. (2014). ラットの消化管から脳へのパーキンソン病態の広がりの直接的証拠。Acta neuropathologica 128, 805-820. doi:10.1007/s00401-014-1343-6.CrossRefMedGoogle Scholar
27.↵Challis, C., Hori, A., Sampson, T.R., Yoo, B.B., Challis, R.C., Hamilton, A.M., Mazmanian, S.K., Volpicelli-Daley, L.A., and Gradinaru, V. (2020). 腸に播種されたαシヌクレイン線維は、高齢マウスにおいて腸の機能障害と脳の病理を特異的に促進する。Nat Neurosci 23, 327-336. doi:10.1038/s41593-020-0589-7.CrossRefGoogle Scholar
28.ȕBraak, H., de Vos, R.A., Bohl, J., and Del Tredici, K. (2006). パーキンソン病関連脳病変の病期分類を行った症例におけるマイスナー神経叢およびアウエルバッハ神経叢の胃αシヌクレイン免疫反応性封入体。Neurosci Lett 396, 67-72. doi:10.1016/j.neulet.2005.11.012.CrossRefPubMedWeb of ScienceGoogle Scholar
29.ȕBraak, H., and Del Tredici, K. (2009). 散発性パーキンソン病の神経解剖学と病理学。(2009).解剖学・発生学・細胞生物学の進歩 201, 1-119.PubMedGoogle Scholar.
30.ȕBraak, H., Del Tredici, K., Rub, U., de Vos, R.A., Jansen Steur, E.N., and Braak, E. (2003). 散発性パーキンソン病に関連する脳病理の病期分類。Neurobiology of aging 24, 197-211.CrossRefPubMedWeb of ScienceGoogle Scholar
31.↵Annerino, D.M., Arshad, S., Taylor, G.M., Adler, C.H., Beach, T.G., and Greene, J.G. (2012). パーキンソン病は消化管腸管神経節ニューロンの喪失とは関連しない。Acta neuropathologica 124, 665-680. doi:10.1007/s00401-012-1040-2.CrossRefPubMedWeb of ScienceGoogle Scholar
32.↵Kuo, Y.M., Li, Z., Jiao, Y., Gaborit, N., Pani, A.K., Orrison, B.M., Bruneau, B.G., Giasson, B.I., Smeyne, R.J., Gershon, M.D., and Nussbaum, R.L. (2010). パーキンソン病関連αシヌクレイン遺伝子変異を含む人工染色体をトランスジェニックしたマウスでは、中枢神経系の変化に先行して広範な腸神経系の異常が認められる。このような遺伝子変異を持つマウスは、中枢神経系の変化に先立ち、腸神経系に広範な異常をきたす。
33.ȕRota, L., Pellegrini, C., Benvenuti, L., Antonioli, L., Fornai, M., Blandizzi, C., Cattaneo, A., and Colla, E. (2019). α-シヌクレイン症モデルマウスにおいて、便秘、結腸収縮不全、結腸内のα-シヌクレイン封入体が運動異常と中枢神経系の神経変性に先行する。この研究は、神経変性症モデルマウスの中枢神経系における運動異常と神経変性に先行している。
34.ȕPan-Montojo, F., Schwarz, M., Winkler, C., Arnhold, M., O'Sullivan, G.A., Pal, A., Said, J., Marsico, G., Verbavatz, J.M., Rodrigo-Angulo, M., et al. 環境毒素は、マウスの腸管ニューロンからのαシヌクレイン放出の増加を介してPD様の進行を誘発する。科学的報告2, 898. doi:10.1038/srep00898.CrossRefPubMedGoogle Scholar
35.↵Ulusoy, A., Rusconi, R., Perez-Revuelta, B.I., Musgrove, R.E., Helwig, M., Winzen-Reichert, B., and Di Monte, D.A. (2013). 迷走神経接続を介したαシヌクレインの尾脳-胸脳拡散。EMBO molecular medicine 5, 1051-1059. doi:10.1002/emmm.201302475.CrossRefGoogle Scholar
36.ȕ植村直己、八木秀樹、植村正俊、畑中義人、山門裕之、高橋理恵(2018)。マウス消化管へのαシヌクレイン前形成線維の接種により、迷走神経を介して脳幹にレビー小体様凝集体が誘導される。分子神経変性 13, 21. doi:10.1186/s13024-018-0257-5.CrossRefPubMedGoogle Scholar
37.↵Svensson, E., Horvath-Puho, E., Thomsen, R.W., Djurhuus, J.C., Pedersen, L., Borghammer, P., and Sorensen, H.T. (2015). 膣切開とその後のパーキンソン病リスク。Annals of neurology.doi:10.1002/ana.24448.CrossRefPubMedGoogle Scholar
38.Tysnes, O.B., Kenborg, L., Herlofson, K., Steding-Jessen, M., Horn, A., Olsen, J.H., and Reichmann, H. (2015). 迷走神経切断術はパーキンソン病のリスクを減少させるか?Annals of neurology 78, 1011-1012. doi:10.1002/ana.24531.CrossRefGoogle Scholar
39.↵Liu, B., Fang, F., Pedersen, N.L., Tillander, A., Ludvigsson, J.F., Ekbom, A., Svenningsson, P., Chen, H., and Wirdefeldt, K. (2017). 膣切開とパーキンソン病: スウェーデンの登録ベースのマッチドコホート研究。Neurology 88, 1996-2002. doi:10.1212/WNL.000000003961.Abstract/FREE Full TextGoogle Scholar
40.↵Bohorquez, D.V., Shahid, R.A., Erdmann, A., Kreger, A.M., Wang, Y., Calakos, N., Wang, F., and Liddle, R.A. (2015). 感覚性腸内分泌細胞の神経支配によって形成される神経上皮回路。J Clin Invest 125, 782-786. doi:10.1172/JCI78361.CrossRefPubMedGoogle Scholar
41.↵Kaelberer, M.M., Buchanan, K.L., Klein, M.E., Barth, B.B., Montoya, M.M., Shen, X., and Bohorquez, D.V. (2018). 栄養感覚伝達のための腸脳神経回路。Doi:10.1126/science.aat5236.Abstract/FREE Full TextGoogle Scholar
42.↵Rodrigues, P.V., de Godoy, J.V.P., Bosque, B.P., Amorim Neto, D.P., Tostes, K., Palameta, S., Garcia-Rosa, S., Tonoli, C.C.C., de Carvalho, H.F., and de Castro Fonseca, M. (2022). 腸内分泌細胞から神経細胞への線維性α-シヌクレインの細胞内伝播には細胞間接触が必要であり、Rab35依存性である。科学報告12, 4168. doi:10.1038/s41598-022-08076-5.CrossRefGoogle Scholar
43.↵Gribble, F.M., and Reimann, F. (2016). 腸内分泌細胞: 腸管上皮における化学センサー。Annu Rev Physiol 78, 277-299. doi:10.1146/annurev-physiol-021115-105439.CrossRefPubMedGoogle Scholar
44.Haber、A.L.、Biton、M.、Rogel、N.、Herbst、R.H.、Shekhar、K.、Smillie、C.、Burgin、G.、Delorey、T.M.、Howitt、M.R.、Katz、Y.、他(2017)。小腸上皮の単一細胞調査。Nature 551, 333-339. doi:10.1038/nature24489.CrossRefPubMedGoogle Scholar
45.ȕBohorquez, D.V., Samsa, L.A., Roholt, A., Medicetty, S., Chandra, R., and Liddle, R.A. (2014). 3次元電子顕微鏡で明らかになった腸内分泌細胞-腸グリア結合。PLoS One 9, e89881. doi:10.1371/journal.pone.0089881.CrossRefMedGoogle Scholar
46.↵Chandra, R., Hiniker, A., Kuo, Y.M., Nussbaum, R.L., and Liddle, R.A. (2017). 腸内分泌細胞におけるα-シヌクレインとパーキンソン病への影響。JCI Insight 2. doi:10.1172/jci.insight.92295.CrossRefPubMedGoogle Scholar
47.↵Sokratian, A., Ziaee, J., Kelly, K., Chang, A., Bryant, N., Wang, S., Xu, E., Li, J.Y., Wang, S.H., Ervin, J., et al. (2021). αシヌクレイン線維活性の不均一性は、レビー小体型認知症の疾患表現型と相関する。Doi:10.1007/s00401-021-02288-1.CrossRefGoogle Scholar
48.↵Cabin, D.E., Gispert-Sanchez, S., Murphy, D., Auburger, G., Myers, R.R., and Nussbaum, R.L. (2005). Snca欠損バックグラウンドでA53T SNCAを発現するマウスにおけるシヌクレイン障害の増悪。Neurobiology of aging 26, 25-35. doi:10.1016/j.neurobiolaging.2004.02.026.CrossRefPubMedWeb of ScienceGoogle Scholar
49.ȕBrowning, K.N., Verheijden, S., and Boeckxstaens, G.E. (2017). 食欲調節、気分、腸の炎症における迷走神経。Gastroenterology 152, 730-744. doi:10.1053/j.gastro.2016.10.046.CrossRefMedGoogle Scholar
50.↵Nicot, S., Verchere, J., Belondrade, M., Mayran, C., Betemps, D., Bougard, D., and Baron, T. (2019). タンパク質のミスフォールディング環状増幅を用いた、マウス脳におけるαシヌクレイン凝集の播種伝播。FASEB J 33, 12073-12086. doi:10.1096/fj.201900354R.CrossRefGoogle Scholar
51.ȕBuchanan, K.L., Rupprecht, L.E., Kaelberer, M.M., Sahasrabudhe, A., Klein, M.E., Villalobos, J.A., Liu, W.W., Yang, A., Gelman, J., Park, S., et al. 甘味料に対する砂糖の選好は、腸のセンサー細胞に依存する。Nat Neurosci 25, 191-200. doi:10.1038/s41593-021-00982-7.CrossRefGoogle Scholar
52.ȕBoone, P.G., Rochelle, L.K., Ginzel, J.D., Lubkov, V., Roberts, W.L., Nicholls, P.J., Bock, C., Flowers, M.L., von Furstenberg, R.J., Stripp, B.R., et al. (2019). がん原性クローン拡大の機能ゲノミクスを可視化するためのがんレインボーマウス。Nature communications 10, 5490. doi:10.1038/s41467-019-13330-y.CrossRefGoogle Scholar
53.ȕLukonin, I., Serra, D., Challet Meylan, L., Volkmann, K., Baaten, J., Zhao, R., Meeusen, S., Colman, K., Maurer, F., Stadler, M.B., et al. (2020). 腸オルガノイド再生の表現型ランドスケープ。Nature 586, 275-280. doi:10.1038/s41586-020-2776-9.CrossRefGoogle Scholar
54.↵Lee, H.J., Patel, S., and Lee, S.J. (2005). α-シヌクレインとその凝集体の小胞内局在とエキソサイトーシス。J Neurosci 25, 6016-6024. doi:10.1523/JNEUROSCI.0692-05.2005.Abstract/FREE Full TextGoogle Scholar
55.Emmanouilidou, E., and Vekrellis, K. (2016). 正常および異常αシヌクレインのエキソサイトーシスと拡散。Doi:10.1111/bpa.12373.CrossRefPubMedGoogle Scholar
56.Gustafsson, G., Loov, C., Persson, E., Lazaro, D.F., Takeda, S., Bergstrom, J., Erlandsson, A., Sehlin, D., Balaj, L., Gyorgy, B., et al. 培養細胞における細胞外小胞を介したα-シヌクレインの分泌と取り込み。Cell Mol Neurobiol 38, 1539-1550. doi:10.1007/s10571-018-0622-5.CrossRefMedGoogle Scholar
57.⅛Xie, Y.X., Naseri, N.N., Fels, J., Kharel, P., Na, Y., Lane, D., Burre, J., and Sharma, M. (2022). ライソゾームのエキソサイトーシスにより、シヌクレイン症モデルの神経細胞から病原性αシヌクレインが放出される。Nature communications 13, 4918. doi:10.1038/s41467-022-32625-1.CrossRefGoogle Scholar
58.ȕAbounit, S., Bousset, L., Loria, F., Zhu, S., de Chaumont, F., Pieri, L., Olivo-Marin, J.C., Melki, R., and Zurzolo, C. (2016). Tunneling nanotubes spread fibrillar alpha-synuclein by intercellular trafficking of lysosome. EMBO J 35, 2120-2138. doi:10.15252/embj.201593411.Abstract/FREE Full TextGoogle Scholar
59.Dieriks,B.V.、Park,T.I.、Fourie,C.、Faull,R.L.、Dragunow,M.、Curtis,M.A. (2017). トンネリングナノチューブを介したα-シヌクレインの移動は、パーキンソン病患者のSH-SY5Y細胞および一次脳周皮細胞で起こる。科学報告書7、42984.doi:10.1038/srep42984.CrossRefGoogle Scholar
60.Rostami, J., Holmqvist, S., Lindstrom, V., Sigvardson, J., Westermark, G.T., Ingelsson, M., Bergstrom, J., Roybon, L., and Erlandsson, A. (2017). Human Astrocytes Transfer Aggregated Alpha-Synuclein via Tunneling Nanotubes. J Neurosci 37, 11835-11853. doi:10.1523/JNEUROSCI.0983-17.2017.Abstract/FREE Full TextGoogle Scholar
61.↵Scheiblich, H.、Dansokho, C.、Mercan, D.、Schmidt, S.V.、Bousset, L.、Wischhof, L.、Eikens, F.、Odainic, A.、Spitzer, J.、Griep, A.、他(2021年)。ミクログリアは、トンネリングナノチューブを介した分布により、線維性αシヌクレインカーゴを共同で分解する。Cell 184, 5089-5106 e5021. doi:10.1016/j.cell.2021.09.007.CrossRefMedGoogle Scholar
62.↵Hawkes, C.H., Del Tredici, K., and Braak, H. (2009). パーキンソン病:dual hit theory revisited. doi:10.1111/j.1749-6632.2009.04365.x.CrossRefPubMedWeb of ScienceGoogle Scholar
63.↵Iranzo, A., Fairfoul, G., Ayudhaya, A.C.N., Serradell, M., Gelpi, E., Vilaseca, I., Sanchez-Valle, R., Gaig, C., Santamaria, J., Tolosa, E., et al. 孤立性急速眼球運動睡眠行動障害患者におけるRT-QuICによる髄液中のαシヌクレインの検出:縦断的観察研究。The Lancet. 神経 20, 203-212. doi:10.1016/S1474-4422(20)30449-X.CrossRefGoogle Scholar
64.↵Siderowf, A.、Concha-Marambio, L.、Lafontant, D.E.、Farris, C.M.、Ma, Y.、Urenia, P.A.、Nguyen, H.、Alcalay, R.N.、Chahine, L.M.、Foroud, T.、他(2023)。α-synuclein seed amplificationを用いたParkinson's Progression Markers Initiativeコホート参加者間の不均一性の評価:横断的研究。Lancet. 神経学 22, 407-417. doi:10.1016/S1474-4422(23)00109-6.CrossRefGoogle Scholar
65.Concha-Marambio, L., Pritzkow, S., Shahnawaz, M., Farris, C.M., and Soto, C. (2023). 脳脊髄液中の病理学的αシヌクレイン凝集体の検出のためのシード増幅アッセイ。Nature protocols 18, 1179-1196. doi:10.1038/s41596-022-00787-3.CrossRefGoogle Scholar
66.↵Sampson, T.R., Debelius, J.W., Thron, T., Janssen, S., Shastri, G.G., Ilhan, Z.E., Challis, C., Schretter, C.E., Rocha, S., Gradinaru, V., et al. Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson's Disease. Cell 167, 1469-1480 e1412. doi:10.1016/j.cell.2016.11.018.CrossRefPubMedGoogle Scholar
67.ȕWorthington, J.J., Reimann, F., and Gribble, F.M. (2017). 腸内分泌細胞-腸内環境の感覚的センチネルであり、粘膜免疫のオーケストレーター。Mucosal Immunol. doi:10.1038/mi.2017.73.CrossRefPubMedGoogle Scholar
68.↵Ye, L.、Bae, M.、Cassilly, C.D.、Jabba, S.V.、Thorpe, D.W.、Martin, A.M.、Lu, H.Y.、Wang, J.、Thompson, J.D.、Lickwar, C.R.、他(2021)。腸内分泌細胞は細菌のトリプトファン代謝産物を感知し、腸管および迷走神経経路を活性化する。Cell Host Microbe 29, 179-196 e179. doi:10.1016/j.chom.2020.11.011.CrossRefGoogle Scholar
69.ȕAmorim Neto, D.P., Bosque, B.P., Pereira de Godoy, J.V., Rodrigues, P.V., Meneses, D.D., Tostes, K., Costa Tonoli, C.C., Faustino de Carvalho, H., Gonzalez-Billault, C., and de Castro Fonseca, M. (2022). iScience 25, 103908. doi:10.1016/j.isci.2022.103908.CrossRefGoogle Scholar.
70.ȕ Claudino Dos Santos, J.C., Lima, M.P.P., Brito, G.A.C., and Viana, G.S.B. (2023). パーキンソン病発症における腸グリアと微生物叢-腸-脳軸の役割。この論文は、パーキンソン病の病態における腸グリアと微生物叢-腸-脳軸の役割を明らかにするものである。
71.↵Mu, L., Sobotka, S., Chen, J., Su, H., Sanders, I., Nyirenda, T., Adler, C.H., Shill, H.A., Caviness, J.N., Samanta, J.E., et al. (2013). パーキンソン病は咽頭末梢知覚神経に影響を及ぼす。J Neuropathol Exp Neurol 72, 614-623. doi:10.1097/NEN.0b013e3182965886.CrossRefPubMedGoogle Scholar
72.↵Phillips, R.J., Walter, G.C., Wilder, S.L., Baronowsky, E.A., and Powley, T.L. (2008). αシヌクレイン免疫陽性の腸管ニューロンおよび迷走神経前駆末:パーキンソン病に関与する自律神経経路?Neuroscience 153, 733-750. doi:10.1016/j.neuroscience.2008.02.074.CrossRefPubMedWeb of ScienceGoogle Scholar
73.↵Chandra, R., Samsa, L.A., Vigna, S.R., and Liddle, R.A. (2010). 腸コレシストキニン細胞における擬足様基底細胞突起。このような細胞は、腸の蠕動運動や蠕動運動に関与している。
74.↵Cabin, D.E., Shimazu, K., Murphy, D., Cole, N.B., Gottschalk, W., McIlwain, K.L., Orrison, B., Chen, A., Ellis, C.E., Paylor, R., et al. シナプス小胞の枯渇は、αシヌクレイン欠損マウスにおける長時間の反復刺激に対するシナプス反応の減弱と相関する。J Neurosci 22, 8797-8807.Abstract/FREE Full TextGoogle Scholar
75.↵Wang, L., Brugge, J.S., and Janes, K.A. (2011). 形態形成と腫瘍進行における単一乳房上皮細胞におけるFOXOとRUNX1を介した遺伝子発現プログラムの交差。Proc Natl Acad Sci U S A 108, E803-812. doi:10.1073/pnas.1103423108.Abstract/FREE Full TextGoogle Scholar
トップへ戻る
前へ 次へ
2023年9月5日掲載
PDFダウンロード
印刷/保存オプション
補足資料
リビジョンサマリー
Eメール
共有
引用ツール
音声抄録
COVID-19 SARS-CoV-2プレプリント(medRxivおよびbioRxivより
主題領域
神経科学
主題領域
すべての記事
動物の行動と認知
生化学
生物工学
生物情報学
生物物理学
癌生物学
細胞生物学
臨床試験
発生生物学
生態学
疫学
進化生物学
遺伝学
ゲノミクス
免疫学
微生物学
分子生物学
神経科学
古生物学
病理学
薬理学と毒性学
生理学
植物生物学
科学コミュニケーションと教育
合成生物学
システム生物学
動物学
bioRxiv の臨床研究パイロットプロジェクトが終了し、健康科学専用サーバー medRxiv (submit.medrxiv.org)が開設されたことに伴い、Clinical Trials と Epidemiology のサブジェクトカテゴリーは新規投稿を締め切りました。臨床試験の結果を報告する新規論文は、medRxivへの投稿が必須となりました。ほとんどの疫学論文もmedRxivに投稿されるべきですが、論文に健康に関する情報が含まれていない場合、著者は他のbioRxivの主題カテゴリー(例えば、遺伝学や微生物学)に投稿することもできます。
本論文の評価/議論 x
0 0 0 0 1 0 15
この記事が気に入ったらサポートをしてみませんか?
