ADSA財団の大学院生による文献レビュー: 子牛の免疫機能の発達的適応と健康と疾病における腸内細菌叢の影響
本文へスキップ
酪農科学ジャーナル
ログイン
検索...
総説|出版中の論文
ADSA財団の大学院生による文献レビュー: 子牛の免疫機能の発達的適応と健康と疾病における腸内細菌叢の影響
https://www.journalofdairyscience.org/article/S0022-0302(23)00787-7/fulltext
L.R. Cangiano
C. ヴィロット
L.L.グアン
I.R. イファラゲール
M.A.スティール オープンアクセス掲載:2023年11月06日DOI:https://doi.org/10.3168/jds.2023-24195
要旨
この大学院生による文献レビューでは、子牛の免疫系の存在論的適応と、腸内細菌叢が子牛の健康と疾病における免疫機能にどのような影響を及ぼすかについて考察している。酪農飼育システムの中で、様々な栄養および管理要因が、子牛の複数の生理学的軸に影響を及ぼす発育の重要な決定要因として浮上してきた。さらに、初乳からの免疫受動的移行によって早期の免疫保護を提供する一方で、新しい環境にうまく対処するための制御ネットワークを確立するために、出生前後の複数の母体因子が免疫発達の軌跡にどのように影響を及ぼすかについて議論します。さらに、腸内細菌叢が子牛の腸管および全身性免疫系の発達にどのように寄与しているのかについて、現在の理解を深める。最後に、予防的抗菌剤の使用と廃乳に関連する潜在的な懸念を取り上げ、特に腸の健康と代謝機能に対する悪影響を検証する。これらの要因を検討することで、現在の管理方法と動物の健康への長期的影響との複雑な関係をよりよく理解することを目指す。
キーワード
免疫発達
粘膜免疫
腸内マイクロバイオーム
抗菌薬
はじめに
代用未経産牛の育成は酪農経営の経済的持続可能性の重要な側面であり、酪農生産コスト全体のほぼ 20% を占めています(Heinrichs, 1993)。離乳前の子牛の管理と栄養は、健康と成長率だけでなく、初産年齢、泌乳期間中の乳量、寿命、淘汰率にも影響することが示されている(Aghakeshmiri ら、2017;Abuelo ら、2021)。初乳の管理、初期栄養、抗菌剤の使用など、普及している飼育システムの多くの要素が、子牛のいくつかの生理学的軸の軌跡に影響を与える発育プログラミングに影響を与えることが示されている(Faber ら、2005 年)。
離乳前の期間に適切な栄養と健康管理を行うことが重要であるにも関わらず、未経産 子牛を安全かつ効果的に飼育することには大きな課題が残されています。離乳前および離乳期は、罹患率と死亡率の高さからもわかるように、子牛の一生の中で最も困難な時期のひとつであることに変わりはありません(Urie et al.) 生後数週間の子牛は、免疫系が時間とともに徐々に成熟するため、免疫応答を開始する能力が限られている。この時期、子牛は環境病原体に対する抗体を介した防御を付与するために、初乳からの免疫グロブリン(Ig)の受動的移行にのみ依存している。受動的移行に失敗すると、子牛の罹患率や死亡率が上昇する可能性がある(Urie et al.) カナダと米国の農場では、雌の乳牛の子牛の 5% ~ 6% が離乳前の期間に死亡し、33% が治療を必要とする健康障害を少なくとも 1 つ抱えていると推定されています(Urie et al.) さらに、雄の乳用子牛の疾病発生率はさらに高く、北米全域の仔牛牧場での死亡率は5~10%で、子牛の25~87%が少なくとも1回は疾病の治療を受けている(Sayinら、2013年、Scottら、2019年)。
この総説では、新生児免疫の本質的な特徴、腸内細菌叢が腸と免疫の発達の形成に与える重大な影響、様々な管理要因が子牛の健康にどのような影響を与え得るかに焦点を当てます。最後に、本総説では、新生ウシの免疫学と微生物学の分野における我々の現在の理解 と知識のギャップに基づき、今後の研究の可能性について議論する。
新生児免疫
出生時、子牛はもともと環境病原体の影響を受けやすく、それはこの時期の死亡率や罹患率の高さにも反映されている(Urie et al.) 牛の合胞体胎盤は母体と胎児の血液供給を分離し、子宮内での防御免疫グロブリン(Ig)の伝達を妨げる。したがって、子牛は無ガンマグロブリン血症で生まれ、環境病原体に対する抗体を介した防御を付与するためには、母牛の初乳からの免疫グロブリン(Ig)の受動的移行に依存する(Windeyer and Gamsjäger, 2019)。初乳を通じて十分な量の IgG とその他の免疫因子を摂取するプロセスは「受動免疫の移 転の成功」と呼ばれ、新生子牛の健康と生存を左右する唯一で最も重要な管理要因である(Godden et al.) 初乳の十分な摂取は、離乳前の子牛の疾病発生率を低下させるだけでなく、健康と成績 の長期的な向上にもつながる(Faber et al. このような利点は、疾病の発生が減少することで、発育に重要な時期に成長を促すための 栄養素が節約されることに起因すると考えられる (Aghakeshmiri ら、2017;Abuelo ら、2021)。さらに、初乳は生後間もない子牛の免疫機能を形成する重要な因子として浮上しており、新生児期 以降の免疫機能の発達と機能のプログラムにおける初乳の潜在的意義について、以下のセクションで 検討する。
子牛の免疫発達
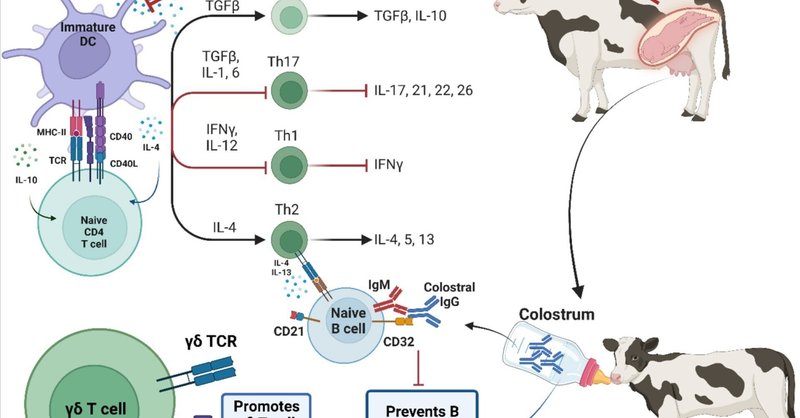
初乳に含まれる母牛の免疫グロブリン(Ig)は、細胞外病原体からの保護に加え、初乳IgのFC部分とFcガンマ受容体II(FcyRII)、別名CD32(Cluster of Differentiation)(図1)との相互作用を介したプロセスで、子牛のナイーブB細胞に対して免疫抑制作用を発揮する。ウシでは、CD32はB細胞、単球、好中球、樹状細胞など様々な免疫細胞に発現している。抗原と結合した母体IgG抗体の存在下で、CD32はナイーブB細胞上のB細胞レセプターと抗原複合体を結合させる。この相互作用によってCD32の細胞内部分が活性化され、その結果、細胞内カルシウムフラックスが減少して抗原プロセッシングが低下し、最終的にB細胞の活性化と分化が制限される(図1;Minskoffら、1998)。子牛の場合、CD32 は B リンパ球に構成的に発現しており、母体抗体による抑制を受けやすい(Chattha et al.) 初乳のIgG濃度が子牛の循環から減少するにつれて、CD32を介したB細胞の活性化抑制作用は時間とともに減少し、子牛は適切な体液性免疫応答を行うことができるようになる。
図のサムネイルgr1
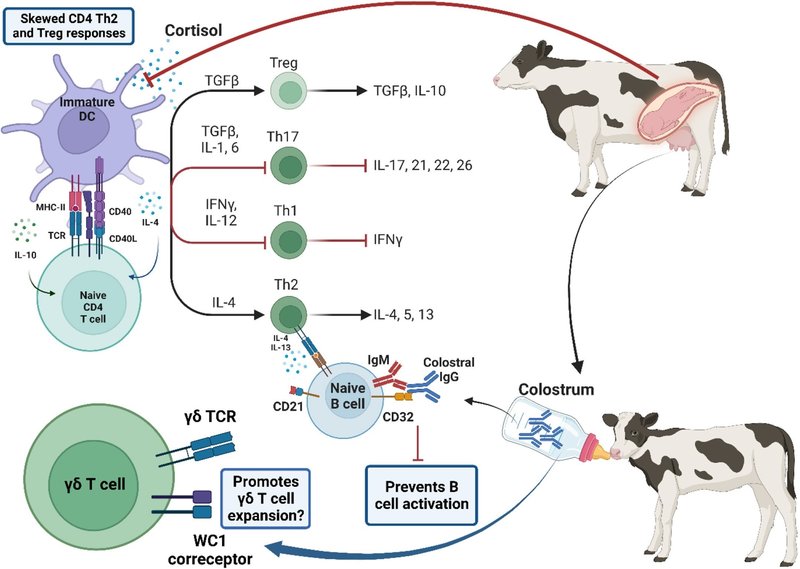
図1生後数週間の免疫機能の出生前および出生後の母体因子による発達プログラミング。出生前後の母体因子は、新しい環境にうまく対処するための制御ネットワークの確立に有利に働くよう、免疫発達の軌跡に影響を与えているようだ。分娩数日前の胎児コルチゾールの大幅な増加は、CD4 Tヘルパー細胞の細胞媒介性エフェクター機能を集団的に変化させ、それが生後早期まで持続してTh2バイアス反応を促進し、効果的に抗炎症性T細胞の表現型を確立する。コロストラムは、B細胞の活性化を抑制しながら、子牛に抗体と細胞媒介性防御を提供し、γδT細胞の増殖を促進し、適応免疫系と自然免疫系の他の分枝が完全に機能するまでの間、早期防御を提供する可能性がある。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
妊娠末期になると、胎児の視床下部-下垂体-副腎(HPA)軸の成熟により、胎児のコルチゾールが大幅に増加し、シクロオキシゲナーゼ2とプロスタグランジンE2のアップレギュレーションが誘発され、エストロゲン濃度が上昇し、プロゲステロン産生が減少する(Wood, 1999)。胎児ホルモンと胎盤ホルモンのこの切り替えは、胎児の排出を助ける子宮筋収縮の増加につながり(Challis, 1971, Chandra and Liddle, 2007)、コルチゾール濃度は生後1週間の間、子牛循環において上昇したままである(Hoyer et al.) このホルモンの変化には2つの役割がある。コルチゾールは分娩を誘発するだけでなく、出産後の最初の数週間、CD4+ T細胞の細胞機能をまとめて変化させ、Th2に偏った反応を促進し、新生仔牛の抗炎症性T細胞表現型を効果的に確立する(Harris and Barletta, 2001; Chase et al.) さらに、生後数週間の免疫機能は、好中球の貪食活性の低下(Kampenら、2006年)、樹状細胞(DC)の成熟と抗原提示の低下によって特徴づけられる。総合すると、生後数週間の子牛の免疫応答は、子牛が本来持っているナイーブな状態だけでなく、出生前と出生後の母体因子の組み合わせによっても損なわれ、この段階で子牛の免疫機能を上書きしてしまう。この再編成は、初乳からの受動免疫の移行による免疫保護を優先させる一方で、子牛自身の防御システムを時間をかけて徐々に発達させ、新しい環境からのアレルゲンに対する異常な免疫反応を効果的に防ぐようである。
ガンマデルタT細胞
初乳を飲ませなかった子牛は、循環中のγδ T細胞のレベルが低くなるため(図 1; Krueger et al. ウシの場合、γδ T細胞は主要なリンパ球サブセットであり、出生時には循環リンパ球全体の50%以上を占め、細胞内感染に対する早期防御をもたらすと同時に、寛容を促進することで免疫応答の悪化を防ぐという二重の役割を担っている(Hoekら、2008;Guzmanら、2014)。これらの非従来型T細胞は、従来のαβT細胞とは異なる一連の特徴を有しており、免疫系の2つの部門をつなぐ架け橋として機能する、適応型と自然免疫型の両方の特徴を備えた、生後早期の重要なリンパ球集団として出現し始めている(Guerra-Maupome et al.)
抗原提示細胞(APC)からのシグナルに基づいていくつかの機能的サブセットに分化できるナイーブCD4+ T細胞とは異なり、γδT細胞の表現型は胸腺での発生過程であらかじめプログラムされている(Baldwin et al.) ウシでは、γδT細胞の機能的サブセットは、膜貫通型糖タンパク質レセプターであるワークショップクラスター1(WC1)の2つの異なるクラスの発現に基づいて分類することができる。WC1レセプターは、従来のαβT細胞におけるCD4+およびCD8+と同様に、コスティミュレイトリー分子として機能し、またパターン認識レセプターとしても機能する(Hsu et al.) WC1受容体は、WC1.1+とWC1.2+に細分される。WC1.1+のγδT細胞サブセットは、ウイルスや細菌感染のクリアランスに関与しており、活性化するとインターフェロンγ(IFN-γ)とインターロイキン17(IL-17;Mcgillら、2013)を分泌し、従来のαβT細胞のエフェクター機能が低下する時期に、細胞内感染に対する早期防御機構を提供する。
WC-と同様にコアセプターWC1.2+を構成的に発現する循環γδT細胞は、in vitroでの刺激によりIL-10、TGF-βなどの抗炎症性サイトカインを産生する能力に基づいて、免疫調節機能を有することが示唆されている(Guerra-Maupomeら、2019;Baldwinら、2021)(Hoekら、2008;Guzmanら、2014;Guerra-Maupomeら、2019)。さらに、ウシにおいてin vivoでWC1.2+γδT細胞を枯渇させると、オバルブミンによるチャレンジ後に体液性免疫応答が悪化し(Skeenら、2001;Guzmanら、2014)、マウスではリステリア菌感染後にγδT細胞を枯渇させると敗血症が誘発される(Skeenら、2001)。我々のグループによる以前の研究で、ホルスタイン子牛の出生時の血液中のリンパ球プールのほぼ60%をγδT細胞が占め、離乳するまで減少することが示された(Cangianoら、2023c)。さらに、WC1.2+レセプターを発現するγδT細胞は、循環において最も豊富なサブセットであり、出生直後は全γδT細胞の55%を占め、離乳後はその割合とレセプター発現が減少する。
全体として、生後早期の発達的適応は免疫機能と発達を調整し、γδT細胞の膨張を促進することで、おそらく早期の全身的保護(WC1.1+サブセット)を提供すると同時に、子牛の免疫系が環境からますます多くの新しい抗原に急速にさらされる時期(WC1.2+サブセット)に免疫寛容を促進する。今後は、新生児疾患の予防策として、γδT細胞の増殖を刺激することを目的とした、テーラーメイドのワクチン接種アプローチの開発に焦点を当てるべきである。ウシの新生児免疫機能についての理解が成熟するにつれ、γδT細胞を積極的な免疫に利用することが、ウシの健康における有力なフロンティアとして浮上してくる。
腸管免疫系
すべての免疫区画の中で、腸管免疫系(IIS)は免疫細胞の数、特殊な解剖学的構造、日常的な微生物との遭遇に基づき、体内で最大である(Chase and Kaushik, 2019)。腸の宿主と微生物の関係は本来相互主義的であるが、豊富な微生物群集と腸内組織との密接な関連は健康上の課題をはらんでいる。IISは、外部環境との関係を媒介する物理的バリアによって、微生物が密集している内腔から物理的に隔てられており、常在微生物に対する不必要な免疫反応を回避するためのいくつかのメカニズムを進化させてきた。腸管免疫系の最も重要な適応のひとつは、腸管上皮細胞が微生物に直接さらされるのを減らすメカニズムを発達させ、潜在的な病理学的転帰を大きく減少させることである(Hooper et al.) いくつかの免疫機構が連携して機能することで、管腔内の微生物を層別化し、微生物と上皮細胞の接触を最小限に抑え、腸の恒常性を維持するために不必要な全身性免疫応答の誘導を防いでいる。IISを形成するさまざまな構成要素、細胞タイプ、免疫エフェクターはすべて協調して働き、微生物の脅威を監視し、それに応じて反応することで、寛容と防御機構のバランスを保っている。
腸管内腔と内部環境を隔てる物理的バリアは、タイトな単層を形成する上皮細胞で構成され(Vancamelbeke and Vermeire, 2017)、小分子やイオンの細胞間通過を制御するタイトジャンクションタンパク質の複合体によって構造的に連結されている(Meda and Spray, 2000)。この上皮バリアは杯細胞(Vancamelbeke and Vermeire, 2017)と呼ばれる特殊な細胞から分泌される粘液で覆われており、腸管内容物を層状化し、内腔の微生物が上皮細胞と直接接触するのを防いでいる。杯細胞はムチンと呼ばれる架橋プロテオグリカンゲルを産生し、高密度の内層を形成し、続いて架橋度の低い外層の粘液層を形成する。外層はいくつかの微生物によってコロニー形成されるが、内層は高濃度の抗菌性化合物と分泌性IgA(sIgA)により、より無菌的な環境を促進し、ほとんどの微生物がコロニー形成するのを防いでいる。さらに、この第一防御線を突破した微生物に対する免疫応答は、大部分が腸内に限定される(Hooper et al.) このように区画化されることで、局所的な免疫応答が全身に影響を及ぼすことが避けられる。これは、パイエル板や腸間膜リンパ節で活性化・分化した後、粘膜に戻るように適応免疫細胞がプログラムされている結果である(Maynard et al.) 腸管バリアの物理的・化学的特性は、腸管陰窩の基部にある共通の幹細胞から発生する、腸細胞(吸収性)、杯細胞(粘液産生)、パネス細胞(抗微生物化合物の産生)、マイクロフォールド(M)細胞(抗原処理と腸管寛容の維持)など、多数の異なる細胞タイプで構成されている。上皮の下には、APC、自然リンパ球、T細胞、B細胞(Chase et al., 2018; Gomez et al., 2019)、補体、ケモカイン、サイトカインなどの免疫メディエーター(Chase and Kaushik, 2019)を含む緩やかな結合組織である固有層が存在する。
IISは、腸管上皮細胞や常在免疫細胞によって発現される生殖細胞系列にコードされた病原体認識受容体(PRR)を介して、微生物関連分子パターン(MAMPS)を認識するいくつかのメカニズムを持っている(Hooper and Macpherson, 2010)。PRRには、Toll like receptor(TLR)2や4、C型レクチン受容体などの膜貫通型受容体や、TLR8やTLR9、NOD Like受容体、RIG like受容体などの細胞内PRRが含まれる。TLRなどのPRRを介した常在細菌叢の感知は、組織の修復と上皮細胞の増殖を誘導し(Maynardら、2012年)、無菌マウスでは、これらのシグナルはLPSやフラジェリンなどの細菌細胞壁成分によって救済される(Hill and Artis、2010年)。粘膜表面近傍の微生物や微生物成分の存在は、APCによって認識され、活性化されるとIL-23の産生を刺激し、さらに自然リンパ球によるIL-22の発現を促進する。この一連の現象は、上皮細胞の増殖を刺激し、腸管上皮細胞やパネス細胞からそれぞれRegIIIγやα-ディフェンシンなどの抗菌ペプチドが分泌・放出される(図2)。さらに、APCは絶えず管腔環境から抗原をサンプリングし、腸間膜リンパ節上のナイーブB細胞やT細胞に抗原を提示している。これにより抗原特異的免疫応答が起こり、腸粘膜で最も豊富なIgである二量体IgAの産生が促進される。このIgAは、高分子免疫グロブリンレセプターによって上皮細胞を横切って輸送され、IgAに分泌成分を付加して半減期を延長する(Maynard et al.) さらに、sIgAは腸管内腔からの抗原サンプリングを補助し、パイエル板におけるAPCによるB細胞やT細胞への抗原提示を改善する(Mantisら、2002年)。抗菌ペプチドとsIgAはともに、腸の主要な非炎症性防御機構の一つであり、上皮細胞近傍の腸内細菌叢の組成を形成するのに役立っている(Pabstら、2016、Patelら、2010、Peterssonら、2011)。
図サムネイルgr2
図2:腸管免疫系、および免疫機能と発達に対する腸内細菌叢の影響。腸内細菌叢は、上皮細胞の増殖、粘液産生、sIgAを刺激することにより腸の健康を促進し、それにより腸内環境と腸上皮の直接接触を回避して免疫排除を促進する。さらに、腸の生態学的条件に高度に適応した特定の微生物群(Niche occupation)は、日和見病原体の侵入を防ぐことができる(Competitive exclusion)。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
腸内微生物群集はIISの複雑なネットワークに大きな影響を及ぼし、免疫寛容とエフェクター機能の間の微妙な均衡を調節している。食生活の急激な変化や抗菌薬の使用など、微生物の多様性を低下させるような変化は、健康全般、特に免疫発達の軌跡に長期的な影響を及ぼす可能性のある幼少期に、重大な影響を及ぼす可能性がある。次の章では、腸内微生物の生態系における宿主と微生物群集のダイナミックな相互作用を探求し、健康と疾患の両方における腸の健康と免疫機能に対する腸内マイクロバイオームの重要性を強調する。
健康と疾患における腸内細菌叢の役割
腸内細菌叢の生態学的複雑性と宿主生理への影響を研究するための次世代シーケンサーのような培養に依存しない技術の出現は、微生物学の分野に革命をもたらし、宿主の健康と疾患に対する微生物叢の機能的役割を探求するレンズを広げた。過去20年間にわたる16SリボソームRNA遺伝子の塩基配列決定と全ゲノム塩基配列決定技術の広範な実施に基づき、腸内細菌叢が局所的および全身的に代謝機能と免疫機能を形成することにより、健康を守る上で重要な役割を果たしていることがますます明らかになってきた(Michaudel and Sokol, 2020)。最近の推定によると、ヒトの腸内にはヒトの細胞数を約10倍上回る微生物が棲息しており、腸内微生物のメタゲノムを構成する微生物遺伝子の総数はヒトゲノムの約100倍である(Sender et al.)
腸内細菌叢は、おそらく選択圧のもとで進化し、難消化性の植物性炭水化物や多糖類を効果的に分解して宿主の消化効率を高め(特に反芻動物の場合)、安定した栄養豊富な生態学的ニッチを確保している(Hooper et al.) 宿主の消化能力を高めることに加え、腸内微生物はビタミンKやB12といった重要な非栄養因子を提供する(Conlyら、1994、Dawson and Karpen、2015)。さらに、腸内常在微生物とその構成微生物は、強固で相互に結びついたネットワークを発達させており、通常の生態学的条件下では腸内に定着するのに適していない非常在細菌や病原体に対して、腸内の利用可能な資源へのアクセスを物理的・代謝的に制限している(Maynard et al.) そのため、腸内常在細菌叢は競争的排除を通じて日和見病原体の侵入を防いでいる(図2)。
腸内常在細菌叢は宿主と主に相互依存的な関係を築いている。これは、短鎖脂肪酸(SCFA)のような食事成分の嫌気性発酵から、あるいは胆汁酸のような宿主によって産生され微生物によって修飾された分子から、幅広い代謝産物を介した宿主と腸内細菌叢の双方向コミュニケーションによって達成される(Jia et al.) 最後に、宿主は病原体認識受容体を通じてさまざまな微生物構造成分を認識し、それに応じて応答することができる。腸内細菌叢の主な役割の一つは、新生児における免疫系の発達と成体動物における腸の健康維持である。腸粘膜、パイエル板、孤立性リンパ濾胞(ILF)、腸間膜リンパ節の成熟は、コロニー形成過程における腸内微生物の感知から得られるシグナルに依存している。無芽胞マウスはリンパ濾胞が発達せず、分泌性IgAと粘液産生が欠損している。その結果、自然壊死性腸炎を発症することがある(Wopereisら、2014年、Yangら、2021年)。我々のグループの研究から、生後1週間までの子牛に生きた酵母プロバイオティクスであるSaccharomyces cerevisiae boulardii(SCB)を補充すると、微生物の多様性が増加し、分泌性IgA(sIgA)産生が刺激されることが示された(Villot et al、 2023b)、離乳前の子牛の重度の下痢の発生率を減少させ、より成熟した微生物群集が免疫の発達を刺激し、日和見病原細菌に対する抵抗性を高めるために必要なシグナルを提供できるというさらなる証拠を提供した。
生後間もない時期は、食事が腸内細菌叢の群集構造と多様性に大きな影響を与える。母乳栄養児とミルク栄養児を比較したヒトの研究では、母乳栄養児の方がビフィズス菌とラクトバチルス菌の割合が多いことが示されている(Fallani et al.) 子牛の場合、初乳の給与を遅らせたり初乳を制限したりすると、微生物の多様性が低下し、ビ フィドバクテリウムと乳酸桿菌の割合が減少することが示されている (Malmuthuge et al., 2015)。母乳と初乳が生後早期の腸内細菌叢の構成を制御するメカニズムには、相互扶助的な関係を促進する制御ネットワークの確立に有利なものがいくつかある(Maynard et al.) 初乳、そして成熟乳には、オリゴ糖として知られる酵素消化に抵抗性の非共役糖鎖群が含まれている(Fischer et al.) これらの分子は、ビフィドバクテリウム、ラクトバチルス、バクテロイデスなど、オリゴ糖をSCFAや乳酸に発酵させる酵素を持つ主要な細菌種の発育を刺激するプレバイオティクスとして働く(Fischer et al.) マウスにおいて、ビフィズス菌のコロニー形成はSCFA産生を促進し、未成熟DCによるIL-10産生を刺激することが示されている(Jeon et al.) さらに、ビフィドバクテリウム属、バクテロイデス属はムチングリカンを「採食」し、粘液層の外側に存在することができる(Martensら、2008)。この細菌群は乳酸を産生し、上皮細胞付近のpHを低下させ、その環境では増殖できない他の細菌群を競合的に排除する。コロストラムにはまた、ラクトフェリンやリゾチームなどの抗菌化合物も含まれており、ほとんどの微生物が粘液層の内側に定着するのを防ぎ、上皮細胞に近接する微生物の負荷を軽減する(Laforest-Lapointe and Arrieta, 2017)。さらに、ラクトフェリンの補給は、早産児や離乳前の子牛の新生児死亡率を低下させることが示されている(Manzoniら、2014;Habingら、2017)。
特定の微生物群は、難消化性の植物性炭水化物や多糖類を発酵させ、IISの構造的完全性と機能の維持に有益な役割を果たす二次代謝産物であるSCFAを産生することができる。腸内細菌叢由来のSCFAは杯細胞に作用してムチンの分泌を刺激し、大腸細胞の主要なエネルギー源となって細胞のターンオーバーと増殖を促進する(Donohoe et al.) また、SCFAはシグナル伝達分子として働き、ヒストン脱アセチル化酵素を阻害し、ヒストンアセチルトランスフェラーゼを活性化する(Liuら、2012年)。これによりIL-18の分泌が誘導され、上皮細胞の細胞修復機構と杯細胞のムチン産生が刺激される。さらに、SFCAはIgAへのクラス転換を促進し、B細胞でのIgA分泌を促進するようで、B細胞のエネルギー代謝の再配線を伴うメカニズムで免疫排除をさらに高める(Kimら、2016年)。最後に、SCFAはT制御細胞(Treg)と呼ばれる制御細胞群の増殖を誘導することにより、腸管免疫機能を媒介する。これは、第一にDCの成熟を阻害することによって、第二に上皮細胞とDCによるトランスフォーミング増殖因子β(TGF-β)の産生を促進することによって媒介される(Atarashi et al.) これにより、DCからのIL-10分泌が促進され、CD4+ Tヘルパー細胞からTregへの分化が促進される。しかし反芻動物では、in vitro研究の結果から、Tregは循環中に存在するものの、少なくともin vitroでは免疫寛容を促進しないようであることが示唆されている(Hoekら、2008年)。反芻動物では、この機能は、少なくとも部分的には、γδT細胞のWC-およびWC1.2+サブセットが担っている可能性が、いくつかの研究で示唆されている(Hoekら、2009;Guzmanら、2014)。
腸内細菌叢は宿主にとって多くの有益な機能を担っているが、初乳の摂取制限、急激な食餌の変化、治療的または予防的な抗菌薬の使用、廃乳の給与、突然の離乳などの特定の要因により腸内細菌叢が損なわれ、日和見病原体の侵入を受けやすい生態環境になる可能性がある(Tamburini et al.) ヒトやマウスのモデル研究では、重要な細菌群の機能的喪失や微生物多様性の低下をもたらす腸内細菌叢組成の変化は、病原性感染の機会を作り出し、疾患の発症に関連する(Levy et al.) ディスバイオーシスと呼ばれるこのプロセスは、通常は腸の炎症を抑制する重要な免疫制御ネットワークを破壊し、腸管バリアの機能に影響を及ぼす可能性がある。
子牛の飼育における抗菌剤の使用と免疫代謝機能への影響
ヒトと動物の両方の研究において、腸内微生物異常症の原因として最もよく知られ ているのが、抗菌剤の使用である(Fallani et al.) 離乳前の時期には死亡率や罹患率が高いため、抗菌剤は伝統的に治療と疾病予防の両方として酪農産業で使用されてきた(Urie et al.、2018;Uyama et al.、2022)。子牛への予防的抗菌薬投与は、抗菌薬耐性に関する懸念だけでなく、疾病予防に有効であるという一貫したデータがないため、近年、その実践が問われている(Aghakeshmiri ら、2017;Buss ら、2021)。腸疾患予防のために予防的に使用される最も一般的な抗菌剤はネオマイシンとオキシテトラサイクリンであり、酪農施設の9%は現在もこの組み合わせを主な抗菌剤添加剤として使用している(USDA, 2018)。さらに、最近の調査(Uyama et al., 2022)によると、カナダの農場の 20% が、病気の治療を受けた牛の売れ残りミルクを子牛に与えている。一般に廃乳と呼ばれるこのミルクには、抗菌剤が残留し、微生物や体細胞が多く含まれている可能性がある。ヒトの新生児では、抗生物質の投与源に関わらず、生後間もない時期に曝露されると腸内微生物の群集構造が変化し(Fallani et al., 2011; Woperies et al., 2014)、離乳前の子牛では、Faecalibacteriumのような有益な細菌の存在量が減少し、病原性E. ShigellaやEnterococcusの存在量が増加することと相関している(Amin et al., 2021)。しかし、我々の知る限り、廃乳が粘膜免疫に与える影響を調べた研究はない。
抗菌剤が免疫機能に及ぼす影響
抗菌薬使用などの環境要因による変化は、健康と生産性に永続的な影響を及ぼす可能性がある(Aghakeshmiri et al.) ヒトでは、新生児期の抗菌薬使用は、その後のアトピー性アレルギーや喘息の発症と相関している(Arrieta et al.) このプロセスは、腸内の常在細菌叢と免疫細胞および上皮細胞間のTLRシグナル伝達の破綻によって媒介されるようである。その結果、B細胞抗体産生とクラススイッチングが制御不能となり、IgEが増加し、循環中の好塩基球レベルが上昇する(Hillら、2012年)。さらに、腸内のビフィズス菌の量が減少すると、T調節サブセットの拡大が抑制されるため、常在細菌叢や食物アレルゲンに対する免疫学的寛容が破壊されることが示されている(Jeon et al.) さらに、微生物の多様性とSCFAが減少すると、通常は適切な腸管バリア機能を促進する微生物叢が発揮する刺激シグナルが減少する。その結果、上皮細胞の増殖が低下し、粘膜層が薄くなり、分泌性IgAの産生が低下する(Tamburini et al.) これらの因子は総体的に、上皮細胞と腸内環境との直接的な接触を高め、腸の炎症を促進する免疫反応を引き起こす(図3)。ヒトとマウスの両方で行われた研究では、抗生物質の投与によって腸内細菌叢の組成が変化し、その結果、重要な細菌群が機能的に失われる。このプロセスにより、通常は腸の炎症を抑制し、腸のバリア機能に影響を与える重要な免疫制御ネットワークが破壊され、最終的に成人期の免疫機能の異常が引き起こされる(Arrieta et al.、2017)。
図サムネイルgr3
図3抗菌薬使用などの環境要因による変化は、子牛の腸の健康と代謝機能に悪影響を及ぼす。微生物の多様性が減少し、特にビフィズス菌や乳酸菌の量が減少すると、短鎖脂肪酸(SCFA)が減少し、微生物叢が適切な腸管バリア機能に及ぼす刺激シグナルが減少する。その結果、上皮細胞の増殖が低下し、粘膜層が薄くなり、分泌型免疫グロブリンA(IgA)の産生が低下する。これらの因子は総体的に、上皮細胞と腸内環境との直接的な接触を高め、腸の炎症を促進する免疫反応を引き起こす。さらに、抗菌薬によって誘導されたディスバイオシスとビフィズス菌および乳酸菌の減少は、胆汁酸(BA)およびBAの微生物変換産物(2BA)のプロファイルを変化させ、BAシグナル伝達の調節不全を引き起こし、末梢脂肪組織における代謝機能と炎症に関連する遺伝子の転写産物量を変化させる。
大きな画像を見るダウンロード 高解像度画像
我々のグループによる以前の研究では、抗菌薬ネオマイシンを14日間または28日間予防的に投与すると、経口投与したマーカーであるクロム-EDTAの血漿回収率の増加によって反映されるように、腸管透過性が増加することが示されている(Cangianoら、2023a)。これは、乳酸桿菌やビフィズス菌など、生後早期の腸の健康に関連する主要な細菌群の種の豊富さや存在量が減少し、病原性細菌に対するコロニー形成抵抗性が低下することが観察されたことによると考えられる(図3)。
子牛の離乳前の時期に抗菌剤を使用した場合の長期的な影響を直接調査した研究はないが、疫学的データによると、この時期の抗菌剤投与は、その後の成績低下や疾病発生率の上昇と相関している。離乳前の期間に抗菌薬を投与された子牛は、離乳後は投与されないが、受胎率が低下し、初産までの期間が長くなり、健康合併症により早期に牛群から離脱するリスクが高まり、最初の泌乳期間中の乳量が減少する(Aghakeshmiriら、2017;Abueloら、2021)。このことは、牛の場合、生後早期の抗菌剤投与による腸内細菌叢の破壊が、これまで予想されていなかった形で免疫の発達と健康にも影響を与える可能性があることを示唆している。商業牛群では、牛の快適性の大幅な向上と遺伝的選択にもかかわらず、淘汰率が高いため、乳牛の生産寿命は自然寿命よりもはるかに短い状態が続いている(De Vries and Marcondes, 2020)。従って、成牛のある種の健康障害や代謝障害が、発育初期の不適応に起因するものなのかどうかを判断するためには、幼若期の管理方法の違いが免疫の発達にどのような影響を与えるのかを理解することが重要である。
代謝機能に対する抗菌剤の影響
近年、幼少期の抗菌剤曝露による腸内細菌叢の変化が、脂肪率の上昇と関連し、ヒトにおけるいくつかの代謝疾患発症の危険因子であることを示唆する証拠が増えつつある(Cox et al.) マウスでは、幼少期の微生物多様性の低下が脂質異常症や脂肪沈着の増加につながる可能性があり(Bäckhedら、2004)、家畜では、増体効率や脂肪沈着を改善するために抗菌薬が日常的に使用されている。抗菌剤の使用によって阻害されると思われる代謝軸のひとつは、胆汁酸(BA;Ipharraguerreら、2018)の代謝である。胆汁酸は、脂質乳化剤という古典的な役割のほかに、近年、いくつかの代謝および炎症経路の全身的調節において重要な役割を果たすことが示されており、その機能は腸内細菌叢の組成に影響される。胆汁酸は栄養感知分子として機能し、食後状態の末梢組織に栄養素の流入を知らせる(Chiang, 2009)。また、腸、肝臓、末梢脂肪組織、特定の免疫細胞で構成的に発現している専用の核内受容体や細胞表面受容体を介して、脂質代謝や炎症の調節にも関与している(De Aguiar Vallim et al.)
腸肝系の各コンパートメント内のBAs濃度は、専用の核内受容体と膜結合型受容体の複合体によって厳密に制御されている。肝臓では、BAsは核内受容体FXRと相互作用し、ステロール応答性エレメント結合タンパク質1cの発現を抑制することにより、BA合成を減少させ、肝脂肪生成をダウンレギュレートする(Hirokaneら、2004)。門脈からのBAの肝回収は不完全であり、BAのごく一部は腸肝系を脱出して全身循環に入る。これらのBAは脂肪組織、骨格筋に発現するTGR5やFXRと相互作用し、脂肪生成、糖新生、炎症に関与する遺伝子の発現を制御する転写ネットワークを活性化する(図4;Lefebvreら、2009;Ipharraguerreら、2018)。脂肪組織常在マクロファージもFXRとTGR5を発現しており、BAを介した活性化により、炎症が抑制され、インスリン感受性が上昇する(McGaviganら、2017)。さらに、脂肪組織におけるFXR活性化は、ペルオキシソーム増殖剤活性化受容体γ活性を促進することにより、細胞増殖を促進する(Abdelkarimら、2010)。最後に、FGF-19は、BAに対するTGR5の受容体親和性を増加させることにより、褐色脂肪組織におけるエネルギー消費を促進する(Watanabeら、2006)。
図サムネイルgr4
図4胆汁酸の腸肝循環と全身代謝への影響。脂質乳化剤としての古典的な役割のほかに、胆汁酸(BA)は多面的なシグナル伝達分子として働き、食後状態の末梢組織に栄養素の流入を知らせることで、栄養素感知分子としての役割を果たしている。BAsは専用の核内受容体と細胞表面受容体を介して脂質代謝と炎症の制御に関与しており、腸、肝臓、末梢脂肪組織で構成的に発現している。FXR = ファルネソイドx受容体。BA = 一次胆汁酸。2BA = 二次胆汁酸。TGR5:武田Gタンパク質共役型受容体5。FGF-19=線維芽細胞増殖因子19。SREBP1=Sterol regulatory element-binding protein 1。 CYP7A1=Cytochrome P450 Family 7 Subfamily A Member 1。LDL-R:低比重リポタンパク質受容体。Ostα/Ostβ=ヘテロ二量体有機溶質トランスポーターαおよびβ。 PPAR-γ=ペルオキシソーム増殖剤活性化受容体γ。BioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
いくつかの微生物は、脱共役およびジヒドロキシル化酵素プロセスによって腸内のBAプールの組成を変化させることができ、それによって殺微生物効果を低下させ、アゴニスト機能を変化させ、宿主との双方向コミュニケーションを確立する(Lefebvre et al.) 一次BAを細菌が修飾した産物である二次BAは、腸、肝臓、末梢組織の標的受容体に対するアゴニスト機能に変化をもたらす。これらのBAのプロファイルと濃度は、腸内細菌叢の組成に大きく依存しており、腸内細菌叢と代謝機能との直接的な関連が示唆されている。抗菌薬によって腸内細菌叢の機能的多様性が失われると、BAの生合成が変化し、末梢組織における代謝に対する「指示機能」が変化する可能性がある(Lefebvreら、2009;Ipharraguerreら、2018)。
いくつかの研究は、抗菌薬の予防的使用が、一次BAの脱共役(胆汁酸塩ヒドロラーゼ;BSH)および脱水素化(BA誘導性遺伝子;BAI)の遺伝子を発現するいくつかの細菌群の存在量の変化を誘導し、最終的にBAのプロファイルおよび組織分布を変化させることによってBA代謝の調節不全をもたらすことを示している。この結果、げっ歯類(Swannら、2011)、子豚(Ipharraguerreら、2018)、子牛(Cangianoら、2023a)において、末梢脂肪組織と肝臓の代謝機能と炎症に関連する遺伝子の転写物量が変化する。我々は最近、ホルスタインの子牛に抗菌薬ネオマイシンを予防的に投与すると、腸肝系のさまざまな区画におけるBA濃度とプロフィールが異常に変化することを証明した。ネオマイシンによるBA代謝の調節異常は、乳酸桿菌やビフィドバクテリウムなどの主要な細菌群の相対的存在量の減少によって媒介されるようで、脂肪組織や肝臓の脂質代謝や免疫活性化に関連する遺伝子の転写産物量の変化につながる(Cangianoら、2023a;図3)。このことは、生後間もない時期の抗菌剤投与が、子牛の発育と健康に、これまで予想されていなかったような影響を及ぼす可能性を示唆している。
結論
まとめると、酪農飼育システムのいくつかの要素が、子牛の複数の生理学的軸にわた る発育の重要な決定因子として浮上してきた。出生前および出生後の母体因子は、免疫発達の軌跡に影響を与え、新しい環境にうまく対処するための制御ネットワークを確立し、同時に初乳による早期の免疫保護をもたらすようである。さらに、微生物のコロニー形成は、腸と免疫の発達を促進する上で重要な役割を果たしている。この複雑なプロセスは、初乳の不適切な管理、予防的抗菌剤、廃乳など、いくつかの管理要因によって悪影響を受ける可能性があり、最終的には初期の腸内細菌叢の構成に影響を与え、宿主の健康に長期的な影響を及ぼす。しかし、抗菌薬使用の長期的影響に関する既存の知見は、主に疫学研究から得られた相関データに基づくものである。そのため、抗菌薬使用が牛の免疫・代謝機能に長期的にどのような影響を及ぼすかについての理解には大きな隔たりがある。従って、今後の研究では、成牛のある種の代謝障害や炎症性障害が、発育初期の不適応に起因するものであるかどうかを理解するために、幼若期の管理要因(予防的抗生物質、廃乳、初乳の管理など)が免疫・代謝機能の発育軌跡に長期的にどのような影響を及ぼすかを調べる必要がある。
参考文献
アブデルカリム M.
Caron S.
Duhem C.
Prawitt J.
デュモン J.
ルーカス A.
ブシャール E.
ブリアン O.
ブロゼック J.
カイパース F.
フィーヴェ C.
カリウ B.
Staels B.
ファルネソイドX受容体は、ペルオキシソーム増殖因子活性化受容体γを促進し、Wnt/β-カテニン経路に干渉することにより、脂肪細胞の分化と機能を制御する*。
J. Biol. Chem. 2010; 285 (20851881): 36759-36767
https://doi.org/10.1074/jbc.M110.166231
論文で見る
スコープス (0)
パブコメ
概要
全文
全文PDF
グーグル奨学生
アブエロA.
カレンズF.
Brester J.L.
大規模酪農牛群における未経産牛の繁殖成績および初産乳量に対する離乳前疾患の影響。
J. Dairy Sci. 2021; 104 (33685674): 7008-7017
https://doi.org/10.3168/jds.2020-19791
論文で見る
スコープス (16)
パブコメ
概要
全文
全文PDF
グーグル奨学生
アリエッタ M.-C.
スティームスマ L.T.
ディミトリュー P.A.
ソーソンL.
ラッセル S.
ユリスト-ドウチュS.
Kuzeljevic B.
ゴールド M.J.
ブリトン H.M.
ルフェーブルD.L.
スバラオ P.
マンデーン P.
ベッカー A.
マクナニー K.M.
シアーズ M.R.
コルマン T.
モーン W.W.
ターベイ S.E.
ブレット・フィンレイB.
乳児期早期の微生物および代謝の変化は、小児喘息のリスクに影響する。
Sci. Transl。Med. 2015; 7 (307ra152 LP-307ra152.)
doi: https://doi.org/10.1126/scitranslmed.aab2271
論文で見る
スコープス (1081)
PubMed
クロス
グーグル奨学生
アタラシ K.
田之上貴之
大島和彦
須田和彦
永野祐子
西川博之
福田 聡
齋藤知行
成嶋慎太郎
長谷 K.
キム S.
フリッツ J.V.
ウィルムズ P.
上羽 聡
松島健一
大野秀樹
オルレ B.
坂口 聡
谷口 徹
森田浩之
服部雅之
本田和彦
ヒト微生物叢から合理的に選択されたクロストリジウム菌株の混合物によるTreg誘導。
Nature. 2013; 500 (23842501): 232-236
https://doi.org/10.1038/nature12331
論文で見る
スコープス (2020)
パブコメ
クロス
グーグル奨学生
ベッケド F.
Ding H.
Wang T.
フーパー L.V.
Gou Y.K.
ナギー A.
セメンコビッチ C.F.
ゴードン・J.I.
脂肪蓄積を制御する環境因子としての腸内細菌叢。
Proc. Natl. Sci. USA. 2004; 101 (15505215): 15718-15723
https://doi.org/10.1073/pnas.0407076101
論文で見る
日本学術振興会特別研究員
パブコメ
クロス
グーグル奨学生
ボールドウィン C.L.
ダマニ-横田P.
Yirsaw A.
ルーニー K.
テイシェイラ A.F.
ギレスピー A.
反芻動物におけるγδT細胞の特殊性。
Mol. Immunol. 2021; 134 (33774521): 161-169
https://doi.org/10.1016/j.molimm.2021.02.028
論文で見る
スコープス (16)
パブコメ
クロス
グーグル奨学生
バス L.N.
ヨーエ T.T.
カンジアーノL.R.
ルノー D.L.
キューネン A.J.
グアン L.L.
Steele M.A.
代用乳へのネオマイシン混入が、離乳前のホルスタイン種雄子牛の健康、成長、成績に及ぼす影響。
J. Dairy Sci. 2021; 104 (33934860): 8188-8201
https://doi.org/10.3168/jds.2020-19827
論文で見る
スコープス (8)
PubMed
概要
全文
全文PDF
グーグル奨学生
カンジアーノ L.R.
イファラゲール I.R.
グアン L.L.
バス L.N.
アモリン・ヘゲダスR.
コントレラス G.A.
チリヴィ M.
Steele M.A.
ホルスタイン子牛へのネオマイシンの予防的給与は、腸内細菌叢、胆汁酸代謝および免疫代謝調節に関与する遺伝子の発現を変化させる。
Front. Microbiol. 2023; 14 (37720145)1210142
https://doi.org/10.3389/fmicb.2023.1210142
論文で見る
日本学術振興会特別研究員 (0)
パブコメ
クロス
グーグル奨学生
カンジアーノ L.R.
ラマースK.
オルメダ M.F.
ヴィロット C.
ホッジンズ D.C.
マラード B.A.
スティール M.A.
ホルスタイン種雄牛子牛の出生から離乳までの血液および腸管粘膜におけるγδT細胞およびB細胞の発達的適応。
J. Dairy Sci. 2023; (In Review). 37806632
https://doi.org/10.3168/jds.2023-23943
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
カンジアーノ L.R.
ヴィロットC.
アモリン・ヘゲドゥスR.
マルムスゲN.
グアン L.L.
グルニンガー R.J.
スティール M.A.
Saccharomyces cerevisiae boulardiiは腸内細菌叢の成熟を促進し、新生児乳牛子牛における分泌性IgA産生の増加と相関する。
Front. Microbiol. 2023; 14 (37795296)1129250
https://doi.org/10.3389/fmicb.2023.1129250
論文で見る
パブコメ
グーグル奨学生
チャリス J.R.G.
羊の分娩直前の遊離循環エストロゲンの急激な増加。
自然。1971; 229 (4923273): 208
https://doi.org/10.1038/229208a0
記事で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
チャンドラ R.
リドルR.A.
コレシストキニン。
Curr. 意見。内分泌。糖尿病肥満。2007; 14
論文で見る
スコープス (137)
PubMed
クロス
グーグル奨学生
チェイス C.
カウシク R.S.
牛の粘膜免疫系: すべての免疫反応はここから始まる。
Vet. Clin. North Am. Food Anim. Pract. 2019; 35 (31590896): 431-451
https://doi.org/10.1016/j.cvfa.2019.08.006
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル・スカラー
チェイス C.C.L.
ハーリーD.J.
リバー A.J.
子牛の新生児免疫発達とワクチン反応への影響。
Vet. Clin. North Am. Food Anim. Pract. 2008; 24 (18299033): 87-104
https://doi.org/10.1016/j.cvfa.2007.11.001
記事で見る
スコープス (255)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
チャッタ K.S.
ファース M.A.
ホッジンズ D.C.
シェウェン P.E.
ウシのリンパ球におけるCD21とCD32の発現の年齢変化: 横断的研究。
Vet. Immunol. Immunopathol. 2009; 130 (19243842): 70-78
https://doi.org/10.1016/j.vetimm.2009.01.009
論文で見る
スコープス (19)
パブコメ
クロス
グーグル奨学生
Chiang J.Y.L.
胆汁酸:合成の制御。
J. Lipid Res. 2009; 50 (19346330): 1955-1966
https://doi.org/10.1194/jlr.R900010-JLR200
論文で見る
日本脂質学会誌(1187)
PubMed
要旨
全文
全文PDF
グーグル奨学生
コンリーJ.M.
スタイン K.
ウォロベッツL.
ラトリッジ・ハーディングS.
ビタミンKのヒト栄養所要量に対する腸内細菌叢によって産生されるビタミンK2(メナキノン)の寄与。
Am. J. Gastroenterol. 1994; 89 (8198105): 915-923
論文で見る
PubMed
グーグル奨学生
ドーソン P.A.
カーペン S.J.
胆汁酸の腸内輸送と代謝。
J. Lipid Res. 2015; 56 (25210150): 1085-1099
https://doi.org/10.1194/jlr.R054114
論文で見る
スコープス (352)
PubMed
概要
全文
全文PDF
グーグル奨学生
デ・アギア・ヴァリムT.Q.
ターリング E.J.
エドワーズP.A.
代謝における胆汁酸の広範な役割。
Cell Metab. 2013; 17 (23602448): 657-669
https://doi.org/10.1016/j.cmet.2013.03.013
論文で見る
日本
パブコメ
要旨
全文
全文PDF
グーグル奨学生
デフリースA.
マーコンデス M.I.
総説: 乳牛の生産寿命に影響する要因の概要。
Animal. 2020; 14 (32024570): S155-S164
https://doi.org/10.1017/S1751731119003264
論文で見る
スコープス (91)
パブコメ
クロス
グーグル奨学生
フェイバー S.N.
フェイバーN.E.
マコーリーT.C.
アックス R.L.
ケーススタディ: 初乳摂取が泌乳成績に及ぼす影響 1.
Prof. Anim. Sci. 2005; 21: 420-425
https://doi.org/10.15232/S1080-7446(15)31240-7
論文で見る
スコパス (0)
要旨
全文PDF
グーグル・スカラー
ファラーニ M.
アマリ S.
ウシヤルヴィ A.
アダム R.
カンナ S.
アギレラ M.
ギル A.
ヴィエイテス J.M.
ノーリン E.
ヤング D.
スコット J.A.
ドレ J.
エドワーズC.A.
ヨーロッパの5つのセンターから採取した乳児サンプルにおける、最初の補完食導入後のヒト乳児腸内細菌叢の決定因子。
微生物学(読書)。2011; 157 (21330436): 1385-1392
https://doi.org/10.1099/mic.0.042143-0
記事で見る
スコープス(279)
パブコメ
クロス
グーグル奨学生
フィッシャー A.J.
マルムスゲN.
グアンL.L.
スティール M.A.
短報: 牛初乳の加熱処理が初乳中およびホルスタイン新生雄子牛の腸内のオリゴ糖濃度に及ぼす影響。
J. Dairy Sci. 2018; 101 (29102133): 401-407
https://doi.org/10.3168/jds.2017-13533
論文で見る
スコープス (31)
PubMed
概要
全文
全文PDF
グーグル奨学生
ゴッデン S.M.
ロンバード J.E.
Woolums A.R.
乳用子牛の初乳管理。
Vet. Clin. North Am. Food Anim. Pract. 2019; 35 (31590901): 535-556
https://doi.org/10.1016/j.cvfa.2019.07.005
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ゲラ-マウポメM.
スレートJ.R.
マクギル J.L.
反芻動物におけるガンマデルタT細胞の機能。
Vet. Clin. North Am. Food Anim. Pract. 2019; 35 (31590897): 453-469
https://doi.org/10.1016/j.cvfa.2019.08.001
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
グスマンE.
ホープ J.
テイラー G.
スミス A.L.
キュビジョス・サパタ C.
チャールストン B.
ウシのγδT細胞は主要な制御性T細胞サブセットである。
J. Immunol. 2014; 193 (24890724): 208-222
https://doi.org/10.4049/jimmunol.1303398
論文で見る
スコープス (80)
パブコメ
クロス
グーグル奨学生
ハービングG.
ハリスK.
シューネマンG.M.
ピニェイロ J.M.
ラクリッツ J.
Clavijo X.A.
ラクトフェリンは離乳前の子牛の下痢による死亡率を減少させる。
J. Dairy Sci. 2017; 100 (28318585): 3940-3948
https://doi.org/10.3168/jds.2016-11969
論文で見る
スコープス (19)
PubMed
概要
全文
全文PDF
グーグル・スカラー
ハリス N.B.
バレッタ R.G.
獣医療におけるMycobacterium avium subsp.
Clin. Microbiol. Rev. 2001; 14 (11432810): 489-512
https://doi.org/10.1128/CMR.14.3.489-512.2001
論文で見る
日本
PubMed
クロス
グーグル奨学生
Heinrichs A.J.
21 世紀のニーズを満たす代替乳牛の育成。
J. Dairy Sci. 1993; 76 (8227639): 3179-3187
https://doi.org/10.3168/jds.S0022-0302(93)77656-0
論文で見る
PubMed
要旨
全文PDF
グーグル奨学生
ヒル D.A.
アーティスD.
腸内細菌と免疫細胞のホメオスタシス制御。
Annu. Rev. Immunol. 2010; 28 (20192812): 623-667
https://doi.org/10.1146/annurev-immunol-030409-101330
論文で見る
スコープス (449)
パブコメ
クロス
グーグル奨学生
ヒル D.A.
シラクサ M.C.
アプトM.C.
キム B.S.
コブレイ D.
久保正明
カンバヤシ T.
ラロサ D.F.
レナー E.D.
オレンジ J.S.
ブッシュマン F.D.
アルティスD.
好塩基球の造血とアレルギー性炎症を制御する常在細菌由来のシグナル。
Nat. Med. 2012; 18 (22447074): 538-546
https://doi.org/10.1038/nm.2657
論文で見る
スコープス (367)
パブコメ
クロス
グーグル奨学生
弘兼憲史
中原雅之
立花慎二
清水雅之
佐藤理学
胆汁酸は肝細胞核内因子-4*を介するミクロソームトリグリセリド移行蛋白遺伝子発現抑制により超低比重リポ蛋白の分泌を低下させる。
J. Biol. Chem. 2004; 279 (15337761): 45685-45692
https://doi.org/10.1074/jbc.M404255200
論文で見る
日本学術振興会特別研究員 (0)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ホーク A.
ルッテンV.P.M.G.
クールJ.
アーケスタインG.J.A.
ブウストラ R.J.
ファン・ラインI.
コーツ A.P.
CD4+CD25highFoxp3+ T細胞ではなく、ウシWC1+γδ T細胞の亜集団が生体外で免疫制御細胞として働く。
Vet. Res. 2009; 40 (18928784): 06
https://doi.org/10.1051/vetres:2008044
論文で見る
スコープス (95)
パブコメ
クロス
グーグル奨学生
フーパー L.V.
リットマンD.R.
マクファーソンA.J.
微生物叢と免疫系の相互作用。
サイエンス。2012; 336 (22674334): 1268-1273
https://doi.org/10.1126/science.1223490
記事で見る
スコープス (2944)
パブコメ
クロス
グーグル奨学生
フーパー L.V.
マクファーソン A.J.
腸内細菌叢の恒常性を維持する免疫適応。
Nat. Rev. Immunol. 2010; 10 (20182457): 159-169
https://doi.org/10.1038/nri2710
論文で見る
スコープス(1053)
PubMed
クロス
グーグル奨学生
ホイヤーC.
グルナートE.
Jöchle W.
分娩時のストレス指標としての子牛の血漿グルココルチコイド濃度。
Am. J. Vet. Res. 1990; 51 (2240818): 1882-1884
論文で見る
PubMed
グーグル奨学生
Hsu H.
チェン C.
ネニンガーA.
ホルツL.
ボールドウィン C.L.
テルファー J.C.
WC1は病原性細菌のγδTCRコアセプターとパターン認識レセプターのハイブリッドである。
J. Immunol. 2015; 194 (25632007): 2280-2288
https://doi.org/10.4049/jimmunol.1402021
論文で見る
スコープス (35)
PubMed
クロス
グーグル奨学生
イファラゲール I.R.
パストルJ.J.
ガバルダ-ナバロA.
ビジャローヤF.
メレウ A.
豚の抗菌性成長促進は、胆汁酸シグネチャーとシグナル伝達の組織特異的リモデリングと関連している。
Sci. Rep. 2018; 8 (30209339): 1-13
https://doi.org/10.1038/s41598-018-32107-9
論文で見る
スコープス (14)
PubMed
クロス
グーグル奨学生
チョン S.G.
香山秀昭
上田康弘
高橋忠彦
浅原忠彦
辻秀人
辻 N.M.
清野秀之
馬 J.S.
楠 毅
奥村理恵子
原 浩史
吉田秀樹
山本幹夫
野本和彦
武田和彦
プロバイオティクスBifidobacterium breveは大腸においてIL-10産生Tr1細胞を誘導する。
PLoS Pathog. 2012; 8 (22693446)e1002714
https://doi.org/10.1371/journal.ppat.1002714
論文で見る
スコープス (254)
クロスリファレンス
グーグル奨学生
Jia W.
Xie G.
Jia W.
消化管炎症と発癌における胆汁酸と微生物叢のクロストーク。
Nat. Rev. Gastroenterol. Hepatol. 2018; 15 (29018272): 111-128
https://doi.org/10.1038/nrgastro.2017.119
論文で見る
スコープス (942)
PubMed
クロス
グーグル奨学生
カンペン A.H.
オルセンI.
トラーシュルッドT.
ストルセット A.K.
Lund A.
生後6ヶ月の子牛におけるリンパ球亜集団と好中球機能。
Vet. Immunol. Immunopathol. 2006; 113 (16772096): 53-63
https://doi.org/10.1016/j.vetimm.2006.04.001
論文で見る
スコープス (90)
PubMed
クロス
グーグル奨学生
Kim M.
Qie Y.
Park J.
キム C.H.
腸内細菌代謝産物は宿主の抗体反応を促進する。
Cell Host Microbe. 2016; 20 (27476413): 202-214
https://doi.org/10.1016/j.chom.2016.07.001
論文で見る
PubMed
概要
全文
全文PDF
グーグル奨学生
クルーガー L.A.
ベイツD.C.
ハンフリー S.B.
スタベル J.R.
初乳が十分なホルスタイン子牛において、γδT細胞はMycobacterium avium ssp.
J. Dairy Sci. 2016; 99 (27614838): 9040-9050
https://doi.org/10.3168/jds.2016-11144
論文で見る
スコープス (11)
PubMed
概要
全文
全文PDF
グーグル奨学生
ラフォレスト・ラポイントI.
アリエッタ M.C.
ヒトの免疫発達における初期腸内細菌コロニー形成のパターン: 生態学的視点。
Front. Immunol. 2017; 8 (28740492): 1-13
https://doi.org/10.3389/fimmu.2017.00788
論文で見る
スコープス (99)
PubMed
クロス
グーグル奨学生
ルフェーブルP.
Cariou B.
Lien F.
カイパースF.
スタールスB.
代謝調節における胆汁酸と胆汁酸受容体の役割。
Physiol. Rev. 2009; 89 (19126757): 147-191
https://doi.org/10.1152/physrev.00010.2008
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
レヴィM.
コロジエチクA.A.
タイスC.A.
エリナブE.
ディスバイオシスと免疫系。
Nat. Rev. Immunol. 2017; 17 (28260787): 219-232
https://doi.org/10.1038/nri.2017.7
論文で見る
スコープス (907)
PubMed
クロス
グーグル奨学生
リウ・L.
Li L.
Min J.
Wang J.
Wu H.
Zeng Y.
Chen S.
Chu Z.
酪酸はヒト単球由来樹状細胞の分化と機能を阻害する。
細胞。Immunol. 2012; 277 (22698927): 66-73
https://doi.org/10.1016/j.cellimm.2012.05.011
論文で見る
スコープス (87)
PubMed
クロス
グーグル奨学生
マルムスゲN.
チェン Y.
Liang G.
グーンワルデン L.A.
グアン L.L.
熱処理した初乳の給与は、新生仔牛の小腸における善玉菌のコロニー形成を促進する。
J. Dairy Sci. 2015; 98 (26342981): 8044-8053
https://doi.org/10.3168/jds.2015-9607
論文で見る
スコープス (69)
PubMed
概要
全文
全文PDF
グーグル奨学生
マンティス N.J.
チャン M.C.
チンタラチャルブ K.R.
レイ J.
コルセシー B.
ノイトラ M.R.
マウスパイエル板M細胞へのIgAの選択的接着: 新規IgAレセプターの証拠。
J. Immunol. 2002; 169 (1844 lp - 1851.)
doi: https://doi.org/10.4049/jimmunol.169.4.1844
論文で見る
スコープス (188)
PubMed
クロス
グーグル奨学生
マンゾーニ P.
マイヤーM.
ストルフィ I.
リナルディ M.
Cattani S.
プーニ L.
ロメオ M.G.
メスナー H.
デセンブリーノL.
ラフォルジア N.
ヴァニャレッリ F.
メモ L.
ボルディニョン L.
マウレ M.
ガロ E.
モスタート M.
クエルチア M.
ボラーニ L.
ペディチーノ R.
レンツッロ L.
ベッタ P.
フェラーリ F.
アレクサンダー T.
マガルディ R.
ファリーナ D.
モスカ F.
ストロナティ M.
超低出生体重新生児における壊死性腸炎予防のための牛ラクトフェリン補充:無作為化臨床試験。
初期のハム。Dev. 2014; 90 (24709463): S60-S65
https://doi.org/10.1016/S0378-3782(14)70020-9
https://doi.org/10.1016/S0378-3782(14)70020-9
論文で見る
スコープス (154)
パブコメ
クロス
グーグル奨学生
マーテンス E.C.
チェン H.C.
ゴードン J.I.
粘膜糖鎖採食は、糖分解性ヒト腸内細菌共生体のフィットネスと伝播を促進する。
Cell Host Microbe. 2008; 4 (18996345): 447-457
https://doi.org/10.1016/j.chom.2008.09.007
論文で見る
スコパス (607)
パブコメ
概要
全文
全文PDF
グーグル奨学生
メイナード C.L.
エルソンC.O.
ハットンR.D.
ウィーバーC.T.
腸内細菌叢と免疫系の相互作用。
doi: https://doi.org/10.1038/nature11551
日付:2012年
論文で見る
Google Scholar
マクガビガン A.K.
ガリベイ D.
ヘンセラー Z.M.
チェン J.
ベタイエブ A.
ハジ F.G.
レイ・R.E.
シュイナード M.L.
カミングスB.P.
TGR5はマウスの垂直スリーブ胃切除術後の糖調節改善に寄与する。
Gut. 2017; 66 (226 lp - 234.)
doi: https://doi.org/10.1136/gutjnl-2015-309871
論文で見る
スコープス (157)
PubMed
クロス
グーグル奨学生
マクギルJ.L.
ノネッケB.J.
リポリスJ.D.
ラインハルトT.A.
サッコ R.E.
ウイルス性toll様受容体作動薬およびin vivo呼吸器合胞体ウイルス感染に対する新生ウシγδT細胞サブセットによるケモカインおよびサイトカイン産生の差異。
Immunology. 2013; 139 (23368631): 227-244
https://doi.org/10.1111/imm.12075
論文で見る
スコープス (38)
パブコメ
クロス
グーグル奨学生
メダ P.
スプレーD.
ギャップ結合機能。
Adv. Mol. 細胞生物学 2000; 30: 263-322
https://doi.org/10.1016/S1569-2558(00)30008-X
論文で見る
クロス
グーグル奨学生
ミハウデル C.
ソコルH.
免疫代謝のサービスにおける腸内細菌叢。
Cell Metab. 2020; 32 (32946809): 514-523
https://doi.org/10.1016/j.cmet.2020.09.004
論文で見る
スコープス (126)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ミンスコフ S.A.
マター K.
メルマンI.
FcガンマRII-B1はB細胞受容体結合抗原の提示を制御する。
J. Immunol. 1998; 161 (9725196): 2079-2083
https://doi.org/10.4049/jimmunol.161.5.2079
論文で見る
パブコメ
クロス
グーグル奨学生
パブストO.
セロヴィッチV.
ホルネフM.
微生物叢の確立と維持の調整における分泌性IgA。
Trends Immunol. 2016; 37 (27066758): 287-296
https://doi.org/10.1016/j.it.2016.03.002
論文で見る
スコープス (133)
パブコメ
概要
全文
全文PDF
グーグル奨学生
パテル A.K.
シンガニア R.R.
パンデイ A.
チンチョルカー S.B.
プロバイオティクス胆汁酸ヒドロラーゼ: 現在の進展と展望。
Appl. Biochem. Biotechnol. 2010; 162 (19669939): 166-180
https://doi.org/10.1007/s12010-009-8738-1
論文で見る
スコープス (114)
PubMed
クロス
グーグル奨学生
ピーターソンJ.
シュライバーO.
ハンソンG.C.
ゲンドラー S.J.
ヴェルチッチ A.
ルンドベリ J.O.
ルース S.
ホルム L.
フィリップソンM.
大腸炎モデルマウスにおける大腸粘液バリアの重要性とその制御。
Am. J. Physiol. Gastrointest. 2011; 300 (21109593): G327-G333
https://doi.org/10.1152/ajpgi.00422.2010
論文で見る
スコープス (276)
PubMed
クロス
グーグル奨学生
サイイン S.I.
ワールストレムA.
フェリンJ.
ヤンッティ S.
マルシャル H.-U.
バンベルク K.
アンジェリン B.
ヒョティライネン T.
オレシッチ M.
Bäckhed F.
腸内細菌叢は、天然に存在するFXRアンタゴニストであるタウロ-β-ムリコール酸のレベルを低下させることによって胆汁酸代謝を制御する。
Cell Metab. 2013; 17 (23395169): 225-235
https://doi.org/10.1016/j.cmet.2013.01.003
論文で見る
日本
パブコメ
概要
全文
全文PDF
グーグル奨学生
スコット K.
ケルトン D.F.
ダフィールド T.F.
ルノー D.L.
穀物肥育仔牛施設における罹病率と死亡率に関連する到着時に特定される危険因子: 前向き単一コホート研究。
J. Dairy Sci. 2019; 102 (31378492): 9224-9235
https://doi.org/10.3168/jds.2019-16829
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル・スカラー
センダーR.
フックス S.
ミロ R.
我々は本当に圧倒的に劣勢なのか?ヒトにおける細菌と宿主細胞の比率の再検討。
Cell. 2016; 164 (26824647): 337-340
https://doi.org/10.1016/j.cell.2016.01.013
論文で見る
パブコメ
概要
全文
全文PDF
グーグル奨学生
スワンJ.R.
ワント E.J.
ガイアー F.M.
スパゴウ K.
ウィルソン I.D.
シダウェイ J.E.
ニコルソン J.K.
ホームズE.
宿主組織コンパートメントにおける胆汁酸代謝の全身的な腸内微生物調節。
Proc. Natl. Acad. Sci. USA. 2011; 108 (20837534): 4523-4530
https://doi.org/10.1073/pnas.1006734107
論文で見る
スコープス (548)
パブコメ
クロス
グーグル奨学生
タンブリーニ S.
シェン N.
ウー・H.C.
クレメンテJ.C.
早生期のマイクロバイオーム:健康転帰への影響。
Nat. Med. 2016; 22 (27387886): 713-722
https://doi.org/10.1038/nm.4142
論文で見る
パブコメ
クロスフィルム
グーグル奨学生
トレンブレー S.
ロマンG.
ルー M.
チェン X.-L.
ブラウン K.
ギブソン D.L.
ラマナサン S.
メネンデス A.
胆汁酸投与は腸内抗菌プログラムを誘発し、2種類の腸内感染モデルマウスにおける細菌負荷を軽減する。
Infect. Immun. 2017; 85 (28348052): e00942-e00946
https://doi.org/10.1128/IAI.00942-16
論文で見る
スコープス (41)
PubMed
クロス
グーグル奨学生
ウリー N.J.
ロンバードJ.E.
シブリーC.B.
コプラルC.A.
アダムス A.E.
アーリーワイン T.J.
オルソン J.D.
Garry F.B.
米国の酪農経営における離乳前の未経産牛管理: 離乳前の未経産子牛の罹病率と死亡率に関連する要因。
J. Dairy Sci. 2018; 101 (29935825): 9229-9244
https://doi.org/10.3168/jds.2017-14019
論文で見る
スコープス (143)
PubMed
要旨
全文
全文PDF
グーグル奨学生
宇山貴志
ルノーD.L.
モリソン E.I.
マクルーア J.T.
ルブラン S.J.
ウィンダー C.B.
デ・ヨング E.
マッカビン K.D.
バークマ H.W.
デュフール S.
サンチェス J.
ハイダー L.C.
Kelton D.F.
カナダの乳用子牛における子牛管理方法と抗菌剤使用の関連性。
J. Dairy Sci. 2022; 105 (36175237): 9084-9097
https://doi.org/10.3168/jds.2022-22299
論文で見る
スコパス (2)
PubMed
概要
全文
全文PDF
グーグル・スカラー
ヴァンカメルベーク M.
フェルメールS.
腸管バリア:健康と疾患における基本的役割。
エキスパートレブ。Hepatol. 2017; 11 (28650209): 821-834
https://doi.org/10.1080/17474124.2017.1343143
論文で見る
スコープス (611)
PubMed
クロス
グーグル奨学生
ヴィロット C.
マー T.
ルノー D.L.
ガファリ M.H.
ギブソン D.J.
スキッドモア A.
シェヴォー E.
グアン L.L.
スティール M.A.
Saccharomyces cerevisiae boulardii CNCM I-1079は、牛乳給与子牛の健康、成長、および糞便微生物叢に影響を与える。
J. Dairy Sci. 2019; 102 (31155261): 7011-7025
https://doi.org/10.3168/jds.2018-16149
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
渡辺真一
ホーテン S.M.
マタキ C.
Christoffolete M.A.
キム B.W.
佐藤秀樹
メサデク N.
ハーニー J.W.
江崎 O.
児玉 崇
Schoonjans K.
ビアンコ A.C.
オーウェルクスJ.
胆汁酸は細胞内甲状腺ホルモン活性化を促進することによりエネルギー消費を誘導する。
Nature. 2006; 439 (16400329): 484-489
https://doi.org/10.1038/nature04330
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ウィンデイヤーM.C.
Gamsjäger L.
母体抗体と直面する子牛のワクチン接種: 課題と機会。
Vet. Clin. North Am. Food Anim. Pract. 2019; 35 (31590902): 557-573
https://doi.org/10.1016/j.cvfa.2019.07.004
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ウッド C.E.
反芻動物の分娩制御。
J. Reprod. Fertil. Suppl. 1999; 54 (10692849): 115-126
記事で見る
パブコメ
グーグル奨学生
Wopereis H.
ウーザーR.
クニッピングK.
ベルザー C.
クノールJ.
最初の千日 - 幼児の腸内細菌学:共生を確立する。
小児科。アレルギー免疫。2014; 25 (24899389): 428-438
https://doi.org/10.1111/pai.12232
論文で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
ヤン J.
パルミオッティA.
カイパースF.
腸管機能の制御における胆汁酸の新たな役割。
Curr. Opin. Clin. Nutr. Metab. Care. 2021; 24 (33075001): 127-133
https://doi.org/10.1097/MCO.0000000000000709
記事で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
論文情報
出版履歴
受理 2023年10月18日
受理 受理:2023年9月14日
出版段階
インプレス
識別
DOI: https://doi.org/10.3168/jds.2023-24195
著作権
© 2023 著者
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図のサムネイルgr1
図1生後数週間の免疫機能の出生前後の母親因子による発達プログラミング。出生前後の母体因子は、新しい環境にうまく対処するための制御ネットワークの確立に有利なように、免疫発達の軌跡に影響を与えているようだ。分娩数日前の胎児コルチゾールの大幅な増加は、CD4 Tヘルパー細胞の細胞媒介性エフェクター機能を集団的に変化させ、それが生後早期まで持続してTh2バイアス反応を促進し、効果的に抗炎症性T細胞の表現型を確立する。コロストラムは、B細胞の活性化を抑制しながら、子牛に抗体と細胞媒介性防御を提供し、γδT細胞の増殖を促進し、適応免疫系と自然免疫系の他の分枝が完全に機能するまでの間、早期防御を提供する可能性がある。BioRender.comで作成。
図のサムネイルgr2
図2:腸管免疫系、および免疫機能と発達に対する腸内細菌叢の影響。腸内細菌叢は、上皮細胞の増殖、粘液産生、およびsIgAを刺激することにより腸の健康を促進し、それにより腸内環境と腸上皮の直接接触を避けて免疫排除を促進する。さらに、腸の生態学的条件に高度に適応した特定の微生物群(Niche occupation)は、日和見病原体の侵入を防ぐことができる(Competitive exclusion)。BioRender.comで作成。
図サムネイルgr3
図3抗菌剤使用などの環境要因による変化は、子牛の腸の健康と代謝機能に悪影響を及ぼす可能性がある。微生物の多様性が減少し、特にビフィズス菌と乳酸桿菌の量が減少すると、短鎖脂肪酸(SCFA)が減少し、微生物叢が腸のバリア機能に及ぼす刺激シグナルが減少する。その結果、上皮細胞の増殖が低下し、粘膜層が薄くなり、分泌型免疫グロブリンA(IgA)の産生が低下する。これらの因子は総体的に、上皮細胞と腸内環境との直接的な接触を高め、腸の炎症を促進する免疫反応を引き起こす。さらに、抗菌薬によって誘導されたディスバイオシスとビフィズス菌や乳酸菌の減少は、胆汁酸(BA)とBAの微生物変換産物(2BA)のプロファイルを変化させ、BAシグナル伝達の調節不全を引き起こし、末梢脂肪組織における代謝機能と炎症に関連する遺伝子の転写産物量を変化させる。
図サムネイルgr4
図4胆汁酸の腸肝循環と全身代謝への影響。脂質乳化剤としての古典的な役割のほかに、胆汁酸(BAs)は多面的なシグナル伝達分子として働き、食後状態の末梢組織に栄養素の流入を知らせることで、栄養素感知分子としての役割を果たしている。BAsは専用の核内受容体と細胞表面受容体を介して脂質代謝と炎症の制御に関与しており、腸、肝臓、末梢脂肪組織で構成的に発現している。FXR = ファルネソイドx受容体。BA = 一次胆汁酸。2BA = 二次胆汁酸。TGR5:武田Gタンパク質共役型受容体5。FGF-19=線維芽細胞増殖因子19。SREBP1=Sterol regulatory element-binding protein 1。 CYP7A1=Cytochrome P450 Family 7 Subfamily A Member 1。LDL-R:低比重リポタンパク質受容体。Ostα/Ostβ=ヘテロ二量体有機溶質トランスポーターαおよびβ。 PPAR-γ=ペルオキシソーム増殖剤活性化受容体γ。BioRender.comで作成。
関連記事
ホーム
論文・号外
プレス記事
最新号
号外一覧
付録
著者へ
著者への指示
執筆許可
研究者アカデミー
原稿提出
査読者の方へ
原稿の査読
ジャーナルの科学セクション
ジャーナル情報
ジャーナルについて
オープンアクセスについて
アブストラクト・索引付け
連絡先
コンテンツアラート
編集委員会
ジャーナル編集者
ディスプレイ広告
リクルート広告
メディア
ADSA
ADSAホーム
会員特典
ADSAミーティング
S-PAC
コレクション
エディターズチョイス
会議要旨
JDSクラブ100
フォローする
フェイスブック
ツイッター
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
著作権 © 2023 Elsevier Inc. 第三者によって提供された一部のコンテンツを除く。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&コンタクト
RELX
この記事が気に入ったらサポートをしてみませんか?
