IL2の脳への合成送達により老化の分子的および認知的シグネチャーが部分的に回復する
記事2023年3月28日
IL2の脳への合成送達により老化の分子的および認知的シグネチャーが部分的に回復する
https://www.embopress.org/doi/full/10.15252/emmm.202216805
https://www.embopress.org/doi/full/10.15252/emmm.202216805

ピエール・ルメートル [...] エイドリアン・リストン
著者情報
EMBO Mol Med (2023)e16805https://doi.org/10.15252/emmm.202216805
すべての測定基準を見る
フィギュア&インフォメーション
アブストラクト
認知機能の低下は、加齢に伴う一般的な病理学的転帰であり、その分子的・細胞的基盤は未解明である。近年、加齢に伴い増加する低グレードの炎症と定義される「炎症性老化」の概念が浮上してきた。加齢に伴い脳内に蓄積する浸潤性T細胞は、加齢に伴い観察される炎症カスケードの増幅や神経原性ニッチの破壊に寄与すると考えられています。近年、制御性T細胞の小さな集団が脳内に存在することが確認され、IL2を介したこの集団の拡大が神経炎症性疾患に対抗できることが証明された。ここでは、脳特異的なIL2送達システムを用いて、老化マウスの神経衰弱を予防することを試みている。我々は、脳グリア区画における老化の分子的特徴を特定し、IL2処理によってこの特徴を部分的に回復させることを確認した。行動レベルでは、脳内IL2投与により、運動能力や覚醒度の一般的な低下を改善することなく、加齢に起因する空間学習の欠損を防ぐことができた。これらの結果から、免疫制御が健康な老化のための認知機能維持のための潜在的な道であることが明らかになりました。
概要
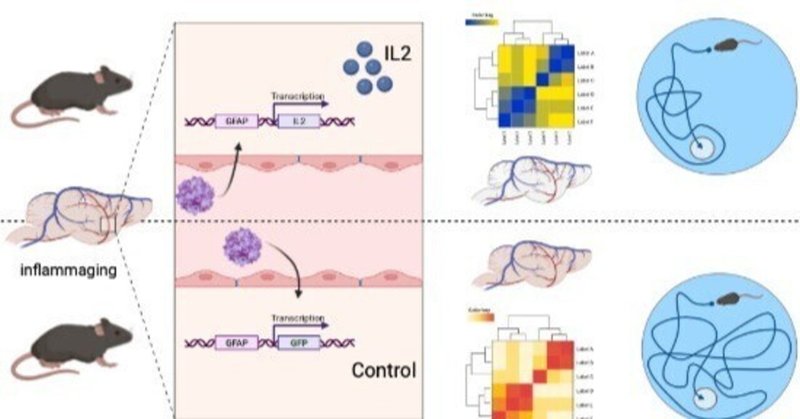
血液脳関門を通過するAAVベクターによるインターロイキン2の脳内デリバリーは、老化マウスの認知機能低下を防ぐ。
遺伝子導入システムは、アストロサイト特異的プロモーターと結合したAAVベースのウイルスベクターを用いて、老化マウスの脳内で抗炎症性サイトカインであるインターロイキン2の発現を促進するものである。
分子レベルでは、老化マウスの脳特異的IL2発現は、老化したグリア細胞の転写シグネチャーを若いグリア細胞のベースライン状態に部分的に戻した。
認知レベルでは、老化マウスの脳特異的IL2発現により、運動能力や覚醒度の全般的な低下を改善することなく、空間学習の低下を部分的に回復させた。
論文では以下のように説明されている。
問題点
高齢者では認知機能の低下が顕著であり、60歳以上では40%以上の人が軽度認知障害に移行しています。加齢に伴う認知機能低下の生物学的原因は複雑であり、十分に解明されていない。しかし、慢性的な低グレードの炎症が主要な原因であるとの認識が広まっています。遺伝子導入システムを用いてインターロイキン2を脳に投与することで、内因性の脳内制御性T細胞集団が増加し、この炎症プロセスに対抗することができる。この治療法は、外傷性脳損傷、脳卒中、多発性硬化症のマウスモデルで有効性が証明されているが、加齢による通常の認知機能低下にも効果があるかどうかは不明であった。
研究成果
我々は、脳特異的な遺伝子発現を与えるAAVベースのウイルスベクターを用いて、老化したマウスにインターロイキン2を投与した。脳の老化は、脳のグリア区画(ミクログリア、アストロサイト、オリゴデンドロサイト)の分子プロファイリングと、認知能力のテストによって評価された。老化したマウスにインターロイキン2を投与したところ、グリア細胞の老化現象が部分的に回復し、主要な経路が若いマウスで観察された状態に回復した。また、認知機能面では、野生型マウスに特徴的な加齢による空間学習の低下を抑制し、チャレンジテストでは加齢マウスが若齢マウスとほぼ同等の成績を示した。
インパクト
軽度認知機能低下は、世界的に深刻な問題となっています。60歳以上の軽度認知障害者の約40%は、認知機能の低下に苛立ちや不安を感じており、その3分の1は5年以内に認知症に移行し、自立した生活能力を失ってしまう。遺伝子導入システムは、抗炎症性タンパク質を長期的に持続的に脳に局所投与できる可能性がある。この結果は、IL2の遺伝子導入と制御性T細胞の増殖を利用して、高齢者の軽度認知機能低下を抑制するための原理を証明するものである。
はじめに
加齢は、肉体の劣化に伴う不可逆的なプロセスであり、それゆえ、脳のような主に後代細胞を含む器官で特に顕著に現れる。ヒトに見られる記憶、方向、注意、意欲、認知の進行性の低下は、主に老化に関連したプロセスに起因すると考えられている(Hof & Morrison, 2004)。認知老化の研究は、一般に、脳の計算単位であると広く信じられているニューロンに焦点を当てているが、ニューロンと非神経細胞(グリアと総称される)の相互作用が、神経系機能のあらゆる側面において重要な役割を果たすことが、次第に認識されるようになってきている。例えば、アストロサイトによるシナプスの形成と機能の制御、オリゴデンドロサイトによる髄鞘形成と神経細胞への栄養補給などである。かつては、傷害や疾患から中枢神経系を保護する免疫細胞としてのみ考えられていたが、ミクログリアが脳から侵入する病原体を除去するために用いるのと同じシステムが、弱い、あるいは不適切な神経細胞シナプスを除去し、脳内の神経細胞結合の正確なパターンを確立するためにも利用されているという証拠が増えている(Allen & Lyons, 2018)。したがって、老化に関連する認知機能低下が、慢性炎症、オートファジーの障害、高分子損傷、ミトコンドリアの機能障害と老化(Hou et al, 2019)を含むいくつかの分子プロセスと関連しており、これらはすべてのCNS細胞タイプの機能に影響を与えることは驚くべきことではない(Jurk et al, 2012; Bussian et al, 2018; Chinta et al, 2018; Ogrodnik et al, 2019).
加齢に伴う共有の細胞表現型に加えて、加齢に伴い個々のグリア細胞型の間でユニークな表現型が出現する。老化した動物のミクログリアは、炎症刺激に対して過敏に反応し、サイトカイン発現の基底レベルが高く、活性化に対する反応が誇張される(Deczkowska et al, 2017)。老化したミクログリアは、膜状突起の短縮、突起の伸縮の鈍化、ソーマ体積の拡大を示す(Hefendehl et al, 2014)。ミクログリアの機能低下は、酸化的なDNA損傷や非分解性のタンパク質や脂質の凝集体の蓄積により、寿命とともに進行すると考えられている。この炎症と機能不全に陥ったミクログリアプロファイルは、加齢に伴う神経変性疾患の発症に関与している(Spitau, 2017)。ミクログリアのこのような老化表現型は、ミエリンの分解(Safaiyan et al, 2016)によって部分的に引き起こされ、この現象はオリゴデンドロサイトの老化と並行する。オリゴデンドロサイトは、特定の神経前駆細胞であるオリゴデンドロサイト前駆細胞(OPC)に由来し、ミエリン産生を主な役割とする。OPCの不均一性は加齢とともに増加し(Spitzer et al, 2019)、一方でオリゴデンドロサイトのミエリン化機能は低下し(Schain et al, 2014)、それに伴いミエリンの完全性が崩壊する(Peters et al, 1996)。アストロサイトは、脳の異なる領域にわたるアストロサイトの反応に地域差があるものの(Rodriguez-Arellano et al, 2016)、反応性炎症性表現型の獲得と一致する、加齢による実質的な形態および転写の変化を受ける(Robillard et al, 2016; Clarke et al, 2018)。これらのグリアの変化が、老化と認知機能低下を結びつける細胞経路のドライバー、メディエーター、または傍観者である程度は議論されています。
老化の影響として最も認識されているのは、免疫系の調節障害である。加齢に伴い、免疫応答の開始と解消に欠陥がある免疫老化と、炎症が発生します(Montecino-Rodriguez et al, 2013; Deleidi et al, 2015)。加齢は、適応型免疫系と自然免疫系の両方に影響を与えます(Shaw et al, 2013; Carrasco et al, 2021)。脳では、免疫老化は、インターロイキン6(IL-6)や腫瘍壊死因子α(TNFα)などの炎症性サイトカイン、急性期タンパク質、活性酸素種(ROS)、自己抗体の産生増加を特徴とする低レベルの慢性炎症性環境を伴っています。脳からの炎症性産物のリンパ排泄は加齢とともに不十分となり、認知機能の低下に寄与します(Da Mesquita et al, 2018)。CNS白血球は、加齢に伴う炎症と神経変性にも関与している可能性があります(Baruch et al, 2013; Prokop et al, 2015; Ritzel et al, 2016)。特に、老化した脳では、IFNγの産生(Dulken et al, 2019)とCCR7の喪失(Da Mesquita et al, 2021)を伴って、クローン状に拡大したT細胞の蓄積が観察される。脳におけるT細胞の炎症作用は、今度は神経幹細胞ニッチを阻害し、グリア区画の生物学を変化させ、神経老化の影響を増幅させます(Dulken et al, 2019)。
観察される加齢に伴う認知機能低下以外にも、加齢は病的な神経変性の主要なリスク要因でもあります。アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、原発性進行性多発性硬化症(PPMS)などの神経変性疾患のリスクは、高齢者集団で著しく増加します(Hou et al, 2019)。この神経変性疾患の増加率は、反応性中枢神経系ミクログリアおよびアストログリア、ならびに浸潤する末梢単球およびリンパ球によって特徴づけられる神経炎症と関連しています。死後AD患者の脳(Merlini et al, 2018)およびADのトランスジェニックモデル(Ferretti et al, 2016)における血管および実質のT細胞の存在は、神経炎症の発症におけるT細胞の関与の可能性を示唆しています。PDでは、患者の黒質にT細胞が観察され、T細胞応答の薬理学的操作によりマウスモデルにおける疾患転帰が変化する(Baird et al, 2019)。同様に、ALS患者の運動ニューロン喪失部位ではT細胞の浸潤が観察され、T細胞欠損マウスモデルでは疾患進行が修正される(Zhao et al, 2013)。ADおよびPDの感受性とHLA対立遺伝子の関連は、このプロセスにおけるT細胞の原因的役割を支持しています(Hamza et al, 2010; International Parkinson Disease Genomics Consortium et al, 2011; Lambert et al, 2013)。これらのことから、脳内に浸潤したT細胞は、一般的な加齢に伴う認知機能低下と多様な神経変性疾患の両方に寄与していることが示唆されます。
制御性T細胞(Treg)は、強力な抗炎症および修復促進機能を持つT細胞のサブセットである。Tregはリンパ系臓器と非リンパ系臓器の両方に存在し、組織の恒常性を制御し、組織の修復に貢献する多様な機能を発揮する(Liston & Gray, 2014)。Tregは、マウスやヒトの脳では数が少なく、脳実質と髄膜リンパの両方で観察される(Liston et al, 2022)。トレグは、様々な神経炎症性疾患および/または神経変性疾患において保護機能を持つことが提案されている。Tregを利用するために提案された治療戦略は、典型的には、細胞ベースのアプローチによるTregの直接的な送達、またはTregを増強するための生物製剤の提供、しばしば主要な生存因子であるIL2(Pierson et al, 2013)のいずれかに基づいている。しかし、その結果は、モデルや治療方法の違いによって一貫していない。例えば、ADでは、Tregを用いた直接的な細胞療法(Baek et al, 2016; Faridar et al, 2022; Yang et al, 2022)は有益な効果を与えているが、他の研究では逆が示されている(Baruch et al, 2015; Yang et al, 2020)、IL2による治療は、ADモデルによって、保護(Baek et al, 2016; Alves et al, 2017)から軽度(Dansokho et al, 2016)または効果なし(Yshii et al, 2022a)まで矛盾した結果が出ている。PDモデルでは、直接細胞移植(Reynolds et al, 2007; Huang et al, 2020; Markovic et al, 2022)、Treg形成を誘導するためのハチ毒ホスホリパーゼA2、それを拡大するスーパーアゴニスト抗CD28抗体(Bador et al, 2022)または活動を強化する血管活性腸ペプチド受容体2(VIPR2)ペプチド作動薬(Mosley et al, 2019)などの多くの異なるTregベースの治療が有益である。脳卒中モデルでは、Treg細胞の直接療法(Ito et al, 2019)(ただし、これはRag欠損マウスでのみ有効)、またはIL33(Liu et al, 2020)またはIL2の使用によるTreg集団の拡大(Zhang et al, 2018; Dong et al, 2021; Shi et al, 2021; Yshii et al, 2022b)で有益な効果が示されたことがあった。最後に、ALSモデルにおいて、Treg細胞療法(Beers et al, 2011)とIL2治療(Sheean et al, 2018)の両方が有益な結果を示しています。神経変性疾患における病態の予防におけるTregの重要な役割を支持する一方で、これらの研究の多くは、脳に常駐するTregを介した直接的な神経保護と、全身性のTregによる末梢炎症反応の制御による間接的な保護を区別していないシステムを使用しています。
神経炎症および神経変性過程におけるIL2およびTregの保護的役割が認識されつつあるにもかかわらず、加齢に伴って生じる病的過程は疾患とは異なるため、これらの細胞が加齢脳を保護する可能性は依然として不明である。ここでは、最近、神経炎症性傷害や疾患から保護することが実証された(Yshii et al, 2022b)脳特異的IL2の合成送達を用いて、脳の免疫学的区画の調節によって神経老化を抑制することができるという仮説を検証した。若齢および高齢のマウスを用いて、脳グリアコンパートメントにおける老化の分子シグネチャーを特徴付け、IL2がグリアの種類を問わず分子老化プロセスの中核をなす要素を抑制することができることを発見しました。これらの分子効果は、認知能力の部分的な維持と関連しており、脳特異的なIL2産生が加齢による認知機能低下と闘う上で有益であることが示唆された。
研究成果
加齢により脳内常在グリアの細胞構成に変化が生じる
TregまたはIL2ベースの治療法の主要な限界は、ほとんどの提案された戦略の末梢への影響であり、望ましくない末梢免疫抑制の可能性があることである。脳をターゲットにしたデリバリーの使用は、末梢の免疫系の完全性を維持しながら、様々な神経病理に関連する炎症を抑制するために使用できる可能性を開くものである。IL2の脳特異的発現を実現する一つの方法は、遺伝子導入ベクターPHP.GFAP-IL2によるものです。このアプローチにより、脳におけるIL2の産生が制限され、それに伴って脳常在トレッグが拡大する(Yshii et al, 2022b)。PHP.GFAP-IL2処理は、外傷性脳損傷、脳卒中、実験的自己免疫脳炎の文脈における神経炎症に対して保護的である(Yshii et al,2022b)。脳特異的IL2送達が老化に及ぼす影響を調べるため、2ヶ月齢の若齢マウスと22ヶ月齢の老齢マウスを、PHP.GFAP-IL2または対照PHP.GFAP-GFPベクターで処理した。以前に若いマウスで実証されたように(Yshii et al, 2022b)、この処置は老齢マウスの脳内のTregの頻度を拡大した(Fig EV1)。この治療の効果は、2ヶ月後の4ヶ月齢と24ヶ月齢の時点で、ミクログリア、アストロサイト、オリゴデンドロサイトのフローサイトメトリーソーティングとシングルセルRNAシーケンスを通じて、全脳のグリア区画で評価した(Fig 1A)。主要な系統マーカーの発現解析と参照データセット(La Manno et al, 2021)との統合により、標的グリア集団(Appendix Fig S1)とマイナー集団の混入物(Appendix Fig S2)を特定した。主要集団とマイナー集団の頻度のPCA分析では、年齢との関連は認められたが、治療との関連は認められず、年齢に依存する表現型であることが示された(図1B)。ミクログリアの抽出と再クラスタリングでは、細胞が強固にクラスター化され(図1C)、オリゴデンドロサイトの再クラスタリングでは、オリゴデンドロサイト前駆体(OPC)とオリゴデンドロサイトが明確に分離した(図1D)。一方、アストロサイトの抽出と再クラスタリングにより、キーマーカーとデータセット統合に基づき、バーグマングリア、小脳アストロサイト、嗅覚アストロサイト、線条体アストロサイト、終脳アストロサイト、非終脳アストロサイトの転写分離が明確になった(図1E)(付録図 S3)。
図1. シングルセルシーケンスにより、加齢に伴うグリア比率の変化が確認された
野生型マウスを2ヶ月齢または22ヶ月齢でPHP.GFAP-IL2(またはPHP.GFAP-GFP対照ベクター)で処理した(n = 3/グループ)。治療2ヶ月後、灌流したマウスからグリアコンパートメントを選別し、10×シングルセル・トランスクリプトミクスを用いて特徴付けた。
データセットに含まれる細胞のUMAP投影。色付きの名前は、下流解析のために選別されたグリア集団(付録図S1と同様)を示し、黒く注釈されたマイナー集団は、選別後のデータで見つかった汚染された細胞タイプ(付録図S2と同様)です。
各クラスタにおける各サンプルの細胞の割合についてPCAを実行し、データの各クラスタにおけるサンプルの割合に関して、年齢や治療が何らかのグローバルな傾向を示しているかどうかを概観した。
ミクログリアのクラスターを再クラスタ化し、UMAP空間に投影して、データのさらなる分離を行った。
オリゴデンドロサイトおよびオリゴデンドロサイト前駆体(OPC)クラスターを再クラスタ化し、UMAP空間に投影して、データをさらに分離した。
アストロサイトのクラスターを再クラスタ化し、UMAP空間に再投影した。異なるアストロサイトクラスターは、既知のアストロサイトのサブタイプにマッピングされた。
図をダウンロード
ダウンロードパワーポイント
図EV1. PHP.GFAP-IL2が高齢マウスの脳内常在制御性T細胞を拡大させる
まず、ミクログリアコンパートメントにおける細胞の変化を調査した。再クラスター化されたミクログリアは、年齢と治療に基づく分離について評価された(図2AおよびB)。UMAPプロットでは、年齢による視覚的な分離が観察され、クラスターの定量化により、若いマウスではMicro1およびMicro2クラスターの表現が増加し、高齢マウスではMicro3からMicro6クラスターが増加した(図2C)。疾患関連ミクログリア(DAM)の事前の特徴付けに基づき、特徴的なマーカーを発現するミクログリアを特定し(付録図S4)、公開データベース(Keren-Shaul et al, 2017)に対して校正した閾値を超える凝集マーカー発現に基づいて細胞をDAMとして分類した(図2D)。DAMは、若いマウスではほぼ存在せず、高齢のマウスで有意に増加し(図2E)、ミクログリアの〜2%のオーダーであった。同定された各サブセットについて、IL2処理による有意な変化は観察されなかった(図2CおよびE)。これらのデータは、脳特異的IL2補給が、加齢に伴って通常観察される細胞状態を通じてミクログリアの進行を変化させないことを示唆している。
図2. IL2投与マウスでは、疾患関連ミクログリアの加齢依存的な蓄積が損なわれていない
野生型マウスを2ヶ月齢または22ヶ月齢でPHP.GFAP-IL2(またはPHP.GFAP-GFP対照ベクター)で処理した(n = 3/グループ)。治療2ヶ月後、灌流したマウスからグリア区画を選別し、10×シングルセル・トランスクリプトミクスを用いて評価した。ミクログリアは同定、抽出、再クラスタ化され、UMAP空間に再投影されました。
治療グループによるミクログリアの分布。
年齢によるミクログリアの分布。サブパネルで治療(PHP.GFAP-IL2またはPHP.GFAP-GFPコントロールベクター)ごとに細胞を分離している。
6つのミクログリアクラスターそれぞれに含まれる各サンプルからの細胞の割合。各パネルは、各年齢グループ内の治療間のサンプルの平均値、および治療に関係なく2つの年齢グループの平均値を比較するt検定の多重検定補正P値を示す。
疾患関連ミクログリア(DAM)スコアのヒストグラムで、DAMとして分類するための0.07の閾値を示している。
各サンプルにおけるDAMの割合。各年齢グループ内の治療間のサンプルの平均値、および治療に関係なく2つの年齢グループの平均値を比較したt検定の多重検定補正P値付き。
データ情報: 治療および年齢グループごとに3生物学的複製(A-E)。平均値±SD、個々の値を示す(CおよびE)。
この図については、ソースデータがオンラインで入手可能です。
図2のソースデータ [emmm202216805-sup-0006-SDataFig2.zip] 。
ダウンロードフィギュア
ダウンロードパワーポイント
オリゴデンドロサイトの再クラスタリングにより、OPCが明確に分離し、残りのオリゴデンドロサイト集団は加齢に基づく視覚的分離を示した(図3AおよびB)。OPCの数は加齢の影響を受けませんでしたが、クラスターであるOligo1とOligo2は加齢とともに減少しました(図3C)。擬似時間解析により、各サンプルにまたがる分岐軌跡の木を作成することができた(図EV2)。IL2を投与した若いマウスと比較して、老化したマウスは、擬似時間軌跡の異なる段階にある細胞の割合が変化し、細胞の相対的な分布に大きな偏差があることを示した(図3D)。これと一致して、オリゴデンドロサイトの進行の擬似時間再構成では、オリゴ1とオリゴ2クラスターが最も未熟な状態であり、オリゴ3が移行期、その後、オリゴ4とオリゴ5が成熟しながら進行することが明らかになった(図3EとEV2)。この再構成は、オリゴデンドロサイトにおいて正規の成熟マーカーとして機能するS100β(図3F)および他のオリゴデンドロサイトマーカーの発現と一致した(付録図S5)。これらの結果から、老化したマウスでは、未熟なオリゴデンドロサイトから成熟したオリゴデンドロサイトへと構造的に進行していることが示唆された。ミクログリアと同様に、PHP.GFAP-IL2による脳特異的なIL2投与は、この正常な成熟の進行を変えることはなかった(図3CおよびD)。
図3. IL2投与によるオリゴデンドロサイトの正常な加齢依存的な細胞内進行
野生型マウスを2ヶ月齢または22ヶ月齢でPHP.GFAP-IL2(またはPHP.GFAP-GFP対照ベクター)で処理した(n = 3/グループ)。治療2ヶ月後、灌流したマウスからグリア区画を選別し、10×シングルセル・トランスクリプトミクスを用いて評価した。オリゴデンドロサイトとオリゴデンドロサイト前駆細胞(OPC)クラスターを同定、抽出、再クラスタ化し、UMAP空間に再投影しました。
治療によるオリゴデンドロサイトとOPCの分布。
オリゴデンドロサイトとOPCの年齢別分布。サブパネルで治療別に細胞を分けている。
様々なオリゴデンドロサイトとOPCのクラスターに属する細胞の割合。各パネルは、各年齢グループ内の治療間のサンプルの平均値、および治療に関係なく2つの年齢グループの平均値を比較するt検定の多重検定補正P値を示す。
オリゴデンドロサイトと前駆体について作成した軌跡樹における年齢群の割合をまとめた偏差値の総和プロット(図EV2)。このプロットは、若いPHP.GFAP-GFP処理マウスに対するそれぞれの軌跡木の各枝における年齢別の細胞の割合の差を視覚化し、どの年齢と処理グループが基準に対して細胞の軌跡に最も偏差を示すかを示している。各処置群および年齢群につき3つの生物学的複製物。データポイントは、3つの若いコントロールレプリケートに対する各レプリケートの順列である。
Monocle v2のDDRTreeアルゴリズムを用いて計算した擬似時間投影をUMAP空間にマッピングしたもの。
S100βの発現をUMAP投影に重ねたもの。
データ情報: データ情報:治療および年齢グループごとに3生物学的複製(A-C、E-F)。可視化のためにプールされた生物学的複製物(A、B、E、F)。平均値±SD、個々の値を示す(C、D)。
この図のソースデータはオンラインで入手可能です。
図3のソースデータ [emmm202216805-sup-0007-SDataFig3.zip] 。
ダウンロードフィギュア
ダウンロードパワーポイント
図EV2. IL2処理後のオリゴデンドロサイトの正常な擬似時間細胞軌跡の進行状況
最後に、アストロサイトの成熟に対する老化とIL2処理の影響を評価した(図4A)。ミクログリアやオリゴデンドロサイトとは異なり、アストロサイトは非常に異質であり、これまでのサブセットの解剖学的分離に対応していた(Batiuk et al, 2020; La Manno et al, 2021)。UMAP再クラスタリングの目視検査では、クラスタ内で年齢に応じた分離が見られた(図4B)。サブタイプレベルでは、年齢によるわずかな変化-バーグマングリアと線条体アストロサイトの減少、非髄脳アストロサイトの増加-しか観察されなかった(図4C)。各サブタイプにおける加齢の影響を調べるために、擬似時間成熟木を作成した(図EV3A-F)。成熟に対する年齢と治療の効果を評価するために、各樹木の枝における頻度差の総和の要約統計量を作成した。全体として、対照処理群(PHP.GFAP-GFP)の加齢は、バーグマングリア、小脳アストロサイト、線条体アストロサイトの凝集変化を促す傾向を示した(Fig 4D)。PHP.GFAP-IL2による処理では、若齢マウスにおける軌跡の進行は変化しなかったが、小脳アストロサイトで生じる老化軌跡の分布は部分的に阻止された(図4D)。この解析により、すべての主要なグリア細胞タイプにおいて、加齢に起因するトランスクリプトームの大幅な変化が見つかり、IL2送達による転写異常は見られませんでした。
図4. IL2投与によるアストロサイトの年齢依存性転写軌跡の部分的予防
野生型マウスを2ヶ月齢または22ヶ月齢でPHP.GFAP-IL2(またはPHP.GFAP-GFP対照ベクター)で処理した(n = 3/グループ)。治療2ヶ月後、灌流したマウスからグリア区画を選別し、10×シングルセル・トランスクリプトミクスを用いて評価した。アストロサイトは、マーカー発現に基づくサブセット注釈と既知のアストロサイトサブタイプへのマッピングにより、同定、抽出、再クラスタ化、UMAP空間への再投影が行われました。
治療による異なるアストロサイトサブタイプの分布。
年齢別の異なるアストロサイトサブタイプの分布、治療別に細胞を分けたサブパネル。
各グループから各アストロサイトサブタイプに分類される細胞の割合。各パネルは、各年齢グループ内の治療間のサンプルの平均値、および治療に関係なく2つの年齢グループの平均値を比較するt検定の多重検定補正P値を示す。
各アストロサイトサブタイプについて生成された、若い対照のものと比較した、擬似時間軌跡の各枝における細胞の割合の偏差を要約した偏差の合計プロット(図EV3)。このプロットは、若いPHP.GFAP-GFP処理マウスと比較して、それぞれの軌道樹の各枝における細胞の割合の年齢による差を可視化し、どの年齢および処理グループが基準に対して細胞の軌道に最も偏差を示すかを示している。各処置群および年齢群につき3つの生物学的複製物。データポイントは、3つの若いコントロールレプリケートに対する各レプリケートの順列である。
データ情報: データ情報:処置および年齢グループごとに3つの生物学的複製物(A-C、E、F)。可視化のためにプールされた生物学的複製物(A、B)。平均値±SD、個々の値を示す(C、D)。
この図のソースデータはオンラインで入手可能です。
図4のソースデータ [emmm202216805-sup-0008-SDataFig4.zip] 。
ダウンロードフィギュア
ダウンロードパワーポイント
図EV3. 加齢時およびIL2処理後のアストロサイトの擬似時間軌跡ツリー
脳特異的IL2送達は、加齢による常在グリアの分子変化を緩和する
脳におけるIL2局所発現が、主要なグリア細胞タイプの相対頻度や正常な軌道分布を歪めないことを確認した後、加齢に伴う分子経路への影響を調査することを試みた。まず、主要なグリア細胞タイプごとに差分発現解析を行った(Dataset EV1)。二次元の差分発現比較により、各グリア細胞タイプで加齢に伴い最も大きな転写変化が起こることが示された(図5)。IL2を投与した老化マウスで起こる変化は、規模は小さくなったが、老化だけで誘導される変化とは正反対であった。比較差分発現の相関から、IL2局所投与は、ミクログリア(図5A)、オリゴデンドロサイト(図5B)、アストロサイト(図5C)において、それぞれ加齢による転写変化の47、55、46%を相殺することがわかった。次に、分子経路の微小な変化の積み重ねを評価することができる遺伝子セットレベルでの影響を調べました。各グリア細胞タイプについて、遺伝子セットの濃縮を行い、加齢と治療の影響を比較した。ミクログリアの加齢によって変化した主要な経路の中には、プロテオスタシスとオートファジー、主要なシグナル伝達経路(Ras、PI3K、mTOR経路を含む)、神経変性関連遺伝子、細胞老化経路に関連するものがあった(Dataset EV2)。オリゴデンドロサイトとアストロサイトは、有意に変化した経路は少ないものの、加齢に伴い同様の転写変化を起こし、プロテオスタシス、オートファジー、神経変性に関連する経路で遺伝子発現の変化が確認されました(Dataset EV2)。老化したマウスを局所的なIL2産生で処理する効果を評価するために、遺伝子セット内の各転写変化を、対照マウスで加齢とともに生じる変化の規模や方向と比較する方向性マップを作成しました。これにより、各グリア細胞タイプにまたがる各経路で起こる転写変化を直接比較することができました。ほぼすべての主要な加齢によるパスウェイの変化は、IL2処理マウスでも反映され、ミクログリアの26/26パスウェイ(図6A)、オリゴデンドロサイトの10/11パスウェイ(図6B)、アストロサイトの15/16パスウェイ(図6C)が、加齢したIL2処理マウスでも加齢した対照マウスと同じ方向の転写変化を起こしていた。しかし、ほぼすべてのケース(ミクログリアの26/26パスウェイ、オリゴデンドロサイトの10/11パスウェイ、アストロサイトの16/16パスウェイ)で、IL2投与により、発現プロファイルは若いコントロールマウスに近い状態に戻った(図6A-C)。これらの結果から、老化したグリア細胞で起こる、タンパク質生産経路、オートファジー関連経路、神経変性関連遺伝子における重要な協調的転写変化が、局所的に生産されたIL2を2ヶ月間投与することによって部分的に回復することが示された。
図5. 老化マウスの局所IL2産生は、老化グリアで起こる分子変化を部分的に回復させる
A-C.正常加齢(若年PHP.GFAP-GFPマウス対高齢PHP.GFAP-GFPマウス)で生じる遺伝子発現変化とIL2処理した高齢マウス(高齢PHP.GFAP-IL2マウス対高齢PHP.GFAP-GFP)の変化を対比した二次元差分発現プロットです。A)ミクログリア、(B)オリゴデンドロサイトとOPC、(C)アストロサイト(合計)についての発現プロットを示す。
図をダウンロード
ダウンロードパワーポイント
図6. グリアにおける加齢に伴う経路は、局所的なIL2産生によって若い転写状態に戻される
年齢(高齢PHP.GFAP-GFPマウス対若年PHP.GFAP-GFPマウス)、若年マウスにおける治療(若年PHP.GFAP-GFPマウス対若年PHP.GFAP-IL2マウス)、高齢マウスにおける治療(高齢PHP.GFAP-IL2マウス対高齢PHP.GFAP-GFPマウス)および治療マウスにおける年齢について比較にわたる発現差に基づいてGene set enrichmentが行われました(高齢PHP.GFAP-IL2マウス対若年PHP.GFAP-IL2マウス)。遺伝子セットはGAGEライブラリから取得し、それぞれのKEGGパスウェイにキュレーションした。リストアップされたパスウェイは、グリア生物学との関連性と非冗長性について手動でキュレーションされた。非バイアスリストからのパスウェイは、4つのそれぞれの差分発現比較のうち少なくとも1つに存在する場合に表示した。各経路について、年齢による発現変化(老化したPHP.GFAP-GFPマウスと若いPHP.GFAP-GFPマウスの対比)に対するメンバー遺伝子の遺伝子発現方向の変化をまとめた方向性マップが作成された。
方向性は、ミクログリアについて行われた4つの比較のそれぞれについて、各経路について示されている、
オリゴデンドロサイトとOPC、および。
全アストロサイトと同定されたアストロサイトサブセット。
ダウンロード図
ダウンロードパワーポイント
IL2やTregがグリア細胞に与える影響についてin vitroモデルを開発するために、ミクログリア培養液を使用しました。胎児のミクログリアは培養でよく生き残るが、成体マウスのミクログリアはin vitroでの生存率が悪い。老化マウス由来のミクログリアは、成体マウスから精製したものよりもin vitroでの死亡率が高かった(図EV4)。IL2とTregを培養液に供給すると、ミクログリアの生存率が高まり、アポトーシス率が低下しました(図EV4)。in vitroからin vivoへの外挿には注意が必要である。このような状況では、制限因子が異なる可能性があるからだ。しかし、これらの結果は、in vivoでのIL2局所産生による分子防御を説明する可能性を示している。局所的なTregの拡大に関連する老化/老衰の転写シグネチャーの防止は、アポトーシス率および細胞のターンオーバーの長期的(マイナー)な減少と一致している。
図EV4. ミクログリア生存率に対するTreg共培養のin vitro効果
脳特異的IL2遺伝子導入により、認知機能低下の部分的な予防が可能
PHP.GFAP-IL2がグリアにおける老化の主要な協調的転写シグネチャーを部分的に防ぐことができることに基づいて、これらの分子変化が認知レベルの改善につながるかどうかを明らかにしようとしたのです。PHP.GFAP-IL2または対照のPHP.GFAP-GFPベクターを老齢マウスに投与し、2ヶ月後の24ヶ月齢で一連の行動テストを開始しました(4ヶ月齢のGFP投与動物は学習対照群として使用されました)。老齢マウスは、ホームケージでの活動性の低下(図7A)、ロータロッドでの移動能力の低下(図7B)、オープンフィールドテストでの探索能力の低下(図7C)など、行動低下の複数の兆候を示した。また、社会的新規性探索行動の低下(図7D)、明暗テストでの探索行動の低下(図7E)も見られた。身体能力の低下や覚醒度の低下を反映していると思われるこれらの各測定値について、脳特異的IL2投与は加齢による低下を変化させなかった。最後に、モリス水迷路における空間学習のテストを行った。老化したマウスは、2つの側面からモリス水迷路の成績が悪いことが示された。第一に、老化マウスは試験中に泳ぐ速度が大きく低下した(図7F)。これは、認知機能の低下ではなく、身体的な低下に由来する表現型であると考えられる。第二に、老化マウスは、訓練中に空間学習の習得が遅れ(図7G-I)、訓練10日後(図7I)には標的象限への選好性が低下した。これは、空間記憶形成の認知能力の低下を反映する表現型である。PHP.GFAP-IL2で老化マウスを処理しても、泳ぐ速度の物理的な低下には影響がなかったが、空間記憶形成で観察された欠損を完全に修正することができた(図7FおよびH)。健康な老化における認知機能低下に対するこの保護効果が、アルツハイマー病マウスモデルで観察されるアミロイド駆動型の認知機能低下の加速に拡張できるかどうかを調べるための予備試験として、前症状のAPP-PS1マウス(Jankowsky et al, 2004)のコホートを2ヶ月齢でPHP.GFAP-IL2投与しました。生後10ヶ月の時点で、APP-PS1トランスジェニックマウスは認知機能の低下を示し、モリス水迷路における経路長の上昇(図EV5A)および四分木選好性の低下(図EV5B)、受動回避テストにおける潜時性の低下(図EV5C)を示した。この悪い成績は、PHP.GFAP-IL2処理によって改善されませんでした(図EV5A-C)。異なる用量や治療法での有効性の可能性を排除するものではありませんが、これらの結果は、IL2治療が加齢による認知機能低下よりもアミロイド駆動型認知機能低下において効力が低いことを示唆しています。これらの結果を合わせると、PHP.GFAP-IL2は、老齢マウスに投与しても、身体能力および覚醒などの加齢に伴う行動低下の他の側面に影響を与えることなく、空間記憶形成における認知低下を予防または回復できることが示唆されます。
図7. 合成IL2送達は、運動能力や新規性探索行動の加齢による変性を変えることなく、空間記憶形成の加齢による低下を防止する
生後2ヶ月でPHP.GFAP-GFPコントロールベクターを投与した野生型マウスを、生後22ヶ月でPHP.GFAP-IL2(またはPHP.GFAP-GFPコントロールベクター)を投与した高齢マウスと比較した。治療後2ヶ月(4ヶ月または24ヶ月)、行動を試験した。
A.ホームケージでの活動は、30分ごとに単房マウスの水平方向の動きを赤外線で登録することで評価した(n = 10, 10, 12)。左は24時間の活動量、点線は昼夜の境界を示す。右は平均活動量。
B.加速ロータロッドに費やした時間、300秒のテストを4回繰り返した平均値(n = 10, 9, 10)。
C.オープンフィールド試験で1日おきに行われた試行での総移動距離(n = 10, 10, 12)。
D.社交性試験中の探索(n = 10, 10, 12)。
E.明暗テスト(n = 10, 9, 10)。左:明るい場所での移動距離。右は暗黒ゾーンに入るまでの潜伏時間。
F.モリス水迷路における空間学習(n = 10, 10, 12)。泳ぐ速度。
G、H.(G)隠れ台を見つけるまでの経路長、(H)獲得試行時の目標までの距離。実験は、10個の異なる時点でのデータ収集を含めて1回行った(n = 10, 10, 12)。
I.モリス水迷路での獲得5日後(プローブ1)および10日後(プローブ2)のプローブテスト。実験は1回行い、提示された10種類の時点のうち2つの時点からデータを収集した(n = 10, 10, 12)。ターゲット四分円に滞在した時間は、若い対照群およびIL2処置の老齢動物において、2回目のプローブ試行で偶然を有意に上回った。
データ情報: 平均値±SEM。(AおよびF)、年齢および治療を主因とする2ウェイANOVA反復測定、(B-D)、年齢および治療を主因とする2ウェイANOVA、(G)、25%チャンスレベルに対する1サンプルt-テスト。
この図のソースデータはオンラインで入手可能です。
図7のソースデータ [emmm202216805-sup-0009-SDataFig7.zip] 。
ダウンロードフィギュア
ダウンロードパワーポイント
図EV5. PHP.GFAP-IL-2で処理したAPP PS1マウスの行動学的評価
ディスカッション
脳の老化は、構造的、機能的、微小環境的な変化を含む多面的な現象であり、神経細胞およびグリア細胞の両方に影響を及ぼす。しかし、神経回路や可塑性の喪失などの変化は、主に細胞内在性の神経細胞老化メカニズムによって引き起こされる可能性もあれば、グリア支持体の老化による影響に由来する可能性もあるため、有害な細胞変化の原因ドライバーを解明することは困難である。このプロセスにおける炎症の役割は、補正実験に基づくと、老化プロセスの少なくともいくつかの側面の主要なドライバーである可能性が高い。例えば、文脈的恐怖条件付けおよび放射状腕水迷路アッセイにおける学習および記憶能力の欠陥は、若いマウスの血漿を繰り返し注入することによって、18ヶ月齢のマウスで部分的に修正することができる(Villeda et al, 2014)。同様に、21ヶ月齢のマウスの循環系を2ヶ月齢のマウスに接合するヘテロクロニックパラビオシスは、嗅覚感受性アッセイにおける老齢マウスの成績を改善した(Katsimpardi et al, 2014)。このように、神経細胞による本質的な老化現象が考えられる一方で、認知機能の低下という新たな特徴は、毒物や炎症性産物の蓄積など、少なくとも部分的には環境要因に依存しなければならない。T細胞は、このような神経老化の環境整備に関与する重要な潜在的プレーヤーである。T細胞は、サイトカイン、活性酸素、自己抗体などの主要な炎症性メディエーターを直接産生したり、産生を刺激したりすることができ、このプロセスは、神経幹細胞ニッチの制約などの創発的特徴に直接寄与し得る(Dulken et al, 2019)。特に、IFNγ産生は、ミクログリアとアストロサイトの活性化が神経細胞損傷につながる、加齢に伴う衰えの潜在的なメディエーターとして浮上している(Liston & Yshii, 2023)。潜在的な犯人としてT細胞が特定されたことで、治療薬としてのTregの可能性が開かれました。Tregは直接的な抗炎症作用を持ち、従来のT細胞から過剰に亢進した反応を防ぐことができる。今回観察された保護効果は、T細胞を介した炎症に直接対抗することでもたらされる可能性があるが、脳内の両細胞タイプの密度が低いため、この制御方法は制限されるだろう(Pasciuto et al, 2020)。さらに、Tregは、アンフィレグリンやオステオポンチン(Ito et al, 2019; Shi et al, 2021)といった、脳卒中などの損傷後に神経保護効果を発揮する、修復を指向するサイトカインを生成することができます。脳内のTreg数は少ないため、その影響は、少なくとも部分的には、グリア細胞の再プログラミングによって媒介されると予想されます。末梢では、Tregは単球を、より修復を促進する抗炎症性プロファイルに再プログラムすることができる(Tiemessen et al, 2007)。脳では、類似のプログラムがミクログリアに付与される可能性があり(Zhou et al, 2017)、今回の結果は、トレグがミクログリアの細胞のターンオーバーを遅らせ、老化を遅らせる可能性を示しています。ミクログリアの極性は、ひいてはアストロサイトの極性に影響を与える可能性がある(Li et al, 2020)。Tregはまた、プロリペア状態において、オリゴデンドロサイトへのOPC成熟を刺激し、髄鞘形成を促進することができる(Dombrowski et al, 2017)。PHP.GFAP-IL2が老化現象を緩和する効果を考慮する場合、最も簡潔な説明は、Tregの局所的な拡大を介した一次効果であろう。外傷性脳損傷の文脈で使用した場合、PHP.GFAP-IL2の有益な効果は、適応免疫系が存在する場合にのみ観察され、達成されたIL2のレベル(〜2 pg/ml)は、非Treg系統で発現する低親和性受容体の活性化を引き起こすには低すぎることを示唆している(Yshii et al, 2022b)。個々の下流メディエーターの役割を推測することは魅力的であるが、老化の複雑さと相互依存性から、修復促進、抗炎症、グリア再プログラムの機能を統合した多因子性機能がより有力である。今回開発したin vitroシステムは、これらのメカニズムの一部を将来的に解明することができるかもしれません。
加齢グリアの単一細胞トランスクリプトミクスにより、すべての主要なグリア細胞タイプに共通する加齢による分子シグネチャーが同定された。同定された経路は、細胞レベルでミトコンドリア機能障害、プロテオスタシスの喪失、細胞老化が主導する、現在の老化の分子的理解に一致する。ミトコンドリア機能不全(ここでは酸化的リン酸化およびマイトファジー経路の変化として特定)は、老化の主要な細胞内マーカーとして特定されており、ミクログリアにおける機能不全は認知症の神経変性の潜在的要因である(Chakravorty et al, 2019)。実際、ミトコンドリア機能不全の負担増は、ADのマウスモデルにおける脳萎縮の進行を早める可能性があり(Kukreja et al, 2014)、一方、欠陥のあるミトコンドリアのマイトファジーは認知低下を逆転させる(Fang et al, 2019). プロテオスタシスの喪失は、組織横断的な老化で繰り返されるもう一つのテーマであり、ここでは、タンパク質生産(RNA輸送、スプライソソーム、リボソーム)、処理(小胞体でのタンパク質処理)、分解(プロテアソーム)経路の変化と一致しています。プロテオスタシスと老化の関連性は不明であるが、ミスフォールドや損傷を受けたタンパク質の毒性や阻害性の蓄積が有力視されている。プロテオスタシスネットワークの構成要素とALS、AD、PDなどの神経疾患との間に遺伝的な関連があることから、正常なプロテオスタシスの破綻が神経病理の明確な危険因子であることが強く示唆されています(Labbadia & Morimoto, 2015)。プロテオスタシスに関連して、老化と密接に関連するプロセスであるオートファジーがあります(Aman et al, 2021)。AD患者は制御不能なオートファジーを示し(Lee et al, 2010)、オートファジーの喪失はマウスで重度の神経変性を引き起こす(Komatsu et al, 2006)。特定された特定のシグナル伝達経路については、Neuregulin-ErbB経路、Ras経路、およびPI3K/ACT/mTOR(Borras et al, 2011; Mazucanti et al, 2015; Ou et al, 2021)はすべて神経老化に不可欠で、老化グリア細胞で発症する細胞表現型に対する潜在的ドライバーである。
驚くべきことに、脳の局所的なIL2の供給は、ミクログリア、オリゴデンドロサイト、アストロサイト全体で、これらの加齢による経路変化のほとんどすべてを大幅に元に戻すのに十分でした。これは、PHP.GFAP-IL2処理と以前に関連したMHCIIのアップレギュレーション(Yshii et al, 2022b)、ミクログリアにおけるTLRおよびIL17シグナル伝達経路の変化を除けば、変化したと確認された免疫経路が比較的少ないにもかかわらずである。この効果が、Tregサイトカインが介在するような直接的なリプログラミングを介するものなのか、あるいは微小環境浄化の間接的な効果なのかは、まだ不明である。しかし、このような細胞固有の老化の分子シグネチャーが、後期の介入に反応することは、非常に有望である。
本研究は、PHP.GFAP-IL2治療のアナログが、ヒトの老化に伴う認知機能低下を回避するために利用できる可能性を示唆しているが、実用化にはいくつかの重要な障壁がある。まず、老化のプロセスが種の壁を越えてどの程度保存されているかは不明である。DNA修飾の蓄積、ミトコンドリア機能障害、プロテオスタシスの喪失など、老化した脳で起こる生物学的プロセスの多くは、種を超えて共有されている(Yankner et al, 2008)。同様に、認知機能の低下もマウスとヒトで共通しており(Gallagher & Rapp, 1997)、空間移動能力(マウスのモリス水迷路やヒトの同種の迷路など;Moffat et al, 2007)が低下する。にもかかわらず、マウスの認知機能低下はヒトよりも比較的早く現れるようであり(Yanai & Endo, 2021)、言語などヒト特有の精巧な認知能力の低下は動物モデルで検証することができない。さらに、老化マウスにおいてT細胞によって抑制される神経原性ニッチ(Dulken et al, 2019)は、ヒトには存在しないかもしれない(Franjic et al, 2021)。したがって、仮にヒトにおける空間ナビゲーション障害の逆転が脳特異的IL2送達によって可能であったとしても、潜在的に共通の細胞的または分子的原因を共有する言語障害などの認知低下の他の側面が、必ずしも同じ治療アプローチに反応するかどうかは明らかでありません。第二に、認知機能の低下に関わる速度が、治療法の制限となる可能性がある。本研究では、評価前に2ヶ月間、高齢マウスに治療を施したが、治療後の高齢マウスは、若い対照マウスと同様の空間ナビゲーション能力を示した。しかし、この治療が老化の分子、細胞、行動プロセスを積極的に逆転させたのか、それとも単に老化を防いだだけなのかは、まだわかっていない。私たちが測定した認知機能低下の動態はマウスの寿命に凝縮されており、ヒトでの治療が数十年にわたる認知機能低下に影響を与えることができるかという疑問が生じます。もし、認知機能の低下が、生涯にわたる免疫系の低レベルの活性化によって誘発される基礎炎症の増加など、脳微小環境の活発な変化によって主に引き起こされるのであれば(Montecino-Rodriguez et al, 2013; Deleidi et al, 2015)、抗炎症治療の一過性のパルスでも、低下を逆転または予防できるかもしれません。逆に、認知機能の低下が主にプログラムされた老化によって引き起こされるのであれば、このような治療法は、せいぜい認知機能の低下を遅らせる程度と予想される。幸いなことに、マウスを用いた実験では、後者よりも前者のモデルが大きく支持されている。マウスの認知機能低下は、より長寿の宿主に移植した場合、個々のマウスニューロンがマウスを長生きさせることができるにもかかわらず、加齢とともに起こる(Magrassi et al, 2013)ため、回復不能な機能低下を排除できるわけではない。第三の限界は、認知機能低下の原因が多様であることにある。同じような認知症状が、神経ネットワークに障害を与える異なる分子・細胞経路から発症することがある。このプロセスが炎症によって引き起こされる程度は、高齢者集団の中でさえ、個人によって異なる可能性がある。IL2ベースの治療に対する潜在的な反応は、例えば、ここに示した純粋な加齢に基づくモデルでの認知機能低下からの保護に関するデータが示すように、アミロイドプラーク形成に起因するモデルでの認知機能低下からの保護はないだろう。最後に、治療法そのものの分子的基盤について検討する必要がある。ここで使用された送達システムであるPHP.Bカプシドは、非ヒト霊長類における血液脳関門通過において、マウスよりも性能が悪い(Hordeaux et al, 2018)。幸い、ヒトで良好に機能する代替AAVキャプシドが利用可能であり(Deverman et al, 2018)、キャプシド設計による神経送達の改善に関する研究が活発に行われており(Chen et al, 2022; Goertsen et al, 2022)、脳における持続的なカーゴ発現が何年にもわたって観察されている(Mittermeyer et al, 2012)ことから、長寿治療の可能性を高める利点となっている。トレグはマウスとヒトの脳の両方に存在し(Pasciuto et al, 2020)、IL2経路は種を超えて高度に保存されているため、カーゴの送達が達成されれば、ヒトでも脳トレグの拡大を誘導できる可能性がある。しかしながら、健康な人への使用を想定した長寿治療法の開発を検討する際には、長期的な安全性データが不可欠であるため、技術的および規制上の大きな障壁が存在する。
材料と方法
マウス
C57BL/6バックグラウンドでFoxp3Thy1.1レポーターマウス(Liston et al, 2008)を使用した。APP-PS1マウス(Jankowsky et al, 2004)は、C57BL/6バックグラウンドで使用された。2ヶ月齢と22ヶ月齢の野生型C57BL/6マウスをJanvier Labsから購入し、温度と湿度が制御された部屋で12時間の明暗サイクルの下、餌と水を自由に摂取できるSPF条件下で飼育しました。すべての動物処置は、関連する国内および欧州のガイドラインを考慮し、KU Leuven Animal Ethics Committee(P124/2019)の承認を得た。本研究では、特に指定がない限り、雄および雌のマウスを使用した。マウス実験のサンプルサイズは、動物倫理委員会と連携して、過剰な動物使用を伴わない強固な感度を可能にするために、検出力計算とパイロットデータに基づいて選択されました。マウスは、実験グループの同一性に関して盲検化された動物技術者が実験手順と臨床測定を行い、様々な実験グループに含めるためにランダムに選択された。分析から除外されたマウスはない。
行動学的実験
野生型マウスの行動実験は4ヶ月および24ヶ月齢の雄で行い、同腹のコントロールと比較した。APP-PS1マウスの行動実験は10ヶ月で行い、同腹のコントロールと比較した。マウスは少なくとも5日間、新しい環境に慣れさせ、テストは活動サイクルの明期に実施した。テストは、遺伝子型および/または治療グループに対して盲目の観察者が実施および分析した。トラッキングエラーが発生した場合、マウスは除外された。
ケージでの活動
歩行行動は、午後4時から翌日午後3時30分までの23時間にわたって調査した(Verreet et al, 2016)。午後7時に消灯し、午前7時に再び点灯した。この試験中、動物は個別に透明ケージ(20×26cm)に入れられ、チャウ、水、最小限の寝具が置かれ、3本の赤外線ビームを備えた実験室製の活動ロガーに入れられた。赤外線ビームは水平方向の動きを記録するもので、ビームの切れ目が30分の時間枠で記録される。
オープンフィールド
オープンフィールド探索は、間接照明で照らされた50cm×50cm×30cm(w×l×h)の正方形のアリーナでテストした。動物は30分間暗順応させ、アリーナで10分間テストした。マウスの動きは、ANY-maze Video Tracking Systemソフトウェア(Stoelting Europe)を用いて、10分間ビデオトラッキングした。
明暗テスト
明暗テストに使用した装置は、ケージ(50×50×30cm)を扉付きのパーティションで2つのコンパートメントに分けたものである。一方の区画は明るく照らされ、もう一方は暗い。マウスは照明のある部屋に入れられ、10分間、2つの部屋の間を自由に行き来できるようにした。照明のある区画でのマウスの行動は、ANY-maze Video Tracking Systemソフトウェア(Stoelting Europe)を用いて追跡された。
ロータロッド試験
運動協調性と平衡感覚はロータロッド(MED Associates Inc.)を使用してテストした。マウスは、まず一定速度(4rpm、2分)で訓練された後、4回の試験試行(試行間隔10分)を受け、その間にロータロッドの速度を4rpmから40rpmまで300秒かけて増加させた。
モリス水迷路(MWM)
空間学習と認知的柔軟性は、隠れプラットフォーム・モリス水迷路(MWM)でテストした。円形のプール(直径150cm)に不透明化(0.01% Acusol OP301, Dow Chemicals)した水(26±1℃)を満たした。プラットフォーム(直径15cm)は、水面下1cmに隠した。空間学習のために、マウスは固定されたプラットフォームの位置まで移動するように10日間訓練された(D'Hooge & De Deyn, 2001; Callaerts-Vegh et al, 2006)。参照記憶を評価するために、獲得学習中の6日目と11日目にプローブ試行(100秒)を実施した。プローブ試験中、フローターマウスは除外された。脱出台をプールから外し、マウスに100秒間迷路を探索させた。泳ぐ経路はEthovisionソフトウェア(Noldus)で追跡した。
社交性試験
社交性は3室試験で評価した。長方形の透明なプレキシグラスの箱を2つのパーティションで仕切り、3つのコンパートメントに分割した。パーティションには複数の穴が開いており、中央の部屋(42×26cm)にいるマウスと左または右の部屋(26×26cm)にいるマウスの間で匂いを嗅ぎ合うことができる。試験は、順化段階と社会性段階の2つの連続した段階から構成されている。中央の部屋に慣れた後(5分間)、見知らぬマウス(同性)を側室の一方に入れ、もう一方は空にしておいた。その後、サイドコンパートメントへの接近行動を10分間記録した(社交性)。動物の行動は、ウェブカメラとANY-maze Video Tracking Systemソフトウェア(Stoelting Europe)を用いて記録した。
受動的回避行動
暗順応した動物を明るい照明の箱に入れ、電気を通すグリッドを取り付けた暗い区画に入るようにした。入室までの時間を記録した(train)。動物が暗室に入ったところで扉を閉め、軽い足裏衝撃(0.3 mA、2秒)を与えた後、ホームケージに入れ替えた。この実験を繰り返し、暗室に入るまでの潜伏時間を記録し(test)、カットオフポイントを5分とした。
In vitro細胞死アッセイ
成体(P240)および高齢(P660)の野生型雌マウスから、先に記載したように初代マウスミクログリア細胞を単離した(Lopez-Serrano et al, 2019)。前脳を採取し、冷たいHBSSに入れ、機械的にトリチュレートし、Neural Tissue Dissociation Kit(P)(Miltenyi)を用いて、製造者の仕様に従って酵素的に解離させた。解離したばかりの細胞を70μmのセルストレーナー(BD2 Falcon)に通し、MACSバッファー(Miltenyi)で洗浄した。細胞をCD11bマイクロビーズとインキュベートし、LSカラム(QuadroMACS, Miltenyi)に通した。マウスマイクログリアを50,000細胞/ウェルの密度で24ウェルプレートにプレーティングし、TIC培地(DMEM/F12)、グルタミン(2mM)、N-アセチルシステイン(5mg/ml)、インシュリン(1:2,000)、アポトランスフェリン(100mg/ml)、亜セレン酸ナトリウム(100ng/ml)、コレステロール(1. 5mg/ml)、ヘパラン硫酸(1mg/ml)を50ng/ml M-CSF、100ng/ml IL-34、10ng/ml CX3CL1、および2ng/ml TGFβで補った(Bohlen et al, 2017; Mancuso et al, 2019)。
プレーティングの2日後、コントロールおよび共培養細胞の両方の培地に、組換えIL-2(20ng/ml、BioLegend)および初代制御性T細胞を補充した。制御性T細胞は、CD4濃縮に基づき、Foxp3Thy1.1レポーターマウスのリンパ節および脾臓から得た単細胞懸濁液から、MojoSort™ Mouse CD4 T Cell Isolation Kit (BioLegend) を用いて、製造者の説明書に従って精製した。細胞のソーティングは、100μmノズルを備えたSony MA900セルソーターを用い、eBioscience™ Fixable Viability Dye eFluor™ 780 (1:2,000), CD4 (AB_312696; 1:200) and Thy1.1 (AB_465773; 1:200) (for Foxp3) を含む抗体パネルで行いました。ソートされた細胞は、10%FBSを補充したDMEM中で回収した。ポストソート、細胞数、生存率はLUNA-FL dual fluorescence cell counter (Logos Biosystems)を用いて確認した。制御性T細胞を50,000細胞/ウェルの密度でミクログリア培養物に添加した。細胞は、分析前に5日間培養した。採取前に、細胞をPBSで洗浄し、その後、セルスクラッパーを使用して5mM EDTA-PBSで回収した。ミクログリアにおける細胞死とアポトーシスは、アネキシンV(AnnV)とヨウ化プロピジウム(PI)の二重染色戦略(Dead cells apoptosis kit, Invitrogen)を用いて測定された。収穫した細胞をアッセイバッファーで洗浄し、製造元の指示に従い、APC標識AnnV(AB_2575165;1:50)、PIおよび抗CD11b-BV421(AB_11203704;1:1,000)とインキュベートした。染色した細胞は、FACSCanto IIサイトメーター(Becton Dickinson)でフローサイトメトリーにより分析した。この実験は、独立した2回で繰り返した。
AAVベクターの作製と精製
AAV-PHP.Bの生産は、Vigene Sciences (Rockville, MD, USA)によって、古典的なトリトランスフェクション法を用いて行い、その後のベクター滴定はqPCRベースの方法論を用いて行った(Rincon et al, 2018; Fripont et al, 2019)。AAV-PHP.B.GFAP-IL2については、マウスIL2コード配列を、5′および3′UTR(アクセッション番号BC116845)とともに、全長GFAPプロモーター(Brenner et al, 1994)、ウッドチャック肝炎転写後制御要素(WPRE)および牛成長ホルモンポリアデニル化(bGH polyA)配列を含む一本鎖AAV2由来発現カセットにクローニングした。コントロールベクターは、IL2コード配列をenhanced green fluorescent protein (EGFP; Vector Biolabs)をコードするものと交換することで調製した。
AAV処理
AAVベクター(総量100μl)を1×109ベクターゲノム/用量で側尾静脈からマウスに投与した。野生型マウスは、特に指示がない限り、AAV注射の2ヶ月後に実験的処置に使用された。APP-PS1マウスは2ヶ月齢で処置し、10ヶ月齢で行動変化を評価した。
フローサイトメトリー
脳からの単細胞懸濁液は、2mM MgCl2、2mM CaCl2、20% FBS、2mM HEPES pH 7.4 (Gibco) を添加したRPMI 1640中、1mg/ml コラゲナーゼ IV (Thermo Fisher) 、300μg/ml ヒアルロニダーゼ (Sigma-Aldrich) 、40μg/ml DNase I (Sigma-Aldrich) を混合して37℃で30分間消化することで準備した。この後、機械的破砕、濾過を行い、勾配遠心分離(40% Percoll GE Healthcare)により白血球を濃縮した。細胞を固定し、以前に記載されたようにeBioscience Foxp3染色キット(eBioscience)を用いて透過処理した(Whyte et al, 2022)。細胞は、Foxp3(AB_2651768;1:200)、CD4(AB_2722549;1:500)、CD3(AB_11218085;1:5000)、CD45(BB790カスタムオーダー;1:2000)、TCRβ(AB_493344;1:2500)、CD25(AB_2739522;1:1000)について染色された。データはBD Symphonyで取得し、AutoSpill(Roca et al, 2021)を使用して補正した。
統計データ
2群間の比較は、対にならない両側Student's t-testを使用して実施した。必要な場合は、ポストホックホルムの多重比較検定またはダネットの多重比較検定を行った。二元配置分散分析(Two-way ANOVA)は、年齢と治療を主因子として、適切な場合に使用した。ケージ内活動行動とMWM獲得については、年齢と治療を主因として、繰り返し測定による2元配置分散分析で解析した。データが正規分布していない場合はノンパラメトリック検定を行った(視覚的チェックのためのQQプロット、プールした残差のShapiro-Wilk正規性検定)。図中の凡例で報告されているnの値は、特に指定がない限り、動物の数を表している。数値は平均値±SEMで表される。
単細胞RNA配列決定
マウスは、ケタミン(87 mg/kg)/キシラジン(13 mg/kg)混合液の腹腔内注射で深く麻酔し、氷冷したPBSで経心灌流した。脳は脳内培地に入れた: B27(サーモフィッシャー)、2mMピルビン酸ナトリウム(ギブコ)、500μM N-アセチル-システイン(シグマ-アルドリッチ)および5uMアクチノマイシンD(シグマ-アルドリッチ)で補充したDMEM(ギブコ)。次に、脳を小片に切断し、33 UI/mlのパパイン(Sigma-Aldrich)および40 μg/mlのDNase I(Sigma-Aldrich)を用いて脳培地で37℃、30分間消化された。消化した組織を機械的に破砕し、100μmメッシュで濾過し、24%Percoll(GE Healthcare)を通して密度遠心分離(300gAv、11分、ブレーキなし)により濃縮した。細胞選別は、100μmノズルを備えたSony MA900を用い、抗体パネルとしてeBioscience™ Fixable Viability Dye eFluor™ 780 (1:1,000), CD11b (AB_953558; 1:400), CD45 (AB_465668; 1: 1,000)、CX3CR1(AB_2565706;1:200)(ミクログリア用)、O4(AB_2751960;1:100)(オリゴデンドロサイト用)、ACSA-2(AB_2727427;1:100)(アストロサイト用)およびPDGFRα(AB_466607;1:50)(OPCs用)のソーティング用。特定の細胞集団を回収し、10%FBSを含むDMEMに再懸濁した。サンプルの細胞数および生存率は、LUNA-FLデュアル蛍光セルカウンター(Logos Biosystems)を用いて直ちに確認した。セルカウントと品質管理後、サンプルはChromium Controllerにロードされた。各実験で、約8,700個の細胞を各チャンネルに加え、5,000個の細胞を回収することを目標とした。ライブラリー調製は、10×Genomics Chromium Single Cell 3′ Kit, v3 (10×Genomics) を用いて実施した。ライブラリーは、製造元の説明書(Single cell 3′ reagent kits v3 user guide; CG000183 Rev C)に従って作成し、Qubit 2 Fluorometer (ThermoFisher) と Bioanalyzer HS DNA kit (Agilent) を用いて、推奨される様々なチェックポイントでライブラリーの品質を評価した。細胞あたり50,000リードを目標としたシーケンスカバレッジで、シングルセルライブラリーをIllumina Novaseq 6000またはIllumina HiSeqプラットフォームで、推奨10X、v3リードパラメータ(28-8-0-91サイクル)でペアエンドシーケンスワークフローを使用してシーケンスした。
生シーケンスデータからのFastqは品質管理(QC)分析を受け、10×Genomics CellRanger v4.0.0 counts pipeline(Zheng et al, 2017)を使用してカウントデータに変換された。QCパラメータは、10×Genomicsのユーザーガイドにあるように、シングルセルシーケンスデータの予想範囲内であることが判明しました。カウントデータは、R v4.0.5(R Core Team, 2021)のSeurat v4.0.2(Hao et al, 2021)を使用してさらに分析された。データは、ミトコンドリア遺伝子を10%以上含むものとして分類される低品質細胞を除去するためにフィルタリングされた(Osorio & Cai, 2021)。次に、個々のカウントデータを結合し、sctransform v0.3.2 library(Hafemeister & Satija, 2019)を用いて分散安定化変換法により正規化し、バッチを補正し、RNAカウントおよびミトコンドリア遺伝子発現率について回帰させた。次に、正規化したデータを、scDblFinder v1.4.0 (Germain et al, 2021)を用いてマルチプレットの検出および除去のために分析した。
集団マーカーの同定と遺伝子発現差の解析は、Seuratの組み込みメソッドを用いて、負の二項検定を用いて行った。同様に、PCAおよびUMAP投影もSeuratを使用して実施した。外部データはMouse Brain Atlas (mousebrain.org/downloads; La Manno et al, 2021)から直接ダウンロードし、Seuratのデータ統合パイプラインを使用して、本研究で生成したアストロサイトデータにマッピングした。擬似時間分析を行い、Monocle v2.22.0 (Qiu et al, 2017)のDDRTreeアルゴリズムを用いてトラジェクトリーを構築した。遺伝子セットの濃縮とパスウェイの濃縮は、それぞれGAGE v2.44.0 (Luo et al, 2009)とPathview v1.34.0 (Luo & Brouwer, 2013)を使用して実行した。
データの利用可能性
完全な解析コードはGitHub (https://github.com/AdrianListon/AAV-IL2) で公開されており、データはGEOのデータセットGSE190486 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE190486) として公開されています。
謝辞
本研究は、Wellcome Trust (222442/Z/21/Z to AL)、ERC Consolidator Grant TissueTreg (to A.L.), ERC Proof of Concept Grant TreatBrainDamage (to A.L.), FWO Research Grant 1503420N (to E.P.), an SAO-FRA pilot grant (20190032, to E.P.), an ERC Starting Grant AstroFunc (to M.G.H.) によって支援されています。 )、ERC Proof of Concept Grant AD-VIP (to M.G.H.)、ERA Chair NCBio (to M.G.H.), and the Biotechnology and Biological Sciences Research Council through Institute Strategic Program Grant funding BBS/E/B/000C0427 and BBS/E/B/000C0428, and the Biotechnology and Biological Sciences Research Council Core Capability Grant to the Babraham Institute. E.P.は、FWOからのフェローシップの支援を受けた。マウスの飼育についてはJeason Haughton(VIB)、Pier-Andrée PenttilaとKUL FACS Core、VIB Single Cell Sequencing Coreの重要な貢献に謝意を表します。ビジュアルアブストラクトはBioRender.comで作成しました。
著者の貢献
ピエール・ルメートル 形式的な分析、調査、方法論、執筆-原案、執筆-レビューと編集。Samar HK Tareen: データキュレーション、ソフトウェア、形式分析、調査。Emanuela Pasciuto:データキュレーション、形式分析、監督、検証、調査、方法論、執筆(原案)、プロジェクト管理、執筆(レビューと編集)。Loriana Mascali:調査。Araks Martirosyan:ソフトウェア、調査。Zsuzsanna Callaerts-Vegh:調査、方法論、執筆(レビューと編集)。Suresh Poovathingal:調査。James Dooley:概念化、監督、執筆-レビューと編集。Matthew Holt: Matthew Holt: 概念化、監督、資金獲得、執筆-原案、プロジェクト管理、執筆-レビューと編集。Lidia Yshii: 概念化、監督、検証、調査、方法論、執筆(原案)、プロジェクト管理、執筆(レビューと編集)。エイドリアン・リストン 概念化、監督、資金獲得、執筆-原案、プロジェクト管理、執筆-レビューおよび編集。
開示事項および競合する利益
VIBとBabraham Instituteは、この出版物に含まれる研究の側面をカバーする特許を申請し、商業化を進めています。著者らは、この商業化努力から金銭的な恩恵を受ける可能性がある。S.T.は現在、ロシュ社の社員である。
詳細はこちら
https://www.braincouncil.eu: 患者団体、科学協会、専門家協会、産業界のパートナーとのネットワーク。
https://www.listonlab.uk/: Liston研究室のホームページです。
https://www.i3s.up.pt/research-group.php?groupid=201: ホルト研究室のホームページです。
サポート情報
付録 (PDF書類, 869.2 KB)
拡大図PDF (PDF書類、2.8 MB)
データセットEV1 (Excel 2007 スプレッドシート , 9.5 MB)
データセットEV2 (Excel 2007 スプレッドシート , 85 KB)
拡大表示用ソースデータ (Zip アーカイブ, 41.6 KB)
参考文献
Allen NJ, Lyons DA (2018) Glia as architects of central nervous system formation and function. サイエンス 362: 181-185CrossrefCASPubMedWeb of Science®Google Scholar
Bohlen CJ, Bennett FC, Tucker AF, Collins HY, Mulinyawe SB, Barres BA (2017) Diverse requirements for microglial survival, specification, and function revealed by defined-medium cultures. Neuron 94: 759-773.e8CrossrefCASPubMedWeb of Science®Google Scholar
Alves S, Churlaud G, Audrain M, Michaelsen-Preusse K, Fol R, Souchet B, Braudeau J, Korte M, Klatzmann D, Cartier N (2017) Interleukin-2 はアルツハイマー病マウスにおいてアミロイド病理、シナプス不全、記憶を改善する。Brain 140: 826-842CrossrefPubMedWeb of Science®Google Scholar
Aman Y, Schmauck-Medina T, Hansen M, Morimoto RI, Simon AK, Bjedov I, Palikaras K, Simonsen A, Johansen T, Tavernarakis N et al (2021) Autophagy in healthy aging and disease. Nat Aging 1: 634-650CrossrefPubMedGoogle Scholar
Badr M, McFleder RL, Wu J, Knorr S, Koprich JB, Hunig T, Brotchie JM, Volkmann J, Lutz MB, Ip CW (2022) CD28 superagonistic antibodiesによる制御性T細胞の拡大によりA53T-αシヌクレインパーキンソン病マウスでの神経変性が抑制された。J Neuroinflammation 19: 319CrossrefCASPubMedGoogle Scholar
Baek H, Ye M, Kang GH, Lee C, Lee G, Choi DB, Jung J, Kim H, Lee S, Kim JS et al (2016) 3xTg-AD Alzheimer's disease modelにおけるCD4+CD25+Foxp3+制御T細胞の神経保護効果. オンコターゲット 7: 69347-69357CrossrefPubMedGoogle Scholar
Baird JK, Bourdette D, Meshul CK, Quinn JF (2019) パーキンソン病の病態と治療におけるT細胞の重要な役割. Parkinsonism Relat Disord 60: 25-31CrossrefPubMedWeb of Science®Google Scholar
Baruch K, Ron-Harel N, Gal H, Deczkowska A, Shifrut E, Ndifon W, Mirlas-Neisberg N, Cardon M, Vaknin I, Cahalon L et al (2013) CNS-specific immunity at the choroid plexus shifts toward destructive Th2 inflammation in brain aging. Proc Natl Acad Sci U S A 110: 2264-2269CrossrefCASPubMedWeb of Science®Google Scholar
Baruch K, Rosenzweig N, Kertser A, Deczkowska A, Sharif AM, Spinrad A, Tsitsou-Kampeli A, Sarel A, Cahalon L, Schwartz M (2015) Foxp3(+) regulatory T cellを標的とした免疫寛容解除によりアルツハイマー病の病態が緩和される。Nat Commun 6: 7967CrossrefCASPubMedWeb of Science®Google Scholar
Batiuk MY, Martirosyan A, Wahis J, de Vin F, Marneffe C, Kusserow C, Koeppen J, Viana JF, Oliveira JF, Voet T et al (2020) Identification of region-specific astrocyte subtypes at single cell resolution. Nat Commun 11: 1220CrossrefCASPubMedWeb of Science®Google Scholar
Beers DR, Henkel JS, Zhao W, Wang J, Huang A, Wen S, Liao B, Appel SH (2011) Endogenous regulatory T lymphocytes ameliorate amyotrophic lateral sclerosis in mice and correlate with disease progression in patients with amyotrophic lateral sclerosis. Brain 134: 1293-1314CrossrefPubMedWeb of Science®Google Scholar
Borras C, Monleon D, Lopez-Grueso R, Gambini J, Orlando L, Pallardo FV, Santos E, Vina J, Font de Mora J (2011) RasGrf1 欠損はマウスの老化を遅らせる. Aging 3: 262-276CrossrefCASPubMedWeb of Science®Google Scholar
Brenner M, Kisseberth WC, Su Y, Besnard F, Messing A (1994) GFAP promoter directs astrocyte-specific expression in transgenic mouse. J Neurosci 14: 1030-1037CrossrefCASPubMedWeb of Science®Google Scholar
Bussian TJ, Aziz A, Meyer CF, Swenson BL, van Deursen JM, Baker DJ (2018) Clearance of senescent glial cells prevents tau-dependent pathology and cognitive decline. ネイチャー 562: 578-582CrossrefCASPubMedWeb of Science®Google Scholar
Callaerts-Vegh、Beckers T、Ball SM、Baeyens F、Callaerts PF、Cryan JF、Molnar E、D'Hooge R (2006) メタボリックグルタミン酸受容体7欠損マウスにおけるワーキングメモリと恐怖の消滅の同時欠損は、不安軽減とは機能的に切り離されます。J Neurosci 26: 6573-6582CrossrefCASPubMedWeb of Science®Google Scholar
Carrasco E, de Las G, Heras MM, Gabande-Rodriguez E, Desdin-Mico G, Aranda JF, Mittelbrunn M (2021) The role of T cells in age-related diseases. Nat Rev Immunol 22: 97-111CrossrefPubMedGoogleスカラー
Chakravorty A, Jetto CT, Manjithaya R (2019) Dysfunctional mitochondria and Mitophagy as drivers of Alzheimer's disease pathogenesis. Front Aging Neurosci 11: 311CrossrefCASPubMedWeb of Science®Google Scholar
Chen X, Ravindra Kumar S, Adams CD, Yang D, Wang T, Wolfe DA, Arokiaraj CM, Ngo V, Campos LJ, Griffiths JA et al (2022) Engineered AAVs for non-invasive gene delivery to rodent and non-human primate nerv system. Neuron 110: 2242-2257.e6CrossrefCASPubMedGoogle Scholar
Chinta SJ, Woods G, Demaria M, Rane A, Zou Y, McQuade A, Rajagopalan S, Limbad C, Madden DT, Campisi J et al (2018) Cellular senescence is induced by the environmental neurotoxin Paraquat and contributes to neuropathology linked to Parkinson's disease. Cell Rep 22: 930-940CrossrefCASPubMedWeb of Science®Google Scholar
Clarke LE, Liddelow SA, Chakraborty C, Munch AE, Heiman M, Barres BA (2018) Normal aging induces A1-like astrocyte reactivity. Proc Natl Acad Sci U S A 115: E1896-E1905CrossrefCASPubMedWeb of Science®Google Scholar
Da Mesquita S, Louveau A, Vaccari A, Smirnov I, Cornelison RC, Kingsmore KM, Contarino C, Onengut-Gumuscu S, Farber E, Raper D et al (2018) Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. ネイチャー560号 185-191CrossrefCASPubMedWeb of Science®Google Scholar
Da Mesquita S, Herz J, Wall M, Dykstra T, de Lima KA, Norris GT, Dabhi N, Kennedy T, Baker W, Kipnis J (2021) Aging-associated deficit in CCR7 is linked to worsened glymphatic function, cognition, neuroinflammation, and beta-amyloid pathology. Sci Adv 7: eabe4601CrossrefCASPubMedWeb of Science®Google Scholar
Dansokho C, Ait Ahmed D, Aid S, Toly-Ndour C, Chaigneau T, Calle V, Cagnard N, Holzenberger M, Piaggio E, Aucouturier P et al (2016) Regulatory T cell delay disease progression in Alzheimer-like pathology. Brain 139: 1237-1251CrossrefPubMedWeb of Science®Google Scholar
Deczkowska A, Matcovitch-Natan O, Tsitsou-Kampeli A, Ben-Hamo S, Dvir-Szternfeld R, Spinrad A, Singer O, David E, Winter DR, Smith LK et al (2017) Mef2C restrains microglial inflammatory response and is lost in brain ageing in an IFN-I-dependent manner. Nat Commun 8: 717CrossrefPubMedWeb of Science®Google Scholar
Deleidi M, Jaggle M, Rubino G (2015) 神経疾患における免疫老化、代謝異常、および炎症。Front Neurosci 9: 172CrossrefPubMedWeb of Science®Google Scholar
Deverman BE, Ravina BM, Bankiewicz KS, Paul SM, Sah DWY (2018) Gene therapy for neurological disorders: progress and prospects. Nat Rev Drug Discov 17: 767CrossrefCASPubMedWeb of Science®Google Scholar
D'Hooge R, De Deyn PP (2001) 学習と記憶の研究におけるモリス水迷路の応用。Brain Res Brain Res Rev 36: 60-90CrossrefCASPubMedWeb of Science®Google Scholar
Dombrowski Y, O'Hagan T, Dittmer M, Penalva R, Mayoral SR, Bankhead P, Fleville S, Eleftheriadis G, Zhao C, Naughton M et al (2017) Regulatory T cell promote myelin regeneration in the central nervous system. Nat Neurosci 20: 674-680CrossrefCASPubMedWeb of Science®Google Scholar
Dong G, Li C, Hu Q, Wang Y, Sun J, Gao F, Yang M, Sun B, Mao L (2021) Low-dose IL-2 treatment affords protection against subarachnoid hemorrhage injury by expanding peripheral regulatory T cells.ACS Chem Nerosci 12: 430-440CrossrefCASPubMedGoogle Scholar
Dulken BW, Buckley MT, Navarro Negredo P, Saligrama N, Cayrol R, Leeman DS, George BM, Boutet SC, Hebestreit K, Pluvinage JV et al (2019) Single-cell analysis reveals T cell infiltration in old neurogenic niches. ネイチャー571:205-210CrossrefCASPubMedWeb of Science®Google Scholar
Fang EF, Hou Y, Palikaras K, Adriaanse BA, Kerr JS, Yang B, Lautrup S, Hasan-Olive MM, Caponio D, Dan X et al (2019) Mitophagy inhibits amyloid-beta and tau pathology and reverses cognitive deficits in models of Alzheimer's disease. Nat Neurosci 22: 401-412CrossrefCASPubMedWeb of Science®Google Scholar
Faridar A, Vasquez M, Thome AD, Yin Z, Xuan H, Wang JH, Wen S, Li X, Thonhoff JR, Zhao W et al (2022) Ex vivo expanded human regulatory T cells modify neuroinflammation in a preclinical model of Alzheimer's disease. Acta Neuropathol Commun 10: 144CrossrefCASPubMedGoogle Scholar
Ferretti MT, Merlini M, Spani C, Gericke C, Schweizer N, Enzmann G, Engelhardt B, Kulic L, Suter T, Nitsch RM (2016) アルツハイマー病様脳アミロイド症のトランスジェニックモデルにおけるT細胞脳浸潤と未熟抗原提示細胞。Brain Behav Immun 54: 211-225CrossrefCASPubMedWeb of Science®Google Scholar
Franjic D, Skarica M, Ma S, Arellano JI, Tebbenkamp ATN, Choi J, Xu C, Li Q, Morozov YM, Andrijevic D et al (2021) Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cell. Neuron 110: 452-469.e14CrossrefPubMedGoogle Scholar
Fripont S, Marneffe C, Marino M, Rincon MY, Holt MG (2019) アデノ随伴ウイルスベースベクターの製造、精製、および品質管理について。J Vis Exp https://doi.org/10.3791/58960CrossrefPubMedGoogle Scholar
ギャラガーM、ラップPR(1997)老化が認知に及ぼす影響を研究するための動物モデルの使用。Annu Rev Psychol 48: 339-370CrossrefCASPubMedWeb of Science®Google Scholar
Germain PL, Lun A, Macnair W, Robinson MD (2021) scDblFinderを用いたシングルセルシーケンスデータにおけるダブレット識別。F1000Research 10: 979CrossrefPubMedGoogle Scholar
Goertsen D, Flytzanis NC, Goeden N, Chuapoco MR, Cummins A, Chen Y, Fan Y, Zhang Q, Sharma J, Duan Y et al (2022) AAV capsid variants with brain-wide transgene expression and decreased liver targeting after intravenous delivery in mouse and marmoset. Nat Neurosci 25: 106-115CrossrefCASPubMedWeb of Science®Google Scholar
Hafemeister C, Satija R (2019) 正規化負の二項回帰を用いた単一細胞RNA-seqデータの正規化と分散安定化。Genome Biol 20: 296CrossrefCASPubMedWeb of Science®Google Scholar
Hamza TH, Zabetian CP, Tenesa A, Laederach A, Montimurro J, Yearout D, Kay DM, Doheny KF, Paschall J, Pugh E et al (2010) HLA領域における共通の遺伝子変異は遅発性の散発性パーキンソン病と関連しています。Nat Genet 42: 781-785CrossrefCASPubMedWeb of Science®Google Scholar
Hao Y, Hao S, Andersen-Nissen E, Mauck WM, Zheng S, Butler A, Lee MJ, Wilk AJ, Darby C, Zager M et al (2021) Integrated analysis of multimodal single-cell data. Cell 184: 3573-3587.e29CrossrefCASPubMedWeb of Science®Google Scholar
Hefendehl JK, Neher JJ, Suhs RB, Kohsaka S, Skodras A, Jucker M (2014) Homeostatic and injury-induced microglia behavior in the aging brain. Aging Cell 13: 60-69Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
Hof PR, Morrison JH (2004) The aging brain: Morphomolecular senescence of cortical circuits. Trends Neurosci 27: 607-613CrossrefCASPubMedWeb of Science®Google Scholar
Hordeaux J, Wang Q, Katz N, Buza EL, Bell P, Wilson JM (2018) AAV-PHP.B の神経栄養特性は C57BL/6J マウスに限られる。Mol Ther 26: 664-668CrossrefCASPubMedWeb of Science®Google Scholar
Hou Y, Dan X, Babbar M, Wei Y, Hasselbalch SG, Croteau DL, Bohr VA (2019) Ageing as a risk factor for neurodegenerative disease. Nat Rev Neurol 15: 565-581CrossrefPubMedWeb of Science®Google Scholar
Huang Y, Liu Z, Cao BB, Qiu YH, Peng YP (2020) Treg cells attenuate Neuroinflammation and protect neurons in a mouse model of Parkinson's disease. J Neuroimmune Pharmacol 15: 224-237CrossrefPubMedGoogle Scholar
International Parkinson Disease Genomics Consortium, Nalls MA, Plagnol V, Hernandez DG, Sharma M, Sheerin UM, Saad M, Simon-Sanchez J, Schulte C, Lesage S et al (2011) Imputation of sequence variants for identification of genetic risk for Parkinson's disease: A meta-analysis of genome-wide association studies. Lancet 377: 641-649CrossrefCASPubMedWeb of Science®Google Scholar
伊藤真也、駒井紘一、三瀬小俣聡、飯塚古賀、野口恭子、近藤哲也、酒井理、松尾恭子、中山哲也、吉江大ら(2019)脳内制御T細胞はアストログリオシスを抑制し神経回復を増強する。Nature 565: 246-250CrossrefCASPubMedWeb of Science®Google Scholar
Jankowsky JL, Fadale DJ, Anderson J, Xu GM, Gonzales V, Jenkins NA, Copeland NG, Lee MK, Younkin LH, Wagner SL et al (2004) Mutant Presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of the 42-specific gamma secretase. Hum Mol Genet 13: 159-170CrossrefCASPubMedWeb of Science®Google Scholar
Jurk D, Wang C, Miwa S, Maddick M, Korolchuk V, Tsolou A, Gonos ES, Thrasivoulou C, Saffrey MJ, Cameron K et al (2012) Postmitotic neurons develop a p21-dependent senescence-like phenotype driven by the DNA damage response. Aging Cell 11: 996-1004Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
Katsimpardi L, Litterman NK, Schein PA, Miller CM, Loffredo FS, Wojtkiewicz GR, Chen JW, Lee RT, Wagers AJ, Rubin LL (2014) Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors. Science 344: 630-634CrossrefCASPubMedWeb of Science®Google Scholar
Keren-Shaul H, Spinrad A, Weiner A, Matcovitch-Natan O, Dvir-Szternfeld R, Ulland TK, David E, Baruch K, Lara-Astaiso D, Toth B et al (2017) A unique microglia type associated with restricting development of Alzheimer's disease. Cell 169: 1276-1290.e17CrossrefCASPubMedWeb of Science®Google Scholar
小松正人、和栗聡、千葉崇、村田聡、岩田純一、谷田一、上野毅、小池光、内山靖、小南英明ら(2006)中枢神経系におけるオートファジーの喪失はマウスの神経変性につながる。Nature 441: 880-884CrossrefCASPubMedWeb of Science®Google Scholar
Kukreja L, Kujoth GC, Prolla TA, Van Leuven F, Vassar R (2014) 加齢によるmtDNA変異の増加は、アルツハイマー病のAPP/Ldトランスジェニックマウスにおいてアミロイド蓄積と脳萎縮を促進する。Mol Neurodegener 9: 16CrossrefCASPubMedWeb of Science®Google Scholar
La Manno G, Siletti K, Furlan A, Gyllborg D, Vinsland E, Mossi Albiach A, Mattsson Langseth C, Khven I, Lederer AR, Dratva LM et al (2021) Molecular architecture of the developing mouse brain. ネイチャー 596: 92-96CrossrefCASPubMedWeb of Science®Google Scholar
Labbadia J, Morimoto RI (2015) The biology of proteostasis in aging and disease. Annu Rev Biochem 84: 435-464CrossrefCASPubMedWeb of Science®Google Scholar
Lambert JC, Ibrahim-Verbaas CA, Harold D, Naj AC, Sims R, Bellenguez C, DeStafano AL, Bis JC, Beecham GW, Grenier-Boley B et al (2013) 74,046 人のメタアナリシスでアルツハイマー病の新しい感受性遺伝子座が 11 遺伝子特定されました。Nat Genet 45: 1452-1458CrossrefCASPubMedWeb of Science®Google Scholar
Lee JH, Yu WH, Kumar A, Lee S, Mohan PS, Peterhoff CM, Wolfe DM, Martinez-Vicente M, Massey AC, Sovak G et al (2010) Lysosomal proteolysis and autophagy require presenilin 1 and is disrupted by Alzheimer-related PS1 mutations. Cell 141: 1146-1158CrossrefCASPubMedWeb of Science®Google Scholar
Li T, Liu T, Chen X, Li L, Feng M, Zhang Y, Wan L, Zhang C, Yao W (2020) Microglia induce the transformation of A1/A2 reactive astrocytes via the CXCR7/PI3K/Akt pathway in chronic post-surgical pain. J Neuroinflammation 17: 211CrossrefCASPubMedWeb of Science®Google Scholar
Liston A, Gray DH (2014) 調節性T細胞多様性の恒常的制御。Nat Rev Immunol 14: 154-165CrossrefCASPubMedWeb of Science®Google Scholar
Liston A, Yshii L (2023) T cell drive aging of the brain. Nat Immunol 24: 12-13CrossrefCASPubMedGoogle Scholar
Liston A, Nutsch KM, Farr AG, Lund JM, Rasmussen JP, Koni PA, Rudensky AY (2008) 胸腺皮質における制御性Foxp3+ T細胞の分化。Proc Natl Acad Sci U S A 105: 11903-11908CrossrefCASPubMedWeb of Science®Google Scholar
Liston A, Dooley J, Yshii L (2022) Brain-resident regulatory T cells and their role in health and disease. Immunol Lett 248: 26-30CrossrefCASPubMedGoogle Scholar
Liu X, Hu R, Pei L, Si P, Wang C, Tian X, Wang X, Liu H, Wang B, Xia Z et al (2020) Regulatory T cell is critical for interleukin-33-mediated neuroprotection against stroke. Exp Neurol 328: 113233CrossrefCASPubMedGoogle Scholar
Lopez-Serrano C, Santos-Nogueira E, Francos-Quijorna I, Coll-Miro M, Chun J, Lopez-Vales R (2019) Lysophosphatidic acid receptor type 2 activation contributes to secondary damage after spinal cord injury in mice. Brain Behav Immun 76: 258-267CrossrefCASPubMedWeb of Science®Google Scholar
Luo W, Brouwer C (2013) Pathview: an R/Bioconductor package for pathway-based data integration and visualization. バイオインフォマティクス 29: 1830-1831CrossrefCASPubMedWeb of Science®Google Scholar
Luo W, Friedman MS, Shedden K, Hankenson KD, Woolf PJ (2009) GAGE: General applicable gene set enrichment for pathway analysis. BMC Bioinformatics 10: 161CrossrefCASPubMedWeb of Science®Google Scholar
Magrassi L, Leto K, Rossi F (2013) 神経細胞の寿命は、生物の寿命と無関係である。Proc Natl Acad Sci U S A 110: 4374-4379CrossrefCASPubMedWeb of Science®Google Scholar
Mancuso R, Van Den Daele J, Fattorelli N, Wolfs L, Balusu S, Burton O, Liston A, Sierksma A, Fourne Y, Poovathingal S et al (2019) 幹細胞由来のヒトマイクログリアをマウス脳に移植してヒト疾患の研究へ.Nat Neurosci 22: 2111-2116CrossrefCASPubMedWeb of Science®Google Scholar
Markovic M, Yeapuri P, Namminga KL, Lu Y, Saleh M, Olson KE, Gendelman HE, Mosley RL (2022) Interleukin-2 expands neuroprotective regulatory T cells in Parkinson's Disease. Neuroimmune Pharm Ther 1: 43-50CrossrefGoogle Scholar
Mazucanti CH, Cabral-Costa JV, Vasconcelos AR, Andreotti DZ, Scavone C, Kawamoto EM (2015) Longevity pathways (mTOR, SIRT, insulin/IGF-1) as key modulatory target on aging and neurodegeneration. Curr Top Med Chem 15: 2116-2138CrossrefCASPubMedWeb of Science®Google Scholar
Merlini M, Kirabali T, Kulic L, Nitsch RM, Ferretti MT (2018) Alzheimer病患者の脳における血管外CD3+ T細胞はタウと相関するがアミロイド病理と相関しない:免疫組織化学研究。Neurodegener Dis 18: 49-56CrossrefCASPubMedWeb of Science®Google Scholar
Mittermeyer G, Christine CW, Rosenbluth KH, Baker SL, Starr P, Larson P, Kaplan PL, Forsayeth J, Aminoff MJ, Bankiewicz KS (2012) パーキンソン病に対するAADC遺伝子治療の第1相試験の長期評価. Hum Gene Ther 23: 377-381CrossrefCASPubMedWeb of Science®Google Scholar
Moffat SD, Kennedy KM, Rodrigue KM, Raz N (2007) Human spatial navigationにおける年齢差への海馬外寄与。Cereb Cortex 17: 1274-1282CrossrefPubMedWeb of Science®Google Scholar
Montecino-Rodriguez E, Berent-Maoz B, Dorshkind K (2013) 免疫系老化の原因、結果、および逆転。J Clin Invest 123: 958-965CrossrefCASPubMedWeb of Science®Google Scholar
Mosley RL, Lu Y, Olson KE, Machhi J, Yan W, Namminga KL, Smith JR, Shandler SJ, Gendelman HE (2019) A synthetic agonist to vasoactive intestinal peptide Receptor-2 induces regulatory T cell neuroprotective activities in models of Parkinson's disease. Front Cell Neurosci 13: 421CrossrefCASPubMedWeb of Science®Google Scholar
Ogrodnik M, Salmonowicz H, Gladyshev VN (2019) 細胞性老化と老化における損傷蓄積の概念の統合:老化細胞のクリアランスに関する関連性。Aging Cell 18: e12841Wiley Online LibraryPubMedWeb of Science®Google Scholar
Osorio D, Cai JJ (2021) シングルセルRNAシーケンスデータ品質管理のためのヒトおよびマウス組織におけるミトコンドリア割合の体系的決定。バイオインフォマティクス 37: 963-967CrossrefCASPubMedWeb of Science®Google Scholar
Ou GY, Lin WW, Zhao WJ (2021) Neuregulins in neurodegenerative diseases. Front Aging Neurosci 13: 662474CrossrefCASPubMedGoogle Scholar
Pasciuto E, Burton OT, Roca CP, Lagou V, Rajan WD, Theys T, Mancuso R, Tito RY, Kouser L, Callaerts-Vegh Z et al (2020) Microglia requires CD4 T cells to complete fetal-to-adult transition. セル182号 625-640.e24CrossrefCASPubMedWeb of Science®Google Scholar
Peters A, Rosene DL, Moss MB, Kemper TL, Abraham CR, Tigges J, Albert MS (1996) Neurobiological bases of age-related cognitive decline in the rhesus monkey. J Neuropathol Exp Neurol 55: 861-874CrossrefCASPubMedWeb of Science®Google Scholar
Pierson W, Cauwe B, Policheni A, Schlenner SM, Franckaert D, Berges J, Humblet-Baron S, Schonefeldt S, Herold MJ, Hildeman D et al (2013) Antiapoptotic Mcl-1 is critical for the survival and niche-filling capacity of Foxp3(+) regulatory T cell. Nat Immunol 14: 959-965CrossrefCASPubMedWeb of Science®Google Scholar
Prokop S, Miller KR, Drost N, Handrick S, Mathur V, Luo J, Wegner A, Wyss-Coray T, Heppner FL (2015) Impact of peripheral myeloid cells on amyloid-beta pathology in Alzheimer's disease-like mouse. J Exp Med 212: 1811-1818CrossrefCASPubMedWeb of Science®Google Scholar
Qiu X, Mao Q, Tang Y, Wang L, Chawla R, Pliner HA, Trapnell C (2017) Reversed graph embedding resolves complex single-cell trajectories. Nat Methods 14: 979-982CrossrefCASPubMedWeb of Science®Google Scholar
R Core Team (2021) R: a language and environment for statistical computing. オーストリア、ウィーン: R Foundation for Statistical Computing (https://wwwR-projectorg/)Google Scholar
Reynolds AD, Banerjee R, Liu J, Gendelman HE, Mosley RL (2007) パーキンソン病動物モデルにおけるCD4+CD25+制御性T細胞の神経保護活性。J Leukoc Biol 82: 1083-1094Wiley Online LibraryCASPubMedWeb of Science®Google Scholar
Rincon MY, de Vin F, Duque SI, Fripont S, Castaldo SA, Bouhuijzen-Wenger J, Holt MG (2018) 自己相補型AAV-PHP.Bベクターの全身投与後のマウス中枢神経系におけるアストロサイトおよび神経細胞の広範なトランスダクション. Gene Ther 25: 83-92CrossrefCASPubMedWeb of Science®Google Scholar
Ritzel RM, Crapser J, Patel AR, Verma R, Grenier JM, Chauhan A, Jellison ER, McCullough LD (2016) Age-associated resident memory CD8 T cells in the central nervous system are primed to potentiate inflammation after ischemic brain injury. J Immunol 196: 3318-3330CrossrefCASPubMedWeb of Science®Google Scholar
Robillard KN, Lee KM, Chiu KB, MacLean AG (2016) Rhesus macaquesの寿命によるグリア細胞の形態と密度の変化。Brain Behav Immun 55: 60-69CrossrefPubMedWeb of Science®Google Scholar
Roca CP, Burton OT, Gergelits V, Prezzemolo T, Whyte CE, Halpert R, Kreft L, Collier J, Botzki A, Spidlen J et al (2021) AutoSpill is a principled framework that simplifies the analysis of multichromatic flow cytometry data. Nat Commun 12: 2890CrossrefCASPubMedWeb of Science®Google Scholar
Rodriguez-Arellano JJ, Parpura V, Zorec R, Verkhratsky A (2016) Astrocytes in physiological aging and Alzheimer's disease. ニューロサイエンス 323: 170-182CrossrefCASPubMedWeb of Science®Google Scholar
Safaiyan S, Kannaiyan N, Snaidero N, Brioschi S, Biber K, Yona S, Edinger AL, Jung S, Rossner MJ, Simons M (2016) Age-related myelin degradation burdens the clearance function of microglia during aging. Nat Neurosci 19: 995-998CrossrefCASPubMedWeb of Science®Google Scholar
Schain AJ, Hill RA, Grutzendler J (2014) Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nat Med 20: 443-449CrossrefCASPubMedWeb of Science®Google Scholar
Shaw AC, Goldstein DR, Montgomery RR (2013) Age-dependent dysregulation of innate immune. Nat Rev Immunol 13: 875-887CrossrefCASPubMedWeb of Science®Google Scholar
Sheean RK, McKay FC, Cretney E, Bye CR, Perera ND, Tomas D, Weston RA, Scheller KJ, Djouma E, Menon P et al (2018) Regulatory T-cell expansion with progression of amyotrophic lateral sclerosis: a study of human and a transgenic mouse model. JAMA Neurol 75: 681-689CrossrefPubMedWeb of Science®Google Scholar
Shi L, Sun Z, Su W, Xu F, Xie D, Zhang Q, Dai X, Iyer K, Hitchens TK, Foley LM et al (2021) Treg cell-derived osteopontin promotes microglia-mediated white matter repair after ischemic stroke. Immunity 54: 1527-1542.e8CrossrefCASPubMedWeb of Science®Google Scholar
Spittau B (2017) Aging microglia-phenotypes, functions and implications for age-related neurodegenerative diseases. Front Aging Neurosci 9: 194CrossrefPubMedWeb of Science®Google Scholar
Spitzer SO, Sitnikov S, Kamen Y, Evans KA, Kronenberg-Versteeg D, Dietmann S, de Faria O, Agathou S, Karadottir RT (2019) Oligodendrocyte progenitor cell become regionally diverse and heterogeneous as age. Neuron 101: 459-471.e5CrossrefCASPubMedWeb of Science®Google Scholar
Tiemessen MM, Jagger AL, Evans HG, van Herwijnen MJ, John S, Taams LS (2007) CD4+CD25+Foxp3+ regulatory T cell induce alternative activation of human monocytes/macrophage. Proc Natl Acad Sci U S A 104: 19446-19451CrossrefCASPubMedWeb of Science®Google Scholar
Verreet T, Rangarajan JR, Quintens R, Verslegers M, Lo AC, Govaerts K, Neefs M, Leysen L, Baatout S, Maes F et al (2016) Persistent impact of In utero irradiation on mouse brain structure and function characterized by MR imaging and behavioral analysis. Front Behav Neurosci 10: 83CrossrefPubMedWeb of Science®Google Scholar
Villeda SA, Plambeck KE, Middeldorp J, Castellano JM, Mosher KI, Luo J, Smith LK, Bieri G, Lin K, Berdnik D et al (2014) Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat Med 20: 659-663CrossrefCASPubMedWeb of Science®Google Scholar
Whyte CE, Tumes DJ, Liston A, Burton OT (2022) Do more with less: Having overnight staining through high parameter cytometry. Curr Protoc 2: e589Wiley Online LibraryCASPubMedGoogle Scholar
Yanai S, Endo S (2021) 雄C57BL/6Jマウスのライフスパンにわたる機能的老化:運動、感情、記憶機能の系統的行動解析による老化表現型の定義。Front Aging Neurosci 13: 697621CrossrefPubMedWeb of Science®Google Scholar
Yang Y, He Z, Xing Z, Zuo Z, Yuan L, Wu Y, Jiang M, Qi F, Yao Z (2020) 初期アルツハイマー病におけるインフルエンザワクチン接種は、制御性T細胞の抑制によりアミロイドーシスを救い、APP/PS1マウスの認知障害を改善させることがわかった。J Neuroinflammation 17: 65CrossrefCASPubMedWeb of Science®Google Scholar
Yang H, Park SY, Baek H, Lee C, Chung G, Liu X, Lee JH, Kim B, Kwon M, Choi H et al (2022) amyloid-beta specific regulatory T cellによるadoptive therapy alzheimer's disease alleviates. Theranostics 12: 7668-7680CrossrefCASPubMedGoogle Scholar
Yankner BA, Lu T, Loerch P (2008) The aging brain. Annu Rev Pathol 3: 41-66CrossrefCASPubMedWeb of Science®Google Scholar
Yshii L, Mascali L, Kouser L, Lemaitre P, Marino M, Dooley J, Burton O, Haughton J, Callaerts-Vegh Z, De Strooper B et al (2022a) The AppNL-G-F mouse model of Alzheimer's disease is refractory to regulatory T cell treatment. bioRxiv https://doi.org/10.1101/2022.03.11.483903CrossrefGoogle Scholar
Yshii L, Pasciuto E, Bielefeld P, Mascali L, Lemaitre P, Marino M, Dooley J, Kouser L, Verschoren S, Lagou V et al (2022b) Astrocyte-targeted gene delivery of interleukin 2 specifically increasing brain-resident regulatory T cell numbers and protects against pathological neuroinflammation. Nat Immunol 23: 878-891CrossrefCASPubMedWeb of Science®Google Scholar
Zhang H, Xia Y, Ye Q, Yu F, Zhu W, Li P, Wei Z, Yang Y, Shi Y, Thomson AW et al (2018) In vivo expansion of regulatory T cells with IL-2/IL-2 antibody complex protects against transient ischemic stroke. J Neurosci 38: 10168-10179CrossrefCASPubMedWeb of Science®Google Scholar
Zhao W, Beers DR, Appel SH (2013) 筋萎縮性側索硬化症の病態進行における免疫介在性機構。J Neuroimmune Pharmacol 8: 888-899CrossrefPubMedWeb of Science®Google Scholar
Zheng GX, Terry JM, Belgrader P, Ryvkin P, Bent ZW, Wilson R, Ziraldo SB, Wheeler TD, McDermott GP, Zhu J et al (2017) Massively parallel digital transcriptional profiling of single cell. Nat Commun 8: 14049CrossrefCASPubMedWeb of Science®Google Scholar
Zhou K, Zhong Q, Wang YC, Xiong XY, Meng ZY, Zhao T, Zhu WY, Liao MF, Wu LR, Yang YR et al (2017) Regulatory T cells ameliorate intracerebral hemorrhage-induced inflammatory injury by modulating microglia/macrophage polarization through the IL-10/GSK3beta/PTEN axis. J Cereb Blood Flow Metab 37: 967-979CrossrefCASPubMedWeb of Science®Google Scholar
ぜんじょう
次の記事
PDFをダウンロード
ジャーナル
ホーム
最新号
アーカイブ
アーティクルコレクション
対象分野
EMBOプレス
オンライン ISSN 1757-4684
著者向け
記事を投稿する
著者ガイドライン
目的・範囲
EMBO Press Policies
ライセンス&チャージ
編集部へのお問い合わせ
個人情報保護方針
INFORMATION
広告を出す
転載・許可について
ニュース
カスタマー・サービス
STAY CONNECTED
エンボ
について
資金調達と受賞歴
イベント情報
科学政策
メンバー紹介
ラボリーダーシップコース
ソースデータ
© 2023
この記事が気に入ったらサポートをしてみませんか?
