尿中マイクロバイオームと生物学的治療: 尿路感染症の新たな治療法
本文へスキップ記事へスキップ
エルゼビアロゴ
微生物学研究
259巻 2022年6月 127010号
尿中マイクロバイオームと生物学的治療: 尿路感染症の新たな治療法
https://www.sciencedirect.com/science/article/pii/S0944501322000507

著者リンク オーバーレイパネルCiara Kenneally, Craig P. Murphy, Roy D. Sleator, Eamonn P. Culligan
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.micres.2022.127010
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
要旨
尿路に存在する微生物群集(ウロバイオーム)の発見は、尿不妊やそれに伴う排尿障害に関するこれまでの学説を根本的に変えた。培養技術および培養に依存しないDNA配列決定技術の最近の進歩により、ウロバイオームにおける常在微生物群集の特徴が明らかになり、その結果、群集の不均衡が感染症や疾患の原因となる可能性が示された。ポスト抗生物質の時代を迎え、多剤耐性(MDR)泌尿器病原体に対する標準的な抗菌薬治療の有効性は大幅に低下している。微生物に基づく治療法、および抗生物質以外の治療法としての可能性をめぐる予備的研究が蓄積されつつある。このような状況において、ウロバイオームの研究は著しく遅れており、その構成成分の基本的な役割に関する知識は不足している。ここでは、尿路感染症(UTI)の観点から、ウロビオームが健康状態や疾患状態にどのような影響を及ぼすのかについて、特にウロビオームに関する技術の現状について概説する。さらに、特に細菌干渉、プロバイオティクス、抗菌ペプチド、バクテリオシン、バクテリオファージに焦点を当て、尿路感染症治療に大きな進歩をもたらす可能性のある新規生物学的治療薬の開発について論じる。
前の記事へ次の記事へ
キーワード
抗菌薬耐性無症候性細菌尿バイオセラピューティクスユーロバイオーム逆病原性大腸菌尿路結石症
はじめに
人体には多様な微生物群集が宿主として存在し、互いに共生関係を築いている(Sleator, 2010)。ヒトマイクロバイオームに関する広範な研究により、人体とその外部環境の両方に生息する微生物について、これまでにない理解が得られている(Culligan et al.) その結果、マイクロバイオームの代謝機能や免疫機能、微生物の相対的な存在量間の相互に関連する動態について多くのことが分かってきた(Rizzetto et al., 2018, Visconti et al.) しかし、身体のすべての部位が最初の調査に適しているとは考えられなかった。
尿路はもともと無菌環境であると考えられていたため、初期のマイクロバイオーム研究には含まれていなかった(Magistro and Stief, 2019)。細菌を含む尿サンプルは、サンプリングや微生物学的分析に伴う困難のため、外部環境によって汚染されていると考えられていた(Ainsworth, 2017)。しかし、ここ10年で尿中マイクロバイオーム(urobiome)の存在が認められ、複雑な微生物群集から構成されていることが示された(Wolfeら、2012年、Whitesideら、2015年、Antunes-Lopesら、2020年、Jonesら、2021年)。比較的最近の研究であるが、「コア」ウロバイオームが存在し、微生物群集の周期的なシフトが感染につながるという仮説がある(Lewisら、2013、Ammitzbøllら、2021、Zandbergenら、2021)。実際、ヒトにおける最も一般的な細菌感染症の1つは尿路に影響を及ぼす(Guglietta, 2017)。世界的には、尿路感染症(UTI)は年間〜1億5,000万件の感染症を引き起こし、院内感染全体の〜40%を占めている(Nicolle, 2008, Totsika et al.) 尿路結石の罹患率は女性に偏っており、女性の50%以上が生涯に少なくとも1回は尿路結石を発症している(Foxman, 2014)。年齢層によってリスク因子が異なる傾向があり、尿道が短いことやホルモンの変動など、解剖学的・生理学的な違いにより、全体的に女性は男性よりも多くの尿路結石を発症する(Abelson et al.) 性交渉の頻度が高いことは若いコホートでは危険因子であり、エストロゲンレベルの低下は閉経後の女性に尿路結石を発症しやすくする(Alperinら、2019、Jung and Brubaker、2020、Priceら、2020b)。さらに、米国では3人に1人の女性が24歳までに初めての尿路結石で抗生物質治療を受けることになる(Foxmanら、2000年)。尿路病原体リザーバーは、尿路やその周辺の膣や腸内細菌叢に存在することが多く、初感染から6ヵ月以内に最大30%の人に尿路結石を再発させる(Vagios et al.) このように感染症の再発率が高いため、多額の医療費がかかる。米国だけでも、尿路結石の経済的負担は年間35億ドルを超えると推定されている(Flores-Mireles et al.)
尿路結石に関連する負担は経済的コストだけでなく、尿路病原体間の抗菌薬耐性(AMR)が憂慮すべき速度で進化し続けている(Hrbacek et al.) 従来の抗生物質療法は、ウロビオームの長期的な変化、慢性再発性膀胱炎、MDR病原体の発生を引き起こし、しばしば感染エピソードの長期化に関連する(Raz, 2001, Kostakioti et al.) にもかかわらず、広域抗生物質は依然として尿路結石の第一選択薬である(Bonkatら、2020年)。その結果、現在、尿路病原体の約80%が少なくとも2種類の抗生物質に対して耐性を示すようになっている(Ahmed et al.) したがって、MDR尿路結石は現在、現実的かつ実質的な健康上の脅威となっている(Sihra et al.)
現在のところ、ウロビオームと宿主との間のメカニズム的な関係に関する機能的な知識は曖昧なままである(Jones-Freemanら、2021)。しかし、他の身体部位に常在する微生物群集は、宿主の健康維持に重要な役割を果たすことが知られている(Krishnanら、2017、Dimitri-Pinheiroら、2020、Manorら、2020)。システム生物学の原理と「オミックス」技術をさらに応用することで、ウロバイオームの機能的能力が解明され、泌尿生殖器科の診断・治療アプローチに役立つ可能性がある(Bullman et al.) このことは、臨床診療においても価値があると思われ、臨床検査中に標的とする診断バイオマーカーを同定できる可能性がある(Claesson et al.) さらに、このような共同生態系に由来する微生物は、天然の生物学的ツールとして中心的な役割を果たす可能性があり、工学的に設計された場合には、新規の治療的介入として有望な可能性を示す(Sleator and Hill, 2008a, Sleator and Hill, 2008b)。ここでは、尿路内の生きた生物治療薬に関する現在の知見と、尿路の健康に対する有益な貢献が期待される生物治療薬について概説する。また、ウロバイオームの塩基配列を決定するための新たな方法と技術、およびそのようなツールが尿路の健康な微生物群集と感染した微生物群集との間の変化を解釈することを可能にするために与えた洞察についても述べる。
方法論の説明
SCOPUS、PubMed、Google Scholarを用いて、開始時から2021年9月までの文献検索を行った。キーワードは以下の通りである: Microbiome OR 'Asymptomatic Bacteriuria' OR 'Urobiome' AND ('UTI' OR 'Interstitial Cystitis' OR 'Pyelonephritis' OR 'Antimicrobial Resistance' OR 'Uropathogens') OR 'UTI' AND ('Asymptomatic Bacteriuria' OR 'Probiotics' OR 'Bacteriophage' OR 'Antimicrobial Peptide' OR 'Bacteriocin')。検索された論文の種類は、原著論文、動物モデル研究、ランダム化比較試験、臨床試験、レビューなどであった。最初の検索で766の論文が同定され、そのすべてをタイトルと抄録でレビューし、適格性を審査した。除外された論文は、抄録がないもの、英語で書かれていないもの、尿サンプリング法の情報がない臨床研究であった。尿中マイクロバイオーム
3.1. 尿培養
ヒトマイクロバイオームプロジェクト(HMP)の設立により、ヒトの健康と疾患における微生物の役割についての理解が深まった(Human Microbiome Project Consortium, 2012)。尿路は無菌環境であるという、現在では時代遅れとなった信念のため、HMPでは特徴付けるべき身体部位として含まれていなかった(Hilt et al.) しかし、最適化された培養法と培養に依存しないDNA配列決定技術により、尿路内のバイオマスの少ない微生物群集が明らかになってきた(Wolfe and Brubaker, 2015)。
従来の尿培養では、35℃で好気的に培養した5%ヒツジ血液寒天培地とマッコンキー寒天培地を用いている(Hilt et al.) 尿路結石を診断する場合、このような培養法では検出能力に限界があり、好気性で潔癖性のグラム陰性尿路病原体の増殖が好まれる(Wolfe et al.) 診断の「ゴールドスタンダード」は、尿路結石を引き起こす細菌尿の適切な診断のために、105 CFU/ml以上の定量的閾値に依存している(Nicolle et al.、2005)。しかし、標準的な尿培養では推定90%の偽陰性率が報告されているため、このような検出方法の妥当性には疑問がある(Hilt et al.)
強化された定量的尿培養(EQUC)は、臨床的に関連性のある尿中微生物の検出を改善し、さらにウロビオーム中の常在微生物および病原性微生物についての理解を深める可能性がある(Price et al.) expanded-spectrum EQUCプロトコールでは、尿量を増やし、酸素または二酸化炭素濃縮雰囲気の異なる増殖培地を追加してプレーティングを行うが、合理化された適応により、臨床医が泌尿器病原体の治療必要性を評価する際に十分な情報を提供できる可能性がある(Hilt et al, 2014, Pearce et al, 2014, Price et al, 2016)。血液寒天培地、コリスチン-ナリジクス酸寒天培地、およびMacConkey寒天培地は、合理化されたEQUCプロトコールで利用され、5%CO2中で培養され、尿サンプル中の優占分類群であるウロタイプの検出を多様化する(Priceら、2016)。ウロタイプは、ウロバイオーム内の群集プロフィールを示すもので、通常、1つの生物によって相対的な存在量が支配されている(Gottschick et al.) DNA配列決定のさらなる進歩により、クラスター解析における操作分類学的単位(OTU)の相対的存在量に基づくウロタイプの同定が増加している(Pearceら、2015、Ammitzbøllら、2021)。標準的な尿培養では既知の泌尿器病原体の33%しか検出されなかったが、合理化されたEQUCプロトコルでは84%が検出された(Price et al.) 105CFU/ml以上の閾値とは対照的に、EQUC法は一般的に102~105CFU/mlの尿を検出することができ、尿路微生物叢のようなバイオマスの少ない群集の状況において有用である(Mueller et al.)
3.2. 尿中マイクロバイオームの培養非依存シークエンシング
平均して、EQUCプロトコルは、ウロバイオームに存在する全微生物属の約72%を捕捉すると推定されている(Thomas-White et al.) オミックス」時代の幕開けにより、DNA配列決定技術が特定の環境に生息する微生物組成の集合体を評価できるようになり、検出能力が向上した(Franzosa et al.) 大規模なメタゲノム解析プロジェクトは、新規遺伝子や生物種の検出につながっただけでなく、生存に必要な代謝経路や生理的適応という観点から、ヒトマイクロバイオームの機能的特徴づけを拡大してきた(Sberro et al.)
マイクロバイオームを評価する際には、2つのシーケンス戦略が一般的に採用されている: 16 SリボソームRNA(rRNA)遺伝子アンプリコンシークエンスと全ゲノムシークエンス(WGS)である(Human Microbiome Project Consortium, 2012, Thomas-White et al.) 尿培養と組み合わせた16 S rRNA遺伝子アンプリコンシークエンシングは、ウロバイオームを特徴付ける研究においてより一般的に採用されている(Karstens et al.) 16 S rRNA遺伝子には9つの超可変領域(V1-V9)が存在する(Van de Peer et al., 1996)。系統的な関連性を評価する際には、特異的な多型を含む超可変領域が利用される(Brubaker and Wolfe, 2015, Thomas-White et al.) 超可変領域が異なると分類学的同定が制限され、微生物の分類群が過小または過大に示される可能性があるからである(Mizrahi-man et al.) 例えば、V1領域とV6領域の両方は、他の超可変領域と比較すると不十分であり、領域の長さが制限され、平均配列同一性が低いため、系統解析において最適ではない性能を示したと報告されている(Yu and Morrison, 2004, Graspeuntner et al.) 異なる超可変領域がウロバイオームの組成を把握する際にどのような性能を発揮するかを評価する直接的な比較はまだ行われていない(Karstens et al.) WGSは、DNA配列全体をシーケンスすることにより、完全なゲノムを包括的に特徴付けることができる(Neugent et al.) WGSはより高価な技術であるが、より高い解像度のシーケンスリードを生成し、通常より詳細な分類学的および機能的プロファイルを提供する(Franzosa et al.) 例えば、FimHアドヘシンにおける変異は、WGSを用いて糞便分離株と尿分離株で比較を行ったところ、尿路病原性大腸菌(UPEC)分離株のB2系統群と有意な相関が認められた(Nielsen et al.) WGSはまた、培養のみの手法ではこれまで同定されなかった嫌気性細菌(Actinobacteria)、ファーミキューテス(Firmicutes)、バクテロイデーテス(Bacteroidetes)のメンバーの同定を可能にした(Thomas-White et al.
Moustafaら(2018)による研究では、シーケンス法の相補性が評価された。排尿サンプル中の低存在DNAを検出する場合、16 S rRNA遺伝子シーケンスの方が高い感度を示した(Moustafa et al.) とはいえ、16 S rRNA遺伝子シーケンスでは分類学的プロファイリングと機能的解像度に限界があるのに対し、WGSではますます特異的な機能的分類と分類学的分類が可能になる(Jovel et al.) しかしながら、WGSはヒト宿主、一般的には皮膚または膣マイクロバイオームから、おそらく尿サンプリング法の結果として得られた汚染物質を増幅する可能性がある(Moustafa et al.) いずれの配列決定法に関連する限界も、生存していない破裂した細菌が検出される可能性があることである(Karstensら、2018、Boersら、2019)。生存していない細菌の同定は、それらがかつてマイクロバイオーム内で役割を果たし、機能的知識を高める可能性があるため、依然として有益であるという仮説がある(Aragón et al.) しかし、これはウロバイオームの現存状態を評価する際に誤解を招く可能性がある。そのため、EQUCとDNAシーケンス技術の併用が推奨され、EQUCによって生きた微生物を同定することができる(Karstens et al.)
どちらの技術も、尿サンプルからまだ培養されていない生物を同定している(Foutsら、2012、Garrettoら、2018、Cummingsら、2020)。16 S rRNA遺伝子配列決定で分析した尿サンプルには、培養法では同定されなかったAtopobium属が含まれていた(Aragón et al.) 非原核生物もまた、培養のみのプロトコルと比較してWGSを用いてより頻繁に検出される、すなわち真核酵母種のCandidaである(Moustafa et al.) アトポビウムとカンジダは以前、膣マイクロバイオーム内で同定されており、存在量の増加は膣感染の発症と相関している。アトポビウムは細菌性膣炎に罹患した人由来のサンプルで同定されており(Ferrisら、2004年)、カンジダ種は性感染症や膣鵞口瘡と関連している(Moustafaら、2018年)。これまでのところ、ウロバイオームをめぐる研究のほとんどは、16 S rRNA遺伝子配列決定による分類学的プロファイリングに焦点を当てた限られた規模のものであり、したがって、ウロバイオームのメンバーの機能性に関する知識は依然として限られている(Jones-Freemanら、2021年)。
3.3. 尿中マイクロバイオームのプロファイリング
尿は通常、4つの門の細菌で構成されている: ファーミキューテス(Firmicutes)、バクテロイデーテス(Bacteroidetes)、プロテオバクテリア(Proteobacteria)、およびアクチノバクテリア(Actinobacteria)である(Karstens et al. コア」ウロバイオームが解明されつつあるが、女性が罹患する泌尿器科疾患は多岐にわたるため、尿路を分析するこれまでの研究のほとんどは、女性のウロバイオームに焦点を当てている(Schneeweiss et al.、2016、Brubaker and Wolfe、2017)。また、尿サンプリング技術にも不一致があり、排尿された尿はしばしば尿道後汚染の影響を受ける(Wolfeら、2012、Brubakerら、2021)。さらに最近の研究では、尿サンプルと膀胱粘膜組織サンプルで検出される細菌の違いも明らかにされている(Mansour et al.) 尿と一緒に組織サンプルを採取すれば、さまざまな膀胱疾患についてさらに深い洞察が得られるだろうが、サンプリング技術は侵襲的である(Mansour et al.) とはいえ、男性と女性のウロバイオームの違いは報告されている(Gottschick et al.)
男性ウロビオームも女性ウロビオームもファーミキューテス門で占められており、一方、男性ウロビオームでは放線菌とバクテロイデーテス門が欠如している(Nelson et al.) 全体として、男性ウロビオームはあまり複雑ではない環境として描かれており、異なる属の相対的な存在量に基づいて女性ウロビオームと区別されるのが一般的である(Foutsら、2012、Ceprnjaら、2021)。コリネバクテリウム(Corynebacterium)は、男性ウロビオームの支配的な属として同定されており、皮膚マイクロバイオーム内に一般的に存在する属である(Foutsら、2012年)。男性ウロビオームと女性ウロビオームの両方で一般的に同定される他の細菌属には、Lactobacillus、Streptococcus、Staphylococcusが含まれる(Gottschickら、2017)。一般に、70歳以上コホートにおける男性のウロビオームは、女性のそれよりも多様であるようで、前立腺、腎臓、膀胱疾患のリスク上昇と相関している可能性がある(Wojciuk et al.) 例えば、男性の皮膚マイクロバイオームに存在するものと類似したプロピオニバクテリウム・アクネス株は前立腺がん患者でより高い存在度を示したが、腸内細菌科とアクチノバクラム尿路病原体は良性腫瘍で優勢であった(Makら、2013、Shresthaら、2018)。Streptococcus anginosus、Anaerococcus spp.、Varibaculum cambriense、およびPropionimicrobium lymphophilumを含む炎症性細菌群もまた、男性の泌尿器科感染症および悪性組織に関連している(Domannら、2003、Williams、2015、Shresthaら、2018)。男性のウロバイオームに存在する微生物は、皮膚マイクロバイオームに存在する微生物に似ているようであり、一方、女性のウロバイオームは膣マイクロバイオームとの共通性を示している(Foutsら、2012、Lewisら、2013)。
女性のウロバイオームにおけるウロタイプは、一般的にシゲラ、ラクトバチルス、腸球菌、ガードネレラ、プレボテラ、スネアチア、エシェリヒア、ストレプトコッカスで占められている(Gottschickら、2017、Priceら、2020a)。乳酸桿菌は、健康な女性のウロビオームにおいて支配的な属として同定されている(Hiltら、2014、Pearceら、2015)。乳酸桿菌は膣マイクロバイオームにも豊富に存在し、特定の種が適切なレベルで存在する場合、健康的な膣の状態に寄与し、低いpHを維持し、病原体から保護する(Marrazzo, 2011)。同様の機能が泌尿器マイクロバイオームにおける乳酸桿菌についても提唱されており、閉経後の女性における乳酸桿菌属の減少と、それに伴う再発性尿路結石(rUTI)の増加に相関している(Stapleton, 2016)。乳酸と過酸化水素の存在下での尿路病原体増殖の抑制も示されている;ラクトバチルス・ラムノサスとラクトバチルス・ロイテリの代謝の副産物である(Cadieux et al.) 閉経前女性における乳酸桿菌の低~中程度のレベルは、尿失禁とも相関しており、健康的なマイクロバイオームからのアンバランスを示している(Komesu et al.) ウロバイオームの分類学的プロファイリングは著しく進歩しているが、性ホルモン、月経周期、性交渉などの時間的要因が微生物組成の変化にどのように寄与しているかはまだわかっていない(Gümüşら、2019、Priceら、2020b)。女性のウロバイオームの時間的動態に焦点を当てた初期の研究では、月経中の皮膚マイクロバイオームと類似していること、および性交渉に関連してブドウ球菌とレンサ球菌が増加することが明らかにされている(Priceら、2020b)。
ガードネレラも尿サンプルから頻繁に分離される属の一つで、より具体的にはガードネレラ膣炎である(Pearceら、2014、Pearceら、2015、Karstensら、2016)。ガードネレラはまた、性交後の膣マイクロバイオームで増加すると報告されている(Gajerら、2012年)。G.vaginalisは細菌性膣炎に罹患している女性に多く存在し、女性が尿路結石を発症するリスクの増加と関連している(Ravelら、2011、Morrillら、2020)。Gilbertら(2017)は、マウスモデルを用いて、G. vaginalisが、潜在的な細胞内リザーバーからUPECの再出現を引き起こす駆動因子として機能する可能性があることを明らかにした。このことは、G. vaginalisの過剰増殖が女性における腎盂腎炎のもっともらしい引き金となり、次第に重篤な症状を引き起こし、重篤な腎臓感染と上皮剥離をもたらすことを示唆している(Gilbertら、2017、O'Brienら、2020)。女性のウロビオームにおけるガルドネレラの高存在は、その後の乳酸桿菌種の減少と関連しているが、健康な個体にもガルドネレラが存在するため、生物学的異常の関係は検証されていない(Pearce et al.) 属レベルの存在量の変化の意味をさらに評価し、有望なバイオマーカーを同定するには、大規模な縦断的研究が必要である。
3.4. 尿路結石時の尿中マイクロバイオームの変調
3.4.1. 再発性尿路結石
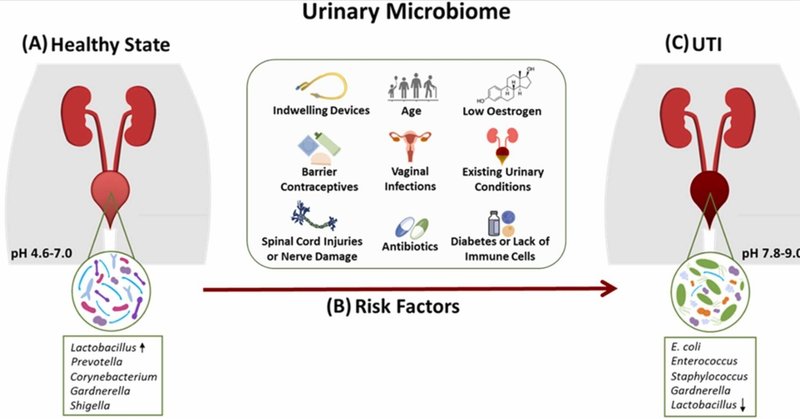
UPECは尿路結石症の病因を支配しており、標準的な培養法を用いて検査した臨床尿検体の80%から検出される(Klein and Hultgren, 2020)。しかし、新興の尿路病原体の検出により、これまで大腸菌中心であった尿路結石の描写が減少しつつある(Priceら、2018年、Hochstedlerら、2021年)。緑膿菌、エンテロバクター・エアロゲネス、クレブシエラ・ニューモニエ、アエロコッカス・ウリネー、プロテウス・ミラビリス、ストレプトコッカス・アンギノサスなどの数種類が、最新のDNA配列決定法によって尿路結石の原因菌として同定されつつある(Priceら、2016、Priceら、2018)。健常時と尿路結石時のウロバイオームの比較を図1に示す。
図1
ダウンロード: 高解像度画像のダウンロード(249KB)
ダウンロード フルサイズ画像のダウンロード
図1. 健常時と尿路結石時の尿中マイクロバイオームの比較。 A)プレボテラ属や赤痢菌などのほとんどの細菌は、健常男性と女性の両方のウロバイオームで共通して認められる。ラクトバチルス属とコリネバクテリウム属は、それぞれ女性と男性のウロバイオームを支配している。(B)尿路結石症発症の素因となる危険因子の概要。免疫不全、高齢者、尿道留置器具、尿路性器感染症や抗生物質の使用歴がある場合、感染リスクが非常に高くなる。(C)尿路結石は、大腸菌、腸球菌、ブドウ球菌などの一般的な尿路病原体の増加、およびそれに続く乳酸菌の減少と関連している(矢印)。また、Gardnerella属菌が感染に関与することも多い。
UPECの病態は、依然として再発性感染症の主な懸念事項である。再感染は、先行する尿路結石から6ヵ月以内に約25%~30%の女性に起こる(Vagiosら、2020年)。rUTIの病態生物学はまだ完全には解明されておらず、rUTI患者を対象とした縦断的なメタゲノム解析も不足している。提唱されているメカニズムの1つは、消化管や泌尿生殖器の上皮リザーバーに生息するUPECから再感染が進展するというものである(Nielsenら、2014a)。UPEC分離株は尿道周囲にコロニー形成し、その後尿道へと移動し、尿路結石症の発症過程で膀胱へと上昇する(Flores-Mirelesら、2015年、Terlizziら、2017年)。UPECは尿路性器上皮細胞に付着した後、細胞質に侵入して凝集を引き起こし、典型的にはバイオフィルム様マトリックス内に細胞内細菌群集(IBC)を形成することがある(Hirakawa et al.) IBCの存在は、急性膀胱炎やrUTIに罹患している個体で検出されている(Rosenら、2007、Robinoら、2013)。Schreiberら(2017年)は、18件のrUTIのうち12件で同系統のrUTIを検出したが、これは潜在的なリザーバーに起因している可能性が高い。閉経後の女性の膀胱や膣壁には、尿路病原体内部リザーバーが残存しているようであり、rUTIのリスクを高めている(De Niscoら、2019年)。
IBCの形成に関与するUPEC株や糸状尿路病原体は病原性が高く、再感染、抗菌薬耐性、感染の慢性化に寄与する(Hannanら、2012、McLellan and Hunstad、2016)。系統解析では通常、大腸菌は4つの主要グループ(A、B1、B2、D)に分類されるが、最新のPCR法ではさらに3つのグループ(C、E、F)が認められている(Clermont et al.) 系統群B2とDは病原性UPEC株と関連している(Schreiberら、2017年、Biggelら、2020年)。特に、系統群B2およびDに由来する腸管由来のUPECクローンは、より高いレベルの多剤耐性を有する(Nielsenら、2014a)。糞便中のUPECの存在は、泌尿生殖器と腸のマイクロバイオームが相互に排他的ではないことを示している。Fordeら(2019)は、rUTIの病因を理解するために、5年間にわたる排尿および糞便検体からの病原性大腸菌ST131系統の集団動態を評価した。ある個人は、5年間にわたって再発を引き起こした尿路結石誘発性大腸菌ST131亜種の腸管リザーバーを保有しており、腸とウロバイオームの関係がさらに関連づけられた(Forde et al.) 興味深いことに、ST131クローンは当初、より多くの抗生物質に対して耐性を示し、5年目の終わりまでに複数の耐性プラスミドを失った(Forde et al.) 著者らは、耐性プラスミドの消失は変動する抗生物質レジメンへの適応メカニズムであることを示唆した(Forde et al.) このことは、IBCにおける細菌尿の進化とウロバイオームへの影響について、時間的かつ長期的な分析が必要であることを示唆している。持続的な細菌叢の変化は、高齢者における潜伏性リザーバーの増加と相関しているようであり、抗生物質治療にもかかわらず、rUTIの60%以上は元の尿路病原株によるものである(Russoら、1995年、Thänertら、2019年、Nielsenら、2021年)。
3.4.2. 多菌性尿路結石
標準的な尿培養は、尿路結石は一般的に単菌感染症であるという信念に依存している(Smelov et al.) このため臨床検査室では、複数のコロニー形態を汚染とみなし、「単一菌種UTI」という概念が定着している(Kline and Lewis, 2016)。多菌性尿路結石をめぐる研究は不足しているが、このような感染症は以前考えられていたよりも一般的であるという仮説がある(Fourcade et al.) 症候性尿路結石の女性の約20%は、尿検体が培養陰性である(Ferryら、2007年)。培養陰性には、多菌が増殖している検体や105 CFU/ml未満の病原体が存在する検体が含まれるため、誤解を招きやすい用語である(Kline and Lewis, 2016)。ある研究では、女性の42%が、少なくとも1つのグラム陽性菌と1つのグラム陰性菌が存在することを特徴とする多菌性感染を呈していたと報告している(Kline and Lewis, 2016, Price et al.) また、高齢者の尿路結石の33%は多菌性であると推定されている(Croxall et al.) 多菌性尿路結石は、免疫不全者や留置カテーテルを使用している人の間で頻繁に報告されている(Kline and Lewis, 2016)。Werneburgと共著者(2020年)は、カテーテル留置後7時間という早い段階でカテーテル上の多菌性尿路病原体バイオフィルムを検出し、留置時間が長くなるにつれてさらに進行し、平均26日後までに近位部と遠位部にバイオフィルムが形成された。その結果、これらの感染症は治療されないか、不適切な抗生物質介入が行われることになる。この有害な影響はWerneburgら(2020年)によっても指摘されており、10個の配列サンプルのうち4個がβ-ラクタム、キノロン、アミノグリコシド、テトラサイクリン耐性遺伝子を持つことが指摘されている。
抗生物質が泌尿生殖器のマイクロバイオームに悪影響を及ぼし、多菌性尿路結石やrUTIの発症を促すことは以前から提唱されている。Raniら(2017)による、予防的トリメトプリム-スルファメトキサゾール(TMP-SMX)投与を受けた腎移植患者の膀胱マイクロバイオームをメタゲノムシークエンシングにより解析した先行研究において、矛盾が示された。2つの日和見病原体、エンテロコッカス・フェカリス(Enterococcus faecalis)と大腸菌(E. coli)はともに、治療後に配列決定されると存在量が増加し、一方で一般的な微生物の多様性はその後減少することが観察された(Rani et al. 興味深いことに、E. faecalisとUPECは、尿路や外科的創傷内で多細菌感染を引き起こすことが以前に報告されている(Keogh et al.) この2つの病原体の間には相乗関係があり、L-オルニチンはE. faecalisによって分泌され、鉄が制限された環境において大腸菌の鉄取り込みシステムであるefeUOB複合体を刺激し、大腸菌の増殖とバイオフィルム形成が促進されることが報告されている(Keogh et al.) 大腸菌はまた、酵母であるキャンディダ・アルビカンスと相乗作用を示し、同時に互いの増殖を増加させることから、真菌性尿路結石の病因のひとつと考えられている(De Brucker et al.) しかし、すべての種間相互作用が病原体にとって有益であるとは限らない。例えば、緑膿菌は大腸菌よりも優勢で、N-アシル-L-ホモセリンラクトンなどの病原性因子を分泌するためと思われる増殖低下を引き起こす(Qin et al.) 一般的に、ウロビオーム内の多細菌の関係をめぐる包括的な研究は不足しており、そのため微生物の相互作用の解釈はほとんど不明なままである(Azevedo et al.)
3.4.3. 多菌バイオフィルム
バイオフィルム形成は、細胞外高分子物質マトリックスに包まれた生物の集合体から生じる、多微生物群集に関連する一般的な属性である(Penesyan et al.) カテーテル関連尿路結石(CAUTI)の微生物培養および培養非依存性検査により、尿道カテーテルを汚染するバイオフィルムは通常、多菌性であることが判明している(Frank et al.、2009、Galván et al.、2016)。Holáら(2010)は、CAUTIのわずか12.5%が単菌性であったという同様の観察を報告している。しかし、彼らの知見は培養技術に依拠したものであり、メタゲノム解析法を用いれば、報告された12.5%がさらに減少する可能性がある。これまでに尿道カテーテルで確認された多菌感染症に関連する菌には、E. faecalis、P. mirabilis、K. pneumoniaeなどがある(Frankら、2009年、Fourcadeら、2015年、Armbrusterら、2017年、Werneburgら、2020年)。泌尿生殖器管内におけるほとんどの種間相互作用の根底にあるメカニズムはまだ解明されていない。このような微生物間相互作用の背後にある説明として提案されているものには、病原性因子のアップレギュレーション、創傷治癒の低下、抗生物質感受性の変化をしばしば伴う代謝シグナル相互作用が含まれる(Pastar et al.、2013、De Vos et al.、2017、Trizna et al.、2020)。
蓄積されたエビデンスによると、多微生物間の相互作用は、最終的に抗生物質の有効性を阻害することにより、抗菌薬耐性を高めることが示唆されている(Orazi and O'Toole, 2020)。その結果、バイオフィルムを介した耐性によって、多微生物群集は高濃度の抗菌剤に耐えることができるようになる(Gaston et al.) 細胞外マトリックスもまた、β-ラクタマーゼを含み、抗生物質が標的菌に到達する前に、侵入時に分解することで、さらなる耐性メカニズムを提供する(Høiby et al.) 例えば、多菌性尿路結石から分離された大腸菌は、侵襲性が高く、シプロフロキサシンやトリメトプリムなどの抗生物質に対する耐性が増加している(Croxall et al.) 種間相互作用によって、混合種バイオフィルムは耐性を増強するか、抗菌薬治療に対して耐性を示す。エンテロコッカス属とプロテウス属は尿路や留置カテーテルに常在し、悪名高いバイオフィルム産生菌である(Fourcadeら、2015、Armbrusterら、2017)。憂慮すべきことに、P. mirabilisとE. faecalisのバイオフィルムは抗菌薬を著しく制限し、β-ラクタム系抗生物質、アミノグリコシド系抗生物質、フルオロキノロン系抗生物質、カルバペネム系抗生物質に対する耐性を付与する(Ch'ngら、2019、Gastonら、2020)。さらに、ウレアーゼ産生は主にP. mirabilisと関連しており、尿閉塞やカテーテル上での結晶性バイオフィルム形成を引き起こす(Soto, 2014, Pelling et al.) 結晶層はまた、カテーテル上の多種のバイオフィルムに高度の保護を与え、プレコート抗菌剤に対する耐性を提供する(Gohら、2017)。このような種間相互作用の結果、代謝産物の相互摂取や抗生物質に対する感受性の変化が生じ(Shortら、2014、Botteryら、2021)、単菌感染と比較して疾患の進行が促進され、患者の転帰が悪化する一因となる。
抗生物質耐性
尿路結石は抗生物質の誤用によって不釣り合いな影響を受けており(O'Gradyら、2019)、MDR尿路病原体の有病率が増加している(Mazzariolら、2017)。現在、尿路結石を定義する臨床ガイドラインは曖昧な解釈につながり、しばしば不必要な広域抗生物質の投与につながっている(Finucane, 2017)。The Global Prevalence of Infections in Urology (GPIU)によって蓄積されたサーベイランスデータによると、泌尿器科病棟の患者の約56%が抗生物質を処方されており、そのうち26%は尿路結石が証明された場合に処方され、21%は尿路結石が疑われた場合に処方されている(Johansen et al., 2006, Wagenlehner et al., 2016)。結局のところ、確認されていない尿路結石に対する抗生物質の過剰処方の結果は、MDR尿路病原体の大幅な増加と相関している(Cekら、2014年)。その結果、尿路結石に対する抗生物質処方のガイドラインは、耐性菌の増加を反映して更新された。現在では、大腸菌の局所耐性頻度が10%以下であり、過去6ヵ月以内にフルオロキノロン治療を受けていない場合にのみ、フルオロキノロンのエンピリック治療が推奨されている(Guptaら、2011、Bonkatら、2020)。
マイクロバイオーム構成成分の長期的な変化も、抗生物質のレジメンによって影響を受ける。尿路結石によく用いられる抗生物質は腸内細菌叢に影響を与え、常在菌の多様性と存在量を減少させると言われている(Elvers et al.) 抗生物質がウロビオームに及ぼす影響を調査した研究は限られているが、それでもなお懸念される。抗生物質は、ウロビオームの地域差に大きく寄与することが指摘されている(Gottschickら、2017、Mulderら、2019)。Gottschickら(2017)は、メトロニダゾール処理後のラクトバチルス・イナーの2倍の増加を評価し、Gardnerella vaginalis、Atopobium vaginae、Sneathia amniの相対存在量は有意に減少した。乳酸桿菌は一般的にその健康増進特性が認められているが、L. inersは細菌性膣炎などの疾患における有意な存在量に関連して議論の的となっている(Petrova et al.) ウロビオームに対するいくつかの抗生物質の影響を調査した際、Mulderら(2019)は、排尿サンプル中の大腸菌とパラバクテロイデスの存在量がその後増加した一方で、FinegoldiaとLactobacillusは減少したことを指摘した。閉経後の女性におけるエストロゲンの欠如もまた、ウロビオーム中の乳酸桿菌の存在量を減少させると同時に、ウロパトゲンの多様性を高め、感染症の有病率と抗生物質治療の頻度を増加させる(Alperin et al.) そのような女性がエストロゲン療法を受けられるようにすることは、泌尿生殖器マイクロバイオーム内の乳酸菌増殖を増加させるなど、閉経後の問題を助けることができる(Gliniewicz et al.) しかし、尿路結石の完全な予防にはまだ結びついていない(Raz、2001、Thomas-Whiteら、2020)。したがって、一般的に抗生物質療法に反応した後、原型的なウロバイオーム常在微生物集団を回復させることはできないため、UTIに対する新たな治療法の開発が必要である(Gottschickら、2017)。
無症候性細菌尿と症候性UTIの比較
無症候性細菌尿(ABU)は、尿路結石に起因する症状がない個人から分離された連続2回の陽性尿検体(≧105 CFU/ml)と定義される(Nicolle et al.) ABUの主な原因は大腸菌である(Roosら、2006a、Dobrindtら、2016)。ABUの有病率は年齢とともに増加し、80歳までに女性の20%に、60歳以降は地域在住の高齢男性で3.6%~19%にみられる(Nicolle, 2003, Roos et al.) その頻度は、長期介護施設では女性で25~50%、男性で15~40%に増加する。機能低下や尿失禁などの合併症が原因と考えられ、最終的には長期カテーテル留置に至る(Nicolle, 1999, Leihof et al.) しかし、ABUには誤解があり、このような菌株は、症候性感染を引き起こす泌尿器病原体との系統学的な関連性から、常在菌とみなすべきか、潜在的な病原体とみなすべきかが問われている(Finucane, 2017)。
施設に入所している成人は、ABU株の発現頻度が高くなりやすい(Ajayi and Radhakrishnan, 2016)。同時に、尿検体中の105 CFU/ml以上の細菌尿の有無に基づいて尿路結石が診断されるため、抗生物質の過剰使用が増加する(Nicolle et al.) そのため、長期介護施設は耐性尿路病原体が蔓延するホットスポットとなっている(Rowe and Juthani-Mehta、2014年)。ウロビオームに存在するABU株は通常、宿主に症状を引き起こさない常在菌の状態で存在している。Caiら(2012年)は、rUTIを起こしやすい女性において、ABUの影響を評価した。一方のグループには抗生物質療法を行い、対照グループには抗生物質療法を行わなかった。再発頻度は、対照群(13.1%)に比べて抗生物質投与群(46.8%)で有意に高く、ABUの存在が保護的役割を果たすことが示唆された(Cai et al.) Caiら(2012)、(2015)はまた、抗生物質投与群から分離された大腸菌は、アモキシシリン-クラブラン酸、シプロフロキサシン、TMP-SMXに対して有意に高い耐性を示したと結論づけている。したがって、ABUを抗生物質で治療することは有害である可能性が高く、実際、ウロビオームを損傷する可能性がある。したがって、欧州泌尿器科学会(EAU)と米国泌尿器科学会(AUA)は、特定のサブグループ(妊婦や膀胱粘膜が破られるような手術を受けている人)を検討しない限り、ABUの治療を避けることを推奨している(Anger et al.
バイオ治療薬の可能性
表1にウロバイオームを調節する可能性のあるバイオ治療薬をまとめ、図2に作用機序の概要を示す。
表1. 尿路病原体に対して抗菌活性を示す生物治療薬。
バイオ治療薬名 タイプ 作用機序 臨床エビデンス 参考文献
大腸菌 83972 無症候性細菌尿 細菌の干渉。バイオフィルム干渉 バクテリオシン産生 フェーズ2-rUTIの有意な減少(N = 20)。フェーズ3は実施せず。EAUによりLUTDでの使用が承認されている。 Sundén et al., 2010, Bonkat et al.
パイオファージ バクテリオファージ ウイルスは細菌に感染する。 フェーズ3-抗生物質より非劣性(N=113)。脊髄患者を対象にRCT開始。 Leitnerら, 2021a, Leitnerら, 2021b
Lactin-V (Lactobacillus crispatus) プロバイオティクス 乳酸と過酸化水素の産生。尿路上皮細胞への付着を阻害する。 フェーズ2-rUTI発生率は15%に減少した(N = 50)。フェーズ3は実施せず。 ステイプルトンら(2011年)
L. rhamnosus GG プロバイオティクス 乳酸および過酸化水素産生。NF-κB、P、1型フィンブリアをダウンレギュレート。バイオフィルム干渉。 フェーズ2-NLUTDとSCI患者(N = 80)において1、2回投与で安全。積極的なフェーズ3なし。 Groahら(2019年)
Mutaflor (E. coli Nissle 1917) プロバイオティクスのマイクロシン産生。鉄取り込みシステムを用いた鉄の競合。 In Vitro - UPECの有意な減少なし。小児の尿路結石を対象としたフェーズ4を積極的に開発中。 Pradhan and Weiss, 2020, Tapiainen, 2020
糞便微生物叢移植 ドナー便移植 細菌干渉。 予備的臨床試験-rUTIの有意な減少(N=90)。 Ghaniら(2021年)
セクロピンA 抗菌ペプチド 膜透過.排出ポンプと核酸相互作用の阻害。バイオフィルム阻害。 In Vivo - G. mellonellaモデルにおけるUPECバイオフィルムの有意な減少。 Fenner, 2020, Kalsy et al.
コリシンE2 バクテリオシン DNAの内核分解。 予備的なカテーテル試験-感受性大腸菌の完全阻害。 Trautner et al.
*rUTI:再発性尿路感染症、LUTD:下部尿路機能障害、EAU:欧州泌尿器科学会、RCT:無作為化比較試験、NLUTD:神経因性下部尿路機能障害、SCI:脊髄損傷。
図2
ダウンロード 高解像度画像ダウンロード(552KB)
ダウンロード フルサイズ画像のダウンロード
図2. プロバイオティクス、バクテリオシン、抗菌ペプチドを含む尿路病原体に対する生物治療薬の作用機序。(A)プロバイオティクス細菌は、栄養分と尿路上皮の接着をめぐって争う競争的な微生物であり、バイオフィルムを妨害する。乳酸の産生は環境のpHを調節し、尿路病原体の生存にとって実体のない培地を提供する。(B)バクテリオシンは、競合する細菌に対する毒素として作用し、細菌のDNAを分解し、ペプチドグリカンの合成を阻害し、膜に孔を形成する。小分子、アミノ酸、イオンが細胞から漏れ出し、細胞死を引き起こす。(C)エフラックスポンプはさらに抗菌ペプチドによって阻害され、毒性化合物や細菌の代謝産物の輸送に影響を与える。
6.1. 細菌による妨害
大腸菌83972は現在、ABUに関連する最もよく特徴付けられた菌株である(Darouicheら、2005、Kövesら、2014、Storkら、2018)。大腸菌83972株は少女から初めて分離され、その少女は感染症状を示すことなく3年間この株を保有していた(Lindbergら、1975年、Anderssonら、1991年)。大腸菌83972株は常在性大腸菌に類似しているが、この菌株は尿路病原性の前駆菌から進化したことが研究で示されている(Klemm et al.) 実際、この株は大腸菌B2系統群に関連しており、UPEC株に関連する主要な系統群である(Roos et al.) 大腸菌83972株に存在するUPEC株に関連する病原性因子には、コリバクチンと細胞傷害性壊死因子1(CNF-1)の発現が含まれる(Stork et al.) しかし、83972 ABU株と症候性感染を引き起こす大腸菌株とを区別する変異(運動性の欠如、fim欠失やpapG点変異による機能的P、タイプ1、F1Cフィンブリアの欠如など)は、その病原性を減弱させる要因となっている(Klemmら、2006、Roosら、2006b、Zdziarskiら、2008、Zdziarskiら、2010)。
大腸菌83972株はUPEC分離株を凌駕するため、細菌干渉を確立することができ、尿路結石リスクを減少させる。大腸菌83972株のコロニー形成は、UPECとは対照的に、尿道カテーテルへの前接種やバイオフィルムへの意図的な定着によって、以前に記録されている(Trautnerら、2003年、Ferrièresら、2007年)。大腸菌83972株を神経因性膀胱に導入したところ、尿路結石の再発が減少した(Sundén et al.) ABUがどのようにUPECを凌駕するのかに関する知見は限られており、栄養素や付着部位の競合、遺伝子獲得、バイオフィルム産生の阻害などが示唆されている(Darouiche and Hull, 2012, Beatson et al.) 大腸菌83972には付着に必要なフィンブリアがないため、付着部位の競合は否定されている(Hullら、2002、Roosら、2006b、Zdziarskiら、2010)。正確な作用機序をめぐる混乱にもかかわらず、大腸菌83972の臨床使用はEuropean Urology Guidelines(Dobrindtら、2016、Bonkatら、2020)によって意図的な膀胱コロニー形成に推奨されている。プロトタイプである83972株以外のABU株は、あまりよく特徴付けられていない。Storkら(2018)による研究では、2つのABU分離株(9株と106株)が2つのモデル株、大腸菌83972株とUPEC 536株に対して競争優位性を示すことが示された。合計で9株のABU株が評価されたが、2つのモデル株との競合のみであったため、他の尿路病原性株に対する性能は未解明のままであった(Stork et al.) 9株と106株はともに、バクテリオシン発現系やシデロフォアエアロバクチン系などの付加的な適性因子を含んでいるようであり、干渉に寄与している可能性がある(Stork et al.) ヒトにおける大腸菌83972株による意図的なコロニー形成は安全とみなされているため、ABU株を追加した大規模な研究が、新規バイオ治療薬のさらなる開発につながる可能性がある(Kövesら、2014、Jones-Freemanら、2021)。
6.2. 微生物叢移植
糞便微生物叢移植(FMT)は、健康なドナーの便を最小限に操作した懸濁液中の微生物群集を患者の腸管内腔に移植し、健康な微生物組成を回復させるものである(Culligan and Sleator, 2016)。近年、FMT療法はウロビオームの常在菌を再増殖させ、rUTIの減少と関連している。Tariqら(2017年)が行った小規模な症例研究では、再発性クロストリジウム・ディフィシル感染症(rCDI)に対するFMT治療後に、rUTI発症の有意な減少が検出された。その後、抗生物質に対する感受性が上昇し、大腸菌およびクレブシエラ尿路病原体の存在量が減少した(Tariqら、2017年)。Biehlら(2018)は、50歳女性のFMTから84日後に、腸内細菌科の存在量が8.3~0.5%から同様に減少したことを検出したが、乳酸菌科の存在量は~0.5%から50%以上に増加した。同様に、93歳の女性においても、FMTは症候性rUTIを減少させ、rCDIを根絶した(Airaら、2021年)。著者らは、症候性感染症が大幅に減少したのは、腸内腸内細菌がFMT前の74%からFMT後は0.07%に減少したためであると推論した(Aira et al, 2021)。FMTは、9人の患者からなるやや大規模なコホートにおいて、ESBL産生株による再発は1回のみで、rUTI減少という良好な結果を示している(Ghani et al.、2021年)。これまでの予備的な症例研究では、FMTについて少数の参加者を対象に調査しており、大規模な研究はこの治療法の確認に有益であろう。
FMTがrCDIを減少させることに成功したことは有名であるが、他のニッチからの微生物移植が有効な治療法になるかどうかという疑問が投げかけられている。膣内細菌叢移植(VMT)は、rUTIに罹患している患者を対象とした臨床試験は行われていないが、細菌性膣炎に対する有効な治療法の可能性があるとして発表されている(Lev-Sagieら、2019年)。これは、執筆時点で、ヒトで実施された最初のVMTの報告であり、5人の参加者のうち4人の細菌性膣炎の長期寛解をもたらした(Lev-Sagie et al.) さらに、VMT後に乳酸桿菌優位のマイクロバイオームが回復し、健康な膣マイクロバイオーム構成が再形成された(Lev-Sagie et al.) 膣マイクロバイオームがウロバイオームと相互に関連していることを考えると、この治療戦略がrUTIやその他の泌尿器科疾患に実行可能かどうか検討される可能性がある。これと同様に、我々は以前、rUTIを対象とした尿中微生物叢移植(UMT)という概念を提唱した(Jonesら、2021年)。この移植療法をABUやLactobacillusのような健康関連株で強化することで、おそらくrUTIの新規生物学的療法を特定できるであろう。
6.3. ファージ療法
他のヒトマイクロボームと比較すると、ウロバイオームに関する知見は比較的少ないが、尿路のウイルス成分(別称、ウロビローム)に焦点を当てた研究はさらに少ない(Santiago-Rodriguez, 2018)。ウロビオームコミュニティ内のシフトは健康状態に大きく影響されるが、ウイルス成分は変化しないようである(Santiago-Rodriguez et al.) 現在、尿ビロームのメタゲノム解析では、主に真核ウイルスに焦点が当てられており、ヒト乳頭腫ウイルス(HPV)が最も豊富である(Shigehara et al.) メタゲノム解析の結果、尿中ビロームの新規ファージ配列は真核ウイルスを上回ることが判明した(Miller-Ensminger et al.) 例えば、Santiago-Rodriguezら(2015)は、尿中のウイルス配列の27%が既知のウイルスと相同であり、そのうち99%がバクテリオファージ遺伝子であることを明らかにした。しかし、これは存在するファージのごく一部に過ぎず、尿路には未解明の大規模なウイルス群集が存在することになる(Miller-Ensmingerら、2018、Garrettoら、2019)。
現在、尿路結石に対するファージ療法をめぐる研究は、通常、溶菌性タンパク質、ファージカクテル、または抗生物質と相乗的に使用されるファージで構成されている(Malik et al.) 溶菌性ファージは、細胞壁の溶解を標的とする2種類の溶菌性タンパク質(エンドリジンおよびビリオン関連ペプチドグリカンヒドロラーゼ(PGH)、ビリオン関連リジン(VAL)とも呼ばれる)を天然に産生する(Gutiérrez et al. さらに、溶解性ファージはMDR尿路病原体に対する潜在的治療法として報告されている(Galtierら、2016、Bagińskaら、2021)。Sybesmaと共著者(2016)は、尿由来のK. pneumoniae分離株9株の溶菌性ファージに対するin vitro感受性を調べた。注目すべきは、1つのファージであるv_BR-KpS10が有意な活性を示し、K. pneumoniae分離株を100%溶解したことである(Sybesmaら、2016)。さらに最近では、溶菌ファージVB_ecoS-Golestanが厄介なUPEC株に対して活性を示し、MDR UPEC分離株の56%を阻害した(Yazdi et al.) 限られた宿主範囲やファージ耐性変異体などの制限因子は、UPEC治療のための単一ファージ療法の有効性を制限している(Malik et al.)
ファージが単一ファージ形態で示す高い特異性は、多菌感染症の治療能力を制限するだけでなく、ファージ耐性菌が進化するリスクも高める(Gurneyら、2017、Wrightら、2019)。したがって、ファージと別の抗菌薬との併用やファージカクテルが一般的に好ましい。ポリファージと併用療法は、多菌感染症やバイオフィルムを治療する際に特に有利である(Malikら、2020)。例えば、MDRアシネトバクター・バウマンニ(Acinetobacter baumannii)を標的とするファージカクテルは、TMP-SMXおよびシプロフロキサシンと併用した場合、バイオフィルムのバイオマスを90%以上減少させた(Grygorcewicz et al. この相乗効果は通常、抗生物質の作用機序に起因するもので、ジヒドロ葉酸還元酵素(DHFR)、DNAトポイソメラーゼII、DNAトポイソメラーゼIVを阻害し、ファージの増殖と細胞溶解を促進する(Chegini et al.) 抗菌性ファージと遺伝子組み換えABU株である大腸菌HU2117(染色体papGに800塩基対の欠失を持つ大腸菌83972の派生株)との間の相乗作用も報告されている(Liao et al. 染色体遺伝子欠失の結果、菌血症や腎盂腎炎(Hull et al., 2002)に関連する病原性因子であるPフィンブリアは、大腸菌HU2117では産生されなくなった。Liaoと共著者(2012)は、大腸菌HU2117とファージ(ΦE2005-A)を併用した場合、カテーテル上の緑膿菌バイオフィルム形成がほぼ4ログ減少したことを報告している。しかし、抗生物質とファージの組み合わせの有効性は、MDR A. baumanniiファージカクテルとコリスチンとの間に見られた拮抗活性(Grygorcewicz et al.) ファージの結合と繁殖は、細胞膜の分解によりコリスチンと併用すると制限された(Danis-Wlodarczykら、2016)。
Eliava Institute(グルジア、トビリシ)が製造した市販のファージであるパイオファージは、投与した場合の尿路結石を引き起こす尿路病原体の治療について、初期臨床試験で検討されている(Leitnerら、2017年)。パイオファージはファージカクテルであり、通常、創傷や皮膚感染を引き起こす大腸菌、シュードモナス、プロテウス、ブドウ球菌、連鎖球菌株を標的とする(Abedonら、2011年)。一次in vitro臨床試験において、市販のパイオファージは、細菌に対して有効な最低濃度を決定するための一連の液滴滴定の後に適合された(Ujmajuridze et al.) その後、4倍に適合させたパイオファージに対する細菌の感受性は41%から75%に上昇した(Ujmajuridze et al.) さらに、カテーテル上の適合ファージは、9人中6人の参加者において細菌力価の1~5log減少を引き起こし、それにより、大腸菌は4人の参加者で検出され、連鎖球菌属と腸球菌属の両方は治療後の2人の参加者のみに存在した(Ujmajuridze et al.) 最近、113人の患者からなる無作為化比較臨床試験において、Leitnerとそのチーム(2021b)は、適応された膀胱内ピオファージの有効性と安全性は、尿路結石に対する抗生物質治療に劣らないことを報告した。膀胱内投与は、カテーテルを用いて患者の膀胱内に直接薬剤を投与する予防法である(GuhaSarkar and Banerjee, 2010)。さらに、経尿道的前立腺切除術(TURP)を受けている男性では、ファージカクテルによる膀胱灌流が優れているようであった(Leitnerら、2021b)。Leitnerら(2021a)はまた、明らかに尿路結石を患っている脊髄損傷者に対するファージ治療の可能性を仮定し、2020年に臨床試験を開始する予定であった。したがって、ファージ研究は尿路病原体を根絶する際に有望な結果を示しているが、その有効性を検証するためにはさらなる臨床研究が必要である。
6.4. プロバイオティクス
6.4.1. グラム陽性
プロバイオティクスは、「適切な量を投与することで、宿主に健康上の利益をもたらす生きた微生物」と広く定義されている(Guarner et al.) 有機酸、バクテリオシン、バイオサーファクタント、過酸化水素などの抗菌性化合物は、プロバイオティクス細菌の拮抗作用を高め、様々な疾患/障害の予防に役立つ(Darouiche and Hull, 2012)。Lactobacillus SCS由来の乳酸は、30 mM以上の濃度で、UPECを排除する強力な抗菌性を示す(Cadieux et al.) しかし、Cadieuxら(2009)は、乳酸を産生する乳酸桿菌が、それをUPECに有益な炭素源に変換する可能性も指摘し、乳酸桿菌のコロニーがまだ残っている場合の感染症の原因を説明している。過酸化水素の産生は、ストレスタンパク質OmpAとOmpXのアップレギュレーションを通じてUPECの接着因子に悪影響を及ぼし、膜障害を引き起こす可能性がある(Stancikら、2002、Wang、2002、Kimら、2010)。このようなタンパク質のアップレギュレーションは、腸内環境や泌尿生殖器環境におけるバイオフィルム形成の減少につながる可能性がある(Li et al.)
一般的に、プロバイオティクスは経口摂取されるが、膣内など別の送達経路も可能である(Wolff et al.) 潜在性UPECリザーバーは性器管にコロニー形成する可能性があるため(Brannonら、2020)、膣プロバイオティクスはUPECリザーバーを減少させ、その結果rUTIを減少させる可能性がある。定常性乳酸菌は膣内細菌叢を制御し、病原体量を減少させることで恒常性を維持するように働く(Marrazzo, 2011)。クリスパタス乳酸菌は、健全なマイクロバイオームの維持に最も効果的な菌株のひとつである(Nardini et al.) L. crispatus CTV-05は、細菌性膣炎を治療するために臨床試験中の生きたバイオ治療製品であるLactin-Vに含まれる活性プロバイオティクス株である(Cohenら、2020年)。Lactin-Vの尿路病原体治療の可能性を評価したところ、治療を受けた50人のうちrUTIを発症したのはわずか15%であったのに対し、プラセボコホートのrUTI発症率は27%であった(Stapleton et al.) さらに、L. rhamnosusは、最も頻繁に研究されている乳酸菌株の1つである(Petrovaら、2018、Pinoら、2019)。核因子-κB(NF-κB)真核転写因子、Pおよび1型フィンブリアを含むUPEC病原性因子のダウンレギュレーションを促進し、バイオフィルムも阻害する(Cadieuxら、2009、McMillanら、2011、Karlssonら、2012、Petrovaら、2016)。閉経後女性252人を対象に、L. rhamnosus GR-1とL. reuteri RC-14を含む経口プロバイオティクスの抗生物質療法に対する有効性を評価する無作為化比較試験が実施された(Beerepoot et al.) TMP-SMXと比較した場合、プロバイオティクスは尿路結石抑制の非劣性基準を満たさなかったが、抗生物質耐性尿路病原体の存在はプロバイオティクスコホート内で有意に減少した(Beerepoot et al.) L. rhamnosus GR-1およびL. reuteri RC-14プロバイオティクスの膣内投与は、抗生物質と併用した場合(N = 41)、尿路結石症の再発を47%から21%に減少させるという有望な結果をもたらしたことがある(Reidら、1992)。さらに、大腸菌に対するラクトバチルス・アシドフィルスの抑制効果は、最も高い抑制力(60%)を示し、この菌株のさらなる研究が正当化された(Velraedsら、1998年、Vagiosら、2020年)。乳酸菌の膀胱内投与は、神経因性下部尿路機能障害を有する患者において有望な可能性を示しており(Groahら、2019)、プロバイオティクス投与の新時代が到来する可能性がある。現在、ゲンタマイシンの膀胱内投与は、他の全身治療がすべて不成功の場合にrUTIを患っている人に有効であると考えられている(Dray and Clemens, 2017)。L.ラムノサスGG膀胱内プロバイオティクスは、1回または2回に分けて投与した場合、尿が濁っていたり悪臭があったりする参加者において安全で忍容性が高いことが判明した(Groah et al.) 膀胱内プロバイオティクスによって、ウロビオームのコミュニティシフトが起こりうるという仮説が立てられたが、研究はまだ予備段階である(Forster et al.) 経口/膣L. rhamnosusを用いた試験管内研究の成功にもかかわらず、この菌株はまだ尿路結石発生、またはUPEC減少の有意な減少を示していない(Forsterら、2019、Groahら、2019)。これは膀胱内プロバイオティクスを利用した最初のヒト試験であるが、ラクトバチルス・カゼイはマウスモデルにおいて慢性尿路結石に対する有意な抗菌活性を示した(Asaharaら、2001)。
6.4.2. グラム陰性
E. coli Nissleは、プロバイオティクスとして利用された最初の菌株のひとつであり、胃腸障害の治療用プロバイオティクスMutaflorの主活性成分として商品化されている(Schultz, 2008, Scaldaferri et al.) 大腸菌ニッスル1917は、泌尿器科感染症の予防薬としても有望視されている(Stormら、2011年)。無病性大腸菌Nissle 1917株および83972株と、病原性泌尿器病原性大腸菌CFT073株とのゲノム解析により、3株間の遺伝的関係が密接であることが明らかになり、これらの株が共通の祖先に由来する可能性が高いことが示唆された(Hancockら、2010b、Vejborgら、2010)。Nissle 1917とCFT073の間の遺伝的類似性の増加は、腎盂腎炎を引き起こす株で主に同定される病原性アイランドPAI-CFT073-serUの存在によって同定された(Vejborg et al.) さらに、F1Cフィンブリエの発現はニッスル1917と関連しており、この菌株のさまざまな細胞への接着能力に寄与している(Grozdanovら、2004、Kletaら、2014)。
フィットネス因子の発現は大腸菌ニッスル1917の拮抗作用に寄与し、続いて細菌のバイオフィルム形成を促進する(Hancockら、2010a、Scaldaferriら、2016)。シデロフォアであるイエルシニアバクチンで構成される第二鉄取り込み系は、以前にこの菌株で同定されており、鉄制限環境におけるバイオフィルム形成に寄与している(Grozdanov et al.) エルシニアバクチン受容体をコードするfyuA遺伝子は、尿路結石を引き起こす株を含め、バイオフィルム産生株で最も発現が上昇する遺伝子の一つである(Hancock et al.) 大腸菌Nissle 1917は、ヘムインポートによる生存を促進する、追加の鉄取り込みシステム(エンテロバクチン、エアロバクチン、二硝酸鉄輸送システム、chuヘム輸送遺伝子座)の配列を含んでいる(Garciaら、2011、Scaldaferriら、2016)。2つの既知のカテコールマイクロシン、マイクロシンMとマイクロシンH47の発現は、大腸菌ニッスルのもう一つの有利な機能を示している(Patzerら、2003、Vassiliadisら、2010)。カテコールマイクロシンは、カテコール-シデロフォア部分を特徴とする翻訳後修飾ペプチドである(Patzerら、2003、Thomasら、2004)。鉄が制限された条件下では、このようなマイクロシンはカテコール-シデロフォアを利用し、第二鉄と結合することで細菌の競争力に貢献する(Thomasら、2004、Vassiliadisら、2010)。このメカニズムが、腸内感染症の原因となる腸内細菌科細菌に対する抗菌機能に役立っている(Schultz, 2008, Baquero et al.) 大腸菌ニッスルのプロバイオティクス特性にもかかわらず、この菌株はUPECの有意な減少をまだ示していないが、これはおそらくUPEC株の抗菌防御によるものであろう(Pradhan and Weiss, 2020)。しかし、大腸菌Nissle 1917は、新規治療薬開発のモデル生物として注目を集めている(Geldartら、2018、Praveschotinuntら、2019)。
6.5. 抗菌ペプチド
抗菌ペプチドは、自然免疫系の一部であり、宿主組織から分泌される小さなポリペプチド抗菌薬(<10 kDa)である(Suda et al.、2017)。宿主の防御システムの一部として、AMPは膀胱、尿管、腎臓、尿道の尿路上皮で産生される(Becknellら、2015)。AMPは直接的な抗菌活性を発揮し、免疫調節化合物としても機能する(O'Sullivan et al.) AMPの正味の陽イオン電荷、両親媒性、二次構造は、標的細胞に結合し脂質二重膜を破壊する能力に寄与している(Yeaman and Yount, 2003, Ebenhan et al.) AMPの生物治療の可能性とともに、発現レベルがしばしば感染と相関することから、AMPは優れたバイオマーカーにもなり得る(Gupta et al.) 尿路で検出されるいくつかの既知の抗菌ペプチドは、マウスとヒトの両方でその機能を決定するために徹底的に評価されており、カテリシジン、ヒトβ-ディフェンシン、ヒトα-ディフェンシン5(HD5)が最も普及しているようである(Hiratsukaら、2000、Chromekら、2006、Zasloff、2007、Spencerら、2014)。
ヒトカテリシジン(LL-37)はα-ヘリカルAMPであり、主に循環好中球、上皮細胞、骨髄性骨髄細胞に発現している(Agerberthら、2000)。尿路におけるLL-37の保護的役割をめぐる証拠は限られているが、いくつかの研究では有望な結果が報告されている(Spencerら、2014年、Babikirら、2018年、Guptaら、2018年)。例えば、UPECの侵入にチャレンジすると、CAMP LL-37遺伝子のmRNA発現の増加、およびそれに続くLL-37分泌の増加が数分以内に検出された(Chromekら、2006年)。ネズミのLL-37ホモログであるCRAMPを欠損させると、膀胱のコロニー形成が進むにつれてUPECの感染率が高くなった(Ali et al.) さらに、LL-37耐性大腸菌は、腎盂腎炎のような侵襲性の高い感染症でますます増加しており、健康な人とは対照的に、rUTIに罹患している患者の尿および糞便サンプルで耐性が増加している(Chromekら、2006、Nielsenら、2014b)。LL-37は、キュルリフィンブリエのサブユニットであるCsgAの重合を阻害することにより、バイオフィルム形成を抑制することができる(Chromek, 2015)。過剰なcurli fimbriaeの存在は、UPEC株に耐性をもたらし、LL-37が細菌膜を破壊するのを阻害する(Kai-Larsenら、2010、Luna-Pinedaら、2019)。
ディフェンシンは、システイン残基とジスルフィド橋の配列によって、ヒトではα-ディフェンシンとβ-ディフェンシンに分類される生物学的に活性なペプチドである(Becknell and Spencer, 2016)。HD5の存在は、腎盂腎炎に罹患している患者や、分尿手術を受けている患者に関連し、有意に増加している(Townesら、2011年、Spencerら、2012年)。AMPの完全な可能性はまだ解明されていないが、組換えHD5は様々な尿路病原体に対して殺菌活性を示すことが示されている(Wangら、2010)。Tikhonovら(1997年)はまた、慢性腎盂腎炎時に尿中α-ディフェンシンHNP-1が8倍増加することを検出し、サイトカインIL-8および白血球レベルの増加と相関しており、好中球の動員を示唆している(Tikhonovら、1997年)。しかし、HNPと尿路病原体との関係に関する微生物学的情報はまだ解明されていない(Aliら、2009、Becknellら、2015)。β-ディフェンシンはヒトにおいてより広く発現しており、ヒトβ-ディフェンシン-1(HBD-1)とヒトβ-ディフェンシン-2(HBD-2)の両方が尿路で同定されている(Becknell and Spencer, 2016)。尿路におけるHBD-2の機能に関する研究は限られているが、AMPはEnterococcus faecalisに対する活性を示している(Kandaswamyら、2013年)。HBD-1は腎臓の上皮細胞で主に発現しており、急性腎盂腎炎の際にはその存在が3倍に増加する(Hiratsukaら、2000、Nielsenら、2014b)。マウスBD-1の欠損はUPECのin vivoでの病原性を変化させなかったが、マウスBD-3とBD-4はUPECに対して殺菌活性を示した(Becknellら、2013)。興味深いことに、ヒトのβ-ディフェンシンは、月経周期を通じて性器管内で異なるレベルで発現しており(Kingら、2003年、Aliら、2009年)、これは、泌尿器と膣のマイクロバイオームが相互接続している可能性との相関を示している可能性がある。エストロゲンの補充は、尿路におけるβ-ディフェンシンやLL-37を含むAMPの増加と相関することも示されている(Lüthje and Brauner, 2016)。
昆虫由来のAMP(Mannielloら、2021年)や植物由来のAMP(Monteiroら、2019年)、抗真菌ペプチド(Ramanら、2016年)もまた、ヒトの尿路結石に対する潜在的な治療法である。最近では、ワクガGalleria mellonella由来のセクロピンA(CecA)が、バイオフィルムを形成するUPEC株に対する新規治療薬として活性を示した(Kalsy et al.) これはマルチターゲット・メカニズムによって達成され、外膜が透過化され、抵抗性-結節-分裂(RND)排出ポンプが抑制され、核酸相互作用が阻害され、その結果バイオフィルム形成が阻害される(Kalsy et al.) CecAと抗生物質ナリジクス酸(NAL)の相乗反応も観察され、最終的にはNALの細胞内への侵入を改善し、尿路病原体バイオフィルムを根絶する新たなアプローチにつながった(Fenner, 2020)。
6.6. バクテリオシン
バクテリオシンはAMPのサブカテゴリーであり、細菌がリボソームで合成したペプチドで、競合する生物を殺すために産生される。グラム陽性菌が産生するバクテリオシンは、バクテリオシン研究の中心的存在であり、このトピックに関する多くの広範な総説がある(Mathur et al.、2017、Acedo et al.、2018、Soltani et al.、2020)。グラム陰性菌は、その外側のリポ多糖膜とそれに続く抗生物質効力の低下により、当初はバクテリオシン治療の良い候補とはみなされていなかった(Eganら、2017)。しかし、MDRグラム陰性菌の増加により、グラム陰性バクテリオシンを含む代替治療薬への関心が再び高まっている。
グラム陰性バクテリオシンは、主にコリシンとマイクロシンの2つのグループに分類される(Engevik and Versalovic, 2017)。コリシンは高分子量(20 kDa以上)のタンパク質であり、一方、マイクロシンは10 kDa未満の低分子量ペプチドである(Rebuffat, 2011, Karpiński and Szkaradkiewicz, 2016)。コリシンはより広範に特性解析されており、大腸菌の50%以上で合成され、小さなマルチコピープラスミドまたは大きな低コピープラスミドによってコードされている(Braun et al.、1994、Gillor et al.、2004)。コリシンが標的細胞にダメージを与える際には、主に3つのメカニズムが利用される。電位依存性チャネルを介した膜透過性化、細胞ヌクレアーゼ分解、ペプチドグリカン合成阻害である (Cascales et al., 2007, de Zamaroczy and Chauleau, 2011)。歴史的に、コリシンは主に腸内菌株で同定されてきた(Garcia-Gutierrez et al.) 泌尿器病原体に対する阻害能に関する研究は限られているが、有望である(Budičら、2011、Roy and Riley、2019)。
特にŠmajsと共著者(2010)は、UPEC株では対照株と比較してコリシンE1プラスミド(ColE1)の割合が高く、それぞれ22%対10%で検出されたことを報告している。このことから、ColE1 が病原性因子となる可能性が示唆された (Rijavec et al., 2007, Šmajs et al., 2010)。逆に、ある種のコリシンは抑制作用を示し、尿道カテーテル上のバイオフィルム形成を減少させる。尿道カテーテルにコリシンE2産生大腸菌K-12をコーティングすると、感受性分離株には完全な抗菌活性を示したが、コリシン耐性を示す変異大腸菌には効果がなかった(Trautnerら、2005年)。さらに、潤滑剤と新規コリシンSR4を組み合わせて予防薬を作ると、尿路病原体に対してゲンタマイシンと同等の抗菌活性が得られる一方、薬剤の使用量は20~30倍少なくなった(Roy and Riley, 2019)。UPECに対するバクテリオシン活性を実現するもう1つのメカニズムは、組換え細菌の導入である。例えば、プロバイオティクスであるラクトバチルス・ブレビス(Lactobacillus brevis)DT24株を遺伝子工学的に操作してコリシンE2を発現させると、UPECに対する同菌株の抗菌能力を高めることができる(Trivedi et al. このようなバイオセラピーを用いることで、尿路病原体を抑制し、同時にマイクロバイオームにも利益をもたらす可能性があるが、in vivoでの評価はまだなされていない。
特徴的なのは、コリシンを発現する大腸菌株が多いことであるが、尿路結石を引き起こす菌株では、マイクロシンをコードする決定基がより多く同定されている(Šmajs et al.) マイクロシンはプラスミドまたは染色体上にコードされる耐熱性抗菌ペプチドであり、主に腸内細菌科細菌に対して幅広い活性スペクトルを示す(Lagos, 2013)。マイクロシンは、細菌酵素の阻害、膜透過性化、膜成分の利用によって抗菌作用を発揮する(Rodríguez and Laviña, 2003, Rebuffat, 2011)。尿路結石を誘発するUPECは、染色体にコードされたマイクロシンH47とマイクロシンMの増加と関連している(Šmajsら、2010、Massipら、2020)。興味深いことに、大腸菌Nissle 1917でこれら両マイクロシンを発現させると、先に述べた鉄取り込み系が誘導されるため、UPECに対して大きな競争優位性をもたらす(Patzerら、2003、Vassiliadisら、2010)。Massipと共著者ら(2020)はまた、UPECよりもABU株の方が、マイクロシンH47とマイクロシンM前駆体をより頻繁に同定している。このようなABU株がUPEC株に対して競争上の優位性を示すかどうかは不明である。本稿執筆時点では、UPEC分離株において天然産のマイクロシンが有意に減少した例はない。しかし、エンテロシンCRL35とマイクロシンVを組み合わせた組み換えハイブリッド型バクテリオシンEnt35-MccVを用いて、グラム陽性菌とグラム陰性菌の両方に対する抗菌活性が解析されている(Acuña et al.) ハイブリッド・バクテリオシンの生産は、munAとcvaCがそれぞれコードするエンテロシンCRL35とマイクロシンVの構造部分を、非対称PCR法によって融合させることで達成された(Acuña et al.) 5つのUPEC株を含む様々な大腸菌株に対して強力な活性を示した(Acuña et al.) UPEC230株はEnt35-MccVに対して耐性を示した唯一の菌株であったが、これはおそらくこの菌株自身がマイクロシンVと免疫タンパク質を産生したためであろう。バクテリオシンは不安定なことで有名であるが、バイオエンジニアリングは安定性を改善すると同時に抗菌活性を拡大する一般的な方法である(Navarro et al.) したがって、バイオエンジニアリング技術を導入することで、尿道カテーテル(Roy and Riley, 2019)または人工プロバイオティクス(Trivedi et al.
バイオエンジニアリング
バクテリオシンは一般的に遺伝子コード化されているため、機能を強化した変異ペプチドを作製する目的でペプチド構造を改変するバイオエンジニアリングが可能である(Culligan and Sleator, 2017)。バクテリオシンの改変は、バクテリオシンをコードする遺伝子を変異させるか、遺伝子を融合させ、その後に別の宿主で発現させることで誘導することができる(Gillorら、2005、Cotter、2012)。モデルバクテリオシンの一つであるナイシンは、ランティバイオティクスの構造を十分に理解した結果、工学的目的のために広く利用されている(Field et al.) 単一アミノ酸残基の改変、アミノ酸配列の改変、個々のヒンジ残基の部位飽和変異導入などの生物工学的戦略は、機能性、溶解性、安定性、活性を改善したバクテリオシン誘導体の生産に貢献してきた(Kuipersら、1992、Rinkら、2007、Fieldら、2008、Cotterら、2013)。
通常、バクテリオシンはグラム陽性菌に対してより一般的に使用されるが、これは主にグラム陰性菌の外膜がその効力を低下させるためである(Eganら、2017)。部位特異的変異導入と部位飽和変異導入の両方によるナイシンのN末端ドメインと「ヒンジ」領域のバイオエンジニアリングは特に有利であり、赤痢菌やシュードモナス属などのグラム陰性病原体に対する抗菌スペクトルを拡大している(Yuanら、2004年、Fieldら、2010年、Healyら、2013年)。さらに、バイオエンジニアリングされたナイシンの変異体S29AおよびS29Gは、大腸菌を含むグラム陰性種に対して高い効力を示した(Fieldら、2012)。
グラム陰性バクテリオシンは、新たな誘導体を設計する柔軟性も備えている(Behrens et al.) 例えばフェロモニシンは、チャネルを形成するコリシンIa、および大腸菌由来のその同族免疫タンパク質と、黄色ブドウ球菌由来のフェロモンコード遺伝子(agrD)との組み合わせによって形成される融合産物である(Jiら、1995、Mayvilleら、1999)。フェロモノシンは黄色ブドウ球菌に対して特異的な活性を示し、マウスモデルではペニシリンと比較して高い性能を示した(Gillorら、2004年)。遺伝子の融合は、S型ピロシンとコリシンを組み合わせたキメラの構築でも示され、リポ多糖合成とDNA分解の阻害により、大腸菌と緑膿菌の両方に対して抗菌活性を示した(Kageyamaら、1996)。さらに最近、同様の戦略が、人工大腸菌からキメラバクテリオシンを分泌させるために応用された。コリシンE3のN末端と中央のドメインをピロシンS3のドメインと置き換えることで、キメラバクテリオシンCoPyが作製された(Gupta et al.) 続いて、鞭毛分泌物であるFlgMにタグを付けると、クオラムセンシング分子N-(3-オキソドデカノイル)ホモセリンラクトン(3OC12HSL)を検出した後に野生型緑膿菌を死滅させるように設計された抗菌剤FlgM-CoPyが生成された(Gupta et al., 2013)。microcin J25のペプチド構造に非カノニカルアミノ酸を組み込むと、野生型microcinと同等かそれ以上の抗菌活性を示す変異体がいくつか得られた(Piscotta et al.) さらに、キトサンナノ粒子とマイクロシンJ25を組み合わせることで、安定なナノ抗菌剤CN-MccJ25が形成され、グラム陰性株とグラム陽性株の両方に対して殺菌活性を示した(Yu et al.) 抗菌性化合物に対する生物工学的戦略のさらなる導入は、最終的には新規治療薬を生み出し、尿路結石に対する抗生物質への依存を減らす鍵となるかもしれない。
将来の展望
細菌群集の相対的な存在量が尿路の健康に大きな影響を及ぼし、疾患や感染症のリスクに寄与していることは明らかである(Burnett et al., 2021, Zandbergen et al.) しかし、依然として大きな知識ギャップが存在する。例えば、大腸菌とフェカリス菌の相乗作用は以前に報告されているが(Keogh et al. メタボロミクスやメタトランスクリプトミクスなどの先進的な「オミクス」技術を統合することで、ウロバイオーム内の代謝シグナル伝達活動や、他の微生物群集との相互作用に関する知見がさらに深まる可能性がある(Franzosa et al.) このような情報を得ることで、天然のUMTのような潜在的な治療法が、ウロビオームの構成成分にとってどのようなメリットがあるのか、あるいは、将来的に実行可能な治療法となるためには、尿を操作する必要があるのかを評価することができる。乳酸菌株は、大腸菌量を減少させることで最も注目されている。ABU株からも同様の効果が認められていることから(Stork et al. これにより、UPECとの代謝的相互作用に関する理解がさらに深まり、他の泌尿器病原体に対する未解明の可能性が明らかになるかもしれない。さらに、これらの菌株がプロバイオティック生物としての可能性を持つ大腸菌Nissle 1917と類似性を示すかどうかも、調査すべき道であろう。もしそうであれば、ABU株はやがてプロバイオティクスの主成分となり、泌尿器疾患を治療することになるかもしれない。従って、より多くのABU株を同定するための大規模なスクリーニング・プロジェクトを開始し、分子レベルおよび遺伝子レベルでそれらの特徴を明らかにすることは、新規治療法を設計する上で特に有益であろう。
これまでに同定された生物学的治療薬の有効性は、尿路結石を治療するための臨床試験において抗生物質と比較した場合、現在のところ非劣性基準を満たしていない。それにもかかわらず、マイクロバイオーム内部からこのような生物学的ツールを利用し、その抗菌効果を向上させ、新規治療法を開発しようという動きがある。膣マイクロバイオームにおける乳酸菌の存在量は、プロバイオティクスの経口投与後に増加するが、ウロバイオームでは有意な増加は検出されていない(Vagios et al.) 乳酸菌を動物モデルの膀胱に直接注入することで、より良好な結果が得られており、尿路結石の治療においてより有望な投与経路であることが示唆されている(Asahara et al.) しかし、膀胱への設置には医療専門家が必要であり、再診が必要な場合は費用も手間もかかる。乳酸菌含有プロバイオティクスを用いた尿路結石治療に関するデータは一貫しておらず、モデルシステム、送達経路、プロバイオティクス薬剤の点で研究は大きく異なっている(Vagios et al.) そのため、プロバイオティクスの真の臨床的可能性は未確定である。さらに、バクテリオシンも有望な可能性を示しているが、グラム陰性菌由来のバクテリオシンに焦点を当てた研究に関しては、大きな隔たりが残っている。バイオインフォマティクス・ツールによって、これらの抗菌薬を検出する能力も向上している。大腸菌、肺炎桿菌、緑膿菌などの日和見病原体を含むグラム陰性菌では、2017年までに約2000のバクテリオシンをコードする遺伝子が同定された(Sharp et al.) ゲノムマイニングからin vitroおよびin vivo研究への移行も、グラム陰性菌由来のバクテリオシンでは著しく不十分である(Behrens et al.) 天然型では、安定性や溶解性が低く、菌株特異性があるため、生物学的療法の有効性はしばしば制限される(Riley et al.) それにもかかわらず、尿路病原体に対する抗菌性の可能性は、尿路病原体の増殖とバイオフィルム形成を標的とする場合に有利であることが証明され、さらなる研究が必要である。
過去10年間、生物工学的戦略は、抗菌機能、ストレス耐性、溶解性を強化するために生物学的ツールの利用を進めてきた(Sheehanら、2007年、Fieldら、2008年、Hayesら、2019年)。他のマイクロバイオームも抗菌性化合物の豊富な供給源であるようであり(Mousa et al., 2017, O'Sullivan et al., 2019, Lagenaur et al., 2021)、ウロバイオームをスクリーニングすることで、新規抗菌薬の豊富な供給源となる可能性があることを示唆している。他の環境で検出されたバクテリオシンは、遺伝子組換え宿主で発現させると活性が向上した(O'Sullivanら、2021年)。同様の戦略を、ウロバイオームに潜在するバクテリオシンに適用することで、その活性を高めることができる。例えば、乳酸菌やABUをウロバイオーム由来のバクテリオシンの宿主発現系としてバイオエンジニアリングすれば、抗菌活性の増強、収率の向上、バクテリオシンの精製に対する応答性の向上など、多くの利点が得られる可能性がある。したがって、このような潜在的な生物学的治療薬が宿主の免疫系とどのように相互作用するのかをより深く理解するためには、ウロバイオームにおける微生物-微生物相互作用および微生物-宿主相互作用のメカニズム解明が必要である。最終的には、非抗生物質療法のための潜在的なバイオマーカーを同定する手段を提供し、生物工学的戦略と組み合わせることで、より効果的な治療法の開発につながり、泌尿器科における診断と治療の新時代への道を開くことになるだろう。
資金援助
シアラ・ケネリーはミュンスター工科大学のRISAM PhD Scholarshipを受けている。
利益相反
著者らは、本論文の発表に関して、我々が認識している利益相反はないことを宣言する。
参考文献
アベドンら、2011
S.T. Abedon、S.J. Kuhl、B.G. Blasdel、E.M. Kutter
ヒト感染症のファージ治療
バクテリオファージ, 1 (2) (2011), pp.
doi: 10.4161/bact.1.2.15845.
CrossRefGoogle Scholar
アベルソンら、2018
B. アベルソン、D.サン、L.クエ、R.A.ネベル、D.ベイカー、P.ポピール、C.L.アムンゼン、T.チャイ、C.クローズ、M.ディサント、M.O.フレイザー、S.J.キールブ、G.クシェル、E.R.ミューラー、M.H.パーマー、C.パーカー-オートリー、A.J.ウルフ、M.S.ダマサー
下部尿路の生物学と生理学における性差
生物学 Sex. Differ., 9 (1) (2018), pp.1-13, 10.1186/s13293-018-0204-8
グーグル・スカラー
アセドら、2018
J.Z. Acedo, S. Chiorean, J.C. Vederas, M.J. van Belkum
グラム陽性菌由来のバクテリオシンの構造多様性の拡大
FEMS Microbiol. Rev., 42 (6) (2018), pp.805-828, 10.1093/femsre/fuy033
スコープで見るGoogle Scholar
アクーニャら、2012
L. Acuña, G. Picariello, F. Sesma, R.D. Morero, A. Bellomio
新規ハイブリッド型バクテリオシンEnt35-MccVは、病原性グラム陽性菌およびグラム陰性菌に対して抗菌活性を示す。
FEBS Open Biol., 2 (2012), 12-19頁, 10.1016/j.fob.2012.01.002
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
アクーニャら、2015
L. アクーニャ、N.S.コルバラン、I.C.フェルナンデス-ノ、R.D.モレロ、J.バロス-ベラスケス、A.ベロミオ
ハイブリッド型バクテリオシンent35-mccvのモデル系および食品系におけるエシェリヒア・コリおよびリステリア菌の増殖抑制効果
Food Bioprocess Technol., 8 (5) (2015), pp.1063-1075, 10.1007/s11947-015-1469-0
スコープで見るGoogle Scholar
アガーバースら、2000
B. Agerberth、J. Charo、J. Werr、B. Olsson、F. Idali、L. Lindbom、R. Kiessling、H. Jornvall、H. Wigzell、G.H. Gudmundsson
ヒト抗菌・走化性ペプチドLL-37およびα-ディフェンシンは、特定のリンパ球および単球集団によって発現される。
Blood, 96 (9) (2000), 3086-3093頁, 10.1182/blood.v96.9.3086
PDFで記事を見るScopusで記事を見るGoogle Scholar
アーメドら、2019
S.S.アーメド、A.シャリク、A.A.アルサルーム、I.H.バビキル、B.N.アルホムード
尿路病原体とその抗菌薬耐性パターン:尿路感染症との関係
Int. J. Health Sci., 13 (2) (2019), pp.48-55
(にて入手可能)
〈http://www.ncbi.nlm.nih.gov/pubmed/30983946
http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC6436442〉
グーグル・スカラー
エインズワース, 2017
C. エインズワース
マイクロバイオーム:驚きの袋
Nature, 551 (7679) (2017), pp.S40-S41, 10.1038/551S40a
スコープで見るGoogle Scholar
Airaら、2021年
A. Aira、E. Rubio、A. Vergara Gómez、C. Fehér、C. Casals-Pascual、B. González、L. Morata、V. Rico、A. Soriano
クロストリジオイデスディフィシル感染症に対するFMT後のrUTI消失:症例報告
Infect. Dis. Ther., 10 (2) (2021), 1065-1071頁, 10.1007/s40121-020-00365-8
スコープで見るGoogle Scholar
AjayiおよびRadhakrishnan, 2016
T. アジャイ、ラダクリシュナン
長期介護施設における高齢者の尿路感染症
Cmaj, 188 (12) (2016), p. 899, 10.1503/cmaj.150708
スコープで見るGoogle Scholar
アリら, 2009
A.S.M.アリ、C.L.タウンズ、J.ホール、R.S.ピカード
無菌尿路の維持:抗菌ペプチドの役割
J. Urol., 182 (1) (2009), 21-28頁, 10.1016/j.juro.2009.02.124
PDFで記事を見るScopusで記事を見るGoogle Scholar
アルペリンら、2019
M. アルペリン、L.バーネット、E.ルカッツ、L.ブルーベイカー
更年期と泌尿生殖器の健康の謎:臨床的および科学的ギャップ
Menopause, 26 (1) (2019), 103-111頁, 10.1097/GME.000000001209
Scopusで見るGoogle Scholar
Ammitzbøll et al.
N. Ammitzbøll, B.P.J. Bau, C. Bundgaard-Nielsen, A.B. Villadsen, A.M. Jensen, P.D.C. Leutscher, K. Glavind, S. Hagstrøm, L.T.S. Arenholt, S. Sørensen
閉経前女性と閉経後女性ではコアとなる尿微生物叢が異なる
Sci. Rep., 11 (1) (2021), 1-10頁, 10.1038/s41598-021-81790-8
Google Scholar
アンダーソンら、1991
P. アンデルソン、I.エングベリ、G.リディン-ヤンソン、K.リンカーン、R.ハル、S.ハル、C.スヴァンボルグ
大腸菌尿の持続性は細菌の付着によって決定されるものではない
Infect. Immun., 59 (9) (1991), 2915-2921頁, 10.1128/iai.59.9.2915-2921.1991
スコープで見るGoogle Scholar
アンガーら、2019
J. アンガー、U.リー、A.L.アッカーマン、B.チョタイ、J.Q.クレメンス、D.ヒックリング
米国泌尿器科学会(AUA)/カナダ泌尿器科学会(CUA)/泌尿器力学・女性骨盤医学・泌尿器再建学会(SUFU)女性における再発性合併症のない尿路感染症: AUA/CUA/SUFUガイドラインR
Am. Urol. Assoc., April (2019), pp.
Google Scholar
アントゥネス-ロペスら、2020
T. Antunes-Lopes、L. Vale、A.M. Coelho、C. Silva、M. Rieken、B. Geavlete、T. Rashid、S.M. Rahnama'i、J.N. Cornu、T. Marcelissen
下部尿路機能障害における尿微生物叢の役割:系統的レビュー
Eur. Urol. Focus, 6 (2) (2020), 361-369頁, 10.1016/j.euf.2018.09.011
PDFを見る記事を見るScopusGoogle Scholarで見る
アラゴンら、2018
I.M.アラゴン、B.エレラ-インブロダ、M.I.ケイポ-オルトゥニョ、E.カスティーヨ、J.S.G.デルモラル、J.ゴメス-ミラン、G.ユセル、M.F.ララ
健康と疾患における尿路マイクロバイオーム
Eur. Urol. Focus, 4 (1) (2018), pp.128-138, 10.1016/j.euf.2016.11.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
アームブルスターら、2017
C.E. Armbruster、V. Forsyth-DeOrnellas、A.O. Johnson、S.N. Smith、L. Zhao、W. Wu、H.L.T. Mobley
Proteus mirabilisのゲノムワイドなトランスポゾン変異導入:必須遺伝子、カテーテル関連尿路感染症の適合因子、および適合要件に対する多細菌感染の影響
PLoS Pathog., 13 (6) (2017), pp.1-43, 10.1371/journal.ppat.1006434
ScopusGoogle Scholarで見る
浅原ら, 2001
T. 浅原, 野本和彦, 綿貫正明, 横倉忠夫
マウス大腸菌尿路感染モデルにおけるプロバイオティクスLactobacillus caseiの尿道内投与による抗菌活性の検討
Antimicrob. Agents Chemother., 45 (6) (2001), pp.1751-1760, 10.1128/AAC.45.6.1751-1760.2001
スコープで見るGoogle Scholar
アゼベドら、2017年
A.S.アゼベド、C.アルメイダ、L.F.メロ、N.F.アゼベド
カテーテル関連尿路感染症における多菌バイオフィルムの影響
Crit. Rev. Microbiol., 43 (4) (2017), pp.423-439, 10.1080/1040841X.2016.1240656
スコープで見るGoogle Scholar
バビキルら、2018
I.H. Babikir、E.A. Abugroun、N.E. Bilal、A.A. Alghasham、E.E. Abdalla、I. Adam
尿路感染症におけるカテリシジン、ヒト抗菌ペプチドLL-37の影響
BMC Infect. Dis., 18 (1) (2018), pp.1-8, 10.1186/s12879-017-2901-z
グーグル・スカラー
バギンスカら、2021年
N. Bagińska, M. Cieślik, A. Górski, E. Jończyk-matysiak
尿路感染症の病因における抗生物質耐性a. Baumanniiの役割とバクテリオファージ療法による治療の可能性
アンチバイオティクス, 10 (3) (2021), 10.3390/antibiotics10030281
グーグル・スカラー
バケロら、2019
F. バケロ、V.F.ランザ、M.R.バケロ、R.デル・カンポ、D.A.ブラボ=バスケス
腸内細菌科におけるマイクロシン:生態活性腸内化学圏におけるペプチド抗菌薬
Front. Microbiol., 10 (2261) (2019), pp.1-25, 10.3389/fmicb.2019.02261
スコープで見るGoogle Scholar
ビートソンら、2015
S.A. Beatson、N.L. Ben Zakour、M. Totsika、B.M. Forde、R.E. Watts、A.N. Mabbett、J.M. Szubert、S. Sarkar、M.D. Phan、K.M. Peters、N.K. Petty、N.F. アリカン、M.J.サリバン、J.A.ゴーソーン、M.スタントン-クック、N.T.K.ヌー、T.M.チョン、W.F.イン、K.G.チャン、V.ハンコック、D.W.ウッセリー、G.C.ユーレット、M.A.シェンブリ
無症候性細菌尿症大腸菌VR50株の分子解析から、遺伝子獲得による尿路への適応が明らかになった
Infect. Immun., 83 (5) (2015), 1749-1764頁
doi: 10.1128/IAI.02810-14.
スコープで見るGoogle Scholar
ベックネルとスペンサー、2016
B. ベックネル、J.D.スペンサー
抗菌ペプチド:尿路の無菌性維持
Birkhauser Adv. Infect. Dis. (2016), 53-65ページ
doi: 10.1007/978-3-319-24199-9_4.
CrossRefView in ScopusGoogle Scholar
ベックネルら、2013
B. Becknell、J.D. Spencer、A.R. Carpenter、X. Chen、A. Singh、S. Ploeger、J. Kline、P. Ellsworth、B. Li、E. Proksch、A.L. Schwaderer、D.S. Hains、S.S. Justice、K.M. McHugh
下部尿路におけるβ-ディフェンシン1の発現と抗菌機能
PLoS One, 8 (10) (2013), pp.1-10, 10.1371/journal.pone.0077714
グーグル・スカラー
ベックネルら、2015
B. ベックネル、A.シュワデラー、D.S.ヘインズ、J.D.スペンサー
腎免疫の増幅:腎盂腎炎における抗菌ペプチドの役割
Nat. Rev. Nephrol., 11 (11) (2015), 642-655頁, 10.1038/nrneph.2015.105
Scopusで見るGoogle Scholar
Beerepootら、2012年
M.A.J. Beerepoot、G. ter Riet、S. Nys、W.M. van der Wal、C.A.J.M. de Borgie、T.M. de Reijke、J.M. Prins、J. Koeijers、A. Verbon、E. Stobberingh、S.E. Geerlings
尿路感染症を予防するための乳酸菌と抗生物質の比較
Arch. Arch. Intern. Med., 172 (9) (2012), p. 704, 10.1001/archinternmed.2012.777
スコープで見るGoogle Scholar
ベーレンスら、2017年
H.M.ベーレンス、A.シックス、D.ウォーカー、C.クレアントス
タンパク質抗生物質としてのバクテリオシンの治療の可能性
Emerg. Top. Life Sci., 1 (1) (2017), 65-74頁, 10.1042/ETLS20160016
スコープで見るGoogle Scholar
Biehlら、2018年
L.M. Biehl、R. Cruz Aguilar、F. Farowski、W. Hahn、A. Nowag、H. Wisplinghoff、M.J.G.T. Vehreschild
尿路感染症を再発した腎移植レシピエントにおける糞便微生物叢移植
感染症 Springe Berl. Heidelb., 46 (6) (2018), 871-874頁, 10.1007/s15010-018-1190-9
スコープで見るGoogle Scholar
Biggelら、2020年
M. Biggel、B.B. Xavier、J.R. Johnson、K.L. Nielsen、N. Frimodt-Møller、V. Matheeussen、H. Goossens、P. Moons、S. Van Puyvelde
水平方向に獲得されたpapGIIを含む病原性アイランドが、侵襲性尿路病原性大腸菌の系統出現の根底をなす
Nat. Commun., 11 (1) (2020), 10.1038/s41467-020-19714-9
グーグル・スカラー
ボアーズら、2019
S.A.ボアーズ、R.ヤンセン、J.P.ヘイズ
ルーチンの臨床微生物診断ラボで使用するための次世代シーケンサー(NGS)法の落とし穴とバイアスの理解と克服
Eur. J. Clin. Microbiol. Infect. Dis., 38 (6) (2019), pp.1059-1070, 10.1007/s10096-019-03520-3
Scopusで見るGoogle Scholar
Bonkatら、2020年
Bonkat, G., Bartoletti, R., Bruyère, F., Cai, T., Geerlings, S.E., Köves, B., Schubert, S., Wagenlehner, F., Mezei, T., Pilatz, A., Pradere, B. and Veeratterapillay, R., 2020. EAU 2020 Guidelines on Urological Infections, European Association of Urology. にて入手可能: http://www.uroweb.org/gls/pdf/15_Urological_Infections.pdf〉。
Google Scholar
ボッタリーら、2021年
M.J.ボッタリー、J.W.ピッチフォード、V.P.フリマン
細菌群集における抗菌薬耐性の生態学と進化
ISME J., 15 (4) (2021), 939-948頁, 10.1038/s41396-020-00832-7
スコープで見るGoogle Scholar
ブラノンら、2020
J.R. Brannon、T.L. Dunigan、C.J. Beebout、T. Ross、M.A. Wiebe、W.S. Reynolds、M. Hadjifrangiskou
尿路病原性大腸菌による膣上皮細胞の浸潤
Nat. Commun., 11 (1) (2020), 1-11頁, 10.1038/s41467-020-16627-5
Google Scholar
ブラウンら、1994
V. ブラウン、H.ピルスル、P.グロブ
コリシン:構造、作用様式、膜を介した移行、進化
Arch. 微生物学, 161 (3) (1994), 199-206頁, 10.1007/BF00248693
スコープで見るGoogle Scholar
ブルーベイカーとウルフ、2015
L. ブルーベイカー、A.J.ウルフ
女性における尿中微生物叢の新しい世界
Am. J. Obstet. Gynecol., 213 (5) (2015), 644-649頁, 10.1016/j.ajog.2015.05.032
PDFを見る記事を見るScopusGoogle Scholarで見る
ブルーベイカーとウルフ、2017年
L. ブルーベイカー、A.J.ウルフ
女性の尿中微生物叢/マイクロバイオーム:臨床的および研究的意義
Rambam Maimonides Med. J., 8 (2) (2017), Article e0015
doi: 10.5041/rmmj.10292.
CrossRefGoogle Scholar
ブルーベイカーら、2021年
L. Brubaker、J.-P.F. Gourdine、N.Y. Siddiqui、A. Holland、T. Halverson、R. Limeria、D. Pride、L. Ackerman、C.S. Forster、K.M. Jacobs、K.J. Thomas-White、C. Putonti、Q. Dong、M. Weinstein、E.S. Lukacz、L. Karstens、A.J. Wolfe
ウロバイオーム研究を推進するためのコンセンサス形成
mSystems, 6 (4) (2021), pp.1-10, 10.1128/msystems.01371-20
スコープで見るGoogle Scholar
ブディッチら、2011
M. Budič, M. Rijavec, Ž. Petkovšek, D. Žgur-Bertok
大腸菌バクテリオシン:菌血症患者からの分離株における抗菌効果および有病率
PLoS One, 6 (12) (2011), 10.1371/journal.pone.0028769
Google Scholar
ブルマンら、2012
S. ブルマン、B.ルーシー、R.D.スリーター
分子診断学:変化する医療微生物学の文化
Bioeng. Bugs, 3 (1) (2012), pp.1-7, 10.4161/bbug.3.1.19011
スコープで見るGoogle Scholar
バーネットら、2021年
L.A.バーネット、B.R.ホックステッドラー、K.ウェルドン、A.J.ウルフ、L.ブルーベイカー
再発性尿路感染症:女性における臨床プロファイルとウロビオーム組成の関連性
Neurourol. Urodyn., 40 (6) (2021), pp.1479-1489
doi: 10.1002/nau.24707
CrossRefScopusで表示Google Scholar
Cadieuxら, 2009
P.A.カデュー、J.P.バートン、E.デヴィラール、G.リード
乳酸菌副産物は尿路病原性大腸菌の増殖と病原性を抑制する。
J. Physiol. Pharmacol., SUPPL.6 (()) (2009), pp.13-18
スコープで見るGoogle Scholar
蔡ら、2012
T. Cai、S. Mazzoli、N. Mondaini、F. Meacci、G. Nesi、C. D'Elia、G. Malossini、V. Boddi、R. Bartoletti
尿路感染症を繰り返す若年女性における無症候性細菌尿の役割: 治療すべきか否か?
Clin. Infect. Dis., 55 (6) (2012), pp.771-777, 10.1093/cid/cis534
スコープで見るGoogle Scholar
蔡ら、2015
T. Cai、G. Nesi、S. Mazzoli、F. Meacci、P. Lanzafame、P. Caciagli、L. Mereu、S. Tateo、G. Malossini、C. Selli、R. Bartoletti
無症候性細菌尿の治療は、尿路感染症の女性における抗生物質耐性株の高い有病率と関連する。
Clin. Infect. Dis., 61 (11) (2015), 1655-1661頁, 10.1093/cid/civ696
スコープで見るGoogle Scholar
Cascalesら、2007年
E. Cascales、S.K. Buchanan、D. Duché、C. Kleanthous、R. Lloubès、K. Postle、M. Riley、S. Slatin、D. Cavard
COlicin生物学
Microbiol. Mol. Biol. Rev., 71 (1) (2007), 158-229頁, 10.1128/mmbr.00036-06
スコープで見るGoogle Scholar
チェクら、2014
M. チェク、Z.タンドゥ、F.ワーゲンレーナー、P.テンケ、K.ネイバー、T.E.ビャークランド=ヨハンセン
泌尿器科入院患者における医療関連尿路感染-グローバルな視点:2003-2010年GPIU研究の結果
World J. Urol., 32 (6) (2014), 1587-1594頁
doi: 10.1007/s00345-013-1218-9.
CrossRefView in ScopusGoogle Scholar
セプルニャら、2021年
M. Ceprnja, D. Oros, E. Melvan, E. Svetlicic, J. Skrlin, K. Barisic, L. Starcevic, J. Zucko, A. Starcevic
膀胱炎に関連する尿中微生物叢のモデル化
Front. Cell. Infect. Microbiol., 11 (643638) (2021), pp.1-10, 10.3389/fcimb.2021.643638
グーグル奨学生
セルケイラら、2013
L. セルケイラ、J.A.オリベイラ、A.ニコラウ、N.F.アゼベド、M.J.ヴィエイラ
尿道カテーテルを模倣した人工尿を用いたシリコン上での緑膿菌/大腸菌混合培養によるバイオフィルム形成
バイオファウリング, 29 (7) (2013), pp.829-840, 10.1080/08927014.2013.807913
スコープで見るGoogle Scholar
Ch'ngら、2019年
J.H. Ch'ng, K.K.L. Chong, L.N. Lam, J.J. Wong, K.A. Kline
腸球菌によるバイオフィルム関連感染症
Nat. Rev. Microbiol., 17 (2) (2019), 82-94頁, 10.1038/s41579-018-0107-z
Scopusで見るGoogle Scholar
チェギニら、2021年
Z. チェギニ、A.ホシュバヤン、S.ヴェサル、A.モラダバディ、A.ハシェミ、A.シャリアティ
多剤耐性尿路病原細菌の抑制のためのバクテリオファージ療法:叙述的レビュー
Ann. Clin. Microbiol., 20 (1) (2021), pp.
doi: 10.1186/s12941-021-00433-y
グーグル・スカラー
クロメック, 2015
M. クロメック
腎疾患における抗菌ペプチド・カテリシジンの役割
Pediatr. Nephrol., 30 (8) (2015), pp.1225-1232, 10.1007/s00467-014-2895-3
スコープで見るGoogle Scholar
クロメックら、2006
M. Chromek, Z. Slamová, P. Bergman, L. Kovács, L. Podracká, I. Ehrén, T. Hökfelt, G.H. Gudmundsson, R.L. Gallo, B. Agerberth, A. Brauner
抗菌ペプチド、カテリシジンが尿路を侵襲性細菌感染から守る
Nat. Med., 12 (6) (2006), 636-641頁, 10.1038/nm1407
スコープで見るGoogle Scholar
クラエッソンら、2017年
M.J.クレッソン、A.G.クルーニー、P.W.オトゥール
臨床医によるマイクロバイオーム解析の手引き
Nat. Rev. Gastroenterol. Hepatol., 14 (10) (2017), pp.585-595, 10.1038/nrgastro.2017.97
ScopusGoogle Scholarで見る
Clermont et al.
O. クレルモン、S.ボナコルシ、E.ビンゲン
大腸菌系統群の迅速かつ簡便な決定
Appl. Environ. Microbiol., 66 (10) (2000), pp.4555-4558, 10.1128/AEM.66.10.4555-4558.2000
スコープで見るGoogle Scholar
コーエンら、2020年
C.R. Cohen、M.R. Wierzbicki、A.L. French、S. Morris、S. Newmann、H. Reno、L. Green、S. Miller、J. Powell、T. Parks、A. Hemmerling
細菌性膣炎の再発予防を目的としたLactin-Vの無作為化試験
N. Engl. J. Med., 382 (20) (2020), pp.
doi: 10.1056/nejmoa1915254
CrossRefScopusで表示Google Scholar
コッター, 2012
P.D.コッター
バイオエンジニアリング
バイオエンジニアリング, 3 (6) (2012), pp.313-319, 10.4161/bioe.21601
スコープで見るGoogle Scholar
コッターら, 2005
P.D.コッター、C.ヒル、R.P.ロス
食品微生物学: バクテリオシン: 食品に対する自然免疫の開発
Nat. Rev. Microbiol., 3 (10) (2005), pp.777-788, 10.1038/nrmicro1273
グーグル・スカラー
コッターら、2013
P.D.コッター, R.P.ロス, C.ヒル
バクテリオシンは抗生物質の代替となるか?
Nat. Rev. Microbiol., 11 (2) (2013), 95-105頁, 10.1038/nrmicro2937
スコープで見るGoogle Scholar
クロクソールら、2011
G.クロクソール、V.ウェストン、S.ジョセフ、G.マニング、P.チーザム、A.マクナリー
単菌培養サンプルからの分離株と比較した、多菌性尿路感染症からの大腸菌のヒト病原性の増加
J. Med. Microbiol., 60 (1) (2011), 102-109頁, 10.1099/jmm.0.020602-0
スコープで見るGoogle Scholar
カリガンとスリーター, 2016
E.P.カリガン、R.D.スリーター
マイクロバイオームの進歩:クロストリジウム・ディフィシル感染症への応用
J. Clin. Med., 5 (9) (2016), 10.3390/jcm5090083
Google Scholar
カリガンおよびスレーター、2017年
E.P.カリガン、R.D.スリーター
抗生物質v2.0:抗生物質耐性と闘うための計算生物学的および合成生物学的アプローチ
Future Microbiol, 12 (4) (2017), pp.267-269, 10.2217/fmb-2017-0005
Scopusで見るGoogle Scholar
カリガンら、2014
E.P.カリガン、R.D.スリーター、J.R.マルケージ、C.ヒル
メタゲノミクスと新規遺伝子発見:新規治療薬への期待と可能性
Virulence, 5 (3) (2014), 10.4161/viru.27208
Google Scholar
カミングスら、2020
L.A.カミングス、D.R.フーゲストラート、S.L.ラスーリアン=バレット、C.A.ローゼンタール、S.J.サリパンテ、B.T.クックソン、N.G.ホフマン
次世代シーケンサーと標準的な微生物学的培養を用いた複雑な多菌検体の包括的評価
Sci. Rep., 10 (1) (2020), pp.1-12, 10.1038/s41598-020-62424-x
グーグル奨学生
ダニス=ウロダルチクら、2016年
K. ダニス=ウロダルチク、D.ヴァンデンヒューベル、H.ジャン、ビン、Y.ブリアーズ、T.オルザック、M.アラブスキー、S.ワシック、M.ドラビク、G.ヒギンズ、J.ティレル、B.J.ハーヴェイ、J.P.ノーベン、R.ラヴィーン、Z.ドルリス=カワ
シュードモナス感染症におけるファージ療法の前臨床評価のための統合的アプローチの提案
Sci. Rep., 6 (28115) (2016), pp.1-13, 10.1038/srep28115
グーグル・スカラー
Darouiche and Hull, 2012
R.O.ダロウイッシュ、R.A.ハル
尿路感染予防のための細菌干渉
Clin. Infect. Dis., 55 (10) (2012), pp.1400-1407, 10.1093/cid/cis639
スコープで見るGoogle Scholar
Darouiche et al.
R.O. Darouiche、J.I. Thornby、C.C. Stewart、W.H. Donovan、R.A. Hull
尿路感染予防のための細菌干渉:前向き無作為化プラセボ対照二重盲検パイロット試験
Clin. Infect. Dis., 41 (10) (2005), 1531-1534頁, 10.1086/497272
Scopusで見るGoogle Scholar
デ・ブルッカーら、2015
K. デ・ブルッカー、Y.タン、K.ヴィントス、K.デ・クレマー、A.ブレーム、N.フェルストラエテン、J.ミヒェルス、J.ヴリューゲルス、B.P.A.カムエ、K.テヴィッセン
真菌のβ-1,3-グルカンは、大腸菌/カンジダ・アルビカンスのバイオフィルムにおけるエシェリヒア・コリのofloxacin耐性を増加させる。
Antimicrob. Agents Chemother., 59 (6) (2015), 3052-3058頁
doi: 10.1128/AAC.04650-14
Scopusで見るGoogle Scholar
デ・ニスコら、2019
N.J.デ・ニスコ、M.ノイジェント、J.マル、L.チェン、A.クプラサートクル、M.デ・ソウザ・サントス、K.L.パーマー、P.ジマーン、K.オルト
再発性尿路感染症を有する閉経後女性の膀胱壁における組織常在菌と慢性炎症の直接検出
J. Mol. Biol., 431 (21) (2019), 4368-4379頁
10.1016/j.jmb.2019.04.008.
PDFで記事を見るScopusで記事を見るGoogle Scholar
デ・ヴォスら、2017
M.G.J.デ・ヴォス、M.ザゴルスキー、A.マクナリー、T.ボレンバッハ
多細菌感染症における相互作用ネットワーク、生態学的安定性、集団的抗生物質耐性
PNAS USA, 114 (40) (2017), pp.10666-10671
doi: 10.1073/pnas.1713372114.
CrossRefView in ScopusGoogle Scholar
Dekaboruahら、2020年
E. Dekaboruah、M.V.Suryavanshi、D.Chetri、A.K.Verma
ヒトマイクロバイオーム:人体部位特異的サーベイランスとその可能な役割に関する学術的最新情報
Arch. Microbiol., 202 (8) (2020), 2147-2167頁, 10.1007/s00203-020-01931-x
スコープで見るGoogle Scholar
Dimitri-Pinheiroら、2020年
S. ディミトリ-ピニェイロ、R.ソアレス、P.バラタ
鼻のマイクロバイオーム-敵か味方か?
Allergy Rhinol., 11 (2020), pp.1-10, 10.1177/2152656720911605
グーグル・スカラー
ドブリントら、2016年
U. ドブリント、B.ウルト、C.スヴァンボルグ
宿主と細菌の共進化を研究するモデルとしての非対称性細菌尿
病原体, 5 (1) (2016), pp.1-8, 10.3390/pathogens5010021
グーグル・スカラー
ドーマンら、2003
E. Domann、G. Hong、C. Imirzalioglu、S. Turschner、J. Kühle、C. Watzel、T. Hain、H. Hossain、T. Chakraborty
腎移植レシピエントの泌尿生殖器管における病原性細菌および多菌感染の培養によらない同定
J. Clin. Microbiol., 41 (12) (2003), pp.5500-5510, 10.1128/JCM.41.12.5500-5510.2003
スコープで見るGoogle Scholar
ドレイとクレメンス、2017
E.V.ドレイ、J.Q.クレメンス
不完全膀胱空洞化患者における尿路感染症の再発: 膀胱内治療の役割はあるか?
Transl. Androl. Urol., 6 (4) (2017), pp. S163-S170, 10.21037/tau.2017.04.08
ScopusGoogle Scholarで見る
エベンハンら、2014
T. エベンハン、O.ガイセンス、H.G.クルーガー、J.R.ゼーヴァート、M.M.サテークゲ
抗菌ペプチド:分子イメージングのための感染選択的トレーサーとしての役割
Biomed. Res. Int. (2014), p. 2014, 10.1155/2014/867381
グーグル奨学生
イーガンら、2017
K. イーガン、R.ポール・ロス、C.ヒル
バクテリオシン:マイクロバイオーム時代の抗生物質
Emerg. Top. Life Sci., 1 (1) (2017), pp.55-63, 10.1042/ETLS20160015
スコープで見るGoogle Scholar
エルバースら、2020年
K.T.エルバース、V.J.ウィルソン、A.ハモンド、L.ダンカン、A.L.ハントレー、A.D.ヘイ、E.T.ファン・デル・ヴェルフ
英国のプライマリ・ケアで最もよく処方される抗生物質によるヒト腸内細菌叢の変化:系統的レビュー
BMJ Open, 10 (9) (2020), Article e035677, 10.1136/bmjopen-2019-035677
Scopusで見るGoogle Scholar
エンゲヴィックとヴァーサロヴィッチ、2017年
M.A.エンゲヴィク、J.ヴェルサロヴィッチ
有益微生物の生化学的特徴:治療微生物学の基礎
Microbiol. Spectr., 5 (5) (2017), 10.1128/microbiolspec.bad-0012-2016
グーグル・スカラー
フェナー、2020
A. フェナー
蛾由来の抗菌ペプチドはUPECのバイオフィルムを根絶でき、新たな治療選択肢を提供する可能性がある
Nat. Rev. Urol., 17 (4) (2020), p. 191, 10.1038/s41585-020-0309-9
Scopusで見るGoogle Scholar
フェリエールら、2007年
L. フェリエール, V. ハンコック, P. クレム
選択された無症候性細菌尿症大腸菌株による尿路病原細菌のバイオフィルム排除
微生物学, 153 (6) (2007), 1711-1719頁, 10.1099/mic.0.2006/004721-0
スコープで見るGoogle Scholar
フェリスら, 2004
M.J.フェリス、A.マスタル、K.E.オルドリッジ、D.フォーテンベリー、P.L.フィデル、D.H.マーティン
最近報告されたメトロニダゾール耐性嫌気性菌Atopobium vaginaeと細菌性膣炎との関連性
BMC Infect. Dis., 4 (2004), pp.1-8, 10.1186/1471-2334-4-5
Google Scholar
フェリーら、2007年
S.A. Ferry, S.E. Holm, H. Stenlund, R. Lundholm, T.J. Monsen
女性における合併症のない下部尿路感染症に対するピブメシリナムの異なる投与量および投与期間とプラセボ療法との比較による臨床的および細菌学的転帰: LUTIWプロジェクト
Scand. J. Prim. Health Care, 25 (1) (2007), pp.
論文番号:10.1080/02813430601183074
CrossRefView in ScopusGoogle Scholar
フィールドら、2008
D. フィールド、P.M.O.コナー、P.D.コッター、C.ヒル、R.P.ロス
特定のグラム陽性病原体に対する活性を増強したナイシン変異体の作製
Mol. 微生物学, 69 (1) (2008), 218-230頁
doi: 10.1111/j.1365-2958.2008.06279.x.
CrossRefView in ScopusGoogle Scholar
フィールドら、2010
D. フィールド、C.ヒル、P.D.コッター、R.P.ロス
ランティバイオティクス生物工学における「黄金時代」の幕開け
Mol. Microbiol., 78 (5) (2010), pp.1077-1087, 10.1111/j.1365-2958.2010.07406.x
スコープで見るGoogle Scholar
フィールドら、2012
D. フィールド、M.ベグリー、P.M.オコナー、K.M.デイリー、F.ヒューゲンホルツ、P.D.コッター、C.ヒル、R.P.ロス
グラム陽性およびグラム陰性病原体に対して増強された活性を有するバイオエンジニアリングされたナイシンa誘導体
PLoS One, 7 (10) (2012), 10.1371/journal.pone.0046884
グーグル・スカラー
フィヌケーン, 2017
T.E.フィヌケーン
"尿路感染症"-重鎮のためのレクイエム
J. Am. Geriatr. Soc., 65 (8) (2017), pp.
doi: 10.1111/jgs.14907.
CrossRefView in ScopusGoogle Scholar
フローレス=ミレレスら、2015年
A.L.フローレス=ミレレス、J.N.ウォーカー、M.キャパロン、S.J.ハルトグレン
尿路感染症:疫学、感染機序、治療オプション
Nat. Rev. Microbiol., 13 (5) (2015), pp.269-284, 10.1038/nrmicro3432
Scopusで見るGoogle Scholar
フォードら、2019年
B.M.フォアード、L.W.ロバーツ、M.D.ファン、K.M.ピーターズ、B.A.フレミング、C.W.ラッセル、S.M.レンヘル、J.B.マイヤーズ、A.P.バーカー、M.A.フィッシャー、T.M.チョン、W.F.イン、K.G.チャン、M.A.シェンブリ、M.A.マルベイ、S.A.ビートソン
再発性尿路感染症における大腸菌ST131系統の集団動態
Nat. Commun., 10 (1) (2019), pp.1-10, 10.1038/s41467-019-11571-5
グーグル・スカラー
フォースターら、2019年
C.S. Forster、M.H. Hsieh、M. Pérez-Losada、L. Caldovic、H. Pohl、I. Ljungberg、B. Sprague、C. Stroud、S. Groah
ラクトバチルス・ラムノサスGGの単回膀胱内注入は神経因性膀胱の小児および成人において安全である:第Ia相臨床試験
J. Spinal Cord. Med, 0 (0) (2019), pp.1-8, 10.1080/10790268.2019.1616456
Scopusで見るGoogle Scholar
Fourcadeら、2015
C. フルケード、L.カニーニ、J.P.ラヴィーニュ、A.ソット
フランスの大学病院における単菌性と多菌性の腸球菌フェカリス菌尿の比較
Eur. J. Clin. Microbiol. Infect. Dis., 34 (8) (2015), 1667-1673頁, 10.1007/s10096-015-2403-0
スコープで見るGoogle Scholar
ファウツら、2012年
D.E. Fouts、R. Pieper、S. Szpakowski、H. Pohl、S. Knoblach、M.J. Suh、S.T. Huang、I. Ljungberg、B.M. Sprague、S.K. Lucas、M. Torralba、K.E. Nelson、S.L. Groah
脊髄損傷に伴う神経因性膀胱において、16S rDNAの統合次世代シークエンシングとメタプロテオミクスにより、健常尿中マイクロバイオームと無症候性細菌尿とを鑑別した。
J. Transl. Med., 10 (1) (2012), pp.1-17, 10.1186/1479-5876-10-174
グーグル奨学生
フォックスマン, 2014
B. フォックスマン
尿路感染症症候群。発生、再発、細菌学、危険因子、疾病負担
Infect. Dis. Clin. North Am., 28 (1) (2014), pp.1-13, 10.1016/j.idc.2013.09.003
PDFで記事を見るScopusで記事を見るGoogle Scholar
フォックスマンら、2000年
B. フォックスマン、R.バーロウ、H.ダーシー、B.ガレスピー、J.D.ソーベル
尿路感染症: 自己申告による発生率と関連費用
Ann. Epidemiol., 10 (8) (2000), 509-515頁, 10.1016/S1047-2797(00)00072-7
PDFを見る記事を見るScopusで見るGoogle Scholar
フランクら, 2009
D.N.フランク、S.S.ウィルソン・セント、A.L.アマンド、N.R.ペース
フォーリー尿道カテーテルバイオフィルムの培養非依存微生物学的解析
PLoS One, 4 (11) (2009), pp.1-7, 10.1371/journal.pone.0007811
グーグル・スカラー
フランゾーザら、2015
E.A. Franzosa、T. Hsu、A. Sirota-Madi、A. Shafquat、G. Abu-Ali、X.C. Morgan、C. Huttenhower
シークエンシングとその先へ:微生物群集プロファイリングのための分子「オミックス」の統合
Nat. Rev. Microbiol., 13 (6) (2015), 360-372頁, 10.1038/nrmicro3451
Scopusで見るGoogle Scholar
Gajer et al.
P. Gajer, R.M. Brotman, G. Bai, J. Sakamoto, U.M.E. Schütte, X. Zhong, S.S.K. Koenig, L. Fu, Z. Ma, X. Zhou, Z. Abdo, L.J. Forney, J. Ravel
ヒト膣内細菌叢の時間的動態
Sci. Transl. Med., 4 (132) (2012), 10.1126/scitranslmed.3003605
グーグル奨学生
ガルティエら、2016
M. ガルティエ、L. デ・ソルディ、D. マウラ、H. アラキ、S. ヴォラン、M.A. ディリーズ、L. デバルビユー
バクテリオファージによる抗生物質耐性尿路病原体の腸管キャリッジの低減と微生物叢組成への影響の低減
環境。Microbiol., 18 (7) (2016), 2237-2245頁
doi: 10.1111/1462-2920.13284
CrossRefView in ScopusGoogle Scholar
ガルバンら、2016
E.M.ガルバン、C.マテイカ、L.イエルピ
多菌性尿道カテーテル関連細菌尿から分離された尿路病原体によりin vitroで形成された二種バイオフィルムにおける種間相互作用の役割
バイオファウリング, 32 (9) (2016), pp.1067-1077, 10.1080/08927014.2016.1231300
スコープで見るGoogle Scholar
ガルシアら、2011
E.C.ガルシア、A.R.ブランボー、H.L.T.モブレー
尿路感染における大腸菌鉄獲得システムの冗長性と特異性
Infect. Immun., 79 (3) (2011), 1225-1235頁, 10.1128/IAI.01222-10
スコープで見るGoogle Scholar
ガルシア-グティエレスら、2019年
E. ガルシア-グティエレス、M.J.メイヤー、P.D.コッター、A.ナルバド
新規抗菌薬の供給源としての腸内細菌叢
Gut Microbes, 10 (1) (2019), pp.1-21, 10.1080/19490976.2018.1455790
Scopusで見るGoogle Scholar
ガレットら、2018
A. ガレット、K.トーマス=ホワイト、A.J.ウルフ、C.プトンティ
女性の尿中マイクロバイオームにおけるウイルスゲノムの検出
J. Gen. Virol., 99 (8) (2018), 1141-1146頁, 10.1099/jgv.0.001097
スコープで見るGoogle Scholar
ガレットら、2019
A. ガレット、T.ミラー=エンスミンガー、A.J.ウルフ、C.プトンティ
下部尿路のバクテリオファージ
Nat. Rev. Urol., 16 (7) (2019), 422-432頁, 10.1038/s41585-019-0192-4
Scopusで見るGoogle Scholar
ガストンら、2020年
J.R.ガストン、M.J.アンダーセン、A.O.ジョンソン、K.L.ベアー、C.M.サリバン、L.B.グーターマン、A.N.ホワイト、A.L.ブラウアー、B.S.リアマン、A.L.フローレス=ミレレス、C.E.アームブルスター
エンテロコッカス・フェカリス(Enterococcus faecalis)の多微生物間相互作用は、バイオフィルム形成、抗生物質不応性、およびカテーテル尿路の持続的なコロニー形成を促進する。
病原体, 9 (10) (2020), 1-20頁, 10.3390/pathogens9100835
スコープで見るGoogle Scholar
ゲルダートら、2018年
K.G.ゲルダート、S.コミネニ、M.フォーブス、M.ヘイワード、G.M.ダニー、N.H.サルツマン、Y.N.カズネシス
腸管におけるバンコマイシン耐性腸球菌の減少を目的とした大腸菌Nissle 1917の工学的作製
Bioeng. Transl. Med., 3 (3) (2018), pp.197-208
doi: 10.1002/btm2.10107
CrossRefGoogle Scholar
Ghani et al.
R. Ghani, B.H. Mullish, J.A.K. McDonald, A. Ghazy, H.R.T. Williams, E.T. Brannigan, S. Mookerjee, G. Satta, M. Gilchrist, N. Duncan, R. Corbett, A.J. Innes, J. Pavlů, M.R. Thursz, F. Davies, J.R. Marchesi
脱コロニー化ではなく疾病予防:多剤耐性菌にコロニー形成された患者における糞便微生物叢移植のモデル
Clin. Infect. DIS., 72 (8) (2021), 1444-1447頁, 10.1093/cid/ciaa948
スコープで見るGoogle Scholar
ギルバートら、2017
N.M.ギルバート、V.P.オブライエン、A.L.ルイス
一過性の微生物叢曝露は膀胱における休眠大腸菌感染を活性化し、再発性疾患の重篤な転帰を促す
PLoS Pathog., 13 (3) (2017), pp.1-19, 10.1371/journal.ppat.1006238
スコープで見るGoogle Scholar
Gillorら、2004年
O. ギラー、B.C.カーカップ、M.A.ライリー
コリシンとマイクロシン:次世代の抗菌薬
アドバンス応用微生物学, 54 (2004), 129-146頁, 10.1016/S0065-2164(04)54005-4
PDFを見る記事を見るScopusで見るGoogle Scholar
Gillorら, 2005
O. ギラー、L. ニグロ、M. ライリー
遺伝子組み換えバクテリオシンと次世代抗菌薬としての可能性
Curr. Pharm. Des., 11 (8) (2005), 1067-1075頁, 10.2174/1381612053381666
スコープで見るGoogle Scholar
グリニエヴィッチら、2019年
K. グリニエヴィッチ、G.M.シュナイダー、B.J.ライデンハワー、C.J.ウィリアムズ、Y.ソング、M.A.ファラージ、K.ミラー、L.J.フォーニー
閉経前女性と閉経後女性の膣マイクロバイオームの比較
Front. Microbiol., 10 (193) (2019), pp.1-9, 10.3389/fmicb.2019.00193
グーグル・スカラー
ゴーら、2017
H.M.S.ゴー、M.H.A.ヨン、K.K.L.チョン、K.A.クライン
腸球菌のコロニー形成と感染研究のためのモデル系
Virulence, 8 (8) (2017), pp.1525-1562, 10.1080/21505594.2017.1279766
スコープで見るGoogle Scholar
ゴッチックら、2017
C. Gottschick、Z.L. Deng、M. Vital、C. Masur、C. Abels、D.H. Pieper、I. Wagner-Döbler
男女の尿中微生物叢と、女性における細菌性膣炎および抗生物質治療中のその変化
マイクロバイオーム, 5 (1) (2017), p. 99, 10.1186/s40168-017-0305-3
スコープで見るGoogle Scholar
グラスプントナーら、2018年
S. グラスペントナー、N.ローパー、S.キュンツェル、J.F.ベインズ、J.ルップ
検証された超可変領域の選択は、女性性器管の16Sベースの微生物相研究において極めて重要である
Sci. Rep., 8 (1) (2018), 4-10頁, 10.1038/s41598-018-27757-8
グーグル・スカラー
グロアら、2019年
S.L. Groah、A.K. Rounds、I.H. Ljungberg、B.M. Sprague、J.K. Frost、R.E. Tractenberg
ラクトバチルス・ラムノサスGGの膀胱内投与は、神経因性下部尿路機能障害を有する成人および小児において安全で忍容性が高い:ヒト初試験
Ther. Adv. Urol., 11 (2019), pp.1-13, 10.1177/1756287219875594
グーグル・スカラー
グロズダノフら、2004年
L. Grozdanov、C. Raasch、J. Schulze、U. Sonnenborn、G. Gottschalk、J. Hacker、U. Dobrindt
非病原性プロバイオティック大腸菌Nissle 1917株のゲノム構造解析
J. Bacteriol., 186 (16) (2004), 5432-5441頁, 10.1128/JB.186.16.5432-5441.2004
スコープで見るGoogle Scholar
グリゴルチェヴィッチら、2021年
B. Grygorcewicz、B. Wojciuk、M. Roszak、N. Łubowska、P. Blstrokaejczak、J. Jursa-Kulesza、R. Rakoczy、H. Masiuk、B. Dogowska
ヒト尿モデルにおけるアシネトバクター・バウマンニバイオフィルムに対する環境ファージベースのカクテルと抗生物質の併用効果
Microb. Drug Resist., 27 (1) (2021), pp.25-35, 10.1089/mdr.2020.0083
スコープで見るGoogle Scholar
Guarnerら、2012年
F. Guarner、A.G. Khan、J. Garisch、R. Eliakim、A. Gangl、A. Thomson、J. Krabshuis、T. Lemair、P. Kaufmann、J.A. de Paula、R. Fedorak、F. Shanahan、M.E. Sanders、H. Szajewska、B.S. Ramakrishna、T. Karakan、N. Kim
世界消化器病学会グローバルガイドライン
J. Clin. Gastroenterol., 46 (6) (2012), 468-481頁, 10.1097/MCG.0b013e3182549092
スコープで見るGoogle Scholar
グリエッタ, 2017
A. グリエッタ
女性における再発性尿路感染症: 危険因子、病因、病態、予防法
Future Microbiol, 12 (3) (2017), pp.239-246, 10.2217/fmb-2016-0145
Scopusで見るGoogle Scholar
GuhaSarkarおよびBanerjee, 2010
S. グハサルカール、R.バネルジー
膀胱内薬物送達: 課題、現状、機会、新規戦略
J. Control. リリース, 148 (2) (2010), pp.147-159, 10.1016/j.jconrel.2010.08.031
PDFを見る記事を見るScopusで見るGoogle Scholar
ギュミュシュら、2019年
D. ギュミュシュ、F. カラユクセク、Ö. セフェル、E. ヨリュック、G. ウズ、M. アンア・キュチュッカー
UPEC株における増殖および病原性遺伝子の発現調節におけるホルモンの役割
Microb. Pathog., 132 (2019), 319-324頁, 10.1016/j.micpath.2019.05.019
PDFで記事を見るScopusで記事を見るGoogle Scholar
グプタら、2011年
K. グプタ、T.M.フートン、K.G.ネイバー、B.ウルト、R.コルガン、L.G.ミラー、G.J.モラン、L.E.ニコル、R.ラズ、A.J.シェーファー、D.E.ソーパー
女性における合併症のない急性膀胱炎および腎盂腎炎の治療に関する国際診療ガイドライン:米国感染症学会および欧州微生物・感染症学会による2010年最新版
Clin. Infect. Dis., 52 (5) (2011), 103-120頁, 10.1093/cid/ciq257
グーグル奨学生
グプタら、2013
S. グプタ、E.E.ブラム、R.ワイス
遺伝的にプログラム可能な病原体の感知と破壊
ACS Synth. Biol., 2 (12) (2013), pp.715-723, 10.1021/sb4000417
スコープで見るGoogle Scholar
グプタら、2018
S. グプタ、A.R.ジャクソン、D.G.ダジュスタ、D.J.マクラウド、S.A.アルパート、V.R.ジャヤンティ、K.マクヒュー、A.R.シュワデラー、B.ベックネル、C.B.チン
尿中抗菌ペプチド:閉塞性尿路障害の新規バイオマーカーの可能性
J. Pediatr. Urol., 14 (3) (2018), pp.238.e1-238.e6, 10.1016/j.jpurol.2018.03.006
PDFを見る記事を見るGoogle Scholar
ガーニーら、2017年
J. ガーニー、L.アルダカク、A.ベッツ、C.グーガ=バルベラ、T.ポワゾ、O.カルツ、M.E.ホッホバーグ
共進化する細菌-ファージ相互作用におけるネットワーク構造と局所適応
Mol. Ecol., 26 (7) (2017), pp.
doi: 10.1111/mec.14008
CrossRefView in ScopusGoogle Scholar
グティエレスら、2018年
D. グティエレス、L.フェルナンデス、A.ロドリゲス、P.ガルシア
ファージ溶菌タンパク質は黄色ブドウ球菌を殺す秘密兵器か?
mBio, 9 (1) (2018), pp.1-17, 10.1128/mBio.01923-17
グーグル・スカラー
ハンコックら、2008
V. ハンコック、L. フェリエール、P. クレム
ヒト尿中における尿路感染性大腸菌の効率的なバイオフィルム形成には、第二鉄イエルシニアバクチン取り込み受容体FyuAが必要である。
微生物学, 154 (1) (2008), 167-175頁, 10.1099/mic.0.2007/011981-0
スコープで見るGoogle Scholar
ハンコックら、2010a
V. ハンコック、M. ダール、P. クレム
プロバイオティクス大腸菌Nissle 1917株は、バイオフィルム形成において腸内病原体を凌駕する
J. Med. 微生物学, 59 (4) (2010), 392-399頁, 10.1099/jmm.0.008672-0
スコープで見るGoogle Scholar
ハンコックら、2010b
V. ハンコック、R.M.ヴェイボルグ、P.クレム
プロバイオティック大腸菌Nissle 1917株および83972株とUPEC CFT073株の機能ゲノム解析:トランスクリプトーム、増殖およびバイオフィルム形成の比較
Mol. Genet. Genom., 284 (6) (2010), 437-454頁
論文番号: 10.1007/s00438-010-0578-8
CrossRefScopusで表示Google Scholarで表示
ハンナンら, 2012
T.J. Hannan、M. Totsika、K.J. Mansfield、K.H. Moore、M.A. Schembri、S.J. Hultgren
持続性・細胞内尿路病原性大腸菌膀胱感染症における宿主-病原体チェックポイントと集団ボトルネック
FEMS Microbiol. Rev., 36 (3) (2012), pp.616-648, 10.1111/j.1574-6976.2012.00339.x
スコープで見るGoogle Scholar
ヘイズら、2019
K. ヘイズ、D.フィールド、C.ヒル、F.オハロラン、L.コッター
ナイシンの新規生物工学的誘導体は、臨床Streptococcus agalactiae分離株に対して増強された抗菌活性を示す
J. Glob. Antimicrob. Resist., 19 (2019), pp.
10.1016/j.jgar.2019.04.010.
PDFで記事を見るScopusで記事を見るGoogle Scholar
ヒーリーら、2013
B. ヒーリー、D.フィールド、P.M.オコナー、C.ヒル、P.D.コッター、R.P.ロス
ナイシンヒンジの集中的な変異導入により、強化された誘導体の合理的な設計が可能になった
PLoS ONE, 8 (11) (2013), pp.1-8, 10.1371/journal.pone.0079563
グーグル奨学生
ヒルトら、2014
E.E.ヒルト、K.マッキンリー、M.M.ピアース、A.B.ローゼンフェルド、M.J.ジリオックス、E.R.ミューラー、L.ブルーベイカー、X.ガイ、A.J.ウルフ、P.C.シュレッケンバーガー
尿は無菌ではない:成人女性の膀胱における常在細菌叢を検出するための強化尿培養技術の使用
J. Clin. Microbiol., 52 (3) (2014), pp.871-876, 10.1128/JCM.02876-13
スコープで見るGoogle Scholar
平川ら、2019
H. 平川秀樹、鈴江健一、倉林健一、冨田秀樹
尿路病原性大腸菌のtol-palシステムは、膀胱上皮細胞への最適な内在化と細胞内凝集、マウスの尿路コロニー形成、および細菌の運動性に関与する
Front. Microbiol., 10 (1827) (2019), pp.1-14, 10.3389/fmicb.2019.01827
グーグル奨学生
平塚ら, 2000
T. 平塚崇, 中里正彦, 井伊日出男, 峯松孝明, 茅野直樹, 中西孝明, 清水昭夫, 寒川和彦, 松倉正明
ヒトβ-ディフェンシン-1の構造解析と尿路感染症における意義
ネフロン, 85 (1) (2000), 34-40, 10.1159/000045627
スコープで見るGoogle Scholar
Hochstedlerら、2021年
B.R. Hochstedler、L. Burnett、T.K. Price、C. Jung、A.J. Wolfe、L. Brubaker
再発性尿路感染症女性の尿中微生物叢:収集と培養法
Int. Urogynecol. J. (2021), 10.1007/s00192-021-04780-4
Google Scholar
Høiby et al.
N. Høiby, T. Bjarnsholt, M. Givskov, S. Molin, O. Ciofu
細菌バイオフィルムの抗生物質耐性
Int. J. Antimicrob. Agents, 35 (4) (2010), pp.
10.1016/j.ijantimicag.2009.12.011
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ホラほか, 2010
V. ホラ、F.ルジッカ、M.ホルカ
超音波処理技術を用いた尿路バイオフィルム感染における微生物の多様性
FEMS Immunol. Med. Microbiol., 59 (3) (2010), pp.525-528, 10.1111/j.1574-695X.2010.00703.x
スコープで見るGoogle Scholar
フルバチェックら、2020年
J.フルバチェック、P.セルマック、R.ザコバル
中央ヨーロッパにおける泌尿器病原体の現在の抗生物質耐性傾向:3次病院泌尿器科からの調査 2011-2019
アンチバイオティクス, 9 (9) (2020), pp.1-11, 10.3390/antibiotics9090630
スコープで見るGoogle Scholar
ハルら、2002年
R.A.ハル、W.H.ドノバン、M.デル・テルゾ、C.スチュワート、M.ロジャース、R.O.ダロイシュ
大腸菌による神経因性ヒト膀胱のコロニー形成における1型フィンブリアおよびP型フィンブリア特異的付着の役割
Infect. Immun., 70 (11) (2002), 6481-6484頁, 10.1128/IAI.70.11.6481-6484.2002
スコープで見るGoogle Scholar
ヒトマイクロバイオームプロジェクトコンソーシアム、2012
ヒトマイクロバイオームプロジェクトコンソーシアム
ヒトマイクロバイオーム研究の枠組み
Nature, 486 (7402) (2012), 215-221頁, 10.1038/nature11209
Google Scholar
ジーら, 1995
G. Ji, R.C. Beavis, R.P. Novick
オクタペプチドフェロモンによるブドウ球菌病原性の細胞密度制御
PNAS USA, 92 (26) (1995), 12055-12059頁
論文番号:10.1073/pnas.92.26.12055
CrossRefScopusで表示Google Scholarで表示
ヨハンセンら, 2006
T.E.B. Johansen、M. Çek、K.G. Naber、L. Stratchounski、M.V. Svendsen、P. Tenke
泌尿器科における院内尿路感染:病原体、感受性および抗生物質の使用。PEPおよびPEAP研究からのデータ
Int. J. Antimicrob. Agents, 28 (SUPPL. 1) (2006), pp.
doi: 10.1016/j.ijantimicag.2006.05.005
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ジョーンズら、2021年
J. ジョーンズ、C.P.マーフィー、R.D.スリーター、E.P.カリガン
ウロビオーム、尿路感染症、代替治療薬の必要性
Microb. Pathog., 110 (2021), Article 105295, 10.1016/j.micpath.2021.105295
PDFで記事を見るScopusで記事を見るGoogle Scholar
ジョーンズ・フリーマンら、2021年
B. ジョーンズ=フリーマン、M.チョンワウォン、V.R.マルセリーノ、A.V.デシュパンデ、S.C.フォースター、M.R.スターキー
尿路疾患におけるマイクロバイオームと宿主粘膜の相互作用
粘膜免疫学, 14 (4) (2021), pp.1-14, 10.1038/s41385-020-00372-5
グーグル奨学生
ジョベルら、2016
J. Jovel、J. Patterson、W. Wang、N. Hotte、S. O'Keefe、T. Mitchel、T. Perry、D. Kao、A.L. Mason、K.L. Madsen、G.K.S. Wong
16Sまたはショットガンメタゲノミクスを用いた腸内細菌叢の特性解析
Front. Microbiol., 7 (459) (2016), pp.1-17, 10.3389/fmicb.2016.00459
グーグル・スカラー
ユングとブルーベイカー、2020
C. ユング、L. ブルーベイカー
閉経後女性における再発性尿路感染症の病因と管理
Climacteric, 22 (3) (2020), 242-249頁, 10.1080/13697137.2018.1551871
Google Scholar
影山ら、1996
M. 影山, 小林正樹, 佐野洋一, 正木秀夫
ピロシン-コリシンキメラタンパク質の構築と特性評価
J. Bacteriol., 178 (1) (1996), 103-110頁, 10.1128/jb.178.1.103-110.1996
ScopusGoogle Scholarで見る
カイ=ラーセンら, 2010
Y. Kai-Larsen, P. Lüthje, M. Chromek, V. Peters, X. Wang, Å. Holm, L. Kádas, K.O. Hedlund, J. Johansson, M.R. Chapman, S.H. Jacobson, U. Römling, B. Agerberth, A. Brauner
尿路病原性大腸菌は免疫応答を調節し、そのキュリフィンブリアは抗菌ペプチドLL-37と相互作用する。
PLoS Pathog., 6 (7) (2010), pp.1-16, 10.1371/journal.ppat.1001010
スコープで見るGoogle Scholar
カルシーら、2020年
M. Kalsy、M. Tonk、M. Hardt、U. Dobrindt、A. Zdybicka-Barabas、M. Cytrynska、A. Vilcinskas、K. Mukherjee
昆虫抗菌ペプチドセクロピンAは尿路病原性大腸菌のバイオフィルムを破壊する
npj Biofilms Micro, 6 (1) (2020), 10.1038/s41522-020-0116-3
Google Scholar
カンダスワミら, 2013
K. Kandaswamy、T.H. Liew、C.Y. Wang、E. Huston-Warren、U. Meyer-Hoffert、K. Hultenby、J.M. Schröder、M.G. Caparon、S. Normark、B. Henriques-Normark、S.J. Hultgren、K.A. Kline
エンテロコッカス・フェカリス(Enterococcus faecalis)において、ヒトβ-ディフェンシン2による局所的ターゲティングが病原性因子集合部位を破壊する。
PNAS USA, 110 (50) (2013), pp.20230-20235, 10.1073/pnas.1319066110
スコープで見るGoogle Scholar
カールソンら、2012年
M. Karlsson, N. Scherbak, H. Khalaf, P.E. Olsson, J. Jass
プロバイオティクス乳酸菌GR-1から放出される物質は、大腸菌刺激膀胱細胞におけるNF-κB活性を増強する。
FEMS Immunol. Med. Microbiol., 66 (2) (2012), pp.147-156, 10.1111/j.1574-695X.2012.00994.x
スコープで見るGoogle Scholar
カルピンスキーおよびスカラドキエヴィッチ, 2016
T.M.カルピンスキー, A.K.スカラドキエヴィッチ
バクテリオシン
Encycl. フードヘルス(2016)、312-319頁、10.1016/B978-0-12-384947-2.00053-2
PDFを見る記事を見るGoogle Scholar
カルステンスら、2016
L. Karstens、M. Asquith、S. Davin、P. Stauffer、D. Fair、W.T. Gregory、J.T. Rosenbaum、S.K. Mcweeney、R. Nardos
尿中マイクロバイオームは切迫性尿失禁とその重症度に関与するか?
Front. Cell. Infect. Microbiol., 6 (78) (2016), pp.1-13, 10.3389/fcimb.2016.00078
Google Scholar
カルステンスら、2018
L. Karstens、M. Asquith、V. Caruso、J.T. Rosenbaum、D.A. Fair、J. Braun、W.T. Gregory、R. Nardos、S.K. McWeeney
尿中微生物叢の群集プロファイリング:低バイオマス試料に関する考察
Nat. Rev. Microbiol., 15 (12) (2018), 735-749頁, 10.1038/s41585-018-0104-z
スコープで見るGoogle Scholar
Karstensら、2021年
L. Karstens、N.Y. Siddiqui、T. Zaza、A. Barstad、C.L. Amundsen、T.A. Sysoeva
尿中マイクロバイオームの解析に使用されるDNA分離キットのベンチマーキング
Sci. Rep., 11 (1) (2021), pp.1-9, 10.1038/s41598-021-85482-1
スコープで見るGoogle Scholar
キョウら、2016
D. Keogh、W.H. Tay、Y.Y. Ho、J.L. Dale、S. Chen、S. Umashankar、R.B.H. Williams、S.L. Chen、G.M. Dunny、K.A. Kline
腸球菌の代謝産物を手がかりに、種間ニッチ調節と多菌感染が促進される
Cell Host Microbe, 20 (4) (2016), 493-503頁, 10.1016/j.chom.2016.09.004
PDFを見る記事を見るScopusで見るGoogle Scholar
キムら、2010年
K. Kim, K.P. Kim, J. Choi, J.A. Lim, J. Lee, S. Hwang, S. Ryu
外膜タンパク質A(OmpA)およびX(OmpX)はクロノバクター・サカザキの菌体外侵入に必須である。
Appl. Environ. 微生物学, 76 (15) (2010), 5188-5198頁, 10.1128/AEM.02498-09
スコープで見るGoogle Scholar
キングら, 2003
A.E.キング、D.C.フレミング、H.O.D.クリッチリー、R.W.ケリー
ヒト子宮内膜における天然抗菌薬β-ディフェンシン3および4の発現の違い
J. Reprod. 免疫学, 59 (1) (2003), pp.1-16, 10.1016/S0165-0378(02)00083-9
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
クラインとハルトグレン、2020年
R.D.クライン、S.J.ハルトグレン
尿路感染症:微生物の病原性、宿主と病原体の相互作用、新しい治療戦略
Nat. Rev. Microbiol., 18 (4) (2020), 211-226頁, 10.1038/s41579-020-0324-0
スコープで見るGoogle Scholar
クレムら、2006
P. Klemm、V. Roos、G.C. Ulett、C. Svanborg、M.A. Schembri
大腸菌無症候性細菌尿症83972株の分子学的特性解析: 病原体の飼いならし
Infect. Immun., 74 (1) (2006), 781-785頁, 10.1128/IAI.74.1.781-785.2006
スコープで見るGoogle Scholar
クレタら、2014
S. Kleta、M. Nordhoff、K. Tedin、L.H. Wieler、R. Kolenda、S. Oswald、T.A. Oelschlaeger、W. Bleiß、P. Schierack
非定型腸管病原性大腸菌感染に対するプロバイオティクス大腸菌ニッスル1917の抑制効果におけるF1Cフィンブリア、鞭毛および分泌菌体成分の役割
Infect. Immun., 82 (5) (2014), 1801-1812頁, 10.1128/IAI.01431-13
スコープで見るGoogle Scholar
クラインおよびルイス、2016年
K.A.クライン、A.L.ルイス
グラム陽性尿路病原体、多菌性尿路感染症、および尿路の新興微生物叢
Microbiol. Spectr., 4 (2) (2016), 10.1128/microbiolspec.uti-0012-2012
グーグル・スカラー
米須ら、2018
Y.M.Komesu、H.E.Richter、B.Carper、D.L.Dinwiddie、E.S.Lukacz、N.Y.Siddiqui、V.W.Sung、H.M.Zyczynski、B.Ridgeway、R.G.Rogers、L.A.Arya、D.Mazloomdoost、M.G.Gantz
混合性尿失禁女性の尿中マイクロバイオームと同程度の年齢の対照群との比較
Int. Urogynecol. J., 29 (12) (2018), 1785-1795頁, 10.1007/s00192-018-3683-6
スコープで見るGoogle Scholar
Kostakioti et al.
M. コスタキオティ、S.J.ハルトグレン、M.ハジフランギスクー
泌尿器病原性大腸菌の病原性の分子設計図は、抗病原性治療薬開発の手がかりとなる。
Virulence, 3 (7) (2012), 592-594頁, 10.4161/viru.22364
スコープで見るGoogle Scholar
Köves et al.
B. Köves, E. Salvador, J. Grönberg-Hernández, J. Zdziarski, B. Wullt, C. Svanborg, U. Dobrindt
無症候性大腸菌Escherichia coli 83972の長期保菌中に、病原因子レパートリーの変化を伴わずに症状が出現することがまれにある。
J. Urol., 191 (2) (2014), 519-528頁, 10.1016/j.juro.2013.07.060
PDFで記事を表示Scopusで記事を表示Google Scholar
クリシュナンら、2017年
K. クリシュナン、T.チェン、B.J.パスター
口腔マイクロバイオームとその健康と疾患との関連についての実践的ガイド
Oral. Dis., 23 (3) (2017), pp.
doi: 10.1111/odi.12509
CrossRefView in ScopusGoogle Scholar
カイパースら、1992
O.P. Kuipers、H.S. Rollema、W.M.G.J. Yap、H.J. Boot、R.J. Siezen、W.M. De Vos
抗菌ペプチドナイシンにおける脱水アミノ酸残基の工学的研究
J. Biol. Chem., 267 (34) (1992), 24340-24346頁, 10.1016/s0021-9258(18)35771-5
PDFで記事を見るScopusで記事を見るGoogle Scholar
Lagenaurら、2021年
L.A.ラゲナー、A.ヘマーリング、C.チウ、S.ミラー、P.P.リー、C.R.コーエン、T.P.パークス
点と点を結ぶ: 膣内マイクロバイオームの医薬品への応用
J. Infect. Dis., 223 (Suppl 3) (2021), S296-S306頁, 10.1093/infdis/jiaa676
スコープで見るGoogle Scholar
ラゴス, 2013
R. ラゴス
バクテリオシン
ブレンナーズ・エンサイクロペディア・オブ・ジェネティクス、エルゼビア(2013)、277-279頁、10.1016/B978-0-12-374984-0.00291-6
PDFを見る記事を見るScopusで見るGoogle Scholar
ルボーら、2014
D. ルボー, J.-M. ギゴ、C. ベロワン
バイオフィルム関連感染症:臨床管理と抗生物質に対する不応性の基本的側面とのギャップを埋めるために
Microbiol. Mol. Biol. Rev., 78 (3) (2014), pp.510-543, 10.1128/mmbr.00013-14
スコープで見るGoogle Scholar
ライホフら、2021年
R.F.ライホフ、K.L.ニールセン、N.フリモット-メラー
高齢者における無症候性細菌尿(ABU):有病率、病原性、系統、抗生物質耐性および尿中の補体C3
微生物, 9 (2) (2021), p. 390, 10.3390/microorganisms9020390
グーグル・スカラー
ライトナーら、2017
L. Leitner, W. Sybesma, N. Chanishvili, M. Goderdzishvili, A. Chkhotua, A. Ujmajuridze, M.P. Schneider, A. Sartori, U. Mehnert, L.M. Bachmann, T.M. Kessler
経尿道的前立腺切除術を受けた患者における尿路感染症治療のためのバクテリオファージ:無作為化プラセボ対照二重盲検臨床試験
BMC Urol., 17 (1) (2017), 1-6頁, 10.1186/s12894-017-0283-6
グーグル・スカラー
ライトナーら、2021a
L. ライトナー、S.マッカリン、T.M.ケスラー
バクテリオファージ:脊髄損傷後の生活においてどのような役割を果たすか?
Spinal Cord., 59 (9) (2021), 967-970頁, 10.1038/s41393-021-00636-2
スコープで見るGoogle Scholar
ライトナーら、2021b
L. Leitner, A. Ujmajuridze, N. Chanishvili, M. Goderdzishvili, I. Chkonia, S. Rigvava, A. Chkhotua, G. Changashvili, S. McCallin, M.P. Schneider, M.D. Liechti, U. Mehnert, L.M. Bachmann, W. Sybesma, T.M. Kessler
経尿道的前立腺切除術を受けた患者における尿路感染症治療のための膀胱内バクテリオファージ:無作為化プラセボ対照二重盲検臨床試験
Lancet Infect. Dis., 21 (3) (2021), 427-436頁, 10.1016/S1473-3099(20)30330-3
PDFで記事を見るScopusで記事を見るGoogle Scholar
Lev-Sagieら、2019年
A. Lev-Sagie、D. Goldman-Wohl、Y. Cohen、M. Dori-Bachash、A. Leshem、U. Mor、J. Strahilevitz、A.E. Moses、H. Shapiro、S. Yagel、E. Elinav
難治性細菌性膣炎の女性における膣マイクロバイオーム移植
Nat. Med., 25 (10) (2019), pp.1500-1504, 10.1038/s41591-019-0600-6
Scopusで見るGoogle Scholar
ルイスら、2013年
D.A.ルイス、R.ブラウン、J.ウィリアムズ、P.ホワイト、S.K.ジェイコブソン、J.R.マルケージ、M.J.ドレイク
ヒトの尿中マイクロバイオーム;無症候性成人の排尿中の細菌DNA
Front. Cell. Infect. Microbiol., 3 (2013), pp.1-14, 10.3389/fcimb.2013.00041
スコープで見るGoogle Scholar
李ら、2018
B. Li, Q. Huang, A. Cui, X. Liu, B. Hou, L. Zhang, M. Liu, X. Meng, S. Li.
外膜タンパク質X(OmpX)の過剰発現は、腸管外病原性大腸菌(ExPEC)のバイオフィルム形成とcurli産生に対するTolC不活性化の影響を補う
Front. Cell. Infect. Microbiol., 8 (208) (2018), pp.1-8, 10.3389/fcimb.2018.00208
PDFを見る記事を見るGoogle Scholar
Liao et al.
K.S. Liao、S.M. Lehman、D.J. Tweardy、R.M. Donlan、B.W. Trautner
バクテリオファージは、尿道カテーテル上の緑膿菌バイオフィルム形成予防のための細菌干渉と相乗効果がある。
J. Appl. Microbiol., 113 (6) (2012), 1530-1539頁
doi: 10.1111/j.1365-2672.2012.05432.x.
CrossRefView in ScopusGoogle Scholar
リンドバーグら、1975年
U. リンドベリ、L.A.ハンソン、U.ヨーダル、G.リジン-ヤンソン、K.リンカーン、S.オーリング
女子学生における無症候性細菌尿
アクタ・パエディアトル, 64 (3) (1975), pp.432-436
doi: 10.1111/j.1651-2227.1975.tb03860.x
CrossRefView in ScopusGoogle Scholar
ルナ=ピネダら、2019年
V.M. Luna-Pineda、L. Moreno-Fierros、V. Cázares-Domínguez、D. Ilhuicatzi-Alvarado、S.A. Ochoa、A. Cruz-Córdova、P. Valencia-Mayoral、A. Rodríguez-Leviz、J. Xicohtencatl-Cortes
尿路病原性エシェリヒア・コリのCurliは、フィットネス因子として尿路コロニー形成を促進する。
Front. Microbiol., 10 (September) (2019), 10.3389/fmicb.2019.02063
グーグル・スカラー
LüthjeおよびBrauner, 2016
P. リュティエ、A.ブラウナー
尿路感染症の予防と治療における新たな戦略
病原体, 5 (1) (2016), 10.3390/pathogens5010013
グーグル・スカラー
マジストロとスティーフ、2019年
G.マジストロ、C.G.スティーフ
尿路マイクロバイオーム:すべての未解決の疑問に対する答え?
Eur. Urol. Focus, 5 (1) (2019), 36-38頁, 10.1016/j.euf.2018.06.011
PDFで記事を見るScopusで記事を見るGoogle Scholar
マックら、2013
T.N.マック、K.S.スファノス、H.ブリュッゲマン
根治的前立腺摘除術検体から分離されたプロピオニバクテリウム・アクネス2株のドラフトゲノム配列
ゲノムアナウンス, 1 (6) (2013), p. 2013, 10.1128/genomeA.01071-13
グーグル奨学生
マリクら、2020
S. マリク、P.K.シドゥ、J.S.ラナ、K.ネーラ
ファージ療法による尿路感染症の管理:新規アプローチ
Folia Microbiol, 65 (2) (2020), 217-231頁, 10.1007/s12223-019-00750-y
スコープで見るGoogle Scholar
マニエロら、2021年
M.D. Manniello, A. Moretta, R. Salvia, C. Scieuzo, D. Lucchetti, H. Vogel, A. Sgambato, P. Falabella
昆虫の抗菌ペプチド:抗生物質耐性に対抗する武器の可能性
Cell. Mol. 生命科学, 78 (9) (2021), pp.4259-4282, 10.1007/s00018-021-03784-z
スコープで見るGoogle Scholar
マナーら, 2020
O. マナー、C.L.ダイ、S.A.コーニロフ、B.スミス、N.D.プライス、J.C.ラブジョイ、S.M.ギボンズ、A.T.マジス
健康および疾患マーカーは、数千人の腸内細菌叢組成と相関する
Nat. Commun., 11 (1) (2020), pp.1-12, 10.1038/s41467-020-18871-1
Google Scholar
マンスールら、2020
B. マンスール, Á. Monyók、N. Makra、M. Gajdács、I. Vadnay、B. Ligeti、J. Juhász、D. Szabó、E. Ostorházi
膀胱癌に関連する微生物叢:尿サンプルと組織サンプルの違いを調べる
Sci. Rep. Nat. Publ. Group UK, 10 (1) (2020), pp.1-10, 10.1038/s41598-020-67443-2
スコープで見るGoogle Scholar
マラッツォ, 2011
J.M.マラッツォ
細菌性膣炎の疫学と自然史の解釈:我々はまだ混乱しているのか?
Anaerobe, 17 (4) (2011), pp.186-190, 10.1016/j.anaerobe.2011.03.016
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
マシップら、2020
C. マシップ、C.V.シャノー、M.ブーリー、E.オズワルド
尿路病原性大腸菌におけるmicrocin、colibactin、salmochelin遺伝子クラスター間の相乗的トライアッド
Microb. Infect., 22 (3) (2020), pp.144-147, 10.1016/j.micinf.2020.01.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
Mathurら、2017年
H. マトゥール、D.フィールド、M.C.レア、P.D.コッター、C.ヒル、R.P.ロス
バクテリオシンと抗菌剤の相乗効果:医療と食品の観点から
Front. Microbiol., 8 (1205) (2017), pp.1-18, 10.3389/fmicb.2017.01205
ScopusGoogle Scholarで見る
メイヴィルら、1999
P. Mayville, G. Ji, R. Beavis, H. Yang, M. Goger, R.P. Novick, T.W. Muir
病原性に関与する黄色ブドウ球菌由来合成自己誘導性チオラクトンペプチドの構造活性解析
PNAS USA, 96 (4) (1999), 1218-1223頁, 10.1073/pnas.96.4.1218
ScopusGoogle Scholarで見る
Mazzariolら、2017年
A. マッザリオール、A.バザジ、G.コルナリア
尿路感染症を引き起こす多剤耐性グラム陰性菌:総説
J. Chemother., 29 (2017), pp.2-9, 10.1080/1120009X.2017.1380395
スコープで見るGoogle Scholar
McLellanおよびHunstad、2016年
L.K.マクレーラン、D.A.ハンスタッド
尿路感染症:病因と展望
Trends Mol. Med., 22 (11) (2016), 946-957頁, 10.1016/j.molmed.2016.09.003
PDFで記事を見るScopusで記事を見るGoogle Scholar
マクミランら、2011
A. McMillan、M. Dell、M.P. Zellar、S. Cribby、S. Martz、E. Hong、J. Fu、A. Abbas、T. Dang、W. Miller、G. Reid
乳酸菌による尿路性器バイオフィルムの破壊
Colloids Surf. B, 86 (1) (2011), pp.58-64, 10.1016/j.colsurfb.2011.03.016
PDFで記事を見るScopusで記事を見るGoogle Scholar
ミードら、2020
E. ミード、M.A.スラッタリー、M.ガーベイ
バクテリオシン、強力な抗菌ペプチドと多剤耐性菌との闘い:耐性は無駄か?
アンチバイオティクス, 9 (1) (2020), 10.3390/antibiotics9010032
グーグル奨学生
ミラー・エンスミンガーら、2018年
T. ミラー=エンスミンガー、A.ガレット、J.ブレナー、K.トーマス=ホワイト、A.ザンボム、A.J.ウルフ、C.プトンティ
尿中マイクロバイオームのバクテリオファージ
J. Bacteriol., 200 (7) (2018), 10.1128/JB.00738-17
グーグル・スカラー
ミズラヒマンら, 2013
O. ミズラヒマン、E.R.ダベンポート、Y.ギラド
短いシーケンスリードを用いた細菌16S rRNA遺伝子の分類学的分類:効果的な研究デザインの評価
PLoS One, 8 (1) (2013), pp.18-23, 10.1371/journal.pone.0053608
グーグル・スカラー
モンテイロら、2019
C. モンテイロ、F.コスタ、A.M.ピルティラ、M.V.テジェスヴィ、M.C.L.マルティンス
カラスウリ内生菌由来の抗菌ペプチドのコーティングによる尿道カテーテル関連感染の予防
Sci. Rep., 9 (1) (2019), pp.1-14, 10.1038/s41598-019-47108-5
Scopusで見るGoogle Scholar
モリルら、2020
S. モリル、N.M.ギルバート、A.L.ルイス
細菌性膣炎の原因としてのガードネレラ膣炎:in vivoモデルからの証拠の評価
Front. Cell. Infect. Microbiol., 10 (168) (2020), 10.3389/fcimb.2020.00168
グーグル奨学生
ムーサら、2017
W.K. Mousa、B. Athar、N.J. Merwin、N.A. Magarvey
ヒト微生物叢からの抗生物質と特殊代謝産物
Nat. Prod. Rep. R. Soc. Chem., 34 (11) (2017), pp. 1302-1331, 10.1039/c7np00021a
記事を見るScopusで見るGoogle Scholar
ムスタファら、2018
A. Moustafa、W. Li、H. Singh、K.J. Moncera、M.G. Torralba、Y. Yu、O. Manuel、W. Biggs、J.C. Venter、K.E. Nelson、R. Pieper、A. Telenti
尿路感染症の微生物メタゲノム
Sci. Rep., 8 (1) (2018), pp.1-12, 10.1038/s41598-018-22660-8
グーグル・スカラー
ミューラーら、2017
E.R.ミューラー、A.J.ウルフ、L.ブルーベイカー、C.オピン、U.著者
女性の尿中微生物叢
Curr. Opin. Urol., 27 (3) (2017), pp.282-286, 10.1097/MOU.000000000396.The
ScopusGoogle Scholarで見る
Mulderら、2019年
M. Mulder、D. Radjabzadeh、R.J. Hassing、J. Heeringa、A.G. Uitterlinden、R. Kraaij、B.H. Stricker、A. Verbon
高齢者集団における抗菌薬使用が泌尿生殖器微生物叢の組成に及ぼす影響
BMC Microbiol. (2019), 10.1186/s12866-018-1379-1
グーグル・スカラー
ナルディーニら、2016
P. ナルディーニ、R.A.ナンホイ・パロミーノ、C.パロリン、L.ラギ、C.フォスキ、R.チェヴェニーニ、B.ヴィタリ、A.マランゴーニ
乳酸菌クリスパタスはクラミジア・トラコマティス素体の感染性を阻害する、in vitro研究
Sci. Rep., 6 (29024) (2016), pp.1-11, 10.1038/srep29024
Google Scholar
ナバロら、2020
S.A. Navarro, L. Lanza, L. Acuña, A. Bellomio, M.C. Chalón
Ent35-MccVハイブリッド型バクテリオシンの特徴と応用:現状と展望
Appl. Microbiol. Biotechnol., 104 (14) (2020), 6067-6077頁, 10.1007/s00253-020-10650-8
Scopusで見るGoogle Scholar
ネルソンら, 2010
D.E. Nelson、B. van der Pol、Q. Dong、K.V. Revanna、B. Fan、S. Easwaran、E. Sodergren、G.M. Weinstock、L. Diao、D.J. Fortenberry
無症候性性感染症に関連する特徴的な男性尿中マイクロバイオーム
PLoS One, 5 (11) (2010), pp.1-7, 10.1371/journal.pone.0014116
グーグル・スカラー
ニュージェントら、2020年
M.L.ノイジェント、N.V.フーヤルカー、V.H.グエン、P.E.ジマーン、N.J.デ・ニスコ
ヒト尿中マイクロバイオームと尿路感染症におけるその潜在的役割の理解の進展
mBio, 11 (2) (2020), pp.1-15, 10.1128/mBio.00218-20
Google Scholar
ニコル, 1999
L.E.ニコル
高齢者の尿路感染症:症候性か無症候性か?
Int. J. Antimicrob. Agents, 11 (3-4) (1999), pp.
doi: 10.1016/S0924-8579(99)00028-X.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ニコル, 2003
L.E.ニコル
無症候性細菌尿:スクリーニングのタイミングと治療のタイミング
Infect. Dis. Clin. North Am., 17 (2) (2003), 367-394頁, 10.1016/S0891-5520(03)00008-4
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ニコル, 2008
L.E.ニコル
院内尿路感染予防について
Clin. Infect. Dis., 46 (2) (2008), 251-253頁, 10.1086/524663
スコープで見るGoogle Scholar
ニコルら、2005年
L.E.ニコル、S.ブラッドリー、R.コルガン、J.C.ライス、A.シェーファー、T.M.フートン
成人における無症候性細菌尿の診断と治療に関する米国感染症学会ガイドライン
Clin. Infect. Dis., 40 (10) (2005), p. 1556, 10.1086/430607
スコープで見るGoogle Scholar
ニールセンら、2014a
K.L.ニールセン、P.ダイネセン、P.ラーセン、N.フリモット-メラー
大腸菌性尿路感染症患者と尿路感染症に罹患したことのない健常対照者の糞便性大腸菌'
J. Med. Microbiol., 63 (2014), pp.582-589, 10.1099/jmm.0.068783-0
スコープで見るGoogle Scholar
ニールセンら、2014b
K.L.ニールセン、P.ダイネセン、P.ラーセン、L.ヤコブセン、P.S.アンデルセン、N.フリモットモラー
合併症のない大腸菌尿路感染症における尿中カテリシジンLL-37およびヒトβ-ディフェンシン1の役割
Infect. Immun., 82 (4) (2014), 1572-1578頁, 10.1128/IAI.01393-13
スコープで見るGoogle Scholar
ニールセンら、2017
K.L. Nielsen, M. Stegger, K. Kiil, P.A. Godfrey, M. Feldgarden, B. Lilje, P.S. Andersen, N. Frimodt-Møller
尿路結石患者と健常対照者の尿中病原性大腸菌と糞便分離株の全ゲノム比較
Int. J. Med. Microbiol., 307 (8) (2017), 497-507頁, 10.1016/j.ijmm.2017.09.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
ニールセンら、2021年
K.L. Nielsen, M. Stegger, K. Kiil, B. Lilje, K. Ejrnæs, R.F. Leihof, L. Skjøt-Rasmussen, P. Godfrey, T. Monsen, S. Ferry, A.M. Hammerum, N. Frimodt-Møller
再発性尿路感染症を引き起こす大腸菌: 非再発分離株との比較と再発性感染症におけるゲノム適応
微生物, 9 (7) (2021), 10.3390/microorganisms9071416
Google Scholar
オブライエンら、2020年
V.P.オブライエン、M.S.ジョーエンス、A.L.ルイス、N.M.ギルバート
マウスにおけるgardnerella vaginalisの膀胱曝露が引き金となった再発性大腸菌尿路感染症
J. Vis. Exp., 166 (2020), pp.1-20, 10.3791/61967
スコープで見るGoogle Scholar
オグレディら、2019
M.C.オグレディ、L.バリー、G.D.コーコラン、C.フートン、R.D.スリーター、B.ルーシー
尿路感染症の経験的治療: ガイドラインの合理性は?
J. Antimicrob. Chemother., 74 (1) (2019), 214-217頁, 10.1093/jac/dky405
Scopusで見るGoogle Scholar
オサリバンら、2019年
J.N.オサリバン、M.C.レア、P.M.オコナー、C.ヒル、R.P.ロス
ヒト皮膚微生物叢は、ヒト病原体を死滅させるバクテリオシン産生ブドウ球菌の豊富な供給源である
FEMS Microbiol. Ecol., 95 (2) (2019), pp.1-10, 10.1093/femsec/fiy241
Scopusで見るGoogle Scholar
オサリバンら、2020年
J.N.オサリバン、M.C.レア、C.ヒル、R.P.ロス
外側を守る:皮膚微生物叢を操作する生物学的ツール
FEMS Microbiol. Ecol., 96 (6) (2020), pp.1-14, 10.1093/femsec/fiaa085
スコープで見るGoogle Scholar
オサリバンら、2021年
J.N.オサリバン、P.M.オコナー、M.C.レア、D.フィールド、C.ヒル、R.P.ロス
レンサ球菌およびブドウ球菌由来のナイシン変異体はNZ980'での発現に成功した。
J. Appl. Microbiol., 131 (5) (2021), pp.
doi: 10.1111/jam.15107
CrossRefView in ScopusGoogle Scholar
オラジとオトゥール, 2020
G.オラジ、G.A.オトゥール
「It takes a village」:多菌バイオフィルムの抗菌剤不応性の基礎となるメカニズム
J. Bacteriol., 202 (1) (2020), 10.1128/JB.00530-19
グーグル奨学生
パスターら、2013
I. パスター、A.G.ヌスバウム、J.ギル、S.B.パテル、J.チェン、J.バルデス、O.ストヤジノビッチ、L.R.プラノ、M.トミック-カニック、S.C.デイビス
多細菌性創傷感染症におけるメチシリン耐性黄色ブドウ球菌USA300と緑膿菌の相互作用
PLoS ONE, 8 (2) (2013), pp.1-11, 10.1371/journal.pone.0056846
グーグル奨学生
パッツァーら, 2003
S.I.パッツァー、M.R.バケロ、D.ブラボー、F.モレノ、K.ハントケ
コリシンG、HおよびX決定基は、カテコール酸シデロフォアレセプターFepA、Cir、FiuおよびIronnを利用する可能性のあるマイクロシンMおよびH47をコードする。
微生物学, 149 (9) (2003), 2557-2570頁, 10.1099/mic.0.26396-0
スコープで見るGoogle Scholar
ピアースら、2014
M.M.ピアース、E.E.ヒルト、A.B.ローゼンフェルド、M.J.ジリオックス、K.トーマス-ホワイト、C.フォック、S.クリーテルメス、P.C.シュレッケンバーガー、L.ブルーベイカー、X.ガイ、A.J.ウルフ
女性泌尿器マイクロバイオーム:切迫性尿失禁のある女性とない女性の比較
mBio, 5 (4) (2014), pp.1-12, 10.1128/mBio.01283-14
グーグル・スカラー
ピアースら、2015
M.M. Pearce, M.J. Zilliox, A.B. Rosenfeld, K.J. Thomas-White, H.E. Richter, C.W. Nager, A.G. Visco, I.E. Nygaard, M.D. Barber, J. Schaffer、P. Moalli、V.W. Sung、A.L. Smith、R. Rogers、T.L. Nolen、D. Wallace、S.F. Meikle、X. Gai、A.J. Wolfe、L. Brubaker
切迫性尿失禁における女性泌尿器マイクロバイオーム
Am. J. Obstet. Gynecol., 213 (3) (2015), 347.e1-347.e11頁, 10.1016/j.ajog.2015.07.009
PDFを見る記事を見るGoogle Scholar
ペリングら、2019
H. ペリング、J. Nzakizwanayo、S. Milo、E.L. Denham、W.M. MacFarlane、L.J. Bock、J.M. Sutton、B.V. ジョーンズ
尿道留置カテーテルにおける細菌バイオフィルム形成
Lett. Appl. Microbiol., 68 (4) (2019), pp.277-293
doi: 10.1111/lam.13144
CrossRefScopusで表示Google Scholar
ペネシヤンら、2020
A. ペネシヤン、I.T.ポールセン、M.R.ギリングス、S.ケレバーグ、M.J.マネフィールド
微生物バイオフィルムに対する抗生物質の二次的効果
Front. Microbiol., 11 (2109) (2020), pp.1-8, 10.3389/fmicb.2020.02109
グーグル奨学生
ペトロワら、2016
M.I. Petrova, N.C.E. Imholz, T.L.A. Verhoeven, J. Balzarini, E.J.M. Van Damme, D. Schols, J. Vanderleyden, S. Lebeer
乳酸菌ラムノサスGGのレクチン様分子は病原性エシェリヒア・コリとサルモネラのバイオフィルム形成を阻害する
PLoS One, 11 (8) (2016), 10.1371/journal.pone.0161337
グーグル・スカラー
ペトロワら、2017
M.I.ペトロワ、G.リード、M.ヴァネヒュッテ、S.ルベール
ラクトバチルス・イナーズ: 敵か味方か?
Trends Microbiol, 25 (3) (2017), pp.182-191, 10.1016/j.tim.2016.11.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
ペトロワら、2018
M.I.ペトロワ、J.M.マクレイム、S.ウイツ、T.ヴァーホーヴェン、J.ヴァンダーレイデン、G.B.グロア、S.ルベール、G.リード
膣プロバイオティクス乳酸菌GR-1の比較ゲノム解析と表現型解析
Front. Microbiol., 9 (1278) (2018), pp.1-12, 10.3389/fmicb.2018.01278
グーグル奨学生
ピノら、2019
A. ピノ、E.バルトロ、C.カッジア、A.チャンチ、C.L.ランダッツォ
プロバイオティクス候補としての膣乳酸菌の検出
Sci. Rep., 9 (1) (2019), pp.1-10, 10.1038/s41598-019-40304-3
グーグル・スカラー
ピスコッタら、2015
F.J.ピスコッタ、J.M.タープ、W.R.リュー、A.J.リンク
遺伝的にコードされた非カノニカルアミノ酸による、ラッソペプチドMccJ25の化学的多様性の拡大
ChemComm, 51 (2) (2015), pp.
doi: 10.1039/c4cc07778d
スコープで見るGoogle Scholar
プラダンとワイス、2020
S. プラダン、A.A.ワイス
ヒト腸管オルガノイドにおける大腸菌ニッスルのプロバイオティクス特性
mBio, 11 (4) (2020), pp.1-16, 10.1128/mBio.01470-20
グーグル奨学生
プラベショチヌントら、2019年
P. プラヴェショティヌント、A.M.デュラジ=タッテ、I.ゲルファット、F.バール、D.B.チョウ、N.S.ジョシ
大腸菌ニッスル1917を工学的に改変し、マトリックスに繋がった治療ドメインを腸に送達する
Nat. Commun., 10 (1) (2019), 10.1038/s41467-019-13336-6
グーグル・スカラー
プライスら、2016
T.K. Price、T. Dune、E.E. Hilt、K.J. Thomas-White、S. Kliethermes、C. Brincat、L. Brubaker、A.J. Wolfe、E.R. Mueller、P.C. Schreckenberger
臨床尿培養:強化された技術により臨床関連微生物の検出が向上
J. Clin. Microbiol., 54 (5) (2016), pp.1216-1222, 10.1128/JCM.00044-16
スコープで見るGoogle Scholar
プライスら、2018
T.K.プライス、E.E.ヒルト、T.J.デューン、E.R.ミューラー、A.J.ウルフ、L.ブルーベイカー
尿トラブル:尿路結石症について違った考え方をすべきか?
Int. Urogynecol. J., 29 (2) (2018), 205-210頁, 10.1007/s00192-017-3528-8
スコープで見るGoogle Scholar
プライスら、2020a
T.K.プライス、E.E.ヒルト、K.トーマス-ホワイト、E.R.ミューラー、A.J.ウルフ、L.ブルーベイカー
大陸性成人女性のウロバイオーム:横断研究
BJOG, 127 (2) (2020), pp.
doi: 10.1111/1471-0528.15920
CrossRefView in ScopusGoogle Scholar
プライスら、2020b
トラビス・K・プライス、B・ウルフ、T・ハルバーソン、R・リメイラ、L・ブルーベイカー、Q・ドン、E・R・ミューラー、A・J・ウルフ
成人女性下部尿路微生物叢の時間的動態
mBio, 11 (2) (2020), pp.
doi: 10.1128/mBio.00475-20.
スコープで見るGoogle Scholar
秦ら、2009
Z. 秦、L. 楊、D. Qu、S. Molin、T. Tolker-Nielsen
緑膿菌の細胞外産物はブドウ球菌の増殖を阻害し、表皮ブドウ球菌が産生する確立されたバイオフィルムを破壊する。
微生物学, 155 (7) (2009), 2148-2156頁, 10.1099/mic.0.028001-0
スコープで見るGoogle Scholar
ラマンら、2016
N. ラマン、M.R.リー、A.ロドリゲス・ロペス、L.ド、S.P.パレチェク、D.M.リン
合成尿培地におけるβ-ペプチドの抗真菌活性: カテーテル関連尿路真菌感染症を減少させる材料ベースのアプローチに向けて
Acta Biomater., 43 (2016), 240-250頁, 10.1016/j.actbio.2016.07.016
PDFで記事を見るScopusで記事を見るGoogle Scholar
ラニら、2016
A. ラニ、R.ランジャン、H.S.マクギー、A.メトワリー、Z.ハジリ、D.C.ブレナン、P.W.フィン、D.L.パーキンス
腎移植患者における多様なウイルロームには、明確な多型を持つ複数のウイルス亜型が含まれる
Sci. Rep., 6 (2016), pp.1-13, 10.1038/srep33327
Scopusで見るGoogle Scholar
ラニら、2017年
A. ラニ、R.ランジャン、H.S.マクギー、K.E.アンドロポリス、D.V.パンシャル、Z.ハジリ、D.C.ブレナン、P.W.フィン、D.L.パーキンス
腎移植患者の尿中マイクロバイオームから、抗生物質耐性の可能性を持つディスバイオーシスが明らかになった。
Transl. Res., 181 (3) (2017), pp.59-70, 10.1016/j.trsl.2016.08.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
ラヴェルら、2011
J. Ravel, P. Gajer, Z. Abdo, G.M. Schneider, S.S.K. Koenig, S.L. McCulle, S. Karlebach, R. Gorle, J. Russell, C.O. Tacket, R.M. Brotman, C.C. Davis, K. Ault, L. Peralta, L.J. Forney
生殖年齢女性の膣マイクロバイオーム
PNAS USA, 108 (SUPPL. 1) (2011), 4680-4687頁
doi: 10.1073/pnas.1002611107.
CrossRefScopusで表示Google Scholar
Raz, 2001
R. ラズ
閉経後女性における再発性尿路結石症
Int. J. Antimicrob. Agents, 17 (4) (2001), pp.269-271
doi: 10.1016/S0924-8579(00)00355-1.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
レベファット, 2011
S. Rebuffat
グラム陰性菌由来のバクテリオシン:分類?
原核生物の抗菌ペプチド: From Genes to Applications, Springer, New York (2011), pp.55-72, 10.1007/978-1-4419-7692-5_4
Google Scholar
リードら、1992
G.リード、A.W.ブルース、M.テイラー
尿路感染症の再発に対する3日間の抗菌薬療法と乳酸菌膣座薬の影響
Clin. Ther., 14 (1) (1992), pp.
スコープで見るGoogle Scholar
Rijavecら、2007年
M. Rijavec, M. Budič, P. Mrak, M. Müller-Premru, Z. Podlesek, D. Žgur-Bertok
尿路病原性大腸菌株におけるColE1様プラスミドおよびコリシンK産生の有病率とコリシンKの阻害活性の定量化
Appl. Environ. Microbiol., 73 (3) (2007), pp.1029-1032, 10.1128/AEM.01780-06
スコープで見るGoogle Scholar
ライリーら, 2012
M.A.ライリー、S.M.ロビンソン、C.M.ロイ、M.デニス、V.リュー、R.L.ドリット
耐性は無駄である:抗生物質耐性の課題に取り組むためのバクテリオシンモデル
Biochem. Soc. Trans., 40 (6) (2012), pp.1438-1442, 10.1042/BST20120179
ScopusGoogle Scholarで見る
Rink et al.
R. Rink, J. Wierenga, A. Kuipers, L.D. Kluskens, A.J.M. Driessen, O.P. Kuipers, G.N. Moll
リングAおよびBの変異導入およびC末端切断によるナイシンの4つの異なる活性の分離と調節
Appl. Environ. 微生物学, 73 (18) (2007), pp.5809-5816, 10.1128/AEM.01104-07
スコープで見るGoogle Scholar
リゼットら、2018
L. リゼット、F.ファヴァ、K.M.トゥーヒー、C.セルミ
免疫系、全身性慢性炎症、腸内マイクロバイオームの関連性:性の役割
J. Autoimmun., 92 (2018), 12-34頁, 10.1016/j.jaut.2018.05.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
ロビノら、2013
L. ロビノ、P.スカヴォーネ、L.アラウージョ、G.アルゴルタ、P.ズニーノ、R.ヴィニョーリ
大腸菌による尿路感染症を再発した小児における細胞内細菌群集の検出
Pathog. Dis., 68 (3) (2013), 78-81頁, 10.1111/2049-632X.12047
スコープで見るGoogle Scholar
ロドリゲスおよびラビーニャ、2003年
E. ロドリゲス, M. ラヴィーニャ
プロトンチャンネルはマイクロシンH47抗生物質作用に必要かつ十分なATP合成酵素の最小構造である
Antimicrob. Agents Chemother., 47 (1) (2003), pp.181-187, 10.1128/AAC.47.1.181-187.2003
スコープで見るGoogle Scholar
ルースら、2006a
V. ルース、E.M.ニールセン、P.クレム
無症候性細菌尿症大腸菌株:アドヘシン、増殖および競争
FEMS Microbiol. Lett., 262 (1) (2006), pp.
doi: 10.1111/j.1574-6968.2006.00355.x
CrossRefView in ScopusGoogle Scholar
ルースら、2006b
V. ルース、M.A.シェンブリ、G.C.ユーレット、P.クレム
無症候性細菌尿症大腸菌83972株はfoc遺伝子座に変異を持ち、F1Cフィンブリアを発現できない
微生物学, 152 (6) (2006), 1799-1806頁, 10.1099/mic.0.28711-0
ScopusGoogle Scholarで見る
Roosら、2006c
V. ルース、G.C.ユーレット、M.A.シェンブリ、P.クレム
無症候性細菌尿症大腸菌83972株は、ヒト尿中の尿路病原性大腸菌株と競合する。
Infect. Immun., 74 (1) (2006), 615-624頁, 10.1128/IAI.74.1.615-624.2006
スコープで見るGoogle Scholar
ローゼンら、2007年
D.A.ローゼン、T.M.フートン、W.E.スタム、P.A.ハンフリー、S.J.ハルトグレン
ヒト尿路感染症における細胞内細菌群集の検出
PLoS Med, 4 (12) (2007), pp.1949-1958, 10.1371/journal.pmed.0040329
スコープで見るGoogle Scholar
ロウおよびジュタニ・メータ、2014年
T.A.ロウ、M.ジュタニ・メータ
高齢者における尿路感染症の診断と管理
Infect. Dis. Clin. North Am., 28 (1) (2014), 75-89頁, 10.1016/j.idc.2013.10.004
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ロイとライリー、2019年
S.M.ロイ、M.A.ライリー
大腸菌による尿道カテーテルの腔外汚染を防止するコリシンの可能性の評価
Int. J. Antimicrob. Agents, 54 (5) (2019), pp.
doi: 10.1016/j.ijantimicag.2019.07.004.
PDFで記事を見るScopusで記事を見るGoogle Scholar
ルッソら、1995年
T.A.ルッソ、A.ステイプルトン、S.ウェンダロス、T.M.フートン、W.E.スタム
若年女性における再発性尿路感染症の原因となる大腸菌株の染色体制限断片長多型解析
J. Infect. Dis., 172 (2) (1995), 440-445頁, 10.1093/infdis/172.2.440
スコープで見るGoogle Scholar
サンティアゴ-ロドリゲス, 2018
T.M.サンティアゴ-ロドリゲス
次世代シーケンサーアプローチを用いたヒト尿中のDNAウイルス集団の同定と定量化
Methods Mol. Bio, 1838 (2018), pp.191-200, 10.1007/978-1-4939-8682-8_14
スコープで見るGoogle Scholar
サンティアゴ-ロドリゲスら、2015年
T.M.サンティアゴ=ロドリゲス、M.リー、N.ボニーヤ、D.T.プライド
尿路感染症に関連するヒト尿ビローム
Front. Microbiol., 6 (14) (2015), pp.1-12, 10.3389/fmicb.2015.00014
グーグル・スカラー
スベロら、2019年
H. スベロ、B.J.フレミン、S.ズリトニ、F.エドフォース、N.グリーンフィールド、M.P.スナイダー、G.A.パブロプロス、N.C.キルピデス、A.S.バット
ヒトマイクロバイオームの大規模解析により、数千もの小さな新規遺伝子が明らかになった
Cell, 178 (5) (2019), pp.1245-1259, 10.1016/j.cell.2019.07.016
スコープで見るGoogle Scholar
スカルダフェッリら、2016年
F. スカルダフェッリ、V.ジェラルディ、F.マンジョーラ、L.R.ロペトゥーゾ、M.ピッツォフェッラート、V.プティート、A.パパ、J.ストヤノヴィッチ、A.ポスチア、G.カンマロータ、A.ガスバリーニ
潰瘍性大腸炎患者の寛解維持における大腸菌ニッスル1917の役割と作用機序:最新情報
World J. Gastroenterol., 22 (24) (2016), pp.5505-5511, 10.3748/wjg.v22.i24.5505
スコープで見るGoogle Scholar
シュネヴァイスら、2016年
J. シュネヴァイス、M.コッホ、W.ウメック
ヒト泌尿器マイクロバイオームと泌尿生殖学との関連性
Int. Urogynecol. J., 27 (9) (2016), 1307-1312頁, 10.1007/s00192-016-2944-5
Scopusで見るGoogle Scholar
シュライバーら、2017
H.L. Schreiber、M.S. Conover、W.C. Chou、M.E. Hibbing、A.L. Manson、K.W. Dodson、T.J. Hannan、P.L. Roberts、A.E. Stapleton、T.M. Hooton、J. Livny、A.M. Earl、S.J. Hultgren
大腸菌の病原性表現型と宿主の感受性が尿路感染症のリスクを決定する
Sci. Transl. Med., 9 (382) (2017), pp.1-14, 10.1126/scitranslmed.aaf1283
グーグル・スカラー
シュルツ、2008
M. シュルツ
炎症性腸疾患における大腸菌ニッスル1917の臨床使用
Inflamm. Bowel Dis., 14 (7) (2008), 1012-1018頁, 10.1002/ibd.20377
スコープで見るGoogle Scholar
シャープら、2017年
Sharp, C., Bray, J., Housden, N.G., Maiden, M.C. J. and Kleanthous, C. (2017) 'Diversity and distribution of nuclease bacteriocins in bacterial genomes revealed using Hidden Markov Models', PLOS Comput. Bio. doi: 10.1371/journal.pcbi.1005652.
Google Scholar
シーハンら, 2007
V.M.シーハン、R.D.スリーター、C.ヒル、G.F.フィッツジェラルド
プロバイオティクス菌株Bifidobacterium breve UCC2003の胃通過性、消化管持続性、治療効果の改善
微生物学, 153 (10) (2007), 3563-3571頁, 10.1099/mic.0.2007/006510-0
スコープで見るGoogle Scholar
重原ら, 2010
K. 重原邦彦, 笹川哲也, 川口修一, 小堀義人, 中島俊哉, 島村雅彦, 田谷多佳子, 古林和彦, 並木幹夫
尿道炎男性の尿路におけるヒトパピローマウイルス感染の有病率
Int. J. Urol., 17 (6) (2010), pp.563-568, 10.1111/j.1442-2042.2010.02521.x
スコープで見るGoogle Scholar
ショートら、2014
F.L.ショート、S.L.マードック、R.P.ライアン
多細菌性ヒト疾患:ソーシャルネットワーキングの悪弊
Trends Microbiol, 22 (9) (2014), 508-516頁, 10.1016/j.tim.2014.05.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
シュレスタら、2018
E. シュレスタ、J.R.ホワイト、S.ユー、I.クラック、O.エルトゥンク、A.M.デマルツォ、S.イェグナスブラマニアン、L.A.マンゴールド、A.W.パルティン、K.S.スファノス
前立腺癌の生検で陽性と陰性の男性における尿中マイクロバイオームのプロファイリング
J. Urol., 199 (1) (2018), 161-171頁, 10.1016/j.juro.2017.08.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
シフラら、2018
N. シフラ、A.グッドマン、R.ザクリ、A.サハイ、S.マルデ
再発性尿路感染症の非抗生物質による予防と管理
Nat. Rev. Microbiol., 15 (12) (2018), 750-776頁, 10.1038/s41585-018-0106-x
Scopusで見るGoogle Scholar
スリーター, 2010
R.D.スリーター
ヒトの超生物-微生物と人間の
医学 仮説, 74 (2) (2010), 214-215頁, 10.1016/j.mehy.2009.08.047
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
スリーターとヒル, 2008a
R.D.スリーター、C.ヒル
「バイオエンジニアリングされた虫」-プロバイオティクスの研究と応用への病理バイオテクノロジー的アプローチ
Med. Hypotheses, 70 (1) (2008), pp.167-169, 10.1016/j.mehy.2007.03.008
PDFを見る記事を見るScopusで見るGoogle Scholar
スリーターとヒル, 2008b
R.D.スリーター、C.ヒル
治療可能性を向上させた工学的ファーマバイオティクス
Hum. Vaccin., 4 (4) (2008), 271-274頁, 10.4161/hv.4.4.6315
スコープで見るGoogle Scholar
シュマイスら, 2010
D. Šmajs、L. Micenková、J. Šmarda、M. Vrba、A. Ševčíková、Z. Vališová、V. Woznicová
尿路病原性大腸菌および常在性大腸菌におけるバクテリオシン合成:コリシンE1は潜在的な病原因子である
BMC Microbiol (2010), p. 10, 10.1186/1471-2180-10-288
Google Scholar
スメロフら、2016
V. スメロフ、K.ネイバー、T.E.ビャークランド・ヨハンセン
尿路感染症の改善された分類:今後の考察
Eur. Urol. Suppl., 15 (4) (2016), 71-80頁, 10.1016/j.eursup.2016.04.002
PDFで記事を見るScopusで記事を見るGoogle Scholar
ソルタニら、2020
S. Soltani、R. Hammami、P.D. Cotter、S. Rebuffat、L. Said、Ben、H. Gaudreau、F. Bédard、E. Biron、D. Drider、I. Fliss
新世代の抗菌薬としてのバクテリオシン:毒性の側面と規制
FEMS Microbiol. Rev., 45 (1) (2020), pp.1-24, 10.1093/femsre/fuaa039
スコープで見るGoogle Scholar
ソト, 2014
S.M. ソト
尿路感染症におけるバイオフィルムの重要性:新たな治療アプローチ
アドバンスバイオロジー, 2014 (2014), pp.
doi: 10.1155/2014/543974.
CrossRefGoogle Scholar
スペンサーら、2012
J.D.スペンサー、D.S.ヘインズ、E.ポーター、C.L.ベビンズ、J.ディロサリオ、B.ベックネル、H.ワン、A.L.シュワデラー
ヒト腎臓および尿路におけるヒトαディフェンシン5の発現
PLoS One, 7 (2) (2012), pp.1-8, 10.1371/journal.pone.0031712
グーグル奨学生
スペンサーら、2014
J.D.スペンサー、A.L.シュワデラー、B.ベックネル、J.ワトソン、D.S.ヘインズ
尿路感染症および腎盂腎炎における自然免疫反応
Pediatr. Nephrol., 29 (7) (2014), 1139-1149頁, 10.1007/s00467-013-2513-9
スコープで見るGoogle Scholar
スタンシクら、2002年
L.M. Stancik, D.M. Stancik, B. Schmidt, D.M. Barnhart, Y.N. Yoncheva, J.L. Slonczewski
大腸菌におけるペリプラズムタンパク質のpH依存的発現とアミノ酸異化作用
J. Bacteriol., 184 (15) (2002), 4246-4258頁, 10.1128/JB.184.15.4246-4258.2002
スコープで見るGoogle Scholar
ステイプルトン, 2016
A.E.ステイプルトン
膣内細菌叢と尿路感染症
Microbiol. Spectr., 4 (6) (2016), pp.139-148, 10.1128/microbiolspec.UTI-0025-2016
Google Scholar
ステイプルトンら、2011
A.E. Stapleton、M. Au-yeung、T.M. Hooton、D.N. Fredricks、P.L. Roberts、C.A. Czaja、Y. Yarova-yarovaya、T. Fiedler、M. Cox、W.E. Stamm
尿路感染症の再発予防を目的とした、膣内に投与する乳酸菌クリスパタス菌プロバイオティクスの無作為プラセボ対照第2相試験
Clin. Infect. Dis., 52 (10) (2011), 1212-1217頁, 10.1093/cid/cir183
スコープで見るGoogle Scholar
ストークら、2018
C. Stork, B. Kovács, B. Rózsai, J. Putze, M. Kiel, Á. Dorn, J. Kovács, S. Melegh, A. Leimbach, T. Kovács, G. Schneider, M. Kerényi, L. Emödy, U. Dobrindt
尿路病原体に対する効率的な細菌干渉のための代替菌株を探索するための無症候性細菌尿症大腸菌分離株の特性解析
Front. Microbiol., 9 (214) (2018), pp.1-18, 10.3389/fmicb.2018.00214
グーグル奨学生
ストームら、2011
D.W.ストーム、A.S.パテル、S.A.コフ、S.S.ジャスティス
尿路感染症の新しい管理
Curr. Opin. Urol., 21 (4) (2011), pp.328-333, 10.1097/MOU.0b013e328346d4ee
スコープで見るGoogle Scholar
須田ら、2017
S. 須田、D.フィールド、N.バロン
抗菌ペプチドの生産と精製
Protein Chromatography, Humana Press, New York (2017), pp.401-410, 10.1007/978-1-4939-6412-3_22
ScopusGoogle Scholarで見る
スンデンら、2010
F. Sundén, L. Håkansson, E. Ljunggren, B. Wullt
大腸菌83972細菌尿は、膀胱排出不全患者における下部尿路感染症の再発を予防する。
J. Urol., 184 (1) (2010), 179-185頁, 10.1016/j.juro.2010.03.024
PDFで記事を見るScopusで記事を見るGoogle Scholar
Sybesmaら、2016年
W. Sybesma、R. Zbinden、N. Chanishvili、M. Kutateladze、A. Chkhotua、A. Ujmajuridze、U. Mehnert、T.M. Kessler
尿路感染症の潜在的治療法としてのバクテリオファージ
Front. Microbiol., 7 (465) (2016), pp.1-9, 10.3389/fmicb.2016.00465
Google Scholar
タピアイネン, 2020
Tapiainen, T. , 2020. Preventing Urinary Tract Infections With E. Coli Nissle: (FinNissle), [online] Clinicaltrials.gov. にて入手可能: 識別子: NCT04608851 (Accessed 25 February 2022).
グーグル・スカラー
タリクら、2017
R. Tariq, D.S. Pardi, P.K. Tosh, R.C. Walker, R.R. Razonable, S. Khanna
再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植は再発性尿路感染頻度を減少させる
Clin. Infect. Dis., 65 (10) (2017), 1745-1747頁, 10.1093/cid/cix618
スコープで見るGoogle Scholar
Terlizziら、2017年
M.E.テルリッツィ、G.グリバウド、M.E.マフェイ
尿路病原性大腸菌(UPEC)感染症:病原因子、膀胱反応、抗生物質および非抗生物質抗菌戦略
Front. Microbiol., 8 (1566) (2017), 10.3389/fmicb.2017.01566
グーグル・スカラー
テナートら、2019
R. Thänert、K.A. Reske、T. Hink、M.A. Wallace、B. Wang、D.J. Schwartz、S. Seiler、C. Cass、C.A.D. Burnham、E.R. Dubberke、J.H. Kwon、G. Dantas
抗生物質耐性尿路病原体の比較ゲノム解析から、尿路感染症の再発に3つの経路が関与していることが示唆された。
mBio, 10 (4) (2019), pp.1-16, 10.1128/mBio.01977-19
グーグル・スカラー
トーマスら、2004
X. Thomas, D. Destoumieux-Garzón, J. Peduzzi, C. Afonso, A. Blond, N. Birlirakis, C. Goulard, L. Dubost, R. Thai, J.C. Tabet, S. Rebuffat
シデロフォアペプチド,強力な活性を持つ新しいタイプの翻訳後修飾抗菌ペプチド
J. Biol. Chem., 279 (27) (2004), pp.28233-28242, 10.1074/jbc.M400228200
PDFで記事を見るScopusで記事を見るGoogle Scholar
トーマス・ホワイトら、2016
K. トーマス-ホワイト、M.ブレイディ、A.J.ウルフ、E.R.ミューラー
膀胱は無菌ではない:尿中マイクロバイオームの歴史と現在の発見
Curr. Bladder Dysfunct. Rep., 11 (1) (2016), pp.
doi: 10.1007/s11884-016-0345-8
CrossRefScopusで見るGoogle Scholarで見る
トーマス-ホワイトら、2018
K. トーマス=ホワイト、S.C.フォースター、N.クマール、M.ヴァン・クイケン、C.プトンティ、M.D.スタレス、E.E.ヒルト、T.K.プライス、A.J.ウルフ、T.D.ローリー
女性の膀胱内細菌を培養したところ、相互に関連した泌尿生殖器微生物叢が明らかになった。
Nat. Commun., 9 (1) (2018), p. 1557, 10.1038/s41467-018-03968-5
スコープで見るGoogle Scholar
トーマス・ホワイトら、2020年
K. Thomas-White、S. Taege、R. Limeira、C. Brincat、C. Joyce、E.E. Hilt、L. Mac-Daniel、K.A. Radek、L. Brubaker、E.R. Mueller、A.J. Wolfe
膣エストロゲン療法は、過活動膀胱症状を有する閉経後女性の尿中の乳酸菌の増加と関連している。
Am. J. Obstet. Gynecol., 223 (5) (2020), 727.e1-727.e11頁, 10.1016/j.ajog.2020.08.006
PDFを見る記事を見るGoogle Scholar
ティホノフら, 1997
I. ティホノフ、A.レベノク、A.チジュ
腎盂腎炎および糸球体腎炎患者の尿および血漿中のインターロイキン-8およびディフェンシンの研究
Nephrol. Dial. Transplant., 12 (12) (1997), pp.2557-2561, 10.1093/ndt/12.12.2557
スコープで見るGoogle Scholar
Totsikaら、2011年
M. Totsika、S.A. Beatson、S. Sarkar、M.D. Phan、N.K. Petty、N. Bachmann、M. Szubert、H.E. Sidjabat、D.L. Paterson、M. Upton、M.A. Schembri
世界的に流行しているST131系統の多剤耐性大腸菌病原体に関する知見:ゲノム解析と病原性メカニズム
PLoS ONE, 6 (10) (2011), 10.1371/journal.pone.0026578
グーグル奨学生
タウンズら, 2011
C.L.タウンズ、A.アリ、W.ロブソン、R.ピカード、J.ホール
分尿後の細菌尿の耐性は抗菌ペプチド活性と関連している。
泌尿器科、77(2)(2011)、509.e1-509.e8頁、10.1016/j.urology.2010.08.019
PDFを見る記事を見るGoogle Scholar
トラウトナーら, 2003
B.W.トラウトナー、R.A.ハル、R.O.ダロイシュ
大腸菌83972は広範な尿路病原体のカテーテルへの付着を阻害する。
Urology, 61 (5) (2003), pp.1059-1062, 10.1016/S0090-4295(02)02555-4
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
トラウトナーら, 2005
B.W.トラウトナー、R.A.ハル、R.O.ダロイシュ
コリシンは尿道カテーテルのコロニー形成を防ぐ
J. Antimicrob. Chemother., 56 (2) (2005), 413-415頁, 10.1093/jac/dki228
スコープで見るGoogle Scholar
トリベディら、2014
D. トリヴェディ、P.K.イエナ、S.セシャドリ
膣内プロバイオティクス分離乳酸菌DT24における尿路病原性大腸菌に対するコリシンE2の発現
ISRN Urol., 2014 (2014), pp.1-7, 10.1155/2014/869610
Google Scholar
トリズナら、2020年
E.Y. Trizna, M.N. Yarullina, D.R. Baidamshina, A.V. Mironova, F.S. Akhatova, E.V. Rozhina, R.F. Fakhrullin, A.M. Khabibrakhmanova, A.R. Kurbangalieva, M.I. Bogachev, A.R. Kayumov
黄色ブドウ球菌と緑膿菌の2種バイオフィルムにおける抗生物質感受性の双方向的変化
Sci. Rep., 10 (1) (2020), pp.1-18, 10.1038/s41598-020-71834-w
グーグル奨学生
ウジマジュリゼら, 2018
A. Ujmajuridze, N. Chanishvili, M. Goderdzishvili, L. Leitner, U. Mehnert, A. Chkhotua, T.M. Kessler, W. Sybesma
尿路感染症治療のためのバクテリオファージの応用
Front. Microbiol., 9 (1832) (2018), pp.1-7, 10.3389/fmicb.2018.01832
グーグル奨学生
ヴァギオスら、2020
S. ヴァギオス、H.ヘシャム、C.ミッチェル
尿路結石再発予防における乳酸菌の可能性の理解
Microb. Pathog., 148 (2020), Article 104544, 10.1016/j.micpath.2020.104544
PDFを見る記事を見るScopusで見るGoogle Scholar
ヴァン・デ・ピアら、1996
Y. ヴァン・デ・ピア, S. シャペル, R. デ・ワクテル
細菌rRNAにおけるヌクレオチド置換率の定量的マップ
Nucleic Acids Res., 24 (17) (1996), 3381-3391頁, 10.1093/nar/24.17.3381
スコープで見るGoogle Scholar
バシリアディスら, 2010
G. Vassiliadis, D. Destoumieux-Garzón, C. Lombard, S. Rebuffat, J. Peduzzi
シデロフォア・マイクロシン・ファミリーの2つのメンバー、マイクロシンMおよびH47の単離と特性解析
Antimicrob. Agents Chemother., 54 (1) (2010), pp.288-297, 10.1128/AAC.00744-09
スコープで見るGoogle Scholar
ヴェイボルグら、2010
R.M. Vejborg、C. Friis、V. Hancock、M.A. Schembri、P. Klemm
強毒な親とプロバイオティックな子孫:Escherichia coli CFT073株、Nissle 1917株、ABU 83972株の比較ゲノミクス
Mol. Genet. Genom., 283 (5) (2010), 469-484頁
doi: 10.1007/s00438-010-0532-9.
CrossRefView in ScopusGoogle Scholar
ヴェルレーズら、1998
M.M.C. Velraeds, B. Van De Belt-Gritter, H.C. Van Der Mei, G. Reid, H.J. Busscher
乳酸菌バイオサーファクタントによるシリコーンゴムへの尿路病原性細菌および酵母の初期付着の妨害
J. Med. 微生物学, 47 (12) (1998), 1081-1085頁, 10.1099/00222615-47-12-1081
スコープで見るGoogle Scholar
ビスコンティら、2019
A. ヴィスコンティ、C.I.ルロワ、F.ローザ、N.ロッシ、T.C.マーティン、R.P.モーニー、W.リー、E.デ・リナルディス、J.T.ベル、J.C.ヴェンター、K.E.ネルソン、T.D.スペクター、M.ファルキ
ヒト腸内細菌叢と宿主代謝の相互作用
Nat. Commun., 10 (1) (2019), 10.1038/s41467-019-12476-z
グーグル・スカラー
ワーゲンレーナーら、2016年
F. Wagenlehner, Z. Tandogdu, R. Bartoletti, T. Cai, M. Cek, E. Kulchavenya, B. Köves, K. Naber, T. Perepanova, P. Tenke, B. Wullt, F. Bogenhard, T.E.B. Johansen
泌尿器科感染症の世界的有病率調査:泌尿器科感染症に関する長期的、世界的サーベイランス調査
病原体, 5 (1) (2016), 1-8頁, 10.3390/pathogens5010010
スコープで見るGoogle Scholar
ワンら、2010年
A.P.ワン、Y.P.スー、S.ワン、M.Q.シェン、F.チェン、M.チェン、X.Z.ラン、T.M.チェン、J.P.ワン
遺伝子組換えヒトディフェンシン5の臨床抗生物質耐性株に対する抗菌活性とそのメカニズム
Afr. J. Microbiol. Res., 4 (8) (2010), pp.
スコープで見るGoogle Scholar
王、2002
Y. 王
大腸菌におけるOmpAの機能
Biochem. Biophys. Res. Commun., 292 (2) (2002), 396-401頁, 10.1006/bbrc.2002.6657
PDFを見る記事を見るScopusで見るGoogle Scholar
ヴェルネブルグら、2020
G.T. Werneburg、A. Nguyen、N.S. Henderson、R.R. Rackley、D.A. Shoskes、A.L. Le Sueur、A.T. Corcoran、A.E. Katz、J. Kim、A.J. Rohan、D.G. Thanassi
尿道カテーテルバイオフィルムの自然史と構成:腔内および遠位部優位の早期尿路病原体コロニー形成
J. Urol., 203 (2) (2020), 357-364頁, 10.1097/JU.000000000492
Scopusで見るGoogle Scholar
ホワイトサイドら、2015
S.A.ホワイトサイド、H.ラズヴィ、S.デイブ、G.リード、J.P.バートン
尿路のマイクロバイオーム-感染を超えた役割
Nat. Rev. Urol., 12 (2) (2015), 81-90頁, 10.1038/nrurol.2014.361
Scopusで見るGoogle Scholar
ウィリアムズ, 2015
ジー・ディー・ウィリアムズ
プロピオニミクロビウム・リンポフィラムによる尿路感染症の2症例
J. Clin. Microbiol., 53 (9) (2015), 3077-3080頁, 10.1128/JCM.00438-15
スコープで見るGoogle Scholar
Wojciukら、2019年
B. ヴォイチュク、A.サラブラ、B.グリゴルチェヴィッチ、K.Kędzierska、K.Ciechanowski、B.Dołęgowska
ウロビオーム:病める時も健やかなる時も
Microorganisms, 7 (11) (2019), p. 548, 10.3390/microorganisms7110548
スコープで見るGoogle Scholar
ウルフとブルーベイカー、2015
A.J.ウルフ、L.ブルーベイカー
無菌尿と細菌の存在
Eur. Urol., 68 (2) (2015), pp.173-174, 10.1016/j.eururo.2015.02.041
PDFで記事を見るScopusで記事を見るGoogle Scholar
ウルフら、2012
A.J. Wolfe, E. Toh, N. Shibata, R. Rong, K. Kenton, M.P. FitzGerald, E.R. Mueller, P. Schreckenberger, Q. Dong, D.E. Nelson, L. Brubaker
成人女性の膀胱における未培養細菌の証拠
J. Clin. Microbiol., 50 (4) (2012), pp.1376-1383, 10.1128/JCM.05852-11
スコープで見るGoogle Scholar
ウォルフら、2019年
B.J.ウルフ、T.K.プライス、C.J.ジョイス、A.J.ウルフ、E.R.ミューラー
経口プロバイオティクスと女性泌尿器マイクロバイオーム:二重盲検無作為化プラセボ対照試験
Int. Urol. Nephrol., 51 (12) (2019), 2149-2159頁, 10.1007/s11255-019-02282-3
Scopusで見るGoogle Scholar
ライトら、2019年
R.C.T.ライト、V.P.フリマン、M.C.M.スミス、M.A.ブロックハースト
ファージの組み合わせに対する耐性進化は曝露のタイミングと順序に依存する
mBio, 10 (5) (2019), 10.1128/mBio.01652-19
グーグル・スカラー
ヤズディら、2020
M. ヤズディ、M.ブザリ、E.A.ゲーミ、K.シャヒン
尿路感染症から分離された多剤耐性エシェリヒア・コリに感染する新規バクテリオファージVB_EcoS-golestanの単離、特性解析およびゲノム解析
Sci. Rep., 10 (1) (2020), pp.1-13, 10.1038/s41598-020-63048-x
グーグル奨学生
イェーマンとヨント, 2003
M.R.イーマン, N.Y.ヨント
抗菌ペプチドの作用と抵抗性のメカニズム
Pharmacol. Rev., 55 (1) (2003), pp.27-55, 10.1124/pr.55.1.2
スコープで見るGoogle Scholar
Yuら、2021
H. Yu, Z. Ma, S. Meng, S. Qiao, X. Zeng, Z. Tong, K.C. Jeong
キトサンナノ粒子と低毒性抗菌ペプチドmicrocin J25に基づく新規ナノハイブリッド抗菌剤
Carbohydr. Polym., 253 (2021), Article 117309, 10.1016/j.carbpol.2020.117309
PDFを見る記事を見るScopusで見るGoogle Scholar
ユーとモリソン, 2004
Z. ユー、モリソン
PCR変性勾配ゲル電気泳動による微生物群集のフィンガープリンティングに用いるrrs遺伝子の異なる超可変領域の比較
Appl. Environ. 微生物学, 70 (8) (2004), pp.
doi: 10.1128/AEM.70.8.4800
スコープで見るGoogle Scholar
Yuan et al.
J. Yuan, Z.Z. Zhang, X.Z. Chen, W. Yang, L.D. Huan
nisinZのヒンジ領域の部位特異的変異導入とnisinZ変異体の性質
Appl. Microbiol. Biotechnol., 64 (6) (2004), pp.806-815, 10.1007/s00253-004-1599-1
スコープで見るGoogle Scholar
ド・ザマロッチーおよびショーロー, 2011
M.ド・ザマロッチー、M.ショーロー
コリシンによる殺傷:失敗した細胞防御と乗っ取られた細胞機能
原核生物抗菌ペプチド, Springer, New York (2011), pp.255-287, 10.1007/978-1-4419-7692-5_14
グーグル奨学生
ザンドバーゲンら, 2021
L.E. Zandbergen、T. Halverson、J.K. Brons、A.J. Wolfe、M.G.J. De Vos
良いことも悪いこともある: 尿中微生物叢と尿路病原体の生態学的相互作用測定'
Front. Microbiol., 12 (May) (2021), p. 1026, 10.3389/fmicb.2021.659450
グーグル奨学生
ザスロフ, 2007
M. ザスロフ
抗菌ペプチド、自然免疫、そして通常無菌の尿路
J. Am. Soc. Nephrol., 18 (11) (2007), pp. 2810-2816, 10.1681/ASN.2007050611
スコープで見るGoogle Scholar
Zdziarskiら、2008年
J. Zdziarski, C. Svanborg, B. Wullt, J. Hacker, U. Dobrindt
尿路内常在菌の分子基盤:病原性の低さか、それとも病原性の減衰か?
Infect. Immun., 76 (2) (2008), 695-703頁, 10.1128/IAI.01215-07
ScopusGoogle Scholarで見る
Zdziarskiら、2010年
J. Zdziarski、E. Brzuszkiewicz、B. Wullt、H. Liesegang、D. Biran、B. Voigt、J. Grönberg-Hernandez、B. Ragnarsdottir、M. Hecker、E.Z. Ron、R. Daniel、G. Gottschalk、J. Hacker、C. Svanborg、U. Dobrindt
細菌ゲノムに刻まれた宿主の痕跡-個々の患者における急速で多様な進化
PLoS Pathog., 6 (8) (2010), 95-96頁, 10.1371/journal.ppat.1001078
スコープで見るGoogle Scholar
引用元: (12)
慢性尿路感染症における細菌病態と粘膜免疫の臨床的意義
2023, 粘膜免疫学
抄録を表示
ウレアーゼ陰性尿路病原体Kalamiella piersonii YU22は、尿素カルボキシラーゼとアロファネートヒドロラーゼ酵素系により尿素を代謝する
2022年、微生物学研究
引用抜粋:
しかし、尿路病原体における尿素分解におけるUC経路とAH経路の寄与とその臨床的関連性は未だ不明である。尿路感染症(UTI)に対する効果的な治療アプローチを達成するためには、尿中マイクロバイオームが採用するコロニー形成戦略を理解することが必要である(Kenneally et al.) 我々の以前の研究で、ストルバイト結石患者の尿からエルビニア科に属するウレアーゼ陰性細菌株Kalamiella piersonii YU22を初めて報告した(Rekha et al.)
抄録を表示
UPEC感染膀胱上皮細胞における抗菌ペプチドとエストロゲンシグナル伝達の制御におけるNLRP3の役割
2023, 細胞
UPECの耐性と病原性に関する最新の概要
2023年、大腸菌研究のトレンドトピック: ラテンアメリカの視点
Commiphora Wightii: 尿路感染症の制御における自然なアプローチ
2023年、インド農業研究ジャーナル
尿路感染症とマイクロバイオーム
2023年、診断学
Scopusで全ての引用論文を見る
© 2022 The Author(s). Elsevier GmbH発行。
エルゼビアのロゴとワードマーク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
