糞便微生物叢移植の成功の主要な決定要因: マイクロバイオームから臨床へ
レビュー|31巻5号 p712-733 2023年5月10日発行
全号ダウンロード
糞便微生物叢移植の成功の主要な決定要因: マイクロバイオームから臨床へ
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00125-7
セレーナ・ポーカリ
ニコラス・ベネシュ
ミレイア・バジェス=コロマー
ジョバンニ・カンマロータ
ハリー・ソコル
ジャンルカ・イアニーロ
すべての著者を表示する
DOI:https://doi.org/10.1016/j.chom.2023.03.020
PlumX メトリクス
概要
糞便微生物叢移植(FMT)は、Clostridioides difficile感染症の再発防止において満足のいく結果を得ているが、この良好な結果は他の疾患では部分的にしか再現されていない。FMTの成功には、ドナーやレシピエント(腸内細菌叢の多様性や特異的組成、免疫系、宿主遺伝学など)に関するもの、作業プロトコル(糞便量や注入回数、投与経路、補助療法)など、いくつかの要因が影響しています。さらに、FMTの臨床的成功は、ドナーの微生物移植の程度に関連している可能性があることを示す最初の証拠がある。マイクロバイオーム評価のための最先端技術の適用と、現在の糞便移植のビジョンの変更は、FMTのプロトコルとアウトカムを改善することが期待されます。ここでは、FMTの成功の重要な決定要因、およびFMTの成功を高めるためにラボベースと臨床のアプローチを密接に統合することを可能にする洞察と戦略について概説します。
キーワード
糞便微生物叢移植術
マイクロビオーム
生着
宿主免疫
糞便微生物移植: 現在の状況、見解、および重要な問題
ヒトの腸内細菌生態系の配列決定が初めて報告されて以来、
1
腸内細菌叢は、ヒトの健康や病気において重要な役割を果たすことが発見され、広範な研究の対象となりました。この知識は、治療ツールやターゲットとしての潜在的な役割を探求する道を開きました。腸内細菌を標的とした治療法の中でも、糞便微生物叢移植(FMT)は、科学界と臨床界の関心を急速に集めている。FMTは、腸内細菌叢の変化に関連する疾患の治療を目的として、健康なドナーからレシピエントの腸内に最小限の操作で糞便を移植することと定義される。
FMTは、いくつかの感染性・非感染性疾患に対して主流医療で研究されており、その結果はさまざまである。偽膜性大腸炎に関する初期の成功報告に基づくと、FMTは、以下のようになります、
2
FMTはまず、再発性クロストリジオイデスディフィシル感染症(rCDI)の治療法として検討され、90%近い一貫した成功率を示しています3。
3
,
4
,
5
に代わる信頼性の高い治療薬であることが証明されており、抗生物質であるバンコマイシン
6
,
7
およびfidaxomicinに代わる信頼性の高い治療薬であることが証明されています。
8
このような環境において、FMTは、重症および重症合併症のCDIの管理など、他の良好な臨床結果も達成している、
9
rCDI患者における全生存期間の延長などです、
10
CDI関連血流感染症やCDI関連手術の減少などです。
10
,
11
さらに、FMTは本疾患の費用対効果の高い戦略であることが示されている。
7
これらの知見は、臨床と研究の両面でFMTを推進する原動力となっている。
まず、FMTはrCDIに推奨される治療法の一つに組み込まれ、重症で難治性のCDIに対する救済策の可能性があると考えられています。
12
,
13
,
14
臨床現場におけるCDI治療へのニーズの高まりにより、FMTは長年にわたり徐々に進化してきた。新鮮な糞便よりも凍結した材料を使用することが、FMTの近代化の第一歩となった。
15
この移行により、便の不足のリスクなしに、大量の患者を管理できるようになりました。また、サンプルの冷凍保存により、保存された便の隔離が可能になり、安全対策も強化されました、
16
,
17
また、分子検査によるドナーのスクリーニングも拡大されました、
18
また、最近、米国食品医薬品局(FDA)がFMTのリスクとして主張した多剤耐性(MDR)菌の感染を防ぐことができる分子検査によるドナースクリーニングの拡充18。
19
さらに最近では、COVID-19の理論的リスクを防ぐために、ドナーの便スクリーニングが更新されました、
20
を防ぐために、ドナー便のスクリーニングが更新され、満足のいく安全性が確認されています。
21
rCDIを予防するためのFMTの臨床的要請の増加と要求される高度な品質管理の両方が、高い安全性、品質、および追跡可能なワークフローとともにFMTへの広範囲かつ公平なアクセスを提供する便バンクの開発につながった。
22
カプセル化されたFMTは、FMTの近代化に向けたもう一つの重要なステップとして登場し、糞便移植を行うための構造化された内視鏡装置の必要性を緩和した。
23
FMTへの関心と可能性の高まりから、この手技に対する規制と分類が強化された(表1)。初期の不確実な状態から、いくつかの当局が腸内細菌叢の本質とその臨床的分類を定義しようと試みている。米国、カナダ、フランスを含むいくつかの国では、FMTは治験薬として定義され、臨床試験の文脈で使用されなければならないが、rCDI(米国)や病院環境での使用(フランス)などの特定の例外がある。
24
注目すべきは、米国FDAが最近、rCDIのこの例外を、自国の患者を治療する施設(例えば、病院の検査室)内で提供されるFMTのみに限定し、便バンクが放出する製品を除外したことである。FDAの執行裁量方針の変更は、中央集権的な製造慣行や特定のドナーに暴露され得る患者数など、便バンクの特定の特徴に関連する安全性への懸念に基づいている。
25
表1各国における糞便微生物移植の分類
国名FMT分類アメリカ、カナダ治験またはRCDの治療に使用される治験薬フランス治験または病院での使用に使用される治験薬イタリア、オランダ、ベルギーは組織移植とみなされる。
(欧州委員会は便をSoHOと認定し、その規制はEUTCDの下で行われる)イギリスFMTは医薬品として規制されているオーストラリア、ドイツFMTは医療行為として規制されている。
FMT、糞便微生物移植、rCDI、再発性クロストリジオイデスディフィシル感染症、SoHO、ヒト由来物質、EUTCD、欧州連合組織・細胞指令。
新しいタブで表を開く
しかし、便は微生物(細菌、ウイルス、真菌、寄生虫など)、ヒト細胞、水、粘液、代謝物などの不均一なコンソーシアムで構成され、その組成はドナー関連要因(年齢、ライフスタイル、薬剤など)によって異なるため、標準化され再現性のある微生物の混合物と容易に比較することはできない。
26
この原則に基づき、マイクロバイオームを人間の臓器としてとらえる見解と一致する、
27
は、イタリア、オランダ、ベルギーを含む他の国々は、FMTを組織移植に分類しています。
28
さらに、欧州委員会は、便をヒト由来物質(SoHO)と定義している、
29
また、欧州委員会は、便をヒト由来物質(SoHO)と定義しているが、作用機序がヒト細胞を介さないため、欧州連合組織・細胞指令(EUTCD)に基づく規制の要件を満たしていない。
30
,
31
しかし、欧州委員会は最近、見解を更新し、ヒトへの適用を目的とするヒト由来物質(微生物叢を含む)の品質と安全性を規制する提案を採択し、EUTCDに組み込まれる予定です。
32
最後に、他のいくつかの国では、FMTは医薬品として(イギリス)または医療行為として(オーストラリア、ドイツなど)、より柔軟に規制されている。
28
FMTの規制に関するこのようなばらつきは、マイクロバイオーム移行の有効成分やメカニズムに関する不確実性を反映していると考えられる。FMTの規制状況は、2つのマイクロバイオームベースのライブバイオセラピューティックによる最近のライセンス取得後、さらに多様化している。ここ数カ月の間に、米国FDAはREBYOTAを認可した、
33
そして、オーストラリアの治療薬登録局(the Australian Register of Therapeutic Goods
34
はBIOMICTRAを認可し、rCDIの予防に限定して商業的に使用することを許可しました。両製品は、これらの当局から生物学的製剤と表示されています。この分類は、標準的なFMTと商業的なマイクロバイオーム治療薬の規制経路を将来的に区別する道を開くものである。
CDIで良好な結果が得られた後、FMTは、炎症性腸疾患(IBD)を含む、バイオハザードに関連する多くの慢性疾患に対して研究されています、
35
過敏性腸症候群(IBS)、
36
メタボリックシンドローム(MetS)などがあります、
37
神経精神疾患
38
などである。しかし、臨床試験の数が増え、エビデンスが蓄積されているにもかかわらず、いくつかの問題が、慢性非伝染性疾患に対するFMTの臨床応用を妨げている。第一に、これらの研究のほとんどは、rCDIにおけるFMTの結果とは比較にならないほど複雑な、あるいは代替的な結果を得ていることである。CDIは、主に腸内細菌叢の変化により引き起こされる比較的単純な疾患である、
39
は、腸内細菌叢の変化が主な原因となる比較的単純な疾患であり、腸内細菌叢が疾患に寄与する多くの経路のうちの1つである複雑な慢性疾患よりも治療が容易である。
40
この概念は、rCDIにおけるFMTの高い有効率が、ドナーの特性が異なる他の条件では観察されないという証拠によって支持されている、
26
,
39
の受信者である、
41
,
42
および作業プロトコル、
43
は、臨床結果に大きな影響を与えるようである。最後に、慢性疾患は寛解を維持するために持続的な治療を必要とする可能性が高いため、FMTを他の治療戦略と組み合わせた慢性治療として考えることが提案されています。
44
カプセル化されたFMT(患者のコンプライアンスを高める)やマイクロバイオーム治療薬(治療の標準化、再現性、精度を保証する)など、マイクロバイオーム調節を長期的に持続させるためのツールはすでに確立されている。
45
このような進歩と考察を念頭に置き、ドナー-レシピエントのマイクロバイオーム生着の役割、腸内コロニー形成と臨床的成功に影響を与えるドナー、レシピエント、作業プロトコルに関連する変数など、FMT成功の主要な決定要因について考察する。最後に、マイクロバイオーム治療薬の進歩の原動力となる変化や技術的進歩(診断・治療ツールを含む)の重要性を強調します。
FMTの結果に影響を与える要因
ドナーに関連する要因
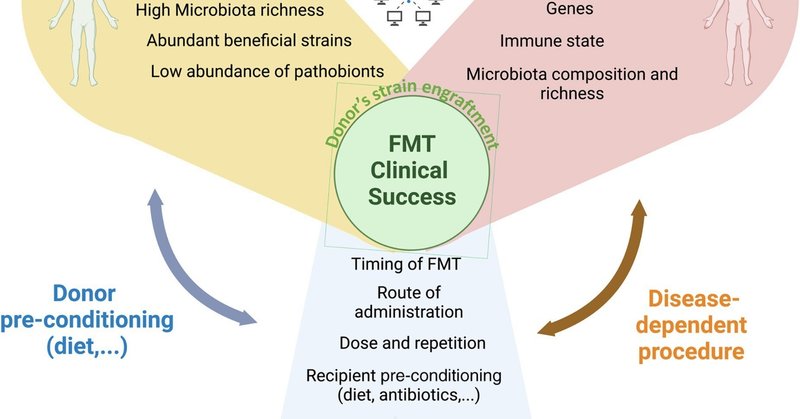
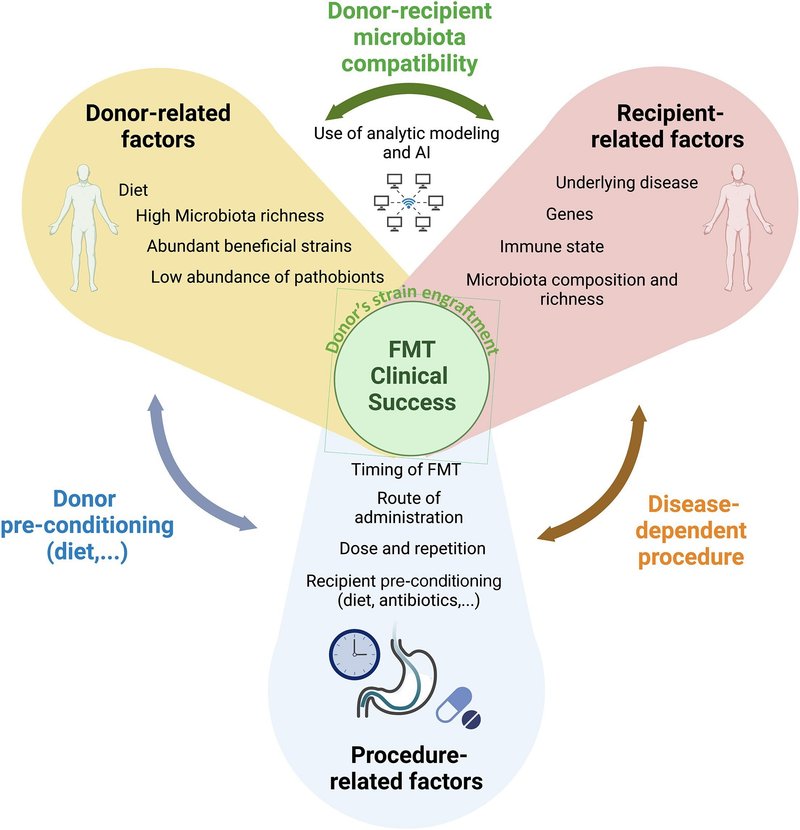
ドナーのスクリーニングと選択は、安全性に関連するもの、糞便移植の有効性に影響を及ぼす可能性のあるものなど、多くの複雑な層を持つFMTの最も困難なステップである(図1)。
図1FMTの成功に影響を与える要因
キャプションの全文を表示する
大きな画像を表示する
高解像度画像をダウンロードする
FMTの短期的および長期的な安全性
臨床現場におけるFMTの最新ガイドライン
14
は、主に感染因子の移行を回避することにより、移植物の安全性を保証することを目的としたドナースクリーニングの特定のプロトコルを推奨している。この問題は、便ドナーから免疫不全のレシピエント2人にβ-ラクタマーゼ産生大腸菌が感染し、菌血症を発症し、1例が致命的な転帰をたどったことから、極めてタイムリーなものとなっている。
46
レシピエントは2つの独立した臨床試験でFMTを受けたが、その際、ドナーは多剤耐性菌(MDROs)のスクリーニングを受けていなかった。このため、FDAは、FMTに基づく試験プロトコルにMDROスクリーニングを含めることを要求した、
19
国際的なガイドラインではすでに推奨されていたが
14
また、すべての主要な検便バンクの作業手順書にも記載されている。
17
より最近では、COVID-19のパンデミックの開始後、FDAが同様の警告を発表した、
47
その後、SARS-CoV-2のFMT関連感染を防止するためのガイドラインが定義された、
20
を策定し、その効果が実証されています。
21
特に、最近のシステマティックレビューでは、FMTに関連する重篤な有害事象はすべて、粘膜バリアが損傷している患者で発生していることが明らかにされた。
48
腸のバリアは、いくつかの胃腸(GI)および腸外疾患の病因に関与しているため、49
49
腸管バリアは、いくつかの胃腸(GI)および腸外疾患の発症に関与しているため、潜在的なレシピエントを評価する際には、腸管の損傷を考慮する必要がある。
また、いくつかの微生物株やシグネチャーが特定の疾患のリスクと関連することが発見されました、
50
FMTを介した、長期的に脅威となりうる微生物シグネチャーの移植もまた、議論の的となっている。rCDIに対してFMTを受け、6カ月間追跡された小児患者の小規模コホートにおいて、3つの潜在的発がん性細菌株(腸内毒素原性バクテロイデス・フラジリス、フソバクテリウム・ヌクレアタム、ポリケチド合成酵素陽性[pks+]大腸菌として知られるコリバクチン産生大腸菌)の持続的移行が明らかにされた。
51
11人中4人(36%)で少なくとも1つの発がん性のある菌株の持続的な獲得が示され、その後、陰性ドナーからFMTを受けた3人の患者では、この菌株は消失または減少した。rCDI患者49人を対象とした別のレトロスペクティブコホートでは、pks+大腸菌陽性のドナーからFMTを受けた9人中8人(89%)が、この菌株を維持していた。一方、陰性ドナーからFMTを受けた陽性患者18人中13人(72%)は、pks+大腸菌の根絶に成功したが、陽性ドナーから陰性患者への感染はあまり見られなかった(5人中1人、20%)。
52
予備的ではあるが、これら2つの研究は、FMTが、潜在的な発がん性細菌、より一般的には好ましくない微生物シグネチャーを伝播または根絶することができる両刃の剣である可能性を示唆している。これらのシフトの一貫性と耐久性はまだ明確に評価されておらず、小児のマイクロバイオームはまだ固まっておらず、耐久的に変更される可能性が高いため、レシピエントの年齢を含むいくつかの要因に依存すると思われる、
51
または糞便注入の回数などです。
53
現在のドナースクリーニングのガイドラインでは、がんや慢性炎症性疾患、代謝性疾患のある人を除外することが推奨されています、
14
しかし、これらの基準が有害な微生物のシグネチャーの移行を回避するのに十分であるかどうかは、まだ不明である。FMTの長期的な安全性を高めるために、今後の研究では、メタゲノム菌株追跡によって特定の微生物シグネチャーを伝達するリスクを評価するとともに、これらのシグネチャーの伝達が特定の疾患表現型の発症をどの程度誘発する可能性があるかを理解することに焦点を当てた研究が必要です。
FMTの有効性
今日まで、国際的に推奨されているドナーのスクリーニングプロトコールは、主に感染リスクを最小化し、腸内細菌叢に摂動があるドナー(慢性消化器疾患、全身性自己免疫疾患、がん、神経/神経変性疾患、精神/神経発達疾患、肥満/代謝性疾患、全身抗菌剤、免疫抑制剤、化学療法剤、プロトンポンプ阻害剤の慢性治療への最近の暴露)を除外する一般基準を適用して手順の安全に焦点を置いています。しかし、これらのプロトコルは、臨床的に有効なドナー糞便を確保することを目的とした戦略については考慮していない。まず、rCDIでは、腸内細菌の構成にかかわらず、健康な腸内細菌を移植することが一貫して有効である、
3
,
4
,
5
のように、現在のFMTの唯一の臨床適応症のためにドナーのスクリーニングを改良する必要はなかった。さらに、FMTが臨床に導入された当初は、マイクロバイオームシーケンスがあまり普及しておらず、コストも高かったため、ほとんどの研究がドナーのマイクロバイオータを評価していませんでした6。
6
,
15
や臨床的に効果的なドナーを作る微生物特性は評価されていない。最後に、ドナーの選択プロセスはすでに高度に選択的であるため、他のパラメータを追加することは困難である。
しかし、近年、複数の研究者が、ドナーのマイクロバイオーム特性とFMTの臨床的成功とを関連付けている。生態学的パラメータとドナーマイクロバイオームの分類学的組成の両方が臨床的成功に影響することを示唆するエビデンスが増えている。薬物療法に抵抗性のIBD患者を対象とした非ランダム化コホートでは、ドナーの濃度が高いことがFMTの臨床的成功に繰り返し関連していた。
54
,
55
潰瘍性大腸炎(UC)患者を対象としたカプセル化FMTの別のランダム化試験では、マイクロバイオームの均等性(より安定したマイクロバイオームを特定する)が高いドナーからの糞便バッチを受け取った被験者は、FMTに反応しやすいことが示され、このパラメータがドナーのマイクロバイオームのニッチと安定性を確立していることを示す可能性が示唆された。
56
より広範に、ドナーのアルファ多様性が高いことは、UC患者におけるFMTを評価した25の研究のシステマティックレビューにおいて、反応の予測因子として特定された。
57
α多様性はヒトの健康の指標であり、FMTは患者マイクロバイオームの多様性を健常者のそれと同様に回復させることを目的としているためです、
58
これらの知見は、信頼できる生物学的根拠を持つものである。しかし、これらの結果は、他の試験では確認されていない、
59
また、異なる疾患にわたるFMT研究のメタアナリシスでは、ドナーαの多様性はドナー株生着と有意に正の相関を示したものの、臨床的成功には影響しなかったことが示されている。
60
最後に、UC患者を対象とした2つのランダム化比較試験において、FMT反応者は非反応者に比べてドナーとの高い類似性を示した。
61
,
62
この最後の知見は、FMTの臨床的反応に対するドナーのマイクロバイオームの生着が重要である可能性を強調するものである。
さまざまな研究によると、いくつかのドナー分類群の相対存在量が高いことは、UCにおけるFMTの臨床的成功(寛解導入)と関連しており、その中にはLachnospiraceaeも含まれている、
62
Ruminococci(ルミノコックス)、
55
,
62
アッカーマンシア・ムチニフィラ
55
またはバクテロイデス
63
が、ドナー糞便中のStreptococciは反応の欠如と関連していた。
63
さらに、FMTによる治療を受けたIBS患者の小規模コホートでは、臨床的に有効なドナーはビフィズス菌の存在量が多いことが示された。
64
IBS患者を対象としたより最近のランダム化試験では、健康なマイクロバイオームの臨床的予測因子(健康、若年、痩身、経膣分娩による出生、母乳育児など)と、Dorea、Lactobacillus、Ruminococcaceae sppに富む好ましいマイクロバイオームプロファイルを持ついわゆる「スーパードナー」を選択したところ、この環境におけるFMTの過去最高の成功率(ほぼ90%)と関連づけられた。
65
同様の関連性は、より予備的な証拠ではあるが、GI以外の疾患においても見出された。最近の3つの研究では、メラノーマのマウスモデルで、免疫チェックポイント阻害薬(ICI)に反応した患者の糞便を投与したところ、免疫チェックポイント阻害薬に満足のいく反応が得られた。その患者のマイクロバイオームは、高いα多様性とRuminococcaceae, Faecalibacterium, Bifidobacterium longum, Akkermansia muchiniphilaなどの有益な細菌が多く含まれる特徴があった。
66
,
67
さらに、ICIに不応の進行性メラノーマの患者さんでは、抗がん剤ニボルマブの長期反応者からFMTを受けた後に、便にビフィズス菌やルミノコックス菌が豊富に含まれていることから、反応性が向上しました。
68
細菌に加えて、ドナーの腸内ビロームの組成もFMTの成功に関与している可能性がある。CDI患者のコホートにおいて、FMT後の治癒は、レシピエント腸におけるドナー由来のCaudovirales分類群の高いコロニー形成と関連しており、主にドナーのCaudovirales濃度が患者よりも高い場合だった。
69
最後に、ドナーのマイコバイオーム異常、特にCandida albicansの過剰増殖は、CDI患者におけるFMTの有効性の低下と関連している。
70
この関連性は、前臨床モデルにおいてC. albicansがCDIを悪化させるという証拠が増加していることからも裏付けられる71。
71
と患者の両方でCDIを悪化させるという証拠が増えていることも、この関連を裏付けている。
72
結論として、入手可能な証拠は、ドナーのマイクロバイオームの指標と構成がFMTの臨床結果に影響を及ぼす可能性があることを示唆している。しかし、現在のデータは、単一の分類群が臨床転帰の一貫した予測因子ではなく、疾患の自然経過におけるマイクロバイオームの役割はより複雑であることも示唆している。
73
解析的階層処理に基づく特定のマッチングモデル
74
または機械学習によるアプローチ、
75
は、特定のレシピエントに最も適したドナーを事前に特定し、この分野での取り組みの発展を支えている。
レシピエント関連要因
腸の生態系は、宿主と環境要因の組み合わせによって形成される複雑なニッチである。これらの原動力は、FMTのような急性障害後の腸内細菌叢の回復力の基礎となる定常状態を達成するために組み合わされます。粘膜景観の主要な決定要因の中には、宿主の遺伝学と免疫がある。FMT後、これらの宿主因子は、移植された微生物集団を新たな宿主-微生物平衡へとリモデリングすることになる。
遺伝的および免疫的要因
遺伝的要因は、腸内細菌叢組成の強力なドライバーであり、二卵性双生児や血縁関係のない個体と比較して、二卵性双生児の腸内細菌叢がより類似していることが実証されている。
76
遺伝子多型と分類群との間の特定の関連は、異なる国やコホートからの複数のゲノムワイド関連研究によって特定されている。
77
,
78
興味深いことに、ハイライトされた遺伝子座の多くは、宿主の免疫反応に関与していた。
78
IBDでは、自然免疫遺伝子の多型と腸内細菌叢の構成との関連はさらに顕著で、自然免疫受容体Nod2やシグナル伝達アダプターCard9を欠損したマウスでのメカニズム研究によって裏付けられました。
79
タイミングがすべて
粘膜免疫と腸内微生物のクロストークでは、離乳期や新生児期など、宿主リンパ球と腸内細菌が腸粘膜を拡大しコロニー形成する時期に、可塑性のある時期が決まっている。
80
この時期のFMTは、マウスにおいて明確かつ耐久性のある生着が確認されている。例えば、マウスの新生児期のFMTは、フラジェリン産生菌の過剰増殖がフラジェリンの自然受容体であるToll様受容体5の新生児期の発現に依存していた同じドナーから成体マウスへのFMTと比較して、非常に明確な移植を示す。
81
同種造血幹細胞移植を受けたヒト成人では、腸内細菌叢と粘膜免疫のクロストークは、集中的な抗生物質治療、化学療法による粘膜損傷、ドナー由来の免疫細胞による粘膜の再コロニー化の際に見られるのと同様のリセットが確認された。これらの宿主と微生物の相互作用の機能不全は、移植片対宿主病(GI-GvHD)の原因となり、FMTが有望な治療アプローチとなる急性腸炎を引き起こす可能性があります。
82
今後の研究により、腸の生態系ニッチの可塑性が高いこの時期について、より良い知見が得られるはずである。
腸粘膜の炎症状態に関するタイミングは、ドナー株の生着にも影響する。実際、腸内細菌科の細菌は、様々な疾患で指摘されているように、炎症環境下で拡大する。
83
その結果、腸内細菌科細菌は粘膜の炎症を促進し、悪循環を引き起こす。
84
例えば、クローン病(CD)に対するFMT後、Haemophilus parainfluenzaeと腸内細菌科のE. coliの生着は、病気の再発と関連していた。
85
IBDの場合、FMTの前にコルチコステロイドなどの従来の免疫標的療法で粘膜の炎症をコントロールすることで、粘膜の治癒を促進できる非炎症環境に適応した分類群の生着が促される可能性がある。このような抗炎症性細菌には、Faecalibacterium prausnitziiやRoseburia intestinalisがあり、これらは急性粘膜炎症状態で速やかに排除される偏性嫌気性細菌である。
86
これらのことから、粘膜炎症がある場合は、非微生物療法により生態系を非炎症の定常状態に戻した上で、FMTを実施することが望ましいと考えられる。
レシピエント腸内細菌叢の組成と機能
レシピエントの腸内細菌叢の回復力は、FMTの生着と成功を決定するもう一つの重要なパラメータである。腸内病原体にさらされたとき、腸内細菌叢のバリア機能は、細菌群の安定性、栄養供給における競争力、および粘膜環境の新しい酸化還元状態への適応能力に依存する。
87
FMTでは、レシピエントの基礎的な腸内細菌叢の組成に基づいてドナー株の生着率を予測することは、依然として課題である。多くの生態系と同様に、ベースラインの多様性(すなわち、生態系における異なる分類群の数と相対的存在量)は、外的障害に対するシステムの堅牢性とFMTの生物学的成功の指標となることが示唆されてきた。しかし、疾患によっては、レシピエントの基礎的な微生物叢の多様性が、様々なFMTの臨床結果と関連する可能性があります。MetSでは、レシピエントの初期糞便微生物叢多様性の低さは、FMT後のインスリン感受性の改善と関連していた、
41
一方、UCおよびIBSでは、FMTの臨床的成功は、より高い基礎細菌多様性と関連していた。
63
これらの矛盾は、(1)細菌の多様性は腸内細菌叢の可塑性を予測するための不完全なツールであること、(2)多様性は微生物叢の機能を推定するものではなく、疾患依存性であることを示唆している。
より具体的には、特定の分類群および菌株が、疾患によってFMTの転帰と関連していた。レシピエントにおけるFusobacterium種とSutterella種の多さは、UCにおけるFMTの失敗と関連していた、
88
一方、CDでは、Klebsiellaのような腸内細菌科のメンバーによるレシピエントのコロニー形成は、臨床転帰不良と関連していた。MetSでは、反応者はEubacterium ventriosumおよびRuminococcus torquesの相対量が少なく、Subdoligranulum variabileおよびDorea種の相対量が多かった。
41
IBSでは、ベースラインのStreptococcus属の存在量が多いほど、FMTの臨床的成功に関連することがわかった。
89
これらの様々な研究結果は、しばしば小規模コホートに基づくものであり、相反する結果であることから、FMTの成功を予測する明確な微生物シグナルを定義することは、同じ病態であっても困難である。最近の2つのメタアナリシスでは、FMT後の生着率を予測するために、FMTレシピエントにおける特定の分類群のベースライン存在量の重要性が強調されている。
75
,
90
このことは、レシピエントの定量的な側面と事前の細菌負荷が、FMTの成功を予測する上で重要である可能性を示唆している。レシピエントのマイクロバイオームにおける対象種の絶対的な定量化は、研究間の矛盾を解決するのに役立つかもしれない。さらに、FMT成功の予測因子は、分類学的レベルよりも腸内細菌叢の機能的レベルで考慮され、マルチオミクスアプローチによって評価されるかもしれない。
FMT後の微生物移行の予測因子を検討する際には、細菌とは別に、腸に生息する他の微生物群も考慮に入れる必要がある。CDIでは、FMTの結果が良好であることは、ベースライン時のレシピエントの糞便中のC. albicansの存在量が少ないことと関連していました。
70
一方、UCでは、ベースライン時のレシピエントのC. albicansの存在量が多いことは、より高い細菌生着およびFMTの臨床的成功と関連している。
91
また、UCでは、レシピエントにおけるベースラインのCaudoviralesバクテリオファージの低レベルと真核生物のウイルスの低濃度が、FMTの成功と関連していた。
92
このことは、ある種に適応した生態学的ニッチの存在(すなわち、生態系の前提条件)が、同じ種のドナー株の生着に役立つ可能性を示唆している。
85
,
93
,
94
これらの理由から、微生物の動態を理解するためには、高解像度の分類学的分析が不可欠である。実際、CDに対するFMTの試験では、以前は種のレベルに基づいてFMT失敗と判定された患者が、株の入れ替えや共存による長期的な微生物生着の明確な証拠を示している。
85
さらに最近、Heらは、CD、UC、CDIを対象としたさまざまなFMT試験において、さまざまなクラスタリング法を用いてレシピエントの微生物相をバクテロイデス優勢型と腸内細菌科優勢型に分類することを提案した。レシピエントの腸型に基づき、異なるレベルの分類群の移植が観察された。
93
一方、Schmidtらは、10種類の疾患における300以上のFMTの菌株レベルでのマイクロバイオーム動態に関する最近のメタ分析において、ほとんどの種について、レシピエントにおける相対存在量の高さは、系統的に関連する種の移植と負の相関を示し、排除効果を示唆していることを明らかにした。
90
CDIでは、レシピエントの基礎微生物叢におけるCaudoviralesバクテリオファージの多様性がドナーのものと比較して低いことが、FMT陽性の結果と関連していることが示されたように、このドナー-レシピエント適合性の程度は、ウイルスによっても影響を受けることがある。
69
このように、ドナーとレシピエントの相補性の微生物決定因子は、疾患によって異なる生着パターンや臨床転帰をもたらす可能性がある。
95
さらに、ドナーとレシピエントの競合を考慮する場合、絶対量と相対量に関する定量的な側面が非常に重要であると考えられる。
環境のコファクター
さらに、腸内細菌叢は安定したコア構造を持っているにもかかわらず、食事、ライフスタイル(運動、旅行など)、薬物治療によって時間的なダイナミクスを示すことがある。FMTの前後にこれらの要因をコントロールすることで、菌株の生着が最適化され、マイクロバイオームの構造と機能が健康な状態に移行する可能性がある。最近、このようなアプローチは、重度の肥満とMetSの患者において、FMTの単回経口投与と毎日の低発酵性(LF)繊維の補給を組み合わせた場合に、インスリン感受性の改善に一定の効果を示しました。
43
FMT作業プロトコルに関連する要因
ドナーのスクリーニングや糞便材料の製造だけでなく、糞便の注入はFMT作業プロトコルの重要な要素であり、患者の準備からFMT後の補助的な食事介入までいくつかの段階を含む(表2)。
表2FMTの微生物学的および臨床的有効性に対する作業プロトコルのさまざまなステップの影響
筆頭著者研究デザイン介入内容研究設定介入結果抗生物質前処置Amorim et al.
96
前臨床試験-アンピシリン
-バンコマイシン
-ネオマイシン
-メトロニダゾールマウスモデル抗生物質を7日間以上投与することで、腸の除染に効果がある。
腸管洗浄後、FMTによりドナー微生物叢の移植に成功した。
ドナー微生物群の生着はFMT後5週間持続したaniro et al.
75
システマティックレビューおよびメタゲノミクスメタ分析-バンコマイシン
-リファキシミン
-コリスチン
-コリスチン+ネオマイシン
-バンコマイシン+ネオマイシンいくつかの感染症および非感染症FMT前の抗生物質がドナー株移植率の上昇と関連Podlesny et al.
60
システマティックレビューおよびメタゲノムメタ解析-バンコマイシン
-フィダキソマイシン
-メトロニダゾール
-リンコサミド
-フルオロキノロン
-コリスチン
-ネオマイシン
-セフェピム
-パラモマイシン
nystatincommunicableおよびnon-communicable diseasesantibiotics before FMT associated with higher donor strain engraftment rateBaruch et al.
68
第Ⅰ相臨床試験-バンコマイシン
-ネオマイシン免疫療法に抵抗性の黒色腫患者3人に臨床効果が認められた。
FMT後の腸管固有層および腫瘍微小環境における良好な免疫変化TMocanu et al.
97
系統的レビューおよびメタ分析-アモキシシリン
-ホスホマイシン
-メトロニダゾール
-バンコマイシン
-パロモマイシン
-nystatinIBD繰り返しFMTと抗生物質の前処置は、臨床的奏効率と寛解率を改善したHaifer et al.
98
RCT-amoxicillin
-メトロニダゾール
-doxycyclineUCFMTは8週間後のステロイドフリー寛解を73%の患者で誘導する効果があるSingh et al.
99
RCT-シプロフロキサシン・メトロニダゾール
-FMT単独群では、FMT前の抗生物質投与群に比べ、ドナー微生物群の生着率が高く、腸内洗浄を行った。
100
前向き研究-PEG+20gアスコルビン酸併用-5/24 (21%)の被験者が軽度の合併症を報告した。
-腸管洗浄前のFirmicutes/Bacteroidetes比は、合併症のない群より合併症群で高い。
-Jalankaら(101)は、腸管処理後のFirmicutes/Bacteroidetes比が合併症群で減少した。
101
RCT-PEG(単回投与2Lまたは分割投与1L×2)-整腸剤投与後の総微生物量は31倍減少し、22%の参加者が被験者固有の微生物相を喪失した。
-瀉下薬を単回投与した場合、二回投与した場合よりも微生物叢の構成に深刻な影響を与えた(単回投与した患者では、Proteobacteria、Fusobacteria、Dorea formicigenerans関連菌のレベルが増加した)Podlesny et al.
60
腸内洗浄により常在細菌叢を減少させ、ドナー細 菌叢の移植に備えるLi et al.
102
RCTlaxative bowel preparation or CB probioticIBSlaxativeの使用は、Clostridium cluster XIVaが微生物叢をシフトさせる好機となった糞便注入の回数Cammarota et al.
6
RCTrepeat FMT in patients with PMCCDI-5人のPMC患者全員が治癒し、大腸炎が消失するまで3日ごとに糞便注入処置を受けたFischer et al.
103
前向き研究FMTCDI内視鏡的連続FMTの全治療効果は93%(27/29)であり、重症CDIでは100%(10/10)、重症/合併症CDIIでは89%(17/19)であったaniro et al.
9
RCTsingle vs. repeat FMTCDIrepeat FMTはsingle FMTより有意に高い治癒率を示した(100% vs. 75%、p = 0.01)Song et al.
104
単回または複数回のFMTBD+CDI-初回FMTは53/67例(79%)で成功。
-8人が2回目の注入を受け、そのうち6人はFMTによりCDIを効果的に治癒した。
-FMTを繰り返すと、CDIが治癒する確率は90%であったParamsothy et al.
88
RCT-ドナーFMT
-プラセボFMT
FMT vs. プラセボ 大腸内視鏡注入後、マルチドナー浣腸を週5日、8週間実施した。8週目に内視鏡的寛解または奏功を伴うステロイドフリー臨床寛解が、ドナーFMT患者11/41名(27%)に対してプラセボ投与患者3/40(8%)で得られた(p = 0.021).Moayeddi et al.
62
RCTrepeat FMT (by enema) active UCドナーFMTを受けた9/35 (24%) とプラセボを受けた2/35 (5%) は7週目に寛解していた。
FMTを受けた患者の便は、ベースラインと比較して、プラセボを受けた患者の便よりも微生物多様性が高かった(p = 0.02)。Rossen et al.
61
RCTrepeat donor FMT vs. placeboactive UC7/17 (41.2%) vs. Control 5/20 (25%) 12週目にMayo内視鏡スコアが1ポイント以上減少し、臨床的併用が達成された (p = 0.29).Kootte et al.
41
RCT2 異なる治療群:自家用FMT(12)、同種赤身ドナーFMT(26)FMT後18週目のMetSat代謝変化は観察されなかった。同種FMT後6週間のインスリン感受性は有意に改善し、それに伴い微生物叢の組成も変化した。
また、γ-アミノ酪酸などの血漿代謝物の変化も観察され、同種FMTによる代謝反応(FMT後6週間のインスリン感受性の改善と定義)は、ベースライン時の糞便微生物多様性の減少に依存していることが示されたIaniro et al.注腸糞量
5
CDI<50gの糞便は、単回FMTに対する反応性の低さと関連するEl-Salhy et al.
65
RCTdonor FMT vs. プラセボIBS 輸液糞便量を30gから60gに増やすとFMT成功率が上がるWei et al.
105
システマティックレビューおよびメタアナリシスFMT vs. コントロール群UC300gの糞便がFMT効果を向上させたMulti-donor approachParamsothy et al.
88
RCTrepeat donor FMT vs. Placebo FMTactive UC 8週目に内視鏡的寛解または奏効を伴うステロイドフリーの臨床的寛解をドナーFMT患者11/41名とプラセボ投与患者3/40名で比較Sood et al.
106
pilot studyrepeat donor FMT vs. placebo FMTUC患者において、複数回のFMTにより臨床的寛解が得られたが、プラセボとFMTの間に差はなかったKedia et al.
107
RCTFMT + AID vs. standard of careUCFMT-AID は SMT よりも 8 週間後の臨床効果、寛解、深い寛解の誘発で優れていた。
108
RCTdonor microbiota vs. placeboobesity MetSの有病率を4.5倍減少させたWei et al.
105
システマティックレビューとメタアナリシス複数ドナーによるFMT複数ドナーによるUCFMTは単一ドナーによるFMTRより有効であった送達経路Quraishi et al.
3
メタアナリシスによるシステマティックレビューFMTCDI下部GI送達は上部GI送達よりCDI治癒に有効であるWei et al.
105
システマティックレビューとメタアナリシスFMTU下部消化管FMTは上部消化管FMTよりも有益な効果があった。
75
システマティックレビューおよびメタゲノム解析-下部消化管および上部消化管の送達経路の組合せ
-下部GI FMT
上部GI FMT-異なる感染症および非感染症FMTルートの組み合わせは、より高い微生物移植と関連するIaniro et al.
5
系統的レビューおよびメタ分析CDIカプセルによるFMTは、大腸内視鏡検査と比較してCDIの治癒率が同等であったVaughn et al.
109
RCTカプセルFMT vs. 大腸内視鏡FMTCDCDI CDI治癒率に差はないHaifer et al.
98
RCT-親水化FMTカプセル vs. プラセボ親水化カプセルは臨床的寛解に有効であった食事療法補助剤El-Salhy et al.
65
RCTsuper donor with healthy diet(タンパク質、ビタミン、繊維、ミネラルを豊富に含む栄養補助食品、タンパク質、クレアチン、ビタミンC、ビタミンE、ビタミンB6、ビタミンB12、ビタミンD、亜鉛マグネシウム、desloratadineIBSFMTはIBS治癒においてプラセボより成功しているZoll et al.
110
高脂肪・高ショ糖食(HFHS)+運動または座位生活(MetSt)HFHS食はドナーに耐糖能異常と肥満をもたらしたが、運動トレーニング(ET)は脂肪率を抑制し耐糖能を改善させた。
111
マウスのRCT-対照群とカロリー制限群にランダム化した後、ドナーFMTまたは自己FMTにランダム化T自己FMT(A-FMT)は、体重減少および脂肪率に対する適度なCRの効果を短期的に増強し、細菌の豊富さ/多様性が有意に増加した。
112
RCT3つの異なるグループ:
-健康的な食事ガイドライン
-アイソカロリー地中海式食事法
-緑色地中海食(ポリフェノールを豊富に含む)
食事療法後、患者を自家FMTまたはプラセボに無作為に割り付け、内臓肥満または脂質異常症A-FMTは、緑の地中海食群で体重増加を有意に抑制したが、食事ガイドラインおよび地中海食群では抑制しなかったSarbagili Shabat et al.
113
盲検 RCT 標準的な FMT 対 UCED + ドナー食による前処理を伴う FMT 対 UCED 単独 アクティブ UCED 単独は寛解導入において他の選択肢よりも有効Kedia et al.
107
RCT-FMT+抗炎症食 vs. 標準治療UCFMT-AIDは、8週間後の臨床反応と寛解、深い寛解の誘発において、標準治療より優れている。
抗炎症食は、48週までの深い寛解の維持においてSMTより優れていた(6/24(25%)対0/27、p=0.007)Jang et al.
114
前向き研究(マウスモデル)大韓バイオリンク社製精製AIN-76-A飼料をベースにした飼料をマウスに自由摂取させた。(Chungbuk,Korea)から供給された精製AIN-76-A飼料をベースにした飼料を自由摂取させた。AIN 76-A飼料を改変し、異なる食餌の効果を検討した。高タンパク食(タンパク質40%)はカゼインを増量して変更、高脂肪食(脂肪40%)はコーン油を添加、高繊維食(繊維20%)はセルロース20%を添加(試験2)、高繊維食(繊維20%)はセルロース10%、ペクチン10%semaAIDと高繊維食が炎症抑制に有効Koopen et al.
115
RCTM地中海式食事療法を2週間実施した後、次の群に無作為に割り付けた。
-地中海食の摂取により、体重、HOMA-IR、脂質の減少が認められた。しかし、6週間後の腸内細菌叢の多様性については、地中海食とリーンドナーFMTの組み合わせによる大きな相乗効果は見られなかったMocanu et al.
43
RCT低発酵性繊維と高発酵性繊維のFMT前の比較 重症肥満とMetStFMT後の低発酵性繊維の補給は、高発酵性繊維よりも微生物の生着促進およびインスリン感受性改善に効果的である。
AID、抗炎症食、CB、Clostridium butyricum、CDAD、Clostridioides difficile associated diarrhea、CD、クローン病、CDI、Clostridioides difficile infection、FMT、便微生物移植、GI、消化器、HF、高発酵性、IBD、炎症性腸疾患; IBS、過敏性腸症候群、IBS-D、下痢が優勢な過敏性腸症候群、MetS、代謝症候群、NA、入手不可能、PEG、ポリエチレングリコール、LF、低発酵性、SMT、標準治療、RCT、無作為化臨床試験、UCED、UC除外食。
新しいタブで表を開く
抗生物質のプライミング
抗生物質のプライミングは、FMTのための患者準備の重要かつ長年の課題であった。バンコマイシンが推奨されるrCDI患者では、抗生物質が明確な役割を果たします。抗生物質は、ドナー材料に対する患者の準備だけでなく、FMTの前にC. difficileの負荷を軽減するため、臨床におけるFMTの国際ガイドラインで推奨されています。
14
しかし、非感染性疾患においてFMT前に抗生物質を使用することは、マイクロバイオームの変化を悪化させる可能性があり、より問題である、
116
また、初期の臨床試験では、作業プロトコールに抗生物質が含まれていなかった。
64
しかし、抗生物質がドナー微生物群のコロニー形成を促進するための前処理療法として機能する可能性があるという概念が、いくつかの理由から近年浮上してきている。まず、ベースライン時の患者の多様性が低いことが、FMTの臨床的成功に関連するというエビデンスがある。
41
さらに、同様のアプローチは血液学の分野でも確立されており、免疫抑制剤によるプレコンディショニングは、同種骨髄移植後のGvHDを予防するために用いられている。
117
また、FMT前の抗生物質が、マウスにおけるドナーのマイクロバイオームの生着可能性を向上させるというエビデンスもある。
96
全体として、24の研究のメタゲノム解析では、FMT前の抗生物質の使用は、FMT後のドナー株の生着率の高さと関連し、それは臨床的成功と相関していました。
75
この知見は、14のFMT試験を対象とした別の現代的なメタゲノム解析でも確認された。
63
さらに、IBDに対するFMTを調査した28件の研究のメタアナリシスでは、抗生物質のプライミングは、抗生物質のコンディショニングを行わない場合と比較して、FMT後の臨床反応および寛解の割合が高いことに関連していた。
97
しかし、マウスモデルですでに示されているように
118
しかし、マウスモデルで既に示されているように、抗生物質の前処理の種類、量、期間は、FMT後のドナーの生着率に影響を与える可能性がある。抗生物質の前処理は、全身性の抗生物質や腸内細菌に大きな影響を与える抗生物質を含む場合に、より効果的であるようだ。グラム陽性菌(バンコマイシン)とグラム陰性菌(ネオマイシン)の両方をカバーする2種類の抗生物質の3日間の併用は、ICIを受けたメラノーマ患者におけるドナー微生物群の生着と臨床的成功に関連していた。
68
さらに、UC患者を対象とした無作為化試験では、カプセル型FMTに先立ち、アモキシシリン、ドキシサイクリン、メトロニダゾールを2週間投与し、成功を収めた。
98
一方、リファキシミンをコンディショニング抗生物質として使用することは、生着率の向上と関連していない、
99
これは、リファキシミンが微生物の多様性を著しく低下させないためと思われます。
119
しかし、抗生物質の使用とFMTの成功との間に有意な関連を見いだせなかった報告もある、
99
また、現在、FMT前にどの抗生物質をどのくらいの期間使用するかについては、専門家の間で合意が得られていない。
したがって、異なる疾患におけるマイクロバイオームの生着と臨床的成功を評価するランダム化比較試験を通じて、効果的なプライミング抗生物質プロトコルを特定することが、FMTの有効性を高め、その役割を拡大する可能性があることを提唱するものである。
腸内洗浄
大腸内視鏡検査が優先される場合、腸内洗浄がFMTの作業プロトコルの必須要素である。大腸内容物を除去することで、クレンジングは細菌負荷を減らし、C. difficileの根絶を助ける。
14
FMT時の不十分な腸内洗浄が、FMT後のCDI再発の予測因子として特定されており、そのリスクは11倍以上増加することが確認されています。
120
新たなエビデンスは、腸内洗浄がFMT前の患者のマイクロバイオームの事前調整に利用できることも示唆している。いくつかの報告では、大腸内視鏡検査前の腸管洗浄がα多様性の低下と関連している。
100
,
101
および細菌負荷
101
を増加させる可能性があります。一般に有害と考えられてきたこの結果を利用し、患者のベースラインの多様性を低くすることで、マイクロバイオームの生着と臨床的成功を促進できる可能性があります。
41
を提供し、患者とドナーの微生物群集の間の競争を減らすことで、マイクロバイオームの移植と臨床的成功を促進することができる。このコンセプトは、14件の研究のメタゲノム解析でも支持されており、腸内洗浄によってドナーのマイクロバイオーム移植が促進されることが示されている。
60
腸内洗浄が、抗生物質の有無にかかわらず、ドナー微生物群の生着率やFMT後の臨床的成功に影響を及ぼすかどうかを明らかにするために、さらなるランダム化試験が必要である。
糞便注入の回数、注入糞便の量、およびマルチドナーアプローチ
FMTは基本的にドナー微生物と患者微生物の戦いとなるため、ドナー微生物の量が増えれば、レシピエントの腸のコロニー形成が促進されると考えられる。この結果は、1回のFMTで微生物量を増やすか、糞便注入の回数を増やすことで達成できる。
失敗した後にFMTを繰り返すことは、CDI患者の全体的な有効率を高めるための確立された方法である。CDI患者を対象とした初期の無作為化試験で、Cammarotaらは偽膜性大腸炎患者が1回のFMTで治癒する確率が低いことを観察した。
6
この観察はFischerらによって再現され、FMTとバンコマイシンの連続投与が重症CDI患者における成功戦略であることが判明した。
103
最終的に、このエビデンスは、ランダム化試験において、1回の糞便注入は、重症CDIの治癒においてFMTを繰り返すよりも効果が低かったという確証を得た、
9
と、240人の患者と10件の研究を対象とした後のシステマティックレビューとメタアナリシスにおいて、このエビデンスは確固たるものとなった。
104
予想通り、慢性非伝染性疾患では、FMTに対する反応は一般的に長期的に持続しない。
121
したがって、逐次的なFMTは、このような状況にも適用され、有望な結果をもたらしている。
41
,
61
,
62
,
88
繰り返し長期間のFMTは、最近の2つのランダム化された
98
,
122
と非ランダム化
106
UC患者を対象とした試験、およびIBS患者を対象とした別の非ランダム化試験において、その効果を確認した、
123
は、患者のマイクロバイオームを慢性的に調節することが、非伝染性慢性疾患において有益であることを示唆している。
また、注入する糞便の量もFMTの臨床効果に影響を与える可能性があることを示す証拠もある。15件の研究と1,150人の被験者を対象とした系統的レビューとメタ分析では、メタ回帰分析において、糞便量≦50gは、単一FMTの有効性の低下と関連していた。
5
糞便量の多さと臨床的成功の関係は、CDI以外の疾患でも確認されている。IBS患者を対象としたFMTのランダム化比較試験において、注入する糞便を30gから60gに増やすと、成功率が76.9%から89.1%に増加した。
65
さらに、9つの試験と425人のUC患者を対象とした系統的レビューとメタ分析では、300g以上の糞便の使用は、FMT後の臨床的寛解の可能性の高さと関連していました。
105
しかし、糞便重量を指標とすることは、このパラメータによって糞便中の生菌の存在を評価することができないことに基づいて、最近では縮小されてきている。製品の効力の指標として、糞便中に存在する全生存生物の推定が提案されている。希釈系列やプレーティングアッセイによる投与量あたりの総生存コロニー形成単位(CFU)の評価、生菌と死菌を区別するための膜排除色素の使用、qPCRベースの技術の適用など、いくつかのアプローチが、実質的に生存微生物の存在を評価する可能性がある方法として注目されている。
124
最後に、異なるドナーの糞便を混合することで、輸液の多様性を高めるという理論に基づき、マルチドナーアプローチが検討されている。UC患者を対象とした2つのランダム化比較試験において、マルチドナーFMTはプラセボよりも臨床的寛解をもたらす効果が高かった、
88
,
107
と炎症マーカーを減少させた。
125
この効果は、システマティックレビューとメタアナリシスでさらに確認された
105
と、長期的な治療としてマルチドナーFMTを調査したパイロット試験で確認された。
106
興味深いことに、肥満患者を対象としたランダム化比較試験において、マルチドナーFMTは患者のマイクロバイオームを持続的に変化させることができ、4人のドナーのうち2人がレシピエントの微生物生着を支配していました。
108
しかし、現在のところ、単一ドナーFMTと混合ドナーFMTを直接比較した研究はない。いくつかの要因(製造工程、ドナープール、患者集団など)のばらつきがマルチドナーアプローチの現在の結果に影響を与える可能性があるため、この特定の問題を明らかにするためにデザインされたランダム化試験が必要である。マルチドナーアプローチは、有害な種や病原体さえも感染させるリスクが高いなどの欠点もあるため、これらの追加研究は特に重要である。さらに、複数のドナーがいると、FMTの成功や株移植のルールの基礎となるメカニズムを理解する能力が制限される。
移植のルート
FMTは、上部内視鏡や経鼻胃管/経鼻十二指腸管を含むいくつかの経路で実施されている、
41
,
61
,
65
エネマ
15
,
62
大腸内視鏡検査
6
,
9
,
10
またはカプセルを使用する。
23
,
98
異なる経路の有効性を評価したメタアナリシスもあるが、
3
,
5
は、直接的な比較は数少ない研究によってのみ行われている。試験的な非盲検無作為化試験において、経鼻胃管による冷凍FMTは、CDI関連下痢の解消において大腸内視鏡による投与と同等の効果があるように思われた。
126
しかし、この試験は患者数が少ないため、この所見を確認するためにはより大規模な試験が必要である。
カプセル化されたFMTについては、より確実な有効性のエビデンスが得られている。大規模な非劣性ランダム化比較試験において、凍結カプセルはrCDIの予防において大腸内視鏡検査と比較して同様の有効率を得た。
23
この結果は、300人以上のrCDI患者を対象とした大規模な非ランダム化試験でも確認されている。
109
最後に、FMTカプセルは、他の疾患においても有望な結果を得ている。
98
カプセル化されたFMTは、特に凍結乾燥された形態では、長期的に持続可能である、
98
したがって、マイクロバイオーム調節のための長期的なアプローチに道を開くものである。注目すべきは、24件の研究のメタゲノム解析において、複合経路を用いたFMTは、単一経路の注入よりも微生物が生着する可能性が高いことと関連していることである。
75
この間接的な知見に基づき、組み合わせによるFMTは、今後の研究の興味深いターゲットとなる可能性があります。
食事によるアジュバント
FMTの結果に影響を及ぼす食事の役割は、近年ますます重要性を増している。一般に、健康な食事は健康な微生物叢と関連している、
127
であり、健康的な食事を遵守するドナーは、特定の環境において有効であることが示されている、
65
は、FMTの効果を高めるために、ドナーのスクリーニングプロセスに食事に関するアンケートを含めることが可能であることを示唆している。
より具体的には、ドナーまたはレシピエントに特定の食事を加えることが、最近、FMT研究において検討されており、最初の研究は、心代謝疾患患者を対象としている。マウスモデルでは、ドナーの食事がドナーのベースラインの代謝状態に関係なくFMTの結果に影響を与える可能性があることが示されている。高カロリー食のドナーからのFMTは、脂肪率に関係なくレシピエントマウスのグルコース代謝を破壊することができた、
110
また、痩せた状態からの自己FMTは、肥満マウスのカロリー制限の効果を増強した。
111
これらの知見はヒトにおいても確認されており、肥満または脂質異常症患者において、除脂肪期に採取した自己FMTを復脂肪期に再注入すると、体重増加およびインスリンリバウンドを抑制することができた。
112
しかし、ドナーの食事によるプライミングは、UC患者におけるFMTの成功率を向上させる効果はなかった。
113
ドナーの食事はマイクロバイオームをより有益な組成にシフトさせるのに役立つかもしれないが、レシピエントのためにデザインされた食事は、生着のプライミングや新しいマイクロバイオームの育成、あるいは症状改善におけるFMTとの相乗的作用など、他の目的があるのかもしれない。
FMTと食事の相乗効果については、MetS患者を対象としたFMT対プラセボ+地中海食のランダム化試験で検討され、両群間に有意差はなかったが、この試験は特にFMTに対するこの食事の価値を評価するためにデザインされたものではなかったと考えられる。
115
UC患者を対象とした別の無作為化試験では、FMTと抗炎症食(AID)の組み合わせは、疾患寛解の誘発において標準治療(SMT)よりも有効であり、AIDは寛解の維持においても標準治療よりも有効であった。
107
この特定のAIDには、新鮮な果物や野菜(特にアリール炭化水素受容体[AhR]リガンドに富む野菜)、発酵食品など、大腸の微生物叢を養う食品の摂取量を増やすことが含まれており、レシピエントの大腸のドナー微生物群を育てたと考えられる。また、FMTと高繊維食の組み合わせは、マウスモデルにおいて炎症とアポトーシスをダウンレギュレートすることにより、肺気腫の発症を減弱させる。
114
特に、重度の肥満とMetSの患者を対象としたランダム化比較試験において、FMT後のLF繊維(特に微結晶セルロース繊維)の補給は、微生物の生着促進およびインスリン感受性の改善において高発酵性(HF)繊維よりも効果的だった。これらの結果の説明として、セルロースの微生物や代謝物に対するバルキング/結合効果、およびプレバイオティクス特性による腸内細菌叢のシフトが考えられる。
43
これらの結果は、FMTのアジュバントとして、また、より広く、マイクロバイオーム治療の複合的なアプローチとして、食物製品(主に繊維)を適用するための魅力的な道を開くものであると言えるでしょう。
FMTの成功を確立する方法: 生着率の重要な役割
腸内細菌叢の包括的な評価: WGSの利点
ドナーの便がレシピエントに移植される際に起こるプロセスを理解するためには、マイクロバイオームの組成を調査することが重要である。マイクロバイオームの生態と動態を理解することで、さまざまな疾患や状態におけるFMTの成功を決定するメカニズム的なヒントを得ることができる。様々な疾患におけるFMTプロトコルは、ドナーの生着率を高めることを目的としており、これが臨床的成功の重要な決定要因であると考えられるからです。
75
,
128
このため、FMT前後の患者の腸内細菌叢の組成を、FMT接種物とともにプロファイリングする必要がある。個人の腸内細菌叢には通常、200種を超える微生物が生息している、
129
その大部分は培養されたことがない、
130
ハイスループットなシーケンサーが必要である。実際、微生物群集の調査を容易にするハイスループット技術は、マイクロバイオームの研究に革命をもたらした。
131
メタゲノム解析は、微生物群集から抽出したDNAの塩基配列を決定することで、どのような微生物が存在するか、その存在量、ゲノム、そして機能的な可能性についての洞察を得ることができます。初期の研究では、16S rRNA遺伝子の塩基配列決定が中心でしたが、この技術は、増幅ステップをバイパスし、より高い分類学的解像度と微生物群集がコードする機能への洞察を提供するショットガン・メタゲノミクスに置き換えられつつあります。
132
ショットガンメタゲノミクスは、15年以上前から利用されているにもかかわらず、シーケンスの深さに関する問題や、利用可能な参照データベースの一部不完全さなどの制約があるため、まだ広く利用されているとは言えません。しかし、現在進行中の活動により、これらの問題が解決され、このアプローチの普及に寄与しています。特に、シーケンスの深さはサンプルの微生物組成を解読するために不可欠ですが、シーケンスが深いとコストが高くなり、分析が複雑になるためです。
132
しかし、ショットガン・メタゲノミクスは費用対効果が高くなりつつあり、安価なシーケンス費用によって可能になったシーケンス深度の増加により、マイクロバイオーム内の分類群の検出限界が下がっています。さらに、オープンアクセスの取り組み、例えば、BioBakeryスイートと関連するチュートリアル、
133
は、ショットガン・メタゲノミクスの普及を促進し、計算スキルのトレーニングを支援している。
また、ショットガンメタゲノミクスの早期普及に関連する問題として、糞便サンプルの分類学的組成全体を特定できない可能性がある参照データベースの必要性が挙げられる。
133
しかし、特に腸内細菌叢については、大規模な培養プロジェク
134
と大規模なメタゲノム解析の取り組み
135
は急速に拡大し、分類学的プロファイリングツールに必要な参照データベースが完成しつつある。
136
同じような食生活、ライフスタイル、健康プロファイルを持つ異なる個人は、同等の種に収束することで、全体的に類似した腸内細菌叢の組成を示すことができます。対照的に、細菌株は対象者に非常に特異的であるため、マイクロバイオームの移植を検討することが容易です。
75
,
137
,
138
移植したサンプルに存在した特定の菌株が、レシピエントの糞便サンプルから検出された場合、その菌株が患者の腸内に移植されたことが推測される。ショットガン・メタゲノミクスのみが単一菌株の解像度に達し、サンプル中の数百の菌株を調査できるスループットを持っているため、FMTの文脈でマイクロバイオームを調査する際に選択すべき技術であることは間違いない。
菌株の生着率の定義
FMTにおける重要な評価は、接種した微生物株がレシピエントの腸内でどの程度生着するかを判断することである。菌株の生着率はFMTの効率性の代用品とみなすことができ、これを定量化することは、生着率を最大化できる条件を特定するための第一歩となる。しかし、Strain engraftmentを計算する手段は、この分野ではまだ標準化されていない。第一の限界は、マイクロバイオームにおける菌株のコンセンサス定義が欠落していることである。
137
,
138
菌株を「限られた遺伝的異質性にもかかわらず、異なる条件下で同じ表現型を持つ微生物実体」と定義することに多くの人が同意しているが、137 , 138
137
これは実際には確立するのが困難である。マイクロバイオームの大部分は、今のところ未培養のままである、
135
表現型の検証は簡単にはできません。このため、(植物)遺伝的変異に関する閾値が採用されています、
139
が、これらは依然としてやや恣意的である。最近、種の異なる進化速度や全体的な変動性を最もよくとらえるために、種に特化した系統の操作的定義が提案された
140
を提案し、FMTに伴う株の生着率を評価するために使用されました。
75
具体的な定義は、より多くのデータが利用可能になり、菌株レベルのプロファイリングツールが改善され続けるにつれて微調整することができるが、菌株の個々の特異性と持続性に基づくこのような情報に基づく定義は、マイクロバイオームの移植をより正確に評価することができると我々は考えている。
第二に、糞便サンプルは患者腸内の微生物群集を非侵襲的に調査することができるが、微生物密度は便1gあたり約1011個に達するため、シーケンス技術では微生物群集全体を捕捉することができない。
141
したがって、FMTレシピエントで検出される菌株の数はシーケンスの深さに依存し、偏った推定値を避けるためにこれを考慮する必要がある。移植株数は、ドナーおよびレシピエントの総検出株数、またはレシピエントに移植される可能性のあるFMT接種物中の(検出)株数(すなわち、シークエンスで検出される種の代表的なもの)などで正規化することにより、移植株数のメトリクスが定義されている。
60
,
75
今後、菌株の生着率の指標を統一することで、研究間の比較が容易になると思われるが、単独の研究結果を解釈する際には、計算方法とそのニュアンスに留意することが重要である。
微生物生着率と臨床的成功の相関性
FMT試験において、臨床的成功と微生物学的成功の両方を評価する場合、これら2つの変数の関係を調べることが重要である。TURN試験では、臨床的成功を経験したレシピエントのFMT後のマイクロバイオームは、FMT前のマイクロバイオームよりも対応するドナーのマイクロバイオームに類似しており、そのβ多様性に変化がみられたという。
60
この設定において、β多様性はマイクロバイオーム移植の初歩的な代用品として想定されたかもしれない。近年、全ゲノム配列解析(WGS)の利用により、微生物移植をより正確に評価できるようになり、上記で説明したように、菌株追跡に基づく評価が可能となった。このアプローチでは、24のFMT試験と約1,400の糞便サンプルを対象とした大規模なメタゲノム解析において、微生物の移植は、疾患に関係なく臨床的成功と関連していることが確認されている。
75
しかし、この知見は、コホート、疾患、FMT作業プロトコル、マイクロバイオーム分析方法の違いによる異質性のためか、別の同様の研究では再現されていない。
90
微生物移植とFMT後の臨床的成功の絶対的な関係だけでなく、微生物移植の縦断的な持続が臨床的成功の期間に影響を及ぼすかどうかというのも、未解決の問題である。ハイスループットな菌株レベルの解像度のマイクロバイオーム解析が最近可能になったばかりであるため、レシピエントのマイクロバイオームにおける生着菌株の経時的な持続性については未解決のままである。菌株は、乱れがない限り、個人のマイクロバイオームにおいて時間的にかなり持続的である(約6ヶ月で87%の菌株が持続する)。
140
抗生物質治療は、副作用として疾患関連菌と健康関連菌の両方を除去するが、コロニー形成抵抗性を低下させ、生着に有利に働く。
75
,
142
抗生物質による前処理は、FMTの臨床プロトコールに含めることが推奨されているが、生着株の持続性については、この文脈ではまだ検討されていない。
75
全体として、生着と FMT の臨床的成功との間に観察された関係は、十分な規模とデザインの研究(例えば、臨床的成功の定義が明確であること)を通して、さらに専門的に調査される必要がある。さらに、生着株の持続性と疾患寛解との関連を明らかにするために、FMT後の複数の時点における縦断的なサンプリングが必要とされる。その結果、異なる条件下でFMTコースを繰り返し実施すべきかどうか、実施する場合はどのような間隔で実施すべきかが明らかになるであろう。
143
文化的な変化と将来の洞察
FMTを非伝染性疾患の潜在的治療オプションとして発展させるためには、技術の向上だけでなく、いくつかの考え方の転換が必要であると私たちは考えています。現在までのところ、2つの主要な文化的障害が、FMTの手順と連動したマイクロバイオーム解析の欠如と、FMTを急性かつ単回使用の治療として考えることを含め、感染症以外のFMTの進展を妨げています(図2)。
図2FMTおよびFMT後のマイクロバイオータ由来療法のための文化的シフトと将来の洞察
キャプションの全文を表示する
大きな画像を表示する
高解像度画像をダウンロードする
ドナーの選択 マイクロバイオームシーケンスと機械学習の役割
現在、多くの臨床医がマイクロバイオームシーケンスと解析にまだ慣れていない。rCDIでは健康なマイクロバイオームの注入はその構成に関わらず臨床的に有効であるが、ドナーの微生物コミュニティの構成は非感染性疾患の治療において重要な役割を果たすと考えられる、
56
の治療において重要な役割を果たすと考えられています。
75
したがって、臨床医は近い将来、マイクロバイオームシーケンスの結果を解釈し、腸内細菌叢を調節するための準備と訓練を受ける必要がある。
FMTにおいて菌株の生着率を最大化するマイクロバイオームの特性を特定することで、臨床医は一人の患者ごとに最適なドナーを選択することができるようになる。スーパードナーを構成する共有特性(例えば、高い微生物種の豊かさと多様性)の存在を支持する研究もあるが、
54
は、最適なドナーは患者ごとに異なることを明らかにした、
75
,
144
このように、最適なドナーは患者ごとに異なるため、「1つの便がすべてに適合する」アプローチではなく、個別化された選択戦略が必要とされている。例えば、家族または世帯員のドナーは、ベースライン時の株分け率が高いことと関連することが判明したが、過去の株分けを考慮すると、株分け生着率が高いという結果にはならなかった。
75
株レベルの解像度のマイクロバイオームプロファイリングは、各FMT症例の生着率を詳細に把握することで、FMTの効率を最適化するドナーのマイクロバイオーム特性を明らかにすることができる。このようなデータのメタアナリシスにより、FMTの実践は、散在するコホート固有の観察から、グローバルで疾患特異的な確かな知見へと移行する。最後に、このような関連性から予測モデルを構築し、パーソナライズされた方法でドナーの選択を知らせることができます。
マイクロバイオームデータは非常に複雑で多次元的であるが、現在利用可能なサンプル数が多いため、マイクロバイオーム組成に基づいて各受容者に最適なドナーを特定できるモデルを開発する道が開かれた。Xiao et al.
145
は、生態学的モデリングの枠組み(一般化ロトカ-ボルテラモデルに基づく)を用いてFMTにおける微生物の動態を評価し、レシピエントがFMT前にマイクロバイオームの多様性が高い場合に最適なドナーが最も個別化されることを発見した。しかし、ほとんどの研究は、機械学習アプローチ(主にランダムフォレストアルゴリズム)を使用し、その後、独立したデータで検証しています。ランダムフォレストに続き、LOO(leave-one-out)アプローチによる検証を行ったKazemian et al.
144
は、FMTの成功を決定するために相互作用する可能性のあるFMT接種物およびFMT前のレシピエントの属を特定した。その中には、新しい宿主に移植されるまでの生存を助けるかもしれない、接種物中の胞子形成細菌が含まれていた。さらに、Zou et al.
146
は、宿主のパラメータ(免疫マーカーや消化器症状のスコアなど)と細菌の分類群に基づいて、FMT後のレシピエントマイクロバイオームの比較的高い予測性(AUC>85%)を見出した。He et al.
93
は、FMTの有効性を予測するために同様のアプローチを行い、同等の精度を得た(受信者動作特性曲線[AUROC]=80%)。Smillie et al.
94
は、宿主とレシピエントの両方のマイクロバイオームの特徴とともに臨床データを組み込んだランダムフォレスト分類モデルを使用して、レシピエントに生着する細菌種を予測し、次にランダムフォレスト回帰モデルを使用してその存在量を予測したが、これも良好な結果を得た(AUC = 92%)。しかし、単一のFMT研究で一般的に使用される数が少ないため、オーバーフィッティングを引き起こす可能性があり、コホート全体への適用が制限されます。より最近の研究では、16の宿主およびマイクロバイオームの特徴を用いて、24の異なるコホートから得られた226のFMT事例において、FMTによる種の移植を予測するランダムフォレストモデルを開発した。
75
その結果、5回クロスバリデーションの設定で、AUROC下面積が85%になった。また、ランダムフォレスト回帰モデルを用いて、FMT後の生物種の存在量を予測したところ、予測可能性はコホートに一部依存することが判明したものの、データセット間で実質的な予測可能性は維持された。
FMT:慢性疾患に対する慢性療法?可能性と限界
もう一つの主な文化的欠点は、他の薬剤が慢性疾患を治すために長期的に使用されるのが一般的であるのに対し、FMTは主に1回限りの治療オプションであるという広く知られている見解が含まれています。このレビューで述べたように、FMTが慢性療法として機能する可能性があることを示す新たな証拠が現れている。
98
しかし、慢性疾患の日常管理においてFMTを大規模に実施するためには、いくつかの問題に対処する必要がある。第一に、便の材料は、食事、習慣、その他の制御不能な環境要因によって、ドナーごとに、また同じドナーであっても時間の経過とともに、本質的に変化するものである。このため、FMT製品のバッチごとの再現性が制限され、有効性と安全性において制御不能な変動要因になる可能性がある。この不確実性の原因を抑えるために、異なるバッチ間のFMTの信頼性を実証するために使用できる機能ベンチマークを開発したいと考えるかもしれない。しかし、便組成の完全な特徴付けは、最新のマルチオミックアプローチを用いても、今のところ達成不可能である。既知および実現可能なものに基づくと、ショットガンメタゲノムリードの20%~50%はマッピングできず、同定された遺伝子の30%~50%は機能不明であり、最も顕著なのは代謝物の80%~90%が同定できない点である。
135
,
147
この課題は、ほとんどが機能未知のFMT材料に存在するウイルス、古細菌、真菌、原生生物、ヒト細胞材料を考慮すると、さらに複雑になる。
第二に、慢性疾患の治療には慢性的な治療が必要であり、予期せぬ安全性の問題を引き起こす可能性がある。FMTは、免疫不全の脆弱な患者であっても、1回または数回の移植でCDIに非常に良好な安全性プロファイルを示した。
48
しかし、生きた微生物を繰り返し投与することは、特有の合併症を引き起こす可能性がある。病原体に対する慎重かつ広範なドナーのスクリーニングにもかかわらず、既知および未知の感染因子の伝播の可能性は、FMTの回数が増えるにつれて高くなるであろう。実際、肝硬変および血液悪性腫瘍の患者において、FMTを繰り返した後、生命を脅かす合併症を伴うMDR菌の伝播が2例報告されている。
46
さらに、FMTの繰り返しにより、腸内細菌叢が深く安定的に変化し、非感染性の慢性疾患に移行する可能性もある。この問題に対処するためには、長期的な前向き安全性コホートが必要であるが、そのような潜在的影響を発見するのに必要な期間が長く、交絡因子も多いため、成功するかどうかは不明である。第三に、日常診療や臨床試験におけるドナーの募集は非常に困難である。潜在的な候補者の2%~20%が最終的に適格であるため
148
であり、糞便の収集と処理に固有の制約があるため、このプロセスの工業化は、コストと物流の面で大きな障害に直面することになる。第四に、FMTの治療効果の要因はほとんど不明であり、疾患ごとに、さらには患者ごとに異なる可能性が高い。FMT製品の工業化の複雑さを示す顕著な例として,健康な被験者の糞便微生物叢に由来する「精製」細菌製剤であるSER-287の開発中止が挙げられる。この製剤は,第1b相試験でUCの寛解導入に効果を示したが,2021年の第2b相試験では確認されなかった.
149
今日、慢性疾患における腸内細菌叢介入による治療効果の可能性を探るためには、追加のFMT試験が必須である。しかし、これらの困難を考慮すると、FMTに関する研究は、合成マイクロバイオームコンソーシアムからなる新しい生きたバイオ治療製品、または高度に制御され、拡張可能で、再現性のある方法で同定および生成できる代謝物と微生物の特定の組み合わせなど、FMT後に投与できる追加のマイクロバイオータに基づく治療の開発を目指す必要があります。
謝辞
ポリクリニコ・ジェメッリIRCCS財団のスタッフは、ローマ財団の科学研究に対する貴重な支援に感謝します。この研究は、欧州研究評議会(ERC-STGプロジェクトMetaPG-716575およびERC-CoGプロジェクトmicroTOUCH-101045015)からN.S.に、欧州H2020プログラム(ONCOBIOME-825410プロジェクトおよびMASTER-818368プロジェクト)によりN.S. に支援されています。 米国国立がん研究所(1U01CA230551)からN.S.へ、Premio Internazionale Lombardia e Ricerca 2019からN.S.へ、イタリア保健省(Ricerca Correnteと5×1000の資金)からN.S.へ、EMBO ALTF 593-2020からM. V.-. C.に、イタリア保健省のRicerca Finalizzata Giovani Ricercatori 2018(プロジェクトGR-2018-12365734)からG.I.に、イタリア研究省のBIOMIS助成金からA.G、G.C.およびG.I.に、欧州連合のHorizon 2020研究・イノベーションプログラム(ERC-2016-StG-71577)に基づく欧州研究会議(ERC)に、Agence Nationale de Recherche(ANR-20-CE14-0005-1)からH.Sに、研究計画、データ収集および分析、出版決定、原稿作成において出資者は関与していない。
著者の貢献
G.I.は総説の構想を行った。N.S.、A.G.、G.C.、H.S.、G.I.が総説の構成を考案した。S.P.、N.B.、M.V.-C.、H.S.、G.I.は原稿の初稿を執筆した。S.P.とG.I.はテーブルを作成した。N.B.とH.S.は図を描いた。著者全員が原稿の重要な修正を行い、最終版を承認して投稿した。
利益申告
A.G.は、Eisai S.r.l., 3PSolutions, Real Time Meeting, Fondazione Istituto Danone, Sinergie S.r.l. Board MRGE, SanofiS.p.A. のコンサルタントとしての個人報酬、武田 S.p.A, AbbVie, Sandoz S.p.A のスピーカーとしての個人報酬、VSL3 とEisaiの諮問委員としての個人報酬を報告している。G.C.は、Ferring Therapeuticsの顧問として個人的な報酬を受け取っています。H.S.は、Amgen、Fresenius、IPSEN、Actial、Astellas、Danone、THAC、biose、BiomX、Eligo、Immusmol、Adare、Nestle、Fering、MSD、Bledina、Pfizer、Biacodex、BMS、Bromatech、Gilead、Janssen、Mayoli、Roche、Sanofi、Serve、武田、Abbieから講演料、役員、コンサルティングの依頼を受けており、エンターメバイオサイエンスの株式を持っていてExeliomバイオサイエンスの共同創業者を務める。G.I.は、Biocodex、Danone、Sofar、Malesci、Metagenics、Tillotts Pharmaの講演者として、Ferring Therapeutics、Giuliani、Metagenics、Tillotts Pharmaのコンサルタント/アドバイザーとして個人的報酬を得ています。
参考文献
ウィルソン・K.H.
ブリッチングトンR.B.
リボソームDNA配列解析によるヒト大腸生物相の研究。
Appl. Environ. Microbiol. 1996; 62: 2273-2278https://doi.org/10.1128/AEM.62.7.2273-2278.1996
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
アイゼマンB.
シレンW.
バスコムG.S.
カウバー A.J.
偽膜性腸炎の治療における補助としての糞便浣腸。
Surgery. 1958; 44: 854-859
記事で見る
PubMed
グーグル奨学生
クライシ M.N.
ウィドラックM.
バーラN.
ムーアD.
プライスM.
シャルマ N.
Iqbal T.H.
メタアナリシスによる系統的レビュー:再発性および難治性のクロストリジウム・ディフィシル感染症の治療に対する糞便微生物移植の有効性。
Aliment. Pharmacol. Ther. 2017; 46: 479-493https://doi.org/10.1111/APT.14201
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
Hui W.
Li T.
Liu W.
Zhou C.
Gao F.
再発性C. difficile感染症の治療に対する糞便微生物移植:最新のランダム化比較試験のメタアナリシス。
PLoS One. 2019; 14 (e0210016)https://doi.org/10.1371/JOURNAL.PONE.0210016
記事で見る
クロスレフ
グーグル スカラー
イアニーロ G.
マイダ M.
ブリッシュJ.
シモネリC.
ホールドG.
ヴェンティミリア M.
ガスバリーニ A.
Cammarota G.
Clostridium difficile感染症に対する異なる糞便微生物移植プロトコルの有効性: システマティックレビューとメタアナリシス。
U. Eur. Gastroenterol. j. 2018; 6: 1232-1244https://doi.org/10.1177/2050640618780762
記事で見る
スコープス(117)
パブコメ
クロスレフ
グーグル奨学生
カマロタG.
マスッチL.
イアニーロG.
ビッボS.
ディノイG.
コスタマーニャG.
サングイネッティ M.
Gasbarrini A.
無作為化臨床試験:再発性クロストリジウム・ディフィシル感染症の治療における大腸内視鏡による糞便微生物移植とバンコマイシンの比較。
Aliment. Pharmacol. Ther. 2015; 41: 835-843https://doi.org/10.1111/APT.13144
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
アビー E.S.
ヴォーンB.P.
エンズE.A.
ラジャシンガムR.
初回再発のClostridioides difficile感染症に対する糞便微生物移植の費用対効果。
Clin. Infect. Dis. 2022; 75: 1602-1609https://doi.org/10.1093/CID/CIAC207
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
フヴァス C.L.
ダール・ヨルゲンセン・S.M.
ヨルゲンセン・S.P.
ストルゴーM.
レミングL.
ハンセンM.M.
エリクストラップC.
Dahlerup J.F.
再発性Clostridium difficile感染症の治療において、糞便微生物移植はfidaxomicinよりも優れている。
Gastroenterology. 2019; 156: 1324-1332.e3https://doi.org/10.1053/J.GASTRO.2018.12.019
記事で見る
スコープス(0)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
イアニーロG.
マスッチL.
クアランタG.
シモネリC.
ロペトゥーゾL.R.(Lopetuso L.R.
サングイネッティ M.
ガスバリーニ A.
Cammarota G.
無作為化臨床試験:重症難治性クロストリジウム・ディフィシル感染症の治療における大腸内視鏡による糞便微生物移植とバンコマイシン-単回注入と複数回注入。
Aliment. Pharmacol. Ther. 2018; 48: 152-159https://doi.org/10.1111/APT.14816
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
イアニーロG.
ムルリR.
スキューメG.D.
インパニャティエッロM.
マスッチL.
フォード A.C.
ローG.R.
ティルグ H.
サングイネッティM.
カウダR.
他
糞便微生物移植または抗生物質による治療を受けたClostridioides difficile感染症の再発患者における血流感染症の発生率、入院期間、および生存率: プロスペクティブ・コホート研究
Ann. Intern. Med. 2019; 171: 695-702https://doi.org/10.7326/M18-3635
記事で見る
スコープス(61)
パブコメ
クロスレフ
グーグル奨学生
カマロータG.
イアニーロG.
マガリーニS.
ガスバリーニA.
グイD.
糞便微生物叢の移植プログラム開始後のClostridium difficile感染症の手術の減少。
Ann. Intern. Med. 2015; 163: 487-488https://doi.org/10.7326/L15-5139
記事で見る
スコープス(46)
パブコメ
クロスフィルム
グーグル奨学生
マクドナルドL.C.
ゲルディングD.N.
ジョンソンS.
バッケンJ.S.
キャロルK.C.
コフィン・S.E.
ダバーク E.R.
ギャリー K.W.
グールド C.V.v.
ケリーC.
ら。
成人および小児におけるクロストリジウム・ディフィシル感染症の診療ガイドライン:米国感染症学会(IDSA)および米国医療疫学学会(SHEA)による2017年更新版。
Clin. Infect. Dis. 2018; 66: 987-994https://doi.org/10.1093/CID/CIY149
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ヴァン・プレインJ.
レイガダスE.
フォーゲルザングE.H.(Vogelzang E.H.
ブーザE.
フリスティア A.
グエリ B.
クルートヴァ M.
ノレン T.
アラーベルガーF.
コイアJ.E.
ら。
欧州臨床微生物・感染症学会:成人におけるClostridioides difficile感染症の治療ガイダンス文書に関する2021年の更新。
Clin. Microbiol. Infect. 2021; 27: s1-s21https://doi.org/10.1016/J.CMI.2021.09.038
記事で見る
スコープス (0)
パブコメ
概要
全文
全文PDF
Google Scholar
カマロタG.
イアニーロG.
ティルグ H.
ラジリッチ-ストヤノヴィッチM.
クンプ P.
サトカリ R.
ソコル H.
アークキラ P.
ピントゥス C.
ハートA.
ら。
臨床現場における糞便微生物移植に関する欧州コンセンサス会議。
Gut. 2017; 66: 569-580https://doi.org/10.1136/GUTJNL-2016-313017
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
リーC.H.
スタイナーT.
ペトロフE.O.
スミーヤM.
ロスコーD.
ネマタラーA.
ウィーズ J.S.
コリンズ S.
モアイェディ P.
クラウザーM.
他
再発性クロストリジウム・ディフィシル感染症患者における凍結便微生物移植と下痢の臨床的消失の比較: 無作為化臨床試験。
JAMA. 2016; 315: 142-149https://doi.org/10.1001/JAMA.2015.18098
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
ヴェンドリック・K.E.W.
ターベールE.M.
クイパーE.J.
ヌーイS.
ボイエ・コッペノールE.
サンダース I.M.J.G.
ヴァン・リンゲンE.
ヴェルスパゲットH.W.
ベルゼンブルッヘ E.K.L.
ケラーJ.J.
他
糞便微生物移植における多剤耐性菌の伝播を防ぐための隔離期間を設けたドナー糞便の定期的なスクリーニング:レトロスペクティブコホートスタディ。
Lancet Infect. Dis. 2021; 21: 711-721https://doi.org/10.1016/S1473-3099(20)30473-4
記事で見る
スコープス(12)
PubMed
概要
全文
全文PDF
グーグル・スカラー
カイパー E.J.
アレグレイティJ.
ホーキーP.
ソコルH.
ゴールデンバーグS.
イアニーロ G.
ガスバリーニ A.
クンプ P.
コステロ S.P.
ケラーJ.
ら。
糞便微生物移植による多剤耐性菌の伝播の後に必要な議論。
Lancet Infect. Dis. 2019; 19: 1161-1162https://doi.org/10.1016/S1473-3099(19)30545-6
記事で見る
スコープス(6)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
イアニーロG.
ポルカリS.
ビッボS.
ジアンボF.
クアランタG.
マスッチ L.
サングイネッティ M.
ガスバリーニ A.
Cammarota G.
糞便微生物移植のためのドナープログラム: イタリアの大容量便バンクの3年間の経験。
Dig. Liver Dis. 2021; 53: 1428-1432https://doi.org/10.1016/J.DLD.2021.04.009
記事で見る
PubMed
概要
全文
全文PDF
Google Scholar
FDA
移植用糞便微生物群の使用と多剤耐性菌の伝播による重篤な副作用のリスクに関する重要な安全警告。
2019
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/important-safety-alert-regarding-use-fecal-microbiota-transplantation-and-risk-serious-adverse
記事で見る
グーグル スカラー
イアニーロ G.
マリシュ B.H.
ケリーC.R.
カッサムZ.
カイパー E.J.
ウン・S.C.
イクバル T.H.
アレグレットティ J.R.
ビッボ S.
ソコル H.
ら。
COVID-19パンデミック時の糞便微生物移植サービスの再編成。
Gut. 2020; 69: 1555-1563https://doi.org/10.1136/GUTJNL-2020-321829
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
イアニーロG.
ビッボS.
マスッチL.
クアランタG.
ポルカリS.
セッタンニ C.R.
ロペトゥーゾL.R.(Lopetuso L.R.
ファントーニM.
サングイネッティM.
ガスバリーニ A.
他
COVID-19パンデミック時のC. difficile感染症に対する糞便微生物移植の標準量、有効性、安全性を維持する: 前向きコホート研究。
Dig. Liver Dis. 2020; 52: 1390-1395https://doi.org/10.1016/j.dld.2020.09.004
記事で見る
スコープス(13)
PubMed
要旨
全文
全文PDF
Google Scholar
カマロタG.
イアニーロG.
ケリーC.R.
マリシュ・B.H.
アレグレットティJ.R.
カッサムZ.
プティニャーニL.
フィッシャー M.
ケラーJ.J.
コステロS.P.
他。
臨床現場における糞便微生物移植のためのスツールバンキングに関する国際コンセンサス会議。
Gut. 2019; 68: 2111-2121https://doi.org/10.1136/GUTJNL-2019-319548
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
カオ D.
ローチB.
シルバM.
ベックP.
リュー・K.
カプラン G.G.
チャン・H.J.
カワード S.
グッドマンK.J.
Xu H.
他。
クロストリジウム・ディフィシル感染症の再発に対する、経口カプセル投与と大腸内視鏡投与による糞便微生物移植の効果: 無作為化臨床試験。
JAMA. 2017; 318: 1985-1993https://doi.org/10.1001/JAMA.2017.17077
記事で見る
スコープス(0)
パブコメ
Crossref
グーグル奨学生
Scheeler A.
便が薬になるところ:移植用糞便微生物群の使用を規制するための国際的アプローチ。
J. 法 Med. Ethics. 2019; 47: 524-540https://doi.org/10.1177/1073110519897729
記事で見る
スコープス(9)
パブコメ
クロスレフ
グーグル奨学生
FDA(米国食品医薬品局
標準治療に反応しないクロストリジウム・ディフィシル感染症を治療するための移植用糞便微生物群の使用に関する治験薬要件についての施行方針。
2022
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/enforcement-policy-regarding-investigational-new-drug-requirements-use-fecal-microbiota
記事で見る
Google Scholar
ビボ S.
セッタンニC.R.
ポルカリS.
ボッキーノE.
イアニーロG.
カンマロータG.
Gasbarrini A.
糞便微生物移植:最適なドナーを選択するためのスクリーニングと選択。
J. Clin. Med. 2020; 9: 1-14https://doi.org/10.3390/JCM9061757
記事で見る
クロスフィルム
グーグルスカラー
バケロ F.
ノンベラC.
ヒトの臓器としてのマイクロバイオーム。
Clin. Microbiol. Infect. 2012; 18: 2-4https://doi.org/10.1111/J.1469-0691.2012.03916.X
記事で見る
スコープス (0)
パブコメ
概要
全文
全文PDF
Google Scholar
デ・ステファノM.C.
マッツァンティ B.
ベスパシアーノF.
ロンバルディーニL.
カルディロ M.
イタリアにおけるClostridioides difficile感染症の治療としての糞便微生物移植の規制アプローチ。
アンチバイオティクス(バーゼル)。2022; 11480https://doi.org/10.3390/ANTIBIOTICS11040480
記事で見る
PubMed
クロスフィクション
Google Scholar
欧州委員会
血液や組織・細胞に関するEUの法律の評価を支援する研究。
(SANTE/2017/B4/010.最終報告書)2018年
https://op.europa.eu/en/publication-detail/-/publication/c1c3414c-ec23-11e9-9c4e-01aa75ed71a1/language-en/format-PDF/source-106664789
記事で見る
グーグル・スカラー
欧州委員会
健康・食品安全総局. ヒト由来物質に関する所轄官庁専門家グループ(CASoHO E01718)。組織・細胞に関する所轄官庁会議.
(サマリーレポート)2014
https://health.ec.europa.eu/system/files/2016-11/ev_20141203_sr_en_0.pdf
記事で見る
グーグル・スカラー
ヒト組織および細胞の寄贈、調達、試験、加工、保存、保管および配布に関する品質および安全性の基準の設定に関する2004年3月31日の欧州議会および理事会の指令2004/23/EC https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:102:0048:0058:en:PDF.
記事で見る
Google Scholar
ヒト由来物質に関する規制の提案 https://health.ec.europa.eu/blood-tissues-cells-and-organs/overview/proposal-regulation-substances-human-origin_en.
記事で見る
Google Scholar
米国食品医薬品局(FDA)
REBYOTA(レビョウタ)。
2022
https://www.fda.gov/vaccines-blood-biologics/vaccines/rebyota
記事で見る
Google Scholar
オーストラリア政府
保健省、高齢者ケア、治療用医薬品管理局
BIOMICTRA.
2022
https://www.ebs.tga.gov.au/servlet/xmlmillr6?dbid=ebs/PublicHTML/pdfStore.nsf&docid=399066&agid=(PrintDetailsPublic)&actionid=1
記事で見る
Google Scholar
Zhao H.L.
チェンS.Z.
Xu H.M.
Zhou Y.L.
He J.
Huang H.L.
Xu J.
Nie Y.Q.
潰瘍性大腸炎患者の治療における糞便微生物移植の有効性と安全性: システマティックレビューとメタアナリシス。
J. Dig. Dis. 2020; 21: 534-548https://doi.org/10.1111/1751-2980.12933
記事で見る
スコープス (16)
パブコメ
クロスフィルム
グーグル奨学生
ウー・ジェイ
Lv L.
Wang C.
過敏性腸症候群における糞便微生物移植の有効性: ランダム化比較試験のメタアナリシス(A meta-analysis of randomized controlled trials)。
Front. Cell. Infect. Microbiol. 2022; 12827395https://doi.org/10.3389/FCIMB.2022.827395
記事で見る
クロスレフ
グーグルスカラー
プロエンサ I.M.
アレグレッティJ.R.
ベルナルドW.M.
デ・モウラ D.T.H.
ポンテ・ネトA.M.
マツバヤシC.O.
フロールM.M.
コティンダ A.P.S.T.
デ・モウラ E.G.H.
糞便微生物移植はメタボリックシンドロームパラメーターを改善する:ランダム化臨床試験に基づくメタアナリシスによるシステマティックレビュー。
Nutr. Res. 2020; 83: 1-14https://doi.org/10.1016/J.NUTRES.2020.06.018
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
セッタンニ C.R.
イアニーロG.
ビッボS.
カンマロータG.
ガスバリーニA.
精神疾患における腸内細菌叢の変化と調節:糞便微生物叢移植に関する現在のエビデンス。
Prog. Neuropsychopharmacol. Biol. Psychiatry. 2021; 109110258https://doi.org/10.1016/J.PNPBP.2021.110258
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
リン Z.
リュウ X.
Jia X.
Cheng Y.
Luo Y.
Yuan L.
Wang Y.
Zhao C.
Guo S.
Li L.
et al.
小児における異なる毒素原性Clostridium difficile株への感染が糞便微生物相に及ぼす影響.
Sci. Rep. 2014; 47485https://doi.org/10.1038/SREP07485
記事で見る
Crossref
グーグル スカラー
ステイリーC.
ケリーC.R.
ブラントL.J.
コルッツA.
サドウスキー M.J.
糞便微生物移植後の再発性クロストリジウム・ディフィシル感染からの回復に完全な微生物叢移植は必須でない。
mBio. 2016; 7 (e01965-e01916)https://doi.org/10.1128/mBio.01965-16
記事で見る
スコープス(79)
PubMed
クロスフィルム
グーグル奨学生
クートR.S.
レヴィン E.
サロヤルヴィJ.
スミッツL.P.
ハルトストラ A.V.v.
ウダヤッパンS.D.
エルメス G.
ブーターK.E.
クーペンA.M.
ホルストJ.J.
et al.
メタボリックシンドロームにおけるリーンドナー糞便後のインスリン感受性の改善は、ベースラインの腸内細菌叢の組成によって左右される。
Cell Metab. 2017; 26: 611-619.e6https://doi.org/10.1016/J.CMET.2017.09.008
記事で見る
スコープス(0)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
ダンヌ C.
ロルヒオンN.
ソコル H.
糞便微生物移植におけるレシピエントファクター:1つの便がすべてに適合するわけではありません。
Nat. Rev. Gastroenterol. Hepatol. 2021; 18: 503-513https://doi.org/10.1038/S41575-021-00441-5
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
モカヌV.
チャンZ.
ディーハン E.C.
カオD.H.
ホッテ N.
カルマリS.
バーチ D.W.
サマラシンゲ・K.K.
ウォルター J.
マドセンK.L.
重度の肥満とメタボリックシンドローム患者における糞便微生物移植と食物繊維補給:無作為二重盲検プラセボ対照第2相試験。
Nat. Med. 2021; 27: 1272-1279https://doi.org/10.1038/S41591-021-01399-2
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
カマロータG.
Ianiro G.
潰瘍性大腸炎に対するFMT:ターニングポイントに近づいている。
Nat. Rev. Gastroenterol. Hepatol. 2019; 16: 266-268https://doi.org/10.1038/S41575-019-0131-0
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
フォイヤースタットP.
ルイT.J.
ラシュナーB.
ワン・イーエル(Wang E.E.L.
ディアオ・L.
ブライアント J.A.
シムズ M.
クラフト C.S.
コーエンS.H.
ベレンソンC.S.
他
再発性クロストリジオイデスディフィシル感染症に対する経口マイクロバイオーム療法、SER-109。
N. Engl. J. Med. 2022; 386: 220-229https://doi.org/10.1056/NEJMoa2106516
記事で見る
スコープス(76)
PubMed
クロスフィルム
グーグル奨学生
デフィリップZ.
ブルームP.P.
トーレス・ソトM.
マンスールM.K.
セイターM.R.A.
ハントリーM.H.
ターベット S.
チョン R.T.
チェン・Y.B.
Hohmann E.L.
糞便微生物叢移植により感染した薬剤耐性大腸菌による菌血症
N. Engl. J. Med. 2019; 381: 2043-2050https://doi.org/10.1056/NEJMoa1910437
記事で見る
スコープス(564)
パブコメ
クロスレフ
グーグル奨学生
米国食品医薬品局(US Food and Drug Administration
移植のための糞便微生物叢の使用に関する安全警告とSARS-CoV-2およびCOVID-19に係る追加の安全保護。
2020
www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/safety-alert-regarding-use-fecal-microbiota-transplantation-and-additional-safety-protections
記事で見る
Google Scholar
マルセラ C.
キュイ B.
ケリーC.R.
イアニーロG.
カンマロータG.
Zhang F.
系統的レビュー:2000年から2020年までの糞便微生物移植関連有害事象の世界的発生率。
Aliment. Pharmacol. Ther. 2021; 53: 33-42https://doi.org/10.1111/APT.16148
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
ディ・トマソN.
ガスバリーニA.
ポンツィアーニF.R.
ヒトの健康と病気における腸管バリアー。
Int. J.エンバイロメント。Res. Public Health. 2021; 1812836https://doi.org/10.3390/IJERPH182312836
記事で見る
パブコメ
クロスレフ
グーグル奨学生
ヴェルノッキP.
リストリ M.V.
ゲレラ S.
グアラシーV.
コンテ F.
ルッソ A.
ルピ E.
アルビタル・ネーメ S.
ガルディーニ S.
パチP.
et al.
ASD児の腸内細菌叢の生態と推測される機能 神経質な被験者と比較した場合。
Front. Microbiol. 2022; 13871086https://doi.org/10.3389/FMICB.2022.871086
記事で見る
PubMed
クロスフィルム
グーグル奨学生
ドリューズJ.L.
コロナA.
サンチェスU.
ファン Y.
ホーリガン S.K.
ワイドナー M.
シドゥ S.D.
シムナー P.J.
ワン・エイチ.
ティンプ W.
他
再発性Clostridioides difficileに対する糞便微生物叢移植における潜在的な発がん性細菌の伝播とクリアランス。
JCI Insight. 2019; 4 (e130848)https://doi.org/10.1172/JCI.INSIGHT.130848
記事で見る
パブコメ
クロスフ
グーグル・スカラー
ヌーイ S.
デュカルモンQ.R.
ラロスJ.F.J.
ツヴィティンクR.D.
ノーマンJ.M.
スミッツW.K.
ヴェルスパゲットH.W.
ケラーJ.J.
ターベール E.M.
Kuijper E.J.
便微生物移植は、レシピエントの再発性Clostridioides difficile患者における発癌性大腸菌に影響を与える。
Gastroenterology. 2021; 161: 1218-1228.e5https://doi.org/10.1053/J.GASTRO.2021.06.009
記事で見る
スコープス (0)
パブコメ
概要
全文
全文PDF
Google Scholar
ダンマンC.J.
ブリットナッハーM.J.
ウェスターホフM.
ヘイデンH.S.
レイディM.
ヘイガー K.R.
マーキス S.R.
ミラー・S.I.
Zisman T.L.
潰瘍性大腸炎患者への糞便微生物群の単回大腸内視鏡投与による低レベル移植と改善。
PLoS One. 2015; 10 (e0133925)https://doi.org/10.1371/JOURNAL.PONE.0133925
記事で見る
Crossref
グーグル スカラー
フェルメイア S.
ヨーセンズ M.
フェルベーク K.
Wang J.
マキエルズK.
サビーノ J.
フェランテ M.
アッシェ G. ヴァン
ルトゲアーツ P.
Raes J.
炎症性腸疾患における糞便微生物移植の成功は、ドナー種の豊かさで決まる。
J. Crohns Colitis. 2016; 10: 387-394https://doi.org/10.1093/ECCO-JCC/JJV203
記事で見る
パブコメ
クロスフ
グーグル奨学生
クンプ P.
ヴルムP.
グレチェニッヒH.P.
ヴェンツルH.
ペトリッチュW.
ハルワックス B.
ワグナー M.
シュタドルバウアー V.
エヘラー A.
ホフマン K.M.
他
ドナー腸内細菌叢の分類学的組成は、治療抵抗性潰瘍性大腸炎における糞便微生物移植の有効性に影響を及ぼす主要な要因である。
Aliment. Pharmacol. Ther. 2018; 47: 67-77https://doi.org/10.1111/APT.14387
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ハイファーC.
ルウ L.D.W.
パラムソティS.
ボロディT.J.
リオン・R.W.
Kaakoush N.O.
UCに対する糞便微生物移植における効果的なドナーの微生物的決定因子。
Gut. 2022;https://doi.org/10.1136/GUTJNL-2022-327742
記事で見る
PubMed
クロスフィルム
グーグル奨学生
リーズ N.P.
シャヒーンW.
クインスC.
ツェレピスC.
ホーンイブローR.D.
シャルマ N.
ベッグス A.D.
イクバル T.H.
Quraishi M.N.
潰瘍性大腸炎患者における糞便微生物移植の反応に関するドナーおよびレシピエントの予測バイオマーカーのシステマティックレビュー。
EBiomedicine. 2022; 81104088https://doi.org/10.1016/J.EBIOM.2022.104088
記事で見る
PubMed
要旨
全文
全文PDF
Google Scholar
コルッツ A.
サドウスキーM.J.
遠位腸内細菌叢の治療的移植。
Mucosal Immunol. 2011; 4: 4-7https://doi.org/10.1038/mi.2010.79
記事で見る
スコープス (66)
PubMed
要旨
全文
全文PDF
Google Scholar
コステロ S.P.
ヒューズP.A.
ウォーターズ O.
ブライアント R.V.v.
ヴィンセントA.D.
ブラッチフォードP.
カティケロスR.
マカニャンガ J.
カンパニエッロM.A.
マヴランゲロスC.
他
潰瘍性大腸炎患者の8週間寛解に対する糞便微生物移植の効果: 無作為化臨床試験。
JAMA. 2019; 321: 156-164https://doi.org/10.1001/JAMA.2018.20046
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
ポドルスニーD.
ドゥルデヴィッチM.
パラムソティS.
カアクーシュ N.O.
ヘーゲナウアーC.
ゴーキエヴィッチ G.
ウォルター J.
Fricke W.F.
メタゲノム解析による糞便微生物移植後の菌株生着の臨床的・生態的決定要因の同定。
セル・リップ・メド. 2022; 3: 100711https://doi.org/10.1016/J.XCRM.2022.100711
記事で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ロッセン N.G.
フエンテスS.
ヴァン・デル・スペックM.J.
ティッセン・J.G.(Tijssen J.G.
ハートマンJ.H.A.
デュフルー A.
レーウェンベルグM.
ファンデンブリンクG.R.
マトゥス=ヴリーゲン E.M.H.
デ・フォスW.M.
他
潰瘍性大腸炎患者に対する糞便移植のランダム化比較試験による所見。
Gastroenterology. 2015; 149: 110-118.e4https://doi.org/10.1053/J.GASTRO.2015.03.045
記事で見る
スコープス (0)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
モアイェディ P.
シュレットM.G.
キム・P.T.
リベルトゥッチ J.
ウォルフ M.
オニスキ C.
アームストロング D.
マーシャル J.K.
カッサムZ.
ライニシュ W.
ら。
無作為化比較試験において、活動性潰瘍性大腸炎患者において、便微生物移植が寛解を誘導した。
Gastroenterology. 2015; 149: 102-109.e6https://doi.org/10.1053/J.GASTRO.2015.04.001
記事で見る
スコープス(0)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
パラムソティ S.
ニールセンS.
カームM.A.
デシュパンデN.P.
フェイスJ.J.
クレメンテJ.C.
パラムソティR.
ウォルシュ A.J.
ヴァン・デン・ボガエルデJ.
サミュエル・D.
et al.
潰瘍性大腸炎患者における糞便微生物移植の反応に関連する特定の細菌および代謝産物。
Gastroenterology. 2019; 156: 1440-1454.e2https://doi.org/10.1053/J.GASTRO.2018.12.001
記事で見る
スコープス(0)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
水野 聡
正岡太一
長沼正明
岸本哲也
北澤真理子
黒川 聡
中島美樹
竹下恭平
須田和彦
三村真理子.
他
ビフィズス菌に富む糞便ドナーは過敏性腸症候群患者における糞便微生物叢移植成功の陽性予測因子である可能性がある。
Digestion. 2017; 96: 29-38https://doi.org/10.1159/000471919
記事で見る
スコープス(88)
パブコメ
クロスフィルム
グーグル奨学生
エルサルヒーM.
ハトレバクJ.G.
ギルヤO.H.
ブローセン・クリストファーセンA.
Hausken T.
過敏性腸症候群患者に対する糞便微生物移植の有効性を無作為化二重盲検プラセボ対照試験で検証した。
Gut. 2020; 69: 859-867https://doi.org/10.1136/GUTJNL-2019-319630
記事で見る
スコープス (0)
PubMed
クロスフィルム
グーグル奨学生
ゴパラクリシュナンV.
スペンサーC.N.
ネジ・L.
ルーベンA.
アンドリュースM.C.
カルピネッツ・T.V.V.
プリエト・P.A.
ビセンテ・D.
ホフマン・K.
ウェイ・S.C.
ら。
腸内細菌はメラノーマ患者の抗PD-1免疫療法に対する反応を調節する。
サイエンス(Science)。2018; 359: 97-103https://doi.org/10.1126/SCIENCE.AAN4236
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ルーティ B.
ル・シャトリエE.
デローザL.
ドゥオン C.P.M.
アロウ M.T.
ダイリエールR.
フルキガーA.
メッサウデネM.
ラウバーC.
ロベルティM.P.
ら。
腸内細菌は上皮性腫瘍に対するPD-1ベースの免疫療法の有効性に影響を及ぼす。
サイエンス(Science)。2018; 359: 91-97https://doi.org/10.1126/SCIENCE.AAN3706
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
バルーチ E.N.
ヤングスターI.
ベンベツァレルG.
オルテンバーグR.
ラハトA.
カッツL.
アドラー K.
ディック=ネキュラ D.
ラスキン S.
ブロッホN.
ら。
免疫療法不応のメラノーマ患者において、糞便微生物移植が奏効を促進する。
Science. 2021; 371: 602-609https://doi.org/10.1126/SCIENCE.ABB5920
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
Zuo T.
ウォン・S.H.
ラム・K.
Lui R.
Cheung K.
Tang W.
Ching J.Y.L.
チャン・P.K.S.
チャン・M.C.W.
ウー・J.C.Y.
et al.
クロストリジウム・ディフィシル感染症における糞便微生物叢移植時のバクテリオファージ移行は治療成績と関連する。
Gut. 2018; 67: 634-643https://doi.org/10.1136/GUTJNL-2017-313952
記事で見る
PubMed
Crossref
グーグル・スカラー
ズオ・T.
ウォン・S.H.
Cheung C.P.
ラム K.
Lui R.
Cheung K.
Zhang F.
Tang W.
Ching J.Y.L.
ウー J.C.Y.
et al.
腸内細菌異常症は、Clostridium difficile感染症における糞便微生物移植の有効性低下と相関する。
Nat. Commun. 2018; 93663https://doi.org/10.1038/S41467-018-06103-6
記事で見る
Crossref
グーグル スカラー
パンペッチ W.
ソンブーンナN.
パラシュックM.
ハイエングラフP.
フィンケルマンM.
トゥムワソーンS.
Leelahavanichkul A.
Clostridium difficileマウスモデルにおけるカンジダ菌の経口投与は、疾患の重症度を悪化させるが、ビフィズス菌によって抑制される。
PLoS One. 2019; 14 (e0210798)https://doi.org/10.1371/JOURNAL.PONE.0210798
記事で見る
パブコメ
Crossref
グーグル奨学生
ブルネッティ G.
ジュリアーニA.
ナバジオA.S.
パラディジ C.
ラポニ F.
コンティL.A.
ラポニ G.
Clostridioides difficile感染者におけるCandida腸内コロニー形成、酵母種分布、バイオフィルム産生:2つの異なる期間における3つの集団間の比較。
Braz. J. Microbiol. 2021; 52: 1845-1852https://doi.org/10.1007/S42770-021-00512-4
記事で見る
PubMed
クロスフィルム
グーグル奨学生
リーK.A.
トーマスA.M.
ボルテL.A.
ビョークJ.R.(Björk J.R.
デ・ルイテルL.K.
アルマニーニ F.
アスニカーF.
ブランコ-ミゲスA.
ボード・R.
カルベット=ロパートN.
他。
進行性メラノーマにおける免疫チェックポイント阻害薬反応と腸内細菌群の関連性(クロスコホート)。
Nat. Med. 2022; 28: 535-544https://doi.org/10.1038/S41591-022-01695-5
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
チャン・ビー.
ヤン L.
Ning H.
Cao M.
チェンZ.
チェン Q.
Lian G.
Tang H.
Wang Q.
Wang J.
et al.
便微生物移植における潰瘍性大腸炎のドナー選択を導くマッチング戦略:メタアナリシスと分析的階層化プロセス。
Microbiol. Spectr. 2023; 11 (e0215921)https://doi.org/10.1128/SPECTRUM.02159-21
記事で見る
クロスレフ
グーグルスカラー
イアニロ G.
プンチョーチャールM.
カーチャーN.
ポルカリS.
アルマニーニF.
アスニカーF.
ベギーニF.
ブランコ=ミゲス A.
クンボ F.
マンギP.
et al.
異なる疾患における糞便微生物移植後の菌株生着のばらつきとマイクロバイオーム組成の予測可能性。
Nat. Med. 2022; 28: 1913-1923https://doi.org/10.1038/S41591-022-01964-3
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
グッドリッチJ.K.
ウォーターズJ.L.
プールA.C.
サターJ.L.
コレン O.
ブレクマンR.
ボーモントM.
ヴァン・トレウレンW.
ナイト R.
ベルJ.T.
ら。
ヒトの遺伝学が腸内細菌叢を形成する。
Cell. 2014; 159: 789-799https://doi.org/10.1016/J.CELL.2014.09.053
記事で見る
スコープス (0)
パブコメ
要旨
全文
全文PDF
Google Scholar
ターピン W.
エスピン-ガルシアO.
シュー・W.
シルバーバーグ M.S.
ケバンス D.
スミスM.I.
ガットマンD.S.
グリフィス A.
パナッチョーネR.
オトリーA.
他
大規模な健康コホートにおける宿主ゲノムと腸内細菌組成の関連性。
Nat. Genet. 2016; 48: 1413-1417https://doi.org/10.1038/NG.3693
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
Wang J.
ティンホルムL.B.
スキースヴィチエネJ.
ラウシュ P.
クムメンM.
ホヴ J.R.
デゲンハルトF.
ハインセンF.A.
リューレマンM.C.
シムチャック S.
他
ゲノムワイド関連解析により、ビタミンD受容体の変異と腸内細菌叢に影響を与える他の宿主因子を同定した。
Nat. Genet. 2016; 48: 1396-1406https://doi.org/10.1038/NG.3695
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ラマス B.
リチャード M.L.
ルドゥックV.
ファムH.P.
ミシェルM.L.
ダ・コスタG.
ブリドノーC.
ジェグー S.
ホフマン・T.W.
ナティヴィダードJ.M.
他
CARD9は、トリプトファンの腸内細菌叢によるアリール炭化水素受容体リガンドへの代謝を変化させることで大腸炎に影響を与える。
Nat. Med. 2016; 22: 598-605https://doi.org/10.1038/NM.4102
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
アル・ナブハニZ.
エバールG.
生後早期の微生物叢による免疫系の刷り込み(Imprinting of the immune system by the microbiota early in life.
Mucosal Immunol. 2020; 13: 183-189https://doi.org/10.1038/S41385-020-0257-Y
記事で見る
スコープス (0)
パブコメ
要旨
全文
全文PDF
Google Scholar
フルデ M.
ソマーF.
シャッセイングB.
ヴァン・ヴォルストK.
デュポンA.
ヘンゼル M.
ベーシック M.
クロップフライシュ R.
ローゼンシュティール P.
ブライヒA.
ら。
新生児期のtoll-like receptor 5による選択は、長期的な腸内細菌叢の構成に影響する。
Nature. 2018; 560: 489-493https://doi.org/10.1038/S41586-018-0395-5
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ビリンスキー J.
リスK.
トマシェフスカA.
Grzesiowski P.
Dzieciatkowski T.
ティシュカ M.
カラクルスカ・プリストゥピウク E.
ボグラツキー P.
トルマノフスカM.
ハラブルダK.
他。
急性および慢性移植片対宿主病患者における糞便微生物移植-反応スペクトルと安全性プロファイル。多施設共同前向き研究の結果。
Am. J. Hematol. 2021; 96 (e88-e91)https://doi.org/10.1002/AJH.26077
記事で見る
クロスレフ
グーグルスカラー
レヴィ M.
コロジエジツクA.A.
タイスC.A.(Thaiss C.A.
エリナブ E.
ディスバイオシスと免疫系
Nat. Rev. Immunol. 2017; 17: 219-232https://doi.org/10.1038/NRI.2017.7
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
ギャレットW.S.
ガリーニC.A.
ヤツネンコT.
ミショーM.
デュボアA.
デラニーM.L.
プニット S.
カールソンM.
ブライL.
グリックマンJ.N.
ら。
腸内細菌は腸内細菌叢と協調して、自然発症および母子感染による大腸炎を誘発する。
Cell Host Microbe. 2010; 8: 292-300https://doi.org/10.1016/J.CHOM.2010.08.004
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
コング L.
ロイド=プライスJ.
ヴァタネンT.
セクシクP.
ボーグリーL.
シモン T.
ヴラマキス H.
ソコル H.
Xavier R.J.
クローン病の寛解維持と糞便微生物移植における菌株生着の関連性。
Gastroenterology. 2020; 159: 2193-2202.e5https://doi.org/10.1053/J.GASTRO.2020.08.045
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ソコル H.
セクシクP.
フュレJ.P.
フィルメッセO.
ニオン=ラルムリエI.
ボーグリーL.
コスネス J.
コルティエ G.
マルトー P.
Doré J.
大腸炎の微生物叢におけるFaecalibacterium prausnitziiの低数値。
Inflamm. Bowel Dis. 2009; 15: 1183-1189https://doi.org/10.1002/IBD.20903
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
鎌田直樹
キム・Y.G.
シャム・H.P.
ヴァランスB.A.
プエンテ・J.L.
マーテンス E.C.
ヌニェスG.
病原体が腸内細菌叢と競合する能力を制御された病原性。
Science. 2012; 336: 1325-1329https://doi.org/10.1126/SCIENCE.1222195
記事で見る
スコープス (0)
PubMed
クロスフィルム
グーグル奨学生
パラムソティ S.
カーム M.A.
カアコウシュN.O.
ウォルシュ A.J.
ヴァン・デン・ボガエルデJ.
サミュエル・D.
レオン・R.W.L.
コナー・S.
ウン・W.
パラムソティR.
ら。
活動性潰瘍性大腸炎に対するマルチドナー集中糞便微生物移植:無作為化プラセボ対照試験。
Lancet. 2017; 389: 1218-1228https://doi.org/10.1016/S0140-6736(17)30182-4
記事で見る
スコープス(753)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ホルボートT.
ヨーセンズM.
Wang J.
ボーレンスJ.
バーハッセルトB.
ラウケンス D.
ヴァン・ヴリエルベルヘH.
ヒンドリクス P.
デ・ヴォスM.
デ・ルーズD.
et al.
重度の腹部膨満感を伴う過敏性腸症候群における糞便微生物移行の評価。
Gut. 2017; 66: 980-982https://doi.org/10.1136/GUTJNL-2016-312513
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
シュミット T.S.B.
リー・S.S.
マイストレンコ O.M.
アカンニW.
コエリョ・L.P.
ドライ S.
フラム A.
グラゼックA.M.
ヘルコグR.
ヘレマH.
他。
糞便微生物移植後の菌株動態の原動力と決定要因。
Nat. Med. 2022; 28: 1902-1912https://doi.org/10.1038/S41591-022-01913-0
記事で見る
PubMed
クロスフィルム
グーグル奨学生
レオナルディ I.
パラムソティS.
ドロンI.
セモン A.
カアクーシュN.O.
クレメンテJ.C.
フェイスJ.J.
ボロディT.J.
ミッチェル H.M.
コロンベルJ.F.
et al.
潰瘍性大腸炎における糞便微生物移植療法(FMT)に対する反応性に関連する真菌のトランスキングダムダイナミクス。
Cell Host Microbe. 2020; 27: 823-829.e3https://doi.org/10.1016/J.CHOM.2020.03.006
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
Google Scholar
コンセイサン・ネトN.
ドゥブットW.
Dierckx T.
マキエルズK.
ワン・ジェー
イインダ K.C.
メース P.
ヴァン・ランストM.
ヨーセンズ M.
レーズ J.
ら。
UC患者における真核生物ウイルスの低濃度化は、糞便微生物移植の成功に関連する。
Gut. 2018; 67: 1558-1559https://doi.org/10.1136/GUTJNL-2017-315281
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
He R.
Li P.
Wang J.
Cui B.
Zhang F.
Zhao F.
ドナーとレシピエントの腸内細菌叢の相互作用が、糞便微生物移植の有効性を決定する。
Gut Microbes. 2022; 142100197https://doi.org/10.1080/19490976.2022.2100197
記事で見る
スコープス(4)
クロスフィルム
グーグル・スカラー
スミリー・C.S.
サウクJ.
ゲバースD.
フリードマンJ.
ソンJ.
ヤングスター I.
ホーマン E.L.
ステイリー・C.
コルッツA.
サドウスキー M.J.
他
糞便微生物移植後のヒト腸内細菌生着の決定要因を菌株追跡で明らかにした。
Cell Host Microbe. 2018; 23: 229-240.e5https://doi.org/10.1016/J.CHOM.2018.01.003
記事で見る
スコープス (0)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
ラヴェル A.
ソコルH.
FMTの有効性を理解し予測する。
Nat. Med. 2022; 28: 1759-1760https://doi.org/10.1038/S41591-022-01991-0
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
アモリム N.
マクガバンE.
ラポーゾA.
カティワダS.
シェンS.
ケントゲン S.
ホールド G.
ベハリ J.
エルオマール E.
ゼクリー A.
抗生物質による腸の除染が成功した後の動物モデルにおける糞便微生物群の生着プロトコルの精緻化。
Front. Med.(ローザンヌ)。2022; 9770017https://doi.org/10.3389/FMED.2022.770017
記事で見る
クロスレフ
Google Scholar
モカヌV.
ラジャルバンS.
ダン・J.
カン・J.Y.
ディーハン E.C.
マドセンK.L.
糞便微生物移植の繰り返しと抗生物質の前処置は、炎症性腸疾患における臨床反応の改善と寛解に関連している: システマティックレビューとプール比例メタアナリシス。
J. Clin. Med. 2021; 10: 1-26https://doi.org/10.3390/JCM10050959
記事で見る
クロスフィルム
グーグルスカラー
ハイファーC.
パラムソティS.
カアクーシュN.O.
サイカルA.
ガーリーS.
ヤン・T.
ルウ・L.D.W.
ボロディT.J.
Leong R.W.
潰瘍性大腸炎に対する凍結乾燥経口糞便微生物移植(Lotus):無作為化二重盲検プラセボ対照試験。
Lancet Gastroenterol. Hepatol. 2022; 7: 141-151https://doi.org/10.1016/S2468-1253(21)00400-3
記事で見る
スコープス(54)
PubMed
要旨
全文
全文PDF
Google Scholar
シン・P.
アルム E.J.
ケリーJ.M.
チェン V.
スミス M.
カッサム Z.
ニー・J.
イトゥリノJ.
Lembo A.
IBS-Dにおける糞便微生物叢移植(FMT)後の細菌生着に対する抗生物質の前処理の影響。
Gut Microbes. 2022; 142020067https://doi.org/10.1080/19490976.2021.2020067
記事で見る
スコープス(11)
クロスフィルム
Google Scholar
キム J.H.
チェ Y.J.
Kwon H.J.
Jung K.
Kim S.E.
Moon W.
パク M.I.
Park S.J.
大腸内視鏡検査後の軽微な合併症に対する腸内細菌叢の影響。
Intest. Res. 2021; 19: 341-348https://doi.org/10.5217/ir.2020.00057
記事で見る
スコープス(3)
PubMed
クロスフィルム
グーグル奨学生
ヤランカ J.
サロネンA.
サロヤルヴィJ.
リタリJ.
イモネンO.
マルシアーニL.
ゴウランド P.
ホード C.
ガースド K.
ラムC.
ら。
腸内洗浄が腸内細菌叢に及ぼす影響。
Gut. 2015; 64: 1562-1568https://doi.org/10.1136/gutjnl-2014-307240
記事で見る
スコープス(154)
PubMed
クロスレフ
グーグル奨学生
Li M.
Xu R.
Li Y.Q.
過敏性腸症候群の治療における下剤・プロバイオティクスの連続使用:マイクロバイオームの数理モデルから着想を得た新しい方法。
Sci. Rep. 2020; 1019291https://doi.org/10.1038/s41598-020-75225-z
記事で見る
スコープ(2)
クロスフィルム
グーグル・スカラー
フィッシャー・M.
サイプB.W.
ロジャースN.A.
クックG.K.
ロブB.W.
ヴッパランチR.
Rex D.K.
重症合併症性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植とバンコマイシンの選択的使用:高い成功率を示したプロトコルの記述。
Aliment. Pharmacol. Ther. 2015; 42: 470-476https://doi.org/10.1111/apt.13290
記事で見る
スコープス(124)
パブコメ
クロスフィルム
グーグル奨学生
ソン Y.N.
ヤン D.Y.
ヴェルドゥイゼン・ファン・ザンテンS.
ウォン・K.
マッカーサーE.
ソング・C.Z.
イアニーロ G.
カマロタG.
ケリー C.
フィッシャーM.
他。
重症または劇症型Clostridioides difficile感染症に対する糞便微生物移植:系統的レビューとメタ分析。
J. Can. Assoc. Gastroenterol. 2022; 5 (e1-e11)https://doi.org/10.1093/jcag/gwab023
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
魏 Z.J.
Dong H.B.
Ren Y.T.
Jiang B.
活動性潰瘍性大腸炎の寛解導入に対する糞便微生物移植の有効性と安全性:ランダム化比較試験の系統的レビューとメタアナリシス。
Ann. Transl. Med. 2022; 10802https://doi.org/10.21037/atm-22-3236
記事で見る
クロスレフ
グーグルスカラー
スード A.
マハジャンR.
シンA.
ミダ V.
メータV.
ナラン V.
シン T.
シン・パンヌ・A.
潰瘍性大腸炎患者における寛解維持のための糞便微生物移植の役割: パイロットスタディ。
J. Crohns Colitis. 2019; 13: 1311-1317https://doi.org/10.1093/ecco-jcc/jjz060
記事で見る
スコープス(84)
パブコメ
Crossref
グーグル奨学生
ケディア S.
ヴィルマニ S.
K Vuyyuru S.
クマールP.
カンテB.
サフ P.
カウシャル K.
ファルーキー M.
シン M.
ヴェルマM.
et al.
抗炎症食を併用した糞便微生物叢移植(FMT-AID)と抗炎症食のみの併用は、軽度から中等度の潰瘍性大腸炎における1年以上の寛解導入と維持に有効である:無作為化比較試験。
Gut. 2022; 71: 2401-2413https://doi.org/10.1136/gutjnl-2022-327811
記事で見る
スコープス(19)
PubMed
クロスフィルム
グーグル奨学生
ウィルソンB.C.
ヴァタネンT.
ジャヤシンゲT.N.
レオン・K.S.W.
デライクJ.G.B.
アルバートB.B.
キアバローリV.
スヴィルスキス D.M.
ベック K.L.
コンロンC.A.
他
肥満に対するマルチドナー糞便微生物叢移植試験における菌株の生着競争と機能増強。
Microbiome. 2021; 9107https://doi.org/10.1186/s40168-021-01060-7
記事で見る
スコープス(27)
クロスフィルム
Google Scholar
ヴォーンB.P.
フィッシャー・M.
ケリーC.R.
アレグレットティJ.R.(Allegretti J.R.
グレイジガーC.
トーマス J.
マクルーア E.
カベージ A.J.
Khoruts A.
再発性Clostridioides difficile感染症に対する大腸およびカプセル糞便微生物移植の有効性と安全性。
Clin. Gastroenterol. Hepatol. 2022;https://doi.org/10.1016/j.cgh.2022.09.008
記事で見る
スコープス (0)
要旨
全文
全文PDF
Google Scholar
ゾル J.
リードM.N.
ヘイウッドS.E.
エステベスE.
マーシャルJ.P.S.
カンムーンH.L.
アレンT.L.
ホームズ A.J.
フェブラリオM.A.
ヘンストリッジ D.C.
高カロリー食ドナーの糞便微生物叢移植は、レシピエントマウスのグルコース代謝を、脂肪率や運動状態とは無関係に変化させる。
Am. J.Physiol.Endocrinol.Metab.誌。Metab. 2020; 319 (E203–E216)https://doi.org/10.1152/ajpendo.00037.2020
記事で見る
パブコメ
クロスフィルム
グーグル奨学生
ペレス=マトゥート P.
Íñiguez M.
デトロM.
レシオ-フェルナンデスE.
オテオ J.A.
肥満マウスの体重および脂肪率に対するカロリー制限効果を増強する痩せた状態からの自家糞便移植。
Sci. Rep. 2020; 109388https://doi.org/10.1038/s41598-020-64961-x
記事で見る
スコープス(17)
PubMed
クロスフィルム
グーグル奨学生
リノット E.
ヤングスターI.
ヤスコルカ・ミールA.
ツァバンG.
ゼリチャH.
カプラン A.
ナイツ D.
トゥーヒー K.
ファバ F.
ショルツ M.U.
ら。
食事で調整された自家糞便微生物移植が体重増加に及ぼす影響。
Gastroenterology. 2021; 160: 158-173.e10https://doi.org/10.1053/j.gastro.2020.08.041
記事で見る
スコープス(66)
PubMed
要旨
全文
全文PDF
グーグル奨学生
サルバギリ・シャバットC.
スカルダフェリF.
ジッタンE.
ヒルシュ A.
メンテラ M.C.
ムスカ T.
コーエン N.A.
ロン Y.
フリス・イサコフ・N.
プフェッファーJ.
他
軽度から中等度の活動性潰瘍性大腸炎に対する新規の食事療法を用いた糞便移植の使用:CRAFT UC無作為化比較試験。
J. Crohns Colitis. 2022; 16: 369-378https://doi.org/10.1093/ecco-jcc/jjab165
記事で見る
スコープス(16)
PubMed
クロスフィルム
グーグル奨学生
チャン・Y.O.
リーS.H.
Choi J.J.
キムD.H.
チェ・ジェム(Choi J.M.
Kang M.J.
Oh Y.M.
パク Y.J.
シン Y.
Lee S.W.
糞便微生物移植と高繊維食は炎症とアポトーシスを抑制することにより肺気腫発症を抑制する。
Exp. Mol. Med. 2020; 52: 1128-1139https://doi.org/10.1038/s12276-020-0469-y
記事で見る
スコープス (28)
PubMed
クロスフィルム
グーグル奨学生
クーペン A.M.
アルメイダE.L.
アッタイエI.
ウィットヘスJ.J.
ランパネリ E.
マジャイト S.
ケンパー M.
レベルス J.H.M.
シンメルA.W.M.
ヘレマ H.
et al.
メタボリックシンドロームの被験者におけるインスリン感受性に対する便微生物移植と地中海食の併用効果。
Front. Microbiol. 2021; 12662159
記事で見る
スコープス(17)
パブコメ
クロスフィルム
グーグル奨学生
イアニーロG.
ティルグ H.
ガスバリーニ A.
腸内細菌叢の深部調節因子としての抗生物質:善と悪の間。
Gut. 2016; 65: 1906-1915https://doi.org/10.1136/GUTJNL-2016-312297
記事で見る
スコープス(0)
パブコメ
クロスフィルム
グーグル奨学生
高塚秀樹
岩崎貴久
岡本哲也
柿下英明
腸管移植片対宿主病:その機序と対処法.
Drugs. 2003; 63: 1-15https://doi.org/10.2165/00003495-200363010-00001
記事で見る
スコープス (28)
PubMed
クロスフィルム
グーグル奨学生
ゴパラクリシュナンV.
ドージアE.A.
グラバーM.S.
ノビックS.
フォード・M.
モアハウス C.
ウォーレナー P.
カセレス C.
ヘス S.
セルマンB.R.
他
糞便微生物叢移植後の細菌の移植は、投与頻度と準備用抗生物質レジメンの期間の両方に依存する。
Microorganisms. 2021; 91399https://doi.org/10.3390/MICROORGANISMS9071399
記事で見る
PubMed
クロスフィルム
グーグル奨学生
ソルディ S.
ヴァシレイアディスS.
ウジェリF.
カンパナーレ M.
モレッリL.
フォグリ M.V.
カランニ F.
グリマルディ M.
Gasbarrini A.
非便秘型過敏性腸症候群患者におけるRifaximinによる腸内細菌叢組成の変調:分子的アプローチ。
Clin. Exp. Gastroenterol. 2015; 8: 309-325https://doi.org/10.2147/CEG.S89999
記事で見る
スコープス(61)
パブコメ
Crossref
グーグル奨学生
イアニーロG.
ヴァレリオL.
マスッチL.
ペセーレ S.
ビボS.
クアランタG.
ポステラーロ B.
クーロ D.
サングイネッティ M.
ガスバリーニ A.
他。
再発性クロストリジウム・ディフィシル感染症患者における単回糞便微生物移植後の失敗の予測因子:3年間の単施設コホート研究からの結果。
Clin. Microbiol. Infect. 2017; 23 (337.e1–337.e3)https://doi.org/10.1016/J.CMI.2016.12.025
記事で見る
アブストラクト
全文
フルテキストPDF
グーグル・スカラー
ハイファー C.
サイカルA.
パラムソティR.
カアクーシュN.O.
レオンR.W.
ボロディT.J.
カーム M.A.
Paramsothy S.
潰瘍性大腸炎における糞便微生物移植の効果は、導入療法後の長期にわたって持続しない。
Gut. 2021; 70: 2210-2211https://doi.org/10.1136/gutjnl-2020-323581
記事で見る
スコープス(9)
PubMed
クロスフィルム
グーグル奨学生
ハンブリン・H.
グナラトネA.W.
クランシーA.
ピラリノスD.
ルブスクA.
ドーソン M.V.M.
ボロディ T.J.
抗生物質の前投与と糞便微生物移植の長期反復により、過敏性腸症候群患者の症状とQOLが改善した:観察的オーストラリア臨床経験。
Gastroenterol. Res. Pract. 2022; 2022 (6083896)https://doi.org/10.1155/2022/6083896
記事で見る
スコープス (0)
パブコメ
クロスフィルム
グーグル奨学生
シュトゥーベ A.
ヴィタルM.
グルナートP.
ピーパーD.H.(Pieper D.H.
シュタルマッハA.
活動性潰瘍性大腸炎に対する経口カプセルによる長期的なマルチドナー糞便微生物叢の移植。
J. Crohns Colitis. 2019; 13: 1480-1481https://doi.org/10.1093/ecco-jcc/jjz073
記事で見る
スコープス(11)
パブコメ
Crossref
グーグル奨学生
カールソン・ジュニア, P.E.
糞便微生物移植製品の規制に関する考察。
セルホストマイクロベ。2020; 27: 173-175https://doi.org/10.1016/j.chom.2020.01.018
記事で見る
スコープス(33)
PubMed
要旨
全文
全文PDF
Google Scholar
コールド F.
ブラウン・P.D.
ギュンターS.
ハルキアS.I.
ピーターセンA.M.
アルギブーリZ.
ハンセンL.H.
クリステンセンA.H.
マルチドナーFMTカプセルは、潰瘍性大腸炎患者の症状を改善し、治療中の糞便カルプロテクチンを減少させる-オープンラベルのパイロット試験。
Scand. J. Gastroenterol. 2019; 54: 289-296https://doi.org/10.1080/00365521.2019.1585939
記事で見る
スコープス(26)
パブコメ
クロスレフ
グーグル奨学生
ヤングスター I.
サウクJ.
ピンダーC.
ウィルソンR.G.
カプランJ.L.
スミスM.B.
アルム E.J.
ゲバース D.
ラッセル G.H.
Hohmann E.L.
再発性Clostridium difficile感染症に対する、非血縁ドナーからの凍結接種液を用いた糞便微生物叢移植:無作為化、非盲検、対照パイロット試験。
Clin. Infect. Dis. 2014; 58: 1515-1522https://doi.org/10.1093/cid/ciu135
記事で見る
スコープス (360)
パブコメ
クロスフィルム
グーグル奨学生
アスニカーF.
ベリーS.E.
バルデスA.M.
グエン・L.H.
ピッキーノG.
ドリュー D.A.
リーミング E.
ギブソンR.
ル・ロイC.
カティブ H.A.
他
1,098人の深い表現型から得られた、宿主の代謝および習慣的な食事とマイクロバイオームとの関連性。
Nat. Med. 2021; 27: 321-332https://doi.org/10.1038/s41591-020-01183-8
記事で見る
スコープス(255)
パブコメ
クロスフィルム
グーグル奨学生
ハザンS.
デイブS.
パポウティスA.J.
バローズB.D.
ボロディT.J.
次世代シーケンサーで特定された細菌生着の成功は、Clostridioides difficileに対する糞便微生物叢移植の成功を予測する。
Gastroenterology Res. 2021; 14: 304-309https://doi.org/10.14740/gr1434
記事で見る
パブコメ
Crossref
グーグル スカラー
秦 J.
Li R.
レイズJ.
アルムガムM.
バーグドルフ・K.S.
マニチャンC.
ニールセン T.
ポンズ N.
レヴェネス F.
Yamada T.
et al.
メタゲノム解析により確立されたヒト腸内細菌遺伝子カタログ。
Nature. 2010; 464: 59-65https://doi.org/10.1038/nature08821
記事で見る
スコープス (7510)
PubMed
クロスフィルム
グーグル奨学生
ラギエ J.C.
ケライフィアS.
アロウ M.T.
Ndongo S.
ディオーネN.
ユゴン P.
カプート A.
カドレF.
トラオレ S.I.
セック E.H.
他
カルチュロミクスによるヒト腸内細菌叢の未培養菌の培養。
Nat. Microbiol. 2016; 116203https://doi.org/10.1038/nmicrobiol.2016.203
記事で見る
スコープス(604)
パブコメ
クロスフィルム
グーグル奨学生
ハンデルスマンJ.
メタゲノミクス:ゲノミクスの未培養微生物への応用。
Microbiol. Mol. Biol. Rev. 2004; 68: 669-685
記事で見る
スコープス (1621)
PubMed
クロスフィルム
グーグル奨学生
クインスC.
ウォーカーA.W.
シンプソンJ.T.
ローマンN.J.
セガタ・N.
ショットガン・メタゲノミクス、サンプリングから解析まで。
Nat. Biotechnol. 2017; 35: 833-844https://doi.org/10.1038/nbt.3935
記事で見る
スコープス(725)
パブコメ
クロスレフ
グーグル奨学生
ベギーニ F.
マカイバーL.J.
ブランコ-ミゲスA.
デュボアL.
アスニカーF.
マハルジャンS.
メイリャン A.
マンギP.
ショルツM.
トーマスA.M.
他
bioBakery 3による多様な微生物群集の分類学的、機能的、菌株レベルのプロファイリングの統合。
eLife. 2021; 10 (e65088)https://doi.org/10.7554/eLife.65088
記事で見る
スコープス(282)
PubMed
クロスフィルム
グーグル奨学生
Huang Y.
シェトR.U.
Zhao S.
コーエンL.A.
ダバギK.
ムーディー T.
Sun Y.
リカウルトD.
リチャードソン M.
ベレス・コルテスF.
ら。
自動化と機械学習を利用したハイスループットな微生物培養学。
Nat. Biotechnol. 2023;https://doi.org/10.1038/s41587-023-01674-2
記事で見る
スコープス (0)
クロスフィルム
Google Scholar
パゾッリ E.
アスニカーF.
マナラ S.
ゾルフォ M.
カーチャーN.
アルマニーニ F.
ベギーニF.
マンギ P.
テット A.
ゲンシP.
et al.
年齢、地理、ライフスタイルを網羅するメタゲノムから15万以上のゲノムを抽出し、未踏のヒト微生物群の多様性を明らかにした。
Cell. 2019; 176: 649-662.e20https://doi.org/10.1016/j.cell.2019.01.001
記事で見る
スコープス(629)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ブランコ-ミゲス A.
ベギーニF.
クンボF.
マカイバーL.J.
トンプソン・K.N.
ゾルフォ・M.
マンギ P.
デュボアL.
ホアン・K.D.
トーマス A.M.
et al.
MetaPhlAn 4を用いた未特性種のメタゲノム分類学的プロファイリングの拡張と改善。
Nat. Biotechnol. 2023; 4https://doi.org/10.1038/s41587-023-01688-w
記事で見る
スコープ (1)
クロスフィルム
グーグル奨学生
Segata N.
菌株分解比較メタゲノミクスへの道。
mSystems. 2018; 3 (e00190–e00117)https://doi.org/10.1128/mSystems.00190-17
記事で見る
スコープス(69)
パブコメ
クロスレフ
グーグル奨学生
ヴァン・ロッサムT.
フェレッティP.
マイストレンコ O.M.
ボーク P.
種内の多様性:マイクロバイオームにおける菌株の解釈。
Nat. Rev. Microbiol. 2020; 18: 491-506https://doi.org/10.1038/s41579-020-0368-1
記事で見る
スコープス (115)
PubMed
クロスフィルム
グーグル奨学生
フェレッティ P.
パゾッリE.
テットA.
アスニカーF.
ゴルファーV.
フェディ S.
アルマニーニF.
チュオンD.T.
マナラ S.
ゾルフォM.
他
母親から乳児への異なる身体部位からの微生物伝播は、発達中の乳児の腸内細菌叢を形成する。
セルホストマイクロベ。2018; 24: 133-145.e5https://doi.org/10.1016/j.chom.2018.06.005
記事で見る
スコープス(540)
PubMed
概要
全文
全文PDF
Google Scholar
バジェス-コロマーM.
ブランコ-ミゲス A.
マンギP.
アスニカーF.
デュボアL.
ゴルザートD.
アルマニーニF.
クンボF.
ホアン・K.D.
マナラ S.
他
腸内細菌と口腔内細菌の人から人への感染風景。
Nature. 2023; 614: 125-135https://doi.org/10.1038/s41586-022-05620-1
記事で見る
スコープス (7)
PubMed
クロスフィルム
グーグル奨学生
ヴァンデプッテD.
カタゲンG.
D'hoe K.
ヴィエイラ=シルヴァ S.
バジェス-コロマーM.
サビーノ J.
ワン・J.
ティト R.Y.
デ・コマールL.
ダージ Y.
ら。
定量的マイクロバイオームプロファイリングにより、腸内コミュニティの変動と微生物負荷が関連付けられた。
Nature. 2017; 551: 507-511https://doi.org/10.1038/nature24460
記事で見る
スコープス(519)
パブコメ
クロスフィルム
グーグル奨学生
キム S.
コビントンA.
パマー E.G.
腸内細菌叢:抗生物質、コロニー形成抵抗性、腸内病原体。
Immunol. レヴュー 2017; 279: 90-105
記事で見る
スコープス(354)
パブコメ
クロスフィルム
グーグル奨学生
クロザーズJ.W.
チュー・N.D.
グエン・L.T.T.
フィリップス M.
コリンズC.
フォートナー K.
デル・リオ=ゲラ R.
ラヴォア B.
カラス P.
ベレスM.
et al.
潰瘍性大腸炎における長期維持療法のための毎日経口するFMT:単一施設、前向き、無作為化パイロット試験の結果。
BMC Gastroenterol. 2021; 21: 281https://doi.org/10.1186/s12876-021-01856-9
記事で見る
スコープス(33)
パブコメ
クロスフィルム
グーグル奨学生
カゼミアンN.
ラメザンクハニM.
セガールA.
カリードF.M.
カルクホランA.H.Z.
ナラヤンA.
ウォン・G.K.
カオ・D.
パクプール S.
ドナーとレシピエントの腸内細菌叢の王国を超えた戦いが糞便微生物移植の結果に影響する。
Sci. Rep. 2020; 10: 18349https://doi.org/10.1038/s41598-020-75162-x
記事で見る
スコープス(15)
パブコメ
クロスフィルム
グーグル奨学生
シャオ Y.
アングーロ M.T.
ラオ・S.
ワイス・S.T.
Liu Y.Y.
糞便微生物移植の有効性を理解するための生態学的枠組み。
Nat. Commun. 2020; 11: 3329https://doi.org/10.1038/s41467-020-17180-x
記事で見る
スコープス (36)
パブコメ
クロスフィルム
グーグル奨学生
Zou M.
Jie Z.
Cui B.
Wang H.
Feng Q.
Zou Y.
Zhang X.
ヤン・エイチ
Wang J.
Zhang F.
ら。
炎症性腸疾患患者における糞便微生物叢移植の結果、細菌株が置換される。
FEBS Open Bio. 2020; 10: 41-55
記事で見る
スコープス(12)
PubMed
クロスフィルム
グーグル奨学生
トーマス A.M.
セガタ・N.
マイクロバイオーム研究における未知なるものの複数のレベル。
BMC Biol. 2019; 17: 48https://doi.org/10.1186/s12915-019-0667-z
記事で見る
スコープス(63)
パブメド
クロスレフ
グーグル奨学生
ターベール E.M.
ファン・ボアデンY.H.
Goorhuis A.
シーガーズ J.F.M.L.
バウアー M.P.
ヴァン・ヌード E.
ダイクグラーフ M.G.W.
マルダー C.J.J.
バンデンブルーケ・グラウルス C.M.J.E.
ヴァースパゲットH.W.
他
How to:便バンクの設立と運営。
Clin. Microbiol. Infect. 2017; 23: 924-930https://doi.org/10.1016/j.cmi.2017.05.015
記事で見る
スコープス(108)
PubMed
概要
全文
全文PDF
Google Scholar
ヘン M.R.
オブライエンE.J.
ディアオ・L.
フィーガン B.G.
サンドボーンW.J.
ハッテンハワーC.
ウォートマンJ.R.
マクガバンB.H.
ワン-ヴァイガンドS.
リヒターD.I.
et al.
胞子性マイクロバイオーム治療薬SER-287の活動性軽度~中等度潰瘍性大腸炎を対象とした第1b相安全性試験。
Gastroenterology. 2021; 160: 115-127.e30https://doi.org/10.1053/j.gastro.2020.07.048
記事で見る
スコープス(33)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
記事情報
識別情報
DOI: https://doi.org/10.1016/j.chom.2023.03.020
著作権について
© 2023 Elsevier Inc.
サイエンスディレクト
ScienceDirectでこの記事にアクセスする
図
図1FMTの成功に影響を与える要因
図2FMTおよびFMT後の微生物由来の治療法に関する文化的シフトと将来の洞察
表
表1各国における糞便微生物叢移植の分類
表2FMTの微生物学的および臨床的有効性に及ぼす作業プロトコルの異なるステップの影響
関連記事
本サイトのコンテンツは、あらゆる分野の医療従事者や研究者を対象としています。
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノミクス
細胞宿主と微生物
細胞代謝
セルレポート
セルレポートメディスン
セルレポートメソッド
セルレポートフィジカルサイエンス
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
イミュニティ
iScience(アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STAR プロトコル
構造
トレンドレビュー誌
生物化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
エコロジー&エボリューション
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理学雑誌
生物物理学レポート
EBioMedicine
HGGアドバンス
モレキュラープラント
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleus Collections
スナップショット・アーカイブ
ジャーナルを越えて
Cellキャリアネットワーク
セルメンター
細胞シンポジューム
ラボリンク
ウェビナー
記事を進化させる
コミュニティレビュー
Figure360
スニークピーク
STARメソッド
サイエンス・イン・ソサイエティ
セル画展
セルプレスポッドキャスト
セルプレスビデオ
ぬりえ・コミック
リサーチアーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版物アラート
アクセス
購読する
今すぐ読む
図書館に薦める
INFORMATION
広告主様向け
採用担当者様へ
図書館員の方へ
ご利用条件
個人情報保護方針
アクセシビリティ
当社は、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を変更するには、本サイトのクッキー設定にアクセスしてください。
著作権 © 2023 Elsevier Inc.ただし、第三者が提供する一部のコンテンツを除く。
この記事が気に入ったらサポートをしてみませんか?
