腸脳軸を介したフラボノイドと腸内細菌叢の神経調節作用
288総閲覧数
5ダウンロード
記事のインパクトを見る
レビュー記事
Front. Cell. Infect. 微生物学、2023年6月23日
Sec.腸管外マイクロバイオーム
第13巻-2023年|https://doi.org/10.3389/fcimb.2023.1197646
腸脳軸を介したフラボノイドと腸内細菌叢の神経調節作用


Haoran Wang1,2†, Tingting Zhao1,2†, Zhenjiang Liu3, Danzengquzhen1, Cisangzhuoma1, Jinying Ma1, Xin Li2, Xiaodan Huang2* and Bin Li1*.
1チベット農業畜産科学院畜産獣医研究所、農業農村部チベット高原動物遺伝育種重点実験室、中国ラサ市
2中国甘粛省蘭州市蘭州大学公衆衛生学院
3中国・長春市吉林大学生命科学学院エイズワクチン国家工程実験室
最近の研究から、フラボノイドを食事から摂取することで、様々な直接的・間接的なメカニズムを通じて神経保護効果が得られる可能性があることが示されている。数多くのフラボノイドがBBBを通過し、中枢神経系(CNS)内に蓄積することが示されている。これらの化合物の中には、活性酸素の蓄積や有害な影響に対抗し、神経炎症反応や酸化ストレス反応を抑制することで神経細胞の生存と増殖を促進するとされるものもある。さらに、いくつかの研究から、腸内細菌叢が生理活性代謝産物の産生と調節を通じて、脳機能と宿主行動の調節に関与している可能性が示唆されている。フラボノイドは、これらの神経保護代謝産物を産生する有益な細菌の増殖を促進する炭素基質として作用することで、腸内細菌叢の組成を形成し、その結果、潜在的な病原体と拮抗または抑制する可能性がある。このような選択プロセスを通じて微生物叢-腸-脳軸に影響を与えることにより、フラボノイドは間接的に脳の健康を改善する可能性がある。本総説では、生理活性フラボノイド、腸内細菌叢、腸脳軸の関係に関する研究の現状について検討する。
1 はじめに
腸の基本的な役割は、食物の消化と栄養吸収を促進することであり、これは重要な身体機能を維持するための代謝エネルギーを生み出すために必要である。ヒトやその他の動物の腸内環境には、腸内細菌叢と総称される微生物の複雑な生態系が存在する。ヒトの場合、腸内細菌叢は、腸内だけで1000種を超える細菌をはじめ、ウイルスやバクテリオファージ、真菌類、原生生物など、潜在的には何兆もの微生物から構成されている(Thursby and Juge, 2017)。ヒトにおいて支配的な細菌門には、ファーミキューテス、バクテロイデーテス、プロテオバクテリア、アクチノバクテリア、ベルコミクレビア、フソバクテリアが含まれることがよく知られており、中でもファーミキューテスとバクテロイデーテスが主要な種類である(Xiong et al.) 腸内細菌叢は、ヒトの生理機能に重要なビタミンやその他の代謝産物を豊富に産生することが知られており、このような有益な代謝産物を産生する微生物や、宿主の健康に有利に働くその他の微生物を、一般に「プロバイオティクス」と呼んでいる(Steinert et al.) 生理的条件下、すなわち健康な宿主のもとでは、腸内細菌叢の構成員はバランスのとれた、すなわち恒常的な増殖レベルで相互依存しており、腸粘膜とともに健康を維持し病原体を排除する天然のバリアとして機能していると考えられている(Flint et al.)
微生物叢の構造や組成が変化すると、腸の機能に大きな影響を与え、結果として宿主の健康に影響を及ぼす可能性がある。AlFalehらは、腸内細菌叢の組成と乳児期の未熟度との関連を報告している。未熟児は微生物プロファイルが未発達であることが多く、壊死性腸炎などの合併症を引き起こしやすいからである(AlFalehら、2012年)。さらに、腸内細菌叢の乱れは、肥満、糖尿病、アテローム性動脈硬化症、炎症性腸疾患などの一般的な健康問題に関連している(Matsuoka and Kanai, 2015; Blandino et al., 2016; Gérard, 2016; Jonsson and Bäckhed, 2017)。このような微生物叢のシフトが消化器系、神経系、呼吸器系、血管系の機能障害や疾患と関連している場合、このような微生物群集の変化は腸内細菌異常症とみなされる(Weiss and Hennet, 2017)。重要なのは、食事がさまざまな細菌分類群に強く影響したり、濃縮に寄与したりすることである(Bibbò et al.) さらに、異なる分類群の存在量に影響を及ぼすことで、食事介入は宿主や他の微生物に栄養素を供給する特定の代謝経路に関連する微生物遺伝子の存在や豊富さにも影響を及ぼす可能性がある。果物、野菜、全粒穀物から食物繊維を摂取すると、食物繊維関連細菌の存在量が増加し、その後発酵が促進されるため、代謝副産物として短鎖脂肪酸(SCFA)が生成され、宿主と腸内微生物の両方にとって重要なエネルギー源となることが観察されている(Cui et al.) 腸内細菌叢がヒトの健康に影響を及ぼすメカニズムには、腸管上皮バリアのバリア機能とBBBの透過性の調節に加えて、複合糖質の消化、腸における栄養吸収の調節、微生物代謝産物の分泌、ビタミンと神経伝達物質の産生が含まれる(Branisteら、2014;Tojoら、2014;Biesalski、2016;MorrisonとPreston、2016;Holscher、2017)。
腸内細菌叢の影響を受ける様々な宿主システムの中でも、腸内細菌叢が腸脳軸を通じて中枢神経系や脳の活動、さらには宿主の行動に影響を与えることを支持する証拠が増えている(Cryan et al.) 微生物生態の摂動が消化管における炎症カスケードと免疫反応を引き起こし、病原性または有害な腸内細菌叢プロファイルをもたらし、腸管バリアの完全性を破壊する可能性があることが研究で示された(Pickardら、2017;Serraら、2019)。血清TNF-α、IL-6、IL-1βを含む炎症性サイトカインの蓄積は、BBBを損ない、神経細胞集団を減少させ、その後の神経炎症につながる全身性の炎症反応を引き起こし、累積的に認知障害を引き起こす(Quigley, 2017)。さらに、これまでの研究で、腸内細菌叢は神経、神経内分泌、免疫のシグナル伝達経路を通じてCNSと相互作用し、様々な代謝産物に加えて、迷走神経、神経伝達物質、脳の神経栄養因子が関与している可能性が示されている(Socała et al.) さらに、新たな研究により、腸内細菌叢が神経活性代謝産物を合成し、それがセロトニン作動性、ノルアドレナリン作動性、ドーパミン作動性、グルタミン酸作動性、またはGABA作動性神経伝達活性を変化させ、ひいては脳や中枢神経系機能に影響を及ぼすことが明らかになっている(Rutsch et al.) さらに、微生物の代謝産物は、ミクログリアによって媒介される炎症反応の有力な制御因子として浮上しており、それによって感染や傷害に対する宿主の反応に寄与している(Wang et al.) CNS免疫系の最初の応答者であるミクログリアは、炎症刺激に応答して活性化され、CNSの恒常性を維持するための防御機構として機能するが、このミクログリアの活性化が調節不全になると、神経炎症の一因となる毒性因子が放出され、アルツハイマー病(AD)、パーキンソン病(PD)、多発性硬化症など、さまざまな神経疾患の発症につながる可能性がある(Hoogland et al.) 腸内細菌叢はまた、血流中のサイトカインを通じてCNSと相互作用し、特に視床下部正中隆起や脳室周囲臓器などのBBBを欠く界面や、BBBが病的に損傷した部位で、CNSの細胞と相互作用する可能性がある(El Aidy et al.) 腸-脳軸における恒常性の喪失は、神経疾患や神経変性疾患との関連が報告されている(Zhuら、2017)。しかしながら、腸内微生物の恒常性は、食事の変更、および/またはプロバイオティクスおよび/またはプレバイオティクスの補充によって回復する可能性がある。特に、フラボノイドのような植物由来の生理活性天然物分子は、微生物叢組成を標的とする治療薬の有望な手段となる可能性があり、最近の研究では、いくつかのフラボノイドが、微生物叢組成の変化を特徴とする神経変性疾患における脳機能の低下を緩和する可能性があることが示されている(Kawabata et al.)
2 フラボノイド
フラボノイドは植物や細菌によって合成される二次代謝産物の天然物である。果物、野菜、お茶に豊富に含まれ、特に柑橘類にはヘスペリジンやナリンギンなどのフラボノイド化合物が皮や果肉全体に豊富に分布している(Wang et al.) これらの低分子ポリフェノールは、ヒドロキシル基を持つ一対のベンゼン環(A環とB環)を3つの炭素でつないだものである(Panche et al.) A環とB環のフェニル環に加えて、フラボノイドは酸素を含む複素環C環を持つこともある。フラボノイドは驚くほど多様な化合物の一種であり、現在までに10,000種類以上のフラボノイドが同定されている(Giusti et al.) ヒトの食事に含まれるフラボノイドは、3炭素結合の酸化度とB環の連結部位の違いから、6つのクラスに分類できる。これらのクラスには、フラボン、フラボノール、フラバノン、イソフラボン、フラバン-3-オール、アントシアニンが含まれる(Baky et al., 2022)。
2.1 生物学的機能
フラボノイドの生物学的効果は多面的である。植物では、フラボノイドは主に天然色素、発生調節物質、病原体に対する防御物質として機能する(Samanta et al.) さらにフラボノイドは、活性酸素(ROS)(Agati et al., 2012)や紫外線(Agati et al., 2013)によるダメージから植物を保護する役割を果たすことが示されている。動物にはフラボノイド生合成経路がないため、植物やバクテリアからフラボノイドを摂取しなければならない(Koes et al.) フラボノイドの化学構造には明確な特性があるため、これらの分子は動物の健康を促進する幅広い生物学的活性を示すことができる。フラボノイドの効果として報告されているものには、抗酸化作用、抗菌作用、抗炎症作用、抗ウイルス作用、抗がん作用、抗老化作用のほか、肝機能や心血管系機能の保護作用、フリーラジカル除去作用、免疫反応の亢進などがある(Bootsら、2008;Agatiら、2012;Farhadiら、2019)。さらに、フラボノイドが細胞の変性や老化を緩和し、神経保護効果を発揮する可能性も、重要な研究対象として注目されている(Badshahら、2021年)。特に、体内のフリーラジカルを消去するフラボノイドの強力な抗酸化作用が注目され、いくつかの治療効果が抗酸化作用と密接に関連している(Amić et al., 2007)。例えば、確立されたADのラットモデルにおいて、合成イソフラボノイドであるイプリフラボンは、神経保護作用において顕著な有効性を示したが、これは主にこの化合物の強力な抗炎症作用と抗酸化作用に起因しており、炎症プロセスを緩和し、酸化ストレスに対抗することを可能にしている(Hafez et al.)
2.2 フラボノイドの吸収と代謝
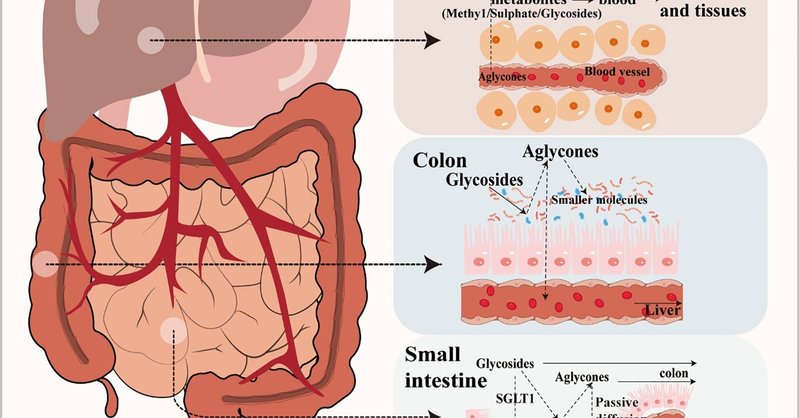
フラボノイドは、グリコシドとアグリコンの2つの主要な形態で発見されることが多い(Xiao, 2017)。フラボノイドアグリコンまたはフリーフォームフラボノイドとも呼ばれるアグリコンは、注目すべき生物学的利用能を有し、高い疎水性とコンパクトな分子構造を示し、消化管上皮細胞膜を通過する受動拡散による効率的な吸収を促進する(図1)。しかしながら、フラボノイドの大部分は、ヒドロキシル化、メチル化、アシル化、グリコシル化などの異なる修飾形態で存在し、中でもグリコシル化は最も一般的な修飾形態である(Xiao, 2017)。さらに、β-グリコシドはイソフラボンが植物中で天然に存在する主要な形態である(Ismail and Hayes, 2005)。摂取後、アグリコン型への加水分解のみが、ヒトにおけるフラボノイドの吸収を促進することができる(Chenら、2022)。例えば、腸内のβ-グルクロニダーゼによるバイカリンのアグリコン型バイカレインへの変換は、バイカリンの吸収に重要な役割を果たし、その取り込みとその後の薬理作用を促進する極めて重要な代謝過程である (Kang et al., 2014)。一般に、フラボノイド配糖体は胃では加水分解を受けず、小腸でラクターゼ・フロリジン・ヒドロラーゼやグルコシダーゼなどの特定の加水分解酵素の基質となる。あるいは、フラボノイド配糖体は、ナトリウム依存性グルコース共輸送体によって腸細胞に積極的に輸送され、そこで細胞質β-グルコシダーゼなどの細胞内酵素によってアグリコンに加水分解される(Oteiza et al.)
図1
図1 フラボノイドの代謝。
しかし、グルコシドは小腸で吸収される唯一のフラボノイド配糖体である(Chen et al.) この吸収の悪さにより、配糖体の大部分は大腸に到達するまで影響を受けずに消化管を通過し、そこで微生物の活動により他の中間体に変換される(Murota et al.) 多くの細菌種が、加水分解、還元、脱グリコシル化を通じてグルコシドを無機化することが判明している(Oteiza et al.) 具体的には、グルコシドは腸内細菌叢のグリコシダーゼによってアグリコンに酵素的に加水分解される(Dymarska et al.) 例えば、Bifidobaterium属とLactobacillus属は、フラボノイド配糖体をアグリコンとグルコースユニットに効果的に加水分解するβ-グルコシダーゼを産生し、α-L-ラムノシダーゼは、様々なLactobacillus acidophilus、Lactobacillus plantarum、Bifidobacterium dentium株由来のフラボノイドの脱グリコシル化に重要な役割を果たしている(Braune and Blaut, 2016)。ヒトの腸内には他にも、エステラーゼ、グリコシダーゼ、芳香族ヒドロキシラーゼなど、フラボノイド配糖体を低分子に変換できる酵素系が多数存在する(Nicholson and Wilson, 2003)。例えば、アントシアニンやフラボノールはC環の開裂によってプロトカテク酸やそれに付随する副生成物に変換され、アントシアニンはフラボノールから2-(2, 4, 6-トリヒドロキシフェニル)酢酸や2-(3, 4-ジヒドロキシ)-フェニル酢酸に変換される(Wang et al., 2020)。この酵素代謝により、腸内細菌叢はフラボノイドを多種多様なグリコシド、グルクロニド、硫酸塩、アミド、エステルまたはラクトン代謝物に変換することができ、これらは生物学的に利用可能で宿主によって容易に利用される(Williamson and Clifford, 2017)。フラボノイドの生物学的に活性な代謝物もまた、強力な生物学的効果を有する可能性がある。フェノール酸代謝物は、血糖値を低下させ、抗炎症作用や神経保護作用をもたらすことが報告されている(Verzelloniら、2011年)。フラボノイドは多くの場合、複数の微生物群が関与する協調的な段階を経て代謝されることに留意すべきである(Santangelo et al.) これらのプロセスは腸内細菌叢の組成に大きく依存し、健康な腸内微生物群では、宿主の健康にプラスの影響を与えると報告されている多数のペプチドグリカン、二次胆汁酸、SCFAの産生につながる(Hervert-Hernández and Goñi, 2011)。
吸収後、フラボノイドは血流に入り、アルブミンと結合して肝臓に輸送・蓄積される(Rechner et al.) 肝臓でフラボノイドは、グルクロン酸との抱合、硫酸化、メチル化、酸化など、さまざまな反応によって修飾される。その後、修飾されたフラボノイドは再び循環に乗り、全身の組織に運ばれ、そこで生物学的効果を発揮する(Chenら、2022年)。腸内細菌叢による異化と肝酵素による変換を経て、フラボノイドは宿主動物の活性二次代謝物となる。したがって、元のフラボノイド分子と生物学的に活性な誘導体代謝物の両方が、同時に体内に存在することになる(Ozdal et al.) 例えば、ある研究では、アントシアニンの生物学的活性は、前駆体であるアントシアニンと同様に、腸内細菌叢によって産生される代謝物の特性を反映していることが報告されている(Hidalgo et al.) フラボノイドはまた、腸内細菌叢の量や種類を調節することによって腸内疾患を制御することが実証されており、これはフラボノイド自身の分解代謝や生物学的利用に間接的に影響を与える可能性がある(Kawabata et al.)
3 フラボノイドの神経調節作用
フラボノイドが、神経炎症の抑制、酸化ストレスの軽減、神経新生の刺激、神経細胞再生の活性化などの潜在的な機能を有することは、動物モデルにおける多くのエビデンスによって裏付けられている(Lee et al., 2016; Jaeger et al.) いくつかの研究は、フラボノイドがいくつかの様々なメカニズムを通じて神経系を保護できることを示している。例えば、ある種のフラボノイドはBBBを透過し、酸化ストレスの抑制、炎症反応の抑制、神経細胞代謝の調節、神経細胞再生の促進といった直接的な神経保護作用をもたらすことができる(図2)。これらの直接的な活性に加えて、フラボノイドは腸脳軸の機能に影響を及ぼす腸内細菌叢の組成や代謝産物を調節することによって、間接的に神経系を保護することができることを示唆する研究もある(Dey, 2019; Josiah et al.)
図2
図2 フラボノイドの神経調節作用
3.1 フラボノイドの直接的な神経調節作用
ヒトの脳の海馬と前頭前野では、酸化ストレスがコリン作動性ニューロンの喪失とコリン作動性神経伝達物質のレベル低下をもたらす変化を誘発し、それらが相まって学習と記憶機能の障害の一因となる(Floyd and Hensley, 2002)。さらに、炎症は中枢神経系のいくつかの疾患の病因や発症に関与していることがよく知られている(Troubatら、2021年)。最近のある研究では、フラボノイドが酸化ストレスを減衰させ、神経炎症を緩和することによって神経保護効果を発揮し、その結果、シナプス形成と神経新生を促進し、神経変性に伴う認知・記憶障害を改善することが示された(Gildawie et al.) 同様に、BBBを通過できる抗炎症薬や抗酸化フラボノイドを投与することで、脳の機能障害を直接治療する介入が可能になるかもしれない(Dey, 2019)。しかしながら、BBB透過性はフラボノイドによって大きく異なる。特に、低分子量で脂溶性のフラボノイドは、BBBを通過してCNSに入る能力が高い可能性がある(Youdimら、2003年)。例えば、ヘスペリジン、ナリンゲニン、ネオヘスペリジンなどのフラバノン類がBBBを効果的に通過することは、広範な研究によって証明されている(Hwang and Yen, 2008)。さらに、二次代謝産物のフラボノイド誘導体は、BBBを通過するバイオアベイラビリティと輸送性が比較的高い。例えば、フラボノイドのサブクラスであるフラバン-3-オールは、消化管での吸収が限られており、腸内細菌叢によって実質的な構造変化が起こることが知られている。一方、F3Osの特定の誘導体である5-(ヒドロキシフェニル)-γ-バレロラクトン-O-硫酸塩は、in vitroおよびin vivoの両方でBBBを効果的に通過することができる(Del Rioら、2010;Angelinoら、2019)。BBBを通過する能力は、CNS内で薬理作用を発揮するフラバノンの可能性を強調している。
さらに、フラボノイドは、酸化ストレスや炎症性免疫反応の病的なアップレギュレーションに関連するさまざまな経路を制御することによって、神経保護効果を発揮することが示されている。例えば、抗酸化性、抗炎症性フラボンであるクリシンは、iNOSやCOX-2などの炎症性遺伝子の発現に対して強力な抑制効果を発揮し、その結果、NF-κBシグナル伝達がダウンレギュレーションされ、その結果、神経毒性の悪影響を緩和する、重要な神経保護特性を示す(Camposら、2022)。また、ケルセチンがNF-κBシグナル伝達を制御し、それによって神経炎症反応を調節する可能性も示されている(Leeら、2020)。さらに、ケルセチンはKeap1/Nrf2シグナルを効率的に活性化することも示されており、これは活性酸素の発生を緩和し、保護作用をもたらすことが知られている。抗酸化作用に加えて、ケルセチンはBBBコネキシンの発現を増強し、BBBの完全性を維持することも確認されている(Liら、2021年)。フラボノイドの中には、脳内のグリアに関連した炎症反応をブロックするものも知られており、グリア細胞の活性化を抑制し、それに伴う炎症プロセスを緩和する顕著な可能性を示している(Spencerら、2012年)。
フラボノイド治療は、認知機能の増強において有望な効果を示したと報告されている(Devoreら、2012;Godosら、2020)。例えば、トロポフラビンとしても知られる7,8-ジヒドロキシフラボン(7,8-DHF)を5mg/kg/日の用量で投与すると、トロポミオシン受容体キナーゼB(TrkB)経路が活性化され、それによって樹状突起の分岐が促進され、神経細胞の生存が促進され、ADモデルマウスにおける皮質ニューロンのシナプス生成が誘導されることが実証されている(Zhang et al.) さらに、ある種のフラボノイドは神経細胞の受容体活性を直接調節することが証明されており、認知機能増強作用の潜在的なメカニズムが示唆されている(Gravandi et al.) 例えば、7,8-DHFは脳由来神経栄養因子(BDNF)を模倣するTrkBアゴニストとして作用することができ、BBBを透過してTrkBと強く結合し、その結果、自己リン酸化と二量体化が起こり、さらなるシグナル伝達カスケードが活性化されることが示されている(García-Díaz Barriga et al.)
3.2 腸内微生物の調節を介したフラボノイドの神経調節に対する間接的効果
フラボノイドは、重要な神経保護および神経回復特性を有することが示されている(Hafez et al.) 研究によると、フラボノイドは血流中の濃度と比較して、より高いレベルで検出され、消化管に長く存在することが示されている(Stalmach et al.) さらに、フラボノイドはヒトの体内で広範な修飾を受けるため、生物学的活性や抗酸化効果に影響を及ぼす可能性がある(Chenら、2022年)。したがって、腸内細菌叢や腸脳軸の調節など、フラボノイドの間接的な作用は、中枢神経系への直接的な作用よりも強い影響を及ぼす可能性がある。
3.2.1 健康全般に影響を及ぼす腸内細菌叢の調整
フラボノイドは腸管に入ると微生物による分解を受け、腸内細菌叢を制御する。研究により、フラボノイドは特定の細菌分類群の増殖を制御し、腸内細菌叢の構造と機能を再構築し、ヒトの健康に幅広く貢献することが実証されている(Xiong et al.) 具体的には、フラボノイドは、病原性を持つ可能性のある細菌群(大腸菌や黄色ブドウ球菌など)の細胞膜を破壊したり、膜透過性を変化させたりすることで、その増殖や腸内定着を阻害し、最終的に病原性を低下させることができる(Xie et al.) さらにフラボノイドは、ビフィズス菌や乳酸菌などの有益な細菌の代謝基質として機能し、それらの増殖と成長を促進し、腸だけでなく脳や肝臓などの臓器の健康にとっても重要な、安定した有益な腸内コミュニティを確保する(Farhadi et al.) これらのメカニズムを通じて、フラボノイドは微生物叢-腸-脳軸を調節することにより、中枢神経系に間接的な作用を及ぼす能力を有している(Zhangら、2023)。例えば、綿密なin vivo研究により、ルイスラットの腸内細菌叢の複雑なバランスに対するヘスペリジンの顕著な影響が明らかになった。具体的には、ヘスペリジンの投与により、乳酸桿菌/腸球菌比の大幅な増加が誘導され、同時にクロストリジウム・コッコイデス/ユバクテリウム・レクタール比の有意な減少が誘発されることが判明した(Estruel-Amadesら、2019)。さらに、バイカリン処理は、ストレプトコッカス属やビフィドバクテリウム属の存在量を増加させると同時に、大腸菌や黄色ブドウ球菌などの有害細菌の数を減少させることが示されている(Wu et al.) さらに、フラボノイドはプレバイオティクスとして働き、腸内細菌叢の構造と多様性を調節し、腸バリアを回復・強化し、適切な免疫応答を確保することで腸機能を改善する可能性がある(Murota et al.) 実際、腸内細菌叢の変化は、フラボノイドの変換能力に大きな影響を与え、ひいては腸内細菌叢の組成と豊富さを調節する可能性がある。様々なフラボノイド代謝産物による腸内細菌叢の制御には複雑なメカニズムが関与しており、まだ完全には解明されていない(Larkin et al.) したがって、フラボノイド代謝産物が腸内細菌叢を制御する具体的なメカニズムや、ヒトの健康への影響を解明するためには、さらなる研究が必要である。さらに、フラボノイドの摂取は、SCFAの排泄、腸管免疫機能、その他の生理学的プロセスを活性化することにより、腸内細菌叢の安定性を改善する(Kawabata et al.)
3.2.2 フラボノイドによる神経伝達物質の調節
宿主の健康に役立つ細菌を選択することで、フラボノイドはSCFA、γ-アミノ酪酸(GABA)、BDNFなどの様々な代謝産物の産生も刺激することができる。これらの代謝物のいくつかは、生物学的に神経伝達物質に変換される可能性がある(Jameson et al.) 例えば、ラクトバチルス属やビフィズス菌を含む特定のグラム陽性腸内細菌は、グルタミン酸を中枢神経系における主要な抑制性神経伝達物質であるGABAに変換することができる(Barrett et al.) 対照的に、Streptococcus属、Escherichia属、Enterococcus属は、トリプトファン代謝を通じてセロトニン(5-HT)を生成することができる(Lyte, 2011; Nzakizwanayo et al.) トリプトファン経路とチロシン経路は、どちらも神経伝達物質合成に不可欠である(Castro et al., 2015; Agus et al., 2018)。したがって、神経伝達物質や神経ペプチドを合成できる微生物は、これらの代謝産物のレベルを調節することによって、宿主の脳の活動や機能を調節することもできる(Cryan, 2012 乳酸菌、ビフィズス菌、腸球菌、連鎖球菌の種はすべて、脳との腸内コミュニケーションに直接関与するアセチルコリン、GABA、または5-HTを産生することが報告されている(Rutschら, 2020; Socałaら, 2021)。したがって、これらの神経活性代謝物を産生する細菌分類群を濃縮するフラボノイドは、脳と腸の双方向の相互作用に関与していると推測できる。
3.2.2.1 短鎖脂肪酸
SCFAsは遠位結腸の腸内細菌叢による非常に豊富な発酵産物であり、一般に炭素原子数1~6の飽和脂肪酸を含む。SCFAは局所的に作用し、腸管バリアの完全性を維持し、粘液産生を促進することにより、腸の健康を維持する。ほとんどのSCFAは、モノカルボン酸トランスポーターを用いて結腸細胞に取り込まれ、エネルギー基質として利用される(Dalile et al.) SCFAは、Gタンパク質共役受容体やヒストン脱アセチル化酵素と相互作用し、体液性、免疫性、またはその他の経路を通じて脳機能に影響を与え、特に炎症反応やホルモンシグナル伝達を調節することが報告されている(Tolhurst et al.) しかし、遊離脂肪酸は、腸内分泌細胞、迷走神経求心性神経、免疫細胞上の遊離脂肪酸受容体(FFAR)2およびFFAR3を介したシグナル伝達により、異なる生理学的システムに影響を及ぼす可能性がある(Cookら、2021年)。さらに、SCFAは迷走神経との相互作用を介してCNSに影響を及ぼすことが実証されている(Goswamiら、2018)。また、SCFAは循環系に入り、BBBを通過して脳に蓄積し、神経シグナル伝達や宿主の行動を間接的に調節することができる(Silvaら、2020)。さらにSCFAは、ミクログリアが介在する神経炎症とアミロイドβ(Aβ)タンパク質の沈着に影響を与えることで、神経疾患の治療効果が期待される。最近の研究では、SCFAはBBBに浸透し、NF-κB活性やリポ多糖誘発シグナル伝達を阻害することで、刺激されたミクログリアの炎症反応を抑制できることが実証されている(Caetano-Silvaら、2023年)。さらに、最近の研究では、SCFAがβアミロイドの産生を阻害し、ADの病態生理に寄与する可能性が示された(Hoら、2018)。フラボノイドは、腸内細菌叢、特にプロピオン酸、酪酸、酢酸を形成する作用を通じて、SCFA産生を促進することが提唱されている。例えば、バイカリンは、酪酸産生Veillonellaceae、Akkermansia(プロピオン酸および酪酸を産生する)、またはBifidobacterium(酢酸および酪酸を産生する)などの細菌群を濃縮することにより、短鎖脂肪酸レベルを増加させることができる(Wu et al.) 同様に、ルチンが豊富な食事は、腸におけるプロピオン酸または酪酸の生合成を増加させる可能性がある(Riederら、2017年)。ヒドロキシサフローイエローAは、高脂肪食を与えたマウスにおいて、SCFAを産生するButyricimonasとAlloprevotellaの存在量を有意に増加させ、酢酸、プロピオン酸、酪酸の蓄積をもたらす(Liuら、2018)。このように、腸内細菌叢によって合成されるSCFAは、それ自体が生理学的効果を発揮すること、あるいはフラボノイドと併用することで相乗的な神経調節効果を発揮することが立証されている。
3.2.2.2 トリプトファン
トリプトファン経路は、腸内細菌叢の影響の有無にかかわらず、トリプトファンが5-HTやメラトニンなどの生理活性分子に変換される生合成経路である。特に、5-HTは豊富な腸関連伝達物質であり、腸上皮の腸内分泌(EC)細胞がヒトの体内に存在する全5-HTプールの90%~95%を生成し、トリプトファン水酸化酵素(TPH)が5-HT合成を制御している(Spohn and Mawe, 2017)。腸内細菌叢は、EC細胞を調節することにより、5-HTの産生と放出を制御する上で重要な役割を果たしている。観察された効果は、微生物実体による多数の代謝産物の合成に起因している。研究では、SCFAがEC細胞におけるTPHの発現に対して正の調節効果を発揮することが示されている。アップレギュレーションは、5-HTの合成と放出の増加につながる(Reigstadら、2015年)。フラボノイドは、様々なメカニズムでトリプトファン代謝を調節することが示されている。ケルセチンは、ラットの感染後過敏性腸症候群モデルにおいて、EC細胞の密度とTPHの発現を低下させることができる。その結果、ケルセチンは5-HTのレベルを低下させ、IBSラットの内臓痛症状を改善する(Qinら、2019年)。観察されたトリプトファン代謝に対するフラボノイドの影響は、腸内細菌叢とSCFAに対する調節作用に起因する可能性がある。
3.2.2.3 チロシン
チロシン代謝経路は、ドーパミン(DA)、ノルエピネフリン(NA)、アドレナリン(A)など、いくつかの神経伝達物質やホルモンの重要な生合成経路である。ヒトにおけるチロシン代謝の大部分は消化管内で起こる。チロシン代謝産物の中でも、DAは運動、情動、神経内分泌機能の制御において基本的な調節的役割を担っている。最近の研究で、DA代謝異常と神経変性、精神疾患との密接な関連が明らかになった(Xu and Yang, 2022)。対照的に、NAとAはともに自律神経系と内分泌系の調節に関与している。チロシン水酸化酵素(TH)は、チロシンからノルエピネフリンとドーパミンへの変換を触媒する重要な酵素である(Tekinら、2014)。フラボノイドは、いくつかの異なる経路を通じてチロシン代謝に影響を与える可能性がある。例えば、糖尿病性腎臓病において、アントシアニンの一種であるシアニジン-3-O-グルコシドを投与すると、マウスの血清チロシン代謝が有意に上昇した(Liら、2022年)。別の研究では、プレニル化フラボノール配糖体であるイカリインが、閉経期うつ病モデルラットの血清中の5-HTレベルとDAレベルの脳組織を増加させることがわかった(Caoら、2019)。さらに、PDのラットモデルにおいて、カテキンとケルセチンによる治療は、合成の減少(THの活性低下による)と異化の増加(モノアミン酸化酵素の活性上昇による)に起因するドーパミンレベルの低下を有意に緩和することが判明した(Josiahら、2022)。
3.2.2.4 γ-アミノ酪酸
GABAは、中枢神経系機能に不可欠な神経細胞の興奮抑制を担う主要な神経伝達物質である。GABAとの結合によるGABA A受容体の活性化は、睡眠を促進し、適切な中枢神経系機能の維持に寄与することが立証されている(Möhler, 2006)。さらに、GABA投与が神経細胞におけるAβの内在化を抑制し、高度糖化最終産物の受容体を介して作用することで、野生型マウスのAβによって誘導される細胞毒性を効果的に改善することが示された(Sun et al. (Sunら、2012)。フラボノイドがGABA神経伝達系に調節作用を及ぼす可能性を示す新たな証拠も出てきている。注目すべきは、Passiflora quadrangularis由来のフラボノイドが鎮静作用を示すという研究結果であり、この作用はGABA作動性経路を介して媒介されると考えられている(Gazola et al.) これらの知見は、GABAシグナル伝達に影響を与えることにより、リラックスと鎮静を促進するフラボノイドの役割の可能性を示唆している。さらに、他の研究では、食餌性フラボノイドのGABAシグナル伝達への直接的な影響を探求している。例えば、ケルセチンは、直接的な相互作用によって、あるいは関連するシグナル伝達経路を間接的に調節することによって、GABAタイプA受容体活性を低下させることが報告されている(Jung and Lee, 2014)。さらに、フラボノイドによる腸内のGABA産生菌の増殖と活性の促進は、GABA作動性神経伝達の調節と、神経学的・精神的健康への潜在的影響に有望な示唆を与える。例えば、食事性フラボノイドによって濃縮されることが知られている乳酸菌やビフィズス菌などの特定の腸内細菌が、GABAの産生を著しく増加させることが研究で実証されている(Barret et al. (Barrettら、2012;Pattersonら、2019)。まとめると、フラボノイドはGABA神経伝達系との相互作用を通じて、気分、認知、神経変性疾患にプラスの影響を与える可能性がある。
3.2.2.5 その他の神経伝達物質
フラボノイドの神経機能に対する有益な作用は、少なくとも部分的には、腸内細菌叢の構造に対する調節作用によって説明されるかもしれないし、生物活性代謝産物の生産における基質として機能するかもしれない。GABAによる調節に加え、ケルセチンはBDNFだけでなく神経成長因子(NGF)の宿主産生も刺激することが示された。これらはいずれもヒトCNSで活性を示すニューロトロフィンとしてよく研究されている(Skaper and Skaper, 2018)。BDNFとNGFは、シナプス可塑性と成体神経新生を制御する上で重要な役割を果たす。したがって、ケルセチンによるこれらの産生増加は、神経保護および/または神経栄養効果につながる(Mattson, 2008)。同様に、トランスフォーミング成長因子-β1(TGF-β1)経路に対するフラボノイドの効果も注目されている。TGF-β1はよく知られた抗炎症性サイトカインであり、神経栄養因子として作用し、中枢神経系レベルでのニューロン分化とシナプス可塑性の開始と維持に重要な役割を果たす。TGF-β1シグナル伝達の消失や欠損は、ADに関連する認知機能障害の一因であると考えられている(Caraci et al.、2015)。注目すべきは、フラボノイドの一種であるヘスペリジンが、TGF-β1シグナル伝達を調節し、CNS内でこの重要な調節因子の産生を増加させる能力を持つことである。この結果、認知障害のげっ歯類モデルとヒト被験者の両方で、認知機能が向上することが示されている(Matiasら、2017年)。これらの観察された効果から、フラボノイドが神経炎症に対抗し、神経系の機能と恒常性の維持に関与するさまざまな潜在的メカニズムが示唆される。
4 結論と今後の展望
いくつかのフラボノイドは、抗酸化作用や抗炎症作用を通じて神経保護作用をもたらすことが示されている。一部のフラボノイドはBBBを通過することが知られており、脳や末梢CNSにおける直接的な抗酸化作用や抗炎症作用、あるいは神経細胞活性の調節を介した神経保護作用が期待できる。さらに、フラボノイドは、フラボノイド基質から神経保護代謝産物を産生する有益な微生物を選択または濃縮することによって、腸脳軸を通じて間接的にヒトの中枢神経系に有益であることを示唆する証拠が豊富にある。
我々の知見によれば、フラボノイドは腸脳軸を調節することにより、中枢神経系に有益な作用を及ぼす。その作用機序としては、病原体の増殖を抑制する一方で有益な細菌の増殖を促進すること、微生物の多様性を増加させること、SCFAなどの有益な代謝産物の産生を刺激して全身の健康を維持することなどが考えられるが、これらに限定されるものではない。しかし、フラボノイドが腸内細菌叢を介して中枢神経系を調節するかどうかを調べた研究はほとんどない。フラボノイド、腸内細菌叢、中枢神経系間の相互作用の根底にあるメカニズムを解明し、神経疾患の治療におけるこの新規アプローチの可能性を探るために、さらなる研究が必要である。
著者貢献
構想、BLおよびXH。原稿執筆-原案作成、HW、TZ。原稿全体の修正、BL、XH、ZL、D、C、JM、XL。最終版の監修、査読、編集、BL、XH。すべての著者が論文に貢献し、提出された原稿を承認した。
資金提供
本研究は、チベット自治区地域共同イノベーション特別項目(QYXTZX-LS2021-01)およびチベット自治区重点研究開発プログラム(XZ202201ZY0004N; XZ202301ZY0018N)の支援を受けている。
謝辞
原稿作成にあたり、言語に関する助言と編集協力をいただいたIsaac V. Greenhut, ELSに感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Agati, G., Azzarello, E., Pollastri, S., Tattini, M. (2012). 植物における抗酸化物質としてのフラボノイド:その位置と機能的意義。植物科学 196, 67-76.
植物における抗酸化物質の位置と機能的意義.
Agati, G., Brunetti, C., Di Ferdinando, M., Ferrini, F., Pollastri, S., Tattini, M. (2013). 光保護におけるフラボノイドの機能的役割:新たな証拠、過去からの教訓。Plant Physiol. doi: 10.1016/j.plaphy.2013.03.014.
クロスレフ・フルテキスト|Google Scholar
Agus, A., Planchais, J., Sokol, H. (2018). 健康と疾患におけるトリプトファン代謝の腸内細菌叢制御。細胞宿主微生物 23, 716-724. doi: 10.1016/j.chom.2018.05.003
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
AlFaleh, K., Anabrees, J., Bassler, D., Al-Kharfi, T. (2012). コクラン・レビュー:早産児の壊死性腸炎予防のためのプロバイオティクス。Evid.-Based Child Health Cochrane Rev. J. 7, 1807-1854. doi: 10.1002/ebch.1881.
クロスレフ・フルテキスト|Google Scholar
Amić, D., Davidović-Amić, D., Beslo, D., Rastija, V., Lucić, B., Trinajstić, N. (2007). フラボノイドの抗酸化活性のSARとQSAR。Curr. Med. Chem. 14, 827-845.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Angelino, D., Carregosa, D., Domenech-Coca, C., Savi, M., Figueira, I., Brindani, N., et al. フラバン-3-オールの重要な微生物代謝物である5-(ヒドロキシフェニル)-γ-バレロラクトン-硫酸塩は、脳に到達することができる:異なるin silico、In vitroおよびIn vivo実験モデルからの証拠。栄養成分 11 (11), 2678.
パブコメ要旨|全文|Google Scholar
フラボノイドの抗ウイルス活性。フラボノイドの抗ウイルス活性。Biomed. Pharmacother. 140, 111596.
パブコメ抄録|全文|Google Scholar
Baky, M. H., Elshahed, M., Wessjohann, L., Farag, M. A. (2022). 食事性フラボノイドと腸内細菌叢の相互作用:包括的レビュー。栄養学雑誌 128, 577-591.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Barrett, E., Ross, R. P., O'Toole, P. W., Fitzgerald, G. F., Stanton, C. (2012). ヒト腸内培養細菌によるγ-アミノ酪酸産生。J. Appl. Microbiol. 113, 411-417. doi: 10.1111/j.1365-2672.2012.05344.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bibbò, S., Ianiro, G., Giorgio, V., Scaldaferri, F., Masucci, L., Gasbarrini, A., et al. 腸内細菌叢組成における食事の役割。Eur. Rev. Med. Pharmacol. Sci. 20, 4742-4749. doi: 10.1016/b978-0-12-821039-0.00002-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Biesalski, H. K. (2016). Nutrition meets the microbiome: Micronutrients and the microbiota. Ann. N. Y. Acad. Sci. 1372, 53-64. doi: 10.1111/nyas.13145.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Blandino, G., Inturri, R., Lazzara, F., Di Rosa, M., Malaguarnera, L. (2016). 糖尿病に対する腸内細菌叢の影響。糖尿病メタブ。42, 303-315. doi: 10.1016/j.diabet.2016.04.004
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Boots, A. W., Wilms, L. C., Swennen, E. L. R., Kleinjans, J. C. S., Bast, A., Haenen, G. R. M. M. (2008). 健康なボランティアにおけるケルセチンのin vitroおよびex vivo抗炎症活性。栄養 24, 703-710.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Braniste, V., Al-Asmakh, M., Kowal, C., Anuar, F., Abbaspour, A., Tóth, M., et al. 腸内細菌叢はマウスの血液脳関門透過性に影響する。Sci. Transl. Med. 6, 263ra158-263ra158. doi: 10.3410/f.725242566.793530847.
パブコメ抄録|全文|Google Scholar
Braune, A., Blaut, M. (2016). ヒト腸内における食事性フラボノイドの変換に関与する細菌種。Gut Microbes 7, 216-234. doi: 10.1080/19490976.2016.1158395
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Caetano-Silva, M. E., Rund, L., Hutchinson, N. T., Woods, J. A., Steelman, A. J. (2023). 食物繊維と短鎖脂肪酸による炎症性ミクログリアの抑制。W.Sci. 13, 2819. doi: 10.1038/s41598-022-27086-x
クロスレフ・フルテキスト|Google Scholar
Campos, H. M., da Costa, M., da Silva Moreira, L. K., da Silva Neri, H. F., Branco da Silva, C. R., Pruccoli, L., et al. アルミニウムによる神経毒性に対するクリシンの保護効果:in vitroおよびin vivo試験。Toxicology 465, 153033. doi: 10.1016/j.tox.2021.153033.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Cao,L.-H.、Qiao,J.-Y.、Huang,H.-Y.、Fang,X.-Y.、Zhang,R.、Miao,M.-S.、他(2019)。PI3K-ACTシグナル活性化とイカリイン:更年期うつ病様ラットモデルに対する潜在的効果。Mol. Basel Switz. 24 (20), 3700. doi: 10.3390/molecules24203700
クロスレフ・フルテキスト|Google Scholar
Caraci, F., Gulisano, W., Guida, C. A., Impellizzeri, A. A. R., Drago, F., Puzzo, D., et al. 海馬のシナプス可塑性と記憶におけるTGF-β1の重要な役割。論文誌5, 11252.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Castro, B., Sánchez, P., Torres, J. M., Ortega, E. (2015). ビスフェノールfとビスフェノールsは、雌性幼若ラットの前頭前野における5α-レダクターゼ発現とドーパミン-セロトニン系に異なる影響を及ぼす。Environ. 論文概要|大日本住友製薬株式会社(本社:東京都港区、代表取締役社長:大西啓介、以下「大日本住友製薬」)。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, L., Cao, H., Huang, Q., Xiao, J., Teng, H. (2022). フラボノイドの吸収、代謝および生物学的利用能:総説。Crit. Doi:10.1080/10408398.2021.1917508。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cook, T. M., Gavini, C. K., Jesse, J., Aubert, G., Gornick, E., Bonomo, R., et al. 正常な摂食行動には、微生物叢由来の代謝産物受容体である遊離脂肪酸受容体(FFAR3)の迷走神経発現が必要である。Mol. Metab. 54, 101350.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Cryan, J. F. (2012). And dinan, T 心を変える微生物:腸内細菌叢が脳と行動に及ぼす影響。G.Nat. Rev. Neurosci. 13, 701-712.
クロスレフ・フルテキスト|Google Scholar
Cryan, J. F., O'Riordan, K. J., Cowan, C. S. M., Sandhu, K. V., Bastiaanssen, T. F. S., Boehme, M., et al. 微生物叢-腸-脳軸。Physiol. Rev. 99, 1877-2013. doi: 10.1152/physrev.00018.2018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cui, J., Lian, Y., Zhao, C., Du, H., Han, Y., Gao, W., et al. Dietary fibers from fruits and vegetables and their health benefits via modulation of gut microbiota. Compr. Rev. Food Sci. Food Saf. 18, 1514-1532. doi: 10.1111/1541-4337.12489.
PubMedアブストラクト|Ref 全文|Google Scholar
Dalile, B., Van Oudenhove, L., Vervliet, B., Verbeke, K. (2019). 微生物叢-腸-脳のコミュニケーションにおける短鎖脂肪酸の役割。Nat. Rev. Gastroenterol. Hepatol. 16, 461-478. doi: 10.1038/s41575-019-0157-3
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Del Rio, D., Calani, L., Cordero, C., Salvatore, S., Pellegrini, N., Brighenti, F. (2010). ヒトにおける緑茶フラバン-3-オールのバイオアベイラビリティと異化。栄養バーバンクロスエンジェル。Cty. カリフォルニア 26, 1110-1116.
クロスレフ・フルテキスト|Google Scholar
Devore, E. E., Kang, J. H., Breteler, M. M. B., Grodstein, F. (2012). 認知機能低下とベリー類およびフラボノイドの食事摂取量。Ann. Neurol. 72, 135-143.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dey, P. (2019). 植物薬理学における腸内細菌叢:概念、相互相互作用、生体内変換および作用機序の包括的概観。Pharmacol. doi: 10.1016/j.phrs.2019.104367.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dymarska, M., Janeczko, T., Kostrzewa-Susłow, E. (2018). isaria fumosorosea KCH J2の培養物におけるメトキシル化フラボノイドのグリコシル化。Mol. Basel Switz. 23 (10), 2578. doi: 10.3390/molecules23102578.
CrossRef 全文|Google Scholar
El Aidy, S., Dinan, T. G., Cryan, J. F. (2014). 脳-腸-微生物軸の免疫調節。Front. Microbiol. 5. doi: 10.3389/fmicb.2014.00146
PubMedアブストラクト|クロス全文|Google Scholar
Estruel-Amades, S., Massot-Cladera, M., Pérez-Cano, F. J., Franch, À., Castell, M., Camps-Bossacoma, M. (2019). 健康ラットの腸内細菌叢と腸関連リンパ組織に対するヘスペリジン効果。doi: 10.3390/nu11020324.
抄録|全文|Google Scholar
Farhadi, F., Khameneh, B., Iranshahi, M., Iranshahy, M. (2019). フラボノイドの抗菌活性とその構造活性相関:最新レビュー。Phytother. Res. PTR 33, 13-40. doi: 10.1002/ptr.6208.
クロスレフ・フルテキスト|Google Scholar
Flint, H. J., Scott, K. P., Louis, P. (2012). And Duncan, s 栄養と健康における腸内細菌叢の役割。H.Nat. Rev. Gastroenterol. Hepatol. 9, 577-589. doi: 10.1038/nrgastro.2012.156
クロスレフ・フルテキスト|Google Scholar
Floyd, R. A., Hensley, K. (2002). 脳の老化における酸化ストレス。神経変性疾患の治療への示唆。Neurobiol. Doi: 10.1016/s0197-4580(02)00019-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
García-Díaz Barriga, G., Giralt, A., Anglada-Huguet, M., Gaja-Capdevila, N., Orlandi, J. G., Soriano, J., et al. 7,8-ジヒドロキシフラボンは、PLCγ1経路の特異的活性化を通じて、ハンチントン病マウスモデルにおける認知および運動障害を改善する。Hum. Mol. Genet. 26, 3144-3160.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gazola, A. C., Costa, G. M., Zucolotto, S. M., Castellanos, L., Ramos, F. A., de Lima, T. C. M., et al. passiflora quadrangularis由来フラボノイドの鎮静活性は、GABA作動性経路を介して媒介される。Biomed. Pharmacother. 100, 388-393. doi: 10.1016/j.biopha.2018.02.002
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gérard, P. (2016). 腸内細菌叢と肥満。Cell. Mol. 生命科学 73, 147-162.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gildawie, K. R., Galli, R. L., Shukitt-Hale, B., Carey, A. N. (2018). 加齢に伴う認知機能低下に対するフラボノイド含有食品の保護効果。Curr. Nutr. 7, 39-48. doi: 10.1007/s13668-018-0227-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ジュスティ、M.M.、宮城-Cruzado、G.、ウォレス、T.C.(2023)。「天然色素としてのフラボノイド」、天然着色料ハンドブック(ニューヨーク:ジョン・ワイリー&サンズ社)、371-390。
クロスレフ・フルテキスト|Google Scholar
Godos, J., Caraci, F., Castellano, S., Currenti, W., Galvano, F., Ferri, R., et al. イタリア人コホートにおける食事からのフラボノイド摂取と認知機能との関連。バイオモレキュールズ 10, 1300.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Goswami, C., Iwasaki, Y., Yada, T. (2018). 短鎖脂肪酸は迷走神経求心性ニューロンを活性化することにより食物摂取を抑制する。J. Nutr. Biochem. 57, 130-135. doi: 10.1016/j.jnutbio.2018.03.009
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gravandi, M. M., Fakhri, S., Zarneshan, S. N., Yarmohammadi, A., Khan, H. (2021). フラボノイドは、AMPK/PGC-1αおよび相互関連経路を調節し、潜在的な神経保護活性をもたらす。Metab. Brain Dis. 36, 1501-1521.
パブコメ抄録|クロステキスト|Google Scholar
Hafez, H. S., Ghareeb, D. A., Saleh, S. R., Abady, M. M., El Demellawy, M. A., Hussien, H., et al. ラットのスコポラミン誘発記憶障害に対するイプリフラボンの神経保護効果。Psychopharmacol. (Berl.) 234, 3037-3053. doi: 10.1007/s00213-017-4690-x
クロスレフ・フルテキスト|Google Scholar
Hervert-Hernández, D., Goñi, I. (2011). 食事性ポリフェノールとヒト腸内細菌叢:レビュー。Doi: 10.1080/87559129.2010.535233.
クロスレフ・フルテキスト|Google Scholar
Hidalgo, M., Martin-Santamaria, S., Recio, I., Sanchez-Moreno, C., de Pascual-Teresa, B., Rimbach, G., et al. アントシアニンとその腸内代謝産物の抗炎症作用、抗粘着作用、抗エストロゲン作用、アンジオテンシン変換酵素阻害作用の可能性。(1)アントシアニンおよびその腸内代謝物の抗炎症作用、(2)抗エストロゲン作用、(3)アンジオテンシン変換酵素阻害作用。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ho, L., Ono, K., Tsuji, M., Mazzola, P., Singh, R., Pasinetti, G. M. (2018). アルツハイマー病型βアミロイド神経病理学的メカニズムにおける腸内細菌叢由来短鎖脂肪酸の保護的役割。Expert Rev. Neurother. 18, 83-90. doi: 10.1080/14737175.2018.1400909
PubMed Abstract|RefRef Full Text|Google Scholar
Holscher, H. D. (2017). 食物繊維およびプレバイオティクスと消化管微生物叢。Gut Microbes 8, 172-184.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hoogland, I. C. M., Houbolt, C., van Westerloo, D. J., van Gool, W. A., van de Beek, D. (2015). 全身性炎症とミクログリアの活性化:動物実験の系統的レビュー。J. Neuroinflamm. 12, 114. doi: 10.1186/s12974-015-0332-6
クロスレフ・フルテキスト|Google Scholar
Hwang, S.-L., Yen, G.-C. (2008). PC12細胞におけるH2O2誘発細胞毒性に対する柑橘類フラバノンの神経保護効果。J. Agric. Food Chem. 56, 859-864.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Ismail, B., Hayes, K. (2005). イソフラボンの異なるグリコシド体に対するβ-グリコシダーゼ活性。J. Agric. Food Chem. 53, 4918-4924.
イソフラボンのグリコシド体について調べた。
Jaeger, B. N., Parylak, S. L., Gage, F. H. (2018). 神経機能および神経炎症における食事性フラボノイドの作用機序。Mol. Aspects Med. 61, 50-62. doi: 10.1016/j.mam.2017.11.003
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Jameson, K. G., Olson, C. A., Kazmi, S. A., Hsiao, E. Y. (2020). 微生物-神経シグナル伝達の理解に向けて。Mol. 細胞 78, 577-583.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jonsson, A. L., Bäckhed, F. (2017). アテローム性動脈硬化症における腸内細菌叢の役割。Nat. Rev. Cardiol. 14, 79-87. doi: 10.1038/nrcardio.2016.183
PubMed Abstract|クロスリファレンス全文|Google Scholar
Josiah, S. S., Famusiwa, C. D., Crown, O. O., Lawal, A. O., Olaleye, M. T., Akindahunsi, A. A., et al. 実験的パーキンソニズムにおけるカテキンとケルセチンの神経保護効果(雄性ウィスターラットにおけるドーパミン代謝とIL-1β、TNF-α、NF-κB、IκKB、p53遺伝子の発現の調節を通して)。神経毒性学 90, 158-171.
パブコメ要旨|全文|Google Scholar
Jung, J. W., Lee, S. (2014). ケルセチンの抗不安作用:GABA作動性システムの関与。J. Life Sci. 24, 290-296. doi: 10.5352/JLS.2014.24.3.290.
クロスレフ・フルテキスト|Google Scholar
Kang, M. J., Ko, G. S., Oh, D. G., Kim, J. S., Noh, K., Kang, W., et al. 経口バイカリンの薬物動態における腸内細菌叢による代謝の役割。Arch. Pharm. 論文誌37, 371-378.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
川端和彦・吉岡洋子・寺尾潤一郎(2019).食事性ポリフェノールのバイオアベイラビリティと生理機能における腸内細菌叢の役割. Mol. Basel Switz. 24, 370. doi: 10.3390/molecules24020370
クロスレフ・フルテキスト|Google Scholar
Koes, R., Verweij, W., Quattrocchio, F. (2005). フラボノイド:生化学的経路の制御と進化のためのカラフルなモデル。フラボノイド:生化学的経路の制御と進化のカラフルなモデル。
パブコメ抄録|全文|Google Scholar
Larkin, T., Price, W. E., Astheimer, L. (2008). 大豆イソフラボンのバイオアベイラビリティは、健康効果を理解する上で重要である。Crit. この論文では、大豆イソフラボンのバイオアベイラビリティ(生物学的利用能)が、健康への有益性を理解する上で重要な役割を担っていることを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Lee, Y., Jeon, S. J., Lee, H. E., Jung, I. H., Jo, Y.-W., Lee, S., et al. スピノシンは、c-グリコシドフラボノイドであり、マウスの認知能力と成体海馬神経新生を促進する。Pharmacol. Biochem. Behav. 145, 9-16. doi: 10.1016/j.pbb.2016.03.007
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, B., Yeom, M., Shim, I., Lee, H., Hahm, D.-H. (2020). ラットのリポ多糖によって誘発される不安様症状と神経炎症に対するケルセチンの保護効果。Evid.-Based Complement. Altern. Med. ECAM 2020, 4892415.
クロスレフ・フルテキスト|Google Scholar
Li,M.-T.、Ke,J.、Guo,S.-F.、Wu,Y.、Bian,Y.-F.、Shan,L.-L.、他(2021)。低酸素および再酸素化によって傷害された内皮細胞に対するケルセチンの保護効果。Front. Pharmacol. 12. doi: 10.3389/fphar.2021.732874
クロスレフ・フルテキスト|Google Scholar
Li,Y.-X.、Lu,Y.-P.、Tang,D.、Hu,B.、Zhang,Z.-Y.、Wu,H.-W.、他(2022)。アントシアニンは、アミノ酸代謝を調節することにより、糖尿病性腎臓病の腎機能を改善する。J. Transl. Med. 20, 510. doi: 10.1186/s12967-022-03717-9
パブコメ要旨|全文|Google Scholar
Liu, J., Yue, S., Yang, Z., Feng, W., Meng, X., Wang, A., et al. Hydroxysafflor yellow aの経口摂取は、腸内細菌叢と血清代謝を調節することにより、マウスの肥満を抑制する。Pharmacol. doi: 10.1016/j.phrs.2018.05.012.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lyte, M. (2011). プロバイオティクスは、神経活性化合物の送達ビヒクルとしてメカニズム的に機能する:プロバイオティクスの設計と使用における微生物内分泌学。BioEssays News Rev. Mol. Cell. バイオエッセイ 生物33, 574-581.
クロスレフ・フルテキスト|Google Scholar
Matias, I., Diniz, L. P., Buosi, A., Neves, G., Stipursky, J., Gomes, F. C. A. (2017). フラボノイド・ヘスペリジンは、シナプス形成を誘導し、アストロサイトTGF-β1を介して記憶能力を改善する。Front. Aging Neurosci. 9. doi: 10.3389/fnagi.2017.00184
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
松岡紘一・金井智子(2015).腸内細菌叢と炎症性腸疾患. Semin. Immunopathol. 37, 47-55. doi: 10.1007/s00281-014-0454-4
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mattson, M. P. (2008). 神経細胞の可塑性と疾患におけるグルタミン酸と神経栄養因子。Ann. N. Y. Acad. Sci.1144、97-112。doi: 10.1196/annals.1418.005
パブコメ要旨|全文|Google Scholar
Möhler, H. (2006). 中枢神経疾患におけるGABAA受容体:不安、てんかん、不眠症。J. Recept. シグナル伝達研究 26, 731-740.
クロスレフ・フルテキスト|Google Scholar
Morrison, D. J., Preston, T. (2016). 腸内細菌叢による短鎖脂肪酸の形成とヒトの代謝への影響。Gut Microbes 7, 189-200. doi: 10.1080/19490976.2015.1134082
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
室田和彦・中村祐之・上原正樹(2018).フラボノイド代謝:代謝物と腸内細菌叢の相互作用. Biosci. Biotechnol. Biochem. 82, 600-610. doi: 10.1080/09168451.2018.1444467
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nicholson, J. K., Wilson, I. D. (2003). 意見:「グローバルな」システム生物学の理解:メタボノミクスと代謝の連続体。Nat. Rev. Drug Discovery 2, 668-676.
クロスレフ・フルテキスト|Google Scholar
Nzakizwanayo, J., Dedi, C., Standen, G., Macfarlane, W. M., Patel, B. A., Jones, B. V. (2015). Escherichia coli nissle 1917は、合成とクリアランスの調節を通じて、腸組織におけるセロトニンの生物学的利用能を高める。論文タイトル:Sci. Rep.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Oteiza, P. I., Fraga, C. G., Mills, D. A., Taft, D. H. (2018). フラボノイドと消化管:局所的および全身的効果。Mol. Aspects Med. 61, 41-49. doi: 10.1016/j.mam.2018.01.001
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ozdal, T., Sela, D. A., Xiao, J., Boyacioglu, D., Chen, F., Capanoglu, E. (2016). The reciprocal interactions between polyphenols and gut microbiota and effects on bioaccessibility. doi: 10.3390/nu8020078
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Panche, A. N., Diwan, A. D., Chandra, S. R. (2016). フラボノイド:概要。J. Nutr. Sci. 5, e47. doi: 10.1017/jns.2016.41.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Patterson, E., Ryan, P. M., Wiley, N., Carafa, I., Sherwin, E., Moloney, G., et al. γ-アミノ酪酸産生乳酸菌は、メタボリックシンドロームモデルマウスにおける代謝およびうつ様行動に正の影響を及ぼす。Sci. Rep. 9, 16323. doi: 10.1038/s41598-019-51781-x
パブコメ要旨|全文|Google Scholar
Pickard, J. M., Zeng, M. Y., Caruso, R., Núñez, G. (2017). 腸内細菌叢:病原体のコロニー形成、免疫応答、炎症性疾患における役割。Immunol. 279, 70-89. doi: 10.1111/imr.12567.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qin, H.-Y., Zang, K.-H., Zuo, X., Wu, X.-A., Bian, Z.-X. (2019). Quercetin attenuates visceral hypersensitivity and 5-hydroxytryptamine availability in postinflammatory irritable bowel syndrome rats: role of enterochromaffin cells in the colon. J. Med. 食品 22, 663-671.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Quigley, E. M. M. (2017). 微生物叢-脳-腸軸と神経変性疾患。Curr. Neurol. Neurosci. 論文誌 17, 94.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rechner, A. R., Smith, M. A., Kuhnle, G., Gibson, G. R., Debnam, E. S., Srai, S. K. S., et al. 食事ポリフェノールの大腸代謝:微生物発酵産物の構造の影響。Free Radic. Biol. Med. 36, 212-225. doi: 10.1016/j.freeradbiomed.2003.09.022.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Reigstad, C. S., Salmonson, C. E., Rainey, J. F., Szurszewski, J. H., Linden, D. R., Sonnenburg, J. L., et al. 腸内微生物は、エンテロクロマフィン細胞に対する短鎖脂肪酸の作用を通じて、大腸セロトニン産生を促進する。FASEB J. 29, 1395-1403. doi: 10.1096/fj.14-259598.
PubMedアブストラクト|クロスリファレンス|Google Scholar
Rieder, R., Wisniewski, P. J., Alderman, B. L., Campbell, S. C. (2017). 微生物とメンタルヘルス:レビュー。Brain. Behav. Immun. 66, 9-17. doi: 10.1016/j.bbi.2017.01.016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rutsch, A., Kantsjö, J. B., Ronchi, F. (2020). 腸脳軸:微生物叢と宿主インフラマソームが脳の生理・病理にどのように影響するか。Front. Immunol. 11. doi: 10.3389/fimmu.2020.604179
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Samanta, A., Das, G., Das, S. (2011). 植物におけるフラボノイドの役割。Int. J. Pharm. Sci. Technol. 6, 12-35. doi: 10.3390/plants11223158.
CrossRef 全文|Google Scholar
Santangelo, R., Silvestrini, A., Mancuso, C. (2019). ジンセノサイド、カテキン、ケルセチンと腸内細菌叢:挑戦的相互作用の現在の証拠。Food Chem. Toxicol. 123, 42-49. doi: 10.1016/j.fct.2018.10.042.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Serra, D., Almeida, L. M., Dinis, T. C. P. (2019). 慢性腸炎が脳疾患に及ぼす影響:微生物叢-腸-脳軸。Mol. Neurobiol. 56, 6941-6951. doi: 10.1007/s12035-019-1572-8
パブコメ抄録|クロスリファレンス全文|Google Scholar
Silva, Y. P., Bernardi, A., Frozza, R. L. (2020). 腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割。Front. Endocrinol. 11. doi: 10.3389/fendo.2020.00025
クロスレフ・フルテキスト|Google Scholar
Skaper, S. D., Skaper (2018). 「Neurotrophic factors: an overview," in Neurotrophic factors: methods and protocols methods in molecular biology. Ed. (New York, NY: Springer), 1-17. doi: 10.1007/978-1-4939-7571-6_1
クロスレフ・フルテキスト|Google Scholar
Socała, K., Doboszewska, U., Szopa, A., Serefko, A., Włodarczyk, M., Zielińska, A., et al. 神経精神疾患および神経疾患における微生物叢-腸-脳軸の役割。Pharmacol. 神経精神疾患および神経疾患における微生物叢-腸-脳軸の役割。
パブコメ抄録|RefRef全文|Google Scholar
Spencer, J. P. E., Vafeiadou, K., Williams, R. J., Vauzour, D. (2012). 神経炎症:フラボノイドによる調節と作用機序。Mol. Aspects Med. 33, 83-97.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Spohn, S. N., Mawe, G. M. (2017). 末梢セロトニンシグナル伝達の非従来的特徴。Nat. Rev. Gastroenterol. Hepatol. 14, 412-420. doi: 10.1038/nrgastro.2017.51
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Stalmach, A., Edwards, C. A., Wightman, J. D., Crozier, A. (2012). ヒトによるコンコードグレープジュース摂取後の(ポリ)フェノール化合物の消化管安定性と生物学的利用能。Mol. Nutr. 56, 497-509. doi: 10.1002/mnfr.201100566.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Steinert, R. E., Lee, Y.-K., Sybesma, W. (2020). 腸内マイクロバイオームのためのビタミン。Trends Mol. Med. 26, 137-140. doi: 10.1016/j.molmed.2019.11.005
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sun, X., Meng, X., Zhang, J., Li, Y., Wang, L., Qin, X., et al. GABAはアミロイドのエンドサイトーシスを抑制することでアミロイド毒性を減弱させ、認知機能障害を改善する。J. Alzheimers Dis. JAD 31, 635-649.
クロスレフ・フルテキスト|Google Scholar
Tekin, I., Roskoski, R., Carkaci-Salli, N., Vrana, K. E. (2014). チロシン水酸化酵素の複雑な分子制御。J. Neural Transm. 121, 1451-1481.
クロスレフ・フルテキスト|Google Scholar
Thursby, E., Juge, N. (2017). ヒト腸内細菌叢入門。Biochem. J. 474, 1823-1836.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tojo, R., Suárez, A., Clemente, M. G., de los Reyes-Gavilán, C. G., Margolles, A., Gueimonde, M., et al. 健康と疾患における腸内細菌叢:腸内ホメオスタシスにおけるビフィズス菌の役割。World J. Gastroenterol. 20, 15163-15176. doi: 10.3748/wjg.v20.i41.15163
パブコメ抄録|クロスリファレンス全文|Google Scholar
Tolhurst, G., Heffron, H., Lam, Y. S., Parker, H. E., Habib, A. M., Diakogiannaki, E., et al. 短鎖脂肪酸は、g-タンパク質共役型受容体FFAR2を介してグルカゴン様ペプチド-1の分泌を刺激する。糖尿病 61, 364-371.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Troubat,R.、Barone,P.、Leman,S.、Desmidt,T.、Cressant,A.、Atanasova,B.、他(2021)。神経炎症とうつ病:総説。Eur. J. Neurosci. 53, 151-171. doi: 10.1111/ejn.14720.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Verzelloni, E., Pellacani, C., Tagliazucchi, D., Tagliaferri, S., Calani, L., Costa, L. G., et al. 大腸由来ポリフェノール異化物の抗糖化および神経保護活性。Mol. Nutr. 食品研究 55 Suppl 1, S35-S43.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
王(Wang, Z.-Y.), 江(Jiang, Z.-M.), 蕭(Xiao, P.-T.), 江(Jiang, Y.-Q.), 劉(Liu, W.-J.), 劉(Liu, E.-H.) (2020). ネットワーク薬理学的アプローチによるバイカリンの肥満・高脂血症改善メカニズム。Eur. J. Pharmacol. 878, 173103. doi: 10.1016/j.ejphar.2020.173103
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, Y., Wang, Z., Wang, Y., Li, F., Jia, J., Song, X., et al. The gut-microglia connection: implications for central nervous system diseases. Front. Immunol. 9. doi: 10.3389/fimmu.2018.02325
CrossRef Full Text|Google Scholar
Wang, M., Zhao, H., Wen, X., Ho, C.-T., Li, S. (2021). 柑橘類のフラボノイドと腸管バリア:相互作用と効果。Compr. Rev. Food Sci. Food Saf. 20, 225-251.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Weiss, G. A., Hennet, T. (2017). 腸内細菌異常症のメカニズムと結果。Cell. Mol. 生命科学 74, 2959-2977.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Williamson, G., Clifford, M. N. (2017). ポリフェノールの代謝運命決定における小腸、結腸および微生物叢の役割。Biochem. Pharmacol. 139, 24-39. doi: 10.1016/j.bcp.2017.03.012
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wu, D., Ding, L., Tang, X., Wang, W., Chen, Y., Zhang, T. (2019). Baicalin protects against hypertension-associated intestinal barrier impairment in part through enhanced microbial production of short-chain fatty acids. Front. Pharmacol. 10. doi: 10.3389/fphar.2019.01271
クロスレフ・フルテキスト|Google Scholar
Xiao, J. (2017). 食事性フラボノイドアグリコンとその配糖体:どちらがより優れた生物学的意義を示すか?Crit. 論文概要|蕭 兆(2017):食事フラボノイドアグコンとその配糖体:どちらがより優れた生物学的意義を示すか?
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xie, Y., Yang, W., Tang, F., Chen, X., Ren, L. (2015). フラボノイドの抗菌活性:構造活性相関とメカニズム. Curr. Med. Chem. 22, 132-149. doi: 10.2174/0929867321666140916113443
パブコメ抄録|クロスリファレンス全文|Google Scholar
Xiong, H.-H., Lin, S.-Y., Chen, L.-L., Ouyang, K.-H., Wang, W.-J. (2023). フラボノイドと腸内微生物の相互作用:レビュー。食品12, 320.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xu, H., Yang, F. (2022). 統合失調症の病態におけるドーパミン代謝異常とミトコンドリア異常の相互作用。Transl. doi: 10.1038/s41398-022-02233-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Youdim, K. A., Dobbie, M. S., Kuhnle, G., Proteggente, A. R., Abbott, N. J., Rice-Evans, C. (2003). フラボノイドと血液脳関門の相互作用:in vitro研究。J. Neurochem. 85, 180-192. doi: 10.1046/j.1471-4159.2003.01652.x
パブコメ要旨|全文|Google Scholar
Zhang,Y.,Cheng,L.,Liu,Y.,Zhan,S.,Wu,Z.,Luo,S.,他(2023)。食事性フラボノイド:腸内細菌叢を介した認知障害改善のための新規戦略。J. Sci. Food Agric. 103、488-495。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zhang, Z., Liu, X., Schroeder, J. P., Chan, C.-B., Song, M., Yu, S. P., et al. 7,8-ジヒドロキシフラボンは、アルツハイマー病モデルマウスにおけるシナプス消失と記憶障害を予防する。Neuropsychopharmacol. Off. Publ. Am. Coll. Neuropsychopharmacol. 39, 638-650.
クロスリファレンス全文|Google Scholar
Zhu, X., Han, Y., Du, J., Liu, R., Jin, K., Yi, W. (2017). 微生物叢-腸-脳軸と中枢神経系。論文タイトル:Oncotarget 8, 53829-53838.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:フラボノイド、血液脳関門(BBB)、腸内細菌叢、微生物叢-腸-脳軸、神経伝達物質
引用 フラボノイドと腸内細菌叢の腸-脳軸を介した神経調節作用。Front. Cell. Infect. Microbiol. 13:1197646.
受理:2023年4月3日 2023年04月03日; 受理済み: 09 June 2023;
発行:2023年6月23日
編集者
Manoj Yadav、米国国立アレルギー・感染症研究所(NIH)
査読者
Kiran Veer Sandhu、コーク大学、アイルランド
Nikhilesh Joardar、ワシントン大学セントルイス校、米国
Copyright © 2023 Wang, Zhao, Liu, Danzengquzhen, Cisangzhuoma, Ma, Li, Huang and Li. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められた慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信: Xiaodan Huang, huangxiaodan@lzu.edu.cn; Bin Li, xukesuolibin@163.com.
これらの著者は本研究に等しく貢献し、筆頭著者である。
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
消化器がんにおけるm6A修飾とマイクロRNAまたはlncRNAの相互作用に関する新たな知見
Tao Su, Jiandong Liu, Nasha Zhang, Teng Wang, Linyu Han, Suzhen Wang, Ming Yang
北極ベリー抽出物を用いたメチシリン耐性黄色ブドウ球菌バイオフィルムの増殖と発達の抑制
ジョン・ジャイロ・アギレラ=コレア、リイサ・ノヒネク、ハンナ=リーナ・アラコミ、ハイメ・エステバン、キルシ=マルヤ・オクスマン=カルデンテイ、リイッタ・プッポネン=ピミア、テーム・J・キンナリ、ラモン・ペレス=タノイラ
ベスパ・オリエンタリスの幼虫におけるミツバチウイルスの検出
カレン・パワー、マヌエラ・マルターノ、エルネスト・ラグーザ、ジェンナーロ・アルタムラ、パオラ・マイオリーノ
乳幼児期の発達遅滞の早期スクリーニングツール: IR-UWBレーダーを用いた動きの非対称性の定量的評価
ナ・ジェユン、イ・ウォンヒョク、イム・ヨンヒョ、チョ・ソクヒョン、チョ・ソンホ、パク・ヒョンギョン
一酸化窒素合成酵素2(NOS2)の遺伝子変異rs2297514は中国漢民族集団における四肢外傷後骨髄炎感受性の低下と関連する
宋晨生、張平、林清栄、胡英宇、潘春秋、姜南、胡延軍
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
この記事が気に入ったらサポートをしてみませんか?
