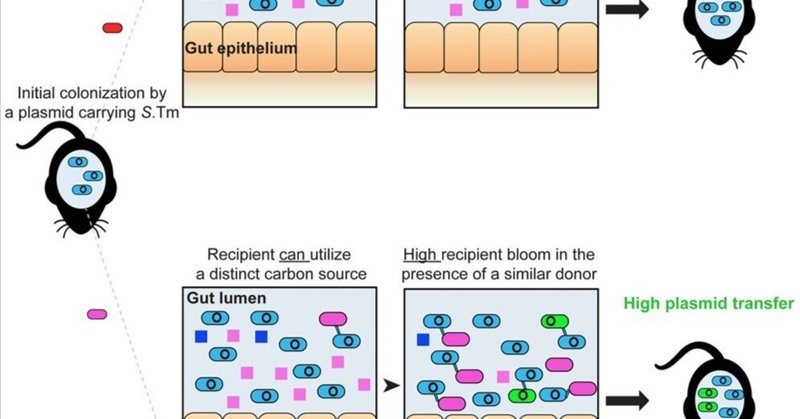
マウス腸内におけるサルモネラ菌株間の炭素代謝能力の燃料共存とプラスミド転移の違い
記事|31巻7号、p1140-1153.e3、2023年7月12日号
全号ダウンロード
マウス腸内におけるサルモネラ菌株間の炭素代謝能力の燃料共存とプラスミド転移の違い
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00222-6
エルシン・ギュル
アンドリュー・アビ・ユネス
ジェミナ・フースコネン
ルカ・マウラー
エリック・バッケレン 2, 3
ヴォルフ=ディートリッヒ・ハルト 4
すべての著者を表示する
脚注を表示する
オープンアクセス掲載:2023年6月21日DOI:https://doi.org/10.1016/j.chom.2023.05.029
PlumXメトリクス
ハイライト
菌株特異的な形質により、サルモネラ菌がマウスの腸内で共繁殖することが可能になった
サルモネラは異なる株との共殖の際に、ガラクチトールまたはアラビノースを使用することができる。
異なる腸内細菌科菌株間のプラスミド転移を促進する単一炭素の利用
異なる腸内細菌科細菌の腸管内共繁殖を可能にする炭素代謝能力
まとめ
抗生物質耐性プラスミドは、腸内において異なる腸内細菌科細菌間で拡散する可能性がある。ここで我々は、栄養要求性が類似した近縁の腸内細菌科細菌集団が、同じ腸内でどのように共ブルーミングし、それによってプラスミドの転移を促進できるかを調べた。サルモネラ・チフスムリウムの異なる株(S.Tm SL1344とATCC14028)とサルモネラ症モデルマウスを用いて、一方の株(すなわちレシピエント)が他方の株(すなわちドナー)に占拠された腸内でごく少数から増殖するためには、ガラクチトールまたはアラビノースという異なる炭素源を株特異的に利用する必要があることを示した。レシピエントであるS.Tm株のガラクチトール依存的増殖は、非同種株間および大腸菌とS.Tm株間のプラスミド転移を促進する。定義された微生物叢(OligoMM12)によって安定的にコロニー形成されたマウスにおいても、同様にガラクチトールの補充は2つのS.Tm株の共存を促進し、プラスミド転移を促進する。我々の研究により、腸内細菌があらかじめ占有された腸内で増殖するための代謝戦略が明らかになり、耐性プラスミドの拡散に対する有望な治療標的が得られた。

グラフィカル抄録
大きな画像を見る
高解像度画像のダウンロード
キーワード
プラスミド転移
サルモネラ菌
ガラクチトール
大腸菌
抗生物質耐性
腸内コロニー形成
コブルーム
アラビノース
微生物叢
コロニー形成抵抗性
はじめに
抗生物質耐性菌による感染症は、公衆衛生上の大きな問題となっている。
1
結合性プラスミドを介した抗生物質耐性遺伝子(ARG)の水平伝播は、抗生物質治療に遺伝的に耐性を持つ新たな細菌株の出現を加速させ、この問題に寄与している。
2
最近の研究では、哺乳類の腸とそれに関連するマイクロバイオームが、耐性プラスミドの獲得と拡散に適した場所であることが強調されている3。
3
抗生物質の多用は、新たな耐性菌の出現につながる既知の要因のひとつである。
4
しかし、哺乳類の腸内における耐性プラスミドの拡散に寄与する(抗生物質の選択以外の)環境因子はよくわかっていない。
哺乳類の腸は、何千もの細菌種の代謝ニッチを含む複雑な生態系である。
5
コロニー形成細菌は、病原性細菌に対するコロニー形成抵抗性など、宿主に不可欠な機能を提供する多様なコミュニティ-腸内細菌叢-を形成している。
6
フレターの栄養ニッチ理論によれば、侵入した病原体が定着して病気を引き起こすためには、少なくとも一つの利用可能なニッチを見つけなければならない。
7
,
8
安定的にコロニー形成された腸内では、常在細菌叢が、増殖に利用可能な栄養源の制限を含む様々なメカニズムを通じて、腸内病原体によるコロニー形成を阻止している。したがって、ニッチ排除理論によれば、同じ栄養素をめぐって競合する代謝の重複が高い2つの細菌集団が、同じ腸内で高密度まで増殖することはあり得ない。
9
,
10
さらに、2つの異なる細菌株は、異なる時点で異なる密度で腸に入ることが多いため、2つの異なる細菌株が同じ腸内で増殖する可能性はさらに低くなる。しかし、微生物生態学分野における最近の観察結果は、このような考え方とは相反するものであるようだ。腸内細菌科の複数の細菌が一過性に腸内を共棲化し、菌株レベルで互いに入れ替わる可能性があることが示唆されている。
11
,
12
とはいえ、異なる近縁の細菌が腸内でうまく共殖できるメカニズムについては、まだ解明されていない。
腸内では、耐性遺伝子を持つプラスミドが結合することで、耐性遺伝子が種内・種間レベルで拡散する可能性がある。しかしながら、プラスミドの効率的な転移は、腸内のドナー菌とレシピエント菌の個体数サイズに影響される細胞密度、エネルギー利用可能性、増殖速度などの因子に大きく左右される。
13
,
14
高密度に達するためには、2つの細菌集団が増殖に利用可能な栄養ニッチを見つける必要がある。従って、安定的にコロニー形成された腸内で、ドナー菌から、同様の栄養を必要とする近縁菌にプラスミドが移行することは、特に腸内細菌科の細菌においては予想外のことである。腸内細菌科の細菌は、健康な人の便中に通常102~106 CFU/gという低い密度で存在する。
15
,
16
,
17
驚くべきことに、臨床研究と動物モデルの両方から得られた証拠は、抗生物質耐性プラスミドが哺乳類の腸内で異なる腸内細菌科の間で拡散しうることを示唆している。
12
,
13
,
18
,
19
,
20
,
21
しかしながら、腸内における近縁種間の効率的なプラスミド移行を決定する因子はよくわかっていない。
サルモネラ菌や腸管病原性大腸菌のような腸内細菌科の病原菌による腸内感染症は、感染すると糞便中の菌密度が非常に高くなるため、抗生物質による耐性選択を行わなくても、哺乳類の腸内でプラスミドの拡散が促進される可能性がある。
13
,
18
,
22
,
23
これまでの研究から、抗生物質耐性プラスミドを保有する宿主組織内のサルモネラ菌は、非常に低い頻度で腸管内腔に再播種することができ、別のサルモネラ菌がすでに高度にコロニー形成している腸管内で、非常に低い密度から非常に高い密度(すなわち、糞便1グラム当たり約104 CFUから約108 CFU)まで増殖できることが明らかになった。
13
,
18
興味深いことに、これらの研究では、サルモネラ菌株はドナーとしてもレシピエントとしても非同種性であり(S.Tm SL1344とATCC14028)、増殖に必要な栄養素も同様であった。このことは、事前にコロニー形成された腸内で、同様のサルモネラ菌株の二次増殖(以降、コ・ブルーミングと呼ぶ)を可能にし、それによって抗生物質耐性プラスミドの拡散に寄与するものは何かという疑問を提起する。
ここでは、代謝能力が重複する近縁の菌株が、哺乳類の腸内でどのようにコ・ブルーミング(両菌株が高密度になること)するのか、また、このことがどのように抗生物質耐性プラスミドの拡散を促進するのかを理解することを目的とした。そのために、モデル腸内病原体であるサルモネラ・チフィムリウム(S.Tm)の異なる株と、微生物叢の複雑さが異なるサルモネラ症モデルマウスを用いて、in vivoプラスミド転移アッセイを行った。
結果
非同原性S.Tm株による共感染はマウス腸内でのプラスミド移行を促進する
近縁の細菌間の共存とプラスミド転移の促進における株レベルの違いの役割を研究するために、我々はマウスに2つの同一または非同一のS.Tm株(すなわち、ドナーとレシピエント)を感染させる実験モデルをデザインした。ドナーの数を多く(1,000倍過剰)することで、コロニー形成能の高いドナー集団の存在下で、少ない数のレシピエントを開花させることが、プラスミド導入効率にどのような影響を与えるかを調べた。実験室で一般的に使用されている2つの天然S.Tm株を選んだ: SL1344(S.Tm-Aと表記)、
24
S.Tm-A)とATCC14028(S.Tm-B)である、
25
鳥類分離株であるATCC14028(S.Tm-Bと表記)である(主要資源表)。この2つの菌株は、サルモネラ症モデルマウスで互換的に使用されており、代謝能力が類似しているため、マウスの腸内に同程度の総密度でコロニー形成することが報告されているため、今回の原理実証実験に特に適していた。
26
,
27
,
28
ストレプトマイシンで前処理したC57BL/6マウスに、ドナー(バーゼル大学病院の患者から分離された大腸菌株由来の広域β-ラクタマーゼプラスミド[pESBL15]を持つ。
29
)とレシピエントを1,000:1(ドナー:レシピエント)の比率で接種した。両菌株をドナー(S.Tm-A + pESBL15またはS.Tm-B + pESBL15)またはレシピエント(S.Tm-AまたはS.Tm-B)として使用し、偏りのないアプローチを行った(実験スキーム;図1AおよびS1A)。選択プレーティングにより糞便中のトランスコンジュガント(プラスミドを保有するレシピエント)の数を定量することにより、プラスミド転移を決定した。プラスミド転移(糞便中のトランスコンジュガントの数)は、同一株(すなわち、S.Tm-A+pESBL15をドナーとし、S.Tm-Bをレシピエントとする)よりも、非同一株(すなわち、S.Tm-A+pESBL15をドナーとし、S.Tm-Bをレシピエントとする)からなるドナー:レシピエント対を用いた場合の方が、有意に高かった、 驚くべきことに、非同一株ペアでは、トランスコンジュガントは、同一株ペアよりも高い効率で形成された(それぞれ、中央値で約107 CFU/g糞便および106 CFU/g)(両者とも中央値で約104 CFU/g糞便;図1BおよびS1B)。一方、レシピエントの総数は、非同一株を接種したマウスの方が、同一株を感染させたマウスよりも有意に多かった(図1DおよびS1D)。従って、前者でプラスミド転移が多いのは、腸内に非同一のサルモネラ菌株がコロニー形成された場合にのみ、レシピエントが低い数から拡大できることに起因するのではないかと推論した。
図12つの異なるS.Tm株をマウスに感染させると、プラスミド転移が高くなる。
キャプションの全文を表示
大きな画像を見る
高解像度画像をダウンロード
コ・ブルーミング、すなわち(別のサルモネラ菌株によって)事前にコロニー形成された腸へのコロニー形成を研究するために、S.Tm-AがS.Tm-B(1,000倍過剰)によってコロニー形成された腸に侵入する能力を試験する感染実験を行った。コントロールとして、S.Tm-AがS.Tm-A(1,000倍過剰)にコロニー形成された腸に生育する別の感染実験を行った。少ない方の菌株の増殖程度を評価するため、3日間感染実験を行った。マウスを同一株ペア(S.Tm-AからS.Tm-Aへ)で共コロニー化した場合、マイナー株はマウスの腸内で増殖することができず、3日目のp.i.における糞便中の比率は接種時と同程度であった(図1E)。驚くべきことに、非同一株ペア(S.Tm-A株とS.Tm-B株)のシナリオでは、少ないほうの株が著しく増殖し、3日目のp.i.までに腸内で多いほうの株と同等の密度に達した(図1F)。これらの菌株が生体内で等しい速度で増殖することを確認するため、両者を同じ比率で接種する対照実験を行ったところ、測定可能な干渉なしに両菌株が同じ速度で増殖することが確認された(図S1EおよびS1F)。以上のことから、株レベルの違いによって、2番目のS.Tm株があらかじめコロニー形成されたマウスの腸に感染し、それによってサルモネラ菌株間の抗生物質耐性プラスミドの移行が促進される可能性があると結論した。
S.Tm-AとS.Tm-Bの炭素代謝能力の違い
次に、サルモネラ菌が密集している中で、より少ない菌株のブルームを可能にする違いを研究したいと考えた。これら2つの菌株間の遺伝的差異(代謝能力など)を同定し、菌株特異的な遺伝子がレシピエントの差異の拡大を説明できるかどうかを調べるため、BLASTを用いて2つのゲノム(染色体とプラスミド)を比較し、Artemis Comparison Toolを用いて可視化した。予想通り、染色体は非常に相同性が高く(SL1344は99.98%、ATCC14028は98%)、(図2A)代謝の重複が高いという予想をさらに裏付ける結果となった。SL1344はATCC14028と比較して、さらに2つのプラスミドを含んでいた(図2A)。相同性を欠く領域に注目すると、多くの遺伝子が一方の株には存在し、他方の株には存在しないことが観察できた(表S1;SL1344[S.Tm-A]では208遺伝子、ATCC14028[S.Tm-B]では67遺伝子)。予想通り、これらのほとんどはプラスミド(SL1344のpCol1b9プラスミド)またはプロファージ(ATCC14028のGifsy3プロファージ)上に存在する遺伝子であった。しかし、特定の炭素源の輸送や処理に関与する染色体遺伝子の遺伝的差異も観察された(表S1)。顕著な例として、S.Tm-Bではほとんどの部分が欠損していたガラクチトール利用オペロンが、S.Tm-Aでは完全なオペロンを持っていた(図2B)。具体的には、細胞内ガラクチトールのインポート(gatA、B、C)とグリセルアルデヒド3-リン酸へのプロセシング(SL1344_3228、SL1344_3229、gatZ)に関与する6つの遺伝子がS.Tm-Bでは欠損していた。これは、今回研究した2つのS.Tm株を含む、異なる腸内細菌科のgat遺伝子座を特に比較した以前の報告と一致していた。
30
図2S.Tm-AとS.Tm-Bは炭素源を利用する代謝能力が異なる
キャプションの全文を表示
大きな画像を見る
高解像度画像をダウンロード
S.Tm-Aは、ガラクチトールという異なる炭素源を文脈依存的に利用することで、S.Tm-Bに占領されていた腸内で増殖することができる。
ガラクチトールは植物に含まれる糖アルコールであり、マウスの餌にも含まれている。
10
,
31
ガラクチトール(gat)オペロンは、サルモネラ属を含む腸内病原性細菌のコロニー形成抵抗性を決定する上で重要な役割を持つことが報告されている。
10
,
32
興味深いことに、最近の研究では、複雑な微生物叢によって他のニッチが占有されている状況において、常在性大腸菌がサルモネラ属菌とガラクチトールを競合することにより、コロニー形成抵抗性を提供できることが示された。
10
しかし、ガラクチトールを利用する能力は、腸内細菌科の菌株特異的な特徴のようである。そこで、S.Tm-BではなくS.Tm-Aがガラクチトール上で増殖できるかどうかを調べた。S.Tm-Aがガラクチトールを炭素源として利用する能力を確認するため、この糖の輸入に関与する遺伝子(gatA、gatB、gatC;S.Tm-A ΔgatABC)を欠損した変異体を作製した。予想通り、この変異体はガラクチトールを炭素源とする改変マッコンキー寒天培地プレート上でガラクチトールを代謝できなかった(図S2A)。次に、ガラクチトールまたはグルコースを添加した最小培地(M9)でin vitro増殖アッセイを行ったところ、S.Tm-Aはガラクチトールを添加したM9で嫌気的に増殖できるのに対し、S.Tm-A ΔgatABCおよびS.Tm-Bはできないことが確認された(図S2BおよびS2C)。
gatオペロンがS.Tm-Aにのみ存在し、ガラクチトール上での生育を可能にすることがわかったので、この経路が、S.Tm-Bによってあらかじめコロニー形成されたマウスの腸内でのS.Tm-Aの増殖に関与しているかどうかを調べることにした。そのために、ストレプトマイシンで前処理したマウスで、S.Tm-AとS.Tm-A ΔgatABCの競合感染実験を行った。一方の群では、過剰のS.Tm-B(1,000倍;最終比1:1:1,000)の存在下で、S.Tm-AとS.Tm-A ΔgatABCを1:1の割合でマウスに感染させ、もう一方の群では、過剰のS.Tm-B(1:1)なしで同様に感染させた。過剰なS.Tm-Bの存在下(図3A;オレンジ色の背景)、S.Tm-A野生型は変異体より有意にフィットネスが優位で、以前と同じように拡大したが、gatABC変異体は事前に占有された腸内で開花できなかった(図3AおよびS3A)。驚くべきことに、過剰なS.Tm-Bを除去すると(図3B;青背景)、gatオペロンはフィットネスアドバンテージを与えず、野生型S.Tm-AもgatABC変異体もキャリングキャパシティまで成長した(図3BおよびS3A)。このことから、ガラクチトールは文脈依存的な炭素源であり、他のニッチが同程度の代謝能力を持つ株によってあらかじめ占有されている条件下でのみ好まれることが示唆された。これらの所見をさらに実証し、腸内炎症とそれに伴う管腔内代謝産物の変化の役割の可能性を排除するため、上記の菌株の強毒バージョン(S.Tm-AavirおよびS.Tm-Aavir ΔgatABC)を用いて同様の競合感染を行った。主要株(1,000倍過剰株)としては、S.Tm-Bavirまたは別のgat陰性腸内細菌科菌株(大腸菌K12;図S3C)を用いた。こうすることで、種レベルで得られた知見が科レベルでも当てはまるかどうかを検証することができた。いずれのグループにおいても、gat欠損のS.Tm-Aavirよりもgat欠損のS.Tm-Aavirの方が適性に優れ、大過剰のS.Tm-Bavir(図S3B;オレンジ色の背景)と大過剰の大腸菌K12(図S3C;茶色の背景)の両方の存在下で増殖することができた。このことから、S.Tm-Aは、類似の代謝能力を持つ近縁種が他の利用可能なニッチをすでに占めている条件下で、ガラクチトールを代替炭素源として利用できると結論された。これらの知見は、無病原性病原性バックグラウンドでも同様であった。
図3ガラクチトールという異なる糖を利用する能力により、S.Tm-Aは過剰なS.Tm-Bの存在下でもマウスの腸内に定着することができる。
キャプションの全文を表示
大きな画像を見る
高解像度画像をダウンロード
それぞれの代謝経路を欠損した同種のS.Tm-A変異体が存在すると、野生型S.Tm-Aは排他的炭素源で増殖する。
腸管感染症に対する感受性を決定する上で、食物組成が重要な役割を果たしていることが、ここ数年のいくつかの研究で明らかになった。
33
,
34
,
35
食事が腸内の利用可能なニッチを変化させ、腸内細菌のコロニー形成の成否に影響を与えることはよく知られている。
6
そこで我々は、ガラクチトールを食事から補充することが、gatオペロンを除く全ゲノムが同一である2つのアイソジェニック株の共存に影響を与えるかどうかを検討した。これを検証するため、まずストレプトマイシン前処理をしたマウスに、gat欠損株とgat欠損株の1:1,000混合株(S.Tm-AおよびS.Tm-A ΔgatABC;図S4Aの実験スキーム)を感染させ、飲料水に0%、0.1%、または1%のガラクチトールを補充した。異なる濃度のガラクチトールを飲料水に添加し、gat欠損株(マイナー株)のコ・ブルーム能力をモニターした。2日目のp.i.において、Gat欠損株の存在下でのS.Tm-Aの増殖は、ガラクチトール濃度と相関していた: 1%ガラクチトールが最も高い増殖率(約1,000倍)を示し、0%ガラクチトールは飲料水中の0.1%または1%ガラクチトールで観察されるよりも、Gat+株の増殖ははるかに少なかった(約3倍)(図S4B)。
次に、0%と1%のガラクチトールで同じ補充実験を繰り返し、さらに別のグループとして、飲料水に1%のアラビノースを添加した。アラビノースは非吸収性の炭水化物であり、大腸に定着している細菌が利用できるはずである。この設定により、補充した栄養源を両系統が利用できる対照が得られた。
36
,
37
ガラクチトールを利用する能力(および選択プレーティングに適した抗生物質耐性マーカー)だけが、多い菌株と少ない菌株の違いであるため、少ない菌株の増殖が、その菌株によるガラクチトールの利用に特異的に依存しているかどうかを調べることができた。上記のデータに沿い、ガラクチトールを添加しない対照群では、gat欠損株 の存在下でgat欠損S.Tm-Aが5×107 CFUまで増殖することが観察された が、p.i.2日目には主要株と同じ密度まで増殖することはできなかった (図4Aおよび4B水色;図S4CおよびS4D)。飲料水に1%ガラクチトールを添加すると、gat欠損S.Tm-Aはマウスの腸内で急速に増殖し、糞便中ではp.i.2日目までにgat欠損株(S.Tm-A ΔgatABC)と同程度の密度(約109 CFU/g;保菌力)に達した(図4BおよびS4D;背景は紫色)。驚くべきことに、1%アラビノース(両菌株が利用可能)を飲料水に補充しても、gat欠損小株の拡大には全く影響せず、gat欠損株とgat欠損株の比率も変わらなかった(図4BおよびS4D;背景はターコイズ)。したがって、ガラクチトールではなく「一般的な」炭素源を飲料水中に補充することで、gat同系株と競合した場合に、あまり多くない株の増殖を促進するのに十分であると結論づけた。さらに、S.Tm-AとS.Tm-A gatABC間のGat依存性共ブルーミングに影響を与える可能性のある、常在細菌叢に対するガラクチトール補給の間接的影響を評価するために、対照実験を行った。実際、gat欠損株をマイナー株として用いた場合(図S4D;三角形)、ガラクチトールの補充は、2番目のgat欠損株と比較して、この株の増殖に影響を与えなかった。アラビノースサプリメント実験と合わせて、これらのデータは、ガラクチトールサプリメントで観察された効果が、他の交絡変数(例えば、微生物叢組成の変化を介して)ではなく、ガラクチトールオペロンによって引き起こされることを検証した。
図4一方の菌株のみが利用可能な異なる炭素源を補充することで、マウス腸内で2つの同系S.Tm株の共存が可能になる
キャプションの全文を表示
大きな画像を見る
高解像度画像をダウンロード
最後に、ガラクチトール以外の炭素源でも、別のS.Tm株が事前にコロニー形成した腸内で低密度からS.Tmのブルームを促進できるかどうかを検討した。そこで、アラビノース・オペロンを欠失させた場合の効果を調べた。アラビノースは最近、スーパーシェダーマウスの腸内でS.Tmの増殖を促進することが示されているので、これは有望であると思われた。
36
我々は、L-アラビノース利用オペロンのaraB遺伝子を欠失させたara欠損S.Tm-A変異体を構築し、ara欠損S.Tm株とara欠損S.Tm株を用いて同様の競合感染を行った。この目的のため、ストレプトマイシン前処理をしたマウスに、ara欠損株とara欠損株の1:1,000混合株(S.Tm-AおよびS.Tm-A ΔaraB)を感染させた。腸内でのアラビノース利用可能性の要件を調べるため、2群のマウスでこの実験を行った。第1群には通常の飲料水を与え、第2群には飲料水にアラビノースを1%添加した(図4Cの実験スキーム)。驚くべきことに、1%アラビノースの補給は、S.Tm-Aの増殖を2日目のp.i.までにS.Tm-A ΔaraBと同程度の密度まで高めるのに十分であった(ともに約109 CFU;図4D)。このことから、アラビノースを利用する能力の差によって、アラビノースを利用する同種のS.Tm株が、あらかじめ占有された腸内で低密度から増殖することが確認された。
以上の結果から、マイナーなS.Tm株のみが利用できる異なる炭素源を飼料に添加すると、この炭素源を利用できない同系統の突然変異体が占有する腸内で、その株の増殖を促進することが明らかになった。
S.Tm-A株とS.Tm-B株、あるいはS.Tm-A株と大腸菌の間のプラスミド転移は、排他的炭素源の補充によって促進される。
マウスの腸内で特異的な炭素源を利用する能力の意味を明らかにしたので、次に、特異的な炭素源を補充することでプラスミド転移が促進されるかどうかをテストしたいと考えた。これを調べるために、ストレプトマイシン前処理をしたマウスに、前回と同じようにドナー株(pESBL15を保有)とレシピエント株の1,000:1混合物を感染させ(実験スキーム;図5A)、3つの異なる疑問について調べた。
図5ストレプトマイシン前処理マウスにおけるS.Tm-AとS.Tm-B、または大腸菌とS.Tm-A間のプラスミド転移を促進する糖の利用。
キャプションの全文を表示
大きな画像を見る
高解像度画像のダウンロード
まず、pESBL15プラスミドを持つS.Tm-Bをドナーとして用い、以下の3群のマウスに感染させた: (1)S.Tm-Aをレシピエントとして(図1より)、(2)S.Tm-A ΔgatABCをレシピエントとして、または(3)S.Tm-Aをレシピエントとして、飲料水に1%のガラクチトールを添加した。ガラクチトールオペロンを欠失させた結果、2日目の糞便中のトランス共役体の密度は、Gat+同系統株で得られた密度と比較して低くなり(図5B;レシピエントとしてのS.Tm-Aと比較して約100倍減少)、図1Bで2つの異なる株間で観察された高いプラスミド転移は、ガラクチトールの利用に起因することが確認された。驚くべきことに、飲料水にガラクチトールを添加すると、糞便中のトランスコンジュガントの数が著しく増加した(図5B;黒丸対紫丸;ガラクチトールを添加しないレシピエントとしてのS.Tm-Aと比較して約1,000倍増加)。糞便中のトランスコンジュガントの密度が高いことは、ドナーの密度とは無関係であった(図5C)。しかし、レシピエントの密度を比較すると、ガラクチトールオペロンの欠失は、レシピエントとトランスジュガントのドナー株存在下での増殖能力を損なうことが明らかになった。一方、ガラクチトールを補充すると、レシピエントとトランスジュガントの増殖が著しく促進され、ドナーと同程度の密度に達することができた(図5D)。
実験2セット目では、ガラクチトールの利用と補充によるこの効果を、腸管内腔にコロニー形成する別の腸内細菌科細菌に適用できるかどうかを検証した。この目的のために、表現型的にGat-である尿路病原性大腸菌536株(図S2A)を用い、pESBL15をドナーとし、図5B-5Dと同じように上記と同じレシピエントセット(図5E-5G;三角形)を用いた。この株はもともとストレプトマイシンに対して耐性であり、S.Tm.と同様の効率でストレプトマイシン前処理したマウスの腸にコロニー形成する。
13
,
38
,
39
S.Tm-Bをドナーとした最初の実験(図5B-5D)と同様に、大腸菌536をドナーとした場合、S.Tm-A ΔgatABCをレシピエントとした場合、S.Tm-Aと比較してトランスコンジュガントの密度が低くなった(黒三角;図5E)。また、この場合、飲料水にガラクチトールを添加すると、糞便中のトランスコンジュガントの密度が増加した(紫色の三角形;約109 CFUトランスコンジュガント;図5E)。このガラクチトール補給の効果は、3群全てのマウスで同程度であったため、ドナーの密度とは無関係であったが(図5F)、おそらくレシピエントの密度が高いことに関連していると思われる(図5Fおよび5G)。
最後に、この効果が、レシピエント系統が独占的に利用できる別の炭素源に一般化できるかどうかを検証した。そのために、pESBL15プラスミドを持つS.Tm-A ΔaraBをドナーとして用い、マウスを3つのグループに分けて実験を行った。(1)S.Tm-Aをレシピエントとするグループ、(2)S.Tm-A ΔaraBをレシピエントとするグループ、(3)S.Tm-Aをレシピエントとし、飲料水に1%のアラビノースを加えたグループ。驚くべきことに、ara欠損のS.Tm-A(茶色の丸)をレシピエントとした場合と比較して、ara欠損のS.Tm-A(黒い丸)をレシピエントとしたマウスの糞便からは、有意に多くのトランスコンジュガントが検出された(図5H)。さらに、水中でアラビノースを補充すると、アラビノースを補充していないマウスよりも糞便中の経接合体密度が高くなった(図5H;トルコ石の丸)。注目すべきことに、アラビノースの利用および補給の効果は、ドナーの密度が影響を受けなかったことから、レシピエントの開花に起因する可能性がある(図5Iおよび5J)。
これらのデータから、ユニークな炭素源(例えば、ガラクチトールやアラビノース)の株特異的利用は、2つのS.Tm株の高密度での共存を可能にするだけでなく、腸内での抗生物質耐性プラスミドの転移を促進することが立証された。さらに、この効果は、健康な人の腸管内腔に普通にコロニー形成している大腸菌などの他の腸内細菌科にも一般化できることも見いだした。
ガラクチトールの補充は、微生物叢が規定されたマウスにおいて、効率的なプラスミド転移と組織リザーバー形成を可能にする。
これまでの競合感染実験は、初期のコロニー形成抵抗性を克服するために、ストレプトマイシン前処置マウスで行われた。そのため、2つのサルモネラ菌株の共存に焦点を当てることができた。自然感染では、無傷の微生物叢の存在がこのプロセスに影響を与える。そこで次に、常在細菌叢の存在下でのプラスミド移行に対する代替炭素源の利用の影響を調べたいと考えた。プラスミド転移速度に対する微生物叢の影響を調べ、抗生物質処理によって常在微生物叢が撹乱されないマウスにおける代替炭素源利用の役割を調べるために、微生物叢のメンバーを欠くマウス(無菌マウス)と、大腸菌とサルモネラ属菌による腸管内腔の緩やかなコロニー化を可能にする定義された微生物叢コミュニティ(マウスの複雑な微生物叢を代表する12種の微生物叢)をコロニー化したマウス(OligoMM12)で感染を行った。
9
S.Tm-B(pESBL15プラスミド入り)を全群のドナーとして過剰に使用し、5群のマウスに感染させた(実験スキーム;図6A): (1)S.Tm-Aをレシピエントとして無菌マウス(黒丸;黄色背景)、(2)S.Tm-A ΔgatABCをレシピエントとして無菌マウス(赤丸;黄色背景)、(3)S.Tm-AをレシピエントとしてOligoMM12マウス(黒丸;緑背景)、(4)S. Tm-AΔgatABCをOligoMM12マウスのレシピエントとした場合(赤丸;緑背景)、および(5)飲料水に1%のガラクチトールを添加したOligoMM12マウスのレシピエントとしてのS.Tm-A(紫丸;緑背景)。
図6ガラクチトールの補充は、微生物叢が乱れていないマウスにおけるプラスミド転移と組織リザーバーの形成を促進する。
キャプションの全文を表示
大きな画像を見る
高解像度画像のダウンロード
まず、微生物叢の有無がプラスミド転移速度にどのような影響を及ぼすかを調べた。微生物叢は糞便中に観察されるトランスコンジュガントの密度の重要な決定因子であることが示されたからである。
13
そのために、レシピエントの総密度、プラスミドを獲得したレシピエントの割合、トランスコンジュガントの総密度をグループ1とグループ3の間で比較した。 無菌マウスでは、レシピエントは108 CFU/g糞便(腸内で効率的にプラスミドを移行させるための閾値と報告されている数)以上の負荷に達していた
13
に達したが、OligoMM12マウスではそうならなかった(図6B;黄色と緑の背景の黒丸を比較)。これに伴い、無菌マウスにおけるトランスコンジュガントの割合は、OligoMM12マウス(ほとんどのマウスで5%未満;図6C)よりも有意に高かった(レシピエント集団で約100%)。これらの結果は驚くべきもので、常在細菌叢の大きな影響と、ドナーとレシピエント間で抗生物質耐性プラスミドが移行する可能性を減少させるというコロニー形成抵抗性の重要な機能を強調するものであった。無傷の微生物叢が存在するとプラスミドの移行が減少することを正式に示すために、OligoMM12マウスの糞便中のトランスコンジュガントの形成を分析した。高いプラスミド転移効率と一致して、2日目のp.i.における無菌マウスの糞便中のトランスコンジュガントの密度は非常に高かった(キャリングキャパシティ;中央値109 CFU/g糞便;図6D)。対照的に、OligoMM12マウスの糞便中のトランスコンジュガントの密度は、無菌マウスよりも有意に低かった(図6D;1,000倍)。
次に、ストレプトマイシン前処理マウスで観察されたのと同様に、ガラクチトールの利用がこの条件下でのプラスミド転移に影響を与えるかどうかを検討した。まず、無菌マウスとOligoMM12マウスでgatオペロン欠失(S.Tm-A ΔgatABCをレシピエントとする)の影響を調べた。ガラクチトールオペロンの欠失は、無菌マウスにおけるレシピエント密度およびプラスミド転移率に影響を与えなかった(図6Bおよび6C;黄色背景の黒丸対赤丸)。その結果、これらのマウスでは、どの系統をレシピエントとして用いても(図6D)、ドナーの密度とは無関係に、トランスコンジュガントの密度は変わらなかった(図S5AおよびS5B)。対照的に、S.Tm-Aの代わりにS.Tm-A ΔgatABCをレシピエントとして用いた場合、オリゴMM12におけるレシピエントの数とプラスミド転移率は有意に低かった(図6Bおよび6C)。その結果、S.Tm-A ΔgatABCをレシピエントとして感染させたOligoMM12マウスでは、S.Tm-Aをレシピエントとして感染させたOligoMM12マウスよりもトランスコンジュガントの密度が有意に低かった(約100倍)(図6D;緑背景の黒丸対赤丸)。注目すべきは、コロニー形成抵抗性をマイルドにするために一過性に高脂肪食に移行させた129マウス(複雑な腸内細菌叢を保有)でも、ガラクチトールオペロンがコブルームとプラスミド転移を促進する同様の役割を果たすことが観察されたことである(図S5C-S5F)。最後に、飲料水中の1%ガラクチトールの効果を試験した。驚くべきことに、OligoMM12マウスにガラクチトールを補充すると、レシピエントの密度とプラスミド転移率は、無菌マウスで観察されたのと同じ高いレベルまで増加した(図6Bと6C;緑の背景の紫色の円対黄色の背景の黒色の円)。驚くべきことに、ガラクチトールを補充したOligoMM12マウスでは、ガラクチトールを補充しなかったマウスと比較して、トランスコンジュガントの密度が1,000倍に増加した(図6D;緑背景の黒丸対紫丸)。
最後に、OligoMM12マウスの組織中のプラスミド・リザーバーについて調べた。
13
,
18
サルモネラは侵入性の病原体であるため、宿主組織内に長期間「潜伏」することができ、また戻って来て耐性プラスミドを常在細菌叢や他の腸内細菌科細菌に移すことができる。
40
そこで、プラスミドの組織リザーバーの形成がガラクチトールの利用によって促進されるかどうかを検討した。このことを調べるために、上記と同じ感染から得たOligoMM12マウスの糞便組織と腸間膜リンパ節(mLN;この病原体の全身移行に関連する臓器)中のプラスミドを保有するサルモネラの数を分析した(図6A-6D)。gatオペロンを欠失させると、糞便組織における組織リザーバーの形成が阻害されたが、ガラクチトールを添加すると、ガラクチトールを添加しないS.Tm-Aと比較して、組織リザーバーの形成が有意に促進された(図6E)。驚くべきことに、mLN中のプラスミド組織リザーバーは、ガラクチトールを添加したグループでのみ形成された(図6E)。全体として、これらのデータから、ガラクチトールの補充は2つのS.Tm株の共存を促進し、抗生物質耐性プラスミドの拡散を促進し、微生物叢が無傷のマウスにおいてプラスミド・リザーバーの形成を促進することが明らかになった。
考察
サルモネラ症モデルマウスを用いて、マウス腸内における抗生物質耐性プラスミドの移行は、レシピエント株がガラクチトールという異なる炭素源を独占的に利用することによって促進されることを示した。抗生物質で前処理したマウスに、遺伝的には異なるが近縁の2種類のサルモネラ菌を感染させると、ガラクチトールの利用に関与する遺伝子に起因する遺伝的差異により、腸管内腔で高いプラスミド移行が起こる(図1、2、3、4、5、6)。飲料水中にこの炭素源を補充すると、常在細菌叢を持つマウスであっても、この糖を利用できない高度にコロニー形成するドナー株を前にして、レシピエント株および/またはトランスコンジュガントの数が非常に少ない状態から拡大する(図4、5、6)。したがって本研究は、哺乳類の腸内におけるサルモネラ菌集団間の抗生物質耐性プラスミドの移行が、菌株レベルの違いによって、共存が可能になるだけでなく、促進されることを示す概念的な例となる。我々の発見は、プラスミドが一つの腸内で数を増やすだけでなく、同時に代謝レパートリーの拡大を通じて(すなわち、代謝能力がわずかに異なる別の宿主に移行することによって)、将来的にコロニー形成する腸の範囲を広げる重要なメカニズムを実証している。
今回の発見は、腸内で利用可能な炭素源の利用における株レベルの違いが、同一種の株間におけるニッチ分離を説明しうるという、増加しつつある証拠に追加されるものである。我々は、コロニー形成抵抗性の程度が異なる様々なモデルマウスを用いて得られた知見が、Rolf Freterのニッチ排除仮説を支持するものであることを提唱する。
7
,
8
この仮説は、病原体が腸内で開花できるかどうかは、常在細菌叢の存在下で適切なニッチを見つけられるかどうかにかかっているとするものである。特に最近の報告では、他のニッチが複雑な微生物叢によって占有されている状況において、常在性大腸菌によるガラクチトールの利用がサルモネラ菌に対するコロニー形成抵抗性をもたらすことが立証されている10。
10
今回の知見はこの報告と一致しており、菌株レベルでは、代謝の多様性がブルームの併発を促進し、それによって同一種の異なる菌株間での抗生物質耐性プラスミドの移行を促進する可能性があることを強調することで、ニッチ排除仮説を拡張するものである。今回の発見は、S.Tmの2株と大腸菌の1株に限定されたものであるが、腸内細菌による腸内コロニー形成のこれまで過小評価されてきた特徴を浮き彫りにするものである。すなわち、腸内細菌はコアゲノムの多様性とは別に、菌株レベルでの代謝能力の多様性(すなわち、アクセサリーゲノムのレベルでの多様性)を特徴とし、それによってユニークなニッチを占めることができるのではないかということである。我々は、複数の菌株の共存を可能にするメカニズムが進化的に好まれ、腸内細菌科のメンバーにおける菌株レベルの違いを説明できるのではないかと推測している。炭素源の利用に関して言えば、2つの菌株が同じニッチを競合するようなシナリオにおいて、腸内へのコロニー形成を効率的に促進するような菌株間の違いが存在するかもしれない。腸内病原体間のこのような株レベルの違いをさらに研究することで、共存とプラスミド転移の両方を可能にするメカニズムをより深く理解することができると考えている。
この研究では、ガラクチトールまたはアラビノースという単一の排他的炭素源を補充するだけで、あるS.Tm株は、この栄養素を利用できない同一株(過剰)の存在下でも増殖することができた(図4およびS6)。しかし、アラビノースやガラクチトールの何がそんなに特別なのだろうか?アラビノースポリマーは植物性食品に豊富に含まれ、微生物叢依存的分解またはサルモネラ菌にコードされたアラビノフラニダーゼによって利用可能になる。
36
,
41
ガラクチトールはいくつかの植物に存在し、ガラクトースの酸化によって生成される。
30
,
42
サルモネラ属菌によるガラクチトール利用経路は、すでに試験管内で明らかにされており、また他の研究では、サルモネラ属菌が植物性飼料を与えたマウスにおいて、微生物由来の産物に反応してガラクチトールオペロンを誘導することが強調されている。
30
,
31
このことは、S.Tmのこの炭素源の利用が、近縁種の存在によって影響を受けることを示している。さらに最近の発表では、常在性大腸菌がこの糖アルコールの利用を状況依存的に制限し、それによってサルモネラのコロニー形成を防ぐことが実証された。
10
この研究結果は、腸内細菌科における代謝の多様性を浮き彫りにし、摂取される栄養素の構成だけでなく、微生物の状況に応じて多様な代謝戦略が作用する可能性があるという議論を支持するものである。全体として、この先行研究と今回の研究から、異なる菌株のアクセサリーゲノムにコードされた代謝能力は、共同繁殖を促進し、近縁の別の菌株がすでにコロニー形成している腸内で特定の菌株の増殖を可能にすることで遺伝子の水平伝播を促進するため、有利である可能性が示唆される。関連する栄養素は、特定の条件下でのみ利用可能かもしれない。例えば、Eberlらは、OligoMM12微生物叢のどのメンバーもガラクチトールを利用できないことを報告している。このことは、マウスの腸管内腔における腸内細菌科細菌の増殖において、ガラクチトールが文脈依存的に機能していることを示している。
10
さらに、Gordo研究室の宿主内進化研究では、大腸菌のgat経路が突然変異のホットスポットであり、このオペロンが微生物叢の構成やマウス腸内の別の大腸菌株の有無によって、有益な効果もあれば成長阻害の効果もあることが示された。
43
,
44
我々の研究では、いずれの菌株に対してもガラクチトールの増殖抑制効果は観察されなかったことから、異なる制御機構または競合機構が働いている可能性が示唆される。ガラクチトールの状況特異的な役割を解明し、腸内細菌科細菌の共存と菌株進化における、異なる炭素源の利用における菌株特異的な違いの役割を完全に確立するためには、さらなる研究が必要である。
ここ数十年の間に、サルモネラ菌や腸管病原性大腸菌などの腸内病原菌の増殖を抑制するために、常在性大腸菌(例えば、E. coli Nissle 1917)株を利用する研究が盛んに行われた35。
35
,
45
このような研究の背景にある考え方は、同系列の菌株は腸内で同様の代謝ニッチを占める可能性が高く、そのため同系列または近縁の分類群に属する侵入病原性種と競合する(あるいはそれに対するコロニー形成抵抗性を示す)可能性があるというものである。我々の発見は、炭素源の利用(例えば、ガラクチトールの利用)における株特異的なミスマッチが、近縁の競合株の存在下で病原体の増殖を可能にするのに十分であることを強調している。これらの考察に基づき、微生物叢に基づく治療法は、これらの代替経路に焦点を当てることで恩恵を受ける可能性があることを提案する。ある病原体株のこのような戦略を系統的にマッピングすることで、理想的な競合株を同定したり、病原体が利用可能なすべての炭素源を枯渇させる競合株の混合を提案したり、食品中のそれぞれの炭素源を減らすことで病原体の増殖を制限する食品ベースの介入を採用したりすることができる。
我々の研究室では、宿主組織内でプラスミドのリザーバーとして機能しているサルモネラ菌が、腸管内腔で再播種することにより、実際に抗生物質を選択することなく、抗生物質耐性プラスミドの拡散を促進することを明らかにした13。
13
,
18
ここで我々は、腸管内腔がすでに別の腸内細菌科菌株によってコロニー形成されている場合、再び栄養生長して腸管内腔に再播種した少数の持続性細胞が、腸管内でどのように増殖し、共増殖するのかを示すことができた。これらの結果は、パーシスターを介した抗生物質耐性プラスミドの拡散は、これらの菌株がコ・ブルームできる場合にのみ効率的であることを示している。
最後に、菌株レベルの違いが、同じ腸内で2つの病原体集団の共存を可能にするなど、非常に顕著な結果を説明できることを示した。我々は、微生物叢のメンバーについても同じことが言えるのではないかと提案している。現在、微生物叢の研究のほとんどは、属レベルではないにしても、最大でも種レベルの違いに焦点を当てており、そのような分類学的レベルではシフトが見られなかったため、観察された現象は微生物叢によるものではないと結論付けている報告が多い。私たちの発見は、他の微生物叢のメンバーにも適用できるかもしれない。そこでは、ファミリーの菌株レベルでの変化が、著しい代謝の変化を説明することができ、これは菌株の共存に影響を与えるだけでなく、宿主の生理学にも大きな影響を与える可能性がある。従って、菌株レベルでの変化を検出する技術は、肥満、メタボリックシンドローム、炎症性腸疾患、腸脳軸の研究など、微生物に関連する現象を扱う研究にとって大きな利益をもたらす可能性がある。
STAR★メソッド
主要リソース表
REAGENT or RESOURCEIDENTIFIERBacterial and Virus strainsSee Table S2N/ACritical commercial assaysPhusion™ Plus DNA PolymeraseThermoFisher ScientificF630LQIAquick PCR Purification KitQiagen28104実験モデル: マウス OligoMM12マウス(C57BL/6遺伝的背景)Brugiroux et al.
9
https://doi.org/10.1038/nmicrobiol.2016.215Mouse: 129SvEv SPFJackson Laboratories; ETH Zurich, SwitzerlandのEPICマウス施設で繁殖されたN/AMouse: C57BL/6 SPFJackson Laboratories; スイス連邦工科大学チューリッヒ校EPICマウス施設にて繁殖N/AMouse: N/AMouse: C57BL/6 Germ-freeJackson Laboratories; ETH Zurich, SwitzerlandのEPICマウス施設で繁殖N/AMouse: 129SvEv High-fat diet shiftWotzka et al.
35
https://doi.org/10.1038/s41564-019-0568-5OligonucleotidesSee表S3N/ARecombinant DN表S4N/ASoftware and algorithmsGraphpad Prism Version 9.0 for WindowsGraphPad Software, La Jolla California USAHome - GraphPadArtemis Comparison ToolACT, Wellcome Sanger Institute, Cambridge, UKhttps://www.sanger.ac.uk/science/tools/artemis-comparison-tool-act
新しいタブで表を開く
リソースの有無
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるWolf-Dietrich Hardt (hardt@micro.biol.ethz.ch)までお願いします。
材料の入手可能性
本研究で使用するマウス系統はJackson laboratoriesから入手できる。グノトビオティックマウスは要望に応じて入手可能である。
実験モデルと研究参加者の詳細
細菌株および培養条件
本試験で使用した菌株は、S.Tm SL1344
24
またはS.Tm ATCC14028の誘導体である、
25
E. coli K12、
46
または大腸菌536
13
大腸菌536, 13を用いた。これらの細菌株を培養するために、適切な抗生物質(50μg/mlストレプトマイシン(AppliChem社製);50μg/mlカナマイシン(AppliChem社製);15μg/mlクロラムフェニコール(AppliChem社製);100μg/mlアンピシリン(AppliChem社製))を含むライソジェニーブロス(LB)培地を37℃(pCP20を含む場合は30℃)で使用した。P22 HT105/1 int-201 ファージ導入は、S.Tm 株の遺伝子改変コンストラクト(遺伝子欠失、中 性同型配列タグ、P3 プラスミドなど)の作製に使用した。
47
遺伝子欠失変異体の作製や抗生物質耐性タグの導入には、Datsenko et al.
48
必要であれば、pCP20にコードされる温度誘導性FLPリコンビナーゼを用いて抗生物質耐性カセットを除去した。
48
欠失および菌株の遺伝子型の確認に使用したプライマーは、key resources tableに記載されている。耐性付与や株構築に使用した細菌プラスミドはエレクトロポレーション法で細胞に形質転換し、key resources tableに記載した。
マウス系統
実験は8-12週齢の雄または雌マウスを用いて行った。サンプルサイズはあらかじめ決めておらず、マウスは無作為に群に割り付けた。すべてのマウスはJackson laboratoriesから入手したC57BL/6または129SvEvブリーダーに由来する。正常な複合微生物叢を持つマウスは、特定病原体フリー(SPF)であり、スイス連邦工科大学チューリッヒ校のEPICマウス施設内の個別換気ケージシステムで完全バリア条件下で飼育された。無菌C57BL/6マウスは、スイス連邦工科大学チューリッヒ校EPICマウス施設のアイソレーター設備で、微生物汚染を厳密に排除したフレキシブルフィルムアイソレーター内で飼育した。OligoMM12マウスは、代表的な12種類の微生物株からなる定義された微生物叢で安定的にコロニー形成された元無菌マウスである。
9
スイス連邦工科大学チューリッヒ校のEPICマウス施設のアイソレーター施設において、微生物汚染を厳密に排除したフレキシブルフィルムアイソレーターで飼育された。
すべての研究は倫理的および法的要件に従って実施され、ZH193/2016、ZH158/2019、ZH108/2022、およびZH109/2022のライセンスに基づき、Kantonales Veterinäramt Zürichの審査および承認を受けた。
方法の詳細
菌株の構築
ラムダレッドを用いたデノボ変異株の調製
新規シングルジーンノックアウト株をλ-redシングルステッププロトコルを用いて調製した。
48
この方法では、目的の遺伝子の代わりに抗生物質耐性カセットを導入する。まず、約40bpの遺伝子フランキング領域と20bpの目的の抗生物質耐性カセットからなるプライマーを構築した(key resources table)。次に、クロラムフェニコール用プラスミドpKD3およびカナマイシン用プラスミドpKD4を用いて、目的の遺伝子のフランキング領域に挟まれた抗生物質耐性カセットを含むDNAコンストラクトを作製した。コンストラクトの作製にはPhusion高忠実度DNAポリメラーゼを用い、PCR産物はQiagen DNA精製キットを用いて精製した。コンピテントセルの高濃度溶液を作るため、λ-redファージを保有するpKD46プラスミドとアンピシリン耐性カセットを含む株を、10mMアラビノース(シグマアルドリッチ)を添加した50mLのLB-アンピシリン中で30℃で3時間培養し(プラスミドは37℃で消失する)、pKD46にコードされるファージ由来遺伝子を誘導した。細胞を洗浄し、氷冷H2O中で遠心分離と再懸濁を繰り返して濃縮した。精製したPCR産物5μLを1.8kV、5msのエレクトロポレーションで形質転換した。得られた細胞を37℃で1.5時間温LBで回収し、それぞれの抗生物質を含むLBプレートにプレーティングし、目的の遺伝子ノックアウトを持つコロニーを選択した。λ-redの誘導と変異株の調製は、ゲノムの他の場所に変異を引き起こす可能性があるため、元の変異株からP-22溶解液を調製し、その後、先祖株に変異を導入するために使用した。
インビトロでのトランスコンジュゲーション
結合プラスミドをある株から別の株に導入するために(例えば、pESBL15をS.Tm-BからS.Tm-A ΔP2へ)、両方の株をそれぞれの抗生物質とともにLB中で一晩培養した。それぞれ1mLを15000rpmで遠心し、1mLのPBSに再懸濁した。その後、両菌株をPBSで10-4に希釈し、それぞれ50μLを抗生物質無添加のLB 5mLに加え、37℃で一晩振盪培養した。連続希釈を行い、耐性表現型および/または色(すなわち、S.Tmはlac陰性であるためMacConkey寒天培地上で黄色のコロニーを形成するが、大腸菌はlac陽性であるため赤色のコロニーを形成する)によってトランスコンジュガントを選択した。
マウス感染
抗生物質で前処理したマウスを用いた感染実験は、S.Tm経口感染モデルとしてよく知られているStreptomycinマウスモデルに従って行った。
26
感染24時間前にストレプトマイシン25mgを経口投与し、0日目に5x107 CFUのS.Tmを経口投与した。指示された時点で糞便を採取し、必要に応じて感染終了時に糞便組織とmLNを採取した。糞便組織のプレーティングには、組織をゲンタマイシンで処理して細胞外細菌を除去するゲンタマイシン保護アッセイを用いた。盲腸組織を縦に切り、PBSで素早く洗浄し(3倍)、PBS/400μg/mlゲンタマイシン(Sigma-Aldrich)で45〜75分間インキュベートした。プレーティングのために、サンプルは組織溶解器(Qiagen)でスチールボールを用いて25Hzの周波数で2分間ホモジナイズした(糞便組織は30Hzで3分間)。ホモジナイズしたサンプルをPBSで希釈し、関連する抗生物質を添加したMacConkey(Oxoid)プレートにプレーティングし、37℃で一晩静置した。翌日コロニーを数え、CFU / g含量で表した。正規化競合指数(C.I.)は、糞便中の野生型と変異型の比として算出し、接種時の初期比に対して正規化した。
In vivoプラスミド導入アッセイ
創始者効果を模倣するために接種液を調製した。ストレプトマイシン前処理マウスモデルにおいて、近縁株のバックグラウンドで不利な条件から開花する株の能力を調べ、抗生物質耐性プラスミドの転移を評価するために、研究する株を2株では1000:1、3株では1000:1:1の割合で接種片に配合した(図1、2、3、4、5)。マウスの非同胞感染(図6)では、10:1(ドナー:レシピエント)の割合で接種した。
マウス感染では、感染の2日前にグリセロールストックからマッコンキープレートに菌株をストリークした。感染の1日前に健康なコロニーを採取し、適切な抗生物質を添加したLB/0.3M NaCl(Sigma-Aldrich)で一晩培養した(約12時間)。感染当日、抗生物質無添加の同じ培地で4時間1:20の継代培養を行った。S.Tmを1回洗浄し、冷PBSで再構成した後、各菌株の最終濃度が5x107 CFU S.Tmとなるように、冷PBSでさらに希釈した。トランス共役株、レシピエントとトランス共役株、およびドナーの数を決定するために、糞便サンプルをホモジナイズし、それぞれの抗生物質耐性を持つマッコンキープレートにプレーティングした。
ガラクチトールの補充
マウスの維持食餌を変えることなくガラクチトールを補充するために、ガラクチトールを0.1%と1%の濃度でマウスの飲料水に添加した過去の実験に依拠した。
44
この目的のために、0.25gまたは2.5gのガラクチトール(Sigma-Aldrich)を250mLの水道水に添加し、0.22μmのフィルター(TPP AG)でろ過して滅菌した。感染1日前にマウスの飲料水をガラクチトール水に交換し、感染期間中維持した。
アラビノースの補給
2.5gのL-アラビノース(Sigma-Aldrich)を250mLの水道水に添加し、0.22μmのフィルターでろ過して滅菌した。マウスの飲料水は感染の1日前に1%アラビノース含有水に交換し、感染期間中維持した。
サルモネラ2株のゲノム比較
S.Tm-AとS.Tm-Bの全ゲノムをBLASTで比較し、Artemis Comparison Tool (ACT; https://www.sanger.ac.uk/science/tools/artemis-comparison-tool-act)で可視化/解析した。染色体(SL1344染色体 NCBI accession FQ312003.1; 14028S染色体 NCBI accession NC_016856.1)およびプラスミド(SL1344 pSLTプラスミド NCBI accession HE654724.1; 14028S pSLTプラスミド NCBI accession CP001362.1)の比較にはローカルBLASTを使用し、ACTで可視化するためのクランチファイル(megablast, E-value filter = 1)を生成した。ACTのスコア10000を相同領域の最小カットオフ値とした。非重複領域内の遺伝子のアノテーションにはNCBIのアノテーションを使用した(表S1)。14028SではなくS1344で見つかったプラスミドはDNAplotterを用いて可視化した(https://www.sanger.ac.uk/tool/dnaplotter/; pCol1b9 aka P2 NCBI accession HE654725.1; pRSF1010 aka P3 NCBI accesssion HE654726.1)。
定量と統計解析
統計解析
該当する場合、両側Mann Whitney-U検定を用いて統計的有意性を評価した。統計検定にはGraphPad Prism 9 for Windowsを用いた。p≧0.05は有意ではない(ns)、p<0.05(*)、p<0.01(**)、p<0.001(**)、p<0.0001(****)。
データとコードの利用可能性
本論文で報告されたデータの再分析に必要な追加情報は、要望に応じて主担当者から入手可能である。
謝辞
有益な議論をしてくれたHardt研究室のメンバー、特にYassine Cherrakに感謝したい。チューリッヒ工科大学マウス施設EPIC/RCHCIのスタッフ(Manuela Graf、Katharina Holzinger、Dennis Mollenhauer、Sven Nowok、Dominik Bacovcin)および微生物学研究所に感謝する。ETH DBIOLブロックコースの学生Amelie Hattori、Abigail Dustour、Dominic Mailänderの貢献に感謝する。本研究は、スイス国立科学財団(NRP 72 407240_167121、310030B_173338、310030_192567)、スイス国立科学財団の助成によるNCCRマイクロバイオーム、ゲーベルト・リュフ財団(GRS-060/18)、モニク・ドルノン・ヴィル・ド・ラ・クール財団からW.-D.H.への助成を受けている。
著者貢献
E.G.とW.-D.H.がプロジェクトを発案し、実験をデザインした。E.G.、A.A.Y.、C.D.、J.H.はマウス実験を行い、データを解析した。E.B.は系統ゲノムの比較を行い、E.B.、E.G.、J.H.、B.D.N.、A.A.Y.、C.D.は変異株の作製と解析を行った。E.G.は原稿の初稿を執筆した。E.G.、L.M.、E.B.、A.A.Y.、W.-D.H.が原稿を見直し、最終形に編集した。著者全員が本原稿を読み、コメントし、承認した。
利害関係
著者らは、競合する利益はないと宣言している。
インクルージョンと多様性
我々は、包括的で多様性があり、公平な研究実施を支持する。
補足情報
pdfダウンロード(.87 MB)
pdfファイルのヘルプ
資料S1. 図S1-S5
ダウンロード .xlsx (.02 MB)
xlsxファイルのヘルプ
表S1. 図2に関連する、S.Tm-A(SL1344)とS.Tm-B(ATCC14028)で差次的に見つかった遺伝子
ダウンロード.xlsx (.01 MB)
xlsxファイルのヘルプ
表S2. 本研究で使用した細菌株(STAR Methods関連
ダウンロード .xlsx (.01 MB)
xlsxファイルのヘルプ
表S3. 本研究で使用したオリゴヌクレオチド、STAR Methods関連
ダウンロード .xlsx (.01 MB)
xlsxファイルのヘルプ
表S4. 本研究で使用したプラスミド、STAR Methods関連
参考文献
Zaman S.B.
Hussain M.A.
ナイ R.
Mehta V.
マムン K.T.
Hossain N.
抗生物質耐性に関するレビュー:警鐘が鳴っている。
Cureus. 2017; 9: e1403https://doi.org/10.7759/cureus.1403
記事で見る
PubMed
クロス
グーグル奨学生
ライト G.D.
抗生物質レジストーム:化学的多様性と遺伝的多様性の結びつき。
Nat. Rev. Microbiol. 2007; 5: 175-186https://doi.org/10.1038/nrmicro1614
論文で見る
日本農芸化学会誌 (923)
PubMed
クロス
グーグル奨学生
マクインズ R.S.
マッカラムG.E.
ランベルテL.E.
ヴァン・シャイクW.
ヒト腸内細菌叢における抗生物質耐性遺伝子の水平伝播。
Curr. Opin. Microbiol. 2020; 53: 35-43https://doi.org/10.1016/j.mib.2020.02.002
論文で見る
スコープス (124)
パブコメ
クロス
グーグル奨学生
ヴェントラ C.L.
抗生物質耐性の危機:パート1:原因と脅威。
P T. 2015; 40: 277-283
論文で見る
PubMed
グーグル奨学生
ペレイラ F.C.
ベリーD.
腸内の微生物栄養ニッチ。
環境。Microbiol. 2017; 19: 1366-1378https://doi.org/10.1111/1462-2920.13659
論文で見る
スコープス (180)
PubMed
クロス
グーグル奨学生
クロイツァー M.
ハードW.D.
腸内細菌に対するコロニー形成抵抗性に食物はどのように影響するか。
Annu. Rev. Microbiol. 2020; 74: 787-813https://doi.org/10.1146/annurev-micro-020420-013457
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
フレター R.
ブリックナーH.
ボットニーM.
クレヴェン D.
アランキA.
マウス大腸内細菌叢の連続流培養モデルにおける細菌集団制御機構。
Infect. Immun. 1983; 39: 676-685https://doi.org/10.1128/iai.39.2.676-685.1983
論文で見る
スコープス (206)
PubMed
クロス
グーグル奨学生
フレター R.
ブリックナーH.
フェケテJ.
ヴィッカーマン M.M.
キャリー K.E.
腸管における大腸菌の生存と着床。
Infect. Immun. 1983; 39: 686-703https://doi.org/10.1128/iai.39.2.686-703.1983
論文で見る
スコープス (186)
PubMed
クロス
グーグル奨学生
ブルジルーS.
ボイトラーM.
プファンC.
ガルゼッティ D.
ルシェウェイ H.J.
リング D.
ディール M.
ヘルプ S.
レッチャー Y.
フサイン S.
他
サルモネラ菌(Salmonella enterica serovar Typhimurium)に対するコロニー形成抵抗性を付与するマウスの微生物叢のゲノム誘導デザイン。
Nat. Microbiol. 2016; 2: 16215https://doi.org/10.1038/nmicrobiol.2016.215
論文で見る
スコープス (211)
PubMed
クロス
グーグル奨学生
エーベルC.
ヴァイスA.S.
ヨッフムL.M.
ドゥライ・ラージA.C.
リング D.
フサイン S.
ヘルプ S.
メン C.
クライグリューK.
ギグルM.
他
大腸菌はサルモネラ・チフス菌に対するコロニー形成抵抗性を、文脈依存的な制限炭素源であるガラクチトールの競合によって高める。
Cell Host Microbe. 2021; 29: 1680-1692.e7https://doi.org/10.1016/j.chom.2021.09.004
論文で見る
日本農芸化学会誌(18)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
フォスター-ニャル子E.
パレン M.J.
脊椎動物の腸内における大腸菌の微生物生態。
FEMS Microbiol. Rev. 2022; 46https://doi.org/10.1093/femsre/fuac008
論文で見る
スコパス (6)
PubMed
クロス
グーグル奨学生
マーティンソンJ.N.V.
ピンカム N.V.
ピーターズG.W.
Cho H.
Heng J.
ラウフ M.
ブロードウェイ S.C.
ウォーク S.T.
健康なヒト成人における腸内細菌叢の残存と腸内細菌科の再考。
ISME J. 2019; 13: 2306-2318https://doi.org/10.1038/s41396-019-0435-7
論文で見る
スコープス(60)
PubMed
Crossref
グーグル奨学生
バッケレンE.
ヘルターJ.A.
ハイズマンJ.S.
シュタイガー Y.
ギュル E.
ニューソン J.P.M.
ブラフマン A.O.
ピエル J.
レゴーズ R.
ボンホーファー S.
他
病原体の侵入に依存した組織リザーバーとプラスミドにコードされた抗生物質の分解が、腸内でのプラスミドの拡散を促進する。
eLife. 2021; 10: e69744https://doi.org/10.7554/eLife.69744
記事で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
ヘンデル N.
オッテS.
ヨンカー M.
ブルル S.
ター・クイル B.H.
IncI1β-ラクタム耐性プラスミドpESBL-283の大腸菌株間移行に影響する因子。
PLoS One. 2015; 10: e0123039https://doi.org/10.1371/journal.pone.0123039
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
ラム L.H.
モナックD.M.
サルモネラ菌の持続感染において、腸管遠位部におけるニッチをめぐる種内競争が伝播を規定する。
PLoS Pathog. 2014; 10: e1004527https://doi.org/10.1371/journal.ppat.1004527
論文で見る
スコパス (55)
PubMed
クロス
グーグル奨学生
ソルバラ M.T.
パマー E.G.
コロニー形成抵抗性の細菌間メカニズムとそれを克服するために病原体が用いる戦略。
Mucosal Immunol. 2019; 12: 1-9https://doi.org/10.1038/s41385-018-0053-0
論文で見る
スコープス(125)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ウォツカ S.Y.
クロイツァー M.
マイアー L.
Zünd M.
シュルンベルジェ M.
グエン B.
フォックス M.
ポール D.
ハインリッヒ H.
ログラーG.
他。
ラクチュロース単回投与チャレンジ後の健常人における微生物叢の安定性-ランダム化比較試験。
PLoS One. 2018; 13: e0206214https://doi.org/10.1371/journal.pone.0206214
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
バッケレンE.
ハイズマンJ.S.
ファッティンガー S.A.
ハウズマン A.
ファーター M.
エグリ A.
スラック E.
セリン M.E.
ボンホーファー S.
レゴーズR.R.
他
サルモネラ菌が腸内で抗生物質耐性プラスミドの拡散を促進する。
Nature. 2019; 573: 276-280https://doi.org/10.1038/s41586-019-1521-8
記事で見る
スコープス (113)
PubMed
クロス
グーグル奨学生
レオン-サンペドロR.
デラフエンテJ.
ディアス-アゲロC.
クレレンT.
ムジチャ P.
ロドリゲス=ベルトラン J.
デ・ラ・ベガ C.
エルナンデス=ガルシア M.
ロペス-フレスネーニャN.
他
R-GNOSIS WP5研究グループ
入院患者の腸内細菌叢におけるカルバペネム耐性プラスミドの広範な伝播。
Nat. Microbiol. 2021; 6: 606-616https://doi.org/10.1038/s41564-021-00879-y
論文で見る
スコープス (41)
PubMed
クロス
グーグル奨学生
サン・ロマンB.
ガリード V.
サンチェス S.
マルティネス-バジェステロスI.
ガライサール J.
マイナル-ハイメR.C.
ミグラ-ガルシアL.
グリロ M.J.
低中等度流行地域における肥育豚のサルモネラ感染、排出および血清学的検査との関係。
Zoonoses Public Health. 2018; 65: 481-489https://doi.org/10.1111/zph.12453
記事で見る
スコープス (11)
PubMed
クロス
グーグル奨学生
テナイヨンO.
スクルニクD.
ピカールB.
デナムール E.
常在性大腸菌の集団遺伝学。
Nat. Rev. Microbiol. 2010; 8: 207-217https://doi.org/10.1038/nrmicro2298
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ハドルストン J.R.
ヒト消化管における遺伝子の水平伝播:抗生物質耐性遺伝子の拡散の可能性。
Infect. Drug Resist. 2014; 7: 167-176https://doi.org/10.2147/IDR.S48820
記事で見る
スコープス (322)
PubMed
クロス
グーグル奨学生
シュテッヒャーB.
デンツラーR.
マイアーL.
ベルネットF.
サンダース M.J.
ピカード D.J.
バルテル M.
ウェステンドルフ A.M.
クログフェルト K.A.
ウォーカーA.W.
他
腸の炎症は、病原性腸内細菌科細菌と常在細菌科細菌間の水平遺伝子移動を促進する。
Proc. Natl. Acad. Sci. USA. 2012; 109: 1269-1274https://doi.org/10.1073/pnas.1113246109
論文で見る
スコープス (302)
PubMed
クロス
グーグル奨学生
ホイセス S.K.
ストッカーB.A.D.
芳香族依存性サルモネラ・チフス菌は非病原性で生ワクチンとして有効である。
Nature. 1981; 291: 238-239https://doi.org/10.1038/291238a0
記事で見る
日本
PubMed
クロス
グーグル奨学生
ヤルヴィックT.
スミリーC.
グロイスマンE.A.
オッシュマン H.
Salmonella Enterica serovar Typhimurium 14028ゲノムにおける進化的変化の短期的特徴。
J. Bacteriol. 2010; 192: 560-567https://doi.org/10.1128/JB.01233-09
論文で見る
スコープス (154)
PubMed
クロス
グーグル奨学生
バルテル M.
ハプフェルマイヤーS.
キンタニージャ-マルティネスL.
クレマー M.
ローデ M.
ホガード M.
プフェッファー K.
リュスマン H.
Hardt W.D.
マウスをストレプトマイシンで前処理することで、病原体と宿主の両方を解析できるSalmonella enterica serovar Typhimurium大腸炎モデルが得られる。
Infect. Immun. 2003; 71: 2839-2858https://doi.org/10.1128/IAI.71.5.2839-2858.2003
論文で見る
日本
PubMed
クロス
グーグル奨学生
ローリーT.D.
ブーリーD.M.
ホイ Y.E.
ゲルケ C.
レルマンD.A.
モナックD.M.
Salmonella Enterica serovar Typhimuriumの宿主伝播は病原因子と常在腸内細菌叢によって制御されている。
Infect. Immun. 2008; 76: 403-416https://doi.org/10.1128/IAI.01189-07
論文で見る
日本
PubMed
クロス
グーグル奨学生
ウィンター S.E.
ウィンター M.G.
ザビエルM.N.
ティエンニミットルP.
プーン V.
キーストラ A.M.
ラフリン R.C.
ゴメス G.
ウー J.
ローホン S.D.
他
宿主由来の硝酸塩が、炎症を起こした腸内で大腸菌の増殖を促進する。
Science. 2013; 339: 708-711https://doi.org/10.1126/science.1232467
記事で見る
スコパス (622)
PubMed
クロス
グーグル奨学生
チューディン・スッター S.
フライR.
シュワーンF.
トミック M.
コンツェルマン M.
シュトランデン A.
ウィドマーA.
広域β-ラクタマーゼ産生大腸菌に対する接触予防策中止の前向き検証。
Emerging Infect. Dis. j. 2016; 22: 1094-1097https://doi.org/10.3201/eid2206.150554
論文で見る
スコープス (25)
PubMed
クロス
グーグル奨学生
ノールN.
フェルスルA.
Heermann R.
フックス T.M.
Salmonella Enterica serovar Typhimuriumのガラクチトール利用経路の遺伝学的特性解析。
J. Bacteriol. 2017; 199 (e00595-00516)https://doi.org/10.1128/JB.00595-16
論文で見る
スコープス (16)
PubMed
クロス
グーグル奨学生
プラックス N.
ワグナー S.
シャルトJ.
ノイハウス K.
クラベル T.
フックス T.M.
食餌特異的な微生物叢がサルモネラ・チフス菌を植物由来の基質に生体内で適応させる。
Anim. Microbiome. 2021; 3: 24https://doi.org/10.1186/s42523-021-00082-8
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
オリベイラ R.A.
ン K.M.
コレイア M.B.
カブラル V.
Shi H.
ソネンバーグ J.L.
ホアン・K.C.
ザビエル K.B.
Klebsiella michiganensisの伝播は、栄養競合によって腸内細菌科細菌の腸内侵入に対する抵抗性を増強する。
Nat. Microbiol. 2020; 5: 630-641https://doi.org/10.1038/s41564-019-0658-4
論文で見る
スコープス (42)
PubMed
クロス
グーグル奨学生
He Y.
ヤン Y.
Dong Y.
Ito K.
Zhang B.
高栄養価飼料はブロイラー鶏の腸内細菌叢と形態を改善することによりサルモネラ・チフスムリウム感染に抵抗性を示す。
Poult. Sci. 2020; 99: 7055-7065https://doi.org/10.1016/j.psj.2020.09.073
論文で見る
Scopus (16)
PubMed
クロス
グーグル奨学生
Yoo W.
ジーバ J.K.
フォージングN.J.
トーレス T.P.
シェルトン C.D.
シーリー N.G.
バインドロス A.J.
セバロス S.A.
ガーツ E.
ティファニーC.R.
他
高脂肪食による結腸細胞の機能障害は、微生物由来のトリメチルアミンN-オキシドをエスカレートさせる。
Science. 2021; 373: 813-818https://doi.org/10.1126/science.aba3683
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ウォツカ S.Y.
クロイツァーM.
マイアーL.
アルノルディーニ M.
グエン B.D.
ブラフマン A.O.
ベルトルド D.L.
Zünd M.
ハウズマン A.
バッケレンE.
他
大腸菌は、マウスにおける食餌シフトと脂肪を介した微生物叢の摂動後にサルモネラ・チフスムリウム感染を制限する。
Nat. Microbiol. 2019; 4: 2164-2174https://doi.org/10.1038/s41564-019-0568-5
論文で見る
スコパス (51)
PubMed
クロス
グーグル奨学生
ラドル S.J.
マシスL.M.
カッターA.C.
モナックD.M.
サルモネラ菌が解放した食餌性L-アラビノースは、スーパースプレッダーにおける増殖を促進する。
Cell Host Microbe. 2023; 31 (405.e5–417.e5)https://doi.org/10.1016/j.chom.2023.01.017
記事で見る
麹菌 (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ヴァシチェックE.M.
オニールL.
パルセック M.R.
フィッチJ.
ホワイト P.
ガン J.S.
サルモネラ菌におけるL-アラビノースの輸送と代謝は、バイオフィルム形成に影響を及ぼす。
Front. Cell. Infect. Microbiol. 2021; 11: 698146https://doi.org/10.3389/fcimb.2021.698146
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
Brzuszkiewicz E.
ブリュッゲマンH.
リーゼガングH.
エマースM.
Ölschläger T.
ナギー G.
アルベルマン K.
ワグナー C.
ブッフリーザー C.
Emődy L.
他。
泌尿器病原体になる方法:腸管外病原性大腸菌株の比較ゲノム解析。
Proc. Natl. Acad. Sci. USA. 2006; 103: 12879-12884https://doi.org/10.1073/pnas.0603038103
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ガライニ M.
マグナン M.
ディオン S.
Zatout O.
ブールギニョンL.
テネイヨン O.
レスキャット M.
母体感染後にコロニー形成されたマウス腸内における大腸菌536の長期進化から、ラクトースオペロンの構成的発現における収束が明らかになった。
Mol. Ecol. 2019; 28: 4470-4485https://doi.org/10.1111/mec.15232
論文で見る
スコープス (10)
PubMed
クロス
グーグル奨学生
バッケレンE.
ディアード M.
ハードW.D.
細菌の抗生物質持続性の進化的原因と結果。
Nat. Rev. Microbiol. 2020; 18: 479-490https://doi.org/10.1038/s41579-020-0378-z
論文で見る
スコープス (85)
PubMed
クロス
グーグル奨学生
マルテンス E.C.
ロウ E.C.
チェン・エイチ
プードロ N.A.
ウー M.
マクナルティ N.P.
アボット D.W.
ヘンリサット B.
ギルバート・H.J.
ボラムD.N.
他
2種類のヒト腸内共生生物による植物細胞壁多糖の認識と分解。
PLoS Biol. 2011; 9: e1001221https://doi.org/10.1371/journal.pbio.1001221
論文で見る
スコパス(540)
PubMed
クロス
グーグル奨学生
フォン S.Y.
ヘレバウト W.M.
Yponomeuta属植物の宿主であるアオイ科およびバラ科植物におけるソルビトールとダルシトール。
Biochem. Syst. Ecol. 1988; 16: 191-194https://doi.org/10.1016/0305-1978(88)90095-6
論文で見る
スコパス (11)
クロスリファレンス
グーグル学者
バローゾ-バティスタJ.
ソウザ A.
ルーレンソ M.
バーグマン M.L.
ソブラル D.
デメンゲオ J.
ザビエル K.B.
ゴルド I.
大腸菌の腸内適応の第一歩はソフトスイープが支配的である。
PLoS Genet. 2014; 10: e1004182https://doi.org/10.1371/journal.pgen.1004182
論文で見る
スコープス (114)
PubMed
クロス
グーグル奨学生
ソウザ A.
ラミロ R.S.
バローゾ-バティスタJ.
ギュレシ D.
ルーレンソ M.
ゴルド I.
常在腸内細菌における強いボトルネック後も、再帰的逆進化が多型性を維持する。
Mol. Biol. Evol. 2017; 34: 2879-2892https://doi.org/10.1093/molbev/msx221
論文で見る
スコパス (23)
PubMed
クロス
グーグル奨学生
シェラックP.
クレタ S.
テディン K.
バビラ J.T.
オズワルド S.
オエルシュレーガー T.A.
ハイマンR.
ペッツォルト S.
ヴィーラー L.H.
大腸菌ニッスル1917はサルモネラのブタ腸管上皮細胞への接着に影響を与える。
PLoS One. 2011; 6: e14712https://doi.org/10.1371/journal.pone.0014712
論文で見る
スコープス (43)
PubMed
クロス
グーグル奨学生
ブラットナー F.R.
プランケットG.
ブロッホC.A.
ペルナ N.T.
バーランド V.
ライリー M.
コラド=ビデス J.
グラスナー J.D.
ローデ C.K.
メイヒュー G.F.
他
大腸菌K-12の全ゲノム配列。
Science. 1997; 277: 1453-1462https://doi.org/10.1126/science.277.5331.1453
記事で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
スタンバーグ N.L.
マウラーR.
大腸菌およびサルモネラ・チフス菌におけるバクテリオファージを介した汎化形質導入。
Methods Enzymol. 1991; 204: 18-43https://doi.org/10.1016/0076-6879(91)04004-8
論文で見る
(183件)
PubMed
クロス
グーグル奨学生
ダツェンコ K.A.
ワナー B.L.
PCR産物を用いた大腸菌K-12の染色体遺伝子の一段階不活化
Proc. Natl. Acad. Sci. USA. 2000; 97: 6640-6645https://doi.org/10.1073/pnas.120163297
論文で見る
スコープス (11362)
PubMed
クロス
グーグル奨学生
論文情報
出版履歴
出版 2023年6月21日
受理 受理:2023年5月26日
改訂版受理 2023年4月12日
受理:2023年4月12日 2022年12月22日
識別
DOI: https://doi.org/10.1016/j.chom.2023.05.029
著作権
© 2023 The Author(s). 発行:エルゼビア社
ライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)
再利用方法
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
図表
グラフィカルアブストラクト
図12つの異なるS.Tm株をマウスに感染させると、プラスミドの転移が多くなる。
図2S.Tm-AとS.Tm-Bは炭素源を利用する代謝能力が異なる。
図3ガラクチトールという異なる糖を利用する能力により、S.Tm-Aは過剰なS.Tm-Bの存在下でもマウスの腸内にコロニーを形成することができる。
図4一方の株のみが利用できる異なる炭素源を補充することで、マウスの腸内で2つの同種のS.Tm株を共存させることができる。
図5ストレプトマイシン前処理マウスにおいて、S.Tm-A株とS.Tm-B株、または大腸菌とS.Tm-A株との間でプラスミドの移行を促進する糖の利用。
図6ガラクチトールの補充は、微生物叢が乱れていないマウスにおいてプラスミドの転移と組織リザーバーの形成を促進する。
関連記事
このサイトのコンテンツは、あらゆる科学分野の医療従事者および研究者を対象としています。
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポーツ・メソッド
セルレポート 物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
免疫
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
EBioMedicine
HGGアドバンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleusコレクション
スナップショット・アーカイブ
ジャーナルを超えて
セルキャリアネットワーク
セルメンター
細胞シンポジウム
ラボリンク
ウェビナー
記事を進化させる
コミュニティ・レビュー
図360
スニークピーク
STARメソッド
社会における科学
セル・ピクチャー・ショー
セルプレスポッドキャスト
セルプレスビデオ
ぬりえ&コミック
リサーチ・アーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版アラート
アクセス
購読申し込み
今すぐ読む
司書に薦める
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
利用規約
プライバシーポリシー
アクセシビリティ
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
著作権 © 2023 Elsevier Inc.第三者が提供する一部のコンテンツを除く。
この記事が気に入ったらサポートをしてみませんか?
