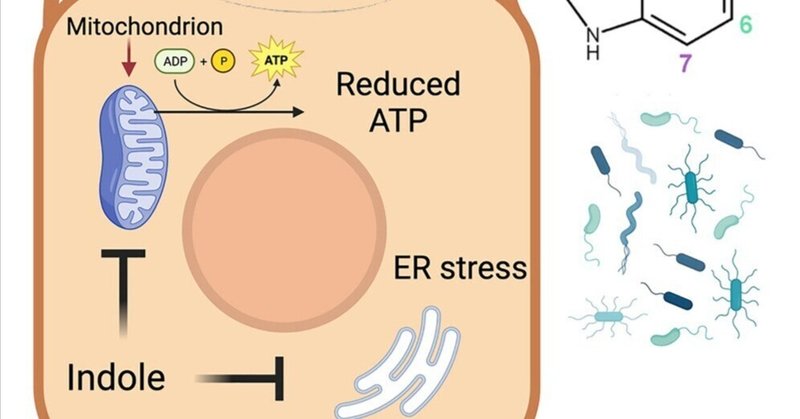
微生物叢が産生するインドール代謝物はミトコンドリア機能を破壊し、クリプトスポリジウム・パルバムの増殖を阻害する
第42巻 第7号 2023年7月25日 112680号
論文
微生物叢が産生するインドール代謝物はミトコンドリア機能を破壊し、クリプトスポリジウム・パルバムの増殖を阻害する
著者リンク オーバーレイパネルを開くLisa J. Funkhouser-Jones 1 4 8, Rui Xu 1 8, Georgia Wilke 1 5, Yong Fu 1, Lawrence A. Schriefer 2, Heyde Makimaa 2, Rachel Rodgers 2, Elizabeth A. Kennedy 2, Kelli L. VanDussen 3 6, Thaddeus S. Stappenbeck 3 7, Megan T. Baldridge 2, L. David Sibley 1 9
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.celrep.2023.112680Get 権利と内容
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
微生物叢は原虫寄生体クリプトスポリジウムの感染に対して抵抗性を示す。
成体微生物叢が産生するインドール代謝物がin vitroでクリプトスポリジウムの増殖を阻害する
インドールは酸化的リン酸化を阻害し、宿主細胞のATPレベルを低下させる。
インドール類は寄生虫のミトソームを脱分極させ、生命維持機能を阻害する可能性が高い。
まとめ
クリプトスポリジウム症は、資源に乏しい環境における幼児の生命を脅かす下痢の主な原因である。クリプトスポリジウムの感受性に対する微生物の影響を調べるために、我々は85種類の微生物関連代謝産物をスクリーニングし、in vitroにおけるクリプトスポリジウムの増殖に対する影響を調べた。その結果、二次胆汁酸塩/酸類、ビタミンB6前駆体、インドールの3つの主要なクラスにおいて、8つの阻害性代謝産物が同定された。インドールによるC. parvumの増殖抑制は、宿主のアリール炭化水素受容体(AhR)経路には依存しない。その代わりに、処理によって宿主のミトコンドリア機能が障害され、細胞内の総ATPが減少し、また寄生虫のミトコンドリアが変性したミトソームの膜電位が直接低下する。インドールの経口投与、あるいはインドール産生菌による腸内細菌叢の再構成は、in vitroでの寄生虫のライフサイクルの進行を遅らせ、マウスにおけるC. parvum感染の重症度を軽減する。これらの知見を総合すると、微生物叢の代謝産物がミトコンドリア機能を障害し、クリプトスポリジウム感染に対するコロニー形成抵抗性に寄与していることが示される。

グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(176KB)
ダウンロード フルサイズ画像のダウンロード
前の記事
次の記事
キーワード
微生物代謝産物
代謝
インドール
微生物叢
粘膜感染
寄生虫学
アピコンプレックス寄生虫
ミトコンドリア
膜電位
ミトソーム
研究テーマ
CP: 微生物学
はじめに
クリプトスポリジウム症は、主にクリプトスポリジウム・ホミニス(Cryptosporidium hominis)またはC.パルバム(C.parvum)によってヒトに引き起こされ、健康な人では自己制限性の下痢、免疫不全患者、特にHIV/AIDS患者では重症の慢性下痢として現れる1。クリプトスポリジウムは世界中に寄生しているにもかかわらず2、世界腸管多施設共同研究(GEMS)により、クリプトスポリジウムが資源の乏しい国の乳幼児(0~24カ月)の中等度から重度の下痢の原因として、ロタウイルスに次いで2番目に多いことが予想外に明らかになるまで、クリプトスポリジウム症の真の世界的負担は過小評価されていた3,4,5。重要なことは、幼児におけるクリプトスポリジウム症は、重度の栄養不良、長期の発育阻害、および死亡のリスクも高めることである3,6,7。しかし、よく理解されていない理由により、同じ集団において、クリプトスポリジウム症の発生率は2歳以上の小児で劇的に低下する3,4。乳牛8、ブロイラー鶏9,10、マウス11,12を含む他の人獣共通宿主は、新生児期にはクリプトスポリジウムに非常に感染しやすいが、幼若期または成体期に感染した場合は比較的抵抗性である。免疫系の成熟はクリプトスポリジウム感染に対する抵抗性の発達において重要な要因であるが、13,14 発育初期の腸内細菌叢の組成と多様性の劇的な変化もまた、感染の発生率と重症度において極めて重要な役割を果たしている11,15,16。例えば、バングラデシュの乳幼児を対象としたある前向き研究では、クリプトスポリジウム症を発症した乳幼児の微生物叢は、感染しているが無症状の乳幼児の微生物叢よりも、下痢症状発症の1ヵ月前の方が多様性が低いことが判明している16。さらに、成体マウスを用いた研究では、抗生物質(Abx)治療または異食飼育のいずれかによって微生物叢が失われると、クリプトスポリジウム感染に対する感受性が急激に高まることが一貫して示されている15,17。
多様な微生物叢はクリプトスポリジウム症から身を守っているように見えるが、微生物叢がクリプトスポリジウム感染にメカニズムレベルでどのように影響しているかについてはほとんど知られていない。1つの可能性は、微生物叢が腸内病原体に反応する免疫系の素地を作ることである。実際、新生児マウスを用いたある研究では、ポリ(I:C)による腸管免疫反応の刺激によってCp負荷が減少することが観察されているが、これは腸内細菌叢が存在する場合に限られる18。この考え方の前例として、C. hominisまたは複数のCp株でチャレンジしたボランティアにおいて、糞便中のインドール濃度が高い(2.5 mM以上)、またはインドール産生菌が下痢の発症を予防したヒトチャレンジ研究がある19。さらに、先行研究では、アルギニンを食事から補給すると、一酸化窒素の産生を刺激することにより、栄養不良の新生児マウスにおけるCp感染の重症度が低下することも示されている20。
我々は以前、新生児におけるクリプトスポリジウム感受性の増加は、寄生虫の増殖を促進する初期腸内代謝産物の存在によって部分的に説明できると仮定した。寄生虫の増殖を阻害する細菌代謝産物には、宿主のミトコンドリア機能を低下させ、宿主細胞内の総ATPレベルを低下させ、in vitroおよびin vivoでの寄生虫の増殖を低下させるインドールを含む数種類が同定された。したがって、腸内のインドール濃度が高いと、宿主由来の必須栄養素を寄生虫から奪うか、寄生虫の主要な機能を阻害することにより、クリプトスポリジウムの負担が減少する可能性がある。
研究結果
微生物代謝物スクリーニングによるin vitroでのCp増殖阻害物質の同定
ヒト回腸腺がん細胞株(HCT-8)を用いて、成体マウス腸内細菌叢22に関連する85種類の代謝産物(表S1)をスクリーニングし、Cp感染に対する影響を調べた(図1A)。HCT-8細胞単層にCpオーシストと各代謝物を同時に添加し、各ウェル内の寄生虫と宿主細胞の数を自動画像ベースアッセイを用いて感染24時間後(hpi)に定量した11。これらの阻害代謝物には、インドールおよびその誘導体である4-ヒドロキシインドール(4HI)、3種類の二次胆汁酸またはその塩(デオキシコール酸、デオキシコール酸、リトコール酸)、および代謝活性型ビタミンB6であるピリドキサール-5-リン酸の前駆体であるピリドキサール塩酸塩が含まれた。用量反応曲線から、二次胆汁酸はCpに対して最も強力であるが(半減最大有効濃度[EC50]<100μM)、宿主毒性のため寄生虫に対する選択性は低い(2.5~3倍)ことが示された(図1B)。ピリドキサール塩酸塩は二次胆汁酸よりもCpに対する作用は弱かったが(EC50 = 213.2 μM)、寄生虫に対する選択性は最も高かった(44.6倍)(図1B)。インドールおよび4HIは最も作用が弱かったが(それぞれEC50 = 410.9および1,255 μM)、二次胆汁酸よりも宿主細胞毒性が低かった(図1B)。インドールは、抗菌活性を示すよく知られた微生物代謝産物である(例えば、大腸菌、緑膿菌、クロストリジウム・ディフィシル)23,24,25,26。さらに、糞便中のインドールレベルは、ヒトチャレンジ試験におけるC. hominisまたはCpに対する耐性と相関する19。したがって、我々は、Cpに対するインドールの潜在的な作用機序を明らかにすることに焦点を当てた。
ダウンロード 高解像度画像ダウンロード(923KB)
ダウンロード フルサイズ画像のダウンロード
図1. 腸内代謝産物、特に二次胆汁酸とインドールはin vitroでC. parvum(Cp)感染を阻害する。
(A)24時間後のHCT-8細胞におけるCp感染に対する85種類の腸内代謝産物の1mM(丸)または0.1mM(四角)の効果。プロットされたデータは、6つの独立した実験におけるPBS対照に対するCpまたは宿主細胞数の平均±SD(青線)を表す。各代謝物とPBSコントロールのCp数の差は、一元配置分散分析(one-way ANOVA)後に多重比較のためのダネット検定(Dunnett's test)を用いて分析した。Cpの増殖を有意に阻害した代謝物を赤で示す。∗p<0.05および**p<0.001。
(B)5つの阻害代謝物の化学構造と、Cpおよび宿主細胞に対するそれぞれのEC50値、および倍数選択性(宿主半量最大細胞毒性濃度[CC50]÷Cp EC50)。CC50値は、濃度ごとに6反復(2つの独立した実験から得られた3つのテクニカルレプリケート)の非線形回帰曲線フィットを用いて算出した。CC50値は、濃度ごとに9反復(3つの独立した実験から3つのテクニカルレプリケート)の非線形回帰曲線フィットを用いて計算した。
(C)HCT-8細胞におけるCp感染に対する3-炭素(ティール)、4-炭素(ピンク)、5-炭素(オレンジ)、6-炭素(緑)、または7-炭素(紫)位で修飾したインドールアナログ(1mM)のスクリーニングとその効果。プロットされたデータは、6反復(2つの独立した実験から得られた3つのテクニカルレプリケート)の平均±SDを表す。各代謝物とDMSOコントロールの平均Cp数の差は、一元配置分散分析(one-way ANOVA)と多重比較のためのダネット検定(Dunnett's test)を用いて分析した。∗∗∗p < 0.001. ILA、インドール-3-乳酸;I3AM、インドール-3-アセトアミド;I3S、インドキシル-3-硫酸;IAA、インドール-3-酢酸;IPA、インドール-3-プロピオン酸;Trypt、トリプタミン;I3ACN、インドール-3-アセトニトリル;MeI、メチルインドール;CNI、シアノインドール;AI、アミノインドール;HI、ヒドロキシインドール;MeOHI、メトキシインドール。
異なる炭素位置で修飾されたインドール類似体は、Cp感染を有意に阻害した。
インドールと4HIはともにCpの増殖を有意に阻害したが、インドールは4HIより3倍強力であり、一次スクリーニングに含まれたもう1つのインドール類似体である5-ヒドロキシインドール-3-酢酸はCpに効果を示さなかった(表S1)。これらの結果は、インドールのピロール環またはベンゼン環に沿った異なる炭素位置での修飾(図1C)が、インドールアナログの効力を変化させる可能性を示唆している。Cpに対するインドールの効力に及ぼす修飾位置の影響を調べるため、in vitro増殖アッセイを用いて、インドールの3、4、5、6、7炭素位置で修飾されたインドールアナログ25種を追加したパネルを試験した(図1C)。興味深いことに、ほぼすべてのインドール類縁体(25種中22種)がCp感染を有意に阻害した(図1C;表S2)。インドール-3-乳酸(ILA)、インドール-3-アセトアミド(I3AM)、インドキシル-3-硫酸(I3S)である。しかし、インドール-3-プロピオン酸(IPA)や3-メチルインドール(スカトールとも呼ばれる)のような、炭素数3の位置で修飾された他のインドールはCpを阻害した。特にメチル基、メトキシ基、シアノ基などである。Cpを阻害した22種のインドールのうち、11種はインドールよりも強力であり、その効力と選択性を総合して、7-シアノインドール(7CNI)を今後の研究に最適な類似体として選んだ。
インドールのCp阻害はアリール炭化水素受容体経路に依存しない
さらに、4-メチルインドール、6-メチルインドール、7-メトキシインドールなどの合成インドールは、in vitroでAhRシグナルを活性化することが示されている28。インドール類縁体によるAhR経路の活性化が、寄生虫の成長を阻害するのに十分であるかどうかを調べるため、トリプトファン代謝物のキヌレン酸29や6-ホルミルインドロ(3,2-b)カルバゾールFICZ30,31を含むAhRアゴニストや、特異性の高い合成AhRアゴニストVAF347でCp感染培養を処理した。 32 インドールと4MeIは用量依存的にCpを有意に阻害したが(図2A)、非インドール系AhR作動薬はいずれもCpの増殖に影響を与えなかった(図2A)。しかし、AhR作動薬で24時間処理したHCT-8細胞では、AhR標的遺伝子AhRRとCYP1A1の発現が有意に上昇した(図2B)。インドールのCp阻害にAhR経路が関与していないことを確認するため、CRISPR-Cas9を用いてHCT-8細胞のAhR遺伝子をノックアウトし、遺伝子の第1エクソンを破壊した。1つは1bpの挿入(AhRノックアウト[KO]1)、もう1つは11bpの欠失(AhR KO 2)である(図S1)。どちらの変異も、早発停止コドンを伴うフレームシフトを引き起こし、それぞれ29アミノ酸と25アミノ酸の切断タンパク質を生じると予測される(全長タンパク質は848 aa;図S1)。重要なことに、AhR KO株はいずれも、VAF347処理によってCYP1A1遺伝子の発現をアップレギュレートする能力を失ったことが確認された(図2C)。しかしながら、CpはAhR KO細胞においてインドールおよび4HI阻害に対する感受性を維持しており(図2D)、インドールは宿主AhR経路を介してCpを阻害するようには作用しないことが示された。
ダウンロード 高解像度画像ダウンロード(595KB)
ダウンロード フルサイズ画像のダウンロード
図2. インドールは宿主AhR経路を通してC. parvum(Cp)を阻害しない。
(A)AhRアゴニストの連続希釈液で24時間処理したHCT-8細胞におけるDMSOコントロールに対するCpの比率。開始濃度(1×)は、VAF347とFICZは1μM、キヌレン酸、インドール、4-メチルインドールは1mMであった。プロットされたデータは、9反復(3つの独立した実験による3つのテクニカルレプリケート)の平均±SDを表す。各化合物について、1×または0.5×処理培養と0.25×処理培養の平均Cp比の差を、二元配置分散分析に続いて多重比較のためのダネット検定を使用して分析した。∗∗∗p < 0.001.
(B)非感染HCT-8培養において、VAF347(250 nM)、インドール(1.5 mM)、または4-ヒドロキシインドール(4HI;2.5 mM)で24時間処理した後のヒトAHRRまたはCYP1A1遺伝子の遺伝子発現の、1%DMSO対照に対する倍数変化(GAPDHに対して正規化)。プロットされたデータは、1回の実験から得られた3または4テクニカルレプリケートの平均±SDを表す。各遺伝子について、DMSOコントロールに対する各処置の遺伝子発現の倍数変化の差を、一元配置分散分析(one-way ANOVA)後に多重比較のためのダネット検定(Dunnett's test)を用いて分析した。∗∗∗p < 0.001.
(C)非感染HCT-8 AhR WT細胞株(灰色)またはKO細胞株(青色)において、VAF347(500 nM)で24時間処理した後のヒトCYP1A1遺伝子の遺伝子発現の、1%DMSO対照に対するフォルド変化(GAPDHに対して正規化)。プロットされたデータは、1つの実験から得られた3つのテクニカルレプリケートの平均±SDを表す。各処理における各AhR KO細胞株対AhR WT細胞株の遺伝子発現の倍数変化の差は、二元配置分散分析(ANOVA)を用い、多重比較のためのダネットの検定を用いて分析した。∗∗∗p < 0.001.
(D)0.5%DMSO、インドール(1mM)、4HI(1mM)、またはVAF347(500nM)で24時間処理した後のHCT-8 AhR WT細胞株(灰色)またはKO細胞株(青色)におけるDMSOコントロールに対するCpの比率。プロットされたデータは、6反復(2つの独立した実験から得られた3つのテクニカルレプリケート)の平均±SDを表す。各処理におけるAhR KO細胞株とAhR WT細胞株のCp比の差は、二元配置分散分析(ANOVA)と多重比較のためのダネット検定(Dunnett's test)を用いて分析した。∗∗p < 0.01.
図S1も参照。
インドール類はCpの細胞内ライフサイクルの進行を遅らせる
インドール類が寄生虫の侵入および/または無性複製を阻害するかどうかを調べるため、インドールまたは7CNIの90%最大有効濃度(EC90)濃度で処理した培養物において、Cpの侵入および寄生虫空胞形成(0〜4時間後)、細胞内複製(4〜24時間後)、またはその両方の過程(0〜24時間後)に相当する時点でCpの増殖を定量した。また、インドールがCp感染に対して宿主細胞を「プライム」するかどうかを調べるため、感染前に宿主細胞を20時間前処理した。宿主細胞の前処理は、その後のCp感染には影響を与えず、感染後4時間だけ処理した場合には、インドールも7CNIもCpの増殖を阻害しなかった(図3A)。対照的に、処理を4時間後に開始した場合、インドールおよび7CNIは、24時間完全に処理した培養とほぼ同じ程度までCp感染を有意に阻害した(図3A)。これらの結果を総合すると、(1)インドールがCpを阻害するには感染中に存在する必要があること、(2)インドールはCpの胞胚形成、侵入、寄生空胞形成を阻害しないこと、(3)インドールは寄生虫の細胞内複製段階のどこかで作用することが示された。
ダウンロード 高解像度画像ダウンロード(754KB)
ダウンロード フルサイズ画像のダウンロード
図3. インドールはC. parvum(Cp)のライフサイクルの進行を遅延させる。
(A)1%DMSOまたはEC90濃度のインドール(880μM)または7-シアノインドール(7CNI;500μM)で感染後指定時間(hpi)処理した後のHCT-8細胞におけるDMSOコントロールに対するCp数の比率。プロットされたデータは、6反復(2つの独立した実験から得られた3つのテクニカルレプリケート)の平均±SDを表す。各時点におけるインドールまたは7CNI処理培養とDMSOコントロールの平均Cp比の差は、二元配置ANOVAと多重比較のためのDunnettの検定を用いて解析した。∗p<0.05および**p<0.001。
(B)1%DMSOまたはEC90濃度のインドールまたは7CNIで感染後指示された時間処理したHCT-8培養におけるCpの総数。プロットされたデータは3つの独立した実験の平均±SDを表す(Cと同じ実験)。各時点におけるインドールまたは7CNI処理培養とDMSOコントロールの平均Cp数の差は、二元配置分散分析に続いて多重比較のためのダネット検定を使用して分析した。∗∗p<0.01およびp<0.001。
(C)感染後、1%DMSOまたはEC90濃度のインドールまたは7CNIで処理した感染HCT-8培養物における、トロホゾイト期、初期メロン期、中期メロン期、または後期メロン期のCp数の比。N、寄生虫あたりの核数。プロットされたデータは3つの独立した実験の平均±SDを表す。
(D)1%DMSOまたはEC90濃度のインドールまたは7CNIで22hpi処理したHCT-8培養におけるCpの免疫蛍光画像。寄生体は膜マーカー1E12(緑)と一般的なCp抗体であるPan Cp(赤)で標識されている。核はHoechstで染色。スケールバー、3μm。
(E)Cp感染気液界面(ALI)培養を1%DMSO、またはEC50(577 μM)、EC90(1,894 μM)、2×EC90(3,788 μM)のインドール、またはEC50(379 μM)、EC90(688 μM)、2×EC90(1,376 μM)の7CNIで48時間処理した後、ウォッシュアウトした。Cpゲノム当量は、各時点でDMSO対照に対して正規化した。プロットされたデータは、6反復の平均値±SDを表す(2つの独立した実験から得られた3つのテクニカルレプリケート)。各インドール濃度について、洗浄後の平均Cp割合対洗浄時(2dpi)の平均Cp割合の差を、二元配置分散分析(ANOVA)後に多重比較のためのダネット検定を使用して分析した。∗∗p<0.01およびp<0.001。
図S2およびS3も参照。
侵入後、Cpは単一核のトロフォゾイトとして細胞内で無性周期を開始し、不完全な細胞質分裂を伴うDNA複製を3回行い(初期および中期メロン)、次いで個々の核の分離と膜への取り込みを経て、8個の成熟したI型メロゾイト(後期メロン)を形成する33。インドールが寄生虫の細胞内ステージで作用する時期をより正確に定義するために、感染培養物をEC90濃度のインドールまたは7CNIで処理する一方、チミジンアナログであるEdUを4時間パルスで添加し、複製中の寄生虫DNAを標識するとともに、ステージ特異的マーカーの染色を行った。その結果、Cpの総数は、DMSOとインドールまたは7CNIで処理した培養の間で、第2ラウンドの分裂が始まるまで(約16 hpi;図3B)有意な差は認められず、インドールが寄生虫の発育を阻害することが示された。特定の複製段階の進行を最初の24 hpiにわたって調べたところ、インドールおよび7CNIは、特定の時点で発育を停止させるのではなく、連続したライフサイクルの段階を通じて進行を遅延させることが明らかであった(図3C)。インドールが、先に研究された化合物KDU691と同様に、メロゾイトの成熟、脱出、および/または再侵入を阻止するかどうかを調べるために33、感染培養物をEC90インドールまたは7CNIで22時間処理した後、固定し、寄生虫表面膜を標識するモノクローナル抗体1E12で標識した35。インドールまたは7CNI処理培養物では、成熟メロゾイトの明らかな形態学的欠陥は観察されず(図3D)、インドールが成熟メロゾイトの形成を阻止しないことが示された。
インドールの阻害は、Cpの長期培養系における洗浄後、部分的に可逆的である
処理の可逆性を調べるために、無性および有性発育の両方を支持し、Cpの長期増殖を可能にする気液界面(ALI)トランスウェル培養系を用いた34,36。EC50、EC90、および2×EC90濃度のインドールまたは7CNIで感染培養を2日間処理した後、化合物を洗い流し、Cpおよび宿主ゲノムの定量前に培養を2〜4日間回復させた。インドールまたは7CNIのEC50濃度で処理した後、インドール洗浄の2日後と7CNI洗浄の4日後にCpの増殖に有意な回復が見られた(図3E)。EC90インドールまたは7CNIで処理した培養液の洗浄後にも(有意ではないが)増殖の回復が見られたが、2×EC90インドールまたは7CNIで処理した培養液では回復は見られなかった(図3E)。しかし、最高濃度のインドールおよび7CNIで寄生虫が回復しなかったのは、これらの濃度では宿主毒性が高いことが影響している可能性が高い(図S3)。したがって、インドールによるCpの増殖阻害は、宿主細胞の生存率が影響を受けない低濃度では部分的に可逆的である。これらの結果は、インドールが存在すると増殖が阻害されるが、除去すると寄生虫の発育に好都合な環境が速やかに回復することを示唆している。
インドール処理は小胞体ストレスと膜輸送に関与する宿主遺伝子をアップレギュレートする
インドールが宿主遺伝子の発現を変化させ、Cpの増殖に不利な宿主細胞環境を作り出すかどうかを調べるため、Cp EC90濃度のインドールまたは1%DMSOで4時間または12時間処理したHCT-8細胞のRNA配列決定(RNA-seq)を行った。インドール処理した全サンプル(n=6)とDMSO処理した全サンプル(n=5)を、処理時間を共変数として比較したところ、インドール処理後に有意に発現が異なる68遺伝子が同定された(偽発見率[FDR]p値<0.05、絶対倍率変化>2): 57の発現上昇遺伝子(AhR標的遺伝子CYP1A1を含む)と11の発現低下遺伝子であった(図4A、表S3)。発現差のある遺伝子の階層的クラスタリング解析により、遺伝子発現パターンは3つの主要なクラスターに分かれた:インドール処理後に発現低下、インドール処理4時間後に発現上昇、インドール処理12時間後に発現上昇(上位30遺伝子を図4Bに、全遺伝子を表S3に示す)。インドール処理4時間後に発現が上昇した遺伝子のサブセットに対してEnrichrで行ったジーンオントロジー(GO)プロセス解析では、小胞体(ER)ストレスに応答する経路(GO:0034976)とERストレスに応答するアポトーシスシグナル伝達(GO:0070059;図4C)の2つが最も重要であることがわかった。興味深いことに、これらの経路に関連する遺伝子、すなわちDDIT3、DNAJB9、CHAC1の発現は、インドールへの曝露時間が長くなるほど低下する(図4B)。対照的に、インドール処理12時間後に発現が上昇した上位10経路のうち5経路は、カルボン酸(GO:0046942)、モノカルボン酸(GO:0015718)、アミノ酸(GO:0015804およびGO:0006865)、または窒素化合物(GO:0071705)の膜輸送に関与している(図4D)。これらのトランスクリプトミクスデータを総合すると、インドールによる短時間処理によって小胞体ストレス応答が誘導され、重要な栄養素の不均衡を回復するために、細胞がトランスポーターをアップレギュレートする可能性が示唆される。私たちは、インドールがトリプトファンやフェニルアラニンなどの芳香族アミノ酸の輸入と競合しているのではないかと考えた。しかしながら、細胞培養液にトリプトファンまたはトリプトファンとフェニルアラニンを追加補充しても、HCT-8細胞におけるインドールのCp増殖阻害は改善されなかった(図4E)。従って、インドールによるCpの阻害は宿主のトリプトファン欠乏によるものではなく、他の必須栄養素の欠乏によるものである可能性が高い。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. インドールはHCT-8細胞においてERストレスとトランスポーターのアップレギュレーションを誘導する。
(A)インドール処理とDMSO処理したHCT-8細胞の遺伝子特異的解析(GSA)後の変化量とp値のボルケーノプロット。インドール処理後に2倍以上有意に(p < 0.05)発現上昇(赤)または発現低下(青)した遺伝子を強調している。
(B-D)インドール処理HCT-8細胞とDMSO処理HCT-8細胞の間で最も差次的に制御された30遺伝子の階層的クラスタリング解析(FDR補正p < 1 × 10-9)。(CとD) インドール処理(C)4時間後または(D)12時間後に有意に発現上昇した遺伝子を入力としてEnrichrで行ったジーンオントロジー(GO)パスウェイ解析。各パスウェイに関連するアップレギュレート遺伝子を棒グラフの右側に示した。
(E)1mMトリプトファン(Trp)または1mM Trp+1mMフェニルアラニン(PHE)を添加した増殖培地中で、インドールの連続希釈液で24時間処理した後のHCT-8細胞におけるDMSOコントロールに対するC. parvum(Cp)の比率。EC50値は、インドール濃度ごとに6反復(2つの独立した実験から3つのテクニカルレプリケート)で非線形回帰曲線フィットを用いて各培地について計算した。
インドールは宿主のミトコンドリア機能を障害し、ATP産生を低下させる
インドールがHCT-8細胞のミトコンドリア機能を阻害するかどうかを調べるために、インドールまたは7CNIで処理した細胞の酸素消費率(OCR)と呼吸能力を測定した。その結果、インドールおよび7CNIは、HCT-8細胞のミトコンドリア呼吸の基礎レベルおよび最大レベルを用量依存的に有意に低下させることがわかった(図5AおよびS4)。その結果、インドールおよび7CNI処理細胞の予備呼吸容量(最大呼吸数から基礎呼吸数を引いた値)も減少し(図5AおよびS4)、これらの細胞のミトコンドリアはエネルギー需要の急激な増加(アッセイにおけるプロトンイオノフォアおよびOxPhosアンカプラーFCCPの添加によってシミュレートされる)に反応する能力が低いことが示された。インドールと7CNIによるミトコンドリア機能のこの用量依存的な障害は、ミトコンドリアによるATP産生速度の有意な減少につながった(図5BとS4)。解糖によるATP産生率はどの処理でも同程度であったが、インドールまたは7CNI処理細胞では総ATP産生率が低かった(図5BおよびS4)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図5. インドールは宿主ミトコンドリアのATP産生を阻害し、C. parvum(Cp)のミトゾームポテンシャルに影響を与える。
(A)1%DMSOまたはインドール(0.5、1、2mM)で18時間処理したHCT-8細胞のSeahorse XF Cell Mito Stress Testキットを用いた代謝解析。データは、各ウェルの酸素消費率(OCR)の、その実験におけるDMSO対照細胞の平均基底OCRに対するパーセンテージとして計算した。予備呼吸容量=各ウェルの最大呼吸数-基礎呼吸数。プロットされたデータは、12反復(2つの独立した実験から得られた6つのテクニカルレプリケート)の平均±SDを表す。各測定における各インドール濃度対DMSOコントロールのOCR割合の差は、二元配置分散分析(ANOVA)後、多重比較のためのダネット検定を用いて分析した。∗p<0.05および**p<0.001。
(B)1%DMSOまたはインドール(0.5、1、2mM)で18時間処理したHCT-8細胞のSeahorse XF Real-Time ATP Rate assayを用いた代謝解析。プロットされたデータは、解糖、ミトコンドリア、または全ATP(解糖+ミトコンドリアATP速度)により産生されたATP産生速度(pmol/分)の平均±SDを12反復(2つの独立した実験から6つのテクニカルレプリケート)について表している。各ATP源について、各インドール濃度対DMSO対照のATP産生率の差を、二元配置分散分析(ANOVA)後に多重比較のためのダンネット検定を使用して分析した。∗∗p<0.01およびp<0.001。
(C)1%DMSOまたはインドール(0.5、1、2mM)で18時間処理したHCT-8 AhR WT細胞(灰色)またはAhR KO細胞(青色)のSeahorse XF Cell Energy Phenotype Testキットを用いた代謝解析。データは、その実験のDMSO対照細胞の基底OCRの平均値に対する各ウェルのOCRのパーセンテージとして計算した。プロットされたデータは、12反復(2つの独立した実験から得られた6つのテクニカルレプリケート)の平均±SDを表す。各細胞株について、一元配置分散分析(one-way ANOVA)と多重比較のためのダンネット検定(Dunnett's test)を用いて、各インドール濃度対DMSOコントロールのOCRのパーセンテージの差を分析した。∗p<0.05、**p<0.01、**p<0.001。
(D)ミトコンドリア複合体IおよびIII阻害剤ロテノンおよびアンチマイシンA(それぞれRot/AA)、ATP合成酵素阻害剤オリゴマイシン、またはプロトン勾配阻害剤カルボニルシアニドm-クロロフェニルヒドラゾン(CCCP)の連続希釈液で24時間処理した後のHCT-8細胞におけるDMSOコントロールに対するCpの比率。阻害曲線は、濃度ごとに6反復(2回の独立した実験から得られた3つのテクニカルレプリケート)の非線形回帰曲線フィットを用いて各化合物について計算した。
(E)1%DMSOまたは2×EC90濃度のインドール(1.76mM)または10μM CCCPで感染後指示された時間処理したHCT-8培養におけるCpの免疫蛍光画像。寄生体は膜マーカー1E12(緑)、MitoTracker Red CMXRos(赤)で標識し、核はHoechst(青)で染色した。スケールバー、3μm。
(F)インドール処理した寄生虫のMitoTracker強度分布。1%DMSOまたは2×EC90濃度のインドール(1.76mM)、7-シアノインドール(7CNI)(1mM)、または10μM CCCPで22hpiから2時間処理したHCT-8培養におけるCp。寄生虫の蛍光強度は、2回の独立した実験から少なくとも180匹の寄生虫から採取したMitoTracker染色に基づいて測定した。各投与群と対照群を比較する統計解析は、両側Mann-Whitney U検定を用いて行った。∗∗∗∗nsは有意ではない。(DMSOとインドールの比較を赤のアスタリスクで、DMSOと7CNIの比較を青のアスタリスクで示す)。
図S4も参照。
インドールによるCp阻害はAhR経路を介して作用するようには見えないが(図2)、RNA-seq実験ではAhR応答性遺伝子が明らかにアップレギュレートされており(図4)、この経路がミトコンドリア機能に影響を及ぼす可能性がある。この可能性を検証するため、HCT-8 AhR KO 1細胞株を用いてミトコンドリア機能を調べた。その結果、HCT-8野生型(WT)とAhR KO細胞の両方において、ミトコンドリアの基礎呼吸数と負荷呼吸数(FCCPとATP合成酵素阻害剤であるオリゴマイシンの同時添加後に測定)が用量依存的に有意に損なわれていることがわかった(図5C)。このように、ミトコンドリア呼吸障害は、AhRに依存しない経路でのCp増殖阻害と関連している。ミトコンドリア機能の阻害がインドールとは無関係にCpの増殖を阻害するのに十分であるかどうかを調べるため、HCT-8細胞をOxPhos阻害剤オリゴマイシン、カルボニルシアニドm-クロロフェニルヒドラゾン(CCCP;FCCPに構造的に類似したプロトンイオノフォア)、または複合体Iと複合体IIIの阻害剤であるロテノンとアンチマイシンAの組み合わせ(Rot/AA)でそれぞれ連続希釈処理した後、Cp増殖アッセイを行った。これら3つの処理はすべて、EC50値がRot/AAで11.5 μM、オリゴマイシンで20.6 μM、CCCPで5.0 μMと、用量依存的にCpの増殖を阻害した(図5D)。
宿主細胞とは異なり、Cpは無傷のミトコンドリアを持たず、代わりに機能的なトリカルボン酸(TCA)サイクルとチトクロム依存性電子輸送経路の両方を欠く残余のミトコンドーム小器官を持つため、ATP産生に直接寄与しない40。ミトコンドリア膜電位の強力な脱分極剤であるCCCPが、CpミトソームのMitoTracker染色性を低下させることも確認した(図5EとF)。同様に、Cpをインドールまたは7CNIで処理すると、短時間(例えば2時間)であろうと長時間(例えば24時間)であろうと、CpミトソームのMitoTracker染色が有意に減少し、インドールがこのオルガネラの膜電位を損なう可能性が高いことが示された(図5EおよびF)。
7CNIの経口投与またはインドール産生微生物の導入は、in vivoでのCp感染を一時的に抑制する
インドールの経口投与がクリプトスポリジウム症モデルマウスにおける感染を変化させうるかどうかを調べるために、Cp感染インターフェロンガンマKO(GKO)マウスに50mg/kgのインドールまたは7CNIを1日2回、感染当日から7日間経口投与した(図6A)。GKOマウスはもともと感染に弱く、ここで用いたCpのAUCP-1株に感染させると、Abx処理をしなくても、多数のオーシストの排出を特徴とする強固な感染が起こる。インドールはin vivoでのCp感染に有意な効果を示さなかったが、7CNI処理は5dpiまでにマウスの糞便中に排出されたCpオーシスト数を有意に減少させた(図6B)。糞便1mgあたりのCpオーシストの平均数は、7CNI処理マウスでは7dpi(処理最終日)でも低いままであったが、9dpiまでには回復した(図6B)。同様に、7CNI投与マウスの体重は、5dpiおよび7dpiではビヒクルまたはインドール投与マウスより有意に多かったが、投与終了後は急速に減少し始めた(図6C)。7CNI投与は生存率を有意に増加させなかったが、ビヒクルまたはインドール投与マウスの生存期間中央値がそれぞれ11dpiまたは17dpiであったのに対し、23.5dpiまで延長した(図6D)。
ダウンロード 高解像度画像ダウンロード(822KB)
ダウンロード フルサイズ画像のダウンロード
図6. 外因性インドール投与、またはインドール産生菌による再構成は、GKOマウスにおけるC. parvum(Cp)感染を抑制する。
(A)GKOマウスにビヒクル(水中10%DMSO)または50mg/kgのインドールまたは7-シアノインドール(7CNI)を1日2回7日間経口投与した。Cpオーシスト数は、3、5、7、9dpiに採取したマウス1匹あたりの糞便ペレットから定量した。プロットされたデータはすべて、2つの独立した実験から経時的にサンプリングされた各処置群7匹のマウスを表す。
(B)感染後指示された日数における各マウスの糞便1mgあたりのCpオーシスト。各群をビヒクルコントロールと比較した統計解析は、両側Mann-Whitney U検定を用いて行った。∗p < 0.05.
(C)元の体重の割合を平均値±SDでプロットした。統計解析は混合効果モデルを用い、マッチした値についてはGeisser-Greenhouse補正を行い、多重比較についてはDunnettの検定を行った。∗p < 0.05.
(D)7匹すべてのマウスの最初の10日間の生存曲線と、2番目の実験から得られた4匹のマウスの11-30日目の生存曲線を合わせたもの。
(E)GKOマウスを抗生物質で処理して内因性細菌叢を抑制した後、WT B. thetaまたはΔtnaA B. thetaで再構成し、その後Cpでチャレンジした。オーシスト数は3、5、7、9dpiに採取した糞便から定量した。プロットされたデータはすべて、経時的にサンプリングされた各処置群につき4匹のマウスを表す。
(F) 16S rRNA qPCRによる腸内細菌量の推定。平均値±SD。個々の日におけるビヒクルとWT B. theta群(青いアスタリスクで示す)またはΔtnaA B. theta群(赤いアスタリスクで示す)を比較した統計解析は、二元配置分散分析(way-way ANOVA)後に多重比較のためのダネット検定(Dunnett's test)を用いて分析した。∗p<0.05およびp<0.01。
(G)各マウスの感染後日数におけるバクテロイデス属レベルの相対存在量。
(H)感染後、各マウスの糞便1mgあたりのCpオーシスト。個々の日数におけるWT B. theta群とΔtnaA B. theta群を比較する統計解析は、両側Mann-Whitney U検定を用いて行った。∗p < 0.05.
図S5、S6、S7参照。
In vivoでの保護におけるインドールの役割に関する研究を拡張するために、Abx処理によってマウスの内因性微生物叢を除去し、Cpでチャレンジする前にインドール産生菌で微生物叢を再構成した。様々なグラム陰性細菌が、トリプトファンをインドールに変換するトリプトファナーゼ遺伝子(TnaA)を発現している42。その中でもバクテロイデス目とクロストリジウム目に属する細菌は、腸内でインドールを生成する能力を持つ最も豊富な分類群のひとつである42。したがって、バクテロイデス・テタイオタミクロン(B. theta)を再構成に選んだ。この種が産生するインドールは、病原性遺伝子の発現を調節することにより、腸管出血性大腸菌感染に対する感受性を変化させることが、以前の研究で示されていたからである43。これらの実験では、マウスにAbxカクテルを投与して内因性細菌叢を抑制した後、TnaAを発現するWT B. thetaまたはこの生合成経路を欠く変異体(ΔtnaA)を経口投与して再構成した(図6E)。Abx処理後、16Sコピー数のqPCR分析で評価したように、微生物叢が枯渇したことを確認した(図6F)。B. thetaで再構成すると、総細菌レベルは急速に回復したが、ビヒクル処置したコントロールマウスは、より徐々にAbx投与前の腸内細菌レベルに戻った(図6F)。マウスの体重は、WT B. thetaで再構成してもtnaA変異体で再構成しても有意差はなかった(図S5)。予想されたように、内因性細菌群集の豊かさはAbx処理によって減少し、B. thetaでコロニー形成したマウスまたはビヒクル投与マウスでは観察された種の数は低いままであった(図S6)。すべてのマウスにおいて、加重UniFrac距離で解析した細菌群集構造はAbxによって破壊され、WTまたは変異型B. thetaを投与したマウスの群集は0dpiまでにCpに収束したが、ビヒクル投与マウスの群集は破壊されたままであり、8dpiまでにAbx投与前の構造に戻った(図S6)。分類学的に解析すると、WTまたは変異型B. thetaを投与したマウスでは、0dpiまでにBacteroidales属がしっかりと再構成されたが、ビヒクル投与マウスでは見られなかった(図S7)。属レベルでは、バクテロイデス属はAbx投与前には一般に検出されなかったが、WTまたは変異型B. theta投与マウスでは支配的なグループとなり、バクテロイデス属について同定された唯一のアンプリコン配列変異体はB. theta由来であった(図6G)。一方、ビヒクルコントロールを投与したマウスでは、BacteroidalesとBacteroidesは見られなかった(図S7と6G)。インドールを産生するWT B. thetaとこの能力を欠くΔtnaA変異体で内因性細菌叢を置き換えるのに、Abx処理と再構成が効果的であることを確認した後、再構成したマウスについて感染感受性を試験した。WT型B. thetaで再構成したマウスは、ΔtnaA変異体で再構成したマウスに比べて、5dpiと7dpiのオーシスト排出が有意に減少し、感染抵抗性におけるインドール産生の役割を支持した(図6H)。排出の差は一過性であり、WT菌と変異株を与えたマウスの感受性の最終的な収束は、インドールを産生することが知られている他の分類群、特にClostridiales(図S7)の出現によるものかもしれない42。
考察
腸内病原体であるクリプトスポリジウム寄生体は、腸内に生息する何十億もの微生物と、それらが産生する膨大な種類の分子にさらされている。成体マウス腸内代謝物のスクリーニングにより、インドールとその誘導体である4HIが、ヒト細胞におけるCp増殖阻害剤として同定された。さらに試験を進めると、修飾位置や側鎖の構成に関係なく、ほとんどのインドール類似体が寄生虫を阻害できることがわかった。インドールはAhRを介してシグナル伝達することが知られているが、AhRを欠損させたKO細胞株では、インドールによるCpの増殖抑制はこの経路とは無関係であることが明らかになった。その代わりに、インドールは宿主のミトコンドリア呼吸を抑制し、ATPレベルを低下させることによって、間接的にCpの増殖に影響を与えている可能性が高いことがわかった。また、インドール処理によって寄生虫のミトコンドリアの膜電位が低下したことから、インドールはこのオルガネラの機能も損なう可能性があることが示唆された。インドール処理により、寄生虫のライフサイクルの進行が遅延し、洗浄により部分的に可逆的であったことから、この効果は静的なものであることが示唆された。インビボでのインドール投与は、インドール産生菌による再構成と同様に、Cp感染からマウスを部分的に保護した。このことは、インドールの補充、あるいはインドールを大量に産生する微生物群集の強化が、感染抑制に有用であることを示唆している。
クリプトスポリジウム属細菌は代謝能力が著しく低下しており、そのほとんどが従来のミトコンドリアとTCAサイクルおよびOxPhosに必要な酵素の両方を欠いている44。そのため、Cpはエネルギーの必要性をほぼ完全に宿主細胞に依存しており、先行研究ではATPを含むリン酸化ヌクレオチド45を輸入している可能性が示唆されている。さらに、いくつかのメタボロームおよびプロテオミクス研究により、CpおよびC. hominisの感染は、細胞株(HCT-8およびCOLO-680N)および実験マウスモデル(C57BL/6JおよびBALB/c)において、宿主のミトコンドリアおよび解糖系活性を誘導し、細胞内ATPレベルも同様に増加することが判明している46,47,48,49。このモデルと一致するように、既知のミトコンドリアETC阻害剤であるロテノン、アンチマイシンA、オリゴマイシン、CCCPで処理すると、いずれもCpの増殖に用量依存的な悪影響を及ぼすことがわかった。この作用機序は、インドールで細胞を処理したときに観察されたCp増殖の発育遅延や、化合物を洗い流すとその効果が部分的に可逆的であるという観察結果と一致する。他の研究では、Cp感染が宿主細胞の代謝に影響することが示されている49。今後、これらの経路は相互作用する可能性が高いため、寄生虫感染と微生物叢の代謝物処理との交差を調べる研究が行われる可能性がある。
インドールは、DNA、電子伝達鎖の複合体2、3、4、およびTCAサイクルのほぼすべての酵素が存在しないなど、正常なミトコンドリアの多くの特徴を欠く変性オルガネラであるミトソームの膜電位に直接影響することも明らかになった40,51。これまでの研究で、Fe-Sクラスター合成タンパク質がミトソームに輸送されることが証明されており52、ユビキノン生合成の場でもある可能性が高い40,51。ミトソームには代替オキシダーゼも存在し、NAD(P)トランスヒドロゲナーゼやNDH2とともに、膜勾配を確立する代替プロトンポンプとして機能すると考えられる40,51。インドールやCCCPで処理すると、ミトトラッカーによる染色性が低下することから、これらの薬剤が膜電位を乱し、ミトゾームの機能を損ない、寄生虫の発育遅延に寄与している可能性が示唆される。
我々の研究から、胆汁酸塩、インドール、いくつかの短鎖脂肪酸(フマル酸やプロピオン酸)を含む、いくつかの微生物代謝産物がin vitroでCpの成長を阻害することが明らかになった。特に、胆汁酸塩であるタウロコール酸ナトリウムは、マイクロネームの分泌を促進し、Cpの宿主細胞への侵入を増加させることが示されている53。最近の別の研究でも、微生物叢が産生する豊富な代謝産物である短鎖脂肪酸54によって、Cpの増殖が阻害されることが示された。したがって、マイクロバイオームの成熟に伴う微生物代謝産物の変化が、成体でみられるコロニー形成抵抗性に寄与している可能性が高い。我々は、インドール誘導体の役割をin vivoで試験し、インドール産生菌の直接投与または再構成により、感染に対する部分的な防御が得られることを示した。インビボでのインドールの作用は、インビトロで測定した増殖抑制特性(AhR非依存性)から生じる可能性があるが、インビボでのバリア機能と免疫力を高めるAhRシグナル伝達にも影響する可能性がある27,55,56。インドールの保護的役割と一致して、便中インドール濃度が高い健常成人はクリプトスポリジウムによるチャレンジに抵抗性であることがこれまでの研究で示されている19。インドールは、Clostridia、Bacteroidia、Gammaproteobacteriaなど、トリプトファナーゼをコードするTnaA遺伝子を発現する広範な細菌分類群によって、食餌トリプトファンから産生される42。そのため、インドールのような代謝物を外因的に投与するか、そのような物質を産生する細菌群集を強化することで、クリプトスポリジウム症の制御においてAbx療法の補助となる可能性がある。
研究の限界
我々の研究は、インドールがCpのマイトソームの膜電位に影響を与え、ヒト細胞のミトコンドリアからのATP産生を減少させることを示しているが、いずれのプロセスも寄生虫の増殖抑制に寄与する程度を正確に定義していない。ミトコンドリアはまだ十分に説明されておらず、今後の研究によって、膜電位に依存するこのオルガネラの重要な経路が解明される可能性がある。インドールの経口投与、あるいはインドール産生菌による再構成は、これらの産物がマウスのCp感染抵抗性に寄与していることを示しているが、これらの産物を人為的に操作した場合の効果はかなり控えめであった。腸内濃度は場所や時間によって変化すると予想されるため、これらの限界は、インドールの急速な代謝と排泄の可能性の両方を反映しているのかもしれない。さらに、われわれの研究および他の研究者の研究から、複数の代謝産物がCp感染に対する抵抗性に寄与していることが示された。したがって、インドール濃度のみを操作しても、Cp感染に対する抵抗性が高まらなかったことは予想外ではなかった。このため、インドールレベルの操作だけではCp感染に対する抵抗性が向上しなかったことは予想外であった。gnotobioticマウスを用いたさらなる研究により、他の交絡因子の寄与を減らすことで、個々の代謝物の役割をより明確にできる可能性がある。
STAR★方法
主要リソース表
抗体ウサギポリクローナル抗RH35N/ウサギポリクローナル汎Cp35N/マウスモノクローナル1A535N/マウスモノクローナル1E1235N/Alexa Fluor 488ヤギ抗ウサギIgG (H + L)Thermo Fisher ScientificCat#A11034; RRID: AB_2576217Alexa Fluor 488ヤギ抗マウスIgG (H + L)Thermo Fisher ScientificCat#A11029; RRID: AB_2534088Alexa Fluor 568ヤギ抗マウスIgG (H + L)Thermo Fisher ScientificCat#A11004; RRID: AB_2534072Alexa Fluor 594ヤギ抗ウサギIgG (H + L)Thermo Fisher ScientificCat#A11037; RRID: AB_2534095Alexa Fluor 647ヤギ抗ウサギIgG (H + L)Thermo Fisher ScientificCat#A21245; RRID: AB_2535813細菌およびウイルス株Bacteroides thetaiotaomicron: VPI-5482株Laboratory of Vanessa SperandioN/ABacteroides thetaiotaomicron: VPI-5482株; ΔtnaALaboratory of Vanessa SperandioN/A化学物質、ペプチド、組換えタンパク質代謝物およびインドール類似体、表S4参照Sigma-Aldrich; AA Blocks, Inc. N/ASodium taurocholate hydrateSigma-AldrichCat#86339; CAS: 345,909-26-4Y-27632 dihydrochloride ROCK inhibitorTocris BiosciencesCat#1254; CAS: 129,830-38-2VAF347Sigma-AldrichCat#182690FICZAA Blocks, Inc. Cat#AA007VKI;CAS:172,922-91-7キヌレン酸Sigma-AldrichCat#K3375;CAS:492-27-3L-トリプトファンSigma-AldrichCat#T8941;Cas: 73-22-3L-phenylalanineSigma-AldrichCat#P5482; Cas: 63-91-2AmpicillinSigma-AldrichCat#A0166; Cas: 69-52-3ネオマイシンSigma-AldrichCat#N1876;Cas: 1405-10-3VancomycinSigma-AldrichCat#V2002; Cas: 1404-93-9PuromycinSigma-AldrichCat#P8833; Cas: 58-58-2ホルムアルデヒドポリサイエンスCat#04018; Cas: 50-00-02-mercaptoethanolSigma-AldrichCat#M6250Triton X-100Thermo Fisher ScientificCat#BP151-100Lipofectamine 3000 Transfection ReagentThermo Fisher ScientificCat#L3000001Hoechst 33,342Thermo Fisher ScientificCat#H3570ProLong Glass Antifade MountantThermo Fisher ScientificCat#P36984RotenoneSigma-AldrichCat#R8875; Cas: 83-79-4アンチマイシンASシグマ-アルドリッチCat#A8674;Cas: 1397-94-0OligomycinSigma-AldrichCat#O4876; Cas: 1404-19-9 カルボニルシアニド m-クロロフェニルヒドラゾン (CCCP)Sigma-AldrichCat#C2759; Cas: 555-60-2Critical commercial assaysClick-iT Plus EdU Alexa Fluor 488 Imaging kitThermo Fisher ScientificCat#C10637QIAamp DNA Mini kitQIAGENCat#51306QIAamp Powerfecal Pro DNA kitQIAGENCat#51804RNeasy Mini kitQIAGENCat#74104CellTiter-Glo発光細胞生存率アッセイPromegaCat#G7571RQ1 RNase フリーDNasePromegaCat#M6101DNAフリーDNA除去キットThermo Fisher ScientificCat#AM1906SuperScript VILO cDNA合成キットThermo Fisher ScientificCat#11754050TB Green Advantage qPCRプレミックスTakara BioCat#639676Platinum Taq DNA Polymerase、 High FidelityThermo Fisher ScientificCat#11304011Seahorse XF Cell Energy Phenotype Test kitAgilentCat#103325-100Seahorse XF Real-time ATP Rate Assay kitAgilentCat#103592- 100Seahorse XF Cell Mito Stress Test kitAgilentCat#103015-100MitoTracker® Red CMXRosThermo Fisher ScientificCat#M7512寄託データ生データおよび解析済みRNA-seqデータ本論文GEO: GSE18565216S rRNA reads本論文ENA: PRJEB58007実験モデル: 細胞株マウス: NIH/3T3ATCCCRL-1658Mouse: C57BL/6Laboratory of Thaddeus StappenbeckN/Aヒト由来回腸上皮幹細胞: Lenti-X 293TTakara BioCat#632180ヒト:HCT-8ATCCCCL-244ヒト:HCT-8 AhR KOT本論文N/A実験モデル: 生物/株Cryptosporidium parvum AUCP-1分離株William Witolaの研究室N/AMouse: Infg KO(C57BL/6バックグラウンド)Jackson LaboratoriesCat#002287; RRID: IMSR_JAX:002,287オリゴヌクレオチドプライマー:ヒトCYP1A1フォワード: ACATGCTGACCCTGGGAAAGPrimerBankhttps://pga.mgh.harvard.edu/primerbank; PrimerBank ID: 189339226c2Primer: ヒトCYP1A1リバース: GGTGGAGCCAATTCGGATPrimerBankhttps://pga.mgh.harvard.edu/primerbank; PrimerBank ID: 189339226c2Primer: ヒトAHRR forward: CTTAATGGCTTTGCTCTGGTCG61N/APプライマー:ヒトAHRRリバース: TGCATTACATCCGTCTGATGGA61N/APrimer:ヒトGAPDHフォワード: TGAGTACGTCGTGGAGTCCAT本論文N/APプライマー:ヒトGAPDHリバース: AGAGGGGCAGAGATGAT本論文N/AsgRNA for human AhR exon 1: TCACCTACGCCAGTCGCAAG本論文N/APプライマー: human AhR forward: GCACCATGAACAGCAG本論文N/APプライマー:ヒトAhRリバース: TCCAAGTCCTCTGTCTCCCAT本論文N/APプライマー:C. parvum GAPDHフォワード: CGGATGGCCATACCTGTGAG34N/APrimer: C. parvum GAPDH reverse: GAAGATGCGCTGGGAACAAC34N/APrimer:マウスGAPDHフォワード: GCCATGAGTGGACCCTTCTT34N/APrimer: マウス GAPDH reverse: GAAAACGGGGGCAATGAG34N/APrimer: V4 16S rRNA 515 forward: GTGCCAGCMGCCGCGGTAA71N/APrimer: V4 16S rRNA 805 reverse: GACTACCAGGGTATCTAATCC71N/AR組換えDNAPlasmid:lentiCRISPR v263Addgeneプラスミド#52961Plasmid:lentiCRISPRv2-sgAhR本論文N/APlasmid:pMD2. gLaboratory of Didier TronoAddgeneプラスミド#12259プラスミド:pMDLg/pRRE64Addgeneプラスミド#12251プラスミド:pRSV-Rev64Addgeneプラスミド#12253ソフトウェアおよびアルゴリズムBioTek Gen5 v. .02Agilenthttps://www.agilent.com/en/product/cell-analysis/cell-imaging-microscopy/cell-imaging-microscopy-software/biotek-gen5-software-for-imaging-microscopy-1623226GraphPad Prism 9GraphPad Softwarehttps://www.graphpad.com/QuantStudio Design & Analysis SoftwareThermo Fisher Scientifichttps://www.thermofisher.com/us/en/home/global/forms/life-science/quantstudio-3-5-software.htmlFIJI (ImageJ)65https://fiji.sc/Partek FlowPartek, Inc.https://www.partek.com/partek-flow/Enrichr70http://maayanlab.cloud/Enrichr/Wave v2.6.1Agilenthttps://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-software/seahorse-wave-desktop-software-740897R package: dada272https://benjjneb.github.io/dada2/R package: phyloseq74https://www.bioconductor.org/packages/release/bioc/html/phyloseq.htmlOtherBioTek Cytation 3 cell imaging multimode readerAgilenthttps://www.biotek.com/products/detection-multi-mode-microplate-readers/cytation-hybrid-multi-mode-reader/Axioskop Mot Plus fluorescence microscopeZeissN/AQuantStu
リソースの有無
代表連絡先
リソースや試薬に関するさらなる情報やリクエストは、リードコンタクトであるL. David Sibley (sibley@wustl.edu)までご連絡ください。
材料の入手可能性
HCT-8 AhRノックアウト細胞株はリクエストに応じて入手可能である。
実験モデルと研究参加者の詳細
クリプトスポリジウム株
C. parvum単離株AUCP-1は、雄のホルスタイン子牛で継代を繰り返すことで維持し、ふるい濾過、Sheatherの糖浮遊法、および不連続スクロース勾配遠心分離によって糞便から精製した。精製したオーシストは、リン酸緩衝生理食塩水(PBS)+50 mM Trisおよび10 mM EDTA(pH 7.2)中4℃で、糞便採取後6ヶ月まで保存した。
細菌株
野生型(WT)およびトリプトファナーゼノックアウト(ΔtnaA)Bacteroides thetaiotaomicron(B. theta)VPI-5482株は、Vanessa Sperandio(University of Texas Southwestern Medical Center、米国テキサス州ダラス)から贈られた。BHI-血液寒天培地での増殖後、シングルコロニーをチョップドミート培地で嫌気的条件下、37℃で一晩増殖させた。細菌株は分注し、さらに処理するまで20%グリセロール中-80℃で凍結保存した。凍結株のコロニー形成単位(CFU)は、TSA +5%ヒツジ血液プレート(Thermo Fisher Scientific)での連続希釈スポッティングに基づいて算出した。
細胞株
全ての細胞株は、37℃、5% CO2インキュベーター中、通常の大気中酸素条件下で培養した。すべての細胞株は、e-Myco plus Mycoplasma PCR検出キット(Boca Scientific社製)を用いてマイコプラズマを含まないことを確認した。男性患者由来のヒト回盲部腺癌細胞(HCT-8;ATCC CCL-244)およびHCT-8 AhRノックアウト細胞株(本研究)は、10%ウシ胎児血清(Gibco)を添加したRPMI1640 ATCC改変培地(Thermo Fisher A14091-01)で維持した。
ヒト腎臓細胞株HEK 293Tに由来するLenti-X 293T細胞(タカラバイオ、632180)は、10%ウシ胎児血清(Sigma)を添加したDulbecco's Modified Eagle's Medium(DMEM high glucose;Sigma D6329)で維持した。
NIH/3T3胚性マウス線維芽細胞(ATCC CRL-1658)は、10%ウシ胎児血清(Sigma)を添加したダルベッコ変法イーグル培地(DMEM high glucose; Sigma D6329)で維持した。
8週齢から10週齢の雌性C57BL/6マウスから単離した初代回腸腸管上皮幹細胞(IEC)を、先に記載したように、マトリゲル(Corning)と10μM Y-27632 ROCK阻害剤(Torcis Biosciences)を含む50%L-WRN調整培地(CM)中で3Dスフェロイド培養として増殖・維持した59,60。本研究のすべての実験において、IECSは継代4から26の間で使用した。
マウス系統
Ifngノックアウトマウス(GKOと呼ぶ)はJackson Laboratoriesから購入した(系統番号002287、B6.129S7-Ifngtm1Ts/J)か、または特定の病原体を含まない動物施設で12:12の明暗サイクルで自家繁殖させた。マウスには、放射線照射した実験用げっ歯類の餌(Purina 5053)とオートクレーブ滅菌した水を自由摂取させた。感染経過中に歩けなくなった動物はSMARTBOX Auto CO2安楽死室で人道的に安楽死させた。すべてのマウス実験は、ワシントン大学セントルイス校医学部の動物実験委員会の承認を得た。
最初の代謝物投与実験では、2~4ヵ月齢のGKOマウス9匹を3つの投与群に分けた:ビヒクルBID(雄1匹、雌2匹)、インドール50mpk BID(雄1匹、雌2匹)、7CNI 50mpkBID(雄2匹、雌1匹)。各投与群では、マウスは兄弟姉妹と同居させたが、性別で分けた。2回目の代謝物投与実験では、2~3ヵ月齢のGKOマウス12匹を1回目の実験と同じ3つの投与群(ビヒクルBID、50mpk BIDインドール、50mpk BID 7CNI)に分け、1群あたり雄2匹、雌2匹とした。各治療群では、マウスは兄弟姉妹と同居させたが、性別で分けた。B.シータの再構成実験では、8週齢から16週齢の12匹のGKOマウスを、ビヒクル(雄2匹、雌2匹)、WT B.シータ(雄2匹、雌2匹)、ΔtnaA B.シータ(雄2匹、雌2匹)の3つの処置群に分けた。各処置群では、マウスは兄弟姉妹と同居させたが、性別で分けた。すべてのマウスに、実験開始前に腸内細菌叢を枯渇させるため、1g/Lアンピシリン、1g/Lネオマイシン、0.5g/Lバンコマイシン(Sigma社製)を含む水を3日間与えた。
方法の詳細
感染用C. parvumオーシストの調製
細胞培養または動物モデルに感染させる前に、C. parvumオーシストをダルベッコのリン酸緩衝生理食塩水(DPBS;コーニング)で希釈した40%漂白液(8.25%次亜塩素酸ナトリウムを含む市販の漂白剤)で氷上10分間処理し、1%(wt/vol)BSA(BSA;シグマ)を含むDPBSで3回洗浄した。漂白したオーシストは、感染前にDBPS+1%BSA中、4℃で最大1週間保存した。ほとんどの実験では、細胞培養液に直接添加した漂白オーシストで細胞を感染させた。胞子虫による感染を必要とする実験では、漂白オーシストをDPBSで希釈した0.75%タウロコール酸ナトリウム中で37℃、1時間静置した後、1,250 x g、3分間遠心分離して胞子虫をペレット化し、タウロコール酸ナトリウムを除去してから適切な細胞培養培地に再懸濁した。
C. parvumに対する代謝物の初期スクリーニング
代謝物(Sigma-Aldrich、表S4)を適切な溶媒(表S1)に溶解し、最終濃度1 mMでスクリーニングした。1mMで顕著な宿主毒性を示した代謝物は、より低濃度、具体的にはデオキシコール酸(DCA)、デオキシコール酸ナトリウム(SDC)、リトコール酸(LCA)は0.1mM、プロスタグランジンE2は0.05mMで再スクリーニングした。阻害アッセイでは、HCT-8細胞を黒色透明底96ウェルプレート(Greiner Bio-One社製)に1ウェル当たり1.5 x 105細胞でプレーティングし、コンフルエントになるまで約24時間培養した。その後、細胞を培養液で希釈した1種類の代謝産物とともに、1ウェルあたり5 x 105個の漂白C. parvumオーシストに感染させた。24時間の感染/処理後、細胞を9:1メタノール:酢酸溶液で5分間固定し、DPBSで2回洗浄し、PBS中0.05%サポニンで10分間透過処理し、抗体染色前にPBS中0.05%サポニン、5%ノーマルヤギ血清(NGS)、5%ウシ胎児血清(FBS)で10分間ブロックした。寄生虫は、1% NGSと0.1%サポニンを含むPBSで1:1000に希釈した抗RH抗体(トキソプラズマ株RHに対して作製したウサギポリクローナル抗体で、細胞内のすべてのC. parvumステージ35も認識する)で標識し、続いてAlexa Fluorヤギ抗ウサギ594二次抗体(Thermo Fisher Scientific、一次抗体と同じ希釈)で標識した。宿主細胞をHoechst 33342(1μg/mL、Thermo Fisher Scientific)で10分間染色した。プレートを BioTek Cytation 3 cell imager の 10× 対物レンズで撮像した(3×3 グリッドでウェルあたり 9 枚)。Gen5 ソフトウェアバージョン 3.02 を用いて、ウェルあたりの寄生虫(Texas Red チャンネルの点刻)および宿主細胞(DAPI チャンネルの核)の総数を定量した。各代謝物は、6 回の別々の実験で 3 回ずつスクリーニングした。相対的な寄生虫および宿主細胞の増殖は、各プレートの処理ウェル対 PBS 陰性対照ウェルにおける C. parvum または宿主細胞の数の比としてそれぞれ算出した。
C. parvum増殖アッセイ
すべてのC. parvum増殖アッセイ(最初の代謝物スクリーニングを除く)は、各実験セクションに記載された変更点を除き、ここに詳述したとおりに実施した。HCT-8細胞は、黒色で底が透明な96ウェルプレート(Greiner Bio-One)に1ウェルあたり1.5 x 105細胞でプレーティングし、コンフルエントになるまで約24時間培養した。細胞を1ウェル当たり1 x 105個の漂白オーシストに感染させた。約24時間の感染/処理後、細胞を4%ホルムアルデヒドで10分間固定し、DPBSで2回洗浄した。その後、透過処理し、0.1%Triton X-100と1%BSAを含むPBSで20分間ブロックしてから抗体染色を行った。C. parvum寄生虫を、0.1% Triton X-100と1% BSAを含むPBSで1:2,000に希釈したPan-Cp(C. parvumに対して飼育されたウサギのポリクローナル抗体で、寄生虫の全ステージを認識する34)で標識し、続いてAlexa Fluorヤギ抗ウサギ488二次抗体(Thermo Fisher Scientific、一次抗体と同じ希釈)を用いた。宿主細胞核をHoechst 33342(5μg/mL、Thermo Fisher Scientific)で20分間染色した。プレートを BioTek Cytation 3 cell imager の 10× 対物レンズで撮像した(3 x 3 グリッドでウェルあたり 9 枚)。BioTek Gen5ソフトウェアバージョン3.08(Agilent)を用いて、ウェルあたりの寄生虫(GFPチャンネルの点刻)と宿主細胞(DAPIチャンネルの核)の総数を定量した。
インドールアナログのスクリーニング
インドールアナログ(表S2およびS4)は、Sigma-Aldrich(ミズーリ州セントルイス)またはAA Blocks, Inc.(カリフォルニア州サンディエゴ)から注文し、DMSO中100mMまたは200mMで再構成した。C. parvum増殖アッセイは、すべてのアナログを培地で1mMに希釈し、上記のように実施した。相対的寄生虫数は、各プレートの処理ウェルにおけるC. parvumの数と1%DMSO陰性対照ウェルにおける寄生虫数の平均値との比として算出した。プロットされたデータは、6反復の平均±S.D.を表す(2回の独立した実験から得られた3つのテクニカルレプリケート)。
C. parvumおよび宿主に対する代謝物の用量反応
C. parvum阻害の代謝物EC50値を算出するため、代謝物を200 μM(DCA、LCA、SDC)、4 mM(4HI、ピリドキサールHCl)、または2 mM(インドール、インドールアナログ)から開始する7点1:2連続希釈系列で試験した。C. parvum増殖アッセイは上記のように行い、相対寄生虫数は、処理ウェル中のC. parvumの数を1%DMSO陰性対照ウェル中の寄生虫数の平均値で除した比として算出した。宿主細胞毒性のCC50値を算出するため、増殖アッセイを以下のように変更して実施した: HCT-8細胞を低濃度(1ウェルあたり5×104細胞)でプレーティングし、細胞は未感染のままとし、7点1:2連続希釈系列を400μM(DCA、LCA、SDC)、16mM(4HI、ピリドキサールHCl)または8mM(インドール、インドールアナログ)から開始した。細胞を固定し、透過処理し、Hoechstで染色し、上記のようにCytation 3で計数した。相対的宿主毒性は、処理したウェルの宿主核数を1%DMSO陰性対照ウェルの宿主核数の平均値で割った比として計算した。また、低濃度(1ウェルあたり1×104細胞)でプレーティングしたHCT-8細胞を用いて、宿主細胞毒性のCC50値をモニターした。細胞は未処理のままか、400μM(DCA、LCA)、16mM(ピリドキサールHCl)または4mM(インドール)から始まる8点1:2連続希釈系列で処理した。細胞生存率は、ATPの定量に基づくCell Titer-Glo Assay(Promega)によって決定した。発光シグナルはCytation3マルチモードプレートイメージャー(BioTek)で測定した。相対的宿主毒性は、処理ウェルにおける発光値を1% DMSO陰性対照ウェルにおける発光値の平均数で割った比として算出した。C. parvum および宿主細胞に対する EC50 値および EC90 値は、GraphPad Prism 9 を用いて、データポイントごとに 6 レプリケート(2 つの独立した実験から得られた 3 つのテクニカルレプリケート)の非線形回帰曲線フィットを用いて算出した。代謝物の宿主に対する寄生虫に対する選択性は、宿主の CC50 を C. parvum の EC50 で割った値として計算した。
AhRアゴニストを用いたC. parvum増殖アッセイ
AhRアゴニストであるVAF347(Sigma)およびFICZ(AAblocks, Inc.)はDMSO中10 mMで再構成し、インドール、4-メチルインドール(4MeI)およびキヌレン酸(Sigma)はDMSO中100 mMで再構成した。化合物は、1μM(VAF347とFICZ)または1mM(インドール、4MeI、キヌレン酸)の開始濃度に培地で希釈し、1:2で2回連続希釈した。C. parvum増殖アッセイは上記のように行い、相対寄生虫数は、処理ウェル中のC. parvum数を1%DMSO陰性対照ウェル中の平均数で割った比として算出した。プロットされたデータは、9反復の平均±S.D.を表す(3つの独立した実験による3つのテクニカルレプリケート)。
AhR標的遺伝子の遺伝子発現解析
HCT-8細胞を12ウェル培養プレートに1ウェルあたり1×106細胞でプレーティングし、コンフルエントになるまで約24時間培養した。その後、各ウェルの培地を1%DMSO、VAF347(250 nM)、インドール(1.5 mM)または4-ヒドロキシインドール(2.5 mM)を含む培地に交換し、さらに24時間培養した。その後、細胞をRLTバッファー(QIAGEN)+1%-メルカプトエタノールで溶解し、QIAshredderカラム(QIAGEN)を用いてホモジナイズした。RNAはRNeasy Mini kit(QIAGEN)を用いて抽出し、RQ1 DNase(Promega)で処理してDNAコンタミネーションを除去し、SuperScript VILO cDNA合成キットを用いてcDNAに変換した。逆転写定量PCR(RT-qPCR)は、QuantStudio 3リアルタイムPCRシステム(Applied Biosciences)を用い、TB Green Advantage qPCRプレミックス(タカラバイオ)と以下のプライマー(5′~3′)を用いて行った: ヒトCYP1A1(フォワード、ACATGCTGACCCTGGGAAAG;リバース、GGTGTGGAGCCAATTCGGAT;プライマーバンクID 189339226c2)、ヒトAHRR(フォワード、CTTAATGGCTTTGCTCTGGTCG; リバース、TGCATTACATCCGTCTGATGGA61)およびヒトGAPDH(フォワード、TGAGTACGTCGTGGAGTCCA;リバース、AGAGGGGCAGAGATGATGA;本研究)。相対遺伝子発現は、QuantStudio Design and Analysis Softwareで、ヒトGAPDHを参照遺伝子とし、各遺伝子の発現をDMSO対照サンプルにおける平均発現に対して正規化するΔΔCT法62を用いて算出した。プロットされたデータは、1つのサンプルでRNAが分解されたためテクニカルレプリケートが3つであったインドールを除き、すべてのグループの4つのテクニカルレプリケートの平均±S.D.を表す。
HCT-8細胞におけるAHRのCRISPR/Cas9 KO
ヒトAHR遺伝子(NM_001621)の第1エクソンを標的とする短いガイドRNA(5′-TCACCTACGCCAGTCGCAAG-3′)を、BsmBI消化したCas9プラスミドlentiCRISPR v2(Addgene #52961 )にクローニングした63。得られたプラスミド(pLentiCRISPRv2-sgAhR)を、サポートプラスミドpMD2とともにトランスフェクトした。 g(Laboratory of Didier Trono, Addgene #12259 )、pMDLg/pRRE(Addgene #12251 )64、およびpRSV-Rev(Addgene #12253 )64とともに、Lipofectamine 3000試薬(Thermo Fisher Scientific)を用いて、Lenti-X 293T細胞(Takara Bio)に等モル濃度でトランスフェクトした。レンチウイルスを含む上清をトランスフェクション後72時間で回収し、0.45μMのポリエーテルスルホン(PES)フィルターを通し、10μg/mLのポリブレン(Sigma)を含む細胞培養液で1:2に希釈してからHCT-8細胞に添加した。ウイルス添加の48時間後から12日間、ピューロマイシン(16μg/mL)を用いて、2-3日ごとにピューロマイシン培地を交換しながら、安定したトランスジェニック細胞を選択した。トランスジェニック細胞集団を連続希釈して単一細胞を単離し、標的領域を挟むプライマー(フォワード:5′-GCACCATGAACAGCAGCAG-3′;リバース:5′-TCCAAGTCCTCTGTCTCCCA-3′)を用いて増幅および配列決定(Genewiz, Inc.)を行い、AHRの両アレルに同一の劇症変異を有するクローン株を同定した。AhRの機能喪失は、AhR WTおよびKO細胞株をVAF347(500 nM)または1%DMSOで24時間処理してからRNAを採取し、上記のようにCYP1A1遺伝子の発現を解析することで確認した。プロットされたデータは、1つの実験から得られた各処理群3テクニカルレプリケートの平均±S.D.を表す。HCT-8 WT vs AhR KO細胞株におけるCp増殖アッセイを、インドール(1 mM)、4HI(1 mM)、VAF347(500 nM)または0.5% DMSOで処理し、上記のように行った。プロットされたデータは、6反復の平均値±S.D.を表す(2つの独立した実験から得られた3つのテクニカルレプリケート)。
インドールによるスライディングウィンドウ処理
HCT-8 細胞をウェルの底に接着させた後(播種後4時間)、「前処理」ウェルの培地を0.87% DMSO 培地中のEC90 濃度のインドール(877 μM)または7-シアノインドール(500 μM)に置換した。他のすべてのウェルの培地は、0.87%DMSO培地と交換した。さらに20時間培養した後、すべてのウェルを培地で2回洗浄し、1×105個の漂白オーシストに感染させた。0.87%DMSO培地中のEC90濃度のインドールまたは7-シアノインドールを0~4時間および0~24時間処理ウェルに添加し、残りのウェルには0.87%DMSO培地を添加した。すべてのウェルを4時間後に培地で2回洗浄し、4-24時間および0-24時間処理ウェルではEC90濃度のインドールまたは0.87%DMSO培地中の7-シアノインドール、その他のすべてのウェルでは0.87%DMSO培地で培地を交換した。すべての細胞を24時間後に固定し、上記のように染色および画像化した。相対的寄生虫数は、処理ウェルにおけるC. parvumの数をDMSO陰性対照ウェルにおける平均数で割った比率として算出した。プロットされたデータは、6反復の平均±S.D.を表す(2つの独立した実験から得られた3つのテクニカルレプリケート)。
C. parvumの抗体およびEdU標識
HCT-8細胞を、直径12mmのガラスカバースリップ(Thermo Fisher Scientific社製)1枚あたり4.5 x 105細胞で24ウェル組織培養プレートにプレーティングし、コンフルエントになるまでインキュベートした(約24時間)。単層を約1×106個の胞子虫に感染させ、4時間後にDPBSで2回洗浄し、1%DMSO培地中、EC90濃度のインドール(880μM)または7-シアノインドール(500μM)で処理した。EdUパルス標識では、1処理群につき2枚のカバースリップを1セットとし、10μM EdUで4時間インキュベートした後、4%ホルムアルデヒドで固定した。次にEdUを別の2セットのカバースリップに4時間添加してから固定し、このサイクルを20hpiまで繰り返した。すべてのカバースリップをDPBS中の0.1% Triton X-100+1% BSAで20分間透過/ブロックした後、Click-iT Plus EdU 488 imaging kit(Thermo Fisher Scientific)で30分間処理してEdUを標識した。マウスモノクローナル抗体1A5とウサギポリクローナル抗体Pan Cpで寄生虫を標識し、抗マウスAlexa Fluor 568(Thermo Fisher Scientific)と抗ウサギAlexa Fluor 647(Thermo Fisher Scientific)、Hoechst核染色を行った。カバースリップはProLong Glass antifade mountant(Thermo Fisher Scientific)を用いてスライドガラスにマウントし、マニキュアで密封した。各ライフステージの寄生虫数は、Zeiss Axioskop Mot Plus蛍光顕微鏡の100×油浸対物レンズを用い、10フィールドからカウントした。各時点の各ライフステージの寄生虫数の合計を、その時点のC. parvumの総数で割った。比率は3つの独立した実験の平均をとった。
C. parvumメロゾイトの膜標識のために、HCT-8細胞を上記のようにカバースリップ上で培養し、5×105個のC. parvumオーシストに感染させた。細胞をDPBSで4時間後に2回洗浄し、1%DMSO培地中のEC90濃度のインドール(880μM)または7-シアノインドール(500μM)を添加した。モノレイヤーを固定し、マウスモノクローナル抗体1E12とウサギポリクローナル抗体Pan Cpで22hpi染色した後、抗マウスAlexa Fluor 488(Thermo Fisher Scientific)と抗ウサギAlexa Fluor 568(Thermo Fisher Scientific)、Hoechst核染色を行った。カバースリップは、ProLong Glass antifade mountant(Thermo Fisher Scientific)を用いてスライドガラスにマウントし、マニキュアで密封した。画像は、AxioVision ソフトウェア(Carl Zeiss, Inc.)を使用し、Zeiss Axioskop Mot Plus 蛍光顕微鏡(100×油浸対物レンズ付き)で取得し、ImageJ(https://fiji.sc/)で処理した65。
ALI培養とウォッシュアウトアッセイ
簡単に述べると、照射したマウス3T3線維芽細胞(i3T3、ATCC CRL-1658)細胞を、10%マトリゲル(コーニング社製)でコートしたトランスウェル(ポリエステル膜、孔径0.4μm、挿入部6.5mm、コーニング社製)上に、トランスウェル当たり8×104個の細胞密度でプレーティングした。細胞は、10%ウシ胎児血清、100U/mlペニシリン、0.1mg/mLストレプトマイシンを添加したDMEM高グルコース培地中、37℃で24時間培養した。マウス腸管上皮細胞(mIEC)スフェロイドをトリプシン処理し、i3T3フィーダー層上にトランスウェルあたり5 x 104 mIECsでプレーティングし、10 μM Y-27632(ROCK阻害剤、RI)を添加した50% L-WRN調整培地(CM)中で培養した。培地は2~3日ごとに交換し、7日後に上部の培地を除去して気液界面を形成させた。
ALI培養におけるC. parvumのインドールおよび7CNIのEC50およびEC90濃度を測定するため、上面培地除去の3日後にC. parvumのオーシスト(トランスウェルあたり5 x 104個)をALI培養の上部に添加した。感染から約4時間後、トランスウェルの上部をDPBSで2回洗浄して未発育のオーシストを除去し、下部培地を8点連続希釈系列でインドールまたは7CNIを含む培地に交換した。約48時間後にトランスウェル膜から細胞を掻き取り、QIAamp DNA mini kit(QIAGEN)を用いてDNA抽出を行った。C. parvumおよび宿主ゲノムに相当するDNAは、QuantStudio 3リアルタイムPCRシステム(Applied Biosystems)を用い、それぞれのGAPDH遺伝子のプライマーを用いて、既述の方法で定量した34。EC50およびEC90値は、データ1点につき7反復(3回の独立した実験から2~3テクニカルレプリケート)の非線形回帰曲線フィットを用いて算出した。
インドールおよび7CNIウォッシュアウト実験では、C. parvumのオーシスト(トランスウェルあたり5 x 104個)を、上部の培地を除去した3日後にALI培養の上部に添加した。感染から約4時間後、トランスウェルの上部をDPBSで2回洗浄し、未発育のオーシストを除去した。残りのトランスウェルの底部培地は、1%DMSO、EC50 (577 μM)、EC90 (1894 μM)、または2 x EC90 (3788 μM)のインドール、またはEC50 (379 μM)、EC90 (688 μM)、または2 x EC90 (1376 μM)の7CNIを含む培地に変えた。約48時間後、インドールを洗浄し、通常の増殖培地を底部に入れた清浄なウェルにトランスウェルを移した。各インドール/7CNI濃度のトランスウェルのサブセットを掻き取り、感染後D2(洗浄日)、D4(回復2日)、D6(回復4日)にDNAを採取した。C.パルバムおよび宿主ゲノム相当量は、上述のようにqPCRによってDNAサンプルから定量した。実験サンプルの値は、各時点におけるDMSOコントロールサンプルの平均値に対して正規化した。プロットされたデータは、6反復の平均値±S.D.を表す(2つの独立した実験から得られた3つのテクニカルレプリケート)。
インドール処理HCT-8細胞のトランスクリプトミクス
HCT-8細胞は12ウェル培養プレートに1ウェルあたり9 x 105細胞でプレーティングし、コンフルエントになるまで約24時間培養した。ウェルあたり約4×106個のCp胞子虫を感染させ、4時間培養した後、DPBSで2回洗浄し、細胞外の寄生虫を除去した。その後、細胞をインドール(880μM)または1%DMSOで4時間または12時間処理した後、RNAを採取した。細胞をRLTバッファー(QIAGEN)+1%-メルカプトエタノール(Sigma)で溶解し、QIAshredderカラム(QIAGEN)を用いてホモジナイズした。RNAはRNeasy Mini kit(QIAGEN)を用いて抽出し、DNA-free DNA Removal kit(Thermo Fisher Scientific)で処理した。各処理条件につき3つのテクニカルレプリケートから得られた全RNAは、ライブラリー調製と配列決定のためにゲノムアクセス技術センター(Washington University School of Medicine)に提出された。RNAの完全性はAgilent Bioanalyzerを用いて測定し(全サンプルのRINは10)、ライブラリー調製はサンプルあたり5~10μgの全RNAを用いて行った。リボソームRNAは、オリゴdTビーズ(mRNA Direct kit、Life Technologies社製)を用いたポリA選択により除去した。mRNAは次に、逆転写酵素バッファー中で、94℃で8分間加熱することにより断片化した。mRNAは、SuperScript III RT酵素(Life Technologies社製)とランダムヘキサマーを用いて、製造業者の指示に従って逆転写した。ds-cDNAを得るために第2鎖反応を行い、cDNAをブラントエンドしてから3′末端にA塩基を付加し、イルミナシーケンスアダプターを両端にライゲーションした。ライゲーションした断片を、ユニークなデュアルインデックスタグを組み込んだプライマーを用いて12~15サイクル増幅した後、Illumina NovaSeq 6000でシーケンスし、150bpのペアエンドリードを生成した。
脱多重化したfastqファイルをPartek Flow(Partek, Inc.)にインポートし、デフォルトパラメーターのSTAR 2.7.8aアライナーを用いて、Homo sapiens hg38ゲノムビルド(NCBI GenBankアセンブリID GCA_000001405.15)にマッピングした67 。この時点で、DMSOで4時間処理したレプリケートのうち1つは、リードのほとんどが遺伝子間領域にマッピングされていたため(DNAコンタミネーションを示す)、以降の解析から除外した。残りの11サンプルについて、遺伝子ごとのリード数をサンプルごとの総リード数で割ってサンプル間の遺伝子発現値を正規化し、counts per million (CPM)値を得た。インドール処理サンプル(計6サンプル)とDMSO処理サンプル(計5サンプル)の一対比較を、デフォルトパラメーターを用いてPartek遺伝子特異的解析(GSA)アルゴリズムを用いて行った。ボルケーノプロットはPartek Flowで作成した。FDRで補正したp値が0.05未満で、絶対倍数変化が2より大きい場合、遺伝子は有意に差次的に発現しているとみなされた。有意な遺伝子の階層的クラスタリング解析は、ユークリッド点距離行列とクラスタ距離メトリックの平均連鎖を用いてPartek Flowで行った。Gene Ontology (GO) パスウェイ解析は、Enrichr (http://maayanlab.cloud/Enrichr/)68,69,70 で GO Biological Process 2021 データベースを用いて行った。
アミノ酸補充によるC. parvumの増殖
HCT-8細胞培養液に1 mM L-トリプトファン(シグマ社製)を添加し、1 mM L-フェニルアラニン(シグマ社製)を添加または無添加し、フィルター滅菌した。インドールは、3つの培地すべてにおいて、2 mMから始まる5段階の1:2連続希釈で試験した。C. parvum増殖アッセイは上記のように行い、相対寄生虫数は、各ウェルのC. parvum数を1%DMSO、非補足培地対照ウェルの平均寄生虫数で割った比率として算出した。各培地タイプにおけるCpに対するインドールEC50値は、非線形回帰曲線フィットを用いて算出した(データポイントあたり6反復(2つの独立した実験から3つのテクニカルレプリケート))。
シーホースを用いた代謝アッセイ
すべての代謝アッセイにおいて、Seahorse XF96 Analyzer(Agilent)を用いてミトコンドリア酸素消費率(OCR)および細胞外酸性化率(ECAR)を測定した。HCT-8細胞またはHCT-8 AhR KO細胞を96ウェルSeahorse XF96細胞培養マイクロプレート(Agilent)に1ウェルあたり2×104細胞でプレーティングし、約24時間培養した。培地は、1%DMSOまたはインドール(2mMから開始)もしくは7CNI(1mMから開始)の1:2連続希釈液を含む新鮮な培地に交換され、さらに18時間培養された(細胞コンフルエントは約90%)。Seahorse XFe96 細胞外フラックスセンサーカートリッジ(Agilent)を、非 CO2、37℃のインキュベーター内で蒸留水中で一晩水和させた。その後、水をXF Calibrant(Agilent)に交換し、センサーカートリッジを非CO2、37℃のインキュベーター内でさらに約1時間インキュベートした。アッセイ培地は、Seahorse XF DMEM 培地 pH 7.4(Agilent) に 1 mM ピルビン酸(Agilent)、2 mM グルタミン(Agilent)、10 mM グルコース(Agilent)を加えて調製した。
Seahorse XF Cell Energy Phenotype kit(アジレント)を用いたアッセイでは、細胞をアッセイ培地で一度洗浄した後、非CO2、37℃のインキュベーター内でアッセイ培地中で1時間インキュベートした。FCCP(1μM)とオリゴマイシン(1μM)の混合液を注入ポートから補充する前後で、混合(2分間)と測定(3分間)を5サイクル行い、OCRとECARのレベルを測定した。
Seahorse XF Real-time ATP Rate Assay kit(アジレント)を用いたアッセイでは、細胞増殖培地をアッセイ培地に交換し、非CO2、37℃のインキュベーターで1時間インキュベートした。アッセイ培地は、アッセイを行う前に新鮮なアッセイ培地に交換した。オリゴマイシン(1.5μM)、次いでロテノン(0.5μM)およびアンチマイシンA(0.5μM)の混合液を、注入ポートから順次補充する前後の混合(2分間)および測定(3分間)を4サイクル行い、OCRおよびECARレベルを測定した。
Seahorse XF Cell Mito Stress Test Kit(アジレント)を用いたアッセイでは、細胞をアッセイ培地で1回洗浄した後、非CO2、37℃のインキュベーター内でアッセイ培地中で1時間インキュベートした。オリゴマイシン(1.5μM)、次いでFCCP(1μM)、ロテノン(0.5μM)とアンチマイシンA(0.5μM)の混合液を注入ポートから順次補充する前後で、混合(2分)と測定(3分)を4サイクル行い、OCRとECARのレベルを測定した。
結果はまずWave v2.6.1 (Agilent)で解析した後、Graphpad Prism 9にインポートした。すべてのアッセイは、各プレートにつきサンプルあたり6テクニカルレプリケートで2回実施した。OCR 値または ECAR 値が負の場合、または GraphPad Prism 9 で実施した Q = 1% の ROUT 検定で外れ値として同定された場合は、分析からウェルを除外した。プロットされたデータは、10-12反復の平均値±S.D.を表す(2つの独立した実験から得られた5-6テクニカルレプリケート)。
インドール処理C. parvumのMitotracker染色
HCT-8細胞をカバースリップ上で培養し、5 x 105個のC. parvumオーシストに感染させた。細胞をDPBSで2回洗浄し、培地に2×EC90濃度のインドール(1.76mM)、7-シアノインドール(1mM)または10μMカルボニルシアニドm-クロロフェニルヒドラゾン(CCCP、シグマ社製)を1%DMSO培地で添加した。感染細胞は2時間(22~24時間)処理、または24時間連続処理し、1%DMSOコントロールと比較した。MitoTracker Red CMXRos(最終濃度50 nM)を固定45分前に培養液に添加した。単層を固定し、24時間後にマウスモノクローナル抗体1E12で染色し、続いて抗マウスAlexa Fluor 488(Thermo Fisher Scientific)とHoechst核染色を行った。カバースリップは、ProLong Glass antifade mountant(Thermo Fisher Scientific)を用いてスライドガラスにマウントし、マニキュアで密封した。画像は、Zeiss Axioskop Mot Plus 蛍光顕微鏡に 100× 油浸対物レンズを取り付け、AxioVision ソフトウェア(Carl Zeiss, Inc.
ミトコンドリア阻害剤を用いたC. parvum増殖アッセイ
ロテノン(シグマ社製)、アンチマイシンA(シグマ社製)、オリゴマイシン(シグマ社製)、およびカルボニルシアニドm-クロロフェニルヒドラゾン(CCCP、シグマ社製)をDMSO中20 mMで再構成した。化合物をDMSOで4mMに希釈し、ロテノンとアンチマイシンAをそれぞれ4mMで混合した。化合物をDMSOで1:2に7回連続希釈した後、細胞培養液で1%DMSOに希釈し、各化合物の最高濃度は40μMから開始した。C. parvum増殖アッセイは上記のように行い、相対寄生虫数は、処理ウェル中のC. parvum数を1%DMSO陰性対照ウェル中の平均数で割った比率として算出した。プロットされたデータは、4反復の平均±S.D.を表す(2つの独立した実験による2つのテクニカルレプリケート)。40μMおよび20μMのCCCPのデータは、これらの濃度で宿主毒性が観察されたため含まれていない。
C. parvum感染GKOマウスの代謝物処理
最初のin vivo代謝物実験では、インドールおよび7-シアノインドール溶液をビヒクル(10%DMSOおよびミリポアろ過水)中5 mg/mLで調製し、分注して-20℃で保存した。2~4ヵ月齢のGKOマウス(Jackson Laboratories #002287 )計9匹を、ビヒクルBID(雄1匹、雌2匹)、50mpk BIDインドール(雄1匹、雌2匹)、50mpk BID 7CNI(雄2匹、雌1匹)の3つの治療群に分けた。各治療群では、マウスは兄弟姉妹と同居させたが、性別で分離した。実験初日(0dpi)に、すべてのマウスに、それぞれの処理液200μLに混合した2×104 Cpオーシストを経口経口投与により感染させた。マウスは、約12時間ごとに200μLの処理液を追加で経口投与され、合計7日間投与された。マウスは24~48時間ごとに体重を測定し、生存率を記録した。マウス1匹につき3、5、7、9dpiの糞便ペレットを1回採取した。糞便ペレットはさらに処理するまで-80℃で保存した。実験は10dpiで終了した。
in vivo代謝物実験の第2セットでは、インドールおよび7-シアノインドール溶液をビヒクル(10%DMSOおよびミリポアろ過水)中10mg/mLで調製し、分注して-20℃で保存した。2~3ヵ月齢のGKOマウス計12匹を、前回と同じ3つの治療群(ビヒクルBID、インドール50mpk BID、7CNI50mpk BID)に分け、1群あたり雄2匹、雌2匹とした。各治療群内では、マウスは兄弟姉妹と同居させたが、性別で分けた。実験初日(0dpi)に、すべてのマウスに100μlのPBS中2×104個のCpオーシストを経口経口投与により感染させた。約30分後、すべてのマウスにそれぞれの処理液100μLを経口投与した。マウスは、合計7日間、約12時間ごとに100μLの処理液をさらに経口投与された。マウスは24~48時間ごとに体重を測定し、生存率を記録した。マウス1匹につき3、5、7、9dpiの糞便ペレットを1回採取した。糞便ペレットはさらに処理するまで-80℃で保存した。実験は30dpiで終了した。
DNA は QIAamp Powerfecal Pro DNA kit(QIAGEN)を用い、製造元のプロトコールに従って糞便ペレットから抽出した。糞便ペレットあたりのCpオーシスト数を、上述のようにCp GAPDH遺伝子に対するqPCRを用いて算出し、ペレットの重量(mg)で割って、mg糞便あたりのCp数を得た。
C.パルバム感染GKOマウスのB.シータ再構成
8週齢から16週齢のGKOマウスを性別に分け、ビヒクル(雄2匹、雌2匹)、WT B. theta(雄2匹、雌2匹)、ΔtnaA B. theta(雄2匹、雌2匹)の3群に分けた。各処理群では、マウスは兄弟姉妹と同居させたが、性別で分けた。すべてのマウスに、1 g/Lアンピシリン、1 g/Lネオマイシン、および0.5 g/Lバンコマイシン(Sigma)を含む水(Abx水)を3日間与え、腸内細菌叢を枯渇させた。Abx処理後(-3dpi)、マウス群にWT B. thetaまたはΔtnaA B. theta(1×108CFU)を接種し、対照マウスにはビヒクル(ミリポア濾過水に10%グリセロール)を経口投与した。マウスは、腸内細菌叢を再構成するために、-3、-2、1、2dpiの3回の追加投与を受けた。実験初日(0dpi)に、すべてのマウスに100μLのPBSに2×104個のCpオーシストを経口投与し感染させた。糞便中のCpオーシストを測定するために3、5、7、9dpiに、腸内細菌叢を分析するために-6、-3、0、4、8dpiに糞便ペレットを採取した。糞便ペレットはさらに処理するまで-80℃で保存した。実験は16dpiで終了し、マウスを人道的に犠牲にした。DNA は QIAamp Powerfecal Pro DNA kit(QIAGEN)を用い、製造元のプロトコールに従って糞便ペレットから抽出した。糞便ペレットあたりのCpオーシスト数は、上述のようにCp GAPDH遺伝子のqPCRを用いて算出し、ペレットの重量(mg)で割ってmg糞便あたりのCp数を得た。
16S rRNA分析
細菌量を定量するために、16S rRNA遺伝子をqPCRで増幅し、SYBR Greenを用いて定量した。qPCR用のプライマーは、16S rRNA遺伝子のV4超可変領域を検出するための515 Fおよび805 Rから構成された:(フォワード、5′-GTGCCAGCMGCCGCGGTAA-3′;リバース、5′-GACTACCAGGGTATCTAATCC-3′)。16S rRNA配列決定のために、V4領域のPCR増幅は、以前に記載されたように行われた71。簡単に言うと、各サンプルは、V4領域(F515/R805)に特異的なGolay-barcodedプライマーを用いて3連で増幅され、ゲル電気泳動によって確認された。PCRにはPlatinum High Fidelity Taq(Invitrogen)を用いた。アンプリコンをプールし、製造元の指示に従って0.6x Agencourt Ampure XPビーズ(Beckman-Coulter)で精製した。最終的にプールされたサンプルは、3つのシーケンスプライマーのアリコートとともに、Center for Genome Sciences(Washington University School of Medicine)により2 x 250 bp Illuminaプロトコルを用いてシーケンスされた。リードの品質管理とアンプリコン配列バリアント(ASV)の分離はdada2 Rパッケージで行った。残りのリードは、Ribosomal Database Project(RDP trainset 16/release 11.5)の16S rRNA遺伝子配列データベースを使用して分類を割り当てた73。α多様性(リッチネス、シャノン多様性)およびβ多様性分析(重み付けなしおよび重み付けUniFrac距離)などの生態学的分析は、PhyloSeqおよび追加のRパッケージを使用して実行した74。
定量化と統計解析
すべての統計解析は、特に指定がない限り、GraphPad Prism 9で行った。一元配置分散分析(単一変数)または二元配置分散分析(複数変数)、それに続くダネットの多重比較検定を用いて、各実験グループと対照グループ(各図の凡例で定義)を比較した。EC50およびEC90値は、非線形回帰曲線フィット(log阻害剤対正規化反応-可変勾配)を用いて算出した。マウス実験では、両側Mann-Whitney U 検定を用いて、各投与群 を個々の日において対照群と比較した。投与群間の体重の比較は、マッチした値についてガイザー・グリーンハウス補正を行い、多重比較についてダネット検定を行った混合効果モデルを用いて解析した。使用した統計検定、技術的反復数(n)、独立生物学的反復数(N)、標準誤差を含む各実験の統計パラメータは、図の説明および関連する方法の詳細に報告されている。
謝辞
Cpオーシストを提供してくれたWilliam Witola(University of Illinois at Urbana-Champaign)、ここで使用したB. theta株を提供してくれたVanessa Sperandio、および技術支援をしてくれたLynn Fosterに感謝する。NIHからの助成金(L.D.S.にはAI145496、K.L.V.にはDK109081)を一部利用した。ゲノム解析については、Washington大学医学部McDonnell Genome InstituteのGenome Technology Access Centerに感謝する。当センターは、Siteman Cancer Centerに対するNCI Cancer Center Support Grant(P30 CA91842)、およびNIHの一部門であるNational Center for Research Resources(NCRR)からのInstitute of Clinical and Translational Sciences/Clinical and Translational Science Award(ICTS/CTSA)助成金UL1TR002345、およびNIH Roadmap for Medical Researchの一部支援を受けている。本書は著者個人の責任によるものであり、必ずしもNCRRやNIHの公式見解を示すものではない。
著者貢献
構想、L.J.F.-J.、R.X.、G.W.、K.L.V.、T.S.S.、M.T.B.、L.D.S.、方法論、L.J.F.-J.、R.X、 G.W.、Y.F.、L.A.S.、H.M.、R.R.、E.A.K.、K.L.V.;形式分析、L.J.F.-J.、R.X.、G.W.、Y.F.、L.A.S.、H.M、 R.R.、E.A.K.、K.L.V.、M.T.B.;調査、L.J.F.-J.、R.X.、G.W.、Y.F.、L.A.S.、H.M.、R.R.、E.A.K、 およびK.L.V.;執筆、F.J.F.-J.、R.X.、K.L.V.D.、M.T.B.、およびL.D.S.;監修、K.L.V.、T.S.S.、M.T.B.、およびL.D.S.
利害関係
著者らは、競合する利益はないと宣言している。
包含と分岐
本論文の著者のうち1名以上が、研究分野または地理的な位置において、十分に代表されていないエスニック・マイノリティであることを自認している。本論文の著者のうち1名以上が、研究分野におけるマイノリティの代表性を高めることを目的としたプログラムからの支援を受けている。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード アクロバットPDFファイルのダウンロード (1MB)
資料S1. 図S1-S7
ダウンロード スプレッドシートのダウンロード(26KB)
表S1 メタボライトスクリーン結果
ダウンロード スプレッドシートダウンロード(20KB)
表S2 インドール類縁体
ダウンロード スプレッドシートダウンロード(23KB)
表S3 RNA-seq結果。
ダウンロード スプレッドシートのダウンロード(24KB)
表S4 代謝物カタログ情報
ダウンロード Acrobat PDFファイルのダウンロード(7MB)
資料S2 論文+補足情報
推奨論文
データとコードの入手可能性
本研究で作成されたRNA-seqリードおよび解析データは、Gene Expression Omnibus (GEO)データベースに寄託されており、公開日現在入手可能である。本研究で作成された16S rRNAシーケンスリードは、European Nucleotide Archive (ENA)に寄託されており、公開日現在入手可能である。アクセッション番号は主要リソース表に記載されている。本論文で報告されたその他のデータはすべて、要請があれば筆頭著者が共有する。
本論文ではオリジナルコードは報告していない。
本論文で報告されたデータを再分析するために必要な追加情報は、要請があれば筆頭責任者から入手可能である。
参考文献
1
R.,M. O'Connor、R. Shaffie、G. Kang、H.D. Ward
HIV/AIDS患者におけるクリプトスポリジウム症
AIDS, 25 (2011), pp.549-560, 10.1097/QAD.0b013e3283437e88
スコープで見るGoogle Scholar
2
L. プティニャーニ、D. メニケラ
原虫病原体クリプトスポリジウムの世界的分布、公衆衛生および臨床的影響
Interdiscip. Perspect. Infect. Dis., 2010 (2010), Article 753512, 10.1155/2010/753512
スコープで見るGoogle Scholar
3
K.L. Kotloff, J.P. Nataro, W.C. Blackwelder, D. Nasrin, T.H. Farag, S. Panchalingam, Y. Wu, S.O. Sow, D. Sur, R.F. Breiman, et al.
開発途上国の乳幼児における下痢性疾患の負担と病因(Global Enteric Multicenter Study, GEMS):前向き症例対照研究
Lancet, 382 (2013), pp.209-222, 10.1016/S0140-6736(13)60844-2
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
4
K.L. Kotloff, D. Nasrin, W.C. Blackwelder, Y. Wu, T. Farag, S. Panchalingham, S.O. Sow, D. Sur, A.K.M. Zaidi, A.S.G. Faruque, et al.
低所得国および中所得国に居住する乳幼児および小児における重症度の低い下痢エピソードの発生率、病因、および有害な臨床的影響:世界腸管多施設共同研究(GEMS)のフォローオンとしての12カ月症例対照研究
Lancet Global Health, 7 (2019), pp.e568-e584, 10.1016/S2214-109X(19)30076-2
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
5
M.M. Levine, D. Nasrin, S. Acácio, Q. Bassat, H. Powell, S.M. Tennant, S.O. Sow, D. Sur, A.K.M. Zaidi, A.S.G. Faruque, et al.
低・中所得国に居住する乳幼児および小児における下痢性疾患とその後の死亡リスク:GEMS症例対照研究および12ヵ月GEMS-1A追跡研究の解析
Lancet Global Health, 8 (2020), pp.e204-e214, 10.1016/S2214-109X(19)30541-8
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
6
W. チェックリー、L.D.エプスタイン、R.H.ギルマン、R.E.ブラック、L.カブレラ、C.R.スターリング
ペルーの小児におけるクリプトスポリジウム・パルバム感染の影響:成長の停滞とその後のキャッチアップ成長
Am. J. Epidemiol., 148 (1998), pp.497-506, 10.1093/oxfordjournals.aje.a009675
スコープで見るGoogle Scholar
7
K. Mølbak、M. Andersen、P. Aaby、N. Højlyng、M. Jakobsen、M. Sodemann、A.P. da Silva
栄養不良の原因としての乳児期のクリプトスポリジウム感染:西アフリカ、ギニアビサウのコミュニティ研究
Am. J. Clin. Nutr., 65 (1997), pp.149-152, 10.1093/ajcn/65.1.149
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
8
J.A.ザンブリスキー、D.V.ナイダム、D.D.ボウマン、M.L.ベローザ、A.J.バートン、T.C.リンデン、J.L.リオッタ、T.L.オリベット、L.トンデロ-マーティンス、H.O.モハメド
実験的にチャレンジした乳牛子牛におけるクリプトスポリジウム・パルバム・オーシストの糞便排出に関する記述
Parasitol. Res., 112 (2013), pp.1247-1254, 10.1007/s00436-012-3258-2
スコープで見るGoogle Scholar
9
D.S.リンゼイ、B.L.ブラッグバーン、C.A.サンダーマン、J.J.ジアンブロン
実験的に誘発されたクリプトスポリジウム・バイレイ感染に対する感受性に及ぼすブロイラー鶏の年齢の影響
Am. J. Vet. Res., 49 (1988), pp.
スコープで見るGoogle Scholar
10
J.M.ハトキン、J.J.ジアンブロン、B.L.ブラッグバーン
Cryptosporidium baileyiに対するブロイラー雛の血清抗体反応の動態
Avian Pathol., 22 (1993), pp.525-532, 10.1080/03079459308418940
スコープで見るGoogle Scholar
11
K.L. VanDussen、L.J. Funkhouser-Jones、M.E. Akey、D.A. Schaefer、K. Ackman、M.W. Riggs、T.S. Stappenbeck、L.D. Sibley
新生児マウスの腸内代謝産物が腸管上皮細胞におけるクリプトスポリジウム・パルバム感染に影響を及ぼす
mBio, 11 (2020), Article e02582-20, 10.1128/mBio.02582-20
Google Scholar
12
D. シャーウッド、K.W.アンガス、D.R.スノッドグラス、S.ツィポリ
実験用マウスにおける実験的クリプトスポリジウム症
Infect. Immun., 38 (1982), 471-475ページ
CrossRefScopusで表示Google Scholarで表示
13
L. L. Lantier, S. Lacroix-Lamandé, L. Potiron, C. Metton, F. Drouet, W. Guesdon, A. Gnahoui-David, Y. Le Vern, E. Deriaud, A. Fenis, et al.
腸管CD103+樹状細胞は、新生児マウスにおけるクリプトスポリジウム・パルバム感染の自然免疫制御におけるキープレイヤーである。
PLoS Pathog., 9 (2013), Article e1003801, 10.1371/journal.ppat.1003801
グーグル
14
L. ポティロン、S. ラクロワ=ラマンデ、M. マルキ、Y. ルヴァン、G. フォート、I. フランチェスキーニ、F. ローラン
Batf3依存性腸管樹状細胞はクリプトスポリジウム・パルバム感染の制御に重要な役割を果たしている。
J. Infect. Dis., 219 (2019), 925-935頁, 10.1093/infdis/jiy528
Scopusで見るGoogle Scholar
15
R. チャラニア、B.E.ウェイド、N.N.マクネア、J.R.ミード
クリプトスポリジウム感染マウスのマイクロバイオームの変化は、感受性および感染レベルの違いと相関する
Microorganisms, 8 (2020), Article 879, 10.3390/microorganisms8060879
Google Scholar
16
M.A. Carey、G.L. Medlock、M. Alam、M. Kabir、M.J. Uddin、U. Nayak、J. Papin、A.S.G. Faruque、R. Haque、W.A. Petri、C.A. Gilchrist
便微生物叢におけるメガファエラは下痢性クリプトスポリジウム症と負の相関を示す
Clin. Infect. Dis., 73 (2021), e1242-e1251頁, 10.1093/cid/ciab207
Google Scholar
17
J.A.ハープ、M.W.ワネミューラー、D.B.ウッドマンシー、H.W.ムーン
クリプトスポリジウム・パルバムに対する無菌または抗生物質処理成体マウスの感受性
Infect. Immun., 56 (1988), pp.
CrossRefScopusで表示Google Scholarで表示
18
L. Lantier、F. Drouet、W. Guesdon、R. Mancassola、C. Metton、R. Lo-Man、C. Werts、F. Laurent、S. Lacroix-Lamandé
ポリ(I:C)による新生児マウスの腸管クリプトスポリジウム・パルバム感染防御には、腸内細菌叢による追加のTLR5シグナルが必要である。
J. Infect. Dis., 209 (2014), 457-467頁, 10.1093/infdis/jit432
スコープで見るGoogle Scholar
19
C.L. Chappell、C. Darkoh、L. Shimmin、N. Farhana、D.K. Kim、P.C. Okhuysen、J. Hixson
クリプトスポリジウム感染感受性のバイオマーカーとしての糞便インドール
Infect. Immun., 84 (2016), 2299-2306頁, 10.1128/IAI.00336-16
スコープで見るGoogle Scholar
20
I.C. Castro, B.B. Oliveira, J.J. Slowikowski, B.P. Coutinho, F.J.W.S. Siqueira, L.B. Costa, J.E. Sevilleja, C.A. Almeida, A.A.M. Lima, C.A. Warren, et al.
アルギニンは、一酸化窒素合成酵素とアルギナーゼが関与する栄養不良の哺乳マウスにおけるクリプトスポリジウムパルバム感染を減少させる
栄養学, 28 (2012), 678-685頁, 10.1016/j.nut.2011.09.011
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
21
M.F. Laursen, M. Sakanaka, N. von Burg, U. Mörbe, D. Andersen, J.M. Moll, C.T. Pekmez, A. Rivollier, K.F. Michaelsen, C. Mølgaard, et al.
母乳育児に関連するビフィズス菌種は乳児の腸内で芳香族乳酸を産生する
Nat. Microbiol., 6 (2021), 1367-1382頁, 10.1038/s41564-021-00970-4
Scopusで見るGoogle Scholar
22
M. 松本昌彦、木部亮太、大賀俊樹、相羽洋一郎、栗原慎一郎、沢木栄一郎、古賀洋一郎、辨野義人
腸内細菌叢が腸管内腔メタボロームに及ぼす影響
Sci. Rep., 2 (2012), p. 233, 10.1038/srep00233
スコープで見るGoogle Scholar
23
C. シメレル、C.M.フィールド、S.ピニェロ-フェルナンデス、U.F.キーサー、D.K.サマーズ
インドールは膜電位を調節することにより大腸菌の細胞分裂を阻止する。
Biochim. Biophys. Acta, 1818 (2012), pp.1590-1594, 10.1016/j.bbamem.2012.02.022
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
24
C. ダーコー、K.プランツ=パリ、D.ビショフ、H.L.デュポン
クロストリジウム・ディフィシルは、ドメイン間シグナル伝達および抗菌分子であるインドールの産生を誘導することによって腸内細菌叢を調節する
mSystems, 4 (2019), 10.1128/mSystems.00346-18
グーグル・スカラー
25
T.R.ガルベ、小林正樹、湯川秀樹
細菌のインドール誘導性タンパク質が示唆する膜および酸化剤毒性
Arch. 微生物学, 173 (2000), 78-82頁, 10.1007/s002030050012
スコープで見るGoogle Scholar
26
J. キム、ホン、ヘオ、パク
インドール毒性は、Pseudomonas putidaにおけるアデノシン三リン酸産生およびタンパク質フォールディングの阻害に関与する。
FEMS Microbiol. Lett., 343 (2013), 89-99頁, 10.1111/1574-6968.12135
スコープで見るGoogle Scholar
27
T.D.ハバード、I.A.マレー、G.H.パーデュー
インドールとトリプトファンの代謝:ah受容体活性化への内因性経路と食事性経路
Drug Metab. Dispos.、43(2015)、1522-1535頁、10.1124/dmd.115.064246
スコープで見るGoogle Scholar
28
M. Stepankova, I. Bartonkova, E. Jiskrova, R. Vrzal, S. Mani, S. Kortagere, Z. Dvorak
メチルインドールおよびメトキシインドールはヒトアリール炭化水素受容体のアゴニストおよびアンタゴニストである。
Mol. Pharmacol., 93 (2018), 631-644頁, 10.1124/mol.118.112151
スコープで見るGoogle Scholar
29
B.C. DiNatale、I.A. Murray、J.C. Schroeder、C.A. Flaveny、T.S. Lahoti、E.M. Laurenzana、C.J. Omiecinski、G.H. Perdew
キヌレン酸は強力な内因性アリール炭化水素受容体リガンドであり、炎症シグナルの存在下でインターロイキン-6を相乗的に誘導する。
Toxicol. Sci., 115 (2010), 89-97頁, 10.1093/toxsci/kfq024
スコープで見るGoogle Scholar
30
A. Rannug, U. Rannug, H.S. Rosenkranz, L. Winqvist, R. Westerholm, E. Agurell, A.K. Grafström
トリプトファンのある種の光酸化誘導体はAh受容体に非常に高い親和性で結合し、内因性シグナル物質である可能性が高い。
J. Biol. Chem., 262 (1987), 15422-15427頁
PDFを見る記事を見るGoogle Scholar
31
U. Rannug, A. Rannug, U. Sjöberg, H. Li, R. Westerholm, J. Bergman
トリプトファン由来の高親和性Ah受容体リガンド2種の構造解明
Chem. Biol., 2 (1995), 841-845頁, 10.1016/1074-5521(95)90090-x
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
32
B.P. Lawrence、M.S. Denison、H. Novak、B.A. Vorderstrasse、N. Harrer、W. Neruda、C. Reichel、M. Woisetschläger
新規低分子化合物の抗炎症作用を媒介するためには、アリール炭化水素受容体の活性化が必須である。
Blood, 112 (2008), 1158-1165頁, 10.1182/blood-2007-08-109645
PDFで記事を見るScopusで記事を見るGoogle Scholar
33
L.J.ファンハウザー・ジョーンズ、S.ラビンドラン、L.D.シブリー
in vitroにおけるクリプトスポリジウム・パルバムの増殖に対する強力な新規阻害剤のステージ特異的活性の定義
mBio, 11 (2020), Article e00052-20, 10.1128/mBio.00052-20
スコープで見るGoogle Scholar
34
G. Wilke, L.J. Funkhouser-Jones, Y. Wang, S. Ravindran, Q. Wang, W.L. Beatty, M.T. Baldridge, K.L. VanDussen, B. Shen, M.S. Kuhlenschmidt, et al.
幹細胞由来のプラットフォームにより、in vitroでのクリプトスポリジウムの完全な発育と遺伝的な扱いやすさが可能になる
Cell Host Microbe, 26 (2019), pp.123-134.e8, 10.1016/j.chom.2019.05.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
35
G. Wilke、S. Ravindran、L. Funkhouser-Jones、J. Barks、Q. Wang、K.L. VanDussen、T.S. Stappenbeck、T.B. Kuhlenschmidt、M.S. Kuhlenschmidt、L.D. Sibley
クリプトスポリジウム・パルバムの細胞内ステージに対するモノクローナル抗体がin vitroでのライフサイクル進行を定義する
mSphere, 3 (2018), Article e00124-18, 10.1128/mSphere.00124-18
スコープで見るGoogle Scholar
36
G.ウィルケ、Y.ワン、S.ラビンドラン、T.S.スタッペンベック、W.H.ウィトラ、L.D.シブリー
幹細胞由来の腸管上皮単層を用いたクリプトスポリジウム・パルバムのin vitro培養
J. J. Mead, M. Arrowood (Eds.), Cryptosporidium Methods in Molecular Biology, Humana Press (2020), pp.351-372
CrossRefScopusで表示Google Scholarで表示
37
M. 酒井正彦、遠山和彦、務台正人
ラット肝のアデニル酸エネルギーチャージおよびミトコンドリアリン酸化活性に及ぼすインドールの影響
Int. 生化学, 14 (1982), 569-572頁, 10.1016/0020-711x(82)90037-4
PDFを見る記事を見るScopusで見るGoogle Scholar
38
C. シメレル、A.J.マレー、E.R.オルデヴュルテル、D.K.サマーズ、U.F.キーサー
脂質膜の電気的特性に対する細菌シグナルインドールの影響
ChemPhysChem, 14 (2013), 417-423頁, 10.1002/cphc.201200793
スコープで見るGoogle Scholar
39
C. シメレル、E.エメリー、D.K.サマーズ、U.キーサー、F.M.グリブル、F.ライマン
細菌代謝物インドールは腸内分泌L細胞からのインクレチン分泌を調節する
Cell Rep., 9 (2014), 1202-1208頁, 10.1016/j.celrep.2014.10.032
PDFで記事を見るScopusで記事を見るGoogle Scholar
40
S. リュー、D.M.ローリグ、Y.グオ、N.リー、M.A.フレース、K.タン、L.チャン、Y.フェン、L.シャオ
クリプトスポリジウムにおけるミトソーム代謝と侵入関連タンパク質の進化
BMC Genom., 17 (2016), p. 1006, 10.1186/s12864-016-3343-5
スコープで見るGoogle Scholar
41
C.W. Roberts, F. Roberts, F.L. Henriquez, D. Akiyoshi, B.U. Samuel, T.A. Richards, W. Milhous, D. Kyle, L. McIntosh, G.C. Hill, et al.
アピコンプレックス系寄生虫クリプトスポリジウム・パルバムにおけるミトコンドリア由来の代替オキシダーゼの証拠:抗菌剤の標的となりうるもの
Int. J. Parasitol., 34 (2004), 297-308頁, 10.1016/j.ijpara.2003.11.002
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
42
B.R.ボヤ、P.クマール、J.H.リー、J.リー
生物におけるトリプトファナーゼ遺伝子の多様性とその進化的意義
Microorganisms, 9 (2021), Article 2156, 10.3390/microorganisms9102156
スコープで見るGoogle Scholar
43
A. クマール、V. スペランディオ
宿主-微生物叢-病原体のインターフェースにおけるインドールシグナル伝達
mBio, 10 (2019), Article e01031-19, 10.1128/mBio.01031-19
Scopusで見るGoogle Scholar
44
P. Xu, G. Widmer, Y. Wang, L.S. Ozaki, J.M. Alves, M.G. Serrano, D. Puiu, P. Manque, D. Akiyoshi, A.J. Mackey, et al.
クリプトスポリジウム・ホミニスのゲノム
Nature, 431 (2004), pp.1107-1112, 10.1038/nature02977
スコープで見るGoogle Scholar
45
M.C. Pawlowic、M. Somepalli、A. Sateriale、G.T. Herbert、A.R. Gibson、G.D. Cuny、L. Hedstrom、B. Striepen
クリプトスポリジウム・パルバムにおけるプリンサルベージの遺伝子改変により、宿主細胞からのヌクレオチド取り込みが明らかになった。
Proc. Natl. Acad. Sci. USA, 116 (2019), pp.21160-21165, 10.1073/pnas.1908239116
Scopusで見るGoogle Scholar
46
J. ベレス、Z.ベラスケス、L.M.R.シルバ、U.ゲルトナー、K.フェーリング、A.ドウグスキース、S.マズレク、C.エルモシージャ、A.タウベルト
クリプトスポリジウム・パルバムに感染したHCT-8細胞の代謝シグネチャーと、選択された代謝阻害剤が生理的酸素欠乏および高酸素状態におけるC. Parvum感染に及ぼす影響
Biology, 10 (2021), Article 60, 10.3390/biology10010060
Google Scholar
47
T. Li, H. Liu, N. Jiang, Y. Wang, Y. Wang, J. Zhang, Y. Shen, J. Cao
比較プロテオミクスにより、クリプトスポリジウム・パルバムが宿主細胞の分子発現と免疫応答を操作していることが明らかになった。
PLoS Neglected Trop. Dis., 15 (2021), Article e0009949, 10.1371/journal.pntd.0009949
Scopusで見るGoogle Scholar
48
A.V. Karpe、M.L. Hutton、S.J. Mileto、M.L. James、C. Evans、R.M. Shah、A.B. Ghodke、K.E. Hillyer、S.S. Metcalfe、J.W. Liu、他。
クリプトスポリジウム症はマウス感染モデルにおいて腸内細菌叢と代謝を調節する
Metabolites, 11 (2021), Article 380, 10.3390/metabo11060380
スコープで見るGoogle Scholar
49
C.N.ミラー、C.G.パナゴス、W.R.T.モセデール、M.クヴァーチ、M.J.ハワード、A.D.ツァウシス
NMRメタボロミクスによりクリプトスポリジウム感染が宿主細胞のメタボロームに及ぼす影響が明らかになった
Gut Pathog., 11 (2019), p. 13, 10.1186/s13099-019-0293-x
Scopusで見るGoogle Scholar
50
M.Y.エルミール、V.ノゲイラ、E.フォンテーヌ、N.アヴェレ、M.リグーレ、X.ルヴェルヴ
ジメチルビグアニドは、呼吸鎖複合体Iを標的とした間接的効果により細胞呼吸を阻害する。
J. Biol. Chem., 275 (2000), 223-228頁, 10.1074/jbc.275.1.223
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
51
E.D. Salomaki, K.X. Terpis, S. Rueckert, M. Kotyk, Z.K. Varadínová, I. Čepička, C.E. Lane, M. Kolisko
アピコンプレキサンのミトコンドリアリモデリングと適応の差異を明らかにしたグレガリンのシングルセル・トランスクリプトミクス
BMC Biol., 19 (2021), p. 77, 10.1186/s12915-021-01007-2
スコープで見るGoogle Scholar
52
C.N.ミラー、L.ジョッセ、A.D.ツァウシス
クリプトスポリジウム・パルバムのマイトソームにおける鉄-S生合成機構の局在化
J. Eukaryot. Microbiol., 65 (2018), 913-922頁, 10.1111/jeu.12663
スコープで見るGoogle Scholar
53
H. Feng, W. Nie, A. Sheoran, Q. Zhang, S. Tzipori
胆汁酸はクリプトスポリジウム属菌の培養細胞への侵入性を高める
Infect. Immun., 74 (2006), 3342-3346頁, 10.1128/IAI.00169-06
スコープで見るGoogle Scholar
54
A.P.キーラガン、R.チャラニア、J.R.ミード
試験管内でのクリプトスポリジウム・パルバムの増殖に対する短鎖脂肪酸の影響
Microorganisms, 10 (2022), Article 1822, 10.3390/microorganisms10091822
スコープで見るGoogle Scholar
55
J. ガオ、シュー、リウ、リュー、バイ、ペン、リー、イン、Y.
トリプトファン代謝が腸管免疫に及ぼす腸内細菌叢の影響
Front. Cell. Infect. Microbiol., 8 (2018), p. 13, 10.3389/fcimb.2018.00013
Google Scholar
56
H.M.ローガー、T.R.リヒト
健康と疾患における微生物トリプトファン異化物
Nat. Commun., 9 (2018), p. 3294, 10.1038/s41467-018-05470-4
スコープで見るGoogle Scholar
57
M.J.アローウッド、C.R.スターリング
不連続スクロースおよびアイソピクニックパーコール勾配を用いたクリプトスポリジウムのオーシストおよびスポロゾイトの分離
J. パラジトール, 73 (1987), 314-319ページ
CrossRefScopusで表示Google Scholarで表示
58
W.L.カレント
クリプトスポリジウムの技術と実験室管理
J.P. Dubey, C.A. Speer, R. Fayer (Eds.), Cryptosporidiosis of Man and Animals, CRC Press (1990), pp.44-77
Google Scholar
59
H. 三好秀樹、安島亮、羅慈哲、山口俊平、T.S. Stappenbeck
Wnt5aはTGF-βシグナルを増強し、組織損傷後の大腸陰窩再生を促進する。
Science, 338 (2012), 108-113頁, 10.1126/science.1223821
スコープで見るGoogle Scholar
60
H. 三好博之、T.S.スタッペンベック
スフェロイド培養における消化管幹細胞の試験管内膨張と遺伝子改変
Nat. プロトコール, 8 (2013), 2471-2482頁
CrossRefScopusで見るGoogle Scholarで見る
61
Y.F. Li, D.D. Wang, B.W. Zhao, W. Wang, S.Q. Yuan, C.Y. Huang, Y.M. Chen, Y. Zheng, R.P. Keshari, J.C. Xia, Z.W. Zhou
AHRRの発現低下による胃腺癌の予後不良
PLoS One, 7 (2012), Article e43555, 10.1371/journal.pone.0043555
スコープで見るGoogle Scholar
62
T.D. Schmittgen, K.J. Livak
比較C(T)法によるリアルタイムPCRデータの解析
Nat. プロトコール, 3 (2008), pp.1101-1108
CrossRefView in ScopusGoogle Scholar
63
N.E.サンジャナ、O.シャレム、F.チャン
CRISPRスクリーニングのための改良ベクターとゲノムワイドライブラリー
Nat. Methods, 11 (2014), 783-784頁, 10.1038/nmeth.3047
Scopusで見るGoogle Scholar
64
T. Dull, R. Zufferey, M. Kelly, R.J. Mandel, M. Nguyen, D. Trono, L. Naldini
条件付きパッケージングシステムを持つ第3世代レンチウイルスベクター
J. Virol., 72 (1998), 8463-8471頁, 10.1128/JVI.72.11.8463-8471.1998
スコープで見るGoogle Scholar
65
J. Schindelin、I. Arganda-Carreras、E. Frise、V. Kaynig、M. Longair、T. Pietzsch、S. Preibisch、C. Rueden、S. Saalfeld、B. Schmid、et al.
Fiji: 生物学的画像解析のためのオープンソースプラットフォーム
Nat. Methods, 9 (2012), 676-682頁, 10.1038/nmeth.2019
Scopusで見るGoogle Scholar
66
K.L. VanDussen、N.M. Sonnek、T.S. Stappenbeck
消化管上皮幹細胞培養用のL-WRNコンディショニング培地は、複数の研究チーム間でバッチ間再現可能な活性レベルを示す
Stem Cell Res., 37 (2019), Article 101430, 10.1016/j.scr.2019.101430
PDFで記事を見るScopusで記事を見るGoogle Scholar
67
A. ドビン、C.A.デイビス、F.シュレシンジャー、J.ドレンコウ、C.ザレスキー、S.ジャ、P.バトゥット、M.シャイソン、T.R.ジンゲラス
STAR:超高速ユニバーサルRNA-seqアライナー
バイオインフォマティクス, 29 (2013), pp.15-21, 10.1093/bioinformatics/bts635
スコープで見るGoogle Scholar
68
E.Y. Chen、C.M. Tan、Y. Kou、Q. Duan、Z. Wang、G.V. Meirelles、N.R. Clark、A. Ma'ayan
Enrichr: 対話的かつ協調的なHTML5遺伝子リスト濃縮解析ツール
BMC Bioinf., 14 (2013), p. 128, 10.1186/1471-2105-14-128
スコープで見るGoogle Scholar
69
M.V. Kuleshov, M.R. Jones, A.D. Rouillard, N.F. Fernandez, Q. Duan, Z. Wang, S. Koplev, S.L. Jenkins, K.M. Jagodnik, A. Lachmann, et al.
Enrichr: 包括的遺伝子セット濃縮解析ウェブサーバー 2016 update
Nucleic Acids Res., 44 (2016), pp.W90-W97, 10.1093/nar/gkw377
ScopusGoogle Scholarで見る
70
Z. Xie, A. Bailey, M.V. Kuleshov, D.J.B. Clarke, J.E. Evangelista, S.L. Jenkins, A. Lachmann, M.L. Wojciechowicz, E. Kropiwnicki, K.M. Jagodnik, et al.
Enrichrによる遺伝子セット知識発見
Curr. Protoc., 1 (2021), p. e90, 10.1002/cpz1.90
スコープで見るGoogle Scholar
71
J.G. Caporaso、C.L. Lauber、W.A. Walters、D. Berg-Lyons、C.A. Lozupone、P.J. Turnbaugh、N. Fierer、R. Knight
サンプルあたり数百万配列の深さにおける16S rRNA多様性のグローバルパターン
Proc. Natl. Acad. Sci. USA, 108 (2011), 4516-4522頁, 10.1073/pnas.1000080107
スコープで見るGoogle Scholar
72
B.J.キャラハン、P.J.マクマーディ、M.J.ローゼン、A.W.ハン、A.J.A.ジョンソン、S.P.ホームズ
DADA2:イルミナアンプリコンデータからの高分解能サンプル推定
Nat. Methods, 13 (2016), pp.581-583, 10.1038/Nmeth.3869
スコープで見るGoogle Scholar
73
J.R. Cole、Q. Wang、J.A. Fish、B. Chai、D.M. McGarrell、Y. Sun、C.T. Brown、A. Porras-Alfaro、C.R. Kuske、J.M. Tiedje
リボソームデータベースプロジェクト:ハイスループットrRNA解析のためのデータとツール
Nucleic Acids Res., 42 (2014), D633-D642頁, 10.1093/nar/gkt1244
スコープで見るGoogle Scholar
74
P.J.マクマーディ、S.ホームズ
phyloseq:マイクロバイオームセンサスデータの再現性のあるインタラクティブな解析とグラフィックスのためのRパッケージ
PLoS One, 8 (2013), Article e61217, 10.1371/journal.pone.0061217
スコープで見るGoogle Scholar
被引用回数 (0)
4
現住所 米国テキサス州ブライアン、テキサスA&Mヘルス、医学部微生物病原学・免疫学教室
5
現住所 米国ミズーリ州セントルイス、ワシントン大学眼科・視覚科学部
6
現職: 米国オハイオ州シンシナティ、シンシナティ大学医学部およびシンシナティ小児病院医療センター、小児科、消化器・肝臓・栄養部門および発達生物学部門。
7
現職: ラーナー研究所、クリーブランド・クリニック、クリーブランド、OH、USA
8
これらの著者の貢献は同等である。
9
連絡先
© 2023 The Author(s).
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect® は Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
