腸管を守るトリプレックス 神経細胞、微生物、杯細胞
55巻 12号 2022年12月13日発行 2228-2230ページ
スポットライト
腸管を守るトリプレックス 神経細胞、微生物、杯細胞
著者リンク オーバーレイパネルを開くDong-YoonKim1DanielMucida12
https://doi.org/10.1016/j.immuni.2022.11.006
権利と内容を取得する
参照元
Wen Zhang, Mengze Lyu, Nicholas J. Bessman, Zili Xie, Mohammad Arifuzzaman, 矢野博司, Christopher N. Parkhurst, Coco Chu, Lei Zhou, Gregory G. Putzel, Ting-Ting Li, Wen-Bing Jin, Jordan Zhou, Hongzhen Hu, Amy M. Tsou, Chun-Jun Guo, David Artis
腸管神経侵害受容器は腸内細菌叢を制御し、組織保護を促進する
セル、第185巻、第22号、2022年10月27日、ページ4170-4189.e20
PDFを購入する
Daping Yang、Amanda Jacobson、Kimberly A. Meerschaert、Joseph Joy Sifakis、Meng Wu、Xi Chen、Tiandi Yang、Youlian Zhou、Praju Vikas Anekal、Rachel A. Rucker、Deepika Sharma、Alexandra Sontheimer-Phelps、Glendon S. Wu, Liwen Deng, Michael D. Anderson, Samantha Choi, Dylan Neel, Nicole Lee, Dennis L. Kasper, Bana Jabri, Jun R. Huh, Malin Johansson, Jay R. Thiagarajah, Samantha J. Riesenfeld, Isaac M. Chiu.
侵害受容器ニューロンは、CGRP-RAMP1軸を介して粘液産生と腸管バリア保護を促進する杯細胞を誘導する
Cell, 185巻, 22号, 2022年10月27日, ページ 4190-4205.e25
PDFを購入する
多様な腸管構成要素(腸管関連神経細胞、免疫細胞、腸内細菌、上皮など)は、互いに密接に絡み合って腸管内の恒常性を維持している。Cell誌の最新号で、Zhangら(2022年)とYangら(2022年)は、侵害受容器ニューロン、腸上皮、マイクロバイオームの相互作用を明らかにし、炎症から腸組織を保護する相補的研究を発表している。
前の記事へ次の記事へ
本文
侵害受容器は、末梢組織からの侵害刺激を感知するという感覚機能から初めて命名されたが(Woolf and Ma, 2007)、末梢組織の生理機能を直接調節する「双方向性シグナル伝達マシン」としても認識されている(Basbaum et al.) 侵害受容器の組織調節の役割は、特にカルシトニン遺伝子関連ペプチド(CGRP)やサブスタンスP(SP)などの神経ペプチドの放出によって媒介され(Basbaumら、2009)、その基礎となる細胞および分子メカニズムが明らかになりつつある(Chuら、2020による総説を参照)。Cell誌の最新号で、Zhangら(2022)とYangら(2022)は、侵害受容器ニューロン、腸管上皮細胞、および腸内微生物の相互作用が、粘液産生と組織保護をどのように制御しているかについて述べている(図1)。

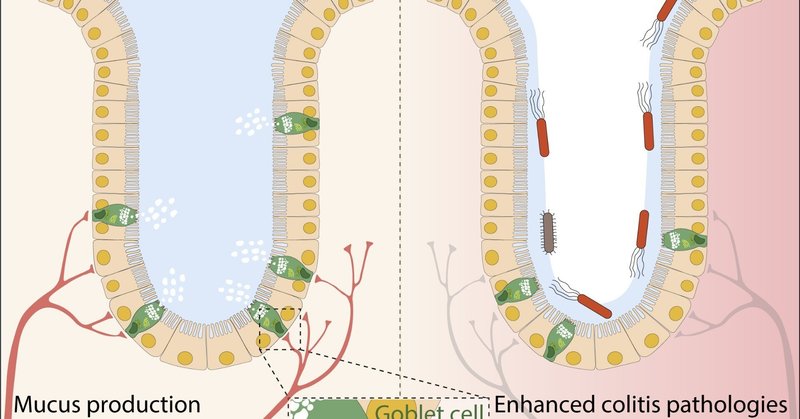
ダウンロード: 高解像度画像のダウンロード(856KB)Download : フルサイズ画像のダウンロード
図1. 侵害受容器ニューロン、杯細胞、腸内常在菌の腸管保護における相互作用
(左)侵害受容器ニューロンの活動は、CGRP-Ramp1軸を介して杯細胞の粘液産生を誘導し、大腸炎からの腸管保護を媒介する。交感神経はDRG感覚神経を直接活性化し、CGRPの放出を誘導する。(右)侵害受容体ニューロンの破壊は、大腸炎病態の亢進と腸内細菌の異常化をもたらし、それは他のgnotobioticマウスに伝染し、炎症を悪化させる。IBD患者は直腸のTRPV1+侵害受容器神経支配が低下していることがわかる。
粘液層は、いくつかの機能の中でも、腸管上皮と内腔の微生物や毒素との間に物理的バリアを形成することによって腸管組織を保護している(Nyströmら、2021)。実際、粘液の欠陥は、炎症性腸疾患(IBD)患者において実証されているように、大腸炎に対する感受性の増加と関連している(Post et al.、2019)。粘液成分(例えば、一次タンパク質要素であるMUC2)は、特殊な上皮細胞である杯細胞によって放出され、微生物や免疫シグナルなどの様々な環境の合図によって制御されるが、粘液分泌の感覚神経制御と組織保護におけるその役割は、ほとんど注目されていない。
Yangらは、慎重に行われた機構研究の中で、電位依存性ナトリウムチャネルNav1.8+侵害受容器ニューロンが、杯細胞による粘液分泌を促進することを明らかにした。ジフテリア毒素サブユニットA(DTA)を特異的に発現させてNav1.8+侵害受容器ニューロンを遺伝的に破壊すると、侵害受容器が無傷のコントロールマウスに比べて粘液層が薄くなった。一方、Nav1.8+ニューロンの化学原性活性化は粘液の厚さを増加させ、まとめて侵害受容器ニューロンが粘液産生を制御していることが示された。侵害受容器ニューロンが直接、杯細胞を調節しているかどうかを調べるため、著者らはまず、腸のNav1.8+およびCGRP+神経を画像化し、侵害受容器ニューロンが杯細胞と並列していることを確認した。さらに、腸管上皮細胞のsingle-cell RNA sequencing(scRNA-seq)により、大腸杯細胞はCGRP受容体をコードするRamp1を高発現していることが明らかになった。これらの結果から、CGRP-Ramp1シグナルは、杯細胞の活性を直接的に調節し、その結果として粘液産生に関与している可能性が浮上しました。
そこで、Yangらは、杯細胞の粘液産生におけるCGRP-Ramp1シグナルの役割を明らかにするために、遺伝学的、化学遺伝学的、薬理学的操作のさまざまな実験を行った。まず、Calcb(CGRPβをコードする)ではなく、CGRPαをコードするCalcaの遺伝子欠失は、野生型コントロールと比較して粘液の厚さを減少させることが示された。第二に、上皮細胞におけるRamp1遺伝子の選択的欠失もまた、コントロールに比べて粘液の厚さを減少させた。まとめて考えると、Calcaと上皮のRamp1の発現が粘液の厚さの維持に必要であることが示唆された。第三に、Nav1.8+とCGRPα+細胞の化学原理の活性化は、腸内のCGRPレベルを増加させ、急速な杯細胞の空洞化を誘発したが、これはRamp1アンタゴニスト、BIBN4096の前処理により部分的だが有意に阻止された。最後に、2次元オルガノイド由来杯細胞培養液および生体外大腸摘出物にそれぞれCGRPを処理すると、杯細胞の分泌胞が空になり、摘出物中の粘液層が厚くなった。これらの知見は、侵害受容器と杯細胞の間のCGRP-Ramp1シグナルが粘液産生調節に因果的に関与していることを明らかにするものである。
粘液産生メカニズムの崩壊は、マウスとヒトの両方で大腸炎と関連している(Nyströmら、2021)。そこで、ZhangらとYangらは、マウスの大腸炎モデルにおいて、組織の保護を促進する侵害受容器の役割について研究した。Zhangらは、化学遺伝学的および薬理学的操作実験を行い、腸の炎症を制御する一過性受容体電位バニロイド1(TRPV1)発現侵害受容器の因果関係を広範囲に探った。急性大腸炎モデルを作製するために、上皮細胞死とその後の大腸炎症を引き起こすことが知られているデキストラン硫酸ナトリウム(DSS)を約1週間マウスに経口投与しました(Wirtz et al.、2017)。驚くべきことに、DSSの送達中および送達後のTRPV1+ニューロンの化学遺伝学的サイレンシングは、体重減少、結腸の短縮、組織学的特徴の障害、および病理学的外観などの大腸炎関連病理を有意に悪化させた。この効果は、逆行性アデノ随伴ウイルス(AAV)を大腸に注入して腸管支配の侵害受容器を特異的に標的にし、化学遺伝学的に抑制すると再現された。逆に、DSSの投与中にTRPV1+ニューロンを化学原性で活性化すると、腸の組織損傷と炎症表現型が緩和された。また、Yangらは、Nav1.8+侵害受容器の遺伝子破壊と化学原理の活性化が、それぞれDSS誘発大腸炎の病態を悪化させ、緩和させることを明らかにした。
次に、ZhangらとYangらは、潜在的なシグナル伝達メカニズムとして、それぞれSPとCGRPに注目した。DSS処理により大腸のSPとCGRPのレベルが上昇したが、TRPV1+ニューロンの化学的阻害(TRPV1hM4Di)およびNav1.8+ニューロンの遺伝子破壊(Nav1.8DTA)により、DSS処理によりSPとCGRPレベルはそれぞれ減少した。AAVを用いた腸管支配TRPV1+ニューロンの選択的阻害も、DSSによる大腸SPおよびCGRPの増加を抑制した。また、TRPV1hM4Di(またはNav1.8DTA)マウスにSP(またはCGRP)を全身投与すると、DSSによる大腸炎への亢進が解消されたことから、これらの神経ペプチドによって侵害受容器欠損マウスを大腸炎悪化から救うことができることが示唆された。さらに、上皮細胞におけるRamp1の特異的ノックアウト(Yangら、2022年)およびTac1遺伝子(SPをコードする;Zhangら、2022年)の全身的欠失も、DSS誘発大腸炎の病態を増強させた。これらのデータを総合すると、大腸炎に対する腸組織の保護を促進する上で、侵害受容器および関連する神経ペプチドシグナル伝達が重要な役割を果たすことが立証された。しかし、この2つの論文では、主に、異なるマーカー(TRPV1とNav1.8)で標識された侵害受容器のサブセットと、異なる神経ペプチド(SPとCGRP)を研究しているので、これらのサブセットや神経ペプチドの働きがどれだけ重なるか、あるいは、互いに異なるかは、まだ精査される必要が残っている。
そこで、神経細胞、杯細胞、微生物叢という3つの神経細胞が登場する。侵害受容器は腸内微生物叢の組成を調節することができ(Laiら、2020)、腸内微生物叢は結腸粘液と密接に関連している(PaoneとCani、2020)。そこで、ZhangらとYangらは、侵害受容器と腸内細菌叢の相互制御による腸管保護について探索した。まず、Yangらは、侵害受容器ニューロンの遺伝子破壊により、腸の炎症を制御することが報告されているTuricibacter属とAllobaculum属が拡大し、微生物のディスバイオーシスが誘導されることを明らかにした。特に、Turicibacter属の増殖はDSS投与マウスでも認められ、Nav1.8+ニューロンを化学的に活性化させると消失した。これらのデータは、侵害受容器が大腸の微生物のホメオスタシスを決定的に形成していることを示唆するものであった。逆に、腸内細菌は侵害受容器の活性と腸管バリア機能をどのように制御しているのだろうか?Yangらは、特定病原体非含有(SPF)マウスから無菌(GF)マウスへの糞便移植が、侵害受容器依存的に大腸のCGRPレベルと粘液厚を有意に増加させることを明らかにした。興味深いことに、SPFマウスの糞便上清は、培養後根神経節(DRG)感覚ニューロンのカルシウム活性およびCGRP放出を誘導し、腸内細菌がDRGニューロンの活性、CGRP放出、粘液の厚さを調節していることが示された。
一方、Zhangらは、腸内細菌がDSS誘発性大腸炎の病態に因果関係を持つことを示唆するデータを発表した。侵害受容器欠損SPFマウスの糞便を移植したGFマウスは、侵害受容器未発達SPFマウスの糞便を移植したGFマウスに比べて、黄砂による炎症表現型が悪化した。また、侵害受容体欠損SPFマウスと同居しているGFマウスでは、疾患の重症度がより高かった。これらの実験から、TRPV1+ニューロンの破壊によって引き起こされる微生物異常は、gnotobioticマウスに伝染し、大腸炎の病態に影響を与えることが示唆された。次に、大腸炎発症における腸内細菌の必要性を、抗生物質(ABX)カクテルまたは特定の細菌群を枯渇させる単環状ABXを用いて検証した。興味深いことに、侵害受容体欠損マウスと対照群マウスをABXカクテルまたはグラム陽性菌を優先的に枯渇させるバンコマイシンで治療した場合、疾患の重症度は同等であった。さらに、GFマウスにClostrudium属細菌(Gram+)を接種すると、侵害受容器欠損マウスのDSS誘発大腸炎に対する感受性が上昇した。これは、侵害受容器欠損マウスで悪化した大腸炎病態にGram+ Clostrudium属細菌が重要であることを示しているかもしれない。これらの知見は、侵害受容器と腸内細菌が双方向に作用し、腸管バリアー保護に重要な役割を果たしていることを明らかにするものである。
これらの知見は、炎症誘発性病態から腸組織を保護するための神経・上皮・微生物相互作用の機構的理解をもたらし、今後の研究にとって興味深い問題を提起している。ZhangらとYangらは、侵害受容器切断マウスにおいて、DSS処理により特定の腸管免疫細胞(マクロファージや好中球など)が拡大することを観察している。免疫細胞がどのように「トリプレックス」に干渉し、組織の保護や損傷を調節しているのかは、複雑な腸管コミュニケーションの根底にあるものをより良く理解するための重要な問題である。臨床的観点から、侵害受容器-小動物細胞-微生物相互作用が慢性腸炎に関与しているかどうか、およびこれをどのように標的とし得るかは、取り組むべき追加の質問である(Wirtzら、2017)。注目すべきは、Zhangらが、IBD患者の直腸生検では、健常者と比較してTRPV1+ニューロンの神経支配が著しく少ないことを示し、侵害受容器と慢性炎症の関連性を指摘したことである。腸の炎症が起きているときに、どのような炎症因子(微生物の代謝物やサイトカインなど)が侵害受容器の活性を調節しているのかを知ることは、メカニズム的に非常に重要である。この情報は、食物アレルギーや肥満など、他のタイプの炎症性疾患における腸の侵害受容器の関与を探るために拡大することができる(Medzhitov, 2021)。
利害関係の宣言
著者らは、競合する利害関係を宣言しない。
参考文献
バスバウムら, 2009
A.I. バスバウム, D.M. バウティスタ, G. シェラー, D. ユリウス
痛みの細胞・分子メカニズム
Cell, 139 (2009), pp.267-284, 10.1016/j.cell.2009.09.028
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
チューら、2020
C. チュー、D. アーティス、I.M. チウ
組織における神経・免疫の相互作用
Immunity, 52 (2020), pp.464-474, 10.1016/j.immuni.2020.02.017
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
Laiら、2020年
N.Y. Lai, M.A. Musser, F.A. Pinho-Ribeiro, P. Baral, A. Jacobson, P. Ma, D.E. Potts, Z. Chen, D. Paik, S. Soualhi, et al.
腸管神経侵害受容器ニューロンは、パイエル板小細胞およびSFBレベルを制御し、サルモネラ菌の宿主防御を媒介する
Cell, 180 (2020), pp.33-49.e22, 10.1016/j.cell.2019.11.014
e22
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
メジトフ、2021
R. メジトフ
炎症反応のスペクトル
サイエンス, 374 (2021), pp.1070-1075, 10.1126/science.abi5200
ScopusGoogle Scholarで記録を見る
ニュストレムら、2021年
E.E.L. Nyström, B. Martinez-Abad, L. Arike, G.M.H. Birchenough, E.B. Nonnecke, P.A. Castillo, F. Svensson, C.L. Bevins, G.C. Hansson, M.E.V. Johansson
大腸粘液バリアー機能に不可欠な杯細胞集団の間質性サブポピュレーション
Science, 372 (2021), p. eabb1590, 10.1126/science.abb1590
ScopusGoogle Scholarで記録を見る
パオネとカニ、2020
P. パオネ、P.D.カニ
粘液バリア、ムチン、腸内細菌叢:期待されるぬるぬるパートナー?
Gut, 69 (2020), pp.2232-2243, 10.1136/gutjnl-2020-322260
グーグル・スカラー
ポストら、2019
S. van der Post, K.S. Jabbar, G. Birchenough, L. Arike, N. Akhtar, H. Sjovall, M.E.V. Johansson, G.C.Hansson。
大腸粘液バリアの構造的弱化は潰瘍性大腸炎発症の初期イベントである
Gut, 68 (2019), pp.2142-2151, 10.1136/gutjnl-2018-317571
ScopusGoogle Scholarで記録を見る
ヴィルツら、2017
S. Wirtz, V. Popp, M. Kindermann, K. Gerlach, B. Weigmann, S. Fichtner-Feigl, M.F. Neurath
化学的に誘導された急性および慢性腸管炎症モデルマウス
Nat. Protoc., 12 (2017), pp.1295-1309, 10.1038/nprot.2017.044
ScopusGoogle Scholarで記録を見る
ウールフおよびマー、2007
C.J.ウルフ、Q.マー
侵害受容器-毒性刺激検出器
ニューロン, 55 (2007), pp.353-364, 10.1016/j.neuron.2007.07.016
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
ヤンら、2022年
D. Yang, A. Jacobson, K.A. Meerschaert, J.J. Sifakis, M. Wu, X. Chen, T. Yang, Y. Zhou, P.V. Anekal, R.A. Rucker, and al.
侵害受容器ニューロンは、CGRP-RAMP1軸を介して粘液産生と腸管バリア保護を促進する杯細胞を誘導する
Cell, 185 (2022), pp.4190-4205.e25, 10.1016/j.cell.2022.09.024
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
Zhangら、2022年
W. Zhang, M. Lyu, N.J. Bessman, Z. Xie, M. Arifuzzaman, H. Yano, C.N. Parkhurst, C. Chu, L. Zhou, G.G. Putzel, et al.
腸管神経侵害受容器は腸内細菌叢を制御し、組織保護を促進する
Cell, 185 (2022), pp.4170-4189.e20, 10.1016/j.cell.2022.09.008
この記事が気に入ったらサポートをしてみませんか?
