原生生物トリトリコモナス・アーノルドがウイルスによるグルテン不耐性を防ぐ
コンテンツへスキップ
健康のための腸内細菌叢 ロゴ
原生生物トリトリコモナス・アーノルドがウイルスによるグルテン不耐性を防ぐ
https://www.gutmicrobiotaforhealth.com/protist-tritrichomonas-arnold-protects-against-viral-induced-gluten-intolerance/

セリアック病は慢性の免疫介在性腸疾患であり、腸内ウイルス感染によって発症する可能性がある。しかし、マウスを用いた新たな研究により、常在性原生生物であるトリトリコモナス・アーノルドが、ウイルス誘発性の炎症性樹状細胞の活性化を抑制することで、レオウイルス誘発性のグルテン不耐症を予防することが明らかになった。
FacebookTwitterLinkedInWhatsAppEmail
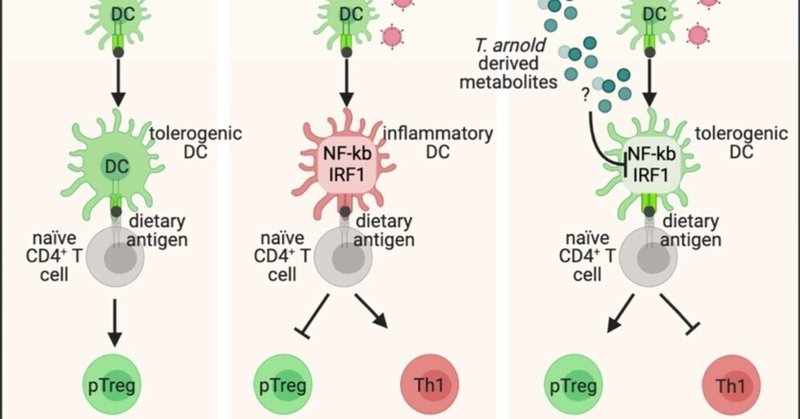
画像出典 Medina Sanchez L, Siller M, Zeng Y, et al. 2023; 56(8):1862-1875.e9.
無害な食物栄養素や微生物を攻撃しない免疫システムの仕組み
消化管では、免疫系は常に腸内容物をパトロールし、敵と味方を識別する役割を担っている。私たちは一日に無数の食品成分と10億以上の微生物を摂取している(1)。大半は無害だが、特定の食品成分や微生物は病気を引き起こす可能性がある。
小腸では、腸間膜リンパ節(mLN)が「経口耐性」と呼ばれる免疫機能を生み出す誘導部位となっている。経口寛容は、食物成分など経口摂取された抗原に対して免疫系が意図的に反応しなくなる能動的なプロセスである(2)。簡単に説明すると、腸管内腔の抗原が樹状細胞(DC)によってサンプリングされ、恒常的な状態でナイーブT細胞に提示されると、制御性T細胞(Treg)が誘導され、これが経口寛容に重要な役割を果たす。しかし、DCが炎症性表現型を持つと、炎症性Tヘルパー1(TH1)細胞への移行が促進され、口腔寛容の喪失と呼ばれる食物抗原に対する免疫応答が惹起される。
セリアック病は、「グルテン」と総称される穀類タンパク質に対する経口耐性が破壊される食物過敏症である。シカゴ大学のReinhard Hinterleitner博士らは、食物抗原に対する経口耐性を破壊する潜在的なメカニズムを以前に発見していた。彼らは、制御因子1(IRF1)やNF-κBなどの転写因子を活性化させる炎症性エンテロウイルスを同定し、その結果、グルテンに対する耐性の喪失につながる寛容型ではなく、むしろ炎症性DCが生じることを突き止めた(3)。
腸内常在性原生生物は、ウイルスが介在する経口耐性の喪失から身を守る。
ヒンターライトナー博士は、セリアック病における活発な炎症が、十二指腸のさまざまな部位に特有の炎症性細菌のニッチと関連していることを示す研究(4)に支えられ、最近、常在微生物が経口耐性を促進するメカニズムを発見した。
マウスを「自社飼育」していたところ、オバルブミンなどの食餌性抗原に対してウイルス媒介性の炎症反応が起こらなかったが、ジャクソン研究所から新たに入手したマウスでは起こったのである。さらに調査を進めたところ、マウスはParabasalia属の新種Tritrichomonasにコロニー形成され、Tヘルパー2(TH2)体液性免疫への移行に関連する小腸の房細胞や杯細胞の増殖を促進した。しかし、T. arnoldによるコロニー形成は、ウイルスの複製や宿主の1型IFN応答には影響を与えなかった。また、T. arnoldは既存の微生物叢の構成や代謝にも影響を与えず、無菌マウスでも防御効果を示したことから、微生物叢は必要ないことが示唆された。
著者らは、T. arnoldがmLNにおける炎症性DCの誘導を特異的に抑制することを発見した。その結果、T. arnoldは炎症性DCの誘導を特異的に抑制することが判明した。T.arnold培養物から得られた未同定の代謝産物は、IRF1とNF-κB転写因子によって制御される遺伝子のウイルス誘導を制限し、DCの炎症反応を緩和した。要約すると、著者らは、抗原提示DCにおける炎症性転写因子を阻害し、Treg応答を促進することによって、ウイルスによる口腔内耐性の喪失から保護する未定義の代謝産物を産生する新種の原生生物T. arnoldを発見した。
著者らは、セリアック病のヒト危険遺伝子であるHLA-DQ8を発現するトランスジェニックマウスを用いて、T. arnoldのコロニー形成が、ウイルスによるグルテンに対する経口耐性の喪失からマウスを保護することを示した。T.アーノルドはグルテンの消化には影響を与えなかったが、ウイルスによって組織トランスグルタミナーゼ2が活性化されるのを阻止した。組織トランスグルタミナーゼ2は、グルテンのペプチドを修飾し、抗原提示細胞への親和性を高める。これらの知見は、CeDの管理や患者のグルテン耐性の喪失を防ぐために臨床的な意味を持つ。
原生生物T. arnoldはセリアック病患者にはあまり見られず、食物耐性を防御するために食物繊維が必要である。
Parabasaliaクラスは、セリアック病患者の~7%で同定されたのに対し、健康なボランティアの~35%で同定された。これは、抗生物質治療の使用によって説明できるかもしれない。最近のメタ解析では、早期感染と抗生物質治療の両方が、後にセリアック病を発症するリスクを高めると結論付けられているからである(6)。従って、これらの結果は、抗生物質の使用とセリアック病リスクとの関連に、メカニズム的な関連性を与える可能性がある。
この結果は、将来、セリアック病の予防に有益な原生生物のコロニー形成を促進する戦略が考慮される可能性を提起している。著者らはまた、マウスのT. arnoldのコロニー形成を維持するためには、水溶性食物繊維を含む食事が必要であることも観察した。興味深いことに、グルテンフリー食を摂取しているセリアック病患者では、臨床的に食物繊維の不足がみられる(7)。このことは、グルテンフリー食を摂取しているセリアック病患者に対する食物繊維の種類と摂取量の最適な推奨に関する臨床管理のギャップを解決するために、さらなる調査が必要であることを示唆している。
参考文献
Lang JM, Eisen JA, Zivkovic AM. The microbes we eat: abundance and taxonomy of microbes consumed in a day's worth of meals for three diet types. PeerJ. 2014;2:e659.
Commins SP. 口腔内耐性のメカニズム。Pediatr Clin North Am. 2015 Dec;62(6):1523-9.
Bouziat R, Hinterleitner R, Brown JJ, Stencel-Baerenwald JE, Ikizler M, Mayassi T, et al. Reovirus infection triggers inflammatory response to dietary antigens and development of celiac disease. Science (80- ) [Internet]. 2017 Apr 7;356(6333):44-50. 入手先:https://doi.org/10.1126/science.aah5298
Constante M, Libertucci J, Galipeau HJ, Szamosi JC, Rueda G, Miranda PM, et al. Biogeographic Variation and Functional Pathways of the Gut Microbiota in Celiac Disease. Gastroenterology. 2022 Nov;163(5):1351-1363.e15.
Medina Sanchez L, Siller M, Zeng Y, Brigleb PH, Sangani KA, Soto AS, et al. 腸内原生生物Tritrichomonas arnoldは、食事性抗原提示樹状細胞を調節することにより、ウイルスを介した経口耐性の喪失を抑制する。Immunity [Internet]. 2023;56(8):1862-1875.e9. https://www.sciencedirect.com/science/article/pii/S1074761323002790 より入手可能。
Jiang H, Zhang X, Zhou Y, Jiang C, Shi Y. 感染症、抗生物質への曝露とセリアック病のリスク: システマティックレビューとメタアナリシス。J Gastroenterol Hepatol [Internet]. 2020 Apr 1;35(4):557-66. https://doi.org/10.1111/jgh.14928。
カルドA、チュルーカI、ラサA、ナバロV、バスケス-ポロM、ペレス-ユンケラG、ら。 グルテンフリー食に従う成人セリアック患者における栄養不均衡。第13巻、栄養素 。2021.
2023年12月18日
ヘザー・ガリポー、マーク・ウルチンスキー著
カテゴリー セリアック病, 腸内細菌叢, 免疫健康, 研究と実践
タグ セリアック病, 腸内細菌叢, 免疫, 経口耐性の喪失
ヘザー・ガリポー
ヘザー・ガリポーはマクマスター大学(カナダ)の助教授で、セリアック病と炎症性腸疾患における食事と微生物...相互作用について研究している。彼女は2015年にマクマスター大学のエレナ・ヴェルドゥの研究室で博士号を取得し、その間に小腸の微生物背景がグルテンなどの食事性抗原によって引き起こされる免疫病理の程度に影響することを発見した。 続きを表示
マーク・ウルチンスキー
Mark Wulczynskiは、マクマスター大学Verdu研究室の博士候補生である。
FacebookTwitterLinkedInWhatsAppEmail
関連記事
腸-脳相互作用障害における微生物学的治療法の現状と課題
4 12月 2023
アンドリュー・プラドス
神経消化器学、消化運動学、腸脳相互作用障害の最新動向に関するESNM主催の欧州における主要な会議であるNeuroGASTRO 2023が、2023年8月31日から9月2日まで開催された。GMFH編集部がピックアップした、腸脳相互作用障害における糞便微生物叢移植、微生物コンソーシアム、プロバイオティクスの役割から得られた主な知見の詳細をご覧ください(後編)。
腸内マイクロバイオームと骨密度との新たな関連性を示す新知見
20 11月 2023
マノン・オリエロ
骨微生物学は、腸内細菌叢と骨粗鬆症予防との有望な関連性を明らかにした。新たな研究は、骨密度に影響を与える微生物株を明らかにし、標的治療への道を開くものである。さらなる研究により、この腸-骨軸と骨格の健康におけるその可能性が明らかになるだろう。
参加資格の確保 ワシントンD.C.で第12回GMFH世界サミットが開催される
16 11月 2023
GMFH編集チームによる
第12回Gut Microbiota for Health World Summitが2024年3月23日と24日に米国ワシントンD.C.で開催される。健康と疾患におけるヒト腸内細菌叢の操作に焦点を当てた科学プログラムとワークショップセッションをご覧ください。
最新ニュース
ニュースレターを購読する
Eメールを入力
最新号をチェックする
アワード今年のベスト腸内健康ブログ
今年のベスト腸健康ブログ
今年のベスト腸健康ブログ
GMFHがHealthlineの2016年ベスト腸健康ブログに選ばれる
私たちのイニシアチブがスペインの賞を受賞
検索する
検索 ...
編集者欧州神経消化器学会&モビリティ
ゴールドスポンサーSBromatech
レザッフル
プライバシーポリシー
法的言及
クッキーポリシー
お問い合わせ
当ウェブサイトでは、お客様に最高の体験を提供するためにクッキーを使用しています。
弊社が使用しているクッキーの詳細を確認したり、設定でクッキーをオフにすることができます。
受け入れる
この記事が気に入ったらサポートをしてみませんか?
