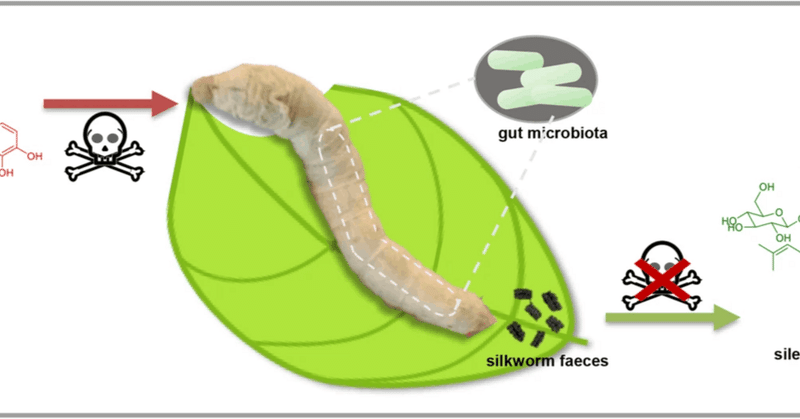
カイコ(Bombyx mori)腸内細菌叢は植物毒素のグルコシル化による代謝解毒に関与する
オープンアクセス
公開日:2023年7月29日
カイコ(Bombyx mori)腸内細菌叢は植物毒素のグルコシル化による代謝解毒に関与する
https://www.nature.com/articles/s42003-023-05150-0

シュアンジー・ユアン
ヨン・サン
...
ホンシャン・ルー
著者を表示する
コミュニケーションズバイオロジー 6巻, 記事番号: 790 (2023) この記事を引用する
13 アクセス数
1 Altmetric
指標詳細
要旨
草食動物は、さまざまなメカニズムによって飼料成分を無毒化する能力を進化させてきた。少食性のカイコは、特別で高品質のシルクを生産する目的で、桑の葉の代わりにCudrania tricuspidataの葉(CTL)を食べる。しかし、CTLを食べた蚕は、桑の葉を食べた蚕に比べて体が小さく、成長が遅く、絹の生産量が低いことが分かっている。ここでは、CTLに多く含まれるプレニル化イソフラボン(PIF)が、カイコの腸内細菌叢を通じてカイコの糞便中で糖化誘導体(GPIF)に変換されること、そしてこの生体内変換がPIFの解毒における重要なプロセスであることを示す。さらに、腸内細菌叢を再構築するプロバイオティクスとして枯草菌を加えることは、カイコの成長と発達を有益に促進する可能性がある。その結果、本研究は、CTL飼育カイコの適応性を改善することにより、シルク生産に有意義な指針を提供するものである。
はじめに
自然界では、植物は有毒代謝物を産生することで草食動物から身を守っている。一方、草食動物は有毒成分の破壊2、加水分解3、リン酸化およびグリコシル化4を含む代謝的解毒によって、有毒な摂食に打ち勝つための適応1として、植物の防御に抵抗するメカニズムを進化させた。上記の解毒イベントは、昆虫のATP結合カセットトランスポーター5、腸内微生物6,7、あるいは水平遺伝子転移8,9によって開始された。これらの要因の中で、腸内細菌叢は昆虫の防御・保護に重要な役割を果たしている7,10。例えば、マツノザイセンチュウやマツノザイセンチュウは、α-ピネンやジテルペン酸などの有毒なテルペノイドを豊富に含む針葉樹林で飼育される昆虫の草食動物であるが、その腸内細菌叢はテルペノイドを分解する強い能力を示し、昆虫のフィットネスに貢献している11,12。昆虫とその腸内細菌叢との有益な相互作用によって、宿主の解毒が達成されることが明らかになった。
鱗翅目カイコ科に属するカイコ(Bombyx mori)は、絹生産のための最も古い経済的昆虫の1つとして、中国における養蚕の長い歴史の中で広く養殖されてきた13。少食性昆虫である蚕は、主にモクセイ科のクワの葉を食べるが、同科のCudrania tricuspidataの葉(CTL)14も食べることがある。CTLを餌とする蚕の歴史は古く、中国古代の辞書「二葉」にまで遡ることができると記録されている。特に、CTLを餌とする蚕が生産する養蚕絹は、桑絹やタッサー絹に比べ、構造が安定し、引張強度が強く、優れた性能を持ち、特に弦や弓の弦を作るのに適している15,16: また、『17世紀の中国技術:天衣無縫』に記載されている旧王朝では、龍の衣を作るための特別な材料として使われることもあった。このように、CTLは徐々に様々な生産方法における蚕の飼料の代替品となってきた。
しかし、適応性の低いCTLを与えた蚕は、他の葉を与えた蚕に比べて体が小さく、成長が遅く17,18、絹の生産量も低かった。この現象の根本的な原因は不明であるが、適応性の欠如は、関連する二次代謝産物によって活性が調節される解毒代謝酵素であるカルボキシルエステラーゼのアップレギュレーションが観察されることから、CTL中の二次代謝産物に関係している可能性が報告されている19。CTLを与えたカイコのカルボキシルエステラーゼ活性は、桑の葉を与えたカイコよりも高かったことから、CTLには有毒な二次代謝産物が存在することが示唆された18。
ここで、CTLとカイコの糞(SWF)を比較化学的に検討した結果、CTLの主要成分であるプレニル化イソフラボン(PIF)は、SWFでは糖化誘導体(GPIF)に変換され、GPIFの毒性は大きく減弱することがわかった。この変換は、CTLの主成分である6,8-diprenylorobol(DPL)とカイコ腸内微生物とのin vitro共培養試験によって確認された。カイコ腸内プロバイオティクスとして枯草菌を給餌中に添加することにより、16S rDNAアンプリコンシークエンスで測定した腸内細菌叢をリモデリングすることができ、CTLを給餌したカイコの成長と発育は良好に改善された。また、CTLを与えたカイコの成長と発育は改善された。我々の研究により、カイコの成長が餌の違いによって異なる根本的なメカニズムが明らかになった。また、給餌中にプロバイオティクスを添加することによって腸内細菌叢を再構築し、カイコの発育を改善する有用な方法を提供する。
研究結果
SWFから単離された天然由来のGPIF
カイコに未曝露の影響を及ぼすCTL中のこれらのPIFを探索するため、CTLを与えたカイコが産生するSWF中の化学成分を系統的に単離・精製した。まず、SWF中の主要成分であるPIFとGPIFを中心に、合計33種類の化合物をSWFから得た(図1)。既知のPIF10種に加え、6,8-diprenylorobol(24)20、lupalbigenin(25)21、isolupalbigenin(26)22、auriculasin(27)23、4′-O-methylerythrinin C(28)24、lupiwighteone(29)25、 erysenegalenseinE(30)26、millewanins H(31)27、isoerysenegalensein E(32)28、millewanins G(33)27は、CTLの主な二次代謝産物とみなされている、 23種類のGPIFも得られた(1-23)。そのうちの21種類のGPIFは我々の知る限り未記載であり、silexcrins A-U(1-21)、2種類の既知のGPIF、lupiwighteone 7-β-D-glucoside(22)29とgenisteone(23)30は主にプレニル化イソフラボン骨格の7,3′,4′-ヒドロキシルに1つまたは2つのグルコースを導入したO-グリコシル化誘導体である。さらに、エピマー13-16の2つのトリビアルペアも得られ、ECD計算により2″R, 2″S, 3″′S, 3'″′R炭素立体中心を同定した(図2)。化合物1-21の構造解明については、補注1および2、補表1-8、および補図1-214を参照されたい。
図1:天然に存在するPIFとSWFから単離されたGPIF。
化合物1-33の構造を示す。新規化合物1-21は赤で示す。
フルサイズ画像
図2:化合物13-16の絶対配置の決定。
a LC-MS分析条件下でのsilexcrins M-P (13-16)のベースピーク。b 化合物13-16の構造。 c 化合物13-16の対応する実験ECDと計算ECD。 d 化合物13-16の対応する脱プロトン化分子イオンピーク([M-H]- m/z): 13([M-H]-m/z∼599.21094)、14([M-H]-m/z∼599.21082)、15([M-H]-m/z∼599.21082)、16([M-H]-m/z∼599.21075)。
フルサイズ画像
SWFとCTLの化学プロファイル比較分析
SWFとCTLの特徴的な成分は大きく異なることから、HPLC定性分析では、SWFとCTLの主な成分の違いは保持時間19-28分のピークに限定された(図3a)。主な差異成分としてGPIFが含まれていた。SWFではGPIF 1-5、6、9およびDPL (24)が主成分であったが、CTLではDPL (24)だけが主成分であった。加えて、化学構造の分析に基づくと、1-5と24の間に構造的な相関関係が見出されたことは、ほとんど驚くべきことではなかった。化合物1-5は、アグリコンであるDPL(24)のグルコシル化によって形成された(図3b)。
図3:SWFとCTLの比較化学プロファイル分析。
a SWFとCTLの粗抽出物のHPLC定性分析。b 化合物1-5と24のグリコシル化の構造関係。 c Silexcrins A-E(1-5)とDPL(24)の保持時間は、LC-MSでそれぞれ11.65、12.82、13.46、16.17、16.44、17. 14分であった。脱プロトン化分子イオンピークは、1([M-H]- m/z ∼745.27228)、2([M-H]- m/z ∼745.27197)、3([M-H]- m/z ∼583.21851)、4([M-H]- m/z ∼583.21851)であった。 21851)、4([M-H]- m/z ∼583.21765)、5([M-H]- m/z ∼583.21832)、24([M-H]- m/z ∼421.16562)。 d, e LC-MSによるSWFおよびCTL中の1-5および24の定量分析結果。d,eのエラーバーは平均±SDを表す。
フルサイズ画像
GPIFはSWFに多く含まれていることから、カイコの腸内代謝によってGPIFが生成されている可能性がある。LC-MSによるSWFおよびCTLの6つの主成分1-5および24の定量分析(図3c-e)と組み合わせると、SWFのGPIF 1、2、3、4および5の含量はそれぞれ0.88、2.67、0.95、1.17および1.61 mg/gであったが、CTLでは検出されなかった。しかし、CTL中のDPL(24)の含量(12.41 mg/g)は、SWF中の含量(2.14 mg/g)の約6倍であったことから、SWF中のDPL(24)の還元部分が代謝変換を受け、部分的にGPIF1〜5へのグリコシル化に関与していることが示唆された。
これらのGPIFはSWFには存在するが、CTLには存在しないことが示された。次に、これらのGPIFの形成におけるカイコの腸内代謝における腸内細菌叢の役割をさらに研究した。
試験管内での腸内微生物による生体内変換
カイコ腸内における糖鎖形成の影響因子をさらに明らかにするために、カイコの腸内細菌を分離し、3つの分離株を得た。これらの菌株の16S rDNA配列をNCBIに提出してBLAST比較したところ、B. subtilis SKG9(Accession: OQ299533.1)、Staphylococcus sciuri CTSP9(Accession: EU855191. 1)、Enterobacter hormaechei ECC33(Accession: CP098486.1)は99.87%、99.87%、99.93%であり、これらの内在性分離株はそれぞれ枯草菌、S. sciuri、E. hormaechei株であることが示唆された。
また、腸内細菌叢には、糖転移酵素を持つプロバイオティクス集団であるバチルス属細菌が存在し、糖鎖修飾に重要な役割を果たしていることが判明した31,32,33,34,35。この種の細菌は、カイコ腸内の重要な微生物の一つとして、カイコの成長・発育、栄養、代謝に影響を与える可能性がある16,36。PIFに対するバチルス属細菌のグリコシル化機能を検証するため、3種のバチルス属細菌、Bacillus licheniformis K1-30-2、Bacillus licheniformis K7-30-7、およびカイコ腸内の内在性分離株であるB. subtilisを選択し、in vitroでの変換能力を実証した(図4a)。LC-MSで表示された結果(図4b)によると、DPL(24)を基質として3株のバチルス菌で発酵させた実験群では、対応するGPIF 1~5が見事に検出された。したがって、3種のBacillusはいずれも24をその糖化産物に生物変換することができた。
図4: In vitroにおけるBacillus属の微生物による5と24の糖鎖の生合成。
a in vitroにおけるBacillus属菌による(ii)5と(i)24の微生物生分解のスキーム。Silexcrin E (5)およびDPL (24)を基質として、B. licheniformis K1-30-2、B. licheniformis K7-30-7、およびB. subtilis株の3種のバチルス属を用いた。b LC-MSで検出されたin vitroでの微生物による生体内変換により、DPL (24)を基質とする3種のバチルスから変換された生成物:(i) B. licheniformis K1-30-2が生成した化合物1-5は、それぞれ11.62, 12.83, 13.45, 16.18, 16.40分で検出された。(ii) B. licheniformis K7-30-7が産生する化合物1-5は、それぞれ11.63, 12.80, 13.46, 16.19, 16.41分に検出された。(iii) B. subtilis株が生産した化合物2-5は、それぞれ11.72、12.89、13.45、16.22および16.45分で検出された。 c in vitroでの微生物形質転換により、silexcrin E (5)を基質とする3種のBacillusからLC-MSで検出された変換産物:(i) B. licheniformis K1-30-2が生産した化合物2および13-16は、それぞれ12.79および15. (i) B. licheniformis K1-30-2が生産した化合物2および13-16は、それぞれ12.79分および15.09-15.35分に検出された;(ii) B. licheniformis K7-30-7が変換した前述の生成物は、それぞれ12.78分および15.09-15.35分に検出された;および(iii) B. subtilis株が生産した化合物は、それぞれ12.81分および15.09-15.35分に検出された。
フルサイズ画像
さらに、SWFでは2対のエピマー13-16が同定されたが、CTLでは13-16の対応するアグリコンは見つからなかったことから、化合物13-16は微生物による形質転換によって形成されたことが示唆された。この結論は、in vitroで5を与えた3種のバチルス菌によって変換され、LC-MSで対応する保持時間と脱プロトン化分子イオンピークで検出された2および13-16(図4c)の形成によってさらに確認された(補足図215)。ここで我々は、カイコ腸内のBacillus種によるSWF中の主成分DPL (24)の微生物生物変換を論理的に提案する。まず、DPL (24)はカイコ腸内のBacillus種によって3、4、5にグリコシル化され、次いで糖が順次付加されて1と2が形成された。さらに、5の一部は腸内細菌の影響下で連続的なエポキシ化とSN2求核付加による13-16の形成に関与した(図4d)。
さらに、他のカイコ内在性腸内細菌であるS. sciuriとE. hormaecheiによるDPL(24)のin vitro微生物変換も行った。そして、S. sciuriはDPL (24)をグリコシル化して1、2および5を形成することができ、E. hormaecheiは基質24を2に変換するのみであったことから、これら2つの分離株はDPL (24)を部分的に変換して対応するGPIFを産生することしかできないと推察された(補足図216)。したがって、これらのカイコ腸内分離株はPIFの変換に関与しており、バチルス属はカイコ腸内の他の2つの分離株よりもDPL(24)の形質転換能力に優れていることが示唆された。惜しむらくは、カイコ腸内からB. subtilis以外の内在性Bacillusを調査しなかったことであり、今回の研究ではカイコ腸内の他の微生物分類群の寄与も否定できない。
silexcrin B (2)およびDPL (24)のin vitro毒性解析
解毒作用に関連するグリコシル化について、PIFはカイコに対して毒性を示すが、生体内変換されたGPIFは毒性を減弱させると仮定した。まず、SWFから単離した化合物1~33の正常ヒト臍帯静脈上皮細胞(HUVEC)に対する細胞毒性をスクリーニングした(表1)。CTLからのこれらのPIFは、一般にHUVECに対して有意または中程度の細胞毒性活性を示した。特に、DPL(24)は1.97±0.31μMでHUVECに対して最も顕著な細胞毒性を示し、これは対照薬であるアジスロマイシンよりも強かったが、対応する5つのGPIF 1~5の毒性はかなり弱いか、あるいは消失さえしていた。
表1 SWF由来の化合物1~33のHUVECに対する細胞毒性活性。
フルサイズの表
また、silexcrin B(2)とDPL(24)で処理した2つのグループで、HUVECの増殖と生存を観察した(図5a)。シレクスクリンB(2)で処理したHUVECの増殖状態は、80μMまでは正常な細胞形態を保っていたが、DPL(24)処理群では、5μM未満で明らかに、そして用量依存的に細胞が損傷した。さらに研究を進めると、フローサイトメトリーによって決定されたように、HUVECを24で処理した場合、DPL(24)が細胞のアポトーシスと周期停止に影響を及ぼすことがわかった(図5b-e)。この結果は、DPL(24)が用量依存的にHUVECのアポトーシスを促進し、HUVECをG1期に留まらせたことを示唆しており、これはDPL(24)の毒性作用によって解釈されるかもしれない。
図5:in vitroおよびin vivoのHUVECおよびG. mellonellaにおけるDPL(24)またはsilexcrin B(2)誘発細胞毒性。
a in vitroで異なる濃度のsilexcrin B(2)またはDPL(24)によって誘導されたHUVECの増殖状態。 b HUVEC株を0、2.5、5、または10μMのDPL(24)で処理し、アネキシンV-FITC/PI染色と組み合わせたフローサイトメトリー分析によって細胞アポトーシスを検出した。(one-way ANOVA, n = 3, P = 0.0687 > 0.05, **P = 0.003 < 0.01, ***P < 0.001 vs. コントロール群。エラーバーは平均±SDとして報告されている。) d細胞を0、1.25、2.5、5μMのDPLで処理し(24)、PI染色と組み合わせたフローサイトメトリー解析によって細胞周期停止も検出した。(一元配置分散分析、n=3、*P=0.0496<0.05、**P=0.0053<0.01、***P<0.001対コントロール群。f 生存曲線におけるG. mellonellaに対するsilexcrin (2)およびDPL (24)の毒性試験。
フルサイズ画像
in vivoにおけるガレリア・メロネラに対するシレクスクリンB(2)とDPL(24)の毒性解析
続いて、G. mellonellaに対するsilexcrin B (2)およびDPL (24)の毒性を試験した(図5f)。カイコとG. mellonellaはともに鱗翅目の昆虫であるため、モデル昆虫37,38としてG. mellonellaに40μg/dまたは80μg/dの化合物を処理し、7日間連続注射した。80μg/dのDPL(24)投与群のG. mellonellaは2日目に斃死し始め、7日目の生存率は50%であった。同じ薬量のsilexcrin B(2)投与群では、昆虫は5日目に斃死し始め、7日目の生存率は75%であった。投与量が40μg/日の場合も同様の結果となった。同じ投与量と処理期間では,DPL(24)投与群の生存率はsilexcrin B(2)投与群よりも低く,投与量の増加とともに生存率は低下した。G. mellonellaに対する毒性試験から、CTL中のPIFはカイコに対して比較的高い毒性を有し、これらの化合物はカイコの腸内細菌叢によって毒性が大幅に減弱されたグリコシル化誘導体に変換されることが示唆された。このように、重要な解毒経路としてのグルコシル化は、カイコにCTLを与えた場合のカイコの腸内代謝において重要な役割を果たしていた。
プロバイオティクスとしての枯草菌はカイコの腸内細菌叢に影響を与えた
腸内細菌叢の組成は食餌の変化によって影響を受けることから14,39、我々はカイコの飼料に枯草菌を補充することで、カイコと腸内微生物に何らかの有益な効果が得られると考えた。明確な遺伝的背景を持つ枯草菌は、一般的な人工細菌およびプロバイオティクスサプリメント40,41,42として使用されているため、2つの異なる品種のカイコを対象に、枯草菌プロバイオティクス粉末を使用したプロバイオティクス試験を実施した。
生きたカイコから解剖した腸内容物の塩基配列を16S rDNAアンプリコン配列法43で決定し、枯草菌の有無による腸内微生物組成の変化、相対量、多様性を比較した。まず、カイコの腸内細菌叢の属レベル、さらには門レベルの組成が変化し、これは外来性の枯草菌の添加の影響を受けた(図6a, b)。さらに、枯草菌を添加するとカイコ腸内のバチルス属の相対存在量も増加し、YSYカイコでは1.19%から2.12%に増加し、HK2カイコでは0.72%から1.26%に増加した(図6c)。α多様性分析によると、Shannon_2、richness、Chao1の3つの指標から、枯草菌を添加した実験群のカイコ腸内の種の豊かさは、枯草菌を添加していない対照群のそれよりも高いことが示された(図6d)。例えば、Shannon_2の値はYSYカイコでは3.12から3.98に、HK2カイコでは1.42から2.44に増加した。さらに、Simpson、優性、および均等性の指標からも、枯草菌を添加した後のカイコ腸内の種の均等性はより均等であることが示された(図6e)。例えば、シンプソンの値はYSYカイコでは0.40から0.21に、HK2カイコでは0.72から0.53に減少した。従って、枯草菌がカイコの腸内でコロニー形成し、腸内細菌叢組成を変化させ、腸内微生物の多様性と全体的な均等性を高めたことが示された。しかし、今回の研究では、枯草菌を含まないプロバイオティック粉末に含まれる他の成分の対照群を探索しなかったため、他の成分の影響を排除することはできなかった。
図6:カイコ中腸における16S rDNA細菌配列解析。
4つの異なるグループにおけるカイコ腸内細菌の門レベル(a)と属レベル(b)の相対量。4群各5匹のカイコを用いた。(YSYはYSYカイコのグループ、HK2はHK2カイコのグループ、BSはCTLに枯草菌を追加してカイコに与えることを意味する。) b カイコの中腸の4つのグループにおけるバチルス属の相対的存在量。c Shannon_2、豊かさ、Chao1の箱ひげ図は、値が大きいほど種の豊かさが高いことを表し、枯草菌を添加した実験群の種の豊かさを示す箱ひげ図の中央線の値は、枯草菌を添加していない対照群よりも高いことを表す。Simpsonは、値が小さいほど種の均等性が高いことを表し、枯草菌を用いた実験群の種の均等性を示す中央線の値は、枯草菌を用いない実験群よりも均等であった。優性と均等性については、値が高いほど種の均等性が高い。c-eのデータは平均値±SDで報告されている。
フルサイズ画像
枯草菌はカイコの成長と発育および腸内代謝物に影響を与えた。
さらに、プロバイオティクス試験に参加したカイコを異なる群に分けて成長と発育を観察し、異なる期間におけるカイコの体重データを記録した。その結果、実験群では蚕の成長状態が良好であり、異なる期間において枯草菌を与えた蚕の平均体重は、与えていない蚕よりも重く(図7a)、枯草菌を与えた蚕は与えていない蚕よりも大きかった(図7b)。YSYカイコの品種については、枯草菌を添加したカイコは添加していないカイコより有意に重かった(図7c)。従って、枯草菌を蚕に与えることにより、蚕の成長発育が促進され、特に体重が増加することがある程度示された。
図7:プロバイオティクス試験におけるカイコの成長と発育、および腸内代謝産物への影響の評価。
a プロバイオティクス試験に参加した全カイコの成長段階別4群における平均体重の変化 b プロバイオティクス試験で各群5頭から無作為に選んだカイコの体の大きさの比較。d λ = 254 nmで検出されたGPIF 1-5およびアグリコン24のHPLC定量分析。 e HPLCによる4群のSWFからの1-5, 24の相対含有量の定量分析結果を棒グラフで示す。縦座標は、これら6つの化合物の総含有量を占める各化合物(1-5と24)の含有量の比率を示し、SWF中の成分の相対的な含有量を反映している。 f 4つの異なるグループのSWFからGPIF 1-5の相対的な含有量の比較。c、e、fのデータは平均値±SDとして報告されている。
フルサイズ画像
次に、HPLCによる主成分1-5および24の定量分析を行った(図7d, e)。HPLCの定量結果より、6成分のピーク面積の合計に対する1-5および24の各ピーク面積の比率を指標として、SWF中の6成分の相対含有量の変化を測定し、カイコの腸内代謝産物の変化に対する外因性枯草菌の影響を示した。図7eに示すように、枯草菌はカイコの腸内代謝産物の含量に影響を与えた。枯草菌添加後、YSYカイコではSWF中の5つの主要GPIF 1-5の相対含量の合計が増加し(図7f)、枯草菌を与えていないカイコに比べ2.0%増加したが、アグリコンDPL(24)の相対含量は減少した。この観察は、YSYカイコの腸内におけるバチルス菌の相対存在量の増加と関連している可能性がある。しかし、HK2カイコのSWF中の1-5の相対的な総含有量は、枯草菌を与えていないカイコと比較して0.2%わずかに増加した。この結果から、YSYカイコはHK2カイコよりも枯草菌に対して感受性が高い可能性が示唆された。
カイコに枯草菌を添加することにより、GPIFの総含有量が増加し、SWF中の対応する毒性アグリコン含量が減少するという現象は、宿主を有害成分から保護するためにCTL中の毒性PIFを無毒化することにも関連している可能性がある。
考察
我々はSWF中に豊富に存在する一連のGPIFを発見した。これらはプレニル化イソフラボン骨格の7-、3′-または4′-OHの1部位または2部位のオキシグリコシル化産物である。自然界にはGPIFがほとんど存在しないことから44、CTLを食べたカイコのSWFは、結果的にこれらの化合物の豊富な天然供給源となる。さらに、SWFとCTLの成分の主な違いはGPIFであることがわかった。その後、HPLC-MS定量分析による予備的証拠により、これらのGPIFはCTL自体には存在せず、カイコの腸内代謝によって生成されることが証明された。カイコの腸から分離されたB. subtilis、S. sciuri、E. hormaecheiの3つの腸内菌株によるDPLのin vitro微生物生物変換(24)は、SWF中の豊富なGPIFの形成がカイコの微生物と密接に関係していることをさらに示唆した。
GTを持つバチルス属などの微生物の中には、幅広い基質特異性を持つ優れたトランスグリコシル化能を持つものがあり、特にプレニル化フェノール成分が高い親和性を持つことが報告されている44,45。近年、Bacillus属由来のGTがフラボノイドのグリコシル化に広く利用されている46。 licheniformis (Bl-YjiC)49,50およびBacillus cereus (MgtB, BcGT1, BcGT-3)51,52,53由来のGTが、フラボノイドの水酸基にグリコシル基を結合させ、フラボノイド-O-グルコシドを生合成するグリコシル化反応を触媒できることを見出した。その例として、我々はバチルス属細菌がDPL(24)をGPIFs silexcrins A-E(1-5)に変換できることを証明した。さらに、アグリコン骨格を変異させたエピマーsilexcrins M-P(13-16)の形成も微生物による生物変換によって確認された。
グリコシル化は、化合物の構造安定性や親水性を向上させるだけでなく、直接的あるいは間接的な解毒プロセスとも考えられている54,55,56,57。本研究では、G. mellonellaに対するDPL (24)の毒性試験により、CTL中のPIFが草食動物に毒性を示すことが証明され、カイコの成長と発育に影響を及ぼす可能性があることがわかった。DPL(24)をHUVECでさらに試験したところ、細胞アポトーシスを誘導し、細胞がG1期にとどまるのを阻害し、深刻な細胞損傷を引き起こした。この研究により、糖鎖修飾はCTLの毒性PIFを毒性が減弱または全くないGPIFに変換するための重要な解毒経路であることが明らかになった。いくつかの研究報告によると、CTLを与えたカイコは桑の葉を与えたカイコと比較して、成長・発育、繭、絹の品質に違いが見られる(補足図217)が、これはCTL由来の毒性成分の影響を受けている可能性がある15,17,18。したがって、CTLに豊富に含まれる特徴的なファイトケミカルのサブクラスであるPIFは、カイコの生育に有害な成分であることが確認され、CTLを与えたカイコの適応性が比較的低い理由が説明された。
また、最近の研究では、プロバイオティクス試験という戦略の可能性が提案されており、コリネバクテリウム属とバチルス属をプロバイオティクスとして用いると、それに応じて腸内微生物が変化し、アマガエル腸内の微生物相互作用を検証できることが明らかになった58。ここで我々は、カイコの腸内に添加されたプロバイオティクスとしての枯草菌が、腸内細菌叢の組成を変化させ、腸内細菌の豊富さと均一性を高め、カイコの植物化学的糖鎖形成を通じた未曝露代謝解毒戦略において重要な役割を果たすことを見出した。重要なことに、カイコの成長と発育に対する有益な促進効果も観察された。プロバイオティクスB. subtilisが動物の成長と発育を促進するために使用され、ヒトの病気の予防と治療に有益であることさえ示されていることから34,59,60,61,62、プロバイオティクスBacillus種もカイコの腸内プロバイオティクス製剤として開発されることが期待される。
しかし、今回の研究では、カイコ腸内から分離されたB. subtilis、S. sciuri、E. hormaecheiの3種以外の内因性腸内細菌叢を調査していないことが限界である。食餌の違いが昆虫の腸内細菌叢の組成に影響を与える可能性が報告されているように14,39、プロバイオティクス粉末に含まれる他の成分もカイコの腸内細菌叢の組成に影響を与える可能性があるかどうかは不明である。
ここで特筆すべきは、カイコの腸内細菌叢が食物成分を糖化誘導体に変換して無毒化する能力を進化させていることを明らかにしたことである(図8)。これは、CTLを餌とするカイコの適応性を向上させるための今後の関連研究の基礎を築き、カイコに適した微生物製剤に応用されるプロバイオティクスのさらなる開発の可能性を示すものである。
図8:カイコの腸内細菌叢の影響下におけるCTLからのDPL(24)のグルコシル化による推定解毒メカニズム。
カイコがCTLを摂食すると、CTL中の毒性成分DPL (24)がカイコの腸内に入り、カイコの腸内細菌叢の影響下で毒性が大幅に減弱したsilexcrin B (2)のようなGPIFに変換される。
フルサイズ画像
実験方法
実験材料、化学物質および試薬
CTLおよびCTLを与えたカイコのSWFは、中国山東省臨沂市から採取した。B.subtilisのプロバイオティック乾燥粉末をShandong Yihao Biotechnology Co. (Ltd.(中国)から購入した。HPLCまたはLC-MS分析用の試薬はクロマトグラフィグレードのものを使用し、その他の試薬は分析グレードのものを使用した。
化合物の抽出、単離および同定
風乾したSWF(1.8 kg)を95%エチルアルコールで3回、各回3時間還流して抽出した。H2Oに懸濁して蒸発させた粗抽出物を、石油エーテル、酢酸エチル、n-ブチルアルコールで順次抽出した。簡単に説明すると、酢酸エチル抽出物をMeOH-H2O(3:7→1:0)、CH2Cl2-MeOH(200:1→0: MCIゲルカラム、シリカゲルカラム(100-200メッシュ)、Sephadex LH-20クロマトグラフィー、セミ分取HPLC(SHIMADZU LC-20AT、DAD検出器、Shim-pack GIS-C18(5μm、10×250mm))を経由して、MeOH-H2O溶出系、MeOH(100%)、MeOH-H2O溶出系で順次分配した。) 33種のGPIFが精製され、silexcrins A-U (1-21)、NMRデータ、HRESIMS、ECD、UV、IRスペクトルの解明は補足資料に示す。
一般的な実験手順
NMRスペクトルは、Avance DRX-400および600スペクトロメーター(Bruker、ドイツ、ジメチルスルホキシド-d6、溶媒として0.3%内部標準TMS)を用いて取得した。UVスペクトルはUV-2550分光光度計(島津製作所、日本)で、IRスペクトルはNicolet iN10 Microinfrared spectrometer(Thermo Fisher Scientific、アメリカ)で得た。ECDスペクトルの化合物を得るためにChirascan Circular dichroism spectrometer (Applied Photophysics, United Kingdom)を使用した。光学回転はMCP 200(Anton Parr、オーストリア、溶媒としてMeOH、20℃)で測定した。高分解能質量スペクトルは、Thermo Fisher Q-Exactive Orbitrap Mass Spectrometer (Thermo Fisher Scientific, America)で得た。
LC-MSによる定量分析
SWFおよびCTLからの特徴的な化学成分silexcrins A-E(1-5)およびDPL(24)の含有量の変化の定量分析は、別々にLC-MSにより以下の分析条件で行った:装置、Thermo Fisher Q-Exactive Orbitrap, UtiMate 3000, Dim. (100×2.1 mm); 検出器、DAD-3000; イオン源、ESI; 流速、0.3 mL/min; および注入量、2.0 μL。MeOH-H2O溶出系では、0.0-1.0分は25:75、1.0-20.0分は25:75から95:5、20.0-24.0分は95:5、24.0-25.0分は95:5から25:75、25.0-28.0分は25:75のグラジエント溶出を行った。6種類のsilexcrins A-E (1-5)とDPL (24)を混合し、1μg/mLの各化合物の標準溶液を調製した。この混合標準溶液を、各化合物の濃度が1000、500、250、100、50、25、10、5、2.5ng/mLになるように連続希釈し、各混合溶液とした。これら9種類の標準混合溶液を、6成分の標準曲線を作成するために適用した(補足図218)。SWFおよびCTLのメタノール超音波抽出物を、上記の条件でLC-MSにより200μg/mLの濃度になるように別々に調製した。各群は3連で分析した。分析から得られたデータを用いて、Thermo Scientific Xcaliburソフトウェアにより、SWFおよびCTL中の6種類の化合物の含有量を検出した。
HPLCによる定性・定量分析
SWFおよびCTLの粗抽出物から得られたさまざまな成分の定性分析は、同じクロマトグラフィ条件(Agilent 1260、DAD検出器、Eclipse XDB-C18カラム(5 μm、4.6×250 mm)、MeOH-H2O溶出系からのグラジエント溶出、30分で30:70から100:0)のHPLCで行った。新鮮なSWF中のsilexcrins A-E(1-5)およびDPL(24)の含有量変化の定量分析は、上記のクロマトグラフィー条件でHPLCにより別々に行った。2品種のカイコが枯草菌の有無にかかわらず生産したSWFは4群(YSY、YSY-BS、HK2、HK2-BS)あり、いずれも50 mg/mLに調製した。さらに、クロマトグラフィグレードのメタノールに溶解したsilexcrins A-E (1-5)およびDPL (24)を定性分析し、上記のクロマトグラフィ条件下での保持時間を確認した。達成された6つのクロマトグラフィーのピーク面積は、4つの異なる排泄物中の6つの化合物の相対的な含有量を比較するために処理された。水に加えて凍結乾燥後の新鮮なSWFをすべて粉末にした。
13-16のECD計算の詳細
理論と計算の詳細63: 計算はGaussian 09プログラムパッケージで行った。半経験的AM1法とDFTアプローチB3LYP/6-31 G (d)を用いてポテンシャルエネルギー曲面をスキャンし、298.15 Kですべての基底状態のコンフォーメーションのジオメトリーを最適化した。時間依存密度汎関数理論により、最初の60状態の気相における電子励起エネルギーと回転強度を計算した。回転強度を合計し、ボルツマン統計に基づいてエネルギー的に重み付けした後、最終的なECDスペクトルは以下の式1によって得られた:
$$\triangle {{{{{\rm{\varepsilon }}}}}}\left(E\right)=\frac{1}{2. limits_{i}{triangle E}{i}{R}{i}{e}^{{-[(E-triangle {Ei})/sigma ]}^{2}}$.
σは1/eの高さ(σ = 0.1eV)におけるバンドの幅。 ΔEiは励起エネルギー。Riは遷移の回転強度。
試験管内での微生物による生体内変換
in vitroでの微生物生物変換に用いたB. licheniformis K1-30-2およびB. licheniformis K7-30-7は、当研究室で以前に選抜したものである。B.subtilis株はカイコから分離した。DPL(24)とsilexcrin E(5)を基質として、3種のBacillusを摂食させた。基質を添加した実験グループと基質を添加しない対照グループを設定し、各グループを3連で試験した。3種のバチルス属細菌を寒天平板上で培養して活性化し、活性化した分離株をエッペンドルフチューブに5mLずつ入れたLuria-Bertani(LB)溶液を培地としてグルコース源とし、37℃恒温振盪台上で24時間培養した。菌液を培養した後、基質としてDPL(24)またはsilexcrin E(5)(1mgを0.5%DMSOに溶解)を実験群に添加し、さらに37℃で24時間連続培養した。その後、溶液中の細菌を超音波で破砕し、酢酸エチルで3回抽出した。溶解液をLC-MS(上記と同じ条件下)で分析し、in vitroにおける3種のバチルス属細菌の微生物生物変換産物を検出した。
プロバイオティクス試験
本研究で選択した2種のカイコ、YeSanYuanカイコ(YSY-silkworm)およびHuaKang 2カイコ(HK2-silkworm)は、臨沂(中国、山東省)のCudrania tricuspidataのRunfa研究所から提供された。プロバイオティクス試験の対照群(YSY、HK2)には枯草菌プロバイオティクス粉末を添加せずにCTLを与え、実験群(YSY-BS、HK2-BS)には枯草菌プロバイオティクス粉末を添加したCTLを与えた。実験には合計400匹の蚕が参加し、各群100匹ずつであった。孵化した蚕の段階からCTLを与えた。3齢以降の蚕には、枯草菌製剤を添加したCTLを散布して与えた。枯草菌乾燥粉末製剤を水で1:1000g/mLに希釈し、実験群の蚕に与えたCTLに1日3回適度に添加した。同時にカイコの体重の変化を記録した。5-instar64時にカイコの消化管に記録された細菌数が最も多かったため、2品種各群5匹の生きたカイコを無作為に選んだ。カイコを75%エチルアルコールで表面殺菌した後、カイコの中腸で解剖した。中腸内容物は滅菌シリンジで採取し、-80℃で保存した。
16S rDNAアンプリコン配列解析による細菌群集の多様性
カイコ中腸内容物のサンプルは、YSYカイコとHK2カイコ、YSY、YSY-BS、HK2、HK2-BSと名付けた4つのグループ、各グループ5個体ずつ、合計20サンプルから得た。以下の手順は、Luojie (Jinan) Biological Medicine Co. (Ltd.(中国、山東省)で行った。抽出したサンプル中の核酸は、DNeasy PowerSoil Pro Kit(Qiagen, Cat No.47016)を用いて分析した。核酸の完全性と濃度を測定した後、DNAサンプルを高忠実度酵素を用いて増幅し、濃度の定量にはInvitrogen Qubit 4.0蛍光光度計を用いた。KAPA Hyper Prep Kitを用いてライブラリーを構築し、Illumina NovaSeqを用いてシーケンスし、生データを得た。一連のデータ分離、プライマー除去、PEリードスプライシング、品質と長さを持つタグ、フィルタリングとインターセプト、キメラ除去の後に得られた有効タグにより、ゼロ半径操作分類単位(ZOTU)を構築した。細菌のアルファ多様性およびベータ多様性解析はZOTUから得られた。16 S rDNAアンプリコンシークエンシング65は、実験群と対照群の腸内微生物の違い、および本実験における腸内微生物の組成の変化を解析するために用いた。
ゲノムDNA抽出: カイコ腸内細菌の全ゲノムDNAは、DNeasy PowerSoil Pro Kit(Qiagen, Cat No.47016)を用いて、以下の抽出手順に従って抽出した: 混合ジルコニウムビーズチューブに入れたサンプルに溶解バッファー を加え、ビーズチューブアダプターを装着した卓上ボルテックスでビーズ ビートを行い、ホモジナイズする。粗ライセートはクリーンアップのため阻害剤を除去し、精製ライセートは等量のDNA結合溶液と混合する。混合系をシリカスピンフィルター膜に通し、2段階の洗浄レジームで洗浄する。その後、10mM Tris溶出バッファーでシリカ結合DNAを溶出する。
PCR反応系とサイクル手順 異なる領域(16S V3-V4)の16S rRNA遺伝子を、特異的プライマー(341 F(5′-CCTAYGGRBGCASCAG-3′)およびバーコード付き806 R(5′-GGACTACNNGGTATCTAAT-3′)を用いて増幅した。PCR反応は15μLのPhusion® High-Fidelity PCR Master Mix(New England Biolabs)、0.2μMのフォワードプライマーとリバースプライマー、約10ngの鋳型DNAを用いて行った。熱サイクリングは、98 °Cで1分間の初期変性、98 °Cで10秒間の変性、50 °Cで30秒間のアニーリング、72 °Cで30秒間の伸長を30サイクル繰り返した。
カイコ腸内細菌の単離と同定
カイコの腸内細菌を、報告されている方法36に修正を加えた方法に従って分離した。簡単に説明すると、24時間餓死させたカイコを5匹選んだ。蚕の体表を75%アルコールで滅菌した後、蚕を解剖し、蚕の腸内容物を得た。無菌操作のもと、5mLの滅菌水を入れた10mL EPチューブに腸液を加えた。腸液は10倍希釈法で10-1、10-2、10-3に希釈した。各濃度100μLの腸液をNA培地プレートに均一に塗布し、37℃で12時間培養した。形態の異なるコロニーを選択し、顕微鏡で単一株として検出されるまでさらに線引き精製を行い、16S rDNA配列と解析のためにSangon Biotech(Shanghai)Co,Ltd.に送付した。
ゲノムDNAの抽出: Ezup Column Bacteria Genomic DNA Purification Kit(Sangon Biotech社製、Cat No.SK8255)により、以下の抽出手順に従ってカイコ株ゲノムDNAを抽出した: 一晩培養した菌液(1 mL)を1.5 mL遠心チューブに加え、室温、8000 rmpで遠心し、上清を捨てて菌体を回収した。グラム陽性菌液を180μLのリゾチーム溶液(20mg/mL)を加えて再懸濁し、37℃で30~60分間静置する。グラム陰性菌溶液に180μLのBuffer Digestionを加える。Proteinase K溶液(20μL)を採取した細菌に加え、よく混合し、細胞が完全に溶解するまで56℃で1時間水浴する。その後、Buffer BD(200μL)、無水エタノール(200μL)を順次添加し、十分に混合する。混合液を吸着カラムに2分間負荷した後、室温、12,000rpmで1分間遠心し、回収チューブの廃液を空にする。PW 溶液(500μL)を加え、10,000rpm で 30 秒間遠心し、ろ液を排出する。次に Wash Solution(500μL)を加え、遠心分離してろ液を除去する。吸着カラムを 1.5 mL 遠心チューブに入れ、CE Buffer (50-100 μL)を加え、3 分間静置した後、12,000 rpm、2 分間、室温で遠心し、DNA 溶液を回収した。
PCR反応系とサイクルの手順 抽出した細菌ゲノムDNAを鋳型とした。PCR増幅は、細菌16 S rRNA遺伝子のユニバーサルプライマー27 F(5′-AGA GTT TGA TCC TGG CTC AG-3′)および1492 R(5′-GGC TAC CTT GTT ACG ACT T-3′)を用いて行った。0.5 μLのゲノムDNAテンプレート(20-50 ng/μL)、0.5 μLのフォワードおよびリバースプライマー(10 μM)、5 μLの10×PCRバッファー(Mg2+プラス)、4 μLのdNTPミクスチャー(2.5 mM L-1)、およびTaqDNAポリメラーゼ(5 U μL-1)0.2μLを、滅菌した超純水で25 μLまで満たす。94 °Cで4分間の予備変性、94 °Cで45秒間の変性、55 °Cで45秒間のアニーリング、72 °Cで1分間の伸長、30サイクル、72 °Cで10分間の修復伸長を行い、4 °Cで保存した。増幅産物を1% AGARゲル電気泳動(BBI、Cat No.AB0014)で精製し、SanPrepカラムDNAJゲル回収キット(Sangon Biotech、Cat No.SK8131)で回収した。
G. mellonellaに対する毒性試験
プレニル化イソフラボンの糖鎖付加の影響を利用するため、G. mellonellaに対する毒性試験を実施した。昆虫モデルとしてG. mellonellaを用い、silexcrin B (2)とDPL (24)の毒性をin vivoで試験した。簡単に述べると、体重0.28~0.35gのG. mellonellaの幼虫合計40匹を選抜した。 35gを実験前に選択し、ビヒクル対照(溶媒を対照とした)、シレクスクリンB(2)(各幼虫に40μg/d)、シレクスクリンB(2)(各幼虫に80μg/d)、DPL(24)(各幼虫に40μg/d)、およびDPL(24)(各幼虫に80μg/d)を含む5群8匹に無作為に分けた。Silexcrin B(2)およびDPL(24)は、5%DMSO、45%PEGおよび50%通常生理食塩水を含む10μL溶液に溶解した。対照群または4つの処置群の幼虫に、調製した薬剤溶液10μLを最後の右前脚から注射し、7日間連続注射した。その後、35℃の暗所で培養した。カイコの生存率を7日間毎日モニターした。生存曲線はGraphPad Prism 7で描き、log-rank(Mantel-Cox)生存分析モデルを用いた。
MTTアッセイによる細胞毒性試験
HUVECは中国科学院上海生物科学研究所(SIBS)から入手した。既報の方法66に従い、HUVECの培養条件は、10%FBS(Sijiqing Company Ltd.)、100units/mLペニシリンG、100μg/mLストレプトマイシンからなるRPMI-1640(HyClone)培地を用い、5%CO2、37℃の環境下で行った。HUVEC株の細胞をまず96ウェルプレートに3~5×103細胞/ウェルで播種し、一晩接着させた。その後、濃度の異なる33種類の化合物と対照薬アドリアマイシンを加え、指示された時間インキュベーションを続けた。12μLのMTT(5.0mg/mL)溶液を加え、37℃でさらに4時間インキュベートした。その後、MTTをDMSOで培地から除去してから、紫色のホルマザン結晶を150μL/ウェル添加した。光学濃度をマイクロプレートリーダー(Bio-Rad 680)で570 nmで検出し、GraphPad Prism 7を用いてIC50値に計算し、細胞生存率を評価した。実験はすべて3連で行った。
ビヒクルコントロールとの比較により、細胞生存率阻害率は以下の式2により算出した:
$${{{{{\rm{Cell}}}}}}; {{{{{\rm{viability}}}}}}; {{{{{\rm{ratio}}}}}}\left( % \right)=\frac{{{{{{\rm{A}}}}}}570,{{{{{\rm{sample}}}}}}-{{{{{\rm{A}}}}}}570,{{{{{\rm{blank}}}}}}}{A570,{control}-A570,{blank}}\times 100 %$$
フローサイトメトリーによる細胞アポトーシスと細胞周期停止の解析
細胞アポトーシスと細胞周期停止は、文献66,67,68 に従ってフローサイトメトリーで分析した。簡単に述べると、一晩培養した後、細胞を0、2.5、5、10μM DPL(24)濃度の5%血清培地に24時間暴露し、その後細胞を回収してPBSで洗浄した。上清を遠心分離で除去した後、細胞を400μLの結合バッファーに再懸濁し、5μLのAnnexin V-FITC、次いで5μLのPI(50mg/L)と共に暗所、室温で15分間インキュベートした。アポトーシス比率は、WinMDI 2.9ソフトウェアを用いたフローサイトメトリー(Becton Dickinson, USA)により分析した。HUVECを0、1.25、2.5、または5μMのDPL(24)で24時間処理し、PI染色と組み合わせたフローサイトメトリー解析によって細胞周期の停止を検出した。
統計と再現性
各実験は、統計と再現性のために少なくとも3つの生物学的に独立したサンプルを用いて行った(n≧3)。結果は分散分析に使用し、平均値間の差は2群間ではStudentのt検定、複数群間では一元配置分散分析で評価した。P < 0.05を統計的に有意とみなした。すべてのデータは平均値±標準偏差(SD)で報告されている。
報告概要
研究デザインに関する詳しい情報は、この論文にリンクされているNature Portfolio Reporting Summaryに掲載されている。
データの利用可能性
本研究の結果を裏付けるすべてのデータセットは、図、表、補足情報ファイルに掲載されている。グラフの作成に使用した数値ソースデータは、補足データ1に掲載されている。腸内細菌叢全体の16S rRNA-seq生データはSequence Read ArchiveにアクセッションコードPRJNA985806で寄託されている。16S rDNA配列の生データは、GenBankにアクセッションコードOR125545(B. subtilis株)、OR125546(S. sciuri株)、OR125547(E. hormaechei株)で公開されている。化合物1-21の構造解明は補注1に詳細を、化合物1-21の物理化学的性質は補注2を参照されたい。すべてのデータは、合理的な要求があれば、対応する著者から入手可能である。
参考文献
Ben-Yosef, M. et al. 共生細菌がオリーブの幼虫に宿主の防御を克服させる。R. Soc. Open Sci. 2, 150170 (2015).
論文 PubMed PubMed Central Google Scholar
郭 圭一(Guo, K.)ら:Leucosceptrum canumの専門昆虫によるベンゼン環の開裂を介した植物芳香族アビエタノイドの11,12-セコジテルペンポリエンへの解毒。Org. 22, 126-129 (2020).
論文 CAS PubMed Google Scholar
Poreddy, S. et al. 捕食者対策としてではなく、宿主植物の化学的防御の解毒が、β-グルコシダーゼを介した鱗翅目昆虫の反適応を促進する。Nat. Commun. 6, 8525 (2015).
論文 CAS PubMed Google Scholar
キャッサバ由来シアノゲノグルコシドのコナジラミBemisia tabaciによる活性化と解毒。日本学術振興会特別研究員。
論文 CAS PubMed PubMed Central Google Scholar
昆虫ATP結合カセット(ABC)トランスポーター: 昆虫のATP結合カセット(ABC)トランスポーター: 異種物質の解毒とBt殺虫活性における役割. Int. J. Mol. Sci. 20, 2829 (2019).
論文 CAS PubMed PubMed Central Google Scholar
Kohl, K. D. & Dearing, M. D. Experience matters: prior exposure to plant toxins enhances diversity of gut microbes in herbivores. Ecol. Lett. 15, 1008-1015 (2012).
論文 PubMed Google Scholar
Xia, X. et al. ダイヤモンドバックガの腸内細菌叢のメタゲノム解析から、草食に対するホロビオントの重要な適応が明らかになった。Front. Microbiol. 8, 663 (2017).
論文 PubMed PubMed Central Google Scholar
コナジラミは植物毒素を中和する植物解毒遺伝子をハイジャックする。Cell 184, 1693-1705.e1617 (2021).
論文 CAS PubMed Google Scholar
藻類由来の共役遺伝子が線虫をシアノ毒素から守る。Curr. 生物32, 1-8 (2022).
論文 Google Scholar
宿主植物種は、植物防御の抑制を媒介する共生細菌群集を決定する。Sci. Rep. 7, 39690 (2017).
論文 CAS PubMed PubMed Central Google Scholar
マツノザイセンチュウの微生物群のメタゲノム解析から、有害物質の分解に重要な共生関係が明らかになった。Sci. Rep. 3, 1869 (2013).
論文 PubMed PubMed Central Google Scholar
マツノザイセンチュウの腸内細菌叢は針葉樹のジテルペンを分解し、昆虫の体力を向上させる。Mol. Ecol. 26, 4099-4110 (2017).
論文 CAS PubMed Google Scholar
Hu, W. et al. カイコ裸蛹変異体における絹糸腺成長と絹糸生産の欠損を特徴づける発生学的およびトランスクリプトーム学的特徴。Insect Biochem. Insect Biochem. Biol. 111, 103175 (2019).
論文 CAS PubMed Google Scholar
Dong, H. L. et al. 新鮮な桑(Morus alba var. multicaulis)の葉または人工飼料で飼育したカイコ(Bombyx mori)の腸内細菌叢の違い。RSC Adv. 8, 26188-26200 (2018).
論文 CAS PubMed PubMed Central Google Scholar
Zhao, J. C. et al. Cudrania tricuspidata (Carr). Bur. all-age silkworm and its silk characteristics. Guangdong Canye 55, 4-6+13 (2021).
Google Scholar
Xiang, X. Q. et al. 異なる飼料で飼育したカイコの優勢腸内細菌叢組成の比較分析。Acta Ecol. Sin. 30, 3875-3882 (2010).
CAS Google Scholar
Feng, W. et al. Isolation and characterization of lipase-producing bacteria in the intestine of the silkworm, Bombyx mori, reared on different forage. J. Insect Sci. 11, 135 (2011).
論文 CAS PubMed PubMed Central Google Scholar
蚕(Bombxy mori)の成長・発育および3つの代謝酵素活性に及ぼす三葉クドラーニャの影響。Canye Kexue 35, 408-411 (2009).
Google Scholar
ニテンピラム抵抗性褐色オオヨコバイNilaparvata lugensにおけるカルボキシルエステラーゼ遺伝子。昆虫科学 28, 1049-1060 (2021).
論文 CAS PubMed Google Scholar
漢方生薬サンバイピーの成分.IV.新規フラボノイド4種の構造.4種の新規フラボノイドsanggenon H, I, J and Kの構造. Heterocycles 20, 1071-1076 (1983).
論文 CAS Google Scholar
Maximo, P. et al. Ulex airensis and Ulex europaeus ssp. europaeus 由来のフラボノイド。J. Nat. Prod. 65, 175-178 (2002).
論文 CAS PubMed Google Scholar
Erythrina poeppigianaから分離されたイソフラボンのメチシリン耐性黄色ブドウ球菌に対する抗菌作用の違い. Lett. Appl. Microbiol. 43, 243-248 (2006).
論文 CAS PubMed Google Scholar
楊 洙洙ほか. Lotus creticus 由来のフラボノイド. Phytochemlstry 28, 1749-1750 (1989).
論文 CAS Google Scholar
エジプト産ハスの根に含まれる2種類の新規イソフラボン誘導体。Nat. Prod. 20,922-926(2006)。
論文 CAS PubMed Google Scholar
(1)ハスの根から合成したルピウィテオンのパラ-クライゼン-コープ転位による合成。Tetrahedron 59, 4177-4181 (2003).
論文 CAS Google Scholar
Sekinea,T.ら. Derris scandens由来の6種類のジプレニルイソフラボン、デリシソフラボンA-F. Phytochemistry 52, 87-94 (1999).
論文 Google Scholar
ミレティア・パチカルパ(Millettia pachycarpa)由来の抗エストロゲン活性を有するイソフラボノイド。J. Nat. Prod. 69, 138-141 (2006).
論文 CAS PubMed Google Scholar
ヒト白血病HL-60細胞におけるキビタキ葉由来イソフラボノイドのアポトーシス誘導作用. Planta Med. 72, 424-429 (2006).
論文 CAS PubMed Google Scholar
Mucor hiemalisによるプレニル化フェノール化合物の効率的かつ選択的なグルコシル化. RSC Adv. 6, 20791-20799 (2016).
論文 CAS Google Scholar
Pistelli, L. et al. Genista ephedroides由来のフラボノイド。J. Nat. Prod. 61, 1404-1406 (1998).
論文 CAS PubMed Google Scholar
フラボノイドに対するYjiCを介したグリコシル化のアクセプター基質多様性の評価。Carbohydr. 393, 26-31 (2014).
論文 CAS PubMed Google Scholar
セラストロール-29-O-β-グルコシドへのBacillus糖転移酵素によるセラストロールの生体内変換。J. Biosci. Bioeng. 131, 176-182 (2021).
論文 CAS PubMed Google Scholar
バチルス・リケニフォルミスはC57BL/6Jマウスモデルにおいて大腸内細菌叢を調節することにより肥満を抑制することを明らかにした。J. Appl. Microbiol. 127, 880-888 (2019).
論文 CAS PubMed Google Scholar
Paytuvi-Gallart, A., Sanseverino, W. & Winger, A. M. プロバイオティクス菌株Bacillus subtilis DE111の毎日の摂取は、デイケアに通う子どもの健康なマイクロバイオームをサポートする。Benef. Microbes 11, 611-620 (2020).
論文 CAS PubMed Google Scholar
2種のバチルス菌の併用が高齢化した産卵鶏の成績、卵質、小腸粘膜形態、および糞便微生物叢プロファイルに及ぼす影響。Probiotics Antimicrob. Proteins 12, 204-213 (2020).
CAS Google Scholar
カイコプロバイオティクスBacillus SWL-19のスクリーニングと同定および腸内細菌叢の多様性に及ぼす影響。Sci. Agric. Sin. 48, 1845-1853 (2015).
CAS Google Scholar
Maurer, E. et al. ガレリア・メロネラ(Galleria mellonella)をモデル系として、ムコルミセスの病原性と抗真菌治療の評価を研究。Med. Mycol. 57, 351-362 (2019).
論文 CAS PubMed Google Scholar
Tao, Y., Duma, L. & Rossez, Y. Galleria mellonella as a good model to study Acinetobacter baumannii Pathogenesis. Pathogens 10, 1483 (2021).
論文 CAS PubMed PubMed Central Google Scholar
桑を食べる家畜カイコ(Bombyx mori)とその近縁種である野生カイコの腸内細菌群集と真菌群集。ISME J. 12, 2252-2262 (2018).
論文 CAS PubMed PubMed Central Google Scholar
Bacillus subtilis PB6 based probiotic supplementation plays a role in the recovery after the necrotic enteritis challenge. PLoS ONE 15, e0232781 (2020).
論文 CAS PubMed PubMed Central Google Scholar
代謝的に操作された枯草菌株によるバイオエタノール生産のための連結バイオプロセス。Sci. Rep. 11, 13731 (2021).
論文 CAS PubMed PubMed Central Google Scholar
枯草菌トランスクリプトームにおける独立制御モジュールの機械学習による発見。Nat. Commun. 11, 6338 (2020).
論文 CAS PubMed PubMed Central Google Scholar
マイクロバイオーム解析:全ゲノムショットガンと16Sアンプリコンシーケンスの利点。Biochem. 生物物理学(Biophys. Res. Commun. 469, 967-977 (2016).
論文 CAS PubMed Google Scholar
Feng, J. et al. Mucor hiemalis由来真菌糖転移酵素を触媒とするフェノール化合物の位置および立体特異的O-グリコシル化. Adv. Synth. Catal. 359, 995-1006 (2017).
論文 CAS Google Scholar
Thierbach, S. et al. 緑膿菌毒素2-ヘプチル-1-ヒドロキシキノリン-4-オンの、基質範囲の広い3種類のバチルス属糖転移酵素による効率的修飾。J. Biotechnol. 308, 74-81 (2020).
論文 CAS PubMed Google Scholar
Hyung, Ko. セレウス菌由来糖転移酵素によるフラボノイドの糖転移。FEMS Microbiol. 258, 263-268 (2006).
論文 Google Scholar
Bacillus subtilis ATCC 6633由来糖転移酵素による8-ヒドロキシジゼインの糖転移からの新規イソフラボングルコシドの生産。Catalysts 8, 387 (2018).
記事 Google Scholar
(1)枯草菌由来糖転移酵素Bs-YjiCのアグリコン多様性の利用と配糖体合成への応用. J. Biotechnol. 248, 69-76 (2017).
論文 CAS PubMed Google Scholar
戴 玲子(Dai, L.)ら:枯草菌168株由来プロミスキルス糖転移酵素を用いた新規プロトパナキサトリオール型ジンセノサイドの酵素合成.J. Agric. Food Chem. 66, 943-949 (2018).
論文 CAS PubMed Google Scholar
Parajuli, P. et al. 天然および非天然ゲニステイン配糖体の生合成. RSC Adv. 7, 16217-16231 (2017).
論文 CAS Google Scholar
Ahn,C.B.ら. Bacillus cereus由来糖転移酵素を用いたフラボンジ-O-グルコシドの生成. J. Microbiol. Biotechnol. 19, 387-390 (2009).
論文 CAS PubMed Google Scholar
セレウス菌由来糖転移酵素1におけるフラボノイド糖転移の位置選択性を制御する3つの重要なアミノ酸. Appl. Microbiol. Biotechnol. 100, 8411-8424 (2016).
論文 CAS PubMed Google Scholar
フラボノイドの酵素的O-グリコシル化における最近の進展。Appl. Microbiol. Biotechnol. 100, 4269-4281 (2016).
論文 CAS PubMed Google Scholar
グルコシル化は葉茎を食害する昆虫の植物防御活性化を妨げる。Nat. Chem. Biol. 16, 1420-1426 (2020).
論文 CAS PubMed Google Scholar
植物におけるフェニルプロパノイドの利用可能性と生物活性の主要な制御因子である。Front. Plant Sci. 7, 735 (2016).
PubMed PubMed Central Google Scholar
デオキシニバレノールのグリコシル化を介した解毒は、トリコデルマがフザリウム・グラミネアルムと対峙した際の拮抗活性に関する新たな知見を示す。Toxins 8, 335 (2016).
論文 PubMed PubMed Central Google Scholar
アルギニンのグリコシル化はメチルグリオキサールの解毒を促進する。(2021年).
論文 CAS PubMed PubMed Central Google Scholar
哺乳類における微生物間相互作用の解明とプロバイオティクスを用いた検証。Front. Microbiol. 8, 525 (2017).
論文 PubMed PubMed Central Google Scholar
Guo、M. et al. 枯草菌はウサギの免疫力と病気抵抗性を改善する。Front. Immunol. 8, 354 (2017).
論文 PubMed PubMed Central Google Scholar
Guo、M. et al. 枯草菌の食餌投与は、ニワトリの免疫応答と病気抵抗性を高める。Front. Microbiol. 11, 1768 (2020).
論文 PubMed PubMed Central Google Scholar
Ruiz Sella, S. R. B. et al. 動物栄養学における潜在的プロバイオティクスとしての枯草菌納豆。Crit. Rev. Biotechnol. 41, 355-369 (2021).
論文 PubMed Google Scholar
辻村眞理子、筑波大学大学院数理物質科学研究科准教授。細胞周期を解析した。
論文 CAS PubMed PubMed Central Google Scholar
Nugroho, A. E. & Morita, H. 天然物の円二色性計算。J. Nat. Med. 68, 1-10 (2014).
論文 CAS PubMed Google Scholar
Nesa, J. et al. Bombyx mori由来抗菌ペプチド:カイコの見事な免疫防御反応。RSC Adv. 10, 512-523 (2020).
論文 CAS PubMed PubMed Central Google Scholar
Laudadio, I. et al. ヒト腸内細菌叢研究におけるショットガンメタゲノミクスと16S rDNAアンプリコンシーケンスの定量的評価。omics 22, 248-254 (2018).
論文 CAS PubMed Google Scholar
Choi, Y. J. et al. 6,8-Diprenylorobolは細胞内活性酸素種とp53の活性化を介してヒト結腸がん細胞にアポトーシスを誘導する。Environ. Toxicol. 36, 914-925 (2021).
論文 CAS PubMed Google Scholar
クドラキサントンLはMAPKシグナルを制御し、FASを介した経路を促進することにより胃がんを抑制する。Biomed. Pharmacother. 141, 111876 (2021).
論文 CAS PubMed Google Scholar
J. Nat. Prod. 80, 3143-3150 (2017).
論文 CAS PubMed Google Scholar
参考文献のダウンロード
謝辞
本研究は、中国国家自然科学基金(第82173703号、第81874293号)、中国国家重点研究開発プログラム(第2019YFA0905700号)、山東省自然科学基金主要基礎研究プログラム(第ZR2019ZD26号)、国家微生物技術重点実験室革新研究グループ基金(第WZCX2021-03号)の支援を受けた。山東大学分析試験センターのスタッフに感謝する。
著者情報
著者および所属
中華人民共和国済南市250012山東大学薬学院教育部化学生物学重点実験室天然物化学部門
袁双芝、孫永、張文強、張家鎮、宋明輝、喬延安、張春陽、朱明珠、楼紅祥
276400 中華人民共和国臨沂市易水区臨沂大学
ジファ・サン & ジアチュン・チャオ
山東大学微生物技術国家重点実験室(中国青島市青島、266237
唐雅杰
貢献
S.Y.とH.L.が研究を計画した。S.Y.、Y.S.、J.S.、J.Z.、M.S.が実験を行った。S.Y.、H.L.、Y.S.、W.C.、J.Z.、Y.Q.、C.Z.、Y.T.、M.Z.がデータを分析し、S.Y.とH.L.が原稿を作成した。
責任著者
Hongxiang Louまで。
倫理申告
競合利益
著者らは競合する利益はないと宣言している。
査読
査読情報
Communications Biology誌は、Michael Wink氏、Magdalena Calusinska氏による本著作の査読に感謝する。プライマリーハンドリングエディター George Inglis。査読ファイルが利用可能です。
追加情報
出版社からの注記 スプリンガー・ネイチャーは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
査読ファイル
補足情報
追加補足ファイルの説明
補足データ1
報告概要
権利と許可
オープンアクセス 本論文は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合はその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
この記事の引用
Yuan, S., Sun, Y., Chang, W. et al. カイコ(Bombyx mori)の腸内細菌叢は、植物毒素のグルコシル化による代謝解毒に関与している。Commun Biol 6, 790 (2023). https://doi.org/10.1038/s42003-023-05150-0
引用文献のダウンロード
2022年12月06日受領
2023年7月17日受理
2023年7月29日発行
DOIhttps://doi.org/10.1038/s42003-023-05150-0
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有リンクを取得
コンテンツ共有イニシアティブSpringer Nature SharedItにより提供されています。
テーマ
農業
細菌の宿主応答
二次代謝
コメント
コメントを投稿することで、私たちの規約とコミュニティガイドラインに従うことに同意したことになります。誹謗中傷や規約・ガイドラインに反する投稿があった場合は、不適切な投稿としてフラグを立ててください。
コミュニケーション 生物学 (Commun Biol) ISSN 2399-3642 (オンライン)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
ナノ
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
キャリア開発
ネイチャー・キャリア
ネイチャーコンファレンス
ネイチャーイベント
地域ウェブサイト
ネイチャー アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー
クッキーの使用
プライバシーポリシー/クッキーの管理
法的通知
アクセシビリティに関する声明
利用規約
アメリカ合衆国のプライバシー権
© 2023 シュプリンガー・ネイチャー・リミテッド
この記事が気に入ったらサポートをしてみませんか?
