変化の風:喘息とマイクロバイオームの物語
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
129
総閲覧数
6
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 微生物学、2023年12月11日
第14巻-2023年|Sec.
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1295215
この論文は次の研究テーマの一部です
慢性呼吸器感染症における微生物の相互作用と生存メカニズム
全5記事を見る
変化の風:喘息とマイクロバイオームの物語
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1295215/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit

David Galeana-Cadena1 Itzel Alejandra Gómez-García1,2 Karen Gabriel Lopez-Salinas1,2 Valeria Irineo-Moreno1,2 Fabiola Jiménez-Juárez1,2 Alan Rodrigo Tapia-García1,3 Carlos Alberto Boyzoo-Cortes1 Melvin Barish Matías-Martínez1,2 Luis Jiménez-Alvarez1 Joaquín Zúñiga1,2* Angel Camarena1*1
1メキシコ国立呼吸器疾患研究所(INER)、メキシコシティ、メキシコ
2メキシコ、メキシコシティ、モンテレイ工科大学医学・健康科学部
3メキシコ国立自治大学イズタカラ高等研究院イズタカラ教育・開発・研究医学部門、メキシコ、メキシコシティ
喘息におけるマイクロバイオームの役割は、免疫応答への影響や喘息患者の変化との関連性を考慮することで強調されている。そこで、喘息の表現型に影響を及ぼす変数をマイクロバイオームの観点から検討し、喘息発症におけるマイクロバイオームの役割について考察する。喘息患者を対象としたこれまでのコホート研究では、腸内マイクロバイオームにおけるビフィドバクテリウム属、ラクトバチルス属、フェカリバクテリウム属、バクテロイデス属などの存在が、喘息に対する防御と関連していることが示されている。一方、呼吸器マイクロバイオームにおけるHaemophilus属、Streptococcus属、Staphylococcus属、Moraxella属などの他の属の存在は、喘息の発症に関与しており、微生物異常と喘息の発症との間に関連性がある可能性を示している。さらに、呼吸器感染症は上気道微生物叢の構成に影響を与え、細菌性疾患への感受性を高め、喘息の増悪を誘発する可能性があることが示されている。マイクロバイオームと喘息の相互作用を理解することで、疾患メカニズムに関する貴重な洞察を得ることができ、新たな治療アプローチの開発につながる可能性がある。
1 はじめに
喘息は、あらゆる年齢層の人が罹患する一般的な呼吸器疾患である。現在では、喘息はいくつかの表現型を持つ疾患であり、エンドタイプと呼ばれるいくつかの異なる疾患のグループとして認識されている。これまでに報告されている喘息の表現型には、アレルギー体質の若年者、過体重の中年者、不健康な加齢を伴う高齢者などがある。しかし、それらの類似性は、可逆的な気道閉塞、非特異的な気道過敏性、および慢性的な気道炎症を特徴とする共通の症候群を生じさせる(Kuruvillaら、2019;Hizawa、2023)。
喘息の根本的な病態は極めて複雑かつ多様であり、長期的な治療の必要性(Nurmagambetov et al., 2018)や生活の質の低下の可能性から、経済的な影響も大きい。臨床的には、喘息は喘鳴、咳嗽、胸部圧迫感、呼吸困難の再発を特徴とする慢性気道疾患である(GINA Report, 2022)。免疫系は喘息の病態生理において中心的な役割を果たしており、炎症反応とアレルゲンに対する感受性が関与している(Bush, 2019)。さらに最近の研究では、マイクロバイオームの微生物や代謝産物によって免疫応答が教育・修飾されることから、免疫応答の発達におけるマイクロバイオームの重要性が強調されている(Zheng et al.) 一方、呼吸器疾患は、正常な微生物組成からの逸脱と定義される微生物多様性の低下と関連しており、ディスバイオーシスと呼ばれている。ディスバイオーシスは、多くの有害な生物学的現象と関連しており、時には臨床的結果を伴うこともある(Natalini et al.) 呼吸器および腸のディスバイオーシスは、肺の炎症に影響を及ぼす免疫系の反応を変化させ、喘息の病態生理、表現型、および臨床転帰に関与する可能性がある(Ver Heulら、2019;Hufnaglら、2020)。通常、特定の発達段階における特定の解剖学的部位からの微生物叢の解析を含む、または特定の例では、小児および成人コホートのみに焦点を限定した、単一のポイントに注目することが一般的である(Zimmermannら、2019;Losolら、2021;Aldriweshら、2023)。しかし、多様な研究から得られた共通の知見を統合しようとすると、注目すべき課題が生じる。一定の共通点は確認されているものの、それぞれの意味合いは文脈の枠組みによって異なるのである(Barcikら、2020;Lupuら、2023;Zhaoら、2023)。その結果、すべてのシナリオにおいて喘息の危険因子や臨床症状に一貫して影響を与えたり軽減したりする特定の分類群を同定することは非常に困難であることが判明した。したがって、特定の分類学的グループがあらゆる状況において普遍的に同一の役割を担うという仮定を避け、その発症の背景の中でマイクロバイオームの役割を探求することの意義を主張する。このような観点から、出生前、出生時、小児期、青年期、成人期、高齢期を含む、ヒトの成長と発達を通して、喘息の表現型とエンドタイプに関連するマイクロバイオームの多様な役割を探るために、包括的なレビューを行った。
2 マイクロバイオーム
マイクロバイオームには、微生物叢、その遺伝物質、代謝産物、周囲の微小環境が含まれる(Berg et al.) それぞれの身体部位には、それぞれ異なる組成と複雑な微生物が存在する。シーケンシングデータに基づいてマイクロバイオームを評価する場合、2つの重要な用語がしばしば採用される。すなわち、特定のサンプルまたは部位における微生物の数と存在量を測定するアルファ多様性と、異なるサンプルまたは部位間の微生物のばらつきを定量化するベータ多様性である(Finotello et al.) マイクロバイオーム内では、多数の常在微生物がヒト細胞と共進化を遂げており、それぞれのコミュニティ内で生態系のバランスを維持するために不可欠な、複雑で、動的で、相互依存的で、文脈依存的な関係を生み出しており、この状態は「ユビオシス」と呼ばれている(Iebba et al.) ユビオシスと宿主マイクロバイオームの関係は、代謝、免疫、概日リズム、栄養応答、恒常性など、宿主のさまざまな機能に影響を及ぼす(Zheng et al.) その機能を達成するために、ヒトの細胞はシステム-システム軸を介した複雑なコミュニケーション機構に関与し、腸-脳軸や腸-肺軸のような異なる器官にまたがる協調的な応答を可能にしている(Suganya and Koo, 2020; Ahlawat et al.)
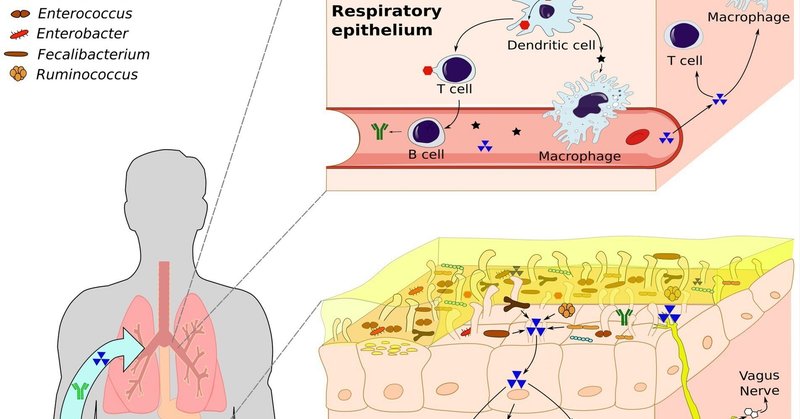
腸-肺軸は、内的要因と外的要因の伝達のための双方向経路を確立し、全身の機能と反応に影響を与えることができるシグナル伝達ネットワークを構築するため、呼吸器系の病態において重要な役割を果たす(Enaud et al.) 消化管や呼吸器を含む粘膜表面のマイクロバイオームの構成は、非常に動的である。腸内細菌叢は約3,594種からなり、主に放線菌門、バクテロイーダ門、ファーミキューテス門、プロテオバクテリア門に分類される(Leviatan et al.) これまでの考えとは異なり、シーケンシング技術の進歩により、ヒトの肺には主にプレボテラ属、ベヨネラ属、ストレプトコッカス属などで構成される独特の肺微生物叢が存在することが知られるようになった(Dicksonら、2016;Yagiら、2021;Nataliniら、2023)。ビフィズス菌、乳酸桿菌、フェーカリバクテリウム、ルミノコッカスによって産生される短鎖脂肪酸(SCFA)を含む分子シグナル(佃ら、2021)は、循環を介して、あるいは迷走神経を介して、これらの器官間のコミュニケーションを促進する。また、いくつかの菌種は、モノアミン、セロトニン、脳由来神経栄養因子などの神経調節物質や神経伝達物質としての顕著な効果を示している(Suganya and Koo, 2020)。乳酸菌は、腸-肺軸と脳-腸軸の両方に強く関与しており(Rastogi and Singh, 2022)、GABAを産生し、受容体の発現を活性化することで、迷走神経を介して認知機能の強化につながる(Breit et al.) L.ラムノサスとL.ムリヌスの経口摂取は、肺へのT制御細胞(Treg)の移動を促進し、Th2反応をブロックする(Zhangら、2018a;Hanら、2021)ことにより、呼吸器系の炎症を抑制する(図1)。Wangらはまた、L. fermentumがOVAマウスモデルにおいてToll様受容体2とToll様受容体4の発現を低下させ、炎症細胞浸潤と肺胞腫大を同時に減少させることを証明している(Wangら、2022)。腸と肺の両方におけるマイクロバイオームの組成と機能は、遺伝、免疫系、妊娠、出生時の状態、年齢、食習慣、汚染、抗生物質、ライフスタイルなど、さまざまな要因の影響を受けている(Martino et al.)
図1
www.frontiersin.org
図1. 腸-肺軸:免疫細胞、神経細胞、微生物叢、シグナル伝達分子間の相互作用を含む、消化管と呼吸器系間の双方向コミュニケーションネットワーク。この図は、肺と腸の微生物叢の構成と、この軸の中でのダイナミックな相互作用を示したもので、微生物叢に依存したコミュニケーションの役割を強調している。このコミュニケーションは、短鎖脂肪酸(SCFA)、リポ多糖(LPS)、サイトカインなどのシグナル分子を通して免疫細胞を刺激する。さらに迷走神経を通じて、マイクロバイオームは神経伝達物質の産生を刺激する。これらの分子はすべて血流に乗り、腸と肺の両方のシステムに影響を与える。inkscapeで作成。
図2
www.frontiersin.org
図2. 喘息の表現型とライフステージを通じてマイクロバイオームを決定する因子。この図は、さまざまなライフステージにおいて喘息の表現型とマイクロバイオームの構成に影響を及ぼす因子のいくつかを示している。マイクロバイオームを介した腸-肺軸コミュニケーションと喘息発症の文脈におけるそれらの役割を理解するためには、それらの複雑な相互作用の研究が必要である。BioRender.comで作成。バイオレンダー契約番号: PT264MFOUQ。
3 マイクロバイオームと喘息:始まりの重要性
個人の旅は、受精と遺伝子の組み換えという複雑なプロセスから始まり、その存在を定義するユニークな特性を発現させるための基盤を整える。しかし、個体が経験する誕生、成長、発達の条件は、個体の特徴を形成し、個体が成長する環境を作り出す上で重要な役割を果たす。
3.1 遺伝的要因
喘息は、遺伝的要因と環境的要因の相互作用の結果として生じる慢性複合疾患と考えられている。100を超える遺伝子が喘息およびこの疾患の特徴と関連しているが、独立した研究における再現性の試みには顕著なばらつきがある。ORMDL3/GSDMB遺伝子座に近い染色体17q21上の遺伝子変異は、小児期発症喘息と関連している(Ntontsiら、2021;Afzalら、2023)。Kumarらは、IL-4受容体遺伝子のバリアントrs1805011とTh1/Th2分化との関連を強調し、喘息への感受性を高めている(Kumarら、2015)。この発見は、遺伝的要因とT細胞応答との間の複雑な相互作用に光を当てた。
このような背景から、近年、腸内細菌叢の形成における宿主遺伝の役割を理解することに関心が高まっており、いくつかの研究がこの複雑な相互作用に光を当てている。Boulundらは、宿主の遺伝子型によって部分的に制御される微生物分類群における有意な対応関係を同定し、これらの分類群に関連する宿主遺伝子は、分泌-代謝、シグナル伝達-輸送、免疫に関連していることを明らかにした(Boulundら、2022年)。同様に、Lopera-Mayáらは、腸内細菌叢に対する宿主遺伝の影響を包括的に特徴付けるためにゲノムワイド関連研究を行い、Lactase遺伝子とABO遺伝子の近傍に、それぞれBifidobacterium属とCollinsella属に関連する2つの研究全体にわたる有意なシグナルを発見した(Lopera-Mayaら、2022年)。Rühlemannらは、喘息におけるPrevotella属とABO血液型との関連を報告している(Rühlemannら、2021年)。さらに、Ahluwaliaらは、フコシルトランスフェラーゼ2(FUT2)とABO遺伝子の変異が、エピスタティック効果とともに、幼児喘息のリスク上昇に寄与している可能性を提唱した(Ahluwaliaら、2020)。彼らは、呼吸器上皮におけるAB抗原の発現と肺炎球菌感染が関与している可能性を示唆している。Kurilshikovらは、ヒト宿主の遺伝的変異が微生物分類群に与える影響を調べるゲノムワイド関連研究を行った。彼らは、腸内細菌叢に影響を及ぼす31の遺伝子座を同定した。これらの遺伝子座の中で、LCT遺伝子はビフィズス菌属にとって特に重要な遺伝子座として際立っている(Kurilshikovら、2021年)。腸内細菌叢、宿主遺伝学、および喘息に関して、Liらは、2標本メンデルランダム化分析により、腸内細菌種Barnesiella属およびRuminococcaceaeUCG014属と喘息リスクとの間に正の相関関係があることを予測したと述べている。さらに、アッカーマンシアが成人発症喘息のリスクを減少させることも発見した(Liら、2023年)。Perez-Garciaらは、マイクロバイオームゲノムワイドアソシエーション(mbGWAS)とマイクロバイオーム量的形質座位(mbQTL)解析の研究を通じて、喘息の併存疾患と関連するAPOBEC3B-APOBEC3c、TRIM24、TPST2遺伝子の多型の同定を報告した。これらの多型は、上気道のレンサ球菌、タンネレラ菌、カンピロバクターに関連するmbQTLであることが判明した(Perez-Garciaら、2020年)。それにもかかわらず、Chenらによって提案されたように、17q12-21上のリスク変異と腸内細菌叢の成熟における摂動は独立して関連し、喘息発症リスクに対して相加的効果を示すことが示唆されている(Chenら、2023)。したがって、微生物の多様性と喘息における宿主遺伝の役割を明らかにするためには、さらなる研究が必要である。
3.2 出生前因子
出生前因子は、横断研究およびシステマティックレビュー(Castro-Rodriguezら、2016;Arif and Veri、2019;Esmeraldinoら、2022)によって示されているように、喘息に対する感受性の増加と関連している。これらの因子には、母親の喫煙(Moradzadehら、2018)、母親の喘息歴(García-Sernaら、2021)、妊娠中の抗生物質使用(Alhasanら、2020)、母親の食事(Grayら、2017)、母親のストレス(Van De Looら、2016;Dourosら、2017)などが含まれる。
さらに、ヒト胎児の免疫系は妊娠初期4週間で発達を開始する(Parkら、2020)。母親の微生物叢からの代謝産物への早期曝露は、出生時の機能的免疫応答の確立に寄与する(Donald and Finlay, 2023)。マウスモデルでは、胎児の発育期に抗原特異的IgGを移行させることで、アレルギー性気道炎症から子孫を保護することができる(Nakata et al.) このことから、抗体は特定の病原体から身を守るだけでなく、新生児をコロニー形成する常在細菌の耐性の確立や認識にも寄与し、二重の役割を果たしていることが示唆される(Kochら、2016;Macphersonら、2017;Mimounら、2020)。さらに、母体の微生物叢は、微生物の代謝産物の移行から生じる宿主-微生物相互作用のために新生児を準備する。妊娠中の雌マウスに大腸菌HA107を一過性にコロニー形成させることで、母親の微生物叢は子孫の免疫系を形成する。母親の微生物代謝産物は、腸管3群自然リンパ球とF4/80 + CD11cを増加させる(Gomez de Agüero et al.) 胎児のコロニー形成のための母体微生物のトランスロケーションに関して、Jimenezらは、エンテロコッカス・フェシウムの標識株を用いた実験を計画した。彼らは妊娠マウスに経口接種し、帝王切開で生まれた動物の糞便と羊水から微生物を回収することに成功した(Jiménez et al.) しかし、システマティック・レビューによれば、ヒトの糞便微生物叢は出生後に発達し始めると報告されている(Turunenら、2023年)。
一方、分娩間近に抗生物質を投与すると、新生児と母体の微生物叢の多様性に大きな影響を与えることが示されている。具体的には、抗生物質に曝露された新生児では、プロテオバクテリア門の存在量が増加することが判明している。対照的に、抗生物質に曝露されていない新生児は、連鎖球菌科や乳酸桿菌科などの門を持つ堅果門が優勢である傾向がある(Stiemsma and Michels, 2017)。
さらに、抗生物質は膣内の母親のマイクロバイオームを破壊する可能性がある。例えば、出産前の分娩期における母親への抗生物質の投与や、膜破裂(ROM)の期間は、新生児への乳酸桿菌優勢混合菌叢の伝播率の低下と有意に関連することが判明している(Keski-Nisula et al.、2013)。以上のことを考慮すると、新生児の免疫系とマイクロバイオームの発達における出生前因子を引き続き調査する必要があると考える。
3.3 周産期の要因
新生児とマイクロバイオームとの最初の相互作用、免疫系のトレーニングの開始など、誕生の過程は複雑な一連の変化を表している。当初、私たちは主に自然免疫系に依存する未熟な免疫系を持って生まれた。新生児の樹状細胞(DC)は、母親のマイクロバイオーム由来のリポ多糖(LPS)で刺激されると、成人レベルの免疫調節サイトカインIL-10を示すが、IL-12の産生が遅れるため、Tヘルパー1(Th1)細胞の分化を促進する能力は低い。その代わり、新生児の免疫系は、免疫調節とTh2細胞応答を好む傾向がある。これは、環境中の新規抗原や自身の微生物叢の常在微生物に対する過剰な炎症反応を防ぐための防御機構として機能する(Donald and Finlay, 2023)。
衛生仮説では、生後間もない時期に、母乳育児、環境、マイクロバイオームなどの外因性決定因子に曝露することで、免疫系の成熟が促進され、アレルギー疾患に対する防御的役割を果たすと提唱している。この重要な曝露期間は、周産期から学童期までである(Liu, 2007; Garn et al.) 要するに、微生物への曝露が不足すると、免疫寛容の発達が損なわれる可能性があるということである。
微生物の初期コロニー形成は、分娩様式や出生時の妊娠年齢と密接な関係がある(Castro-Rodriguez et al.) 経膣分娩で生まれた赤ちゃんは、すぐに母親の腸管内腔や膣に主に生息する微生物、例えばラクトバチルス属、バクテロイデス属、ビフィドバクテリウム属などにさらされる(Kalbermatter et al.) その結果、経膣的に生まれた新生児の腸内細菌叢は母親のそれと類似する傾向がある(Song et al.) 出生後数日以内に、Clostridiaceae(クロストリジウム科)、Enterococcaceae(腸球菌科)、Streptococcaceae(連鎖球菌科)が観察され、3日目以降に40%の乳児の腸内にBacteroides(バクテロイデス)とBifidobacterium(ビフィドバクテリウム)が出現する(Yao et al. 対照的に、上気道のコロニー形成はブドウ球菌とレンサ球菌で始まり、モラクセラ属、コリネバクテリウム属、ドロシグラヌルム属、および/またはヘモフィルス属の増殖が続く(Bosch et al.
しかし、コロニー形成のプロセスは、主に帝王切開(C-section)分娩など、いくつかの理由で中断される可能性がある。経膣分娩で生まれた赤ちゃんと比較して、帝王切開で出産した乳児は母親と共有する細菌種がおよそ30%少ない(Kalbermatterら、2021年)。上気道では、Boshらは、特に生後数カ月はコリネバクテリウムとドロシグラヌムの存在量が少ないと報告している(Boschら、2016)。腸内細菌叢では、これらの新生児は主に母親の皮膚からの微生物や、ブドウ球菌、レンサ球菌、クロストリジウムなどの病院環境からの抗生物質耐性菌を保有しており、その成熟を変化させる可能性がある(Rutayisire et al.)
実際、帝王切開、特に選択的帝王切開による微生物叢の変化は、免疫系の変化と関連し、喘息、アレルギー、I型糖尿病、セリアック病の発症リスクを高めることを示唆する証拠がある(Salas Garciaら、2018;Ferllini Montealegreら、2019;Kumbhareら、2019)。Słabuszewska-Jóźwiakらは、帝王切開分娩と子孫の喘息に関するメタアナリシス研究で、オッズ比1.23(95%CI 1.14-1.33、p<0.00001)であり、帝王切開分娩児の喘息の頻度が高いと報告している(Słabuszewska-Jóźwiakら、2020)。別のコホート研究では、喘息が部分的にコントロールされている小児の相対リスクは1.11(95%信頼区間1.00~1.25)であり、コントロールされていない小児では1.8(95%信頼区間1.00~1.39)に増加した(Mooreら、2023)。このリスクは、帝王切開に関連した微生物叢を維持している小児は、呼吸器症状のエピソード中に異なる免疫反応を示し、TNF-a、IL-4、IL-13、またはIL-1bのレベルが低くなることから説明できる。さらに、帝王切開で長期分娩された乳児はIgEレベルが高く、喘息やアレルギーを発症しやすい(Stokholm et al.)
帝王切開分娩は未熟児(妊娠37週までに生まれた乳児)に多く、喘息を含むさまざまな健康問題の発症と関連している。また、早産はバクテロイデス属、ビフィドバクテリウム属、ラクトバチルス属などの有益な細菌による腸内コロニー形成の遅れや減少につながる。これにより、クロストリジウム科などの他の細菌が腸管内腔に定着する機会が生じ、喘息やアレルギー疾患の発症に寄与する可能性がある(Zimmermann et al.) Zhangらはメタアナリシスを通じて、未熟児は正期産の乳児と比較して喘息のリスクが最大36%高いことを報告している(Zhangら、2018b)。さらに、未熟児に粉ミルクを与えると、腸内微生物の多様性が全体的に減少し、ビフィズス菌のレベルも低下する(Healyら、2022年)。4、数百万人の出生児を46歳まで追跡調査したスイスのコホート研究では、出生時の年齢が低くなるにつれて喘息の発症リスクが上昇し、その確率は満期新生児の1.5~2.5倍になると記述されている(Crumpら、2023)。さらに、早産児はしばしば肺機能の低下や肺の構造的変化を経験し、気流の問題につながる(Arroyasら、2020)。
さらに、早産児は、満期産児と対照的に、呼吸器合胞体ウイルス(RSV)に関連した入院、集中治療室への入院、機械的換気の必要性、入院期間の延長の割合が高い(Andersonら、2017年)。RSV細気管支炎に罹患した乳児221人を含む多施設前向きコホート研究において、Raitaらはいくつかの特徴的な特徴を有するエンドタイプを同定した。このエンドタイプには、親の喘息、IgE感作、ライノウイルス(HRV)の同時感染が多く含まれていた。特に、鼻咽頭における肺炎球菌とモラクセラ・カタルハリスの共優性、IFN-αおよび-γ反応の上昇も顕著な特徴であった。この特定のエンドタイプは、小児喘息の発症リスクの増加と有意に関連していた。これらの患者のうち22.2%が早産であったことは注目に値する(Raitaら、2021年)。重要なことは、HRV-Cに感染すると、HRV-AやHRV-Bに比べて喘息の増悪が重篤化することである(Bizzintino et al., 2011)。
これらの感染症は Th1 および IFN-γ 反応を低下させ、Th2 反応を亢進させ、炎症と気管支収縮を促進する (Pinto et al., 2006)。さらに、未熟児はTh17細胞からのIL-17レベルが上昇していることが多く、これが炎症をさらに悪化させ、好酸球性喘息(IL-4とIL-13)と好中球性喘息(IL-17)の両方の特徴をもたらし、複合型の喘息となる(Chesnéら、2014;Andersonら、2023)。
前述の要因の研究は進展しているが、周産期におけるマイクロバイオームの変化の影響を理解するためには、さらなる長期縦断的研究が必要である。
4 乳幼児期と小児期、インプリントの発達
小児喘息は、世界中で数百万人の小児が罹患している有病かつ複雑な呼吸器疾患であり、健康上の重大な課題と負担をもたらす。文献レビューによると、早期の微生物叢の乱れは、ヒトにおけるT-reg細胞の増殖、Th17反応、IgE反応などの免疫変化につながる可能性がある(Lee and Kim, 2017)。さらに、生後1年間の腸内・気道微生物叢は、喘息のリスクが高い乳児において寛容原性免疫を増強するT-reg細胞を誘導することが報告されている(Busse and Rosenwasser, 2003)。複数の調査により、確立した喘息患者と健常者の肺と腸のマイクロバイオームの違いが示されており、喘息患者では細菌の多様性が低いことが分かっている(Marslandら、2015;Carrら、2019;Liuら、2020)。症例対照研究では、腸内細菌異常症と特定のフェーカリバクテリウム属、ビフィドバクテリウム属、ラクノスピラ属、ヴェイヨネラ属、ロチア属の減少が関連している(Yapら、2014;Arrietaら、2015)。したがって、システマティックレビューでは、生後最初の数年間に健康な微生物叢を確立することの重要性が強調されている。特筆すべきは、母乳育児(Dohertyら、2018年)と乳酸菌の補充(Durackら、2018年;Allietら、2022年)であり、免疫の発達に長期的な可能性があり、喘息やアレルギー疾患の発症リスクを低減する。
4.1 母乳育児と食生活の変化
子どものマイクロバイオームは、最初の授乳方法と食事摂取によってより大きな影響を受けることがエビデンスによって示唆されている。ヒトの母乳には、α-トコフェロール、β-カソモルフィン、プロラクチン、ラクトフェリン、リゾチーム、抗酸化物質、サイトカイン、分泌性IgA(Miliku and Azad, 2018)などの免疫調節物質や抗炎症物質が含まれており、粘膜免疫系と全身性免疫系の両方の適切な発達を促し、粉ミルクで育てられた乳児の免疫系と比較して、より強固な免疫系の形成に重要な役割を果たしている(Munblit et al、 2017; Domenici and Vierucci, 2022)。
スタフィロコッカス、ストレプトコッカス、ラクトバチルス、ビフィドバクテリウムを含む特定の細菌属の存在は、一貫してヒト乳汁中に報告されている(Boquien, 2018; Lyons et al.) スウェーデンで行われた無作為化二重盲検試験によると、母乳中の細菌種の豊富さは、腸球菌のような喘息発症に関連する潜在的に有害な種の過剰増殖を防ぐのに重要であるようだ(Dzidic et al.) さらに、母乳中の一般的な属であるビフィズス菌は、抗炎症性サイトカインの産生を促進し、Th2免疫応答を抑制し、IgEの産生を抑制することにより、抗炎症性を示しており、母乳が喘息リスクの低減に寄与するという考え方をさらに裏付けている(Eslami et al.) 対照的に、韓国で行われたコホートでは、粉ミルク育児の乳児は腸内細菌叢の早期多様化を示しており、ビフィズス菌の減少、Escherichia、Veillonella、Enterococcusの増加を伴っている(Leeら、2015年)。直接母乳育児と比較して、その他の乳児への授乳方法(粉ミルクを含む)は、日和見病原体の発生、抗生物質耐性、喘息リスクの上昇と関連していた(Klopp et al.)
これらはすべて、母乳育児が小児の喘息に対して予防的であることを示唆しているが(Ahmadizarら、2017年)、他の研究では有意な関連はまったく認められていない(Elliottら、2009年)。これらの食い違いは、研究デザインの違いや母乳組成などの交絡変数など、いくつかの要因に起因する可能性があり、母乳育児の効果は集団によって異なる可能性があり、研究間で観察された母乳育児の効果のばらつきを説明する可能性がある(Miliku and Azad, 2018)。母乳育児と喘息との複雑な関係を、マイクロバイオームの免疫トレーニングを考慮しながら、よりよく理解するための研究努力を継続することが重要である。
腸内マイクロバイオームの発達に影響を与える乳児期の重要な出来事は、固形食の導入と母乳育児の中止である。この移行により、LachnospiraceaeとRuminococcaceaeが増加する一方で、Bifidobacterium、Enterobacteriaceae、Enterococcaceae、Lactobacillaceae、Veillonellaceae、Clostridiaceaeが減少し、微生物多様性が全体的に増加する(Laursen et al.) この移行は必要かつ有利である。エネルギーを抽出し、ミルクに頼らなくなった食事を処理するのに適した微生物群集の発達を促し、食物繊維とタンパク質が豊富な食事に移行する(Dong and Gupta, 2019)。
食事摂取は全身性炎症に影響を及ぼすことが示されている。西洋の食事は、抗酸化物質が不足し、脂肪酸が多いという特徴がある。このような食事は、喘息患者と健常対照者を比較したコホート研究によると、酸化ストレスの促進や、Toll様受容体4(TLR4)などの受容体を介した炎症カスケードの活性化と関連しており、炎症性環境へと導いている(Wood et al.) さらに、高脂肪混合食の摂取は、喘息患者の喀痰好中球を増加させ、特に食後4時間に観察されることが判明している(Woodら、2011年)。Schroederらは、欧米食を与えたマウスモデルを用いて研究を行い、その結果、ビフィズス菌、Sutturella属、Akkermansia属の個体数が減少した。同時に、Clostridiales目、Lactobacillus属とOscillospira属が増加した。注目すべきことに、ビフィドバクテリウム属の減少は、このモデルにおける粘液障害の発症と一致していた(Schroeder et al.) さらに、欧米食は内毒素血症を引き起こし、腸管バリア障害と細菌性リポ多糖(LPS)レベルの上昇をもたらし、結果として炎症シグナル伝達の亢進につながる(Pendyala et al.)
逆に、多様な果物、オリーブ油、野菜、全粒穀物を特徴とする地中海食は、抗炎症環境を作り出すと考えられている。これは、食物繊維、一価不飽和脂肪酸やオメガ3などの不飽和脂肪酸、豊富な抗酸化物質の存在に起因する。Garcia-Marcosらが行ったメタアナリシスでは、地中海食は喘息の有病率の低下と有意に関連していることが明らかになった(OR:0.86、95%CI:0.78-0.95、p=0.004)(Garcia-Marcosら、2013)。同様に、Zhangらによるメタアナリシスでは、喘息に対する地中海食の予防効果(OR = 0.88; 95% CI: 0.79-0.97; p = 0.014)が報告されている(Zhangら, 2023)。しかし、地中海食を遵守している喘息患者におけるマイクロバイオームの具体的な役割をより深く理解するためには、さらなる研究が必要である。さらに、高繊維食は大腸のバクテロイデーテス門と放線菌門の増加と関連しており、一方、ファーミキューテス門とプロテオバクテリア門は減少している。このような微生物組成のシフトは、マウスモデルで実証されたように、アレルギー反応に対する保護をもたらす(Zhang et al.) ペクチンなどの食物繊維は、常在腸内細菌によって発酵され、抗炎症反応を媒介するSCFAsなどの代謝産物を産生する(Blanco-Pérezら、2021年)。妊娠中、授乳期、幼児期のケトジェニック食は、エピジェネティックマーカーの変化による喘息発症の低リスクと関連している。例えば、ビフィズス菌や乳酸菌はSCFAを産生するが、SCFAは酪酸に関連するヒストン脱アセチル化酵素の阻害を含むエピジェネティックなメカニズムにより、免疫細胞に対して抗炎症作用を発揮する。このような免疫反応の調節により、喘息のリスクが低下する(Alsharairi, 2020)。
4.2 環境が子どもの発育と発達に及ぼす影響
幼児期に農場で生活することは、小児期に喘息を発症するリスクの低下と関連することが、数多くの疫学研究で示されている(Stein et al.) このような状況下で、ビフィズス菌や乳酸菌種はSCFAを産生し、酪酸に関連するヒストン脱アセチル化酵素の阻害を含むエピジェネティックなメカニズムにより、免疫細胞に対して抗炎症作用を発揮する。特に、遺伝的背景は似ているが農法が異なるアーミッシュとハッターの両集団を比較した研究では、動物への微生物曝露が多い伝統的な農法を行っているアーミッシュは、小児喘息のリスクが低いことがわかった。対照的に、工業化された農業を実践していたハッター人は、同じ予防効果を示さなかった(Stein et al.)
14カ国で実施された研究では、アレルギー疾患の発症に対する農場環境と都心環境の影響が比較された(Campbell et al.) その結果、農場環境にさらされることは、アレルギー疾患に対する予防効果と関連していることが明らかになった。この予防効果において他の著者が特定した重要な要因の1つは、農場牛乳の摂取であり、農場牛乳には大腸菌、シュードモナス菌、クレブシエラ菌などのグラム陰性菌や、リポ多糖類(LPS)が多く含まれていることが報告されている(Garedew et al.) LPSのような内毒素は、ほこりとの組み合わせで最もよく研究されているが、マウスにおいてTh2反応を誘導し、TLR4経路を介して肺好酸球増多を増悪させる。低用量だが継続的にエンドトキシンに曝露することで、喘息モデルマウスは保護された。このことは、小児が学齢期に達するまでに、環境内毒素への長期曝露の結果として、Th2反応の能力が著しく抑制されることを示唆している(Braun-Fahrländer et al.)
さらに、ペットや兄弟姉妹と一緒に育つと、微生物叢組成に複雑な変化が生じると考えられており、乳児の糞便微生物叢組成を比較した縦断的研究では、ペットや兄弟姉妹の両方に暴露された被験者は、ビフィズス菌科やその他の細菌の相対存在量が低い傾向があると報告されている(Azad et al.) このような腸内細菌叢の変化は、健康な免疫系の発達をもたらし、喘息やアレルギーの発症予防につながる。兄弟姉妹は、αおよびβの多様性に影響を与えるため、幼児期の微生物叢の発達において最も重要な決定要因のひとつである(Christensen et al.) しかし、子供がペット特有のアレルギー感作を持っている場合、喘息を悪化させるリスクもある(Pinot de Moira et al.) さらに、犬を飼っている家では、プレボテラ、ポルフィロモナス、モラクセラ、バクテロイデスなど、少なくとも56の細菌属が有意に多く、これらは動物の口や糞便、また飼い主からも検出された(Barberánら、2015;Hufnaglら、2020)。
衛生仮説と免疫学的効果との関係は、さまざまなメカニズムで説明できる。第一に、より多様な細菌種に曝露することで、バランスの取れた免疫応答が発達する。第二に、このような曝露が、乳児の消化管マイクロバイオームの発達の出発点となる可能性がある。第三に、食物栄養素に対する免疫寛容を促進する食事の移行。第四に、生育環境である。適切な微生物や食事への曝露の欠如は、喘息などのアレルギー疾患と関係があるかもしれない(Pendersら、2006;Fujimuraら、2010;Garnら、2021;Pfefferleら、2021)。
4.3 抗生物質:使用と乱用
今日、抗生物質は現代医学において重要な役割を果たし、限りなく多くの患者の予後を改善してきたが、抗生物質耐性やマイクロバイオームの変化など、考慮すべきいくつかの副作用があることを忘れてはならない(Ni et al.)
幼児期における抗生物質の使用は、喘息の発症リスクを2.3倍まで高めることがいくつかの研究で示されており(Kim et al. 乳児(1歳未満)では、抗生物質の使用は、処方が10%増えるごとに喘息の発生率が24%高くなることと関連している(Patrickら、2020年)。最も処方されているのはアモキシシリンなどのB-ラクタム系抗菌薬(2倍)であり、次いでマクロライド系抗菌薬、第2世代セファロスポリン系抗菌薬(2.7倍)、スルホンアミド系抗菌薬である(Marraら、2009;Liら、2023)。
697人の小児を対象としたコホートでは、生後1年間に2種類以上のB-ラクタム系抗生物質に曝露した場合、喘息リスクの上昇と鼻腔マイクロバイオームの経時的変化が関連し、最も顕著な変化はMoraxella sparsityであった(Toivonen et al., 2021)。マウスに抗生物質を投与した別の実験的研究では、プロテオバクテリア門が増加し、バクテロイデーテス門とファーミキューテス門が減少した、 Antonopoulosら, 2009)、アレルギー性喘息患者と非アレルギー性喘息患者の糞便サンプルでも、健常者と比べてこのような変化が見られた(Zhengら, 2022)。
具体的には、アモキシシリン抗生物質に関して、ヒトを対象とした臨床試験では、この抗生物質による治療を中止した後、腸内細菌叢のクロストリジウム属とファーミキューテス属の存在量が減少したことが示されている。実際、アモキシシリンを長期間使用すると、抗生物質治療終了後もSCFAs細菌種が著しく減少することが明らかになった(Dhariwalら、2023)。前述したように、SCFAは抗炎症反応を媒介し、喘息やその他のアレルギー疾患に対する保護効果を説明する(Blanco-Pérez et al.)
マウスモデルを用いた実験的研究では、抗生物質曝露後の微生物叢の乱れにより、真菌叢、特にカンジダ・アルビカンスの存在が高まることが示された。これらの真菌は、プロスタグランジン様オキシリピンタンパク質などの免疫調節機能を持つ分子を産生することが知られている(Noverrら、2004年)。さらに同じ研究で、微生物叢の破壊は芽胞とオバルブミンに対するTh2免疫反応のアップレギュレーションをもたらし、一貫したアレルギー反応を示すことが報告された(Noverr et al.、2004)。
抗生物質、マイクロバイオームの変化、喘息の発症の間の複雑な相互作用については、さらなる研究が必要である。しかし、抗生物質が細菌感染症の治療に不可欠であることは事実であり、ヒトのマイクロバイオームへの影響や、喘息やその他のアレルギー疾患の発症リスクから、特に小児においては、過剰あるいは不適切な使用には注意が必要である。
5 思春期、なぜすべてが変わるのか?
変化は人生における自然なプロセスである。思春期は小児期から成人期への重要な移行期であり、WHOによれば10~19歳である。思春期には、代謝、免疫、性、心理社会的な変化が急速に起こります。思春期の発達は、喘息を含む小児期から成人期への疾患の有病率の変化に大きく影響する。
5.1 思春期、性的二型、ホルモン
思春期には、代謝、免疫、ホルモン反応に大きな変化が生じ、成人期まで持続的な影響を及ぼす。この重要な時期には、免疫反応のパターンやホルモン調節が形成され、将来の反応の基礎が築かれる。遺伝子発現とエピジェネティック修飾の解析から、B細胞(男性ではIGKV1-27)とT細胞(女性ではTRBV30)の抗原認識タンパク質の発現における遺伝子型と思春期の相互作用が明らかになった。肺機能に関連する遺伝子はアップレギュレーションを示し、この時期に呼吸能力が向上する可能性を示唆している。しかし、女性では、思春期に関連する遺伝子発現の変化は、喘息症状と正の相関を示し、肺機能とは逆相関を示す。女性では、免疫反応が主に生得的なパターンからより適応的なパターンへと顕著に変化している(Resztakら、2023年)。
ホルモンは、特に思春期の成長と発達に関与している。性ホルモンは、多くの組織の成熟に重要な役割を果たしている。男性と女性では内分泌パターンが異なり、その結果、性的二型として知られるようになり、これは複数の病因で研究されてきた。近年、多くの研究グループが、この現象が免疫系にどのような影響を与えるか、またマイクロバイオームとの関係について研究している(Ucciferri and Dunn, 2022)。
喘息の性特異的有病率は生涯を通じて変化する。男児は女児よりも喘息の有病率が高く(CDC and Prevention. Asthma data, statistics, and Surveillance, 2020)、喘息増悪で入院する可能性が2倍高い(Kynyk et al.) このパターンは、アレルギー性炎症の増加、血清IgE値の上昇(Borish et al., 2005)、肺活量に対する気道径の減少として表現されるジサナプシス(dysanapsis)(Pagtakhan et al., 1984)という事実によって一部説明できる。
10代(11~16歳頃)では、喘息の有病率は男性では減少するが、女性では増加する(Genuneit, 2014)。また、成人女性が増悪で入院する確率は男性より3倍高く、この差は閉経後に減少することが観察されている(Troisi et al.) Fuらはこの現象を研究し、女児における症状の進行と思春期の開始を関連付けた(Fuら、2014)。思春期の男女間のホルモンの違いは、生理的側面だけでなく、生物学的因子(pH、酸素レベル、栄養)および生物学的因子(免疫監視、シグナル伝達分子)を変化させ、宿主にさらなる影響を与えるマイクロバイオームの違いを出現させる数多くのニッチを作り出す。現在までに最もよく研究されている例は腸内マイクロバイオームであり、多数の性特異的な生理学的プロセスや疾患に強く関与している(Fuseini and Newcomb, 2017)。また、多くの研究で、αの多様性は男性よりも成人女性で高く、高齢者では低い傾向があることが示されている(de la Cuesta-Zuluaga et al.) さらに、成人の腸内細菌叢に性的二型が存在することを裏付ける証拠となる研究もある(Shin et al.) マウスモデルでは、アンドロゲンが腸内細菌叢の調節とグルタミン酸/グルタミン酸比に大きな影響を与えることが観察された(Gao et al.) ヒトの二卵性双生児を対象に行われた研究では、男女の乳児双生児は腸内細菌叢のβ多様性が保存されている一方で、思春期になると男女間の分化がより明らかになることが明らかになった(Yatsunenko et al.) さらに、思春期の男女の腸内細菌叢のベータ多様性は、思春期が進むにつれて、それぞれの性別の成人微生物叢とますます類似するようになった(Yuan et al.)
自然免疫と適応免疫の両方が腸内マイクロバイオームにおける相互作用の多くを形成し、その逆もまた然りであるため、免疫系の性差による二型性は、腸内細菌叢アレルギーと自己免疫疾患との関連性を示している(Sisk-Hackworthら、2023)。現在のところ、免疫とマイクロバイオームの二型性が喘息の自然史をどのように変化させるかは不明であるが、さらなる研究によって解明されるかもしれない。
6 成人、新たな適応
成人の喘息罹患率は小児に比べて低いが、成人の喘息合併症は死亡率が高い(Dharmage et al.) 早期発症の現行喘息を有する成人は、アトピー状態になりやすく、喘息発作の発生率が高い、成人発症喘息は、主に環境リスク因子と関連するユニークな表現型を表している(Tanら、2015)。しかし、Heらは前向きコホート研究を通じて、成人発症喘息は全死因死亡率および心血管死亡率が高いことを報告している(Heら、2021年)。成人の喘息有病率を決定することは、自己申告に依存し、研究アプローチが多様であるため困難である。世界的にみると、成人の医師診断による喘息有病率は4.3%、臨床的喘息有病率は4.5%、喘鳴有病率は8.6%である(To et al.) 最近の有病率は、定義や地域によって5.4~17.9%である(Song et al.)
Wangらは、成人および小児の急性喘息と安定型喘息における炎症反応の特徴を明らかにすることを目的とした。その結果、小児および成人の安定型喘息では、paucigranulocytic炎症が最も一般的な表現型であることがわかった。しかし、急性喘息では、成人では好中球性炎症が多く、小児では好酸球性炎症が多かった(Wang et al.)
健康な成人では、肺で最も一般的な細菌門はバクテロイデーテス(Bacteroidetes)、ファーミキューテス(Firmicutes)、プロテオバクテリア(Proteobacteria)である。健康な成人の気管支肺胞洗浄(BAL)で検出される優勢属には、Prevotella、Veillonella、Pseudomonas、Fusobacteria、Streptococcusが含まれる(Wangら、2017;Leviatanら、2022)。Wangらは、英国で185人の対照者と36人の喘息成人の腸内細菌叢を比較し、Faecalibacterium prausnitzii、Sutterella wadsworthensis、Bacteroides stercorisが症例で枯渇している一方、Eggerthellaを有するClostridiumが喘息患者で過剰発現していることを明らかにした(Wangら、2018)。確立した喘息を有する成人の呼吸器マイクロバイオームに関しては、Streptococcus属、Haemophilus属、Moraxella属の存在量の増加が報告されている一方で、Th2反応の活性化を通じて、重度の気道閉塞および気道好中球増多に関連する、炎症性反応に関連するPrevotella属およびCorynebacterium属の減少が報告されている(Hufnagl et al.)
全体として、成人期に起こるマイクロバイオームの変化は、若年層と比較して、より確実に健康や疾患と関連づけることができる。特定の分類群には、健康にも病気にも関連性があることが判明しており、潜在的に有益な共生生物を保存することの重要性が示されている(Ghosh et al.、2022)。
6.1 喘息成人期における環境汚染とマイクロバイオーム
喘息は、免疫系、アレルゲン、環境トリガー、エピジェネティクスなど、いくつかの要因に影響される複雑な疾患である。この複雑な相互作用の中で、環境因子は重要な役割を果たしている。これらの要因には、汚染物質、家庭用洗剤、マイクロプラスチック、ナノ粒子、タバコの煙など、さまざまな生体分子が含まれる。
Gehringらが行った研究では、幼少期に汚染物質にさらされた人の喘息発症が顕著に増加し、成人後に長期的な影響を及ぼす可能性があるという証拠が示されている(Gehringら、2020年)。一日の大半を室内で過ごす先進工業国では、室内空気の組成は、屋外汚染物質、換気の質と量、室内アレルゲン、喫煙、暖房、調理などの活動など、さまざまな要因の影響を受ける。室内空気に存在する微生物、特にアスペルギルス、ペニシリウム、クラドスポリウムなどの特定の真菌類は、小児と成人の両方において喘息のリスク増加と関連している(Sharpe et al.)
タバコの煙にはニコチン、アルデヒド、多環芳香族化合物が含まれており、内因性抗酸化物質を減少させ、脂質過酸化を増加させ、酸化ストレスを誘発する可能性がある。さらに、これらの物質は腸内細菌異常を引き起こす可能性がある。動物モデルでは、タバコの喫煙によって、酢酸、プロピオン酸、酪酸、吉草酸などの有機酸濃度や盲腸内のビフィズス菌の個体数が有意に減少することが示されており、腸内細菌異常症の存在が示唆されている(Tomoda et al.) Pfeifferらの研究では、Prevotella属、Veillonella属、Streptococcus属、Actinomyces属が喫煙者の気道に最も多く存在することが判明した(Pfeifferら、2021年)。さらに、喫煙パターンを評価したところ、鼻腔サンプル中のコリネバクテリウムおよびドロシグラヌムの有病率と1日の最大喫煙本数との間に負の相関関係が観察された。Simpsonらは喘息患者を調査し、その喀痰微生物叢を特徴付けた。その結果、喫煙経験のない人と比較して、元喫煙者はフソバクテリア門の出現率が高く、ファーミキューテス門とバクテロイデーテス門のレベルも高かったが、プロテオバクテリア門のレベルは低かった。さらに、喫煙と細菌多様性の増加との関連も発見された(Simpson et al.) 一方、Munkらは、喫煙喘息患者のマイクロバイオームには、禁煙患者と比較して有意な変化はないと報告している(Munckら、2016年)。したがって、喘息患者における喫煙とマイクロバイオームとの関連を解明するためには、さらなる研究が必要である。
6.2 職業曝露労働者のマイクロバイオームと喘息
職業性喘息は、成人期の喘息患者の10~25%を占め、職業性肺疾患の最も一般的な形態である。職業性喘息は、その病因に基づいて、作業増悪型喘息、刺激誘発型喘息、免疫学的職業性喘息など、さまざまなタイプに分類することができる。低分子量イソシアネートは、職業性喘息の原因化合物の中でも特に多く含まれている(Kenyonら、2012;Maestrelliら、2020)。イソシアネートはまた、アトピー性皮膚炎など他の慢性炎症性疾患において見られる、皮膚に存在するロゼオモナス粘膜とブドウ球菌種の間の共生経路を破壊するため、腸内細菌異常症との関連も指摘されている(Zeldinら、2023年)。
Ahmedらによって行われた別の研究では、エジプトの主要工業都市のセラミック産業労働者を対象に、農村出身者と比較した。彼らは、工業地帯のグループにおいて、プロテオバクテリア門の相対的存在量が有意に増加していることを発見した(p = 0.02)。工業製品群では、ブドウ球菌、スフィンゴモナス、モラクセラが優勢であったことから、環境汚染が鼻のマイクロバイオームを変化させ、その群集構造を乱す可能性があるという結論に至った(Ahmed et al.) 職業曝露に起因する微生物叢の変化は、他の炎症性疾患との関連と同様に十分に文書化されているが、これらの変化と喘息の有病率との直接的な関連性を確立することは、現在のエビデンスに基づくと依然として困難である。しかし、職業曝露が私たちの生活の一部であることを考慮すると、いくつかの職業は、多様なメカニズムを通じて喘息の発症や増悪の危険因子となる可能性がある。
6.3 喘息発症に関連するウイルス感染症
呼吸器ウイルス感染は、喘息の発症に重要な役割を果たし、喘息増悪の重大な要因となっている(Hofstra et al.) ウイルス感染症のなかでもHRV感染症は、この病原体が地域社会を広く循環しているため、特によくみられる。成人では、ウイルス感染、特にHRVが喘息増悪の50~80%の原因となっており、成人症例の最大83%でHRVが検出されている(Jartti et al., 2020; Ojanguren et al., 2022)。
喘息増悪で入院した成人88人を対象とした研究では、患者の50%から呼吸器ウイルスが検出された。HRVが最も多く同定されたウイルス(77%)で、ヒトコロナウイルス(16%)、パラインフルエンザウイルス(5%)、ヒトメタニューモウイルス(2%)がこれに続いた。これらの患者のうち6人は細菌感染も併発していた(Bjerregaardら、2017年)。Voraphaniらは、活発な喫煙者で、最初の3年間に呼吸器合胞体ウイルス感染の既往がある人は、成人になってから現在喘息を有する可能性が1.7倍高いと報告している(Voraphaniら、2014)。
興味深いことに、喘息患者の喀痰中のウイルス群の研究において、Choiらはサイトメガロウイルス(CMV)とエプスタイン・バーウイルス(EBV)の増加について報告している。さらに、増悪を経験した患者ではレンサ球菌ファージの減少がみられ、これは重症化と相関していた(Choiら、2021年)。
ウイルス関連喘息の基礎にある正確なメカニズムはまだ研究中である。しかし、インターフェロン-γおよびインターロイキン-10応答の欠損は、インターロイキン-4、インターロイキン-5、インターロイキン-13などのTh2サイトカインの増加とともに、ウイルス感染症の臨床転帰不良と強く関連している(Busse et al.)
さらに、呼吸器ウイルス感染症は、上気道微生物叢の組成の変化を引き起こすことが判明している。例えばライノウイルスに感染すると、中耳炎、副鼻腔炎、肺炎などの細菌性疾患に罹患しやすくなる(Hofstra et al.) これらの感染症は、Haemophilus、Neisseria、Streptococcus、Moraxellaなどの細菌の相対的存在量の増加と関連している。これらの細菌組成の変化は、好中球性気道表現型および治療に抵抗性の持続性喘息と関連している(Ver Heul et al.)
だからこそ、環境暴露、ウイルス感染、ディスバイオーシス、喘息の間の複雑な相互作用を調査し続けることが必要なのである。この探求を通じて、喘息の増悪を促すメカニズムに関する貴重な洞察を得ることができ、予防と治療のための新たな戦略を開発できる可能性がある。
7 高齢者、すべてが変わった
加齢とは、細胞の老化や、生物の生物学的機能や代謝ストレス適応能力の漸減につながる、自然で進行性の生理的変化を指す。骨密度、虚弱、筋肉量、認知機能、心血管系の健康状態、いくつかの血液の生体指標や化学パラメータ、テロメアの長さ(López-Otín et al.、2013)、マイクロバイオーム(Partridge et al.、2018)など、ある種のバイオマーカーが加齢の判定に役立つ。このため、慢性全身性炎症、免疫老化、マイクロバイオームの変化は、喘息などの老化性疾患を理解する上で重要である。
7.1 代謝の変化と併存疾患
併存疾患は、喘息を研究する際の基本的な要素である。併存疾患はすべての年齢で起こりうるが、成人期以降はより重要になる。Yañezらは、喘息を持つ高齢者152人のうち、36%が3つ以上の併存疾患を有していることを示した(Yáñez et al.) 肥満、メタボリックシンドローム(MetS)、糖尿病は、その有病率の高さから、喘息に関連する最も一般的な代謝障害のひとつである(Park et al.) さらに、脂肪組織量は、レプチン、IL-6、TNF-aのような炎症性分子の高レベルと正の相関があり、アディポネクチンのような抗炎症マーカーとは負の相関がある。同様に、炎症を起こした脂肪組織は肺に循環するアディポカインを放出し、呼吸過敏の一因となる(Shore, 2010; Parkら, 2018; Palmaら, 2022)。
微生物叢を構成する細菌属の多様性の減少を特徴とするディスバイオーシスと肥満の間には関連性が確立されている(Kimら、2021)。Fuらによる研究では、細菌叢の豊かさは、肥満度指数および血清トリグリセリド値と負の相関を示す一方、血清高密度リポタンパク質値と正の相関を示すことが報告されている(Fuら、2015)。同様に、肥満と重度の喘息を持つ人では、Prevotellaceae、Mycoplasmataceae、Lachnospiraceae、Spirochaetaceaeに属する分類群の増加が認められたことが報告されている(Huang et al.)
腸内細菌叢の変化と喘息症状の改善との関係は、まだよくわかっていない。しかし、SCFA、特に酪酸とプロピオン酸の産生が増加することで、炎症性サイトカインが減少し、免疫調節性サイトカインが増加すると推測されている(Kimら、2021年)。とはいえ、これらの関連性は主に腸内細菌叢の文脈で述べられてきたものであり、喘息、肥満、肺微生物叢異常症の関係をさらに調査する必要性が強調されている。
7.2 最終段階における微生物継代
後期継代は、健康的な老化との直接的な関係から、研究対象として非常に重要となっている。時間の経過とともに、微生物叢のα多様性は減少し、β多様性が増加するため、高齢者は日和見菌による感染を受けやすくなる(Martinoら、2022年)。2016年、Biagiらは、高齢者の腸内細菌叢はバクテロイデス科、ラクノスピラ科、ルミノコックス科が優勢であることを示した(Biagi et al.) しかし、Prevotellaceae、Enterococcaceae、Lactobacillaceae、Turicibacteraceae、Christensenellaceae、Clostridiaceae、Enterobacteriaceae、Bifidobacteriaceae、Porphyromonadaceae、Peptostreptococcaceae、Coriobacteriaceaeなどの他の科も見られた。一般に高齢者の腸内細菌叢は、ファーミキューテス属、テネリキューテス属、放線菌属、ラクノスピラ属、プロテオバクテリア属が主であると報告されている。
しかしながら、Prevotella、Eubacterium、Bifidobacterium、Faecalibacterium、Coprococcus、Roseburiaなどの分類群は、加齢とともに減少する。対照的に、Akkermansia、Odoribacter、Butyricimonas、Butyrivibrio、Oscillospira、Christensenellaceae、Barnesiellaceaeは高齢者で存在量が増加することが分かっており、これは健康的な老化と関連している(Biagiら、2010;Claessonら、2012;Parkら、2015;Biagiら、2016;Effendiら、2022)。いくつかの微生物の漸減は、高齢者における全身性炎症と疾患発症に直接影響する。さらに、エッゲルテラ属、バクテロイデス属、デスルホビブリオ属、腸内細菌科、カンピロバクター属、連鎖球菌属、放線菌属、クロストリジウム属などの病原性微生物の増加など、いくつかの構造変化も不健康な加齢と関連している。
腸内細菌叢が最もよく研究されているとはいえ、喘息などの呼吸器疾患を研究する上では、気道内の生物も重要である。Leeらによって報告された研究では、若年成人と高齢者の気道微生物叢の構成を調べ、喘息の有無について比較した。若年成人と高齢者群では、放線菌、ファーミキューテス、プロテオバクテリア、バクテロイデーテスが優勢であったが、相対的な存在量は有意に異なっていた。さらにこの研究では、喘息のない高齢者では、喘息患者と比較してモラクセラの有病率が高いことが指摘された(Lee et al.) 最近、百寿者の腸内細菌叢は、異なる集団間の差異や類似性にもかかわらず、新たな組成変化を起こしていることが判明した。健康的な加齢に関連するAkkermansia属、Bifidobacterium属、Christensenellaceae属、およびその他の種の存在量の増加が報告されているためである(Biagiら、2016;Katoら、2017)。しかし、これらの比較的最近の知見を理解するためには、さらなる研究を行う必要がある。
7.3 免疫老化と慢性炎症
免疫老化は、自然免疫と獲得免疫の両方が経時的に影響を受け、病原体、病原生物、抗原に対する効果的な免疫応答が損なわれる多因子性の現象である(Van Den Munckhof et al.) これは3つの要因が組み合わさって生じると考えられている: 自己免疫、免疫不全、免疫調節不全である(Chotirmall and Burke, 2015)。炎症性細胞の増加は、"inflammaging "として知られる慢性的な低グレードの炎症状態を引き起こす。この炎症老化は、免疫老化、慢性疾患、マイクロバイオーム間の相乗的なプロセスであり、高齢者は潜在的に危険な細菌に対して脆弱になり、糖尿病、肥満、心臓病、喘息などの疾患のリスクを高める(Chotirmall and Burke, 2015; Huang et al.)
慢性炎症は、ある種の微生物の多さによっても媒介される。Faecalibacterium属、Roseburia属、Lachnospira属、Eubacterium属、Coprococcus属、Butyricimonas属、Butyrivibrio属などの短鎖脂肪産生属は、炎症性メディエーターをダウンレギュレートすることで免疫恒常性を維持することが研究されている(Serrano-Villarら、2017;Effendiら、2022;Singhら、2023)。残念ながら、これらの属の減少が進むとSCFAが不足し、腸粘膜の透過性が高まる。このため、酢酸生産者であるAkkermansia属などがより重要になる(Bodogaiら、2018;Wuら、2021)。上記の属とは対照的に、Limら(2021)が韓国で実施した研究で示されたように、Bacteroides属の増加は低悪性度の炎症と関連している。この研究では、C. hathewayiの増加が炎症性Th17細胞の活性化と正の相関があることも示された。同様に、いくつかのカンピロバクター株は、炎症性タンパク質を誘導するサイトリジン毒素を産生し、デスルホビブリオは酪酸を酸化する(Callahanら、2021)。
免疫系の調節を助ける微生物もいる。エンテロコッカス・フェカリスは酸化的代謝に関与する活性酸素産生種である。しかし、その漸増は炎症、アポトーシスの増加に寄与し、ミトコンドリアおよび核DNAの酸化的損傷を助長する(Hemachandra Reddy, 2011; Bullone and Lavoie, 2017)。バクテロイデス・フラジリスは、B細胞に結合してCD4+およびCD8+制御性T細胞を誘導し、それによってIL-10を分泌する多糖であるPSAを産生する(Ramakrishna et al.) また、この種がTreg細胞を刺激・分化させ、免疫調節に関与する可能性も示唆されている(Troy and Kasper, 2010; Johnson et al.) Liら(2023)の研究では、Lactobacillus fermentumやBacteroides fragilisといった種がプロバイオティクス菌株としての役割を果たすことが示された。老化マウスにこれらを併用すると、神経細胞の壊死、抗酸化能が改善し、炎症レベルが低下した(Liら、2023年)。
7.4 高齢者のマイクロバイオームと喘息
喘息は表現型の異なる疾患であり、高齢者における特性は完全には解明されていない(Liuら、2020年)。しかし、可逆的閉塞、過呼吸、慢性気道炎症がこの疾患の代表的な特徴であることは知られている。免疫系の悪化、全身性の炎症、肺機能の低下、さまざまな表現型、気道リモデリング、併存疾患、遅発性発症などが、この疾患の調査や治療を複雑にしている(Zhang and Huang, 2021)。アレルゲン、タバコ、公害、食事もこの疾患の発症に直接関与している。加齢に伴い、高齢者ではマイクロバイオームが変化し、日和見微生物が肺にコロニーを形成しやすくなっている。
Leeらによる研究では、ソウルの喘息患者と非喘息高齢者の微生物叢の組成と機能プロファイルを分析した(Leeら、2019)。バークホルデリア属とサイクロバクター属は、低い強制呼気量(FEV1)と正の相関があった。したがって、著者らは、これらの微生物の存在量の低さが喘息の特徴と関連している可能性を示唆した。また、コリネバクテリウム属は鼻副鼻腔炎など他の呼吸器疾患でも報告されていることから、コリネバクテリウム属の存在量の増加が喘息の発症に関係している可能性も示唆された。
喘息は気道に直接影響を及ぼすが、腸内細菌叢が肺機能や喘息に関連することが発見されている。Begleyらは、ミシガン州の高齢者の腸内細菌叢は確かにいくつかのPrevotella種に支配されており、それらが慢性炎症性疾患と関連していることを示した(Begleyら、2018)。黄色ブドウ球菌は、喘息を含む気道疾患の病態生理に関与する微生物叢の微生物である。Songらによる研究では、ブドウ球菌エンテロトキシンIgE(SE-IgE)が高齢者の喘息、特に遅発性喘息と有意に関連することが示された(Songら、2016年)。この種はまた、Th2極性化、炎症、コルチコステロイド耐性を誘導し、ヒトにおける制御性T細胞機能を阻害しうるブドウ球菌性エンテロトキシンB(SEB)を産生することが示されている(Haukら、2000;Cardonaら、2006)。
高齢者は、加齢や様々な疾患の影響を受け、非常に脆弱な存在である。このため、高齢者における微生物叢の研究は、病態を理解し、新しい治療法を見つけ、適切な予防文化を創造するための有用かつ基本的なツールとなっている。微生物叢と喘息などの疾患との関係に関する研究は限られているが、この関係を理解することは、他の年齢の人々にとっても有用な知見につながる可能性がある。
8 微生物多様性の構成に対する喘息治療の影響
国際喘息ガイドラインは、副腎皮質ステロイドを喘息の主要な治療薬と定めている(Reddelら、2022年)。これらの抗炎症分子は、IL-1B、IL-6、GM-CSF、ICAM-1の産生を抑制することによって気道における免疫細胞の動員を阻害し、好酸球のアポトーシスを誘導し、Tリンパ球と肥満細胞の生存率を低下させる(Barnes, 2010)。通常、吸入コルチコステロイド(ICS)は症状をコントロールし合併症を軽減するのに十分であるが、喘息増悪時にはより高用量が必要となり、時には経口コルチコステロイド(OCS)療法が必要となるが、全身作用のため副作用が増加する(Perez-Garciaら、2020)。
Zhouらは、ICS療法にもかかわらず喘息増悪のリスクに関連する鼻腔内微生物叢の変化を同定するために縦断的研究を行った(Zhouら、2019)。軽症中等症喘息の欧州の小児214人を対象に、良好にコントロールされた時点と最初の喘息コントロール喪失エピソードの間に鼻腔スワブを採取した。コリネバクテリウム属(Corynebacterium)とドロシグラヌルム属(Dolosigranulum)が優勢な鼻腔マイクロバイオームを有する患者は、ブドウ球菌属(Staphylococcus)、レンサ球菌属(Streptococcus)、モラクセラ属(Moraxella)が優勢な患者と比較して、増悪エピソードが少なく、増悪エピソード間の期間が長かった。細菌の豊富さは、良好にコントロールされている喘息と比較して、増悪時に増加した。さらに、コリネバクテリウム属の相対的存在量が高いほど、OCSの使用を必要とする喘息増悪のリスクが低いことに関連したが、モラクセラ属はOCSを必要とするリスクが高いことに関連した(Zhou et al.)
副腎皮質ステロイドの免疫調節作用は、呼吸器マイクロバイオームを変化させるかもしれない。Huangらは、ICSがマイクロバイオーム組成に及ぼす影響を評価し、喘息患者を9ヵ月にわたって調査し、投与前、3ヵ月後、治療開始9ヵ月後にサンプリングを行った。すべてのサンプルにおいて、Streptococcus属、Rothia属、Actinomyces属、Leptotrichia属、Neisseria属が優勢であった。Wallemia属、Cladosporium属、Penicillium属、Alternia属の割合がベースラインと比較して2倍以上減少し、同時にICS治療後の細菌-真菌ドメイン内およびドメイン間ネットワークの減少が認められた(Huangら、2022年)。Martinらは、低用量ICS群と高用量ICS群の喀痰マイクロバイオーム組成を比較したが、細菌負荷やコミュニティ全体に有意差はなかった(Martinら、2020)。しかし、レンサ球菌属は低用量ICS服用群で有意に高い相対的存在量を示し、パラインフルエンザ菌はフルチカゾンプロピオン酸エステル高用量服用群でブデソニド高用量服用群よりも2週間にわたって有意に高い存在量を示した。Dennerらは、気管支マイクロバイオームについて研究し、OCSの使用とバクテロイデーテス属およびフソバクテリア属の相対的存在量の減少、プロテオバクテリア属の増加との相関を示した。また、ブラシサンプルの一般化線形モデルは、OCSの使用がシュードモナス属、リケッチア属、ラクトバチルス属、ストレプトコッカス属の相対的存在量に影響し、喘息患者サンプルで有意に濃縮されることを示した(Dennerら、2016)。さらに、喘息患者のブラシサンプルにおけるα多様性は、気道閉塞の臨床的パラメータであるFEV1値の最低値と相関していた。
Golevaら、 は、コルチコステロイド治療に抵抗性を示す喘息患者は、Toll様受容体4と相互作用し、トランスフォーミング成長因子-b関連キナーゼ-1(TAK1)を活性化するヘモフィルス・パラインフルエンザ菌(Haemophilus parainfluenzae)のような気道内の特定のグラム陰性菌の拡大が原因であることを示した、 TAK1の活性化は、グルココルチコイド受容体を介するMKP-1の産生を阻害し、その結果、副腎皮質ステロイドに対する細胞応答を低下させ、感受性を低下させる(Goleva et al. , 2013).
これらの研究は、マイクロバイオームと副腎皮質ステロイドの間に複雑な相関関係があることを示しており、喘息患者のより良い、より合理的な治療のために、この現象とその意味をよりよく理解するためのさらなる研究の必要性を啓発している。
9 喘息治療の新たな視点:プロバイオティクス
適応免疫系は、感染因子に対する多彩な防御を提供するが、T細胞の自己反応性による自己免疫性炎症の可能性という課題に直面している。トレグは自己免疫の予防に重要な役割を果たしている。Tregは、致命的な自己免疫や組織病理を逆転させ、長期的な保護を提供することができる(Huら、2021年)。
プロバイオティクスには、Tヘルパー(Th)-1、Th2、Th17、Treg細胞、B細胞など、ヒトの健康や免疫関連疾患の発症に重要な役割を果たす様々な種類の免疫細胞を調節する可能性がある。プロバイオティクスの使用は、アレルギー性炎症の重症度の調節と関連している(Dargahi et al.) プロバイオティクスによって誘発される有益な効果は、粘膜レベルで株依存的に免疫反応を制御する「オン/オフ」スイッチとして作用するプロバイオティクスの能力に基づいている。アレルギー性喘息では、Th1細胞とTh2細胞のバランスを調整し、炎症反応を抑制し、腸内細菌叢を調整し、Tregの数を増加させることによって、免疫系の恒常性を守っている(Huangら、2021年)。
Wuらによって行われた研究では、ラクトバチルス・アシドフィルス、ラクトバチルス・ラムノサス、ビフィドバクテリウム・アニマリスからなるプロバイオティクス製剤が、アレルギー性喘息患者において気管支周囲の炎症を制御し、PI3K遺伝子の発現を制御する能力を示した(Wuら、2022)。Linらによって実施されたシステマティックレビューでは、プロバイオティクスの補充が喘息のエピソード数を減少させる可能性があることが明らかにされた(Linら、2018年)。しかし、日中や夜間の症状や、FEV1やPEFなどの肺機能測定値については、有意な改善は認められなかった。とはいえ、著者らは、小児喘息患者におけるプロバイオティクスの効果を十分に評価するためには、より多くのサンプルサイズを用いた、十分にデザインされたランダム化比較試験をさらに実施することの重要性を強調している。
10 結論
宿主マイクロバイオームと喘息との相互作用は、多様な状況において大きな変化を示しており、マイクロバイオームが健康であるとみなされるか疾患関連であるとみなされるかは状況によって異なる(表1)。喘息の表現型の根底にあるメカニズムを明らかにし、予防と治療のための的確な介入策を開発するためには、変数とマイクロバイオームとの間のこのような複雑な相互作用を包括的に理解することが不可欠である。
表1
www.frontiersin.org
表1. 喘息患者と健常人の微生物叢プロファイリング。
マイクロバイオームは早期の免疫発達と調節に重要な役割を果たすことが示されている。この相互作用は、遺伝的要因、出産様式(経膣分娩か帝王切開か)、最初の授乳方法(母乳か粉ミルクか)、生育環境(田舎か都会か、兄姉やペットの有無)などによって影響を受ける可能性があることに注意することが重要である。幼児期には、ビフィドバクテリウム属、ラクトバチルス属、フェーカリバクテリウム属、バクテロイデス属などの腸内細菌叢の特定の属が、喘息に対して保護的な役割を果たすことが報告されている。思春期にはマイクロバイオームに変化が起こるが、これは免疫系の成熟とこの時期のホルモンの変化に部分的に影響されている。成人期になると、マイクロバイオームが健康や疾病に及ぼす影響がより明らかになり、慢性疾患の発症に寄与して併存疾患を引き起こしたり、高齢になると喘息やその他の疾病に罹患しやすい炎症性状態を引き起こしたりする。成人では、喘息患者の腸内細菌叢にClostridium属やEggerthella属が増加していることを示す証拠がある。さらに、呼吸器系マイクロバイオームでは、ヘモフィルス属、レンサ球菌属、ブドウ球菌属、モラクセラ属などが、喘息の病因に大きく関与していることが明らかになっている。さらに、コリネバクテリウム属は、生後間もない時期から成人に至るまで、呼吸器における減少が、特定の状況における炎症性反応と関連している。しかし、このコリネバクテリウム属は、特に高齢者における喘息の発症にも関係している可能性がある。
この概念を説明するために、動植物種が生息する森林を考えてみよう。これらの生物の個体数と構成は、森林が温帯、赤道、地中海性気候のいずれにあるかによって大きく異なる。さらに、これらの生物が果たす役割は季節の変化に影響され、異なるコンテクストが形成される。この生態学的な例と同様に、マイクロバイオームがヒトの成長と発達の様々な段階に与える影響もまた、喘息との関連性を含め、ダイナミックな変化を示している。
我々のレビューにはいくつかの限界がある。多くの研究はコホートデザインに限定されており、個人の変化に関する長期的な縦断的データが欠けている。さらに、このマイクロバイオームを調査するために下気道からサンプルを採取することは依然として困難であり、情報の多くは腸内細菌叢から得られている。さらに、これらの研究のかなりの部分は16Sリボソーム遺伝子の配列決定と解析に依存しており、その範囲は細菌の側面と性別に基づく解析に限定されている。その結果、ビロームとマイコバイオームの包括的な理解がまだ必要とされている。したがって、これらの相互作用の根底にあるメカニズムを完全に解明し、世界中の多様な集団において免疫応答を調節し健康転帰を改善することができるプロバイオティクスなどの潜在的介入策を探るためには、さらなる研究と長期追跡調査が必要である。
著者貢献
DG-C: 概念化、データキュレーション、形式分析、調査、方法論、プロジェクト管理、検証、視覚化、執筆-原案、執筆-校閲・編集。IG-G: 形式分析、調査、執筆-原案、執筆-校閲・編集。KL-S: 形式分析、調査、執筆-原案、執筆-校閲・編集。VI-M: 形式分析、調査、執筆-原案、執筆-校閲・編集。FJ-J: 形式分析、調査、執筆-原案、執筆-校閲・編集。AT-G:データキュレーション、形式分析、調査、執筆-原案、執筆-校閲・編集。CB-C: 形式分析、調査、検証、執筆-原案、執筆-校閲・編集。MM-M: 形式分析、調査、可視化、執筆-原案、執筆-校閲・編集。LJ-A: 形式分析、調査、視覚化、執筆-初稿、執筆-校閲・編集。JZ: 概念化、形式分析、資金獲得、調査、プロジェクト管理、監督、可視化、執筆-原案、執筆-校閲・編集。AC: 概念化、データキュレーション、形式分析、資金獲得、調査、プロジェクト管理、リソース、監督、検証、視覚化、執筆-初稿、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または出版に関して、いかなる金銭的支援も受けていないことを宣言する。
謝辞
本論文とその背景にある研究は、UNAMとRed MEDICIプログラムの講義と支援なしには不可能であった。
利益相反
著者らは、本研究が、利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
略語
WHO, World Health Organization; IL, Interleukins; TNF, Tumor Necrosis Factor; IFN, Interferon; Tregs, T Regulatory Cells; Th, T Helper Cells; GM-CSF, Granulocyte-Macrophage Colony-Stimulating Factor; ICAM, Intercellular Adhesion Molecule; NF-kB, Nuclear Factor-kappa B; TAK1, Transforming Growth Factor Beta-Activated Kinase 1; MAPK, Mitogen-Activated Protein Kinase; SCFAs, Short-Chain Fatty Acids; FEV1, Forced Expiratory Volume in 1 s; mbGWAS, microbiome- genome wide association; mbQTL、マイクロバイオーム量的形質遺伝子座;PEF、ピーク呼気流量;C-section、帝王切開;RSV、Respiratory Syncytial Virus;HRV、Human Rhinovirus;LPS、Lipopolysaccharide;TLR、Toll-Like Receptors;GABA、Gamma-Aminobutyric Acid; OVA、オバルブミン;CDKI、サイクリン依存性キナーゼ阻害剤;SA-βgal、老化関連β-ガラクトシダーゼ;ROS、活性酸素種;MetS、メタボリックシンドローム;ICS、吸入コルチコステロイド;OCS、経口コルチコステロイド。
参考文献
Afzal,S.、Ramzan,K.、Ullah,S.、Jamal,A.、Basit,S.、AlKattan,K. M.、他(2023)。パキスタンのパシュトゥーン人集団における17q21変異体と喘息素因との関連。J. Asthma 60, 63-75. doi: 10.1080/02770903.2021.2025391.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ahlawat、S.、Asha、およびSharma、K. K. (2021). 腸-臓器軸:微生物による働きかけとネットワーキング。Lett. Appl. Microbiol. 72, 636-668.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Ahluwalia、T. S.、Eliasen、A. U.、Sevelsted、A.、Pedersen、C. T.、Stokholm、J.、Chawes、B.、他(2020年)。FUT2-ABOエピスタシスは幼児期の喘息と肺炎球菌による呼吸器疾患のリスクを増加させる」、nature. コミュニケーション 11, 1-12. doi: 10.1038/s41467-020-19814-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ahmadizar, F., Vijverberg, S. J. H., Arets, H. G. M., de Boer, A., Garssen, J., Kraneveld, A. D., et al. 母乳育児は、小児喘息の増悪リスクの低下と関連している。Pediatr. Allergy Immunol. 28, 649-654. doi: 10.1111/pai.12760
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ahmed, N., Mahmoud, N. F., Solyman, S., and Hanora, A. (2019). メタゲノミクスによって特徴付けられたヒト鼻腔マイクロバイオームは、エジプトの農村地域と工業地域との間で著しく異なる。OMICS J. Integr. Biol. 23, 573-582. doi: 10.1089/omi.2019.0144.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Aldriwesh, M. G., al-Mutairi, A. M., Alharbi, A. S., Aljohani, H. Y., Alzahrani, N. A., Ajina, R., et al. 小児喘息とマイクロバイオーム:システマティックレビュー。doi: 10.3390/microorganisms11040939.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alhasan, M. M., Cait, A. M., Heimesaat, M. M., Blaut, M., Klopfleisch, R., Wedel, A., et al. 妊娠中の抗生物質使用は、用量依存的に子孫の喘息重症度を増加させる」、allergy: European. J. Allergy Clin. Immunol. 75, 1979-1990.
クロスレフ・フルテキスト|Google Scholar
Alliet, P., Vandenplas, Y., Roggero, P., Jespers, S. N. J., Peeters, S., Stalens, J. P., et al. 2'-フコシラクトースを添加したプロバイオティクス含有乳児用調製粉乳の安全性と有効性:二重盲検ランダム化比較試験。Nutr. Doi:10.1186/s12937-022-00764-2。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alsharairi, N. A. (2020). ケトン食と乳児腸内細菌叢の相互作用における短鎖脂肪酸の役割と喘息軽減のための治療的意義。Int. J. Mol. 喘息治療における腸内細菌叢の重要性を明らかにした。
パブコメ抄録|全文|Google Scholar
Anderson, E. J., Carbonell-Estrany, X., Blanken, M., Lanari, M., Sheridan-Pereira, M., Rodgers-Gray, B., et al. 複数の呼吸器合胞体ウイルスシーズンに生まれた妊娠33~35週の乳児における重症呼吸器合胞体ウイルス疾患の負担。Pediatr. Infect. Dis. J. 36, 160-167. doi: 10.1097/INF.000000001377.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Anderson, J., do, L. A. H., Wurzel, D., and Licciardi, P. V. (2023). 早産児における喘息発症感受性の亢進を理解する」、allergy: European. J. Allergy Clin. Immunol. 78, 928-939.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Antonopoulos, D. A., Huse, S. M., Morrison, H. G., Schmidt, T. M., Sogin, M. L., and Young, V. B. (2009). 抗生物質擾乱後の消化管微生物叢の再現可能な群集動態。Infect. Immun. 77, 2367-2375.
パブコメ抄録|全文|Google Scholar
Arif, A. A., and Veri, S. D. (2019). 出生前の危険因子と小児喘息との関連。J. Asthma 56, 1056-1061.
クロスレフフルテキスト|Google Scholar
Arrieta, M. C., Stiemsma, L. T., Dimitriu, P. A., Thorson, L., Russell, S., Yurist-Doutsch, S., et al. 乳児期早期の微生物と代謝の変化は、小児喘息のリスクに影響する。Sci. Transl. Med. 7:307ra152. doi: 10.1126/scitranslmed.aab2271.
パブコメ抄録|全文|Google Scholar
Arroyas,M.、Calvo,C.、Rueda,S.、Esquivias,M.、Gonzalez-Menchen,C.、Gonzalez-Carrasco,E.、他(2020)。早産児の喘息有病率、肺機能、心血管系機能。Sci.Rep.10,19616-19610.doi:10.1038/s41598-020-76614-0。
パブコメ抄録|全文|Google Scholar
Azad, M. B., Konya, T., Maughan, H., Guttman, D. S., Field, C. J., Sears, M. R., et al. 乳児の腸内細菌叢とアレルギー疾患の衛生仮説:家庭のペットと兄弟姉妹が微生物叢の組成と多様性に及ぼす影響。Allergy Asthma Clin. Immunol. 9, 1-9. doi: 10.1186/1710-1492-9-15
パブコメ抄録|全文|Google Scholar
Barberán, A., Dunn, R. R., Reich, B. J., Pacifici, K., Laber, E. B., Menninger, H. L., et al. The ecology of microscopic life in household dust. Proc. Biol. Sci.282:20151139.doi:10.1098/rspb.2015.1139。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Barcik, W., Boutin, R. C. T., Sokolowska, M., and Finlay, B. B. (2020). 喘息の病態における肺および腸内細菌叢の役割。doi: 10.1016/j.immuni.2020.01.007.
CrossRef 全文|Google Scholar
Barnes, P. J. (2010). 吸入コルチコステロイド。医薬品 3, 514-540.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Begley, L., Madapoosi, S., Opron, K., Ndum, O., Baptist, A., Rysso, K., et al. 肺機能と成人喘息の表現型に対する腸内細菌叢の関係:パイロット研究」、BMJ open. Respir. Res. 5:e000324. doi: 10.1136/bmjresp-2018-000324.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Berg, G., et al. Microbiome definition re-visited: old concepts and new challenges. Microbiome. 2020;8(1):1-22. 定義再考:古い概念と新たな課題。マイクロバイオーム 8, 1-22.
Google Scholar
Biagi, E., Franceschi, C., Rampelli, S., Severgnini, M., Ostan, R., Turroni, S., et al. 腸内細菌叢と極端な長寿。Curr. doi: 10.1016/j.cub.2016.04.016
クロスレフ・フルテキスト|Google Scholar
Biagi, E., Nylund, L., Candela, M., Ostan, R., Bucci, L., Pini, E., et al. 加齢を経て、そしてその後も:高齢者と百寿者における腸内細菌叢と炎症状態。PLoS One 5:e10667. doi: 10.1371/journal.pone.0010667.
クロステキスト|Google Scholar
Biesbroek, G., Bosch, A. A. T. M., Wang, X., Keijser, B. J. F., Veenhoven, R. H., Sanders, E. A. M., et al. 母乳育児が乳児の上咽頭微生物群集に及ぼす影響。Am. J. Respir. Crit. Care Med. 190, 298-308. doi: 10.1164/rccm.201401-0073OC
クロスレフ・フルテキスト|Google Scholar
Bisgaard, H., Hermansen, M. N., Buchvald, F., Loland, L., Halkjaer, L. B., Bønnelykke, K., et al. 新生児における気道の細菌コロニー形成後の小児喘息。N. Engl. 357, 1487-1495.
クロスレフ・フルテキスト|Google Scholar
Bizzintino, J., Lee, W. M., Laing, I. A., Vang, F., Pappas, T., Zhang, G., et al. 小児におけるヒトライノウイルスCと急性喘息の重症度との関連。Eur. Respir. 論文概要: 小児喘息におけるヒトライノウイルスC型と急性喘息の重症度との関連, Eur. Respir.
PubMed Abstract|全文|Google Scholar
Bjerregaard, A., Laing, I. A., Poulsen, N., Backer, V., Sverrild, A., Fally, M., et al. 成人における自然発生ウイルス誘発喘息増悪の臨床的重症度と炎症表現型に関連する特徴。Respir. Med. 123, 34-41. doi: 10.1016/j.rmed.2016.12.010.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Blanco-Pérez, F., Steigerwald, H., Schülke, S., Vieths, S., Toda, M., and Scheurer, S. (2021). 食物繊維ペクチン:健康上の利点と腸内細菌叢の調節によるアレルギー治療の可能性。doi: 10.1007/s11882-021-01020-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bodogai,M.、O'Connell,J.、Kim,K.、Kim,Y.、Moritoh,K.、Chen,C.、他(2018)。Commensal bacteria contribute to insulin resistance in aging by activating innate B1a cells. Sci. Transl. Med. 10, 1-26. doi: 10.1126/scitranslmed.aat4271
パブコメ抄録|クロスリファレンス全文|Google Scholar
Boquien, C. Y. (2018). ヒトミルク:早産新生児の栄養のための理想的な食品。Front. doi: 10.3389/fped.2018.00295.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Borish, L., Chipps, B., Deniz, Y., Gujrathi, S., Zheng, B., and Dolan, C. M. (2005). 重症または治療困難な喘息患者の大規模コホートにおける血清総IgE値。Ann. Allergy Asthma Immunol. doi: 10.1016/S1081-1206(10)61221-5
クロスレフ・フルテキスト|Google Scholar
Bosch, A. T. M., Levin, E., van Houten, M. A., Hasrat, R., Kalkman, G., Biesbroek, G., et al. 乳児期の上気道微生物叢の発達は分娩様式に影響される。EBioMedicine 9, 336-345. doi: 10.1016/j.ebiom.2016.05.031
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Boulund, U., Bastos, D. M., Ferwerda, B., van den Born, B. J., Pinto-Sietsma, S. J., Galenkamp, H., et al. 腸内細菌と宿主の遺伝子型との関連は民族によって異なり、心代謝形質に影響を及ぼす可能性がある。この論文では、腸内細菌と宿主の遺伝子型との関連について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Braun-Fahrländer, C., Riedler, J., Herz, U., Eder, W., Waser, M., Grize, L., et al. エンドトキシンへの環境暴露と学童喘息との関係。N. Engl. 347:869. doi: 10.1056/NEJMoa020057
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Breit, S., Kupferberg, A., Rogler, G., and Hasler, G. (2018). 精神疾患および炎症性疾患における脳腸軸のモジュレーターとしての迷走神経。Front. Psych. 9:e0044. doi: 10.3389/fpsyt.2018.00044
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bullone, M., and Lavoie, J. P. (2017). ヒトおよびウマ喘息における酸化ストレスと炎症老化の寄与。Int. J. Mol. Doi: 10.3390/ijms18122612
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bush, A. (2019). 喘息の病態生理学的メカニズム。Front. 小児科 7, 1-17.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Busse, W., Lemanske, R., and Gern, J. (2010). 喘息および喘息増悪におけるウイルス性呼吸器感染症の役割。Lancet 376, 826-834. doi: 10.1016/S0140-6736(10)61380-3.
パブコメ抄録|全文|Google Scholar
Busse, W. W., and Rosenwasser, L. J. (2003). 喘息のメカニズム。J. Allergy Clin. Immunol. 111, S799-S804. doi: 10.1067/mai.2003.158
クロスレフ・フルテキスト|Google Scholar
Callahan, S. M., Dolislager, C. G., and Johnson, J. G. (2021). カンピロバクター感染に対する宿主細胞性免疫応答と疾患におけるその役割。Infect. Immun. 89, e0011621-e0011617.
パブコメ抄録|全文|Google Scholar
Campbell, B., Raherison, C., Lodge, C. J., Lowe, A. J., Gislason, T., Heinrich, J., et al. 農場で育ったことが成人の肺機能とアレルギー表現型に及ぼす影響:国際集団ベースの研究。doi: 10.1136/thoraxjnl-2015-208154.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cardona、I.D.、Goleva、E.、Ou、L.S.、およびLeung、D.Y.M.(2006年)。ブドウ球菌エンテロトキシンBは、単球上のグルココルチコイド誘導性TNF受容体関連タンパク質リガンドを誘導することにより、制御性T細胞を阻害する。J. Allergy Clin. Immunol. 117, 688-695. doi: 10.1016/j.jaci.2005.11.037
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Carr, T. F., Alkatib, R., and Kraft, M. (2019). 喘息のメカニズムにおけるマイクロバイオーム。Clin. Chest Med. 40, 87-96. doi: 10.1016/j.ccm.2018.10.006.
CrossRef Full Text|Google Scholar
Castro-Nallar, E., Shen, Y., Freishtat, R. J., Pérez-Losada, M., Manimaran, S., Liu, G., et al. 微生物と宿主のトランスクリプトミクスを統合し、喘息関連微生物群集の特徴を明らかにする。BMC Med. Genet. 8, 50-59. doi: 10.1186/s12920-015-0121-1
喘息に関連する微生物群集の特徴を明らかにする。
Castro-Rodriguez, J. A., Forno, E., Rodriguez-Martinez, C. E., and Celedón, J. C. (2016). 小児喘息の危険因子と防御因子:エビデンスは何か」、Journal of allergy and clinical immunology. In Pract. 4, 1111-1122. doi: 10.1016/j.jaip.2016.05.003.
PubMed Abstract | CrossRef Full Text | Google Scholar
CDCと予防。喘息のデータ、統計、サーベイランス(2020年)。https://www.cdc.gov/asthma/most_recent_national_asthma_data.htm(2023年5月アクセス)。
Google Scholar
Chen, Y. C., Chen, Y., Lasky-Su, J., Kelly, R. S., Stokholm, J., Bisgaard, H., et al. 小児喘息における早期腸内微生物の成熟異常と環境および遺伝的関連。J. Allergy Clin. Immunol. 151, 1494-1502.e14. doi: 10.1016/j.jaci.2023.01.006
PubMed Abstract|全文|Google Scholar
Chesné, J., Braza, F., Mahay, G., Brouard, S., Aronica, M., and Magnan, A. (2014). 重症喘息におけるIL-17:我々はどこに立っているのか?Am. J. Respir. Crit. Care Med. 190, 1094-1101. doi: 10.1164/rccm.201405-0859PP
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Choi, S., Sohn, K. H., Jung, J. W., Kang, M. G., Yang, M. S., Kim, S., et al. 肺ウイルソーム:喘息の重症度と増悪に関する新たな潜在的バイオマーカー。J. Allergy Clin. Immunol. 148, 1007-1015.e9. doi: 10.1016/j.jaci.2021.03.017.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chotirmall, S. H., and Burke, C. M. (2015). 加齢とマイクロバイオーム:高齢者の喘息への影響?Expert Rev. Respir. Med. 9, 125-128. doi: 10.1586/17476348.2015.1002473.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Christensen, E. D., Hjelmsø, M. H., Thorsen, J., Shah, S., Redgwell, T., Poulsen, C. E., et al. 幼少期の気道および腸内細菌叢の発達は、兄姉の年齢に影響される。微生物ゲノム10, 106-115.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Claesson, M. J., Jeffery, I. B., Conde, S., Power, S. E., O'Connor, E. M., Cusack, S., et al. 腸内細菌叢組成は、高齢者の食事や健康と相関する。Nature 488, 178-184.
クロスレフ・フルテキスト|Google Scholar
Crump, C., Sundquist, J., and Sundquist, K. (2023). 早産・早産と成人期半ばまでの喘息の長期リスク:全国コホートおよび同胞研究。胸郭78, 653-660.
パブコメ抄録|全文|Google Scholar
Dargahi, N., Johnson, J., Donkor, O., Vasiljevic, T., and Apostolopoulos, V. (2019). プロバイオティクスの免疫調節効果:アレルギーや自己免疫疾患の治療に利用できるか?Maturitas 119, 25-38. doi: 10.1016/j.maturitas.2018.11.002.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
de la Cuesta-Zuluaga, J., Kelley, S. T., Chen, Y., Escobar, J. S., Mueller, N. T., Ley, R. E., et al. ヒト成人における腸内細菌多様性の年齢および性別依存パターン。
パブコメ抄録|全文|Google Scholar
Denner, D. R., Sangwan, N., Becker, J. B., Hogarth, D. K., Oldham, J., Castillo, J., et al. Corticosteroid therapy and airflow obstruction influence the bronchial microbiome, which is distinct from bronchoalveolar lavage in asthmatic airways. J. Allergy Clin. Immunol. 137, 1398-1405.e3. doi: 10.1016/j.jaci.2015.10.017
PubMed Abstract|クロスリファレンス全文|Google Scholar
Depner, M., Taft, D. H., Kirjavainen, P. V., Kalanetra, K. M., Karvonen, A. M., Peschel, S., et al. 生後1年間の腸内細菌叢の成熟は、小児喘息に対する農場保護効果に寄与する。Nat. Med. 26, 1766-1775.
クロスレフ・フルテキスト|Google Scholar
Dhariwal, A., Haugli Bråten, L. C., Sturød, K., Salvadori, G., Bargheet, A., Åmdal, H., et al. アモキシシリン長期投与に対する反応の違い:マイクロバイオームの長期的回復力と腸内レジストームの長期的摂動。doi: 10.1080/19490976.2022.2157200.
クロスレフ・フルテキスト|Google Scholar
Dharmage, S. C., Perret, J. L., and Custovic, A. (2019). 小児および成人における喘息の疫学」、Frontiers. doi: 10.3389/fped.2019.00246.
クロス・リーフ・フルテキスト|Google Scholar
Dickson, R. P., Erb-Downward, J. R., Martinez, F. J., and Huffnagle, G. B. (2016). マイクロバイオームと呼吸器。Annu. 生理学雑誌 78, 481-504.
パブコメ抄録|全文|Google Scholar
Doherty, A. M., Lodge, C. J., Dharmage, S. C., Dai, X., Bode, L., and Lowe, A. J. (2018). ヒトミルクオリゴ糖と小児期の免疫介在性疾患および感染症との関連:系統的レビュー」、Frontiers. doi: 10.3389/fped.2018.00091.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Domenici, R., and Vierucci, F. (2022). 排他的母乳育児とビタミンD補充:小児期の感染症予防にプラスの相乗効果?Int. J. Environ. 公衆衛生 19, 1-29.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Donald, K., and Finlay, B. B. (2023). 微生物叢と免疫系との早期の相互作用:免疫系の発達とアトピー性疾患への影響。Nat. Rev. Immunol. 23, 735-748. doi: 10.1038/s41577-023-00874-w
クロスレフ・フルテキスト|Google Scholar
Dong, T. S., and Gupta, A. (2019). 初期生活、食事、環境がマイクロバイオームに及ぼす影響。Clin. Gastroenterol. Hepatol. 17, 231-242. doi: 10.1016/j.cgh.2018.08.067
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Douros, K., Moustaki, M., Tsabouri, S., Papadopoulou, A., Papadopoulos, M., and Priftis, K. N. (2017). 出生前の母親のストレスと子どもの喘息リスク。Front. doi: 10.3389/fped.2017.00202
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Durack, J., Kimes, N. E., Lin, D. L., Rauch, M., McKean, M., McCauley, K., et al. 喘息のハイリスク乳児における腸内細菌叢発達の遅延は、乳酸菌補充によって一時的に修飾可能である」、nature. Communications 9, 1-9. doi: 10.1038/s41467-018-03157-4
パブコメ要旨|全文|Google Scholar
Dzidic, M., Mira, A., Artacho, A., Abrahamsson, T. R., Jenmalm, M. C., and Collado, M. C. (2020). アレルギーの発症は、生後1ヵ月の微生物濃度が低下した母乳の摂取と関連している。Pediatr. Allergy Immunol. 31, 250-257.
クロスレフ・フルテキスト|Google Scholar
Effendi, R. M. R. A., Anshory, M., Kalim, H., Dwiyana, R. F., Suwarsa, O., Pardo, L. M., et al. 免疫関連疾患におけるAkkermansia muciniphilaとFaecalibacterium prausnitzii。微生物 10, 1-16.
パブコメ抄録|全文|Google Scholar
Elliott, L., et al. 喘鳴、アトピー、気管支過敏症に関連する母乳育児の前向き研究(Avon longitudinal study of parents and children (ALSPAC))。doi:10.1016/j.jaci.2008.04.001.Prospective。
CrossRef 全文|Google Scholar
Enaud, R., Prevel, R., Ciarlo, E., Beaufils, F., Wieërs, G., Guery, B., et al. 健康および呼吸器疾患における腸-肺軸:臓器間および領域間クロストークの場。Front. Cell. Infect. Microbiol. 10, 1-11. doi: 10.3389/fcimb.2020.00009
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
エスラミ(Eslami, M)、バハール(Bahar, A)、ケイカ(Keikha, M)、カルバラエイ(Karbalaei, M)、コビリアック(Kobyliak, N. M)、ユセフィ(Yousefi, B)(2020)。アレルギー疾患におけるプロバイオティクスの機能と免疫系の調節。Allergol. Immunopathol. 48, 771-788. doi: 10.1016/j.aller.2020.04.005
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Esmeraldino, L., Traebert, E., Nunes, R. D., and Traebert, J. (2022). 出生前および新生児期の要因と6歳児における喘息症状の発生との関連。Ciencia e Saude Coletiva 27, 545-554. doi: 10.1590/1413-81232022272.44892020
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fazlollahi, M., Lee, T. D., Andrade, J., Oguntuyo, K., Chun, Y., Grishina, G., et al. 喘息における鼻腔マイクロバイオーム。J. Allergy Clin. Immunol. 142, 834-843.e2. doi: 10.1016/j.jaci.2018.02.020
PubMedアブストラクト|クロス全文|Google Scholar
Ferllini Montealegre, S. M., Miranda Muñoz, M. F., and Vindas Vargas, J. F. (2019). Revista Medica Sinergia 4, e266. doi: 10.31434/rms.v4i9.266、
CrossRef フルテキスト|Google Scholar
Finotello, F., Mastrorilli, E., and Di Camillo, B. (2018). 標的次世代シーケンサーを用いたヒト微生物叢の多様性の測定。Brief. Bioinform. 19, bbw119-bbw692. doi: 10.1093/bib/bbw119
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fu, J., Bonder, M. J., Cenit, M. C., Tigchelaar, E. F., Maatman, A., Dekens, J. A. M., et al. 腸内マイクロバイオームは、血中脂質の変動のかなりの割合に寄与している。Circ. doi: 10.1161/CIRCRESAHA.115.306807.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Fu, L., Freishtat, R. J., Gordish-Dressman, H., Teach, S. J., Resca, L., Hoffman, E. P., et al. 小児喘息症状の自然経過と性および思春期の強い影響。Ann. Am. Thorac. doi: 10.1513/AnnalsATS.201402-084OC
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
藤村恵理子、Johnson, C. C., Ownby, D. R., Cox, M. J., Brodie, E. L., Havstad, S. L., et al. 人間の親友?ペットの飼育がハウスダスト微生物群集に及ぼす影響。J. Allergy Clin. Immunol. doi: 10.1016/j.jaci.2010.05.042.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fuseini, H., and Newcomb, D. C. (2017). 喘息における性差を駆動するメカニズム。doi: 10.1007/s11882-017-0686-1.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gao, A., Su, J., Liu, R., Zhao, S., Li, W., Xu, X., et al. グルコース代謝における性的二型性は、アンドロゲン主導型の腸内細菌叢によって形成される」、nature. Doi:10.1038/s41467-021-27187-7。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ガルシア-マルコス、L.、カストロ-ロドリゲス、J.A.、ワインマイヤー、G.、パナギオタコス、D.B.、Priftis、K.N.、およびNagel、G.(2013)。小児の喘息に対する地中海食の影響:系統的レビューとメタアナリシス。Pediatr. アレルギー免疫学。24, 330-338.
PubMed Abstract|クロスリファレンス全文|Google Scholar
García-Serna, A. M., Martín-Orozco, E., Hernández-Caselles, T., and Morales, E. (2021). 新生児免疫系を形成する出生前および周産期の環境影響:喘息およびアレルギーの起源に焦点を当てて。Int. J. Environ. 公衆衛生 18, 1-24. doi: 10.3390/ijerph18083962
パブコメ要旨|全文|Google Scholar
Garedew, L., Berhanu, A., Mengesha, D., and Tsegay, G. (2012). エチオピアのゴンダール町とその近郊で消費される生乳と低温殺菌牛乳の重要管理点からグラム陰性菌を同定。BMC公衆衛生12:1.
パブコメ抄録|クロスリード全文|Google Scholar
Garn、H., Potaczek, D. P., and Pfefferle, P. I. (2021). 衛生仮説と新たな展望-古い定説を満たす現在の課題。Front. Immunol. 12, 1-7. doi: 10.3389/fimmu.2021.637087.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gehring, U., Wijga, A. H., Koppelman, G. H., Vonk, J. M., Smit, H. A., and Brunekreef, B. (2020). 出生から青年期までの大気汚染と喘息の発症。Eur. Respir. 56:2000147. doi: 10.1183/13993003.00147-2020.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Genuneit, J. (2014). 喘息の性特異的発症は農家と非農家の子供で異なる:コホート研究。Am. J. Respir. Crit. Care Med. 5, 588-590. doi: 10.1164/rccm.201403-0428LE
クロスレフ・フルテキスト|Google Scholar
Ghosh, T. S., Shanahan, F., and O'Toole, P. W. (2022). Toward an improved definition of a healthy microbiome for healthy aging. Nat. 加齢 2, 1054-1069.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Goleva, E., Jackson, L. P., Harris, J. K., Robertson, C. E., Sutherland, E. R., Hall, C. F., et al. 喘息におけるコルチコステロイド反応性に対する気道マイクロバイオームの影響。Am. J. Respir. Crit. Care Med. 188, 1193-1201. doi: 10.1164/rccm.201304-0775OC
クロスレフフルテキスト|Google Scholar
Gomez de Agüero, M., Ganal-Vonarburg, S. C., Fuhrer, T., Rupp, S., Uchimura, Y., Li, H., et al. 母親の微生物叢は生後早期の自然免疫発達を駆動する。科学 351, 1296-1302.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gray, L. E. K., O'Hely, M., Ranganathan, S., Sly, P. D., and Vuillermin, P. (2017). 妊娠中の母親の食事、腸内細菌、および細菌代謝産物は、子孫の喘息に影響を与える。Front. Immunol. 8, 1-13. doi: 10.3389/fimmu.2017.00365
CrossRef フルテキスト|Google Scholar
Ham, J., Kim, J., Choi, S., Park, J., Baek, M. G., Kim, Y. C., et al. 気道におけるncr+ilc3sとマイクロバイオームとの相互作用が喘息の重症度を形成する。doi: 10.4110/in.2021.21.e25.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Han、W., Tang, C., Baba, S., Hamada, T., Shimazu, T., and Iwakura, Y. (2021). Dectin-1欠損マウスでは、腸内常在細菌の改変により肺制御性T細胞が増殖し、オバルブミン誘発気道炎症が改善する。J. Immunol. 206, 1991-2000.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hauk, P. J., Hamid, Q. A., Chrousos, G. P., and Leung, D. Y. M. (2000). 微生物超抗原によるヒトPBMCSにおけるコルチコステロイド不感症の誘発。J. Allergy Clin. Immunol. 105, 782-787. doi: 10.1067/mai.2000.105807.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
He,X.、Cheng,G. S.、He,L.、Liao,B.、Du,Y. J.、Xie,X.、他(2021年)。現在喘息であるが、かつては喘息ではなかった成人では、全死因死亡率および心血管死亡率が高い:集団ベースの前向きコホート研究。論文誌11:1329.doi: 10.1038/s41598-020-79264-4
パブコメ抄録|全文|Google Scholar
Healy, D. B., Ryan, C. A., Ross, R. P., Stanton, C., and Dempsey, E. M. (2022). 早産児の腸内細菌叢発達の臨床的意味。Nat. Microbiol. 7, 22-33. doi: 10.1038/s41564-021-01025-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hemachandra Reddy, P. (2011). 喘息におけるミトコンドリア機能障害と酸化ストレス:ミトコンドリアを標的とした抗酸化治療薬への示唆。医薬品 4, 429-456.
パブコメ要旨|全文|Google Scholar
Hilty, M., Burke, C., Pedro, H., Cardenas, P., Bush, A., Bossley, C., et al. 喘息性気道における微生物群集の乱れ。PLoS One 5:e8578. doi: 10.1371/journal.pone.0008578.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
樋沢直樹(2023)。プレシジョン・メディシンの時代における喘息病態の解明. Allergol. 論文概要|樋沢直樹(2023):プレシジョン・メディシンの時代における喘息病態の理解.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hofstra, J. J., Matamoros, S., van de Pol, M. A., de Wever, B., Tanck, M. W., Wendt-Knol, H., et al. 実験的ヒトライノウイルス感染時の微生物叢の変化。BMC Infect. Dis. 15, 336-339. doi: 10.1186/s12879-015-1081-y
パブコメ抄録|全文|Google Scholar
House, J. S., Wyss, A. B., Hoppin, J. A., Richards, M., Long, S., Umbach, D. M., et al. 農業肺健康調査における早期の農場暴露と成人喘息およびアトピー。J. Allergy Clin. Immunol. 140, 249-256.e14. doi: 10.1016/j.jaci.2016.09.036
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hu, W., Wang, Z. M., Feng, Y., Schizas, M., Hoyos, B. E., van der Veeken, J., et al. 制御性T細胞は、確立された全身性炎症で機能し、致命的な自己免疫を逆転させる。Nat. Immunol. 22, 1163-1174.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, Y. J., Nariya, S., Harris, J. M., Lynch, S. V., Choy, D. F., Arron, J. R., et al. 重症喘息患者における気道マイクロバイオーム:疾患の特徴および重症度との関連。J. Allergy Clin. Immunol. 136, 874-884. doi: 10.1016/j.jaci.2015.05.044
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, C., Ni, Y., du, W., and Shi, G. (2022). 吸入コルチコステロイドが喘息のマイクロバイオームと微生物相関に及ぼす9ヵ月間の影響。Clin. Doi:10.1111/cts.13288。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., et al. 中国武漢市における2019年新型コロナウイルス感染患者の臨床的特徴。doi: 10.1016/S0140-6736(20)30183-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, J., Yang, Z., Li, Y., Chai, X., Liang, Y., Lin, B., et al. ラクトバチルス・パラカゼイR3は、Th17/Treg細胞バランスの制御を介して、マウスのデキストラン硫酸ナトリウム(DSS)誘発性大腸炎から保護する。J. Transl. Med. 19, 1-13. doi: 10.1186/s12967-021-02943-x
PubMedアブストラクト|全文|Google Scholar
Hufnagl, K., Pali-Schöll, I., Roth-Walter, F., and Jensen-Jarolim, E. (2020). 腸と肺のマイクロバイオームのディスバイオーシスは喘息に関与する。Semin. Immunopathol. 42, 75-93. doi: 10.1007/s00281-019-00775-y
PubMedアブストラクト|全文|Google Scholar
Iebba, V., Totino, V., Gagliardi, A., Santangelo, F., Cacciotti, F., Trancassini, M., et al. エビオーシスとディスバイオシス:微生物叢の2つの側面。New Microbiol. 39, 1-12.
PubMedアブストラクト|Google Scholar
Jartti, T., Bønnelykke, K., Elenius, V., and Feleszko, W. (2020). 喘息におけるウイルスの役割。Semin. Immunopathol. 42, 61-74. doi: 10.1007/s00281-020-00781-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jiménez, E., Marín, M. L., Martín, R., Odriozola, J. M., Olivares, M., Xaus, J., et al. 健康な新生児の糞便は実は無菌なのか?Res. Microbiol. doi: 10.1016/j.resmic.2007.12.007.
PubMed Abstract|全文|Google Scholar
Johnson, J. L., Jones, M. B., and Cobb, B. A. (2015). バクテロイデス・フラジリスのカプセル由来の多糖類aは、クローン性CD4+ T細胞の増殖を誘導する。J. Biol. Chem. 290, 5007-5014. doi: 10.1074/jbc.M114.621771.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Kalbermatter, C., Fernandez Trigo, N., Christensen, S., and Ganal-Vonarburg, S. C. (2021). 母親の微生物叢、生後早期のコロニー形成、母乳が新生児の免疫発達を促進する。Front. Immunol. 12, 1-22. doi: 10.3389/fimmu.2021.683022
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
加藤和彦、小田巻俊夫、光山英樹、菅原秀樹、蕭洙、大澤玲子(2017)。加齢に伴う腸内ビフィズス菌種組成の変化. Curr. Microbiol. 74, 987-995. doi: 10.1007/s00284-017-1272-4
クロスレフ・フルテキスト|Google Scholar
Kenyon, N. J., Morrissey, B. M., Schivo, M., and Albertson, T. E. (2012). 職業性喘息。Clin. Rev. Allergy Immunol. 43, 3-13. doi: 10.1007/s12016-011-8272-0
クロスレフ・フルテキスト|Google Scholar
Keski-Nisula, L., Kyynäräinen, H. R., Kärkkäinen, U., Karhukorpi, J., Heinonen, S., and Pekkanen, J. (2013). 出産時の母親の分娩内抗生物質と新生児への乳酸菌の垂直伝播の減少 Acta Paediatrica. Int. J. Paediatr.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kim, D. H., Han, K., and Kim, S. W. (2018). 小児および青年期における喘息およびその他のアレルギー疾患の発症に対する抗生物質の影響。Allergy Asthma Immunol. Res. 10, 457-465. doi: 10.4168/aair.2018.10.5.457.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kim, Y., Womble, J. T., Gunsch, C. K., and Ingram, J. L. (2021). 肥満、喘息、肥満手術における腸・肺マイクロバイオーム軸:文献レビュー。Yeon. 肥満 29, 636-644.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Klopp, A., Vehling, L., Becker, A. B., Subbarao, P., Mandhane, P. J., Turvey, S. E., et al. 乳児期の哺乳様式と小児喘息リスク:前向き出生コホート研究。J. Pediatr. 190:e2, 192-199.e2. doi: 10.1016/j.jpeds.2017.07.012.29144244
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Koch, M. A., Reiner, G. L., Lugo, K. A., Kreuk, L. S. M., Stanbery, A. G., Ansaldo, E., et al. 母親のIgGおよびIgA抗体は、生後早期の粘膜Tヘルパー細胞応答を減衰させる。Cells 165, 827-841. doi: 10.1016/j.cell.2016.04.055
クロスレフ・フルテキスト|Google Scholar
Kumar, A., das, S., Agrawal, A., Mukhopadhyay, I., and Ghosh, B. (2015). 主要なTh1/Th2経路候補遺伝子、IRF2、IL6、IFNGR2、STAT4、IL4RAとインド集団におけるアトピー性喘息との遺伝的関連。J. Hum. Genet. 60, 443-448. doi: 10.1038/jhg.2015.45
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kumbhare, S. V., Patangia, D. V., Patil, R. H., Shouche, Y. S., and Patil, N. P. (2019). 小児の腸内細菌叢に影響を及ぼす因子:乳児期から小児期まで。J. Biosci. 44, 1-19. doi: 10.1007/s12038-019-9860-z
クロスレフ・フルテキスト|Google Scholar
Kurilshikov、A.、Medina-Gomez、C.、Bacigalupe、R.、Radjabzadeh、D.、Wang、J.、Demirkan、A.、他(2021)。大規模関連解析により、ヒト腸内細菌叢の構成に影響を及ぼす宿主因子が同定された。Nat. Genet. 53, 156-165. doi: 10.1038/s41588-020-00763-1
ヒトの腸内細菌叢の構成に影響を与える宿主の因子。
Kuruvilla, M. E., Lee, F. E. H., and Lee, G. B. (2019). 喘息の表現型、エンドタイプ、および疾患のメカニズムを理解する。Clin. Rev. Allergy Immunol. 56, 219-233. doi: 10.1007/s12016-018-8712-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kynyk, J. A., Mastronarde, J. G., and McCallister, J. W. (2011). 喘息、性差。Curr. Opin. Pulm. Med. 17, 6-11. doi: 10.1097/MCP.0b013e3283410038
クロスレフ・フルテキスト|Google Scholar
Laursen, M. F., Bahl, M. I., Michaelsen, K. F., and Licht, T. R. (2017). ファーストフードと腸内微生物。Front. Microbiol. 8, 1-8. doi: 10.3389/fmicb.2017.00356
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, N., and Kim, W. U. (2017). T細胞の恒常性と炎症性疾患における微生物叢。Exp. Mol. Med. 49:e340. doi: 10.1038/emm.2017.36
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, J. J., Kim, S. H., Lee, M. J., Kim, B. K., Song, W. J., Park, H. W., et al. 若年成人および高齢者における喘息と関連する異なる上気道マイクロバイオームとその機能遺伝子」、allergy: European. J. Allergy Clin. Immunol. 74, 709-719. doi: 10.1111/all.13608
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, S. A., Lim, J. Y., Kim, B. S., Cho, S. J., Kim, N. Y., Kim, O. B., et al. パイロシークエンシングを用いた母乳栄養と粉ミルク栄養の韓国人乳児の腸内細菌叢プロファイルの比較。Nutr. Res. Pract. 9, 242-248. doi: 10.4162/nrp.2015.9.3.242
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Leviatan, S., Shoer, S., Rothschild, D., Gorodetski, M., and Segal, E. (2022). ヒト腸内細菌叢の拡大参照マップにより、これまで知られていなかった数百種が明らかになった。Nat. Commun. 13, 3863-3814. doi: 10.1038/s41467-022-31502-1
パブコメ抄録|全文|Google Scholar
Li,R.、Guo,Q.、Zhao,J.、Kang,W.、Lu,R.、Long,Z.、他(2023)。腸内細菌叢と喘息の因果関係の評価:2標本メンデルランダム化解析による証拠。Front. Immunol. 14:684. doi: 10.3389/fimmu.2023.1148684.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li,R.、Zheng,W. X.、Zhang,Q. R.、Song,Y.、Liao,Y. T.、Shi,F. C.、他(2023)。長寿に関連するコア腸内細菌叢の採掘と老化マウスに対する仲介プロバイオティクスの組み合わせの効果:中国広西チワン族自治区の長寿集団のケーススタディ。栄養15、1-22。
パブコメ要旨|全文|Google Scholar
Lim, M. Y., Hong, S., Kim, J. H., and Nam, Y. D. (2021). 韓国の高齢者集団における腸内細菌叢と虚弱との関連。J. Gerontol. Ser. A Biol. Sci. Med. 論文概要抄録集:「高齢者における腸内細菌叢と虚弱との関連性」『日本老年医学会雑誌』(日本老年医学会、1991年)。
パブコメ抄録|全文|Google Scholar
Lin, Y. C., Chen, Y. C., Kuo, C. H., Chang, Y. H., Huang, H. Y., Yeh, W. J., et al. アレルギー性鼻炎児における抗生物質曝露と喘息発症。J. Microbiol. Immunol. Infect. 53, 803-811. doi: 10.1016/j.jmii.2019.02.003.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lin, J., Zhang, Y., He, C., and Dai, J. (2018). 小児喘息におけるプロバイオティクスの補充:系統的レビューとメタアナリシス。J. Paediatr. doi: 10.1111/jpc.14126.
クロスレフ・フルテキスト|Google Scholar
Liu, A. H. (2007). 衛生理論とアレルギー・喘息予防。Paediatr. Perinat. Epidemiol. 21, 2-7. doi: 10.1111/j.1365-3016.2007.00878.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu, Q. H., Kan, X., Wang, Y. B., Liu, K. X., and Zeng, D. (2020). 高齢者における早期発症喘息と後期発症喘息の臨床的特徴の違い。Biomed. 2020,1-7.doi:10.1155/2020/2940296。
パブコメ抄録|全文|Google Scholar
Liu,C.、Makrinioti,H.、Saglani,S.、Bowman,M.、Lin,L.L.、Camargo,C.A.、他(2022)。微生物異常と小児喘息発症: 気道および腸内細菌叢、環境曝露、宿主の代謝および免疫応答の統合的役割。Front. Immunol. 12, 1-9. doi: 10.3389/fimmu.2022.1028209
クロスレフ・フルテキスト|Google Scholar
Lopera-Maya, E. A., Kurilshikov, A., van der Graaf, A., Hu, S., Andreu-Sánchez, S., Chen, L., et al. オランダ・マイクロバイオーム・プロジェクト参加者7,738人における腸内マイクロバイオームに対する宿主遺伝の影響。Nat. Genet. 54, 143-151. doi: 10.1038/s41588-021-00992-y
クロスレフ・フルテキスト|Google Scholar
López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., and Kroemer, G. (2013). 老化の特徴 欧州PMC資金提供者グループ。細胞 153, 1194-1217.
パブメッドアブストラクト|クロスリファレンス全文|Google Scholar
Losol, P., Choi, J. P., Kim, S. H., and Chang, Y. S. (2021). 成人喘息の発症における上気道マイクロバイオームの役割。doi: 10.4110/in.2021.21.e19.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lu, Y., Wang, Y., Wang, J., Lowe, A. J., Grzeskowiak, L. E., and Hu, Y. J. (2023). 早期の抗生物質曝露と小児喘息の軌跡:全国人口ベースの出生コホート。doi: 10.3390/antibiotics12020314
パブコメ要旨|全文|Google Scholar
Lupu, A., Jechel, E., Mihai, C. M., Mitrofan, E. C., Fotea, S., Starcea, I. M., et al. 小児喘息におけるマイクロバイオームの足跡-バランスのとれた発達のための複雑なパズル。doi: 10.3390/nu15143278.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lyons, K. E., Ryan, C. A., Dempsey, E. M., Ross, R. P., and Stanton, C. (2020). 母乳は、有益な微生物の供給源であり、乳児の健康にとって有益である。栄養12, 1-30. doi: 10.3390/nu12041039
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Macpherson, A. J., De Agüero, M. G., and Ganal-Vonarburg, S. C. (2017). How nutrition and the maternal microbiota shape the neonatal immune system. Nat. Rev. Immunol. 17, 508-517. doi: 10.1038/nri.2017.58
クロスレフ・フルテキスト|Google Scholar
Maestrelli, P., Henneberger, P. K., Tarlo, S., Mason, P., and Boschetto, P. (2020). 仕事関連喘息の原因と表現型。Int. J. Environ. doi: 10.3390/ijerph17134713.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Marra, F., Marra, C. A., Richardson, K., Lynd, L. D., Kozyrskyj, A., Patrick, D. M., et al. 小児における抗生物質の使用は、喘息のリスク増加と関連している。小児科 123, 1003-1010.
CrossRef 全文|Google Scholar
Marsland, B. J., Trompette, A., and Gollwitzer, E. S. (2015). 呼吸器疾患における腸-肺軸。Ann. Am. Thorac. Soc. 12, S150-S156. doi: 10.1513/AnnalsATS.201503-133AW
クロスレフ・フルテキスト|Google Scholar
Martin, M. J., Zain, N. M. M., Hearson, G., Rivett, D. W., Koller, G., Wooldridge, D. J., et al. 高用量および低用量の吸入コルチコステロイドによる治療を受けた喘息患者の気道マイクロバイオーム。PLoS One 15, e0244681-e0244614. doi: 10.1371/journal.pone.0244681.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Martino,C.、Dilmore,A.H.、Burcham,Z.M.、Metcalf,J.L.、Jeste,D.、Knight,R.(2022)。ゆりかごから墓場まで、生涯にわたる微生物叢の継承。Nat. Rev. Microbiol. 20, 707-720. doi: 10.1038/s41579-022-00768-z
CrossRef 全文|Google Scholar
Miliku, K., and Azad, M. B. (2018). 母乳育児と喘息の発達起源:現在の証拠、可能性のあるメカニズム、および今後の研究の優先事項。doi: 10.3390/nu10080995.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Mimoun, A., Delignat, S., Peyron, I., Daventure, V., Lecerf, M., Dimitrov, J. D., et al. 抗原特異的免疫寛容の誘導におけるマテルノ-胎児インターフェイスの関連性。Front. Immunol. 11, 1-16. doi: 10.3389/fimmu.2020.00810
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Moore, L. E., Serrano-Lomelin, J., Rosychuk, R. J., Kozyrskyj, A. L., Chari, R., Crawford, S., et al. 未就学児の周産期および早期生活因子と喘息コントロール:集団ベースのレトロスペクティブコホート研究。BMJ Open Respir. 10,e001928-001929.doi:10.1136/bmjresp-2023-001928。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Moradzadeh, R., Mansournia, M. A., Baghfalaki, T., Nadrian, H., Gustafson, P., and McCandless, L. C. (2018). The impact of maternal smoking during pregnancy on childhood asthma: adjusted for exposure misclassification; results from the National Health and nutrition examination survey, 2011-2012. Ann. Epidemiol. 28, 697-703. doi: 10.1016/j.annepidem.2018.07.011
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Munblit, D., Peroni, D., Boix-Amorós, A., Hsu, P., Land, B., Gay, M., et al. ヒト乳汁とアレルギー疾患:未解決のパズル。doi: 10.3390/nu9080894.
クロスレフ・フルテキスト|Google Scholar
Munck, C., Helby, J., Westergaard, C. G., Porsbjerg, C., Backer, V., and Hansen, L. H. (2016). 喫煙喘息患者の誘発喀痰サンプルにおける禁煙とマイクロバイオーム。PLoS One 11, e0158622-e0158611. doi: 10.1371/journal.pone.0158622.
パブコメ要旨|全文|Google Scholar
中田和典、小林慶三郎、石川洋一郎、山本幹男、船田吉彦、小谷嘉一郎、他(2010)。母体抗原特異的IgGの移行は、FcRn依存的に生後早期のアレルギー性気道炎症の発症を制御する。Biochem. Biophys. Res. Commun. 395, 238-243. doi: 10.1016/j.bbrc.2010.03.170.
パブコメ要旨|全文|Google Scholar
Natalini, J. G., Singh, S., and Segal, L. N. (2023). 健康と疾患におけるダイナミックな肺マイクロバイオーム。Nat. Rev. Microbiol. 21, 222-235. doi: 10.1038/s41579-022-00821-x
パブコメ抄録|全文|Google Scholar
Ni, J., Friedman, H., Boyd, B. C., McGurn, A., Babinski, P., Markossian, T., et al. 小児期における早期抗生物質曝露と喘息およびアレルギー性鼻炎の発症。BMC Pediatr. 19, 225-228. doi: 10.1186/s12887-019-1594-4.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Noverr,M.C.、Noggle,R.M.、Tews,G.B.、Huffnagle,G.B. (2004). 肺アレルギー反応の促進における抗生物質と真菌微生物叢の役割。Infect. Immun. 72, 4996-5003. doi: 10.1128/IAI.72.9.4996-5003.2004
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ntontsi, P., Photiades, A., Zervas, E., Xanthou, G., and Samitas, K. (2021). 喘息における遺伝学とエピジェネティクス。Int. J. Mol. 喘息における遺伝学とエピジェネティクス。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nurmagambetov, T., Kuwahara, R., and Garbe, P. (2018). 米国における喘息の経済的負担、2008-2013年。Ann. Am. Thorac. Soc. 15, 348-356. doi: 10.1513/AnnalsATS.201703-259OC
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ojanguren, I., Satia, I., and Usmani, O. S. (2022). 重症喘息増悪におけるウイルス感染の役割:現在と将来。論文タイトル:喘息増悪におけるウイルス感染の役割:現在と将来。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pagtakhan, R. D., Bjelland, J. C., Landau, L. I., Loughlin, G., Kaltenborn, W., Seeley, G., et al. 小児の気道と肺実質の成長パターンにおける性差。J. Appl. Physiol. 環境。Exerc. Physiol. 56, 1204-1210. doi: 10.1152/jappl.1984.56.5.1204.
クロスレフ・フルテキスト|Google Scholar
Palma, G., Sorice, G. P., Genchi, V. A., Giordano, F., Caccioppoli, C., D'Oria, R., et al. 肥満における脂肪組織の炎症と肺機能障害。Int. J. Mol. 23,10-12.doi:10.3390/ijms23137349。
パブコメ要旨|全文|Google Scholar
Park, S., Choi, N. K., Kim, S., and Lee, C. H. (2018). 高齢者におけるメタボリックシンドロームと喘息の関係。Sci. Rep. 8:9378. doi: 10.1038/s41598-018-26621-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Park, J. E., Jardine, L., Gottgens, B., Teichmann, S. A., and Haniffa, M. (2020). ヒト免疫の出生前発達。科学 368, 600-603.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Park, S. H., Kim, K. A., Ahn, Y. T., Jeong, J. J., Huh, C. S., and Kim, D. H. (2015). 都市化した町と長寿村の高齢者における腸内細菌叢の比較分析。BMC Microbiol. 15:49. doi: 10.1186/s12866-015-0386-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Park, H. K., Shin, J. W., Park, S. G., and Kim, W. (2014). 喘息および慢性閉塞性肺疾患患者の上気道における微生物群集。PLoS One 9:e109710. doi: 10.1371/journal.pone.0109710.
パブコメ抄録|全文|Google Scholar
Pärnänen, K. M. M., Hultman, J., Markkanen, M., Satokari, R., Rautava, S., Lamendella, R., et al. 早期からの粉ミルク給与は、乳児の腸内細菌叢の変化と抗生物質耐性負荷の増加と関連している。Am. J. Clin. 栄養学 115, 407-421.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Partridge, L., Deelen, J., and Slagboom, P. E. (2018). 高齢化のグローバルな課題に立ち向かう。Nature 561, 45-56.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Patrick, D. M., Sbihi, H., Dai, D. L. Y., al Mamun, A., Rasali, D., Rose, C., et al. 小児における抗生物質使用の減少、腸内細菌叢、喘息発症率:集団ベースおよび前向きコホート研究からのエビデンス。Lancet Respir. Med. 8, 1094-1105. doi: 10.1016/S2213-2600(20)30052-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Penders, J., Stobberingh, E. E., Thijs, C., Adams, H., Vink, C., van Ree, R., et al. アトピー性湿疹が発症している乳児と発症していない乳児の腸内細菌叢の分子指紋。Clin. Exp. アレルギー 36, 1602-1608.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pendyala, S., Walker, J. M., and Holt, P. R. (2012). 高脂肪食は腸に由来する内毒素血症と関連している。胃腸病学 142, 1100-1101.e2. doi: 10.1053/j.gastro.2012.01.034
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Perez-Garcia, J., Herrera-Luis, E., Lorenzo-Diaz, F., González, M., Sardón, O., Villar, J., et al. 小児喘息における精密医療: 治療反応に関するオミックス研究。Int. J. Mol. Doi: 10.3390/ijms21082908.
PubMedアブストラクト|全文|Google Scholar
Pfefferle, P. I., Keber, C. U., Cohen, R. M., and Garn, H. (2021). 衛生仮説-過去から学ぶことはあっても、過去に生きることはない。Front. Immunol. 12, 1-6. doi: 10.3389/fimmu.2021.635935.
PubMedアブストラクト|全文|Google Scholar
Pfeiffer, S., Herzmann, C., Gaede, K. I., Kovacevic, D., Krauss-Etschmann, S., and Schloter, M. (2021). タバコの煙に対する口腔、鼻腔、肺のマイクロバイオームの異なる反応。論文タイトル:「タバコの煙に対する口腔、鼻腔、肺のマイクロバイオームの異なる反応」(原題:Thorax 77, 191-195.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ピノ・ド・モイラ、A.、ストランドベリ・ラーセン、K.、ビショップ、T.、ペデルセン、M.、アヴラム、D.、キャドマン、T.、他(2022年)。幼少期のペット飼育と喘息およびアレルギー感作との関連:EU子どもコホートネットワークの77,000人以上の子どものメタアナリシス。J. Allergy Clin. Immunol. 150, 82-92. doi: 10.1016/j.jaci.2022.01.023
PubMed Abstract|全文|Google Scholar
Pinto, R. A., Arredondo, S. M., Bono, M. R., Gaggero, A. A., and Díaz, P. V. (2006). 呼吸器合胞体ウイルス感染におけるTヘルパー1/Tヘルパー2サイトカインの不均衡は、内因性血漿コルチゾールの増加と関連している。小児科 117, e878-e886. doi: 10.1542/peds.2005-2119.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Raita, Y., Pérez-Losada, M., Freishtat, R. J., Harmon, B., Mansbach, J. M., Piedra, P. A., et al. Integrated omics endotyping of infants with respiratory syncytial virus bronchiolitis and risk of childhood asthma」、nature. Doi:10.1038/s41467-021-23859-6。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ramakrishna, C., Kujawski, M., Chu, H., Li, L., Mazmanian, S. K., and Cantin, E. M. (2019). Bacteroides fragilis polysaccharide aは、ウイルス性脳炎を予防するIL-10分泌B細胞とT細胞を誘導する。Nat. Commun. 10, 1-13. doi: 10.1038/s41467-019-09884-6
クロスレフ・フルテキスト|Google Scholar
Rastogi, S., and Singh, A. (2022). 腸内マイクロバイオームとヒトの健康:プロバイオティクス乳酸菌属が免疫応答をどのように調節するかを探る。Front. Pharmacol. 13, 1-17. doi: 10.3389/fphar.2022.1042189
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Reddel, H. K., Bacharier, L. B., Bateman, E. D., Brightling, C. E., Brusselle, G. G., Buhl, R., et al. 2021年喘息戦略のためのグローバルイニシアチブ:主要な変更の要旨と根拠。doi: 10.1183/13993003.02730-2021.
PubMedアブストラクト|全文|Google Scholar
Ren, Y., Ichinose, T., He, M., Youshida, S., Nishikawa, M., and Sun, G. (2019). リポ多糖と砂漠粉塵の共曝露は、TLR4/MyD88依存性および非依存性の経路を介して、マウスにおけるオバルブミン誘発アレルギー性肺炎の増悪を引き起こす。Allergy Asthma Clin. Immunol. 15, 1-12. doi: 10.1186/s13223-019-0396-4
クロスレフ・フルテキスト|Google Scholar
GINAレポート(2022年)。喘息の管理と予防のための世界戦略。https://ginasthma.org/gina-reports/。
Google Scholar
Resztak, J. A., Choe, J., Nirmalan, S., Wei, J., Bruinsma, J., Houpt, R., et al. 喘息児の縦断的コホートにおける思春期の発達に関連した免疫系の転写変化の解析。Nat. Commun. 14, 230-214. doi: 10.1038/s41467-022-35742-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rühlemann, M. C., Hermes, B. M., Bang, C., Doms, S., Moitinho-Silva, L., Thingholm, L. B., et al. ドイツ人8,956人を対象としたゲノムワイド関連研究により、ABO組織血液型が腸内細菌叢に及ぼす影響が明らかになった。Nat. Genet. 53, 147-155. doi: 10.1038/s41588-020-00747-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rutayisire, E., Huang, K., Liu, Y., and Tao, F. (2016). 分娩様式は乳児の生後1年間の腸内細菌叢の多様性とコロニー形成パターンに影響する:系統的レビュー。BMC Gastroenterol. 16, 1-12. doi: 10.1186/s12876-016-0498-0
パブコメ抄録|クロスリファレンス全文|Google Scholar
Salas Garcia, M. C., Yee, A. L., Gilbert, J. A., and Dsouza, M. (2018). 帝王切開で生まれた子どもにおけるディスバイオーシス。Ann. Nutr. Metab. 73, 24-32. doi: 10.1159/000492168
パブコメ抄録|クロスリファレンス全文|Google Scholar
Santacroce, L., Charitos, I. A., Ballini, A., Inchingolo, F., Luperto, P., de Nitto, E., et al. ヒトの呼吸器系とそのマイクロバイオームを垣間見る。生物学 9, 1-16.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Schroeder, B. O., Birchenough, G. M. H., Ståhlman, M., Arike, L., Johansson, M. E. V., Hansson, G. C., et al. ビフィズス菌または食物繊維は、食事誘発性微生物叢が介在する大腸粘液の劣化から保護する。Cell Host and Microbe 23, 27-40.e7. doi: 10.1016/j.chom.2017.11.004.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Serrano-Villar, S., Vázquez-Castellanos, J. F., Vallejo, A., Latorre, A., Sainz, T., Ferrando-Martínez, S., et al. HIV感染者における微生物ディスバイオシス、酪酸産生および免疫に対するプレバイオティクスの効果。Mucosal Immunol. 10, 1279-1293. doi: 10.1038/mi.2016.122.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Sharpe, R. A., Bearman, N., Thornton, C. R., Husk, K., and Osborne, N. J. (2015). 室内真菌の多様性と喘息:リスク因子のメタ分析とシステマティックレビュー。J. Allergy Clin. Immunol. 135, 110-122. doi: 10.1016/j.jaci.2014.07.002.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shin, J. H., Park, Y. H., Sim, M., Kim, S. A., Joung, H., and Shin, D. M. (2019). 性ステロイドホルモンの血清レベルは、ヒト腸内細菌叢の多様性とプロファイルと関連している。Res. Microbiol. 170, 192-201. doi: 10.1016/j.resmic.2019.03.003.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shore, S. A. (2010). 肥満、気道過敏性、および炎症。この論文では、肥満、気道過敏性、および炎症について解説しています。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Simpson, J. L., Daly, J., Baines, K. J., Yang, I. A., Upham, J. W., Reynolds, P. N., et al. 気道内細菌異常症:コントロール不良喘息におけるヘモフィルス・インフルエンザとトロフェリーマ。Eur. Respir. J. 47, 792-800. doi: 10.1183/13993003.00405-2015.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Singh, V., Lee, G. D., Son, H. W., Koh, H., Kim, E. S., Unno, T., et al. 腸のセンチネル」である酪酸産生菌:酪酸産生菌の腸内における意義と、酪酸産生菌以外の微生物治療薬としての将来性。Front. Microbiol. 13, 1-16. doi: 10.3389/fmicb.2022.1103836
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sisk-Hackworth, L., Kelley, S. T., and Thackray, V. G. (2023). 性、思春期、そして腸内マイクロバイオーム。Soc. Reprod. D. S. G. (2023). 性、思春期、腸内細菌叢.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Słabuszewska-Jóźwiak, A., Szymański, J. K., Ciebiera, M., Sarecka-Hujar, B., and Jakiel, G. (2020). 帝王切開の小児科的影響-系統的レビューとメタ分析。Int. J. Environ. Doi: 10.3390/ijerph17218031.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Song, W. J., Sintobin, I., Sohn, K. H., Kang, M. G., Park, H. K., Jo, E. J., et al. 高齢者の後期発症重症好酸球性喘息におけるブドウ球菌エンテロトキシンIgE感作。Clin. Exp. アレルギー 46, 411-421.
パブコメ要旨|全文|Google Scholar
Song, S. J., Wang, J., Martino, C., Jiang, L., Thompson, W. K., Shenhav, L., et al. 帝王切開出生新生児の膣内播種後の微生物叢発達軌跡の自然化。医学 2, 951-964.e5. doi: 10.1016/j.medj.2021.05.003
パブコメ抄録|クロスリファレンス全文|Google Scholar
Stein, M., Hrusch, C. L., Gozdz, J., Igartua, C., Pivniouk, V., Murray, S. E., et al. アーミッシュとハッタイト農家の子どもたちにおける自然免疫と喘息リスク。N. Engl. J. Med. 375, 411-421. doi: 10.1056/nejmoa1508749
PubMed Abstract|RefRef Full Text|Google Scholar
Stiemsma, L. T., and Michels, K. B. (2017). 健康と疾患の発生的起源におけるマイクロバイオームの役割。小児科 141:e20172437
Google Scholar
Stokholm, J., Blaser, M. J., Thorsen, J., Rasmussen, M. A., Waage, J., Vinding, R. K., et al. 小児期における腸内マイクロバイオームの成熟と喘息リスク」、nature. 通信 9, 1-10. doi: 10.1038/s41467-017-02573-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Suganya, K., and Koo, B. S. (2020). 腸-脳軸:神経疾患における腸内細菌叢の役割と、プロバイオティクス/プレバイオティクスがどのように微生物および免疫経路を有益に調節して脳機能を改善するか。Int. J. Mol. (注1)本学会は、平成23年4月1日~平成24年3月31日の期間、東京大学大学院医学系研究科・医学部附属病院において開催された。
パブコメ抄録|全文|Google Scholar
高木俊介、内藤恭子、井上亮、柏木聡、内山恭子、水島啓介、他(2019).健康な日本人における年齢、性別、便の硬さに関連した腸内細菌叢の違い。J. Gastroenterol. 54, 53-63. doi: 10.1007/s00535-018-1488-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tan,D.J.、Walters,E.H.、Perret,J.L.、Lodge,C.J.、Lowe,A.J.、Matheson,M.C.、他(2015)。成人における異なる喘息表現型の決定因子としての喘息発症年齢:文献の系統的レビューとメタ分析。Expert Rev. Respir. Med. 9, 109-123. doi: 10.1586/17476348.2015.1000311
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Taylor, S. L., Leong, L. E. X., Choo, J. M., Wesselingh, S., Yang, I. A., Upham, J. W., et al. 重症喘息患者における炎症表現型は、異なる気道微生物学と関連している。J. Allergy Clin. Immunol. 141, 94-103.e15. doi: 10.1016/j.jaci.2017.03.044
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Teo, S. M., Mok, D., Pham, K., Kusel, M., Serralha, M., Troy, N., et al. 乳児上咽頭マイクロバイオームは、下気道感染症の重症度と喘息発症リスクに影響する。細胞宿主微生物17, 704-715.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Thorsen, J., Stokholm, J., Rasmussen, M. A., Mortensen, M. S., Brejnrod, A. D., Hjelmsø, M., et al. 気道微生物叢は、未就学児における喘息様症状の再発エピソードに対するアジスロマイシン治療の効果を調節する......無作為化臨床試験。Am. J. Respir. Crit. Care Med. 204, 149-158. doi: 10.1164/rccm.202008-3226OC
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
To, T., Stanojevic, S., Moores, G., Gershon, A. S., Bateman, E. D., Cruz, A. A., et al. 成人における世界の喘息有病率:横断的世界保健調査の結果。BMC公衆衛生12:204.doi: 10.1186/1471-2458-12-204.
パブコメ抄録|全文|Google Scholar
Toivonen, L., Schuez-Havupalo, L., Karppinen, S., Waris, M., Hoffman, K. L., Camargo, C. A., et al. 乳児期の抗生物質治療、鼻内細菌叢の変化、喘息発症:集団ベースのコホート研究。Clin. Infect. Dis. doi: 10.1093/cid/ciaa262
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
友田和彦、久保和彦、浅原俊彦、安藤晃、野本和彦、西井靖之、他(2011).タバコの煙はラットの盲腸内の有機酸濃度とビフィズス菌の個体数を減少させる。J. Toxicol. (2011)タバコの煙は、ラット盲腸内の有機酸濃度とビフィズス菌の個体数を減少させる。
パブコメ要旨|全文|Google Scholar
Troisi, R. J., Speizer, F. E., Willett, W. C., Trichopoulos, D., and Rosner, B. (1995). 閉経、閉経後エストロゲン製剤、および成人発症喘息のリスク。Am. J. Respir. Crit. Care Med. 152, 1183-1188. doi: 10.1164/ajrccm.152.4.7551368
クロスレフ・フルテキスト|Google Scholar
Troy, E. B., and Kasper, D. L. (2010). バクテロイデス・フラジリス多糖体の免疫系に対する有益な効果。Front. Biosci. 15, 25-34.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
佃直樹、矢作和彦、原俊英、渡辺義明、松本秀樹、森英樹、他(2021)。生後早期の腸内短鎖脂肪酸プロファイルに影響を及ぼす主要細菌分類群と代謝経路。ISME J. 15, 2574-2590.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Turunen, J., Tejesvi, M. V., Paalanne, N., Pokka, T., Amatya, S. B., Mishra, S., et al. 出生前および周産期におけるメコニム微生物叢に関する因子の調査:系統的レビューとコホート研究。Pediatr. 論文番号: 10.1038/s41390-023-02783-z.
クロスレフ・フルテキスト|Google Scholar
Ucciferri, C. C., and Dunn, S. E. (2022). 思春期の免疫系への影響:多発性硬化症との関連性」、Frontiers. doi: 10.3389/fped.2022.1059083.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
van de Loo, K., van Gelder, M., Roukema, J., Roeleveld, N., Merkus, P. J., and Verhaak, C. M. (2016). 出生前の母親の心理的ストレスと小児期の喘息および喘鳴:メタアナリシス。Eur. Respir. J. 47, 133-146. doi: 10.1183/13993003.00299-2015.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
van den Munckhof, E. H. A., Hafkamp, H. C., de Kluijver, J., Kuijper, E. J., de Koning, M. N. C., Quint, W. G. V., et al. モラクセラ菌が優勢な鼻腔内細菌叢は、高齢者集団における呼吸器の健康と関連している:症例対照研究。Respir. Res.21,181-189.doi:10.1186/s12931-020-01443-8。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ver Heul, A., Planer, J., and Kau, A. (2019). ヒト微生物叢と喘息。Clin. Rev. Allergy Immunol. 57, 350-363. doi: 10.1007/s12016-018-8719-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Voraphani, N., Stern, D. A., Wright, A. L., Guerra, S., Morgan, W. J., and Martinez, F. D. (2014). 幼少期に呼吸器合胞体ウイルス疾患に罹患した成人喫煙者における現在の喘息リスク。Am. J. Respir. Crit. Care Med. 190, 392-398.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, W., Li, Y., Han, G., Li, A., and Kong, X. (2022). Lactobacillus fermentum CECT5716は、TLR2/TLR4の発現を制御することにより、喘息の炎症反応を緩和する。Front. DOI: 10.3389/fnut.2022.931427
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, Q., Li, F., Liang, B., Liang, Y., Chen, S., Mo, X., et al. 英国成人の喘息における腸内細菌叢のメタゲノムワイド関連研究。BMC Microbiol. 18, 114-117. doi: 10.1186/s12866-018-1257-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, J., Li, F., and Tian, Z. (2017). Role of microbiota on lung homeostasis and diseases. Sci. China Life Sci. 60, 1407-1415.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Wood, L. G., Garg, M. L., and Gibson, P. G. (2011). 高脂肪チャレンジは気道炎症を増加させ、喘息における気管支拡張薬の回復を損なう。J. Allergy Clin. Immunol. 127,1133-1140.doi:10.1016/j.jaci.2011.01.036。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wood, L. G., Shivappa, N., Berthon, B. S., Gibson, P. G., and Hebert, J. R. (2015). 食事性炎症指数は、喘息リスク、肺機能、喘息における全身性炎症と関連している。Clin. Exp. アレルギー 45, 177-183.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Wu, Z., Mehrabi Nasab, E., Arora, P., and Athari, S. S. (2022). TLR4/NF-kBシグナル伝達経路の制御によるOVA-LPS誘発アレルギー性喘息炎症および肺炎の治療に対するプロバイオティクスおよびプレバイオティクスの研究効果。J. Transl. Med. 20, 130-114.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wu,Y.L.、Xu,J.、Rong,X.Y.、Wang,F.、Wang,H.J.、Zhao,C. (2021). 高齢者における腸内細菌叢の変化と健康状態:相関関係から因果関係へ。Aging Med. 4, 206-213.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
八木一郎、Huffnagle, G. B., Lukacs, N. W., and Asai, N. (2021). 健康時と疾患時の肺マイクロバイオーム。Int. J. Mol. Sci.22,1-13.doi:10.3390/ijms221910872。
パブコメ抄録|全文|Google Scholar
Yáñez, A., Soria, M., de Barayazarra, S., Recuero, N., Rovira, F., Jares, E., et al. アレルギークリニックに通院する高齢喘息患者の臨床的特徴と併存疾患。Asthma Res. Pract. 4, 1-7. doi: 10.1186/s40733-018-0041-x
CrossRef 全文|Google Scholar
Yao, Y., Cai, X., Ye, Y., Wang, F., Chen, F., and Zheng, C. (2021). 乳児の健康における微生物叢の役割:初期から成人期まで。Front. Immunol. 12, 1-21. doi: 10.3389/fimmu.2021.708472.
パブコメ抄録|全文|Google Scholar
Yap, G. C., Loo, E. X., Aw, M., Lu, Q., Shek, L. P., and Lee, B. W. (2014). アジアのアトリスクコホートにおける乳児糞便微生物叢の分子解析-乳児湿疹および小児湿疹との相関。BMC. 研究ノート 7, 1-6.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yatsunenko, T., Rey, F. E., Manary, M. J., Trehan, I., Dominguez-Bello, M. G., Contreras, M., et al. ヒトの腸内細菌叢は、年齢や地理的条件によって異なる。Nature 486, 222-227.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yuan, X., Chen, R., Zhang, Y., Lin, X., and Yang, X. (2020). 思春期における腸内細菌叢の性的二型性(Sexual dimorphism of gut microbiota at different pubertal status)。Microb. 細胞ファクトリー 19, 152-116.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zeldin, J., Chaudhary, P. P., Spathies, J., Yadav, M., D'Souza, B. N., Alishahedani, M. E., et al. イソシアネートへの曝露はアトピー性皮膚炎の有病率を予測し、常在細菌の治療経路を破壊する。科学アドバンス 9, eade8898-eade8820.
パブコメ要旨|全文|Google Scholar
喘息に対する健康的な食生活の効果。小児および青年の喘息と喘鳴に対する健康的な食事の効果:系統的レビューとメタ分析。J. Asthma Aller. 6, 1007-1024.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang, Y., and Huang, L. (2021). 気管支喘息を有する高齢成人入院患者の特徴:後方視的研究。Allergy Asthma Clin. Immunol. 17, 122-127. doi: 10.1186/s13223-021-00628-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang, J., Ma, J.-y., Li, Q.-h., Su, H., and Sun, X. (2018a). アレルギー性気道炎症に対するラクトバチルス・ラムノサスGG誘導保護効果は腸内細菌叢と関連している。Cell. Immunol. 332, 77-84. doi: 10.1016/j.cellimm.2018.08.002
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zhang, J., Ma, C., Yang, A., Zhang, R., Gong, J., and Mo, F. (2018b). 早産は出生から17歳までの子どもの喘息と関連するか?-2011-2012 US National Survey of Children's healthに基づく研究。Ital. doi: 10.1186/s13052-018-0583-9.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,Z.,Shi,L.,Pang,W.,Liu,W.,Li,J.,Wang,H.,他(2016)。食物繊維摂取は腸内細菌叢を制御し、マウスモデルにおいてオバルブミン誘発アレルギー性気道炎症を抑制する。PLoS One 11, 1-16. doi: 10.1371/journal.pone.0147778.
パブコメ抄録|全文|Google Scholar
Zhao,X.,Hu,M.,Zhou,H.,Yang,Y.,Shen,S.,You,Y.,他(2023)。呼吸器感染と喘息の複雑な関係における腸内細菌叢の役割。Front. Microbiol. 14, 1-13. doi: 10.3389/fmicb.2023.1219942
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zheng, D., Liwinski, T., and Elinav, E. (2020). 健康および疾患における微生物叢と免疫の相互作用。細胞研究 30, 492-506.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zheng, P., Zhang, K., Lv, X., Liu, C., Wang, Q., and Bai, X. (2022). アレルギー性および非アレルギー性小児喘息の腸内細菌叢とメタボロミクスプロファイル。J. Asthma Aller. 15, 419-435. doi: 10.2147/JAA.S354870
クロスレフ・フルテキスト|Google Scholar
Zhou, Y., Jackson, D., Bacharier, L. B., Mauger, D., Boushey, H., Castro, M., et al. 喘息児の上気道微生物叢と喘息コントロールの喪失。Nat. Commun. 10, 5714-5710. doi: 10.1038/s41467-019-13698-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zimmermann, P., Messina, N., Mohn, W. W., Finlay, B. B., and Curtis, N. (2019). 腸内細菌叢とアレルギー感作、湿疹、喘息との関連:系統的レビュー。J. Allergy Clin. Immunol. 143, 467-485. doi: 10.1016/j.jaci.2018.09.025
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zou, X. L., Wu, J. J., Ye, H. X., Feng, D. Y., Meng, P., Yang, H. L., et al. 腸内細菌叢と喘息のエンドタイプとの関連:新たに喘息と診断された患者に基づく中国南部での横断研究。J. Asthma Aller. 14, 981-992. doi: 10.2147/JAA.S320088
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:喘息、微生物叢、増悪、腸肺軸、多様性、環境因子、喘息表現型
引用 Galeana-Cadena D, Gómez-García IA, Lopez-Salinas KG, Irineo-Moreno V, Jiménez-Juárez F, Tapia-García AR, Boyzo-Cortes CA, Matías-Martínez MB, Jiménez-Alvarez L, Zúñiga J and Camarena A (2023) Winds of change a tale of: Asthma and microbiome. フロント。微生物学。14:1295215.
受理された: 15 September 2023; Accepted: 2023年11月15日;
発行:2023年12月11日
編集者
廖春興(国立陽明交通大学、台湾
査読者
Yen-Chu Huang, 台中退役軍人総合病院, 台湾
Naser Alsharairi, グリフィス大学、オーストラリア
ウェンディ・フォンセカ(ミシガン大学、米国
Copyright © 2023 Galeana-Cadena, Gómez-García, Lopez-Salinas, Irineo-Moreno, Jiménez-Juárez, Tapia-García, Boyzo-Cortes, Matías-Martínez, Jiménez-Alvarez, Zúñiga and Camarena. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Joaquín Zúñiga, joazu@yahoo.com; Angel Camarena, ang_edco@yahoo.com.mx
免責事項:本記事で表明されているすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
活性酸素はNLRP3インフラムソームと相互作用し、敗血症の炎症に関与する: 進行のメカニズムから治療まで
Shuai Zhao、Fan Chen、Qiliang Yin、Dunwei Wang、Wei Han、Yuan Zhang
抗生物質スチュワードシップのためのWHO AWaRe分類:抗菌薬耐性への取り組み-COVID-19パンデミック前およびパンデミック中の英国NHS財団トラストにおける記述的研究
Rasha Abdelsalam Elshenawy、Nkiruka Umaru、Zoe Aslanpour
長期COVID-19における消化器症状の発現と管理
Yong-Ping Jian、Kai-Yue He、Dan-Hui Wu、Li-Yuan Lu、Zhi-Xiang Xu
CIN III患者におけるLEEP手術後の残存病変の予測モデル
鄧麗輝、王鉄軍、陳葉、唐学利、翔大軍
発泡スチロールを餌とするTenebrio molitor幼虫の糞便に含まれる嫌気性細菌および培養可能細菌の多様性と群集組成:カルチュロミクスに基づく研究
朱淳宇、陳暁晨、陳盛忠、邱万玲、余建英、郭騰飛、王賢興
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
