地中海食と過敏性腸症候群の症状との関連性
本文へスキップ記事へスキップ
エルゼビアロゴ
臨床消化器病学・肝臓病学
オンラインで入手可能 2023年7月29日
In Press, Corrected Proofこれは何ですか?
地中海食と過敏性腸症候群の症状との関連性
https://www.sciencedirect.com/science/article/pii/S1542356523005748
著者リンク オーバーレイパネルを開くEllie Y. Chen 1, Swapna Mahurkar-Joshi 1 2 3, Cathy Liu 1 2 3, Nancee Jaffe 1, Jennifer S. Labus 1 2 3, Tien S. Dong 1 3, Arpana Gupta 1 2 3, Shravya Patel 4, Emeran A. Mayer 1 2 3, Lin Chang 1 2 3
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.cgh.2023.07.012
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
背景と目的
地中海食(MD)の遵守率の低さは過敏性腸症候群(IBS)の有病率の高さと関連することが示されているが、IBS症状との関連は確立されていない。我々は、MDとIBS症状との関連を評価し、IBS症状と関連するMDの構成要素を同定し、症状修飾型MDが腸内細菌叢の変化と関連するかどうかを明らかにすることを目的とする。
方法
Rome +IBS患者106名と健常対照者108名が、食事歴および消化器症状に関する質問票に回答した。代替地中海食(Alternate Mediterranean Diet)と地中海食アドヒアランススクリーナー(Mediterranean Diet Adherence Screener)を用いてMDのアドヒアランスを測定した。疎部分最小二乗法により、IBS症状と関連するMD食品を同定した。IBS被験者の16SリボソームRNA遺伝子配列決定および微生物組成分析のために便サンプルを採取した。
結果
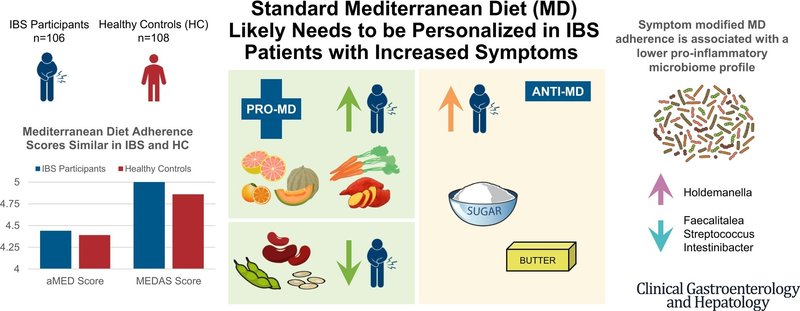
代替地中海食および地中海食アドヒアランススクリーナーのスコアは、IBSと健常対照の間で同程度であり、過敏性腸症候群重症度評価システム、腹痛、腹部膨満感とは相関しなかった。IBS患者では、果物、野菜、砂糖、バターの摂取量が多いほど、IBS症状の重症度が高かった。多変量解析により、いくつかのMD食品がIBS症状の増加と関連していることが同定された。症状修飾MDの摂取量が多いほど、潜在的に有害なFaecalitalea属、Streptococcus属、Intestinibacter属が少なく、潜在的に有益なFirmicutes門のHoldemanella属が多かった。
結論
標準的なMDはIBS症状の重症度とは関連しなかったが、特定のMD食品はIBS症状の増加と関連していた。本研究は、標準的なMDがすべてのIBS患者に適しているわけではなく、症状が増強している患者には個別化が必要である可能性が高いことを示唆している。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(324KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
地中海食過敏性腸症候群症状マイクロバイオーム
本稿で使用した略語
aMED地中海食aMED-symptom modified-aMEDDHQ IIDiet History Questionnaire IIFODMAPfermentable oligo-, di-, monosaccharides and polyolsGIgastrointestinalHChealthy control subjectsIBSirritable bowel syndromeIBS-SSSIrritable Bowel Syndrome Severity Scoring SystemMDM地中海食MEDASMediterranean Diet Adherence ScreenerVSIVisceral Sensitivity Index
知っておくべきこと
背景
地中海食は健康的な食事と考えられている。地中海食のアドヒアランスがIBSの発症率と逆相関することを示す研究は少ないが、地中海食とIBS症状との関連は十分に確立されていない。
研究結果
地中海食の遵守はIBS症状の重症度と関連しなかった。また、果物や野菜などの食品群はIBS症状の増加と関連していた。症状修飾地中海食は、より有益な腸内細菌叢プロフィールと関連していた。
患者ケアへの示唆
IBS症状の管理には、標準的な地中海食ではなく、IBS修正地中海食を考慮すべきである。
地中海食(MD)は、地中海に面した国々の人々の伝統的な食習慣である。全粒穀物、果物、野菜、ナッツ類、種子類を多く摂取することを特徴とする健康的なライフスタイルと考えられている。魚やその他の魚介類、鶏肉、乳製品は適度に食べ、赤身肉や糖分の多い食品はたまに食べる。オリーブオイルはMDの主な脂肪源である1。
MDを摂取することで、その必須食品が持つ抗酸化作用と抗炎症作用により、心血管疾患、糖尿病、がんのリスクを低減できることを示す証拠が増えつつある2,3。MD食に多量に含まれるフェノールは、炎症分子の発現を低下させるなど、抗炎症作用を有することが示されている4。さらに、MDは、腸上皮の適切な機能の維持に役立つ短鎖脂肪酸産生微生物叢の増加とも関連している5。さらに、オリーブ油は、動物実験において、腸の炎症および内臓過敏症の減少と関連していることが示されている6,7。
過敏性腸症候群(IBS)は、世界人口の約4%~11%が罹患している一般的な胃腸(GI)疾患である8。IBSの病因は、様々な宿主因子と環境因子の組み合わせを反映した多因子性である9。低発酵性オリゴ・ジ・単糖類・ポリオール(FODMAP)食などの食事介入は、IBSの第一選択治療と考えられている11。しかし、ほとんどの食事介入は誘因となる食品の除去に重点を置いており、制限的で継続が難しく、特定の栄養素の欠乏を招き、腸内細菌叢をネガティブに変化させる可能性がある12,13。
MDは、より制限的な食事(低FODMAP、グルテンフリーなど)とは対照的に、バランスのとれた食事であるが、MDとIBSとの関連を検討した研究はほとんどない。さらに、IBS患者に対してMD食の特定の構成要素を修正すべきかどうかを判断するために、個々のMD食のIBS症状への寄与に関する研究は現在のところ行われていない。
本研究の目的は、(1)IBS患者と健常対照者(HC)におけるMDのアドヒアランスを比較すること、(2)MDが腹痛、腹部膨満感、IBS症状全般を含むIBS症状の重症度と相関するかどうかを明らかにすること、(3)IBS症状の重症度と相関するMDの構成要素を同定すること、(4)症状修飾MDがマイクロバイオーム・プロファイルの違いと関連するかどうかを明らかにすることである。われわれは、一般的に、MDへのアドヒアランスはIBS患者とHC患者で差はないが、MDへのアドヒアランスが高いIBS患者は、MDへのアドヒアランスが低いIBS患者と比較して、IBS症状の重症度が低下し、便中マイクロバイオームプロファイルが異なるという仮説を立てた。さらに、IBS症状の重症度と関連する個々のMD食品(例えば、高FODMAP食品)が存在する可能性があるという仮説を立てた。
方法
参加者
本研究は、カリフォルニア大学ロサンゼルス校のG. Oppenheimer Center for Neurobiology of Stress and Resilienceで2013年7月~2021年11月に実施されたIBS臨床研究に参加したIBSおよびHCの成人参加者の後ろ向き分析を含む横断研究である。
IBSの診断は、募集時期に応じてRome IIIまたはRome IV17,18基準を用いて行われた。HCは、消化器症状や疾患の既往歴がなかった。器質性GI疾患のある参加者は除外した。微生物叢分析のために便サンプルを提出した参加者も、過去3ヵ月以内に抗生物質を投与された場合は除外した。組み入れ基準および除外基準に関する詳細は以前に発表されているが、MDのアドヒアランスの評価とIBS症状との関連は新規のものであり、これまでに発表されていない13。
本研究はカリフォルニア大学ロサンゼルス校の施設審査委員会の承認を得た。
過敏性腸症候群症状関連質問票
IBS参加者は、腸症状質問票19および過敏性腸症候群重症度評価システム(IBS-SSS)20を含む有効なGI症状関連質問票に記入した(補足方法)。
心理症状評価
参加者は有効な質問票に回答した: Visceral Sensitivity Index(VSI)21は、消化器症状に関連する不安を測定するもので、Hospital Anxiety and Depression Scale(病院不安・抑うつ尺度)22は、現在の不安または抑うつ症状を測定するものである(補足方法)。
食事評価
食事情報は、食事歴質問票II(DHQ II)を用いて入手した23。MDのアドヒアランスは、有効性が確認された代替地中海食(aMED)および地中海食アドヒアランススクリーナー(MEDAS)のスコアにより評価した。aMEDは、伝統的なMDを非MD諸国に適応させたものであり24、MEDASは、MDの主要な研究の1つであるPREDIMED試験の指針として用いられた3。また、Alternative Healthy Eating Index-2010は、慢性疾患リスクの軽減を目的としているため、各参加者の食事の質を評価するために算出された(補足表1、補足表2、補足表3)25。
さらに、GI管理栄養士が、Dietary Inflammatory IndexとPREDIMED研究で使用された採点ガイドの組み合わせに基づいて、MDにおいて定期的に消費されるか、または時折(1日1食未満)回避/消費されるDHQ II食品群および個々の食品を特定し、さらなる分析を行った(補足表4)3,26。これらの食品の1日当たりの平均総消費量は、Diet∗Calcソフトウェア27を用いてDHQ IIのデータから計算し、1日当たりのグラム数として報告した。
統計解析
人口統計学的特性、MDアドヒアランススコア、および食品項目に関するIBS群とHC群の比較は、独立t検定、一般線形モデル、またはカイ二乗検定を用いて行った。IBSの状態を従属変数とする一般化ロジスティック回帰(リンクロジット)を用いて、病院不安・抑うつ尺度(Hospital Anxiety and Depression Scale-Anxiety)を調整した群間差を決定した。IBS症状とMDアドヒアランスの関連を明らかにするために一般線形モデルを用いた。統計的有意性はP<0.05と定義した。mixOmics Rパッケージで実装された疎部分最小二乗回帰を適用して、抗MD食品および親MD食品の食事摂取量とIBS症状の重症度測定値との関係を決定した(補足方法)。
モデルによって選択された食事変数とIBS症状との相関に基づき、標準的なaMED計算からIBS症状の増加と関連するpro-MD食品項目を除外して、症状修正-aMED(aMED-m)スコアを計算した。aMED-mスコアが低、中、高の人における腸内細菌叢の違いを比較した。
マイクロバイオーム解析
PowerSoil DNA Isolation Kit(MO BIO, Carlsbad, CA)を用いて新鮮な凍結便サンプルからDNAを抽出した。515Fと806Rのプライマーセットを用いてV4超可変領域を増幅した。その後、市販のキットを用いてDNAを精製し、Illumina HiSeq 2500(Illumina, San Diego, CA)を用いて塩基配列を決定した。生リードをデフォルトパラメーターを用いてDADA2で処理し、アンプリコン配列バリアントを生成した。分類学的割り当てはSilva 138データベースを用いて行った。低存在量のアンプリコン配列バリアントは、相対存在量が1E-7を超えない場合は削除した。サンプルあたりの平均リード数は57,462で、標準偏差は25,423であった。α多様性とβ多様性はQIIME 2を使用して計算した。 β多様性に使用した距離メトリックはQIIME 2のDEICODEプラグインのロバストAitchisonである。β多様性の有意性はRのAdonisパッケージを使用して計算した。ベータ多様性は主座標分析プロットを用いて可視化した。アルファ多様性は、種の均等性(シャノン指数)と豊かさ(Chao1指数)を用いて測定した。存在量の差の検定はRのDESeq2を用いて行った。DESeq2は負の二項モデルを使って非稀釈化カウントデータを検定する。P値は多重仮説検定を補正するためにq値に変換した。
結果
IBS参加者とHCの年齢、性別、肥満度、人種は類似していた(表1)。しかし、IBS参加者はHCと比較して病院不安・抑うつ尺度-不安スコアが高く(7.94 vs 4.23;P=3.0e-11)、HCよりも制限食を摂取する傾向が強かった(14% vs 4%;P=5.90e-05)。
表1. 人口統計学的特徴
空セル IBS(N = 106) HCS(N = 108) P値
年齢 28.75 (10.93) 28.85 (10.43) 0.95
性別 n (%) 77 (73) 84 (78) .43
BMI 23.88 (4.03) 24.73 (3.59) .1
HADS-Anxiety 7.94 (4.24) 4.23 (3.41) 3.0e-11
人種、n (%) .61
アジア人 26 (24) 38 (35)
黒人 7 (6) 9 (8)
白人 56 (53) 42 (39)
多民族 10 (9) 11 (10)
不明 7 (7) 8 (7)
ヒスパニック n (%) 26 (24) 22 (20) 0.34
aMEDスコア 4.44 (1.82) 4.39 (1.80) 0.83
MEDASスコア 5.0 (1.37) 4.86 (1.40) .46
制限食a 30 (14) 8 (4) 5.90e-05
腸習慣のサブタイプ, n (%)
IBS-C 30 (28)
IBS-D 41 (39)
IBS-M 10 (9)
IBS-U 25 (23)
全体の重症度(0-20) 10.11 (4.12)
腹痛 (0-20) 8.94 (4.33)
腹部膨満感(0-20) 11.39 (5)
VSIスコア(0-75) 39.69 (15.04)
IBS-SSS(0-500)248.91(81.44)
aMED、alternative Mediterranean index;BMI、body mass index;HADS、Hospital Anxiety and Depression Scale;HC、健常対照被験者;IBS、過敏性腸症候群;IBS-C、便秘優位のIBS; IBS-D、下痢優勢型IBS、IBS-M、混合性食習慣を伴うIBS、IBS-U、分類不能IBS、IBS-SSS、過敏性腸症候群重症度評価システム、MEDAS、地中海式食事療法アドヒアランス・スコア、VSI、内臓感受性指数。
a
グルテンフリー、乳製品フリー、および/または低FODMAP食。
aMEDスコアおよびMEDASスコアの平均値には、IBS参加者とHCとの間に有意差はなかった(M[標準偏差(SD)]4.44[1.82] vs 4.39[1.80]、P = 0.83;および5.0[1.37] vs 4.86[1.40]、P = 0.46)。また、MDの遵守とIBS症状全体、腹痛、腹部膨満感、VSI、IBS-SSSとの間に有意な関連はみられなかった(表2)。食事の質に関しては、aMEDスコアおよびMEDASスコアはAlternative Healthy Eating Indexスコアと正の相関を示した(それぞれr = 0.54, t[dof] = 9.40 [212], P < 2.2e-16; およびr = 0.45, t[dof] = 7.26 [212], P = 7.19e-12)。全体として、IBS参加者の21%、HCの9%が地中海系であった(P = 0.18)。しかし、aMEDスコアとMEDASスコアは、地中海系の参加者とその他の出身国の参加者との間に差はなかった(M[標準偏差(SD)]4.36[1.78] vs 4.35[1.89]、P = 0.98;および4.87[1.39] vs 5.13[1.41]、P = 0.35)。
表2. MDアドヒアランスとIBS症状の相関
空欄 aMEDスコア MEDASスコア
推定 標準誤差 P値 推定 標準誤差 P値
全体症状 -0.08 0.24 .74 -0.12 0.32 .71
腹痛 -0.03 0.25 .92 -0.39 0.33 .24
腹部膨満感 0.37 0.28 .19 0.61 0.37 .10
VSIスコア 1.49 0.83 .08 1.17 1.05 .29
IBS-SSS 2.70 4.70 .57 3.06 6.17 .62
注 この値は、肥満度、人種、Hospital Anxiety and Depression Scale-Anxietyを共変量した線形回帰を用いて作成した。推定値は線形回帰モデルからのβ値である。
aMED、代替地中海食指数、IBS、過敏性腸症候群、IBS-SSS、過敏性腸症候群重症度評価システム、MD、地中海食、MEDAS、地中海食アドヒアランススコア、VSI、内臓感受性指数。
Pro-MDおよびAnti-MD食品群では、IBS患者はHCと比較して平均して豆類の摂取量が少なかった(P = 0.048)(表3)。さらに、IBS参加者では、果物は腹痛、腹部膨満感、IBS-SSSが高いことと関連し、野菜はVSIスコアが高いことと関連した(すべてP < 0.05)。しかし、豆類、豆類、大豆(pro-MD)の摂取量が多いほど、全体的な症状およびIBS-SSSは低かったが(それぞれP = 0.0004および0.002)、VSIとは関連していなかった。加糖などの抗MD食品群の摂取量が多いほど腹痛の評価が高く、バター、クリーム、マーガリンの摂取量が多いほど腹部膨満感およびIBS-SSSのスコアが高かった(すべてP<0.05)(表4)。
表3. IBS群とHCsa群間におけるプロ地中海食品群とアンチ地中海食品群の摂取量の差
空細胞 IBS(N = 106)HC(N = 108) 推定 標準誤差 FDR P値
プロMD食品, g/日 (SD)
豆類/豆類/大豆 30.18 (63.88) 37.89 (69.34) -0.015 0.005 .048
魚/魚介類 24.37 (32.41) 31.86 (52.93) -0.012 0.005 .12
果物 262.8 (278.14) 263.9 (313.92) -2.6e-04 0.001 .70
穀物(ホール) 102.74 (105.86) 104.8 (124.56) 8.4e-05 0.001 .95
ナッツ/種子 19.59 (30.46) 19.21 (24.75) -0.003 0.006 .70
オリーブ油 3 (3.1) 3.57 (4.37) -0.08 0.051 .26
鶏肉 49.77 (62.8) 48.24 (70.33) -0.004 0.003 .32
野菜 248.37 (256.15) 308.95 (417.42) -0.001 0.001 .12
水 2350.04 (2603.21) 2329.08 (2749.07) -7.5e-05 6.5e-05 .39
ワイン 21.81 (30.53) 25.05 (36.96) -0.007 0.006 .39
抗MD食品, g/日 (SD)
砂糖 253.86 (590.78) 269.28 (806.63) -0.0002 0.0002 .98
アルコール(ワインを除く) 105.93 (225.17) 68.12 (110.58) 0.001 0.001 .64
焼き菓子、デザート、スイーツ 26.73 (34.07) 43.96 (88.02) -0.008 0.004 .64
バター、マーガリン、クリーム 23.58 (68.92) 18.62 (35.99) -0.004 0.004 .92
揚げ物 19.29 (21.47) 25.28 (42.51) -0.01 0.006 .64
赤肉/加工肉 54.25 (69.84) 80.68 (148.31) -0.003 0.002 .64
注 この値は、一般化線形モデル(link=logit)を用いて、肥満度、人種、Hospital Anxiety and Depression Scale-Anxietyを共変量して作成した。推定値はモデルからのベータ値である。
FDRは偽発見率、HCは健常対照被験者、IBSは過敏性腸症候群、MDは地中海食、SDは標準偏差。
a
消費量は被験者1人当たりの平均総消費グラム/日で測定(SD)。
表4. 地中海食摂取とIBS症状の相関
プロMD食品 腹痛 腹部膨満感 VSI IBS-SSS
推定P値 推定P値 推定P値 推定P値 推定P値 推定P値
豆類/豆類/大豆 -0.05 .0004 -0.023 .12 -0.018 .29 -0.061 .21 -0.941 .002
魚/魚介類 0.011 .47 0.022 .17 0.015 .43 0.093 .08 0.335 .28
果物 0.003 .10 0.004 .009 0.006 .004 0.007 .17 0.101 .0005
穀類(ホール) -0.003 .51 -0.001 .87 -0.007 .16 0.016 .25 -0.1 .20
ナッツ/種子 -0.001 .95 0.003 .83 0.006 .75 -0.019 .72 0.115 .69
オリーブ油 0.129 .39 0.183 .23 0.235 .18 0.051 .92 3.054 .27
鶏肉 0.001 .85 0.003 .71 0.001 .88 0.014 .57 -0.006 .97
野菜 0.001 .48 0 .82 0.004 .072 0.013 .027 0.045 .18
水 0 .74 0 .71 0 .40 0 .92 0.003 .36
ワイン 0.012 .51 -0.006 .76 0.001 .48 0.076 .21 0.381 .22
抗MD食品
加糖 0.001 .14 0.003 .006 0.001 .48 0.004 .21 0.033 .08
アルコール(ワインを除く) -0.001 .67 0 .92 -0.004 .13 -0.013 .07 -0.066 .09
焼き菓子/デザート/スイーツ 0.004 .78 0 .98 -0.017 .25 0.052 .24 -0.137 .58
バター/マーガリン/クリーム 0.01 .25 0.005 .54 0.021 .03 0.041 .12 0.346 .02
揚げ物 0.015 .45 0.011 .62 -0.013 .58 0.014 .84 0.012 .98
赤肉/加工肉 -0.001 .88 0.008 .23 -0.004 .66 0.012 .58 -0.103 .44
注 この表は、地中海食品目の摂取とIBS症状の重症度測定値との関連を示し、推定値は、肥満度、人種、Hospital Anxiety and Depression Scale-Anxietyを共変量した線形回帰を用いて作成した回帰ベータ値を示す。
IBSは過敏性腸症候群、IBS-SSSは過敏性腸症候群重症度評価システム、MDは地中海食、VSIは内臓感受性指数。
疎部分最小二乗モデルにより、IBS症状と最も関連する親MDおよび抗MD食品が同定され、単一の食事シグネチャーが作成された。補足図1に、モデルによって選択された変数の負荷量を示す。全体的な食事シグネチャーのスコアとIBS症状との間には負の相関がみられた(例えば、食事シグネチャー vs IBS-SSS、r = -0.46、P = 0.0001)。いくつかの抗MD食品(例、炭酸飲料、加工肉、焼き菓子、ビール)の消費量の増加は、IBS症状の軽減と最も関連しており、一方、いくつかのプロMD食品(例、カンタロープ、ニンジンジュース、グレープフルーツ、サツマイモ、オレンジ/ミカン/クレメンタイン)の消費量の増加は、IBS症状の増加と最も関連していた(図1)。
ダウンロード 高解像度画像ダウンロード(172KB)
ダウンロード フルサイズ画像のダウンロード
図1. MD食品とIBS症状との相関の疎部分最小二乗分析。抗MD食品は、地中海食スタイルでは一般的に避けるか、たまに食べる食品である。Pro-MD食品は地中海食で優先的に摂取される食品である。ヒートマップは、派生した食事変数と派生した症状変数の間のピアソン相関係数を示す。赤が濃いほど正の相関が高く、青が濃いほど負の相関が高いことを表す。階層的クラスタリング法に基づくデンドログラムの行/列クラスタ。
我々の研究では、aMED-mスコアが高、中、低の被験者間でベータ多様性に差がないことが示された。しかし、aMED-mスコアが高いほど(q値<0.05)、Faecalitalea属、Streptococcus属、およびIntestinibacter属の存在量が少なく、Firmicutes門のHoldemanella属の存在量が多かった(図2)。
ダウンロード 高解像度画像ダウンロード(330KB)
ダウンロード フルサイズ画像のダウンロード
図2 (A)低、中、高症状のaMED-mを持つIBS被験者間のβ多様性の主座標分析比較。(B)aMED-mスコアが高いIBS被験者と低いIBS被験者における糞便微生物叢の相対的存在量。
考察
我々の研究から、IBS参加者とHCの間でMDの遵守に差がないことが示された。また、MDは食事の質の向上と関連していたが、MDの遵守とIBS症状との相関は認められなかった。しかし、MDを主な食品群別にさらに分析したところ、特定のプロMD食品およびアンチMD食品の摂取量が多いほど、IBS症状の重症度が高いことがわかった。興味深いことに、個々の食品項目の多変量解析では、カンタロープのようないくつかのプロMD食品の摂取量が多いほどIBS症状が強く、ソーダのようないくつかのアンチMD食品の摂取量が多いほどIBS症状の重症度が低いことが示された。
先行研究では、MDの遵守とIBSの有病率との間に逆相関があることが示されている。Zitoら14は、南イタリアの1134人の参加者を調査し、若い参加者において、MDの遵守度が低いことと、IBSおよび機能性ディスペプシアの有病率が高いこととの間に関連があることを見いだした(P < 0.05)。同様に、Agakidisら15はギリシャで1116人の小児を調査し、MDの遵守度が高いほど、Rome III基準による機能性便秘、IBS、機能性ディスペプシアなどの腸脳相互作用障害の有病率が低いことを明らかにした(P = 0.001)。対照的に、本研究ではIBSとHCの間でMDのアドヒアランスに差はみられなかった。これは、研究集団や標準的な食事の違いによるものかもしれない。さらに、Agakidisら15は6〜18歳の小児を対象としており、Zitoら14の研究では若年層でのみMDのアドヒアランスとIBSとの間に有意な関連が認められたが、我々の研究では成人だけを対象としており、年齢による層別化は行われなかった。これらの研究では、IBS患者は症状を悪化させるMD食品の摂取が少なかった可能性があるが、これらの研究ではMDのアドヒアランスとGI症状との関連は評価されていない。
より最近の2021年には、Altomareら16人がイタリアのローマでパイロット研究を実施し、IBS参加者28人とHC21人の間で食習慣、IBS症状、腸内細菌叢を比較した。この研究では、IBS患者はHCに比べてMDアドヒアランススコアが低いことが明らかになった。MDアドヒアランスとIBS症状である腹痛や鼓腸との関連はみられなかった。IBS患者において、特異的な微生物バイオマーカーが、栄養摂取の変化と適切さについて検出された。これらの結果は、MDのアドヒアランスはIBS症状と関連しないという我々の所見と一致した。しかし、この研究は28人のIBS患者を対象とした小規模なものであり、われわれの大規模研究に比べればはるかに小規模であった。
同様に、本研究では、症状修飾型MDを遵守しているIBS被験者は、Faecalitalea属、Intestinibacter属、Streptococcus属など、潜在的に炎症性、病原性、ガス産生性のある微生物の存在量が少なく28, 29, 30、Firmicutes門の抗炎症性Holdemanella属31の存在量が多いことが示された。これらの予備的知見は、症状修飾型MDがマイクロバイオームの有益な変化と関連している可能性を示唆している。しかし、16S rRNA分析では微生物の組成は測定できるが機能は測定できないため、今後の研究では微生物の機能を評価すべきである。
健康的な食事であるにもかかわらず、MDがIBS症状の重症度に有益であることは、我々の研究でも文献でも示されていない。IBSの食事管理に関する先行研究では、低FODMAP食やNational Institute for Health and Care Excellenceの伝統的IBS用食事療法がIBS症状の軽減に有効であることが示されている。対照的に、MDの主な構成要素には、果物、野菜、全粒穀物、豆類が含まれるが、これらの多くは、本研究においてIBS症状の増加と関連することが示されている。IBS症状を増加させると同定されたプロMD食品は、FODMAPの量が多いこととも関連している。したがって、標準的なMDに含まれるこれらの成分は、IBSにやさしい食事の一部とは見なされず、IBS症状がより重い人が耐えられる量まで減らす必要がある。同様に、食物の誘因は個人によって異なるため、一般的なMDはすべてのIBS患者に適しているとは限らず、低FODMAP食のように個別化する必要がある。
我々の研究では、IBS患者はHC患者に比べて豆類、豆類、大豆の摂取量が少なかったが、これはこれらの食品がGI症状を誘発する可能性があるためと考えられる。IBSでは、豆類/豆類/大豆の摂取量が多いほど、IBS症状の重症度は低かったが、GI症状に関連する不安は低かった。症状の重いIBS参加者では豆類/豆類/大豆が優先的に避けられ、内臓感受性が比較的低い、あるいはガス産生腸内細菌叢が少ない参加者ではより多く摂取されていた可能性がある。しかし、IBSの症状に関する心配や不安から豆類・豆乳・大豆の摂取を減らしているわけではないようである。さらに、いくつかの抗MD食品もIBS症状の軽減と関連していた。我々は以前、IBS症状がより重いIBS患者は、より制限的な食事を摂取していることを示した13。したがって、今回の知見は、単にIBSが軽い人はより多くの種類の食品に耐えられることを示しているのかもしれない。
本研究には、先行研究と異なる長所がある。本研究は、IBS患者106人とHC108人を対象に、MD摂取量とIBS症状との関連を検討した、これまでで最大規模の研究の一つである。本研究では、すべてのIBS腸習慣サブタイプを対象とし、年齢、人種、Hospital Anxiety and Depression Scale-Anxietyなどの共変量をコントロールした。検証されたMDアドヒアランススコアを用い、個々のMD賛成・反対食品群および食品を含むMDの詳細な食事評価を行った。さらに、IBS症状は複数の有効な尺度を用いて評価した。
いくつかの限界があった。本研究は横断研究であった;したがって、患者は特定の食事介入に無作為に割り付けられたわけではなく、結果は関連を示したに過ぎず、因果関係を示したわけではない。さらに、食事はDHQ IIを用いて評価されたが、これは複数の時点ではなく過去1年間の食事の想起に依存しており、MDの生活習慣の要素を捉えていなかった。さらに、本研究の母集団はロサンゼルスを拠点としていたため、地中海沿岸の母集団と比較して平均MDスコアが低かった。さらに、我々の集団はオリーブオイルの摂取量もMD研究に比べて有意に少なかった(平均3g対55g3)。このギャップを埋めるために、我々の研究では、地中海諸国以外のMD摂取量を評価するために開発され、異なる集団における食事パターンの違いを説明するMEDスコアも含めた。しかし、我々の集団は、地中海諸国の人々とは異なるMDを摂取している可能性がある。
要約すると、標準的なMDは健康的な食事であるが、IBS患者においてMDの遵守率はHCと比較して高くはなく、IBS症状の軽重とも関連していないことが示された。特定のプロMD食品は、おそらくFODMAPを多く含むため、症状の増加と関連していた。IBSの症状が軽い患者は食事療法をより自由に行えるかもしれないが、症状が重い患者は症状を軽くするために特定の抗MD食品を制限する必要があるかもしれない。我々の知見は、IBS症状の重症度を軽減するためには、標準的なMDではなく、IBS修正MDを研究研究や臨床で考慮すべきことを示唆している。
謝辞
本論文にご協力いただいたUCLA Goodman-Luskin Microbiome Center Microbiome Core、Biorepository Core、Integrative Biostats and Bioinformatics Core、Clinical Studies and Database Coreに謝意を表します。
CRediT執筆者の貢献
Ellie Ying Chen医学博士(概念化: リード;方法論: 同等、可視化: 執筆-原案: 執筆-原案:リード;執筆-校閲・編集:リード: リード)
Swapna Mahurkar-Joshi(形式分析: リード;方法論: 同等;検証: リード;可視化: 同等;執筆 - 原案: 執筆 - 原案: サポート; 執筆 - 査読 & 編集: 執筆-原案:支持、執筆-校閲・編集:支持)
Cathy Liu (データキュレーション: リード;方法論: 執筆-レビューと編集: サポート)
Nancee Jaffe (概念化: 支援;方法論: 同等; 執筆 - レビューと編集: サポート)
ジェニファー・ラバス(形式分析: 支援;資金獲得: 同等;方法論: 同等;検証: 執筆 - 査読と編集: 執筆-校閲・編集:支持)
ティエン・ドン(形式分析: 支持;方法論: 同等;執筆-原案: 支持;執筆-校閲・編集: 支援)
Arpana Gupta (資金獲得: 同等; 執筆 - 査読 & 編集: 助手)
シュラヴィア・パテル(可視化: 支援; 原案執筆: 執筆-原案作成:支援、執筆-校閲・編集:支援: 執筆-校閲・編集:支援)
Emeran A. Mayer (資金獲得: 同等; 執筆 - 査読 & 編集: 助手)
Lin Chang (概念化: リード;方法論: 同等、監修: 執筆 - 査読と編集: 執筆-校閲・編集:リード)
補足方法
過敏性腸症候群症状関連質問票
腸症状質問票
Bowel Symptom Questionnaire1(腸症状質問票)は、ローマIBS症状とIBS症状の重症度を評価する質問を含む自己報告式の評価である。腹痛、腹部膨満感、全体的な症状の重症度は、0~20の数値尺度を用いて測定される。
過敏性腸症候群重症度評価システム
過敏性腸症候群重症度評価システム2 は、腹痛の頻度と重症度、腹部膨満感の重症度、腸習慣への不満、IBSによる日常生活への支障を5つのカテゴリーごとに0~100のスコアで評価する有効な尺度である。過敏性腸症候群重症度評価システムの総スコアは、これらのカテゴリーの合計であり、総スコアの範囲は0~500である。
心理症状評価
内臓感覚指数
内臓過敏性指標3,4は、IBS患者の消化器症状特有の不安を測定するために用いられる15項目の質問票である。各項目は0~5で採点され、0は強くそう思わない、5は強くそう思うである。総スコアは0~75の範囲で、0は消化器症状特異的不安なし、75は重度の消化器症状特異的不安を意味する。
病院不安・抑うつ尺度
Hospital Anxiety and Depression Scale5は14項目の自己評価尺度であり、非精神医学的環境における不安および抑うつの現在の状態を評価するためにデザインされている。項目のうち7項目は不安に関するもので、他の7項目は抑うつに関するものである。各項目は0~3点で採点される。不安と抑うつの合計得点はともに0~21点で、0~7点が正常、8~10点が境界域、11~21点がおそらく臨床的不安または抑うつである。
食事評価
食事歴質問票II
DHQ II6は自記式の食物摂取頻度調査票である。過去12ヵ月の食事回想に基づいて、134の食品項目の頻度と量、および8つの栄養補助食品の質問項目が測定される。DHQ IIから得られた食品群別摂取量推定値(グラム/日)を含む男女別の食事データは、Diet∗Calcソフトウェアを用いて分析される。
代替地中海指標
Alternate Mediterranean Index7スコアには、MDに特徴的な9つの食事構成要素が含まれる。これは集団における食事パターンの違いを考慮したもので、各項目は集団の中央値との比較に基づいて採点される。Alternate Mediterranean Indexスコアは、炎症性バイオマーカーの濃度が有意に低いことと関連している。Alternate Mediterranean Indexスコアの構成要素は補足表1に示されている。スコアは0-9の範囲であり、低順守の三分位は0-3、中順守の三分位は4-6、高順守の三分位は7-9である。
地中海食アドヒアランス・スクリーナー
MEDAS8スコアは、Prevención con Dieta Mediterránea (PREDIMED)研究のMDアドヒアランス評価用に開発されたもので、心血管疾患のリスクが高い参加者が、エクストラバージンオリーブオイルとナッツを多く含むMDを遵守した場合、脂肪を減らした食事を遵守した場合と比較して、そのリスクを低下させることができたことを示した9。MEDASスコアが高いほど、高比重リポ蛋白/コレステロールが高く、肥満度、ウエスト周囲径、トリグリセリド、トリグリセリド/高比重リポ蛋白比、空腹時グルコース、コレステロール/高比重リポ蛋白/コレステロール比が低かった。MEDASスコアの構成要素と計算は補足表2にある。MEDASスコアの最大値は14であったが、DHQの項目をMEDASスコアに変換する際、DHQからソフリット摂取量を変換することができなかったため、我々の集団における最大値は13であった。先行研究では、MD食の遵守が良好または非常に良好であることは、MEDASスコアが10点以上であることと相関していた。
代替健康食指数-2010
Alternative Healthy Eating Indexは、慢性疾患を予測する11の食品群と栄養素についてそれぞれ10点満点で、最高得点は110点である。Alternative Healthy Eating Indexのスコアが高いほど、主要な慢性疾患である冠動脈性心疾患、糖尿病、脳卒中のリスクが低いことが示されている10,11。Alternative Healthy Eating Index-2010のスコアの構成要素は補足表3にある。
空間的部分最小二乗モデル構築のためのモデル仕様とチューニングパラメータ
mixOmics Rパッケージ13に実装されているスパース偏最小二乗法(sPLS-R)回帰12を使用して、抗MD食品および親MD食品の食事摂取量とIBS症状の重症度測定値との関係を決定した。この潜在変数アプローチは、データセット間の共分散を最大化するLASSOペナルティによるデータ統合と変数選択を同時に使用する(すなわち、食事または症状のプロファイルまたはパターンを反映するデータタイプの線形結合)。結果の可視化は、各プロファイルへの各変数の寄与を反映するローディング・プロットの形で提供され、最も高いローディングを持つ変数が、導出されたプロファイルに最も高い影響力を持つ。さらに、マッチしたプロファイルの変数間のピアソン相関係数を示すクラスタ・イメージ・マップが提供されます。クラスタ・イメージ・マップの一部として、各行/列が階層的クラスタリング法に基づいてどのようにクラスタリングするかを描写するために、軸に沿ってデンドログラムが使用されます。
チューニングパラメータ(すなわち、選択する食事変数[keepX]とIBS症状変数[keepY]の成分数と変数数)は、mixOmics Rパッケージの "tune.spls "関数を用いてチューニングした13。チューニング関数の出力に基づき、最適なコンポーネント数として2つのコンポーネントが選択され、最適なkeepX変数数として9つの食事変数が選択され、すべての症状変数がkeepY変数として含まれた。モデルは、両方のデータセットから、サンプル間で高い正または負の相関を持つ変数のサブセットを選択するために、"回帰 "モードで "spls "関数を使用して、チューニング・パラメータを使用してトレーニングされた。食事と症状シグネチャーの相関を評価するため、ピアソン相関を実施した。性能は、"perf "関数を使用し、5 回と 10 回の繰り返しによる M 回クロスバリデーションで評価した。
部分最小二乗法(PLS)のような多変量モデルは、予測変数および/または反応変数が複数存在する状況に適している。主成分分析と異なり、PLS モデルは、相関の高い特徴に対してよりロバストである。さらに、sPLSモデルは、"lasso" ペナルティ化を使用します。これは、"重要でない "特徴の係数を強制的にゼロにし、モデルからそれらを効果的に除去し、よりよい特徴選択を助けます。これは、より良い特徴選択を助けます。その結果、よりシンプルで解釈しやすいモデルになります。予測因子内の相関構造をテストするために、ピアソン相関係数を使用して、選択された特徴における親MD食品と反MD食品の間に負の相関があるかどうかをテストした。プロMD食品(カンタロープ、ニンジンジュース、グレープフルーツ、サツマイモ、オレンジ/ミカン/クレメンタイン)の消費量の増加とIBS症状、またはアンチMD食品の消費量の減少との間に観察された関係を説明できるような、プロMD食品とアンチMD食品の間の顕著な負の相関は見つからなかった。
ダウンロード 高解像度画像ダウンロード(159KB)
ダウンロード フルサイズ画像のダウンロード
補足図1. sPLSモデルの食事変数とIBS症状変数の負荷量プロット。1成分モデルと2成分モデルの性能を検定するためにsPLSモデルをチューニングした結果、1成分システムの方がより良い性能(すなわち、地中海食項目とIBS症状との間のより高い相関)を示した。この図は、食品項目とIBS症状との有意な関連についてsPLSモデルによって選択された変数の負荷量を示している。横棒グラフは負荷ベクトルを可視化し、各棒の長さは特徴の負荷重み(重要度)に対応する。
補足表1. 代替地中海式ダイエットのスコア構成要素と採点基準
食品群 含まれる食品 1点の基準
野菜類 ジャガイモを除くすべての野菜類 摂取量の中央値(1食/日)以上
豆類 豆腐、いんげん豆、エンドウ豆、豆類 摂取量の中央値より多い(1食/日)
果物 すべての果物およびジュース類 摂取量(1日1サービング)中央値以上
ナッツ類 ナッツ、ピーナッツバター 摂取量(1日当たり)中央値より多い
全粒穀物 全粒穀物の調理済みシリアル、調理済みシリアル、クラッカー、黒パン、玄米、その他の穀物、小麦胚芽、ふすま、ポップコーン 摂取量(1日1サービングあたり)の中央値より多いもの
赤肉および加工肉 ホットドッグ、惣菜肉、ベーコン、ハンバーガー、牛肉 摂取量の中央値未満(1日1サービング)
魚 魚、エビ、パン粉をつけた魚 摂取量(1日当たり)中央値より多い
一価不飽和脂肪と飽和脂肪の比率 - 摂取量の中央値より多い(1食/日)
エタノール ワイン、ビール、「ライト」ビール、酒類 女性:5~25 g/日
男性:10-50g/日
補足表2. 地中海食アドヒアランス・スクリーナーの得点構成要素と得点基準
食品と摂取頻度 1ポイントの基準
1.
主な調理用脂肪としてオリーブ油を使用していますか?
はい
2.
1日にどれくらいのオリーブオイルを摂取しますか(炒め物、サラダ、外食を含む)?
大さじ4杯以上
3.
野菜は1日に何皿食べますか(1皿=200g、おかずは半皿とみなす)。
2人前以上(少なくとも1人前は生かサラダで食べる)
4.
果物(天然果汁を含む)を1日に何個食べますか?
3個以上
5.
赤身肉、ハンバーグ、肉製品(ハム、ソーセージなど)を1日に何皿食べますか(1皿=100~150g)。
1人前未満
6.
バター、マーガリン、生クリームを1日に何皿食べますか?
1個未満
7.
甘い/炭酸飲料を1日に何本飲みますか?
1本未満
8.
週にワインをどのくらい飲みますか?
7杯以上
9.
週に豆類を何皿食べますか? 1皿=150g
3皿以上
10.
魚介類は週に何皿食べますか(1皿:魚100~150g、貝類4~5個、200g)
3 以上
11.
週に何回、ケーキ、クッキー、ビスケット、カスタードなどの市販のお菓子やペストリーを食べますか?
3回未満
12.
ナッツ類(ピーナッツを含む)を週に何皿食べますか(1皿=30g)?
3個以上
13.
あなたは、子牛肉、豚肉、ハンバーガー、ソーセージの代わりに、鶏肉、七面鳥肉、ウサギ肉を好んで食べますか。
はい
14.
野菜、パスタ、ライスなど、ソフリット(トマトとタマネギ、リーク、ニンニクをオリーブオイルで煮込んだソース)で味付けした料理を週に何回食べますか?
2回以上
a
これらの基準を満たしていない場合は0点。
b
ベジタリアンは1点。
補足表3. 代替健康食指数-2010の構成要素と採点基準
構成要素 最低得点0点の基準 最高得点10点の基準
果物全体 0 ≥4 サービング/日
野菜(ジャガイモを除く) 0
食/日
全粒穀物 0
75g/日
90 g/日
赤肉と加工肉
食/日 0
ナッツと豆類 0
食/日
長鎖(ω-3)脂肪および(EPA+DHA) 0 250 mg/d
多価不飽和脂肪酸 エネルギーの10
トランス脂肪酸 エネルギーの4%以上
炭水化物および果汁
食/日 0
ナトリウム 最高十分位 最低十分位
合計 0 100
DHAはドコサヘキサエン酸、EPAはエイコサペンタエン酸、SSBは砂糖入り飲料。
補足表4. プロMD食品とアンチMD食品の全リスト
空細胞 食品
プロMD食品群
ワイン ワイン
豆類/豆類/大豆 豆類
空細胞 大豆
果物 オレンジまたはグレープジュース
空欄 その他の果物ジュース
空のセル アップルソース
空欄 リンゴ
空セル 洋ナシ
空欄 バナナ
空欄 ドライフルーツ
空セル 桃、ネクタリン、プラム
空セル ブドウ
空セル カンタロープ
空セル カンタロープ以外のメロン
空房 イチゴ
空セル オレンジ、ミカン、クレメンタイン
空セル グレープフルーツ
空欄 パイナップル
空欄 その他の果物
魚介類 サーモン、マグロ、マス
空欄 その他の魚(揚げていない
空欄 揚げていない貝類
穀類(全粒) オートミール、グリッツ、その他の調理済みシリアル
空のセル 食物繊維の多いシリアル
空 Cell 米またはその他の調理済み穀類
空のセル 全粒粉のパン
ピーナッツまたはナッツバター
空房 ピーナッツ、クルミ、種子、その他のナッツ類
オリーブ油 オリーブ油
鶏肉 トルコまたは鶏のコールドカット
空のセル 鶏ひき肉または七面鳥
空のセル 七面鳥のロースト
鶏肉ミックス
鶏肉
野菜(コーン・ポテトを除く) ニンジンジュース
空 胞 トマトジュースまたはその他の野菜ジュース
空のセル 青菜
空のセル 生野菜
空っぽのニンジン
空のセル いんげん
空っぽのセル エンドウ豆
空っぽのセル ブロッコリー
空っぽのセル カリフラワーまたは芽キャベツ
空セル アスパラガス
空セル 冬カボチャ
空っぽのセル ミックスベジタブル
空っぽのセル 玉ねぎ
空セル ピーマン
空のセル フレッシュトマト
空セル レタスサラダ
空欄 サツマイモ
空のセル その他の野菜
水分 水分
抗MD食品群
アルコール(ワインを除く) ビール
空のセル 酒類/ミックス飲料
加工肉・赤身肉 加工肉
空細胞 牛肉
空欄 豚肉または牛肉のスペアリブ
空のセル 豚肉
加糖ソーダ
空欄 スポーツドリンク/エナジードリンク
空欄 食品への砂糖添加
焼き菓子、デザート、スイーツ フローズンヨーグルト、シャーベット、アイス
空欄 焼き菓子・デザート
空欄 チョコレート菓子
空欄 その他の菓子
バター/マーガリン/クリーム バター、マーガリン、クリーム
揚げ物 フライドポテト
空欄 貝のフライ
空欄 魚のフライ
ポテトチップス
MD、地中海食
参考文献
1
C. Davis, J. Bryan, J. Hodgson, et al.
地中海食の定義;文献レビュー
栄養素, 7 (2015), pp.
CrossRefScopusで見るGoogle Scholarで見る
2
M. Dinu, G. Pagliai, A. Casini, et al.
地中海食と複数の健康アウトカム:観察研究と無作為化試験のメタアナリシスの包括的レビュー
Eur J Clin Nutr, 72 (2018), 30-43頁
CrossRefScopusで見るGoogle Scholarで見る
3
R. Estruch, E. Ros, J. Salas-Salvado, et al.
エクストラバージンオリーブオイルまたはナッツを補充した地中海食による心血管疾患の一次予防
N Engl J Med, 378 (2018), p. e34
Scopusで見るGoogle Scholar
4
M.P. Mena, E. Sacanella, M. Vazquez-Agell, et al.
循環免疫細胞活性化の抑制:地中海食の分子的抗炎症効果
Am J Clin Nutr, 89 (2008), pp.
CrossRefGoogle Scholar
5
F. De Filippis, N. Pellegrini, L. Vannini, et al.
地中海食の高水準の遵守は腸内細菌叢と関連メタボロームに有益な影響を与える
Gut, 65 (2016), 1812-1821頁
CrossRefGoogle Scholar
6
M. Cariello, A. Contursi, R. Gadeleta, et al.
アプリア産エキストラバージンオリーブオイルと腸炎症
栄養素, 12 (2020), p. 1084
CrossRefScopusで見るGoogle Scholarで見る
7
C. Parisio, E. Lucarini, L. Micheli, et al.
ラット胃腸障害における腹痛緩和のためのフェノール化合物の天然供給源としてのエキストラバージンオリーブオイルと関連副産物(Olea europaea L.)
Food Funct, 11 (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
8
O. Palsson, W. Whitehead, H. Tornblom, et al.
米国、カナダ、英国の成人におけるRome IV機能性腸疾患の有病率
Gastroenterology, 158 (2020), pp.1262-1273
スコープで見るGoogle Scholar
9
E.J.ヴィデロック、L.チャン
過敏性腸症候群の病態に関する最新の知見
Gastroenterol Clin North Am, 50 (2021), 505-522頁
PDFを見る記事を見るScopusGoogle Scholarで見る
10
W.D.チェー
食物:過敏性腸症候群患者における健康と病気へのメインコース
Am J Gastroenterol, 111 (2016), pp.366-371
CrossRefView in ScopusGoogle Scholar
11
C.J.ブラック、H.M.スタウダッハー、A.C.フォード
過敏性腸症候群における低FODMAP食の有効性:系統的レビューとネットワークメタ解析
Gut, 71 (2022), pp.1117-1126
CrossRefScopusで見るGoogle Scholarで見る
12
M. Bellini、S. Tonarelli、A. Nagy、他。
低FODMAP食:エビデンス、疑問、そして希望
栄養素, 12 (2020), p. 148
CrossRefScopusで表示Google Scholar
13
A. Lenhart, T. Dong, S. Joshi, et al.
過敏性腸症候群患者における排除食が症状の重症度と腸内細菌叢に及ぼす影響
Clin Gastroenterol Hepatol, 20 (2022), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
14
F. Zito, B. Polese, L. Vozella, et al.
地中海食の良好な遵守は胃腸症状を予防できる:南イタリアからの調査
World J Gastrointest Pharmacol Ther, 7 (2016), pp.
CrossRefGoogle Scholar
15
C. Agakidis, E. Kotzakioufali, D. Petridis, et al.
地中海食の遵守は、小児および青年における機能性胃腸障害の有病率の低下と関連する
栄養素, 11 (2019), p. 1283
クロスリーフScopusで表示Google Scholar
16
A. Altomare, F. Del Chierico, G. Rocchi, et al.
過敏性腸症候群患者における食習慣と糞便微生物叢組成との関連:パイロット研究
栄養素, 13 (2021), p. 1479
CrossRefView in ScopusGoogle Scholar
17
B. Lacy、F. Mearin、L. Chang、他。
腸疾患
Gastroenterology, 150 (2016), pp.
スコープで見るGoogle Scholar
18
G. Longstreth、W.G. Thompson、W.D. Chey、他。
機能性腸疾患
胃腸病学、130(2016)、1480-1491頁
Google Scholar
19
R. Addante, B. Naliboff, W. Shih, et al.
過敏性腸症候群患者における健康関連QOLの予測因子と健常人との比較
J Clin Gastroenterol, 53 (2019), pp.e142-e149
CrossRefGoogle Scholar
20
C.Y.フランシス、J.モリス、P.J.ウォーウェル
過敏性腸症候群重症度スコアリングシステム:過敏性腸症候群とその経過をモニタリングする簡便な方法
Aliment Pharmacol Ther, 11 (1997), pp.395-402
CrossRefScopusで見るGoogle Scholarで見る
21
J.S. Labus, R. Bolus, L. Chang, et al.
内臓感覚指数:消化器症状特異的不安尺度の開発と検証
Aliment Pharmacol Ther, 20 (2004), pp.
スコープで見るGoogle Scholar
22
A.S.ジグモンド、R.P.スナイス
病院不安・抑うつ尺度
Acta Psychiatr Scand, 67 (1983), 361-370ページ
CrossRefView in ScopusGoogle Scholar
23
食事歴質問票、バージョン2.0。2010. https://epi.grants.cancer.gov/dhq2/. 2022年4月20日閲覧。
Google Scholar
24
T.T. Fung, M.O.L. McCullough, P.K. Newby, et al.
食事品質スコアと炎症および内皮機能不全マーカーの血漿濃度
Am J Clin Nutr, 82 (2005), pp.
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
25
S.E. Chiuve, T.T. Fung, E.B. Rimm, et al.
食事の代替指標はともに慢性疾患のリスクを強く予測する
J Nutr, 142 (2012), pp.
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
26
N. Shivappa, S.E. Steck, T.G. Hurley, et al.
文献に基づく集団ベースの食事性炎症指数の設計と開発
Public Health Nutr, 17 (2014), pp.1689-1696
スコープで見るGoogle Scholar
27
食事歴質問票II(DHQ II): Diet∗Calc Software. 2012 https://epi.grants.cancer.gov/dhq2/dietcalc/. 2022年4月20日アクセス
Google Scholar
28
N.O.カアコウシュ
ヒト宿主におけるうどんこ病菌の役割に関する洞察
Front Cell Infect Microbiol, 5 (2015), p. 84
スコープで見るGoogle Scholar
29
W. Krzysciak、K.K. Pluskwa、A. Jurczak、他。
レンサ球菌属の病原性
Eur J Clin Microbiol Infect Dis, 32 (2013), pp.1361-1376
CrossRefScopusで表示Google Scholarで表示
30
J.D.フォーブス、C.チェン、N.C.ノックス、他。
免疫介在性炎症性疾患における腸内細菌叢の比較研究:共通のディスバイオージスは存在するか
マイクロバイオーム, 6 (2018)
グーグル・スカラー
31
J. Pujo, C. Petitfils, P. Le Faouder, et al.
細菌由来の長鎖脂肪酸は大腸炎において抗炎症作用を示す
Gut, 70 (2021), 1088-1097頁
CrossRefScopusで見るGoogle Scholarで見る
32
S.L. Eswaran、W.D. Chey、T. Han-Markey、他。
米国の成人IBS-D患者における低FODMAP食と修正NICEガイドラインの比較ランダム化比較試験
Am J Gastroenterol, 111 (2016), pp.
CrossRefView in ScopusGoogle Scholar
参考文献
1
R. Addante, B. Naliboff, W. Shih, et al.
健常人と比較した過敏性腸症候群患者における健康関連QOLの予測因子
J Clin Gastroenterol, 53 (2019), pp.e142-e149
CrossRefGoogle Scholar
2
C.Y.フランシス、J.モリス、P.J.ウォーウェル
過敏性腸症候群重症度スコアリングシステム:過敏性腸症候群とその経過をモニタリングする簡便な方法
Aliment Pharmacol Ther, 11 (1997), pp.395-402
CrossRefScopusで見るGoogle Scholarで見る
3
J.S. Labus, R. Bolus, L. Chang, et al.
内臓感覚指数:消化器症状特異的不安尺度の開発と検証
Aliment Pharmacol Ther, 20 (2004), pp.
スコープで見るGoogle Scholar
4
T. 西郷俊之、田山淳、浜口俊之、他。
過敏性腸症候群における胃腸特異的不安:大学生を対象とした内臓感受性指数日本語版の検証
Biopsychosoc Med, 8 (2014), p. 10
スコープで見るGoogle Scholar
5
A.S.ジグモンド、R.P.スナイス
病院不安・抑うつ尺度
Acta Psychiatr Scand, 67 (1983), 361-370頁
CrossRefView in ScopusGoogle Scholar
6
食事歴質問票、バージョン2.0。2010
(2010)
https://epi.grants.cancer.gov/dhq2/, 2022年4月20日アクセス
7
T.T. Fung, M.L. McCullough, P.K. Newby, et al.
食事品質スコアと炎症および内皮機能不全マーカーの血漿中濃度
Am J Clin Nutr, 82 (2005), pp.163-173
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
8
H. Schroder, M. Fito, R. Estruch, et al.
スペインの高齢男女における地中海食のアドヒアランスの評価には、短いスクリーナーが有効である。
J Nutr, 141 (2011), pp.
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
9
R. Estruch, E. Ros, J. Salas-Salvado, et al.
エクストラバージンオリーブオイルまたはナッツを添加した地中海食による心血管疾患の一次予防
N Engl J Med, 378 (2018), p. e34
Scopusで見るGoogle Scholar
10
S.F. Chiuve、T.T. Fung、E.B. Rimm、他。
代替的な食事指標はともに慢性疾患のリスクを強く予測する
J Nutr, 142 (2012), pp.
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
11
Z.L.シャン、Y.リー、M.Y.バーデン、他。
健康的な食事パターンと心血管疾患リスクの関連性
JAMA Intern Med, 180 (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
12
mixOmics: オミックスデータ統合プロジェクト。Rパッケージバージョン6.1.1 (2016)
https://CRAN.R-project.org/package=mixOmics, 2023年1月15日アクセス
13
K.A. Le Cao、I. Gonzalez、S. Dejean
integrOmics:2つのオミックスデータセット間の関係を解明するためのRパッケージ
バイオインフォマティクス, 25 (2009), pp.
CrossRefScopusで見るGoogle Scholarで見る
引用者 (0)
利益相反 これらの著者は以下を公表している: Emeran Mayerは、Danone、Axial Biotherapeutics、Amare、Mahana Therapeutics、Pendulum、Bloom Biosciences、Seed、およびAPC Microbiome Irelandの科学顧問委員会メンバーである。Lin ChangはFood Marbleのコンサルタントであり、Food MarbleおよびModifyHealthのストックオプションを保有している。残りの著者は利害関係を公表していない。
資金提供 Jennifer LabusはR01 HD076756の支援を受けている。Arpana GuptaはK23 DK106528、R03 DK121025、ULTR001881の支援を受けている。Emeran A. MayerはR01 DK048351の支援を受けている。
© 2023 by the AGA Institute. 発行:エルゼビア社。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
PDF
ヘルプ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
