αシヌクレインの凝集を促進する腸内細菌代謝経路を発見
ACS出版物 最も信頼されている 最も引用されている 最も読まれている
広告
記事に戻るasaparticlenext
ジャーナルロゴ
eアラートを受け取る
αシヌクレインの凝集を促進する腸内細菌代謝経路を発見
https://pubs.acs.org/doi/10.1021/acschembio.4c00095
リゼット・オルティス・デ・オラ、ジュリア・M・バルサモ、カイリー・S・上田、エリザベス・N・ベス*。
引用 ACS Chem. Biol. 2024, XXXX, XXX, XXX-XXX
出版日:2024年3月22日
https://doi.org/10.1021/acschembio.4c00095
© 2024 The Authors. アメリカ化学会発行。この出版物は
cc-by-nc-nd 4.0に従っています。
オープンアクセス
記事閲覧
アルトメトリック
2
引用
これらの指標について学ぶ
共有
追加する
輸出
RIS
PDF (3 MB)
サポート情報 (1) "サポート情報
SUBJECTS:凝集,アミン,アニオン,バクテリア,もっと見る
要旨
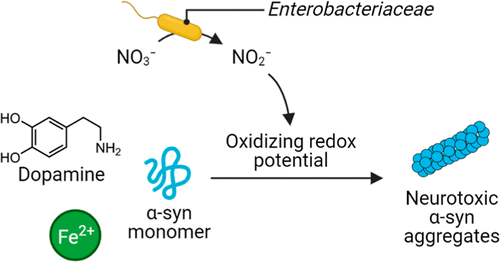
パーキンソン病(PD)の病因は、中脳ドーパミン作動性ニューロンにおけるα-シヌクレイン(α-syn)タンパク質の凝集と蓄積と関連している。新たな証拠によると、パーキンソン病の特定のサブタイプでは、α-syn凝集体は腸で生じ、その後脳に広がる。しかし、腸でのα-syn凝集を引き起こすメカニズムは不明なままである。脳では、α-synの凝集は酸化ドーパミンによって誘導される。このようなメカニズムは、体内のドーパミン・リザーバーの46%を擁するニッチである消化管では、まだ解明されていない。ここでは、ヒトの腸内細菌叢に広く存在する腸内細菌科がα-synの凝集を誘導することを報告する。より具体的には、我々のin vitroデータから、大腸菌K-12による硝酸塩の呼吸が、Fe2+をFe3+に酸化させる亜硝酸塩の産生をもたらし、酸化還元電位を形成することが示された。この酸化的条件下で、ドーパミン由来のキノンとα-syn凝集体の形成が可能になった。硝酸塩ではなく亜硝酸塩を腸内分泌細胞であるSTC-1細胞に暴露すると、腸管を覆っているSTC-1細胞にネイティブに発現しているα-synの凝集が誘導された。これらの知見を総合すると、細菌による硝酸塩の還元が、腸管のα-syn凝集の開始に重要である可能性が示された。
この出版物は
cc-by-nc-nd 4.0.
ccライセンス
ライセンス
ncライセンス
NDライセンス
はじめに
ジャンプ
パーキンソン病(PD)は長い間脳に発症すると考えられてきたが、PDのサブタイプの中には消化管に発症するものがあることを示す証拠が蓄積されている(1,2)。(1,2)PDは、α-シヌクレイン(α-syn)タンパク質の凝集体が、脳の運動制御部位である黒質のドーパミン作動性ニューロンに蓄積することによって生じる運動障害を特徴とするが(3)、α-synの発現は脳に限定されるものではない。 α-synは腸管内分泌細胞(EEC)(4)や、消化管を支配する腸管ニューロンによって腸管壁粘膜内にも発現している(5)。(5)特発性PD患者では、運動症状が出現する少なくとも8年前に、α-syn凝集体が消化管組織に蓄積する(6)。(6)これらのタンパク質凝集体はその後、プリオンのような様式で、腸から脳へ、これらの器官をつなぐ迷走神経を介して伝播すると考えられている。(7,8)腸管α-syn凝集体が脳における神経変性の前兆であるという証拠がある一方で、腸管α-syn凝集を引き起こす分子レベルの機序はほとんど解明されていない。
α-syn凝集体の発生とPDの進行に微生物が関与していることを示唆する証拠がいくつかある。PD患者における腸内細菌叢は、非疾患の対照群と比べて異なっている(9-13)。(9-13)この腸内細菌叢異常は通性嫌気性腸内細菌科の濃縮によって特徴づけられることが多く、その腸内細菌叢の豊富さはPD患者の運動機能障害の重症度と正の相関を示す(9,14-16)。(9,14-16)腸内細菌叢異常がPD発症の原因なのか結果なのかについてはまだ議論の余地があるが、マウスモデルを用いた研究では、この疾患の病因に腸内細菌叢が関与していることが示唆されている。α-synを過剰発現させた無菌マウスにおいて、PD患者の糞便サンプルを用いた腸管コロニー形成は、疾患のない対照群の糞便サンプルを用いたコロニー形成と比較して、運動障害と脳病理を悪化させた(17)。(17)さらに、腸内細菌の大発生(黄砂誘発性大腸炎)(18,19)に伴って腸管にα-synが蓄積し、α-syn過剰発現マウスの脳にもこのタンパク質が蓄積した(20,21)。(20,21)
消化管でのα-syn凝集を誘導する特異的な腸内細菌の生化学的プロセスを同定するために、我々は脳でのα-syn凝集の特徴的なメカニズムについての手がかりを探した。脳のドーパミン作動性ニューロンでは、鉄とドーパミンが毒性のペアを形成し、神経α-synの凝集を引き起こすことがある(図1)。ドーパミン作動性ニューロンにおける加齢に関連した鉄の蓄積は酸化ストレスを引き起こし、その結果、不安定な細胞質第一鉄(Fe2+)が第二鉄(Fe3+)に酸化される(22)。 ドーパミン作動性ニューロンに豊富に存在する細胞質ドーパミンは、Fe3+によって容易に酸化され、反応性の高いオルトキノンになる(23)。(23)ドパミン由来のキノンは神経α-synと相互作用してミスフォールディングを引き起こし、その結果、有毒なα-synオリゴマーが生じる。(24)
図1
図1. 脳ドパミン作動性ニューロンでFe2+がFe3+に酸化されると、ドーパミンはオルトキノンに酸化され、α-synのミスフォールディングと凝集を引き起こす(図はBioRender.comで作成、契約番号AA246MEBQ8)。
脳と同様、消化管にもドーパミンと鉄が存在し、α-synが発現している。体内のドーパミンプールのうち、46%が消化管に含まれており(25)、腸内細菌叢は腸内組織のドーパミン濃度を上昇させる役割を担っている(26)。(26)ドーパミンの酸化を仲介する鉄は、腸管内腔に高濃度(最大25mM)で存在し、食餌性鉄の増加は腸管細胞内の鉄濃度を上昇させる。(27)非病的な消化管では、不安定な細胞質鉄の酸化状態は主にFe2+であるが(28)、酸化ストレスがかかるとFe3+の濃度が上昇し、図1に示すようにドーパミンを酸化する可能性がある。腸管上皮におけるドーパミンと鉄の濃縮、および腸管EECと腸管ニューロンによるα-synの発現により、α-synの凝集が消化管で起こる準備が整った。われわれは、鉄を介したドーパミンの酸化とそれに続くα-syn凝集を誘導する酸化物質を供給する腸内細菌の生化学的プロセスを同定しようとした。
消化管における酸化ストレスを誘導する酸化還元電位の変化は、一般的に宿主の代謝過程と関連しているが、(29-33)腸内細菌もその環境の酸化還元電位を調節する(34)。(34)ここで我々は、大腸菌(腸内細菌科の代表的な腸内細菌(18))が酸化還元電位の環境を作り出す能力が、鉄とドーパミンを刺激してα-syn凝集を引き起こす刺激であることを明らかにした。我々は、腸内細菌科細菌の硝酸塩異化代謝の過程で生成される酸化剤であり、細菌におけるFe2+からFe3+への酸化を媒介する亜硝酸塩(18,35-37)が、α-syn凝集をもたらす酸化反応のカスケードを刺激することを同定した。細菌培養とα-syn発現腸上皮細胞の両方を用いたin vitro実験の結果は、腸内細菌叢がPDの病因に影響を及ぼす可能性のある新しい分子メカニズムを示唆している。
研究結果
ジャンプ
大腸菌の硝酸塩呼吸が酸化還元電位の環境を作り出す
PDの重症度とPD患者の腸内細菌叢における腸内細菌科細菌の多さとの間に正の相関があることから(9)、この細菌群の代謝能力がα-synの病原性凝集に関与しているかどうかを明らかにしようとした。特に、腸内細菌科細菌が嫌気性硝酸塩呼吸を行い、その結果、酸化物質である亜硝酸塩が産生されることに興味をそそられた(18,38,39)。(18,38,39)我々は、硝酸塩呼吸を行う腸内細菌科細菌によって酸化還元電位が生じ、それによって、主にFe2+(腸内細菌叢の還元性条件下では優勢であると考えられている(40))からFe3+(ドーパミンを酸化し、α-synのミスフォールディングと凝集を誘導する可能性がある)へと、不安定な鉄の相対量のシフトが刺激されるだろうと仮定した。
我々の仮説を検証するため、大腸菌K-12を嫌気培養し、発酵と呼吸の2種類の代謝を可能にした。発酵条件は、Fe2+(500μM)とグルコース(20mM)を唯一の炭素源として添加し、硝酸塩を含まない最小栄養培地(mM9-NO3と呼ばれる培地)で大腸菌K-12を培養することで作り出した。硝酸塩呼吸の条件は、同じ培地に硝酸塩(50 mM、mM9+NO3)を添加することで調製した。図2aに示すように、硝酸塩を添加すると、培養12時間後に細菌増殖が1.6倍に増加した。硝酸塩呼吸は発酵代謝よりもエネルギー的に有利であるため、(41)腸内硝酸塩濃度が高いほど腸内細菌叢の腸内細菌数が増加する(18)。(18)
図2
図2. 大腸菌の硝酸塩還元により酸化剤である亜硝酸塩が生成され、細菌環境に酸化還元電位が生じ、Fe3+の相対量が増加する。大腸菌K-12を、硝酸塩添加(mM9+NO3)または無添加(mM9-NO3)のミネラル培地で培養した。 a)増殖は600nmの光学密度(OD600)で測定した。(b) 細菌培養物の酸化還元電位(ORP)を、電極を用いて無菌培地に対する培地中で測定した。(c) 硝酸塩を添加した培養液中の亜硝酸塩を、Griess assayを用いて定量した。(d,e) (d)硝酸塩を含まない培地(mM9-NO3)または(e)硝酸塩を添加した培地(mM9+NO3)の細菌培養において、フェロジンアッセイを用いて鉄の化学種を測定した。
大腸菌K-12培養では、細菌代謝の関数として酸化還元電位の変動も評価した。mM9-NO3中で培養した場合、(無菌対照と比較して)還元的な酸化還元電位が観察された(図2b)。指数関数的な細菌増殖の過程で観察される酸化還元電位は、還元剤である水素を産生する発酵代謝の特徴である(42)。(42)対照的に、mM9+NO3中で培養した細菌は、18時間の培養で酸化還元電位が(無菌対照に対して)着実に上昇し、最大値308.17±7.62 mVに達した(図2b)。注目すべきことに、酸化還元電位の上昇は培養液中の亜硝酸塩の蓄積を反映していた(図2c)。亜硝酸塩の酸化還元活性代謝物としての役割をさらに裏付けるものとして、亜硝酸ナトリウムを滅菌mM9培地(mM9+NO2)に添加すると、濃度依存的に酸化還元電位が上昇することが観察された(図S1)。対照的に、硝酸ナトリウム(mM9+NO3)を添加した非接種無菌培地では、溶液の酸化還元電位に有意な変化は見られなかった。これらの知見は、バクテリアの硝酸塩呼吸が亜硝酸塩の生成を通じて環境の酸化還元電位をより酸化的なものにシフトさせるという考えを支持するものである。
次に、硝酸塩呼吸がもたらす酸化還元電位が、鉄種分化のバランスをFe2+有利からFe3+有利にシフトさせるかどうかを評価した。大腸菌K-12をmM9-NO3またはmM9+NO3培地で培養し、フェロジンアッセイを用いてFe2+とFe3+の相対量を測定した(43)。(43) 還元的な酸化還元電位を与える発酵条件(mM9-NO3)では、Fe2+が優勢な鉄種であった(図2d)。逆に、バクテリアによる硝酸塩呼吸の培養条件(mM9+NO3)では、亜硝酸塩の生成に対応する酸化還元電位が鉄の酸化を促進し、Fe3+が鉄の支配的な酸化状態となった(図2e)。これらの結果から、硝酸塩の存在は大腸菌K-12の増殖を促進すると同時に、亜硝酸塩の生成に対応する酸化還元電位を作り出し、その結果、培地中の鉄の酸化状態がFe2+よりもFe3+が優勢になることが示された。
大腸菌の硝酸塩呼吸は、α-Syn凝集につながる酸化反応のカスケードを開始する
次に、大脳のドーパミン作動性ニューロンではドーパミン依存性のα-syn凝集に関与しているが、消化管では未解明である酸化反応のカスケード、すなわちα-synのミスフォールドとそれに続く凝集を引き起こすオルトキノン(44-46)を形成するFe3+を介したドーパミンの酸化反応を、細菌の硝酸塩呼吸が引き起こすかどうかを調べようとした(23,24)。(23,24)この目的のために、再び大腸菌K-12をmM9+NO3またはmM9-NO3中で定常期(14時間)まで嫌気培養したが、α-synモノマー(20μM)だけでなく、ドーパミン(500μM;それぞれmM9+NO3,+DAまたはmM9-NO3,+DA)またはそのビヒクル(それぞれmM9+NO3,-DAまたはmM9-NO3,-DA)も添加した。以前と同様に、硝酸塩反応条件下で培養した細菌は、硝酸塩の量を亜硝酸塩に還元した(図3a)。亜硝酸塩の蓄積は酸化還元電位に対応し(図3b)、硝酸塩を添加しない培養と比較してFe3+の相対量が増加するように鉄の種分化がシフトした(図3c)。亜硝酸塩が生成され、ドーパミンも存在する培養条件では、ドーパミンを添加しない条件と比較して、Fe3+の相対存在量が低くなった。この結果は、ドーパミンの酸化がFe3+の還元と結びつき、Fe2+の相対量が増加したためと考えられる。これに対応して、ドーパミンを含む培養条件では酸化還元電位が安定しなかったため、酸化還元電位を測定することはできなかった。
図3
図3. 大腸菌の硝酸呼吸は、ドーパミン依存的なキノン形成とα-syn凝集を引き起こす。大腸菌K-12野生型またはΔmoaAを、硝酸塩存在下(+NO3)または非存在下(-NO3)、ドーパミン存在下(+DA)または非存在下(-DA)で、α-synモノマーとともにmM9培地で14時間培養した。(a)亜硝酸塩(Griessアッセイを使用)、(b)無菌培地に対するORP(酸化還元電極を使用)、(c)不安定Fe3+およびFe2+(フェロジンアッセイを使用)の定量。(d-f) (d)細菌培養、(e)膜染色キノン形成(NBT染色を使用)、または(f)α-syn凝集体形成について染色したドットブロット(一次抗体としてMJFR-14抗線維α-synを用いた免疫染色を使用)の代表的な画像。(g) ドットブロットにおけるα-syn凝集体の定量。n = 3生物学的反復;バーは平均値±S.E.M.;有意性はシダックの多重比較検定による通常の一元配置ANOVAを用いて決定;および****: P < 0.0001、ns:有意ではない。
ドーパミンを含む培養では、キノンに特徴的な暗色色素の形成が観察された(図3d)。(47)キノン類を特異的に染色する酸化還元染色剤ニトロブルーテトラゾリウム(NBT)(48)により、硝酸塩還元細菌培養のドットブロットでキノン類を検出することができた(図3eおよびS2)。対照的に、図3dに描かれているように、ドーパミンを添加した発酵培養条件(mM9-NO3,+DA)では暗色色素は観察されず、Fe3+の相対量は呼吸培養条件(mM9+NO3,+DA)よりも有意に少なかった;それに応じて、NBT染色ではキノン類は検出されなかった(図3e;図S2に陽性対照を示す)。培地にドーパミンを補充しない場合、硝酸塩還元菌培養でも発酵菌培養でもキノンは検出されなかった。これらのデータは、キノン形成にはドーパミンの補充が必要であり、硝酸塩の細菌還元時に生じる酸化的条件下でドーパミン依存的なキノン形成が起こることを示している。
驚くべきことに、ドーパミン依存的キノン形成はα-syn凝集と一致していた。α-syn凝集の評価は、培養液でスポットした膜上で抗体MJFR-14を用いてα-syn凝集体を免疫染色し、ドットブロット法で行った(図3f;陽性対照を図S3に示す)。有意なことに、発酵条件下と比較して硝酸塩還元条件下では、より多量のα-syn凝集体が形成された--ただしドーパミンが存在する場合に限る(図3gおよびS3)。ドーパミン非存在下では、酸化還元電位の培養環境(mM9+NO3,-DA;図3b)はα-syn凝集を誘導するのに十分ではなかった(図3gおよびS3)。亜硝酸塩が誘発するドーパミン依存性α-syn凝集は、亜硝酸塩を細菌によって産生するのではなく、外因的に供給する生物実験でも再現された(図S4)。この知見は、検出に用いた抗体(MJFR-14または5G4)に関わらず一貫しており、後者はモノマーに対するα-syn凝集体の検出選択性を高めていた(図S5)。
次に、硝酸塩呼吸の遺伝子ノックアウトを用いて、α-syn凝集の開始における硝酸塩と亜硝酸塩の役割をさらに明らかにした。まず、硝酸還元酵素の活性部位に組み込まれ、この酵素が硝酸塩を亜硝酸塩に還元するのに必須なモリブデン補酵素(MoaA)を標的とした(49)。(49)MoaAを野生型大腸菌K-12から欠失させ、同系変異体大腸菌K-12 ΔmoaAを作製した。大腸菌K-12 ΔmoaAをmM9+NO3培地で培養すると、大腸菌K-12野生型が硝酸塩還元を行ったときのような増殖の利点は得られなかった(図S6)。さらに、大腸菌K-12 ΔmoaAは酸化還元活性のある亜硝酸塩を生成しなかった(図3a)ことから、moaAの遺伝子欠失によって硝酸塩還元が実際に阻害されたことが示された。同様に、mM9+NO3培地で培養した野生型株の培養液と比較して、酸化還元電位が著しく低いことが観察された(図3b)。大腸菌K-12 ΔmoaA培養物の酸化還元電位が低いことは、大腸菌K-12 ΔmoaAをmM9+NO3,-DAまたはmM9+NO3,+DAのいずれかで培養した場合、大腸菌K-12野生型の類似培養物と比較して、Fe3+の相対存在量が有意に減少することに対応した(図3c)。大腸菌K-12 ΔmoaAが硝酸塩を還元して培地の酸化還元電位を上昇させなければ、ドーパミンの酸化もα-synの凝集も起こらなかった(図3e-g;S2およびS3)。これらのデータを総合すると、硝酸塩の存在だけではα-syn凝集は誘導されず、亜硝酸塩を産生する細菌が、無害なトリオ──Fe2+、ドーパミン、α-synモノマー──を、有毒なα-syn凝集体を生成するトリオに変化させることが示された。
タングステートは細菌の硝酸塩還元によって誘導されるα-シンの凝集を阻害する
α-syn凝集におけるバクテリアによる硝酸塩の亜硝酸塩への還元が、α-syn凝集を引き起こすことを明らかにした後、我々はバクテリアの硝酸塩呼吸を化学的に阻害することによって、α-syn凝集を緩和することができるかどうか知りたくなった。この目的のため、腸内細菌科の硝酸還元酵素を不活性化するモリブデン酸の化学的アナログであるタングステートに注目した(19)。(19)我々は、α-synモノマー(20μM)を添加したmM9+NO3培地で定常期(14時間)まで培養した大腸菌K-12(野生型およびΔmoaA)に対するタングステン酸ナトリウム(0.5-100mM)の効果を、ドーパミンの有無にかかわらず評価した(図S7)。大腸菌K-12野生型培養では、用量反応関係が観察された:タングステン酸ナトリウムの濃度が増加すると、亜硝酸塩の産生が減少した(図4a)。
図4
図4. タングステートは細菌の硝酸塩還元を阻害することによりα-synの凝集を制限し、細菌環境の酸化還元電位を低下させる。大腸菌K-12野生型またはΔmoaAを、硝酸塩存在下(+NO3)、ドーパミン存在下(+DA)または非存在下(-DA)、およびタングステン酸ナトリウム(WO42-)の濃度を変化させた(0-100 mM)mM9培地で、α-synモノマーとともに14時間培養した。(a)亜硝酸塩(Griessアッセイを使用)、(b)無菌培地に対するORP(酸化還元電極を使用)、(c,d)不安定Fe3+およびFe2+(フェロジンアッセイを使用)の定量。(e-g)タングステン酸(0-100 mM)を添加したmM9+NO3,+DA中で培養した大腸菌K-12野生型の(e)細菌培養物、および(f)キノン形成について染色した膜(NBT染色を使用)、または(g)α-syn凝集体形成について染色したドットブロット(一次抗体としてMJFR-14抗線維α-synを用いた免疫染色を使用)の代表的な画像。(h)ドットブロットにおけるα-syn凝集体の定量。n = 3生物学的反復;バーは平均値±S.E.M.;有意性はシダックの多重比較検定を用いた通常の一元配置分散分析を用いて決定;および****: P < 0.0001, ***: P < 0.0007, **: P < 0.0026, *: P = 0.0168、ns:有意ではない。
バクテリアによる硝酸塩の亜硝酸塩への還元が、より酸化的な酸化還元電位を作り出すという我々の知見に従い、大腸菌K-12野生型(ドーパミン非存在下)の培養液にタングステン酸ナトリウムを添加し、濃度を増加させると、このプロセスが徐々に阻害され、培養液の酸化還元電位が低下することが相関した(図4b)。大腸菌K-12野生型培養液の酸化還元電位がタングステート濃度の増加とともに低下するにつれて、Fe3+の相対存在量もドーパミンを添加した培養液(図4c)およびドーパミンを添加しない培養液(図4d)で低下した。タングステン酸(0.5-50 mM)による大腸菌K-12野生型による硝酸塩還元の阻害は、培養物の可視色素沈着(図4e)およびNBT染色キノン(図4fおよびS2)の減少、ならびにα-syn凝集体の形成の減少(図4g,h;S3)に対応していた。タングステン酸濃度を0.5 mMから100 mMまで増加させると、亜硝酸濃度、相対酸化還元電位、Fe3+相対存在量、およびα-syn凝集が有意に減少したが、大腸菌K-12野生型培養物に100 mMまでのタングステン酸を供給しても、moaAの遺伝的欠失で観察された程度まで亜硝酸還元の影響を改善することはできなかった。100mMのタングステン酸を添加しても、亜硝酸濃度、Fe3+相対量、およびα-syn凝集体は、大腸菌K-12野生型の培養では大腸菌K-12 ΔmoaAと比較して有意に大きいままであった。これらの結果を総合すると、タングステン酸塩は大腸菌の硝酸塩還元によって生じる酸化環境の生成を化学的に制限し(完全には防止できない)、それによってα-syn凝集につながる酸化反応のカスケードを阻害する手段であることが示された。
酸化還元活性亜硝酸塩は特殊化した腸上皮細胞においてα-シンの凝集を誘導する
次に、われわれが提唱しているバクテリアによるα-syn凝集メカニズムと哺乳類の腸管との関連性を調べた。消化管では、α-synはEECと呼ばれる特殊な上皮細胞で発現しており、(4) ドーパミン代謝経路もこれらの細胞で発現している(50)。(50) EECは、腸管内腔内容物と神経系との境界にある化学感覚細胞である。EECの先端側は腸内細菌やその代謝産物と直接接触しているが、EECの基底側表面にある細胞突起(ニューロポッドと呼ばれる)は迷走神経を含む腸管ニューロンとシナプスを形成している(51)。(51)このように、EECは、細菌の代謝産物を含む環境因子がα-synのミスフォールディングやPDにつながるプリオン様カスケードを引き起こす可能性のある部位として提唱されてきた。(4,52)
腸上皮細胞は受動拡散によって亜硝酸塩を吸収することから(53)、硝酸塩を代謝する細菌(18,19)によって腸管内腔で産生されるこの酸化還元活性代謝物が、EECの細胞質に存在するα-synの凝集を誘導する可能性があると我々は仮定した(4)。(4)我々の仮説を検証するために、ネイティブEECの特性を解明するためのモデル細胞株として知られているマウスSTC-1細胞を用いた(54)。(54)STC-1細胞を硝酸塩または亜硝酸塩(0.05-50 mM)とインキュベートし、α-syn線維に対する抗体を用いた免疫蛍光染色によってα-syn凝集を解析した(図5a)。0.5mMの硝酸塩で処理したSTC-1細胞は、未処理の細胞と比較して、α-syn凝集体の量に有意差は認められなかった(図5b)。一方、亜硝酸塩で処理すると、濃度依存的にα-synの凝集が有意に誘導され、0.5、5、50mMの亜硝酸塩で処理した細胞と比較して、凝集はそれぞれ2.1倍、12.9倍、77.0倍に増加した(図5b)。0.05mM亜硝酸塩を細胞に供給しても、硝酸塩処理細胞と比較してα-syn凝集の有意な増加は見られなかった。アイソタイプコントロールで細胞を染色しても、有意な非特異的バックグラウンド相互作用は見られなかった(図S8)。これらの結果を総合すると、亜硝酸塩がα-synタンパク質を発現している腸細胞内でα-syn凝集を誘導するという我々の提唱するモデルの強力な証拠となるばかりでなく、これらの知見は、この病原性プロセスを誘発するために細菌が硝酸塩を亜硝酸塩に還元することの重要性も強調している。
図5
図5. 硝酸塩ではなく亜硝酸塩が腸内分泌STC-1細胞におけるα-syn凝集を誘導する。 硝酸塩(NO3-)または亜硝酸塩(NO2-)とインキュベートしたSTC-1細胞あたりのα-syn凝集体を(a)可視化し(代表画像)、(b)構造化照明顕微鏡で得られた最大強度投影を用いて定量した(α-syn凝集体の免疫蛍光染色を緑で示し、DAPI染色した細胞核を青で示す)。n = 3個の独立した生物学的複製、それぞれ3-4個の技術的複製;棒グラフは平均値±S.E.M.;有意性は対応のないt検定で決定;*: P = 0.0113; ****: P < 0.0001、ns:有意ではない。
考察
ジャンプ
ここで我々は、腸内細菌科細菌、特に大腸菌が細菌環境の酸化還元電位を調節する能力が、α-syn凝集体の形成を誘導する上で重要な役割を果たしていることを示した。微生物代謝が環境の酸化還元電位に影響を与えることは以前にも証明されている(34)が、腸内細菌の代謝経路は通常、より還元的な環境を作り出すことに関連しており、一方、酸化的な環境の生成は一般的に宿主のプロセスに関連している(29-33,55)。(29-33,55)我々のデータは、硝酸異化代謝を行う細菌が酸化的環境を生成できることを示唆している。この代謝過程が起こると、腸内細菌は宿主の炎症反応の比較的酸化還元不活性な副産物である硝酸塩を(56)、酸化剤である亜硝酸塩に還元する。
大腸菌K-12野生型培養物を用いて、増殖培地中に硝酸塩が存在すると、硝酸塩が亜硝酸塩に還元されるとともに、硝酸塩を含まない同じ培養物と比較して、より酸化的な酸化還元環境が生成されることを示した。一方、硝酸呼吸欠損菌(すなわち大腸菌K-12 ΔmoaA)や無菌培地に硝酸塩を供給すると、亜硝酸塩の生成も酸化還元電位の上昇も見られなかった。これらのデータは、大腸菌K-12の硝酸塩代謝が酸化的環境を生成することを示している。注目すべきは、亜硝酸塩生成に伴う酸化還元電位のシフトは、鉄種の相対量を変化させるのに十分であり、培養物ではFe2+よりもFe3+が優勢になることであった。このシフトは、Fe3+よりもFe2+が優勢であることを好む消化管と同様の嫌気性および還元性のin vitro培養条件にもかかわらず起こった。(40)腸内細菌科の硝酸塩呼吸は、腸内細菌がFe2+とFe3+の相対的な存在量や、この酸化還元活性金属によって媒介される代謝過程を乱す、過小評価されているメカニズムかもしれない。
鉄は、鉄3+がドーパミンを酸化してα-syn単量体を凝集させるオルトキノンに変化させる能力により、PD発症に関与していることが示唆されている(24,57,58)。(24,57,58)我々は、in vitroの実験を通して、腸内細菌の硝酸塩還元が、最終的にドーパミン依存性のα-syn凝集をもたらす酸化反応のカスケードを誘導することを証明した。これは、in vitroでα-syn凝集に直接影響する腸内細菌代謝経路を解明した最初の報告である。もし哺乳類の消化管に保存されていれば、この生化学的経路は、腸におけるα-syn凝集を予防する介入戦略の新規ターゲットになるかもしれない。
タングステートが腸内細菌科細菌の硝酸塩呼吸を阻害することから(19)、我々はタングステートを用いて腸内細菌科細菌によるα-syn凝集を阻害できるかどうかを調べた。硝酸塩を添加した大腸菌K-12野生型の培養において、タングステン酸の暴露はドーパミンの酸化とα-synの凝集を制限した。さらに、タングステン酸塩処理は細菌環境の酸化還元電位を効果的に低下させ、酸化しにくいFe2+の相対量を増加させた。タングステートの経口投与が、腸内細菌の硝酸塩呼吸によって悪化するマウス大腸炎を効果的に改善することから(19)、in vitroでα-syn凝集を制限するタングステートの能力は、哺乳類の腸におけるα-syn凝集を制限する上で重要な治療的意味を持つかもしれない。
腸におけるα-syn凝集に対する細菌の硝酸塩呼吸の重要性を明らかにするために、我々はEECに焦点を当てた。EECは腸-脳軸の重要なメディエーターとして台頭してきており(59,60)、PDでは腸管α-synの供給源として関与している(4,52)。EECは腸神経系とシナプスを形成することができるため(59)、α-syn凝集体がEECから迷走神経を介して脳に広がるのではないかという仮説が立てられている(4,52)が、EECにおけるα-syn凝集の正確な分子刺激については不明なままであった。亜硝酸塩がin vitroでドーパミン依存性のα-syn凝集を誘導するというわれわれの知見から、亜硝酸塩がEECでも同じ過程を誘導するのではないかと考えた。EEC内で亜硝酸塩(0.5-50mM)に暴露すると、α-syn凝集量は用量依存的に増加した。我々のin vitro実験と一致して、α-syn凝集に対する硝酸塩(0.5 mM)の効果は偽処理と変わらなかった。注目すべきことに、腸管内腔の粘液層における硝酸塩の濃度は0.5mMのオーダーである(18)。我々は、亜硝酸塩──消化管内で起こる腸内細菌Enterobacteriaceaeの硝酸塩呼吸の産物(18,19)──が、消化管内腔を覆うEECにおいてα-syn凝集を誘導することを示した。
まとめると、我々のデータは、腸内細菌叢、特に大腸菌(腸内細菌科細菌の原型生物(18))がα-syn凝集を誘導できることを示している。腸内細菌科細菌は、非疾患者で年齢をマッチさせた対照群と比べてPD患者でより多く存在し、運動機能障害の重症度と正の相関がある(9)が、腸内細菌科細菌がPDにおいて原因的役割を果たすかどうかは不明なままであった。我々は、腸内細菌がドーパミンの酸化とそれに続くα-synの凝集を引き起こす酸化的環境を生成する特定の代謝経路、細菌性硝酸塩還元を同定した(図S9に作業モデルを示す)。ドーパミンの酸化は脳におけるα-syn凝集メカニズムの重要な構成要素として同定されているが(24,57,58)、我々はドーパミン依存性のα-syn凝集メカニズムが腸においても関連する可能性が高いことを示した。亜硝酸塩がEECにおけるα-syn凝集を誘導するというわれわれの発見は、PDにおける腸-脳軸の可能性の高い導管としてEEC細胞を調べる強い動機付けとなった。今後の研究では、EECにおけるα-syn凝集体の形成後、腸神経系に拡散する能力に焦点を当てる予定である。細菌の硝酸塩還元によって開始され、α-syn凝集で終わる反応のカスケードが哺乳類の腸で保存されているのであれば、今回の知見は、腸内細菌の硝酸塩還元を、腸管でのα-syn凝集を予防し、パーキンソン病神経変性を抑制するための早期介入戦略に活用できるかもしれない新規標的として位置づけることができる。
材料と方法
ジャンプ
細菌と培養条件
一般細菌
大腸菌K-12 BW25113はVWR社から入手した(470179-082)。大腸菌ΔmoaAは、以前に記載されたように構築した(61,62)。(61,62) 細菌の保存株は16%グリセロール中、-80℃で保存した。細菌は、COY嫌気チャンバー内で、37℃、無酸素・還元条件下(2-5% H2、20% CO2、残りはN2)で、改変M9ミネラル培地(mM9、以下に定義)でルーチンに培養した。指示された場合、mM9培地(以下に記述)に50mM硝酸ナトリウム(Sigma、S5506-250G)、50mM亜硝酸ナトリウム(Fisher Scientific、M1065490100)、500μMドーパミンHCl(Alfa Aesar、A11136-06)、および/または20μMα-syn(以下に記述のように精製)を添加した。実験を開始する前に、培地を一晩無酸素条件下で平衡化し、酸素を除去した。
mM9培地は以下を含むように調製した: 1x M9塩類(Sigma, M6030-1KG)、2mM硫酸マグネシウム(Fisher Scientific, 0338-500G)、100μM塩化カルシウム(Fisher Scientific, AC219171000)、20mM無水d-グルコース(VWR Life Science, Biotechnology grade)、0. 2%(w/v)カザミノ酸(Fisher Scientific, DF0288-15-6)、1×ビタミンサプリメント(ATCC, MD-VS)、500μM塩化第一鉄(Oakwood, 098678-5g)。
組換えα-シンの精製
α-シンの精製は、Huangら、2005の方法に従って行った。(63)簡単に述べると、pET-21a-α-syn(Addgene、51485)で形質転換した大腸菌Rosetta 2の一晩培養を、100μg/mLアンピシリンを補充したLBで100倍に希釈した。細胞密度が0.3-0.4のOD600に達した時点で培地に100μM IPTGを添加し、α-synの発現を5時間誘導した。1L培養の細胞ペレットを100mLの浸透圧ショック緩衝液(30mM Tris-HCl、40%スクロース、2mMエチレンジアミン四酢酸二ナトリウム、pH7.2)に懸濁し、RTで10分間インキュベートした。12,000rpm、20分間の遠心分離で回収したペレットを90mLの冷水にすばやく再懸濁し、37.5μLの飽和MgCl2を加えた。再懸濁液は氷上で3分間静置した。ペリプラスムタンパク質を含む上清を3500×g、20分間の遠心分離で回収し、バッファーA(20mM Tris-HCl、pH8.0)に対して一晩透析した。溶出画分をSDS-15% PAGEで分析し、18 kDaのバンドのみを含む画分を合わせて、0.0095% MgCl2, 0.316% Tris-HCl, 0.58% NaCl, pH 7.5でサイズ排除クロマトグラフィーを行った。純粋なα-synを含む画分を1 mg/mLまで濃縮し、分注し、-20℃で保存した。
酸化還元電位の測定
酸化還元電位は、Ag/AgCl参照電極付き酸化還元電極(Cole-Parmer、EW-59001-75)を用いて、5 mLの細菌培養物中で測定した。値は標準水素電極(SHE)に対する相対値で報告され、酸化還元電位が既知の参照溶液(Thermo Scientific、967961)中で参照電極のオフセットを測定することによって決定された。相対酸化還元電位(ORP)は、実験条件のORPから無菌対照のORP値を差し引いて求めた。
硝酸塩および亜硝酸塩の測定
硝酸塩濃度を測定するために、Mirandaらによって開発されたGriess-塩化バナジウム法を、若干の修正を加えて使用した(64)。(64) 手短に言えば、2μLの細菌培養を198μLの1M HClで希釈した。この懸濁液のうち50μLを、0.1%(w/v)スルファニルアミド(Sigma、S9251-100G)および0. 0.5M塩酸中の05%(w/v)N-(1-ナフチル)エチレンジアミン二塩酸塩(Sigma, N9125-10G)を含む溶液50μLと混合し、次いで1M塩酸中の0.25%(w/v)塩化バナジウム(III)(Sigma, 208272-1G)50μLを急速に加えた。混合物を37℃で30分間インキュベートした。亜硝酸塩は、塩化バナジウム(III)の代わりに50μLの1 M HClに曝露した以外は同様の方法で評価した。いずれの場合も、インキュベーション後、SPECTROstar Nanoプレートリーダー(BMG LABTECH)を用いて540 nmの吸光度を測定した。試料濃度は、540 nmでの吸光度を測定し、硝酸ナトリウムまたは亜硝酸ナトリウム標準物質からそれぞれ調製した既知濃度の硝酸塩および亜硝酸塩に対して線形回帰を行うことにより作成した検量線を用いて決定した(2倍希釈系列)。
鉄スペシエーションアッセイ
培地中のFe2+/Fe3+の比率を測定するために、以前に記載されたFe2+-フェロジンアッセイを用いたが、若干の修正を加えた。(43) 手短に言えば、培地中に存在するFe2+の濃度を測定するために、細菌培養物(70μL)を、1M酢酸カリウム緩衝液(pH 5.5)中で、50mg/mLのフェロジン(Hach、230424)70μLと混合した。溶液中に存在する全鉄を測定するために、Fe3+をFe2+に還元する還元剤としてアスコルビン酸を使用した。この目的のために、細菌培養液(90μL)を、1M酢酸カリウム緩衝液(pH5.5)中の50mg/mLフェロジン100μLおよび1Mアスコルビン酸(Sigma、A92902-25G)10μLと混合した。還元および非還元サンプルを37℃で30分間インキュベートした後、3000×gで15分間遠心分離した。その後、上清100 μLを用い、SPECTROstar Nanoプレートリーダー(BMG LABTECH)を用いて、562 nmにおけるFe2+-フェロジン錯体の光吸収を測定した。試料濃度は、562 nmでの吸光度を測定し、100~1.56 mM(2倍希釈系列)の濃度のFeCl2標準物質から調製した既知濃度のFe2+に対して線形回帰を行うことにより作成した検量線を用いて決定した。Fe3+は、全鉄(Fe2+とFe3+の合計がFe2+に還元されたもの)とFe2+の差として計算された。
キノン検出のためのニトロブルーテトラゾリウムアッセイ
細菌培養物中のキノンの存在は、以前に記載されたように評価された(48)。(48) 手短に言えば、常温条件下で、各サンプル2μLを、あらかじめメタノールで活性化し、トリス緩衝生理食塩水(pH 7.4)で平衡化したポリフッ化ビニリデン(PVDF)膜(Fisher Scientific、ISEQ00005)にスポットした。陽性対照として、アスペルギルス・チロシナーゼ(Worthington Biochemical、LS003789;詳細プロトコールは後述)によって産生された酸化ドーパミン2μLを用いた。次に、メタノールを用いて膜を再活性化し、グリシン酸カリウム緩衝液(pH10)中の0.6 mg/mL NBT(Santa Cruz Biotechnology, sc-296003)の溶液に浸した。その後、メンブレンをRT、暗所で45分間インキュベートした。インキュベーション後、メンブレンを0.16Mホウ酸ナトリウム溶液(シグマ、S9640-25G)で2回洗浄し、エプソンV19スキャナーで撮影した。
チロシナーゼによるドーパミン酸化
凍結乾燥したアスペルギルス・チロシナーゼ(Worthington Biochemical、LS003789)を1000μLの50mMリン酸緩衝液、15%グリセロール、pH6.5に懸濁し、24kU/mL溶液(50mg/mL、390μM)とした。単回使用のアリコート(100μL)を調製し、-20℃で保存した。アリコートは使用直前に氷上で融解した。ドパミン(500μM)は、250U(3.9μM)のチロシナーゼを加えて酸化した。この溶液をRTで1時間インキュベートした。
α-Syn凝集体の免疫検出
α-Syn凝集をメタノール活性化PVDF膜上で評価した。嫌気条件下で、2μLの細菌培養物をスポッティングし、少なくとも1時間乾燥させた。コントロールとして、2μLの単量体(Abcam, ab51189)と凝集したα-syn(Abcam, ab218817)をそれぞれメンブレン上にスポッティングした。一次抗体として抗線維α-syn(Abcam, ab209538;1:50,000希釈)、二次抗体としてNIR 800CWロバ抗ウサギIgG(LI-COR, 926-32213)を用いて、製造元の指示に従って膜を免疫染色した。膜はOdyssey CLxイメージャー(LI-COR)を用いて800nmチャンネルで可視化した。α-Syn凝集体は、Image Studioデータ解析ソフトウェア(LI-COR)を用いて定量した。相対蛍光単位(R.F.U.)の値は、無菌対照試料をゼロとして相対的にスケーリングした。
生物学的インキュベーション
硝酸ナトリウム(50 mM; Sigma)、亜硝酸ナトリウム(50 mM; Fisher Scientific)、塩酸ドーパミン(500 μM; Alfa Aesar)、塩化第一鉄(500 μM; Oakwood)、および/または組換えヒトα-synモノマー(20 μM; Abcam、ab51189)を二重脱イオン(DDI)水(36μL)中、COY嫌気チャンバー内で無酸素・還元条件下(2-5% H2、20% CO2、残りはN2)で調製した。サンプルは3つの12μL容量に分注した。これらの3連サンプルをPCRチューブに入れ、記載した嫌気チャンバー内で37℃で4時間インキュベートした。
α-Syn凝集体の免疫検出
α-Syn凝集をメタノール活性化PVDF膜で評価した。嫌気条件下で、各サンプル2μLを3種類のメタノール活性化PVDF膜にスポットした。コントロールとして、2μL(578 ng)の単量体α-syn(Abcam, ab51189)と578 ngの凝集α-syn(Abcam, ab218817)をそれぞれの膜にスポットした。膜は1時間乾燥させた。各サンプルのタンパク質濃度が同等であることを確認するため、1枚の膜を定量的コントロールとして使用した。乾燥したメンブレンをDDI水で洗浄した後、ポンソーS(Sigma-Aldrich)と氷酢酸(Fisher Scientific)を含むように調製したポンソー染色液に浸した。ポンソー染色は1分後に捨て、その後膜をDDI水で洗浄して余分な水分を除去してから可視化した。他の2つの膜は、TBS中の5% Blotting Grade Blocker Non-Fat Dry Milk(Bio-Rad)を用いて1時間ブロッキングした。ブロッキングした膜の1枚を、MJFR-14抗凝集α-syn一次抗体(Abcam, ab209538; 1:10,000希釈)で2時間プローブした後、4℃で一晩インキュベートした。TBS-T[調製したTBSに0.1% Tween 20(Sigma-Aldrich)を加えたもの]で5分間4回洗浄した後、IRDye 800CW ロバ抗ウサギIgG二次抗体(LI-COR, 926-32213; 1:20,000希釈)で暗所で45分間免疫染色した。TBS-Tでさらに4回洗浄した後、TBSでTween 20を洗い流した。もう一方のブロックした膜を、5G4抗凝集体一次抗体(Millipore Sigma, MABN389; 1:4000希釈)とIRDye 800CW ロバ抗マウスIgG二次抗体(LI-COR, 926-32212; 1:20,000希釈)で免疫染色した。洗浄および二次抗体による免疫染色は、上記と同じ手順に従った。膜は、Odyssey CLx イメージャー(LI-COR)を用い、800 nm チャンネルで可視化した。ブロットをImage Studioデータ解析ソフトウェア(LI-COR)を用いて定量し、α-synの相対的凝集を解析した。さらなるデータ処理にはPrismを用いた。
α-Syn凝集体と単量体に対する抗体の選択性
DDI水中で、α-syn単量体(1 mg/mL;Abcam、ab51189)およびα-syn凝集体(2 mg/mL;Abcam、ab218817)をそれぞれ用いて、以下の量のタンパク質を含む別々の希釈系列を調製した:350、289、144.5、72.3、36.1、18.1、および9.03 ng/μL。各サンプルから、2μLを2つの異なるメタノール活性化PVDF膜に重複してスポットし、各ドットの膜上に以下の量のα-synモノマーまたはα-syn凝集体を得た:700、578、289、144、72.3、36.1、および18.1ng。上記の手順で、一方の膜をMJFR-14抗凝集体α-syn一次抗体(Abcam, ab209538;1:10,000希釈)、次いでIRDye 800CWロバ抗ウサギIgG二次抗体(LI-COR, 926-32213;1:20,000希釈)を用いて免疫染色した。もう一方の膜は、5G4抗凝集体一次抗体(Millipore Sigma, MABN389; 1:4000希釈)とIRDye 800CW ロバ抗マウスIgG二次抗体(LI-COR, 926-32212; 1:20,000希釈)を用いて免疫染色した。膜は、Odyssey CLx イメージャー(LI-COR)を用いて 800 nm チャンネルで可視化した。ブロットをImage Studioデータ解析ソフトウェア(LI-COR)を用いて定量し、α-synの相対凝集を解析した。さらなるデータ処理にはPrismを用いた。
細胞株と増殖条件
一般
腸内分泌STC-1(CRL-3254)細胞株はAmerican Type Culture Collection(ATCC)から入手した。細胞は、4.5g/Lグルコース、2mM l-グルタミン、10%(v/v)ウシ胎児血清(Life Technologies)、ペニシリン(100U/mL)、ストレプトマイシン(100μg/mL、Gibco)を含むダルベッコ変法イーグル培地(DMEM、Corning)で培養した。細胞は、5% CO2の加湿雰囲気下、37℃でインキュベートした。細胞は、0.25% Trypsin-EDTA(ギブコ)を用いて連続的に継代した。その後、硝酸ナトリウム、亜硝酸ナトリウム、ビヒクルのいずれかを添加した新しい培地に交換した。細胞を固定する前に、さらに24時間培養した。
免疫蛍光
固定は10%ホルマリン(Fisher Scientific, 22-170-402)を用い、20分間RTで行った。その後、リン酸緩衝生理食塩水(PBS)、pH7.4中、0.1% Triton X-100(Bio-Rad, 1610407)を用いて、さらに20分間、RTで細胞を透過処理した。透過液を捨てた後、ウェルをPBSで2回洗浄した。次に、5% Normal Goat Serum (Thermo Scientific, 50197Z)と0.2% bovine serum albumin (BSA; Fisher Scientific, 501613336)を含むPBSで1時間室温でブロッキングし、PBSで3回洗浄した。その後、スライドグラスのチャンバーを抗α-syn凝集素一次抗体(Abcam, ab209538; 1:250希釈)、アイソタイプコントロール(Abcam, ab172730; 1:566希釈)、またはビヒクルと4℃で一晩インキュベートした。その後、チャンバーをPBSで洗浄し、抗ヤギAlexa Fluor-488二次抗体(Abcam, ab150077; 1:500希釈)を用いて暗所、室温で1時間インキュベートした。3回洗浄した後、DAPI入りVECTASHEILD PLUS Antifade Mounting Medium(Vector Laboratories, H-1900)を各ウェルに約10滴ずつ加えた。すべての剥離および染色工程は常温で行ったが、チャンバースライドは4℃で暗所に保存した。
構造化照明顕微鏡法
画像は、Zeiss Elyra 7 超解像顕微鏡(63×油浸レンズ付き)を用いて同一条件下で取得した。励起には405nmと488nmのレーザーラインを用い、発光フィルターにはBP 420-480(DAPI)とBP 495-550(AlexaFluor488)を用いた。切片は一次抗体非存在下で撮像し、画像は一次抗体を用いた画像と同じゲインで撮像した。一次抗体非存在下では、内因性の組織蛍光は観察されなかった。Zスタック画像を取得し、SIM2を用いて生画像にスケーリング処理した。各サンプルの蛍光シグナルの定量は、Zen Black 3.0ソフトウェアで得られた各画像の最大強度投影の平均強度を求めることにより決定した。各画像中の細胞数を数え、細胞あたりの平均強度を計算した。各生物学的サンプルについて、約30~40個の細胞を評価した。バックグラウンド蛍光シグナルは、各レプリケートについて、それぞれの未処理サンプルの細胞あたりの平均強度を差し引くことによって説明した。結果は、細胞あたりの平均強度の任意単位(a.u.)で表した。
データと統計解析
データはGraphPad Prism 8ソフトウェアを用いてプロットし、統計的に解析した。特に断りのない限り、平均値±平均値の標準誤差(S.E.M.)をプロットした。実施した統計学的検定は、図の凡例に明記した。すべての解析において、P≦0.05を有意とみなした。サンプルサイズは、本文と図の凡例、および「材料と方法」の項に記した。
参考情報
へジャンプ
Supporting Informationはhttps://pubs.acs.org/doi/10.1021/acschembio.4c00095。
酸化還元電位測定、フルドットブロット膜、凝集したα-synを検出する抗体の比較、細菌培養の増殖データ、免疫蛍光顕微鏡実験のアイソタイプコントロール、細菌誘導性ドーパミン依存性α-syn凝集のワーキングモデルなど、その他の実験詳細(PDF)
α-シヌクレインの凝集を促進する腸内細菌代謝経路の発見
0
閲覧数
0
シェア
0
ダウンロード
ナビゲーションへスキップ
S1補足資料:α-シヌクレインの凝集を促進する腸内細菌代謝経路の発見Lizett Ortiz de Ora1✝, Julia M. Balsamo1✝, Kylie S. Uyeda1✝, Elizabeth N. Bess112 カリフォルニア大学アーバイン校化学部、米国926172 Bess1,2*1Department of Chemistry, University of California, Irvine, California, USA 926172Department of Molecular Biology and Biochemistry, University of California, Irvine, California, USA 92617✝These authors contributed equally.*Corresponding author: Elizabeth N. Bess、カリフォルニア大学アーバイン校化学・分子生物学・生化学部、1102 Natural Sciences II, Irvine, CA 92617, USA。電子メール: Elizabeth.Bess@uci.edu。
S2図S1. 無菌mM9培地に硝酸ナトリウム(NO3-)と亜硝酸ナトリウム(NO2-)を添加したときの酸化還元電位に及ぼす影響。
拡大
ご利用条件
ほとんどのSupporting Informationファイル(電子版)は、ACS Web Editionsを購読していなくてもご利用いただけます。このようなファイルは、研究利用のために論文ごとにダウンロードすることができる(関連論文にリンクされた公共利用ライセンスがある場合、そのライセンスは他の利用を許可することがある)。その他の利用については、RightsLink許可システム(http://pubs.acs.org/page/copyright/permissions.html)を通じてACSから許可を得ることができる。
著者情報
ジャンプする
コレスポンディング・オーサー
Elizabeth N. Bess - 化学科、カリフォルニア大学アーバイン校、カリフォルニア州、92617、アメリカ合衆国; 分子生物学・生化学科、カリフォルニア大学アーバイン校、カリフォルニア州、92617、アメリカ合衆国; Orcidhttps://orcid.org/0000-0003-0349-0423; Email: Elizabeth.Bess@uci.edu
著者
Lizett Ortiz de Ora - カリフォルニア大学アーバイン校化学部、カリフォルニア州、92617、アメリカ合衆国
Julia M. Balsamo - カリフォルニア大学アーバイン校化学部、カリフォルニア州92617、アメリカ合衆国
Kylie S. Uyeda - カリフォルニア大学アーバイン校化学部、カリフォルニア州92617、アメリカ合衆国
著者貢献
L.O.O.とJ.M.B.は同等に貢献した。L.O.O.とE.N.B.がプロジェクトを開発した。L.O.O.、J.M.B.、E.N.B.は実験デザインとデータ解析を行った。L.O.O.とJ.M.B.はK.S.U.の協力を得て実験を行った。L.O.O.、J.M.B.、K.S.U.およびE.N.B.は実験に対する批判的フィードバックを提供した。L.O.O.、J.M.B.、E.N.B.は原稿を執筆した。E.N.B.は資金を獲得し、プロジェクトの監督と管理を行った。すべての著者が最終版の原稿を読み、承認した。
備考
著者らは競合する金銭的利害関係はないことを表明している。
謝辞
ジャンプ
目次グラフィックはBioRender.com(契約番号DM240BYT0B)で作成した。本書の出版は、カリフォルニア大学アーバイン校物理科学部、カリフォルニア大学癌研究調整委員会(C21CR2124)、Research Corporation for Science Advancement、Frederick Gardner Cottrell Foundation、Paul G. Allen Frontiers Groupの共同スポンサーによるScialog助成金第28626号および第28648号による財政的支援を受けている。本研究の一部は、カリフォルニア大学アーバイン校のがんセンター支援助成金(CA-62203)およびCenter for Complex Biological Systems支援助成金(GM-076516)による共有リソースである発生生物学センターの光学生物学コア施設の利用により可能となった。
参考文献
ジャンプ
この論文は64の他の文献を参照しています。
1Braak, H.; Rüb, U.; Gai, W. P.; Del Tredici, K. 特発性パーキンソン病: 特発性パーキンソン病:脆弱な神経細胞型が未知の病原体による神経浸潤を受ける可能性のある経路。J. Neural. Transm. 2003, 110 (5), 517- 536, DOI: 10.1007/s00702-002-0808-2
Google Scholar
2Borghammer, P.; Van Den Berge, N. 脳が先か腸が先かのパーキンソン病: 仮説。J. Parkinsons Dis. 2019, 9 (s2), S281- S295, DOI: 10.3233/JPD-191721
グーグル・スカラー
3Spillantini, M. G.; Schmidt, M. L.; Lee, V. M.; Trojanowski, J. Q.; Jakes, R.; Goedert, M. レビー小体におけるα-シヌクレイン。Nature 1997, 388 (6645), 839- 840, DOI: 10.1038/42166
Google Scholar
4Chandra, R.; Hiniker, A.; Kuo, Y.-M.; Nussbaum, R. L.; Liddle, R. A. 腸内分泌細胞におけるα-シヌクレインとパーキンソン病への示唆。JCI Insight 2017, 2 (12), e92295 DOI: 10.1172/jci.insight.92295
Google Scholar
5Paillusson, S.; Clairembault, T.; Biraud, M.; Neunlist, M.; Derkinderen, P. Activity-Dependent Secretion of Alpha-Synuclein by Enteric Neurons. J. Neurochem. 2013, 125 (4), 512- 517, DOI: 10.1111/jnc.12131
Google Scholar
6Hilton, D.; Stephens, M.; Kirk, L.; Edwards, P.; Potter, R.; Zajicek, J.; Broughton, E.; Hagan, H.; Carroll, C. パーキンソン病前臨床期患者の腸管におけるα-シヌクレインの蓄積。Acta Neuropathol. 2014, 127 (2), 235- 241, DOI: 10.1007/s00401-013-1214-6
Google Scholar
7Holmqvist, S.; Chutna, O.; Bousset, L.; Aldrin-Kirk, P.; Li, W.; Björklund, T.; Wang, Z.-Y.; Roybon, L.; Melki, R.; Li, J.-Y. パーキンソン病病理が消化管から脳へ拡がったことのラットにおける直接的証拠。Acta Neuropathol. 2014, 128 (6), 805- 820, DOI: 10.1007/s00401-014-1343-6
Google Scholar
8Challis, C.; Hori, A.; Sampson, T. R.; Yoo, B. B.; Challis, R. C.; Hamilton, A. M.; Mazmanian, S. K.; Volpicelli-Daley, L. A.; Gradinaru, V. Gut-Seeded α-Synuclein Fibrils Promote Gut Dysfunction and Brain Pathology Specifically in Aged Mice. Nat. Neurosci. 2020, 23 (3), 327- 336, DOI: 10.1038/s41593-020-0589-7
Google Scholar
9Scheperjans, F.; Aho, V.; Pereira, P. A. B.; Koskinen, K.; Paulin, L.; Pekkonen, E.; Haapaniemi, E.; Kaakkola, S.; Eerola-Rautio, J.; Pohja, M.Gut Microbiota Are Related to Parkinson's Disease and Clinical Phenotype. Mov. Disord. 2015, 30 (3), 350- 358, DOI: 10.1002/mds.26069
Google Scholar
10Sun, M.-F.; Shen, Y.-Q. Dysbiosis of Gut Microbiota and Microbial Metabolites in Parkinson's Disease. Ageing Res. Rev. 2018, 45, 53- 61, DOI: 10.1016/j.arr.2018.04.004
Google Scholar
11Romano, S.; Savva, G. M.; Bedarf, J. R.; Charles, I. G.; Hildebrand, F.; Narbad, A. Meta-Analysis of the Parkinson's Disease Gut Microbiome Suggests Alterations Linked to Intestinal Inflammation. NPJ Parkinsons Dis 2021, 7, 27, DOI: 10.1038/s41531-021-00156-z
Google Scholar
12Keshavarzian, A.; Green, S. J.; Engen, P. A.; Voigt, R. M.; Naqib, A.; Forsyth, C. B.; Mutlu, E.; Shannon, K. M. パーキンソン病における大腸細菌組成。Mov. Disord. 2015, 30 (10), 1351- 1360, DOI: 10.1002/mds.26307
グーグル奨学生
13Li, C.; Cui, L.; Yang, Y.; Miao, J.; Zhao, X.; Zhang, J.; Cui, G.; Zhang, Y. Gut Microbiota Differs Between Parkinson's Disease Patients and Healthy Controls in Northeast China. Front. Mol. Neurosci. 2019, 12, 171, DOI: 10.3389/fnmol.2019.00171
Google Scholar
14Li, W.; Wu, X.; Hu, X.; Wang, T.; Liang, S.; Duan, Y.; Jin, F.; Qin, B. Structural Changes of Gut Microbiota in Parkinson's Disease and Its Correlation with Clinical Features. Sci. China Life Sci. 2017, 60 (11), 1223- 1233, DOI: 10.1007/s11427-016-9001-4
Google Scholar
15Zhang, F.; Yue, L.; Fang, X.; Wang, G.; Li, C.; Sun, X.; Jia, X.; Yang, J.; Song, J.; Zhang, Y.Altered Gut Microbiota in Parkinson's Disease Patients/healthy Spouses and Its Association with Clinical Features. Parkinsonism Relat. Disorders 2020, 81, 84- 88, DOI: 10.1016/j.parkreldis.2020.10.034
Google Scholar
16Unger, M. M.、Spiegel, J.、Dillmann, K.-U.、Grundmann, D.、Philippeit, H.、Bürmann, J.、Faßbender, K.、Schwiertz, A.、Schäfer, K. H.、短鎖脂肪酸と腸内細菌叢はパーキンソン病患者と年齢をマッチさせた対照群で異なる。Parkinsonism Relat. Disorders 2016, 32, 66- 72, DOI: 10.1016/j.parkreldis.2016.08.019
Google Scholar
17Sampson、T. R.; Debelius、J. W.; Thron、T.; Janssen、S.; Shastri、G. G.; Ilhan、Z. E.; Challis、C.; Schretter、C. E.; Rocha、S.; Gradinaru、V.Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson's Disease. Cell 2016, 167 (6), 1469.e12- 1480.e12, DOI: 10.1016/j.cell.2016.11.018
Google Scholar
18Winter、S. E.; Winter、M. G.; Xavier、M. N.; Thiennimitr、P.; Poon、V.; Keestra、A. M.; Laughlin、R. C.; Gomez、G.; Wu、J.; Lawhon、S. D.宿主由来の硝酸塩は、炎症を起こした腸内で大腸菌の増殖を促進する。Science 2013, 339 (6120), 708- 711, DOI: 10.1126/science.1232467
Google Scholar
19Zhu, W.; Winter, M. G.; Byndloss, M. X.; Spiga, L.; Duerkop, B. A.; Hughes, E. R.; Büttner, L.; de Lima Romão, E.; Behrendt, C. L.; Lopez, C. A.Precision Editing of the Gut Microbiota Ameliorates Colitis. Nature 2018, 553 (7687), 208- 211, DOI: 10.1038/nature25172
Google Scholar
20Kishimoto, Y.; Zhu, W.; Hosoda, W.; Sen, J. M.; Mattson, M. P. Chronic Mild Gut Inflammation Accelerates Brain Neuropathology and Motor Dysfunction in α-Synuclein Mutant Mice. NeuroMolecular Med. 2019, 21 (3), 239- 249, DOI: 10.1007/s12017-019-08539-5
グーグル・スカラー
21Grathwohl, S.; Quansah, E.; Maroof, N.; Steiner, J. A.; Spycher, L.; Benmansour, F.; Duran-Pacheco, G.; Siebourg-Polster, J.; Oroszlan-Szovik, K.; Remy, H.Specific Immune Modulation of Experimental Colitis Drives Enteric Alpha-Synuclein Accumulation and Triggers Age-Related Parkinson-like Brain Pathology. Free Neuropathol. 2021, 18 (2), 2- 13, DOI: 10.21203/rs.3.rs-100199/v1
Google Scholar
22Hare, D. J.; Double, K. L. 鉄とドーパミン: 毒性カップル。Brain 2016, 139 (4), 1026- 1035, DOI: 10.1093/brain/aww022
Google Scholar
23Conway, K. A.; Rochet, J. C.; Bieganski, R. M.; Lansbury, P. T., Jr ドーパミン-α-シヌクレイン付加体によるα-シヌクレイン原線維の動力学的安定化。Science 2001, 294 (5545), 1346- 1349, DOI: 10.1126/science.1063522
Google Scholar
24Bisaglia、M.; Mammi、S.; Bubacco、L. ドーパミンの初期酸化生成物の速度論的および構造解析。J. Biol. Chem. 2007, 282 (21), 15597- 15605, DOI: 10.1074/jbc.M610893200
Google Scholar
25Eisenhofer, G.; Aneman, A.; Friberg, P.; Hooper, D.; Fåndriks, L.; Lonroth, H.; Hunyady, B.; Mezey, E. ヒト消化管におけるドーパミンの実質的産生。J. Clin. Endocrinol. Metab. 1997, 82 (11), 3864- 3871, DOI: 10.1210/jcem.82.11.4339
Google Scholar
26マウスの腸管内腔における生物学的に活性な遊離カテコールアミンの産生における腸内細菌叢の重要な役割。Am. J. Physiol. Gastrointest. 肝臓生理学 2012, 303 (11), G1288- G1295, DOI: 10.1152/ajpgi.00341.2012
Google Scholar
27Lund, E. K.; Wharf, S. G.; Fairweather-Tait, S. J.; Johnson, I. T. 食餌性鉄補給に応答する利用可能鉄濃度の増加は、ラット大腸におけるクリプト細胞増殖の変化に関連する。J. Nutr. 1998, 128 (2), 175- 179, DOI: 10.1093/jn/128.2.175
Google Scholar
28Lv, H.; Shang, P. The Significance, Trafficking and Determination of Labile Iron in Cytosol, Mitochondria and Lysosome. Metallomics 2018, 10 (7), 899- 916, DOI: 10.1039/C8MT00048D
Google Scholar
29Radi, R. 酸素ラジカル、一酸化窒素、ペルオキシナイトライト: 分子医学における酸化還元経路。Proc. Natl. Acad. Sci. U.S.A. 2018, 115 (23), 5839- 5848, DOI: 10.1073/pnas.1804932115
グーグル スカラー
30Singer, I. I.; Kawka, D. W.; Scott, S.; Weidner, J. R.; Mumford, R. A.; Riehl, T. E.; Stenson, W. F. Expression of Inducible Nitric Oxide Synthase and Nitrotyrosine in Colonic Epithelium in Inflammatory Bowel Disease. Gastroenterology 1996, 111 (4), 871- 885, DOI: 10.1016/S0016-5085(96)70055-0
Google Scholar
31Schöneich, C. 活性酸素によるメチオニン酸化: 反応機構とアルツハイマー病との関連性。Biochim. Biophys. Acta 2005, 1703 (2), 111- 119, DOI: 10.1016/j.bbapap.2004.09.009
Google Scholar
32Balagam, B.; Richardson, D. E. The Mechanism of Carbon Dioxide Catalysis in the Hydrogen Peroxide N-Oxidation of Amines. Inorg. Chem. 2008, 47 (3), 1173- 1178, DOI: 10.1021/ic701402h
Google Scholar
33Circu, M. L.; Aw, T. Y. 腸の酸化還元生物学。Free Radic. Res. 2011, 45 (11-12), 1245- 1266, DOI: 10.3109/10715762.2011.611509
Google Scholar
34Reese, A. T.; Cho, E. H.; Klitzman, B.; Nichols, S. P.; Wisniewski, N. A.; Villa, M. M.; Durand, H. K.; Jiang, S.; Midani, F. S.; Nimmagadda, S. N.Antibiotic-Induced Changes in the Microbiota Disrupt Redox Dynamics in the Gut. Elife 2018, 7, e35987 DOI: 10.7554/elife.35987
グーグル・スカラー
35Berg, B. L.; Stewart, V. Structural Genes for Nitrate-Inducible Formate Dehydrogenase in Escherichia Coli K-12. Genetics 1990, 125 (4), 691- 702, DOI: 10.1093/genetics/125.4.691
Google Scholar
36Parham, N. J.; Gibson, G. R. ヒト大腸内における硝酸塩の異化還元に関与する微生物。FEMS Microbiol. Ecol. 2000, 31 (1), 21- 28, DOI: 10.1111/j.1574-6941.2000.tb00667.x
Google Scholar
37Carlson, H. K.; Clark, I. C.; Blazewicz, S. J.; Iavarone, A. T.; Coates, J. D. Fe(II) Oxidation Is an Innate Capability of Nitrate-Rucing Bacteria That Involves Abiotic and Biotic Reactions. J. Bacteriol. 2013, 195 (14), 3260- 3268, doi: 10.1128/jb.00058-13
Google Scholar
38Bonnefoy, V.; Demoss, J. A. 大腸菌における硝酸還元酵素。Antonie Leeuwenhoek 1994, 66 (1-3), 47- 56, DOI: 10.1007/BF00871632
Google Scholar
39Tiso, M.; Schechter, A. N. Nitrate Reduction to Nitrite, Nitric Oxide and Ammonia by Gut Bacteria under Physiological Conditions. PLoS One 2015, 10 (3), e0119712 DOI: 10.1371/journal.pone.0119712
グーグル・スカラー
40Kortman, G. A.; Raffatellu, M.; Swinkels, D. W.; Tjalsma, H. Nutritional Iron Turned inside out: 腸内細菌から見た腸内ストレス。FEMS Microbiol. Rev. 2014, 38 (6), 1202- 1234, DOI: 10.1111/1574-6976.12086
Google Scholar
41Eckburg, P. B.; Bik, E. M.; Bernstein, C. N.; Purdom, E.; Dethlefsen, L.; Sargent, M.; Gill, S. R.; Nelson, K. E.; Relman, D. A. Diversity of the Human Intestinal Microbial Flora. Science 2005, 308 (5728), 1635- 1638, DOI: 10.1126/science.1110591
Google Scholar
42Liu, C.-G.; Qin, J.-C.; Lin, Y.-H. 発酵と酸化還元電位。In Fermentation Processes; Jozala, A. F., Ed.; IntechOpen: Rijeka, 2017.
Google Scholar
43Jeitner, T. M. 最適化されたフェロジンベースの溶存鉄アッセイ。Anal. Biochem. 2014, 454, 36- 37, DOI: 10.1016/j.ab.2014.02.026
Google Scholar
44Sun, Y.; Pham, A. N.; Waite, T. D. Elucidation of the Interplay between Fe(II), Fe(III) and Dopamine with Relevantance to Iron Solubilization and Reactive Oxygen Species Generation by Catecholamines. J. Neurochem. 2016, 137 (6), 955- 968, DOI: 10.1111/jnc.13615
Google Scholar
45Abeyawardhane, D. L.; Lucas, H. R. Iron Redox Chemistry and Implications in the Parkinson's Disease Brain. Oxid. Med. Cell. Longev. 2019, 2019, 1- 11, doi: 10.1155/2019/4609702
グーグル・スカラー
46Zucca, F. A.; Segura-Aguilar, J.; Ferrari, E.; Muñoz, P.; Paris, I.; Sulzer, D.; Sarna, T.; Casella, L.; Zecca, L. Interactions of Iron, Dopamine and Neuromelanin Pathways in Brain Aging and Parkinson's Disease. Prog. Neurobiol. 2017, 155, 96- 119, DOI: 10.1016/j.pneurobio.2015.09.012
Google Scholar
47Munoz, P.; Huenchuguala, S.; Paris, I.; Segura-Aguilar, J. Dopamine Oxidation and Autophagy. J. Parkinsons Dis. 2012, 2012, 1- 13, doi: 10.1155/2012/920953
Google Scholar
48Paz, M. A.; Flückiger, R.; Boak, A.; Kagan, H. M.; Gallop, P. M. 酸化還元サイクル染色によるキノタンパク質の特異的検出。J. Biol. Chem. 1991, 266 (2), 689- 692, doi: 10.1016/s0021-9258(17)35225-0
Google Scholar
49Rothery, R. A.; Magalon, A.; Giordano, G.; Guigliarelli, B.; Blasco, F.; Weiner, J. H. 大腸菌硝酸還元酵素A(NarGHI)のモリブデン補酵素。J. Biol. Chem. 1998, 273 (13), 7462- 7469, DOI: 10.1074/jbc.273.13.7462
Google Scholar
50Habowski, A. N.; Flesher, J. L.; Bates, J. M.; Tsai, C. F.; Martin, K.; Zhao, R.; Ganesan, A. K.; Edwards, R. A.; Shi, T.; Wiley, H. S.; Shi, Y.; Hertel, K. J.; Waterman, M. L. Transcriptomic and Proteomic Signatures of Stemness and Differentiation in the Colon Crypt. 大腸陰窩における幹細胞性と分化のトランスクリプトームとプロテオミクスの特徴。Biol. 2020, 3, 453, DOI: 10.1038/s42003-020-01181-z
Google Scholar
51Bohórquez, D. V.; Shahid, R. A.; Erdmann, A.; Kreger, A. M.; Wang, Y.; Calakos, N.; Wang, F.; Liddle, R. A. 感覚性腸内分泌細胞の神経支配によって形成される神経上皮回路。J. Clin. Invest. 2015, 125 (2), 782- 786, doi: 10.1172/jci78361
Google Scholar
52Amorim Neto, D. P.; Bosque, B. P.; Pereira de Godoy, J. V.; Rodrigues, P. V.; Meneses, D. D.; Tostes, K.; Costa Tonoli, C. C.; Faustino de Carvalho, H.; González-Billault, C.; de Castro Fonseca, M. アッカーマンシア・ムシニフィラは腸内分泌細胞株においてミトコンドリアカルシウム過負荷とα-シヌクレイン凝集を誘導する。 .103908
Google Scholar
53Roediger, W. E.; Radcliffe, B. C. Role of nitrite and nitrate as a redox couple in the rat colon. Gastroenterology 1988, 94 (4), 915- 922, DOI: 10.1016/0016-5085(88)90547-1
Google Scholar
54McCarthy, T.; Green, B. D.; Calderwood, D.; Gillespie, A.; Cryan, J. F.; Giblin, L. STC-1細胞。In The Impact of Food Bioactives on Health: In Vitro and Ex Vivo Models; Verhoeckx, K., Cotter, P., López-Expósito, I., Kleiveland, C., Lea, T., Mackie, A., Requena, T., Swiatecka, D., Wichers, H., Eds.; Springer International Publishing: Cham, 2015; pp 211- 220.
Google Scholar
55Friedman, E. S.; Bittinger, K.; Esipova, T. V.; Hou, L.; Chau, L.; Jiang, J.; Mesaros, C.; Lund, P. J.; Liang, X.; FitzGerald, G. A..Microbes vs. Chemistry in the Origin of Anaerobic Gut Lumen. Proc. Natl. Acad. Sci. U.S.A. 2018, 115 (16), 4170- 4175, DOI: 10.1073/pnas.1718635115
Google Scholar
56Radi, R. Oxygen Radicals, Nitric Oxide, and Peroxynitrite: 分子医学における酸化還元経路。Proc. Natl. Acad. Sci. U.S.A. 2018, 115 (23), 5839- 5848, DOI: 10.1073/pnas.1804932115
グーグル・スカラー
57Conway, K. A.; Rochet, J. C.; Bieganski, R. M.; Lansbury, P. T., Jr. ドパミン-α-シヌクレイン付加体によるα-シヌクレイン原線維の動力学的安定化。Science 2001, 294 (5545), 1346- 1349, DOI: 10.1126/science.1063522
グーグル奨学生
58Bisaglia, M.; Tosatto, L.; Munari, F.; Tessari, I.; de Laureto, P. P.; Mammi, S.; Bubacco, L. ドーパミン・キノンはα-シヌクレインと相互作用して非構造化付加体を形成する。Biochem. Biophys. Res. Commun. 2010, 394 (2), 424- 428, DOI: 10.1016/j.bbrc.2010.03.044
Google Scholar
59Kaelberer, M. M.; Buchanan, K. L.; Klein, M. E.; Barth, B. B.; Montoya, M. M.; Shen, X.; Bohórquez, D. V. A Gut-Brain Neural Circuit for Nutrient Sensory Transduction. Science 2018, 361 (6408), eaat5236 DOI: 10.1126/science.aat5236
Google Scholar
60Ye, L.; Bae, M.; Cassilly, C. D.; Jabba, S. V.; Thorpe, D. W.; Martin, A. M.; Lu, H.-Y.; Wang, J.; Thompson, J. D.; Lickwar, C. R.腸内分泌細胞は細菌のトリプトファン代謝産物を感知し、腸管および迷走神経経路を活性化する。Cell Host Microbe 2021, 29 (2), 179.e9- 196.e9, DOI: 10.1016/j.chom.2020.11.011
Google Scholar
61Datsenko, K. A.; Wanner, B. L. PCR産物を用いた大腸菌K-12における染色体遺伝子のワンステップ不活性化。Proc. Natl. Acad. Sci. U.S.A. 2000, 97 (12), 6640- 6645, DOI: 10.1073/pnas.120163297
Google Scholar
62馬場 孝典、荒 孝典、長谷川 雅彦、高井 祐樹、奥村 靖弘、馬場 正人、Datsenko, K. A.、冨田 昌宏、Wanner, B. L.、森 浩之:Escherichia Coli K-12 in-Frame, Single-Gene Knockout Mutantsの構築: 慶應コレクション。Mol. Syst. 2006, 2 (1), 2006.0008, DOI: 10.1038/msb4100050
Google Scholar
63Huang, C.; Ren, G.; Zhou, H.; Wang, C.-C. 大腸菌を用いた組換えヒトα-シヌクレインの新しい精製法。Protein Expr. Purif. 2005, 42 (1), 173- 177, DOI: 10.1016/j.pep.2005.02.014
Google Scholar
64Miranda, K. M.; Espey, M. G.; Wink, D. A. A Rapid, Simple Spectrophotometric Method for Simultaneous Detection of Nitrate and Nitrite. 一酸化窒素 2001, 5 (1), 62- 71, DOI: 10.1006/niox.2000.0319
Google Scholar
引用者
ジャンプ先
この論文はまだ他の出版物に引用されていません。
PDFをダウンロード
戻る
パートナー
Atypon Chorus Cope 出版倫理 Project Counter Crossref 類似性チェック Orcid 研究と研究者をつなぐ Portico デジタル保存サービス
ACS出版
1155 Sixteenth Street N.W.
ワシントンDC 20036
著作権 © 2024
アメリカ化学会
ACSについて
ACS出版物について
ACSとオープンアクセス
ACSメンバーシップ
ACS出版物ブログ
リソースと情報
ジャーナルA-Z
書籍とリファレンス
広告メディアキット
インスティテューショナルセールス
ACS出版センター
プライバシーポリシー
利用規約
サポート&コンタクト
ヘルプ
ライブチャット
よくある質問
ACS出版物とつながる
このウェブサイトでは、ユーザーエクスペリエンスを向上させるためにクッキーを使用しています。サイトの利用を継続することで、クッキーの使用に同意したものとみなされます。ACSのプライバシーポリシーを読む。続ける
最近表示されたモーダルを閉じる
αシヌクレインの凝集を促進する腸内細菌代謝経路を発見
この記事が気に入ったらサポートをしてみませんか?
