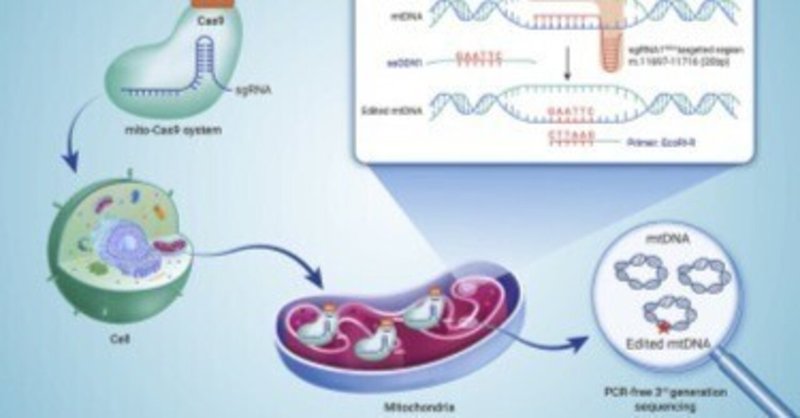
CRISPR-Cas9を介したミトコンドリアゲノム編集の直接的証拠
記事| 第3巻 第6号 100329, 2022年11月08日号
CRISPR-Cas9を介したミトコンドリアゲノム編集の直接的証拠
劉碧(Rui Bi) 10
Yu Li 10
Min Xu 10
Xingxu Huang
Ping Zheng
Yong-Gang Yao
すべての著者を表示する
脚注を表示するオープンアクセス公開日:2022年9月26日DOI:https://doi.org/10.1016/j.xinn.2022.100329
PlumX メトリクス
公開概要
mtDNA編集を成功させるためにミトコンドリア標的のCas9システムを設計した
Cas9で編集されたmtDNAをPCRフリーの第3世代シークエンスで確認した。
RAD51アゴニストRS-1はmtDNAノックイン効率を著しく向上させた
病原性のあるミトコンドリアDNA(mtDNA)変異は、ヒトの様々な疾患の原因となる。近年、ミトコンドリアを標的としたDNAヌクレアーゼやベースエディターなど、mtDNAを操作するゲノム編集技術が開発され、mtDNAの変異に起因するミトコンドリア病の治癒に期待が寄せられています。CRISPR-Cas9 システムはゲノム編集に広く用いられているツールであるが、mtDNA 編集への応用はまだ 議論の余地がある。本研究では,Cas9遺伝子の上流にミトコンドリア標的配列,下流に核内ミトコンドリア遺伝子の3′非翻訳領域を追加し,mito-Cas9システムを開発した。ミトコンドリアへの輸送を確認し,プロテイナーゼおよび DNase 保護アッセイに基づき,外来一本鎖 DNA オリゴヌクレオチド(ssODN)の mtDNA へのノックインを可能とした.さらに、ポリメラーゼ連鎖反応を用いない第三世代シークエンス技術により、mtDNAへの外来ssODNsのノックインに成功したことを検証した。また、RAD51のアゴニストであるRS-1がmito-Cas9システムのノックイン効率を著しく向上させることも実証された。CRISPR-Cas9システムを用いてmtDNAを編集できることを直接的に証明することができた。mito-Cas9 システムは、病原性 mtDNA 変異に起因するミトコンドリア疾患、特にホモプラズム mtDNA 変異を伴う疾患の治療に対する有望なアプローチとして最適化される可能性がある。
グラフィカルな要旨
図 サムネイル fx1
大きな画像を見るダウンロード 高解像度画像
キーワード
ミトコンドリア病
mtDNA編集, mito-Cas9
第三世代シークエンス
はじめに
ミトコンドリアは、細胞の代謝、エネルギー生産、アポトーシス、カルシウムの恒常性、免疫において重要な役割を担っている1,2。哺乳類のミトコンドリアは、独自のゲノム(ミトコンドリアDNA[mtDNA])を持つ二重膜小器官である。ヒトのmtDNAは16,569塩基対(bp)からなる二本鎖の円形分子で、13種類の呼吸鎖サブユニット、22種類の転移RNA、2種類のリボソームRNA(rRNA)をコードする37個の遺伝子を含んでいます3。mtDNAの変異に起因するミトコンドリア機能障害は、ヒトの様々な疾患の原因となります1,2。5 病原性mtDNA変異におけるヘテロプラスミーのレベルは、疾患の発症や臨床表現型に影響を与え、一般的に60%から95%の変異mtDNAが生化学的および臨床的障害を引き起こすとされている6,7,8。
現在、ミトコンドリア病の治癒は困難な課題として残されている。10 また、ミトコンドリア置換療法は、患者の紡錘体、前核、極体ゲノムを健康な核移植ドナーの卵子または胚に移植し、母子感染防止を図るものである4,11,12。ゲノム編集技術の急速な発展に伴い、近年、mtDNAをin vitroおよびin vivoで操作するいくつかのアプローチが確立されています13,14,15,16,17,18,19,20,21,22,23これらはmtDNA複製体成分を介して二本鎖切断(DSBs)で損傷したmtDNAを迅速に分解することを利用するものです24,25。例えば、ミトコンドリアエンドヌクレアーゼ、14,16,20 ミトコンドリア転写活性化因子様エフェクターヌクレアーゼ(mito-TALENs)など、変異した mtDNA に特異的なミトコンドリア標的の DNA ヌクレアーゼが挙げられます。 18,19,20,22 ミトコンドリアジンクフィンガーヌクレアーゼ (mito-ZFNs),13,15,17,21 およびミトコンドリアメガヌクレアーゼ23は、DSBを特異的に誘導し、変異mtDNAの分解を促進することが可能である。これらのアプローチは、変異mtDNAのヘテロプラスミックレベルを効果的にシフトさせることができるが、ホモプラスミックな病原性mtDNA変異を利用できないために限界がある13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23. 最近、ミトTALENと融合した細菌性シチジンデアミナーゼ(DdCBE)が、mtDNAのC > T転移の塩基編集を誘導することが確立され26 、マウス、ラット、ゼブラフィッシュ、植物、ヒト胚への応用に成功した27、28、29、30、31 さらに最近、核およびミトコンドリア遺伝子のC > T塩基編集を正確に行う小型亜鉛指デアミナーゼ(ZFD)32が造ら れ、治療応用におけるいくつかの利点があることが示された。同じ研究チームがmtDNA用のA > G塩基編集酵素(TALED、transcription activator-like effector-linked deaminases)も開発し、mtDNA編集の幅が広がりました。
CRISPR-Cas9システムは、ゲノム編集に広く用いられているツールである36。その基本原理は、標的とするゲノム領域にDSBを誘導し、非相同末端接合(NHEJ)、微小相同末端接合(MMEJ)、相同組み換え(HR)経路などのDSB修復経路を介してゲノム編集を完了することである37。しかし、CRISPR-Cas9によるmtDNA編集の適合性と効率性については、依然として議論の余地があります。39 第一に、哺乳類ミトコンドリアではDSB修復が非効率的ですが24、25、CRISPR-Cas9による編集の成功には不可欠であることです。第二に、ミトコンドリアへのsmall-guide RNA(sgRNA)およびCas9タンパク質複合体の送達は、困難である。最近のいくつかの研究では、CRISPR-Cas9システムを用いてmtDNAを操作することが試みられており、40,41,42,43,45では、Cas9タンパク質がミトコンドリアに輸送されること、およびsgRNAがミトコンドリア局在を示すことが確認された40,43。これらの研究のほとんどは、mtDNAコピー数の減少40,41,42,43および対立遺伝子特異的ポリメラーゼ連鎖反応(PCR)および/またはPCRベースの配列決定の陽性シグナルに基づいて、CRISPR-Cas9によって仲介されたmtDNAの操作の成功を評価している42,44。これらの研究は、CRISPR-Cas9を使用してmtDNAを操作できる可能性を示唆しているが、PCRベースの方法は、「テンプレートスイッチング」またはその他の技術的アーティファクトにより、編集されたmtDNAの検出に限界があるかもしれない46,47,48 さらに、CRISPR-Cas9によるmtDNA編集が成功したという証拠はまだ決定的ではなく、そのためGammageらはミトコンドリアゲノムが「CRISPR化」しないかもしれないと主張している39.
本研究では、mito-Cas9システムを構築し、PCRフリーの第3世代シーケンサーを用いて、外来一本鎖DNAオリゴヌクレオチド(ssODN)のmtDNAへのノックインに成功することを確認しました。さらに、RAD51の過剰発現または活性化により、mito-Cas9システムのノックイン効率が有意に上昇した。これらの結果は、CRISPR-Cas9を介したミトコンドリアゲノム編集が成功したことの直接的な証拠となる。
研究成果
mito-Cas9 システムはミトコンドリアを標的とし、mtDNA 量を減少させた。
px330-mCherryベクターのCas9のN末端の核局在配列(NLS)をCOX8AのMTSに、C末端のNLSをSOD2の3′非翻訳領域(UTR)に置換し、mito-Cas9システムを構築した(図S1)。それぞれのミトコンドリア遺伝子の MTS と 3′ UTR は、mRNA のミトコンドリア局在を効率的に媒介する 49,50 Small-guide RNA、sgRNA1ND4 (Table S1) は m.11 697-11 716 を標的とするように設計され、sgRNA の効率的な U6 転写と CRISPR-Cas9 システム全体の効率を得るために 20-bp ガイド配列の 5′ 位置に G が付加されており 37,51,52 mito-Cas9 構築物 sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 (Figure S1) を作成するためにクローニングされている。以前の研究では、未修飾の sgRNA はミトコンドリアと共分離することが示されていた 40,42,43 したがって、sgRNA のさらなる修飾は行わなかった。同様の戦略で、sgRNA2ND4 とミトコンドリア遺伝子 COX10 および SOD2 の MTS を用いた他の mito-Cas9 コンストラクトを構築した(図 S1)。
予想通り、COX8AのMTSを含むCas9構築物(sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2)をトランスフェクトしたHEK293T細胞は、同量のpx330-mCherryベクターまたはsgRNAAPP-NLS-Cas9ベクターをトランスフェクトした細胞よりも細胞質成分中に多くのCas9タンパク質を含んでいました(図1Aおよび1B )。プロテアーゼ保護アッセイを行い、低効率ではあるが、mito-Cas9システムをトランスフェクトした細胞のミトコンドリア内にCas9タンパク質が正常にトランスロケーションすることを確認した(図1C)。図1Cに示すように、Cas9タンパク質は、プロテイナーゼK処理の有無にかかわらず、複数のバンド(80〜160kDa程度)を示した。MTSを有するCas9タンパク質のごく一部は、COXIV(ミトコンドリア内膜タンパク質の陽性対照)と共に、ミトコンドリア膜によってプロテイナーゼK消化から保護されていた。一方、細胞質タンパク質β-アクチンおよびミトコンドリア外膜タンパク質MFN2(ネガティブコントロールとして使用)は、プロテイナーゼKによって完全に消化された(図1C)。ミトコンドリアに完全に局在するCOXIVとは異なり、Cas9(MTSを含むまたは含まない)はミトコンドリアに部分的に局在し、そのタンパク質レベルはプロテアーゼK処理により著しく減少した。免疫蛍光アッセイでは、MTSを有するCas9タンパク質は、ミトコンドリア緑色蛍光タンパク質と優先的に共局在化することが示された(図1D)。注目すべきは、NLSやMTSがないにもかかわらず、核や粗ミトコンドリアでCas9タンパク質の過剰発現が観察されたことである(図1A〜1D)。しかし、このようなCas9の分布パターンの理由は依然として不明である。
図サムネイルgr1
図1Mito-Cas9システムによるCas9タンパク質のミトコンドリアへの輸送とmtDNAコピー数減少の様子
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
6-carboxyfluorescein(FAM)標識sgRNA1ND4(100 bp)とpDsRed2-mitoベクター(ミトコンドリア標的赤色蛍光タンパク質[mito-RFP]を発現)を共導入したHEK293T細胞からミトコンドリアを抽出して、ミトコンドリア内にCas9タンパク質を輸送した。その結果、FAM標識したsgRNA1ND4とmito-RFPの有意な共局在化が観察された(図1E)。さらに、フローサイトメトリーにより、全ミトコンドリア抽出物中の標識ミトコンドリアの割合を定量した。FAM標識sgRNA1ND4シグナルは、比較的低い頻度ではあるが、mito-RFPで標識されたミトコンドリアにおいて検出された(図S2A)。また、ミトコンドリアを標識するためにMitoTrackerを使用しても同様の結果が観察された(図S2B)。これらの結果は、MTSおよびsgRNAを有するCas9が(部分的に)ミトコンドリア内に輸送され得ることを示唆している。
細胞内では、DSBを持つmtDNAは急速に分解されるため24、mtDNAのコピー数の減少は、mtDNA操作のマーカーとして使用することができる40,41,42。先行研究と同様に、40,41,42, 先行研究40,41,42と同様に、核標的Cas9(sgRNAAPP-NLS-Cas9)または非標的対照(MTSCOX8A-Cas9-UTRSOD2、sgRNAなしのmitoCas9)を過剰発現する細胞と比較して、mitoCas9構築物sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2を過剰発現するHEK293T細胞においてmtDNAコピー数に著しい減少が観察された(図1F)。さらに、ミトコンドリア機能に対するmito-Cas9システムの効果を評価した。ミトコンドリア標的Cas9をトランスフェクトした細胞は、核標的Cas9または標的配列を有しないCas9をトランスフェクトした細胞と比較して、活性酸素種(ROS)のレベルが著しく増加し、アデノシン三リン酸のレベルが著しく減少し(図S3A)、mito-Cas9発現時にミトコンドリア機能が低下することが示された。mito-Cas9をトランスフェクトした細胞におけるmtDNAコピー数の減少が活性酸素の増加によって引き起こされたかどうかを調べるために、ビタミンK3(vitK3、細胞の活性酸素レベルを増加させると報告されている53)およびメラトニン(細胞の活性酸素を減少させると報告されている54)で処理した細胞においてmtDNAコピー数を測定した。他のグループと比較して、mito-Cas9をトランスフェクトした細胞は、処理に関係なく、mtDNAのコピー数の有意な減少を示した(図S3C)。
異なるmtDNA領域を標的とする代替sgRNAを有するmito-Cas9構築物が依然としてmtDNA編集に適用できるかどうかを調べるために、MT-ND4遺伝子のm.11 851-11 868(20 nt)領域を標的とするsgRNA2ND4(表S1)を使用した。その結果、sgRNA2ND4-MTSCOX8A-Cas9-UTRSOD2構築物を過剰発現させると、mtDNAのコピー数が有意に減少した(図S4A)。このように、ここで確立したmito-Cas9システムは、ミトコンドリアを標的とし、mtDNAのコピー数の減少を誘導することに成功した。
Mito-Cas9システムによる相同性指向性修復を介したmtDNAへの外来性ssODNのノックイン
哺乳類のミトコンドリアでは、MMEJ を介した DSB 修復と HR を介した DSB 修復が存在することが証明されつつある55, 56, 57, 58。ここでは、mito-Cas9 システムが mtDNA の相同指向性修復を仲介できるかどうかを検討した。40bp 以上の相同性アームが高いノックイン効率を示すという過去の知見に基づき、45bp の相同性アーム(左アーム: m.11 669-11 713 と相同、右アーム: m.11 714-11 758 と相同)を含む 96bp ssODN1 ドナーテンプレート(図 2A ; 表 S1)を設計し、 EcoRI サイト(GAATTC)6bp を挟みこんでおいた(表 S1)。ssODN1ドナーテンプレートおよびCas9構築物をHEK293T細胞に48時間共トランスフェクトした後、EcoRI部位特異的プライマー対L11338/EcoRI-Rを用いたPCRおよび定量的リアルタイムPCR(qRT-PCR)を用いてmtDNAの相同指示修復を分析した(図2Aおよび2B ;表S1)。EcoRI部位特異的PCR産物は、MTSCOX8A-Cas9-UTRSOD2単独でトランスフェクトした細胞では検出されず、ssODN1単独でトランスフェクトした細胞で検出された(図2BおよびS5)。これは、ssODN1テンプレートとmtDNA分子間の「テンプレートスイッチング人工物」の可能性に一部起因すると考えられる46,47,48。一方、sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2とssODN1を組み合わせてトランスフェクトした細胞では、異なる対照と比較して、EcoRI部位特異的PCR産物が著しく増加した (図2B)。また、p.D10A と p.H840A の2つの変異を導入し、SpCas9タンパク質の触媒活性を消失させたsgRNA1ND4 を標的としたミトdCas9 (dead Cas9) をコントロールとして構築した60,61。ミトdCas9システムのEcoRI部位特異的PCR産物の相対レベルは、ssODN1単独またはssODN1 + MTSCOX8A-Cas9-UTRSOD2 (sgRNAなし)をトランスフェクトしたコントロールと比較して有意差は見られなかった(図2C)。これらの結果から、Cas9活性はmito-Cas9系に必須であることが示された。EcoRI部位特異的PCR産物の増加が、mito-Cas9システムを用いたssODN1の潜在的により高いトランスフェクション効率/安定性に起因するかどうかを調べるために、FAM標識したssODN1(トランスフェクション後にミトコンドリアに導入可能、図S6A)およびmCherryタグ付きCas9ベクター(異なる標的配列を有するかまたは有さない)でHEK293T細胞をトランスフェクションさせた。蛍光標識された細胞の割合は、フローサイトメトリーによって定量化された。トランスフェクトされた細胞間で同様のレベルの標識細胞を観察し(図S6B)、ssODN1が、異なるssODN1およびCas9ベクターの組み合わせにおいて同様のレベルのトランスフェクション効率を示すことが示された。
図サムネイルgr2
図2ミトCas9システムによる外来性ssODNsのmtDNAへの効率的なノックイン
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
次に、EcoRI部位特異的PCR産物の直接塩基配列決定により、mtDNAのsgRNA1ND4標的部位への「GAATTC」配列の挿入を確認した(図2D)。さらに、ミトコンドリア遺伝子(COX8A、COX10、またはSOD2)の異なるMTSを有するmito-Cas9構築物は、外因性ssODNの同様のノックイン効率を示すことが分かった(図2E)。PCR中の「鋳型交換アーチファクト」の潜在的な影響を除外するために、トランスフェクション後48時間、96時間、144時間におけるトランスフェクト細胞内のssODN1レベルを定量化した。その結果、ssODN1をトランスフェクトした細胞では、EcoRI部位特異的PCR産物の相対量が時間とともに著しく減少し、144時間後にはほとんど検出されなくなることがわかった(図S7)。対照的に、ssODN1とmito-Cas9システムでトランスフェクトした細胞は、各時点でssODN1単独でトランスフェクトした細胞と比較して、有意に高いレベルのEcoRI部位特異的PCR産物を含んでいた(図S7)。注目すべきは、EcoRI部位特異的PCR産物の減少が時間とともに観察され(図S7)、これは編集mtDNAを有する細胞と比較して野生型mtDNAを有する細胞の高い増殖率に起因する可能性があることである。
さらに、mtDNAの他の供給源(例えば、損傷したミトコンドリアからのmtDNA断片の細胞質への漏出)またはmtDNA様断片(例えば、, ミトコンドリア外の核ミトコンドリア偽遺伝子62) は、mito-Cas9 システムの標的として認識される可能性があるため、ミトコンドリア内に位置する mtDNA への外来性 ssODN のノックイン成功の検証のために DNase 保護測定を行った(図 2F)。DNase I処理により、核のAPP遺伝子についてはPCR産物が増幅されなかったが(図2F)、mtDNA PCR産物(プライマー対L11338/H11944により増幅)およびEcoRI部位特異的PCR産物は目に見えた。これは、外因性のssODNがmtDNAに挿入されて、ミトコンドリア膜によりDNase I消化から保護されていることを示したものである(図2F)。EcoRI部位特異的PCR産物の定量化は、粗mtDNA(DNase-)および精製mtDNA(DNase+)の両方において、mito-Cas9構築物sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2がssODN1のノックイン効率を著しく増大することを示した(図2G)。EcoRI部位特異的PCR産物は、標的部位とノックイン部位を変更した場合にも検出された(図S4B〜S4D)。ssODN2単独、またはssODN2とMTSCOX8A-Cas9-UTRSOD2の組み合わせ(sgRNAなし)でトランスフェクトした細胞と比較して、sgRNA2ND4-MTSCOX8A-Cas9-UTRSOD2とssODN2の組み合わせでトランスフェクトした細胞は、EcoRI部位特異的PCR産物の著しい増加を示し(図S4D)、mito-Cas9システムによるノックインはCRISPR-Cas9編集に適したあらゆる部位に適用できることが明らかにされた。これらの結果は、mito-Cas9 システムが HR 修復経路を通じて mtDNA への外来性 ssODN のノックインを仲介できることを示しています。
第三世代シークエンスにより、mito-Cas9システムによる外来ssODNのmtDNAへのノックインが検証された。
EcoRI部位特異的PCR産物が、外来性ssODNsとmtDNA間のテンプレートスイッチングアーチファクト46,47,48などのPCRアーチファクトによる可能性を排除するために、PCRフリーの第3世代シーケンシングを行い、外来性ssODNsのmtDNAへのノックインを確認した(図3A )。ssODN1 ドナー テンプレートと mito-Cas9 構築物 sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 を HEK293T 細胞に 48 時間共トランスフェクトした。ssODN1 のみまたは ssODN1 と MTSCOX8A-Cas9-UTRSOD2 (sgRNA なし ) を組み合わせたものでトランスフェクトした細胞をコントロールとして考慮した。DNase I処理したミトコンドリアから単離した精製mtDNAを直線化するためにBamHI消化を使用した(図3A)。全ゲノムDNAはBamHIにより完全に消化され、ゲル上に明確なバンドを示さなかったが、直線化に成功したmtDNAは、BamHI消化後のmtDNAの単一バンドによって証明された(図S8A)。また、プライマー対L14054/H14573を用いたqRT-PCRにより、BamHI部位に隣接するmtDNA断片を定量することで線形化の効率を測定した(表S1;線形化されたmtDNAはL14054/H14573では増幅できなかった)。BamHIを受けた精製mtDNAでは未消化試料と比較してPCR産物が著しく減少しており、mtDNAは十分に線形化されたと考えられる(図S8B)。PCRフリーPacBioシーケンサーを用いた線状化mtDNAの直接塩基配列決定により、約16 kbに明確な配列ピークが得られ(図3B、左)、mtDNAゲノムの完全長捕捉と塩基配列決定が行われたことが示された。mtDNA参照配列63と核ミトコンドリア(NUMTs)参照配列64を用いたReads Mappingでは、NUMTsにマッピングされたリードのほとんどが<16 kbであった(図3C、左図)。そこで、NUMTよりもmtDNAへのマッピング率や一致度が高い16 kb以上のリードのみを以下の解析に使用し、NUMTやその他のアーチファクトの影響を確実に排除した。ミトコンドリアゲノム全体から読み取ったmtDNAにおいて、sgRNA1ND4標的部位にGAATTCが正確に挿入されていることを確認した(図3D)。注目すべきは、sgRNA1ND4標的部位へのGAATTCの挿入頻度が、MTSCOX8A-Cas9-UTRSOD2(sgRNAなし)+ ssODN1(3/22,995, 0.0087%)でトランスフェクトした対照細胞よりもsgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2+ssODN1でトランスフェクトした細胞でより高く観察されています(図3E、上段)。どちらのサンプルでも、極めて低い頻度でmtDNAゲノム全体にランダムに分布するGAATTC挿入が観察され(図3E、上)、これは第3世代シーケンサー技術の潜在的なエラーに起因している可能性があります65。
図サムネイルgr3
図3第3世代シーケンサーによりmito-Cas9システムにより導入されたmtDNA編集が確認される
キャプションを表示
大きな画像を表示するダウンロード 高解像度画像
これらの標的挿入がPacBio Sequel IIのシーケンスエラーによって導入された可能性を排除するため、別のPCRフリーシーケンス法であるNanoporeシーケンスを用いて、sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 + ssODN1でトランスフェクトした細胞から抽出したmtDNAのシーケンスを行いました。mtDNAゲノム全体にわたるリード(16,569 bp付近にピーク;図3Bおよび3C、右)を捕捉したところ、sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 + ssODN1でトランスフェクトした細胞(2/41万1780)では、ssODN1のみでトランスフェクトした細胞(1/31万4840)と比べて高い割合のGAATTC挿入を確認しました(図3E、下段)。PacBioのデータでは、mtDNAゲノム全体にいくつかの非標的GAATTC挿入を確認したが(図3E、上)、これらの挿入はNanoporeシーケンスデータでは再現されず(図3E、下)、ほとんどの非標的挿入はPacBioシーケンスエラーによってもたらされたと考えられた65。sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 + ssODN1 (n = 6) でトランスフェクトした細胞では、ssODN1単独 (n = 2) でトランスフェクトした細胞よりもsgRNA1ND4標的領域で10 kbより大きいmtDNA配列に正確なGAATTC挿入が高い頻度で確認された (図3F)。全体として、異なる長さのカットオフ(10〜16kbまで)を有するmtDNA配列における標的挿入の総数は、ssODN1単独でトランスフェクトした細胞よりもmito-Cas9システムでトランスフェクトした細胞において一貫して高かった(図3F)。したがって、mito-Cas9 システムをトランスフェクトした細胞における標的挿入の高い割合は、ランダムな配列決定エラーによるものとは考えにくく、mito-Cas9 システムの編集能力を示している可能性がある。ssODN1単独でトランスフェクトした細胞における標的挿入の発生は、非常に低い頻度であっても、今後さらに注目し、重点的に研究する必要がある。これは、mito-Cas9システムがない場合のmtDNA複製の開始におけるssODN1の予想外の役割を示唆しているかもしれない(Biら、未発表のデータ)。
RAD51の活性化はmito-Cas9システムのノックイン効率を向上させた
さらに、ゲノムの安定性維持や修復経路に関わるそれらの因子を調節することで、mito-Cas9 システムのノックイン効率を向上させることができるかどうかを検証した。RAD51 や XRCC3 などの HR 経路の主要な因子は、DNA 損傷ストレス下でミトコンドリア に動員され、mtDNA の維持に関与することができる。我々の mito-Cas9 システムは HR を介した効果に基づいているため、核 DNA に対する Cas9 によるノックイン効率が示すように、RAD51 の機能を強化することで mtDNA への ssODN のノックイン効率が向上すると仮定した68,69,70。mito-Cas9 コンストラクト sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 および/または ssODN1 をトランスフェクトした HEK293T 細胞を RAD51 アゴニスト RS-1 (10 μM) で 42 時間処理し、編集した mtDNA のレベルを定量した(図 4B)。RS-1によるRAD51の刺激は、mito-Cas9システムのノックイン効率を有意に増加させたが(図4B)、RS-1は、ssODN1単独でトランスフェクトした細胞、または他の3つのコントロール(ssODN1なしのmito-Cas9、sgRNAなしのmito-Cas9および別の領域を標的とするsgRNA2ND4のmito-Cas9)に対して有意に影響しなかった(図4Bおよびs9a)。RAD51 タンパク質の過剰発現は、RAD51 アゴニストの処理と同様に、mito-Cas9 システムのノックイン効率を著しく増加させた (図 4C および S9B)。しかしながら、RAD51 のノックダウンまたは RI-171 による RAD51 の阻害は、mito-Cas9 システムのノックイン効率に全く、または弱い影響を与えた (図 4C, 4D, S9C, および S9D) ことは、RAD51 をノックダウンまたは阻害した細胞において、ゲノム安定性の維持中に補償効果が生じる可能性を示唆している。興味深いことに、sgRNA1ND4-NLS-Cas9とssODN1をトランスフェクトした細胞では、ssODN1のみをトランスフェクトした細胞と比較して、EcoRI部位特異的PCR産物シグナルの増加が観察された(図4B)。これは、NLS非存在下での核輸入型Cas9で観察されたのと同様に、Cas9とssODN1を導くsgRNA1ND4のレベルが最小であるか、Cas9とssODN1のミトコンドリアへの浸透が原因ではないかと推察された(図1A)。
図サムネイルgr4
図4RAD51はmito-Cas9システムを介したmtDNA編集に関与していた
キャプションを表示
大きな画像を表示するダウンロード 高解像度画像
さらに、第二世代シーケンサーを用いて、mito-Cas9システムのノックイン効率を定量化した。ssODN1以外のプライマーペアを用いて、粗製および精製mtDNAのノックインサイト(m.11 600-11 820)を挟む断片をそれぞれ増幅し(表1;図S9E)、PCR産物を第2世代シーケンシングに供した。ssODNのノックインがシークエンスリードで確認された(表1;図S9E)。qRT-PCRの結果と一致して、mito-Cas9構築物sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2およびssODN1をトランスフェクトしたHEK293T細胞では、RS-1処理によって粗mtDNAにおけるノックイン効率(0.14%)が、RS-1処理なしの細胞におけるもの(0.03%、p < 2.2 × 10-16, Fisherの正確検定)と比べて5倍近く増加した(Table 1)。精製したmtDNAでは、ノックイン頻度がさらに増加した(0.23%; p < 2.2 × 10-16, フィッシャーの正確な検定)(表1)。注目すべきは、ssODN1のみをトランスフェクトした細胞では、mito-Cas9コンストラクトとssODN1をトランスフェクトした細胞に比べ、ノッキングを伴う配列リードの相対数が著しく低い(p < 2.2 × 10-16, フィッシャーの正確検定)ことである(Table 1)。さらに、ssODN1をトランスフェクトした細胞では、RS-1処理の有無に関わらずノックイン効率に大きな変化は見られなかったことから、ssODNを単独でトランスフェクトした細胞におけるGAATTCノックインによる配列読み取りは、HRを介さないことが示唆された(Table 1)。
表 1 第 2 世代シーケンサーによる GAATTC ノックインリードの頻度
サンプル 総リード数 GAATTC挿入リード数 ノックイン率
粗mtDNA
ssODN1 5,028,392 343 0.00006821
ssODN1 + RS-1 6,838,719 324 0.00004738
mito-Cas9 + ssODN1 5,367,579 1608 0.00029958
mito-Cas9 + ssODN1 + RS-1 6,208,098 8839 0.00142379
精製mtDNA
ssODN1 + RS-1 5,991,432 210 0.00003505
mito-Cas9 + ssODN1 + RS-1 4,992,779 11,714 0.00234619
ノックインサイトに隣接する短いPCR断片(mtDNAのm.11 600-11 820領域)にGAATTCを挿入したシーケンシングリードのカウント数。Crude mtDNAと精製mtDNAをそれぞれPCRのテンプレートとして使用し、PCR産物を第2世代シークエンス技術で配列決定した。Crude mtDNA、ssODN1単独、mito-Cas9システム(sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2およびssODN1)をトランスフェクトしたHEK293T細胞の粗ミトコンドリアから、RS-1処理ありまたはなしで分離したmtDNA;精製mtDNA、DNase I消化後に粗ミトコンドリアから分離したmtDNA。
新しいタブで表を開く
これらの結果を総合すると、RAD51は外来ssODNのmtDNAへのノックインに重要な因子であることが示唆された。また、RS-1はRAD51の活性化を通じてmito-Cas9システムのノックイン効率を高め、HRを介したmtDNAへの外来ssODNのノックインがさらに支持された。テンプレートスイッチングアーチファクトや他の潜在的な要因が、ノックイン頻度の解釈に関して多少のノイズをもたらすかもしれないが、このノイズがグループ間で観察された有意差に寄与したとは考えにくい。
mito-Cas9システムによる核内ゲノムの明らかなオフターゲットサイトの欠如
sgRNA1ND4-MTSCOX8A-Cas9-UTRSOD2 + ssODN1 および sgRNA2ND4-MTSCOX8A-Cas9-UTRSOD2 + ssODN2 をそれぞれトランスフェクトした HEK293T 細胞から分離したゲノム DNA について全ゲノム配列決定(WGS)を実行した。2つのサンプルの平均配列深度は約34×であった。核内ゲノムは、「NGG」または「NAG」プロトスペーサー隣接モチーフを持ち、sgRNAに対して最大9つのミスマッチを持つ潜在的オフターゲットサイトについてスクリーニングされた。sgRNA1ND4およびsgRNA2ND4の潜在的なオフターゲットサイトには、挿入や欠失は確認されなかった(表S2)。さらに、WGSデータを用いてGAATTCの挿入について全ゲノムをスクリーニングした。このことから、第3世代シーケンサーのmtDNAリードにおけるGAATTCノックインは、核DNAやNUMTからのオフターゲットおよび/または非特異的ノックインの可能性によって引き起こされたものではないことが示された72。
mito-Cas9システムを用いたmtDNA病原性突然変異の生成
MT-ND1遺伝子の遺伝子内逆転変異m.3902_3908inv (m.3902_3908 ACCTTGC>GCAAGGT) は、致死性の乳児乳酸症とミトコンドリアミオパシーの原因となると報告されているが73, 74、現在のところそのメカニズムは不明であった。ここでは、同じ戦略で、m.3902_3908inv 変異を HEK293T 細胞に導入する mito-Cas9 システムを設計した(図 5A )。ミトコンドリア内の mtDNA における ssODN3902 のノックインが成功したことは、DNase 保護アッセイを用いて実証された (図 5B) 。ssODN1ND4およびssODN2ND4ノックイン実験からの以前の観察と一致して、mito-Cas9構築物とssODN3902を共導入した細胞は、ssODN3902単独またはssODN3902とMTSCOX8A-Cas9-UTRSOD2の組み合わせ(sgRNAなし)でトランスフェクトした細胞と比べてm.3902_3908inv特異的PCR産物の有意な増加を示した(図5C)。さらに、第二世代のシークエンスリードにおいて、変異m.3902_3908invが同定された(図5D)。変異 m.3902_3908inv のノックイン効率は約 0.05% (5,284,619 生リードのうち 2,432 リードの編集に成功)であった。これらの結果は、mito-Cas9システムがmtDNAの標的ノックインの有望なアプローチとして機能する可能性を示唆しており、mtDNAの病原性変異を研究するための細胞モデルを確立するための実行可能な方法として最適化される可能性があることを示唆している。
図サムネイルgr5
図5HEK293T細胞のmtDNAに病原性突然変異m.3902_3908invが導入された様子。
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
考察
現在、CRISPR-Cas9によってmtDNAが編集されるかどうかは議論の余地がある。4,39,40 NHEJ修復がないため、DSBを持つmtDNAは急速に分解され24、結果としてmtDNAコピー数が減少し、これまでの研究ではmtDNA編集産物は直接検出されていなかった40,41,42。本研究では、Cas9にMTSを添加することに加え、Cas9 mRNAの効率的なミトコンドリア局在を促進するために、Cas9遺伝子の下流領域にSOD2遺伝子の3′UTRを追加し、ミトコンドリア標的Cas9系を最適化した40, 41, 42, 43, 44,45. 開発したmito-Cas9システムは、Cas9をミトコンドリア内に輸送し(図1C)、mtDNA操作を可能にすることを確認した。重要なことは、PCR増幅に起因するアーチファクト(テンプレートスイッチングアーチファクトなど)を効果的に回避するPCRフリーの第3世代シーケンサー技術を開発し、mito-Cas9システムを用いて外来ssODNをmtDNAに正確にノックインすることを検証したことである(図3)。ミトコンドリア標的CRISPR-Cas9システムの有効性と効率性を確認するためのもう一つの簡単なアプローチは、mtDNAに基づく薬剤耐性を導入することによって操作することができる。現在、我々は、クロラムフェニコールによる選択を容易にする、mtDNA の 16S rRNA に m.2991T>C という変異を持つ薬剤耐性細胞株の樹立を試みている75。
これまでの研究で、40bp以上の相同アームは短いアームよりも高いHR効率を示すことが示されている37,59。この観察に基づいて、3つのssODN(ssODN1、ssODN2、ssODN3902)の相同アームを、すべて45bpの長さで設計した。また、より短い腕(22 bp)を持つssODN50のノックイン効率についても検討した。その結果、ssODN50のノックイン効率は、ssODN1のノックイン効率に比べ、著しく低いことがわかった(図S10)。このように、ssODNのノックイン効率はその長さに影響される可能性があり、ssODNの安定性とミトコンドリア輸送効率のバランスを考慮して相同腕の長さを最適化することが、mito-Cas9システムのノックイン効率を高めるために有用である可能性が示された。
ミトコンドリアゲノムの安定性を維持する機構は、未だ解明されていない。特に、2つの主要なDNA修復経路については、ミトコンドリアではNHEJが検出されず、ミトコンドリアにおけるHRの存在については議論がある。以前の研究58と同様に、HR修復経路の重要な核内因子であるRAD51がミトコンドリアへ移動し(図4A)、作動薬RS-1でその活性化によりssODNのmtDNAへのノックイン効率が2-5倍増加することが分かった(図4B)。さらに、RAD51活性化の効果は、mito-Cas9システムをトランスフェクトした細胞に特異的であるように思われた(図4、表1)。これらの知見と第三世代シーケンサーの結果は、mtDNAがHR経路の影響を受け、RAD51刺激によるHR経路の活性化がmtDNAにおけるCRISPR-Cas9を介したノックインを促進する可能性があることを示唆している。未解決の問題の一つは、ssODNがどのようにミトコンドリアに輸入されるかということであり、さらなる研究が必要である。いくつかの研究により、動物細胞および植物においてDNAおよびRNAがミトコンドリアに輸送されることが示されており42,77,78,79,80、我々の研究は、FAM標識sgRNAおよびssODN1がミトコンドリアに輸送されることを示すさらなる証拠を提供している(図1E、S2、およびS6A)。
mtDNA 編集への熱意は,病原性 mtDNA 変異によって引き起こされるミトコンドリア病の治療に対する臨床的必要性に由来しており,そのほとんどはヘテロプラズム状態である.ホモプラズムのmtDNA変異に対しては、塩基編集26,32,33やCRISPR-Cas9を介したHRノックインが変異体mtDNAの編集に有効である。しかし、mtDNA編集の重要な問題の一つは、各細胞が数百から数千のmtDNAコピーを持つ可能性があり、各コピーの編集は不可能であることである。このため、mtDNA編集技術を利用して、mtDNAの変異に起因するミトコンドリア病を治療することは、依然として大きな課題である。本研究では、mito-Cas9システムのノックイン効率は、最近開発されたDdCBE法(5%-50%)と比較して、0.03%-0.23%とかなり低かった26。この低効率は、編集システムのミトコンドリア輸送が非効率的で、Cas9タンパク質によるmtDNAの編集効率が限られるためだと推測された。したがって、ミトコンドリアRNA輸送などのミトコンドリア輸送効率の向上(ただし、ミトコンドリアへのRNA輸入を制御できるPNPASEを過剰発現した細胞81では、RAD51を過剰発現した細胞と比較してmtDNA編集効率が向上しなかった[データ示さず])、あるいは編集効率の高い人工Casタンパク質82の使用によるmtDNA編集システムの最適化が本システム適用のために必須であると思われた。さらに、ノックイン効率は変異の種類によって異なり、これは標的領域の配列の特徴(すなわち、GC%含有量)またはsgRNAの標的効率の違いに起因すると思われる。編集効率には限界があるものの、mito-Cas9システムは、変異体置換の範囲が広く、同じ編集ウィンドウ内の他の遺伝子座を変更することなく標的変異体を正確にノックインできる可能性があり、特にミトコンドリアの塩基編集者が核ゲノムに広範なオフターゲット編集を誘導するという最近の知見を考えると、mtDNA操作の代替戦略として機能する34,35。さらに、mito-Cas9システムを用いてごく一部の野生型mtDNAを誘導し、mito-ZFNまたはmito-TALEN技術を用いて野生型mtDNAのヘテロプラズムレベルを変化させることは、ホモプラズム病原mtDNA変異を編集する有望な戦略であると考えられる。
結論として、我々はCRISPR-Cas9によるHR経路を介したノックインに基づくmtDNA編集システムを確立し、RAD51アゴニストRS-1がmtDNAノックイン効率を有意に高めることを見出した。PCRフリーの第3世代シーケンサーを用い、CRISPR-Cas9システムを介したmtDNA編集の直接的な証拠を提供することができた。今後、mtDNAの変異に起因するミトコンドリア病の治療において、mito-Cas9システムの応用と安全性を拡大するために、編集効率を高めるための研究が不可欠である。
材料と方法
詳細な材料と方法は、補足情報に含まれています。
データアクセス
本研究の成果を裏付けるデータは、合理的な要求があれば、対応する著者から入手可能である。配列データはGSA (https://ngdc.cncb.ac.cn/gsa/) にアクセッション番号HRA001435で寄託されている。
謝辞
Ge Shan教授の有益な議論、Christine Watts博士の言語編集、Jiankui Zhou博士のPST1374-Cas9ベクターとp.H840A変異を持つpST1374-N-NLS-flag-linker-Cas9-D10Aベクターを共有することに感謝する。本研究は、国家科学技術革新2030主要プログラム ( 2021ZD0200900 )、中国国家自然科学基金 ( U1702284 and 31970560 )、雲南省 ( 202003AD150009 and 2019FA027 )、中国科学院 (CAS) 戦略重点研究プログラム (B) ( XDB32020200 )により支援されたものである。
著者による寄稿
Y.-G.Y.、R.B.、X.H.、H.Z.、P.Z.が研究を設計した。R.B.とY.L.は、mito-Cas9システムを構築した。M.X.は第3世代シーケンシングを行い、データを解析した。Q.Z.、B.X.、X.Z.は、DNAの抽出とPCR解析を行った。D.-F.Z.とX.L.は第二世代シークエンスを行い、結果を解析した。R.B.とG.M.はフローサイトメトリーを実施した。Y.-G.Y.、R.B.、M.X.、Y.L.は論文の第一稿を執筆した。すべての著者は、最終版の原稿に貢献し、承認した。
利害関係者の宣言
著者らは、競合する利害関係を宣言しない。
補足資料
pdfをダウンロード(0.8MB)
pdfファイルに関するヘルプ
資料S1. 図S1〜S10および材料と方法
.xlsxをダウンロード(.01 MB)
xlsx ファイルに関するヘルプ
資料S2. 表S1
ダウンロード .xlsx (.93 MB)
xlsxファイルに関するヘルプ
資料S3. 表S2
リードコンタクトのウェブサイト
http://sourcedb.kiz.cas.cn/yw/zjrc/sc/200908/t20090825_2446617.html.
参考文献
Schon E.A.
ディマウロ S.
平野正人
ヒトミトコンドリアDNA:遺伝性変異と体細胞変異の役割。
Nat. Rev. Genet. 2012; 13: 878-890
記事で見る
スコープス (502)
PubMed
クロスリファレンス
グーグル奨学生
ラーマン J.
ラーマンS.
オミックス時代のミトコンドリア医学。
Lancet. 2018; 391: 2560-2574
記事で見る
スコープス(130)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ファルケンベルグ M.
ラルソン N.G.
Gustafsson C.M.
哺乳類ミトコンドリアにおけるDNA複製と転写。
Annu. Rev. Biochem. 2007; 76: 679-699
論文で見る
スコープス (498)
PubMed
クロスリファレンス
グーグル奨学生
パタナナンA.N.
ウー T.H.
チョウ・P.Y.
テイテル・M.A.
ミトコンドリアゲノムを改変する。
Cell Metab. 2016; 23: 785-796
記事で見る
スコープス (84)
PubMed
要旨
全文
全文PDF
Google Scholar
ヤオ Y.G.
梶ヶ谷 聡
ヤング N.S.
単一ヒト血液細胞におけるミトコンドリアDNAの突然変異。
Mutat. Res. 2015; 779: 68-77
記事で見る
スコープス (14)
PubMed
Crossref
グーグル奨学生
ラッセルO.
ターンブルD.
ミトコンドリアDNA疾患-分子的洞察と治療への潜在的なルート。
Exp. セル・レス. 2014; 325: 38-43
記事で見る
スコープス (64)
PubMed
クロスリファレンス
グーグル奨学生
テイラーR.W.
ターンブルD.M.
ヒトの病気におけるミトコンドリアDNAの突然変異
Nat. Rev. Genet. 2005; 6: 389-402
記事で見る
スコープス (1281)
PubMed
クロスリファレンス
グーグル奨学生
ウォレス D.C.
カルキアD.
ミトコンドリアDNAの遺伝学と進化および疾患におけるヘテロプラスミーの難問。
コールドスプリングハーブ。Perspect. Biol. 2013; 5: a021220
記事で見る
スコープス (228)
パブコメ
クロスリファレンス
グーグル奨学生
エルーゼ S.
オーギュスタンS.
ブアイタA.
他。
ヒトミトコンドリアND4の最適化された同位体発現は、ミトコンドリア機能不全のラットモデルにおける失明を防ぐ。
Am. J. Hum. Genet. 2008; 83: 373-387
記事で見る
スコープス (164)
パブコメ
概要
全文
全文PDF
Google Scholar
ビ R.
ローガン I.
ヤオ Y.G.
Leber hereditary optic neuropathy: a mitochondrial disease unique in many ways.
Handb. Exp. Pharmacol. 2017; 240: 309-336
記事で見る
スコープス (6)
PubMed
クロスリファレンス
グーグル奨学生
ハーバート M.
ターンブルD.
ミトコンドリア補充療法の進歩。
Nat. Rev. Mol. Cell Biol. 2018; 19: 71-72
記事で見る
スコープス(40)
PubMed
Crossref
グーグル奨学生
カン・E.
ウー・ジェイ
Gutierrez N.M.
他。
病原性ミトコンドリア DNA 変異を有するヒト卵子におけるミトコンドリア置換。
Nature. 2016; 540: 270-275
記事で見る
スコープス(173)
PubMed
クロスリファレンス
グーグル奨学生
ミンチャックM.
パップワースM.A.
ミラーJ.C.
他
変異ヒトミトコンドリアDNAを選択的に分解する一本鎖準二量体亜鉛フィンガーヌクレアーゼの開発。
核酸医薬研究 2008; 36: 3926-3938
記事で見る
Scopus (145)
PubMed
クロスリファレンス
グーグル奨学生
田中真一
ボルゲルドH.J.
Zhang J.
他
制限酵素SmaIをミトコンドリア内に導入することによるミトコンドリア病の遺伝子治療。
J. Biomed. Sci. 2002; 9: 534-541
記事で見る
PubMed
グーグル奨学生
ガメージ・P.A.
ビスコミC.
シマールM.L.
他
ミトコンドリアにおけるゲノム編集は、生体内で病原性mtDNA変異を修正する。
Nat. Med. 2018; 24: 1691-1695
記事で見る
スコープス(140)
パブメド
クロスリファレンス
グーグル奨学生
バックマンS.R.
ウィリアムズS.L.
ドゥアンD.
モラエスC.T.
ミトコンドリア標的制限エンドヌクレアーゼのAAV9媒介による新生児マウスの全筋肉におけるmtDNA異形成の操作。
Gene Ther. 2012; 19: 1101-1106
記事で見る
スコープス (59)
PubMed
クロスリファレンス
グーグル奨学生
ガメージ・P.A.
ロルバッハJ.
ヴィンセントA.I.
他
大規模な欠失や点変異を有する病原性ミトコンドリアゲノムを選択的に分解するためのミトコンドリア標的ZFN。
EMBO Mol. Med. 2014; 6: 458-466
記事で見る
スコープス (175)
パブコメ
クロスリファレンス
グーグル奨学生
バックマンS.R.
カウピラJ.H.K.
ペレイラC.V.
他
MitoTALENは、ヘテロプラスミックmtDNA変異のマウスモデルにおいて、変異mtDNA負荷を低減し、tRNA(Ala)レベルを回復させる。
Nat. Med. 2018; 24: 1696-1700
記事で見る
スコープス(125)
パブメド
クロスリファレンス
グーグル奨学生
ペレイラ C.V.
バクマンS.R.
アルゲーロT.
他
mitoTev-TALE:変異型ミトコンドリアDNAレベルを減少させる単量体DNA編集酵素。
EMBO Mol. Med. 2018; 10: e8084
記事で見る
スコープス(44)
PubMed
クロスリファレンス
グーグル奨学生
レディP.
オカンポA.
鈴木健一
他
ゲノム編集による生殖細胞内のミトコンドリア変異の選択的除去。
Cell. 2015; 161: 459-469
記事で見る
スコープス (192)
パブコメ
概要
全文
全文PDF
Google Scholar
ミンチャック M.
パップワースM.A.
コラシンスカP.
他。
キメラ型ジンクフィンガーメチラーゼによるミトコンドリアDNAの配列特異的修飾。
Proc. Natl. Acad. Sci. USA. 2006; 103: 19689-19694
記事で見る
スコープス (119)
PubMed
クロスリファレンス
グーグル奨学生
バックマンS.R.
ウィリアムズS.L.
ピントM.
他。
mitoTALENsによる患者由来細胞の変異ミトコンドリアゲノムの特異的除去。
Nat. Med. 2013; 19: 1111-1113
記事で見る
スコープス(260)
PubMed
クロスリファレンス
グーグル奨学生
ゼコニートU.
バックマンS.R.
スミスJ.
ら。
ミトコンドリア標的メガヌクレアーゼを用いた生体内変異型mtDNAの排除プラットフォーム
Nat. Commun. 2021; 12: 3210
記事で見る
スコープス (13)
PubMed
クロスリファレンス
グーグル奨学生
ペーバV.
ブレイD.
トロンブリーG.
他。
リニアミトコンドリアDNAは、複製装置の構成要素によって急速に分解される。
Nat. Commun. 2018; 9: 1727
記事で見る
スコープス (88)
PubMed
クロスリファレンス
グーグル奨学生
モレトンA.
モレルF.
マカオB.
他。
二本鎖切断に伴う選択的なミトコンドリアDNA分解。
PLoS One. 2017; 12: e0176795
記事で見る
スコープス (75)
PubMed
クロスリファレンス
グーグル奨学生
モク B.Y.
デ・モラエスM.H.
Zeng J.
他。
細菌のシチジンデアミナーゼ毒素がCRISPRフリーのミトコンドリア塩基編集を可能にする。
ネイチャー. 2020; 583: 631-637
記事で見る
スコープス (216)
PubMed
クロスリファレンス
グーグル奨学生
リー・エイチ
リーS.
Baek G.
他。
DddA-TALE融合デアミナーゼを持つマウスにおけるミトコンドリアDNA編集。
Nat. Commun. 2021; 12: 1190
記事で見る
スコープス (36)
PubMed
クロスリファレンス
グーグル奨学生
郭 傑(Guo J.
Zhang X.
チェンX.
他。
DdCBEを介したmtDNA塩基編集によるゼブラフィッシュのミトコンドリア疾患の精密モデリング。
Cell Discov. 2021; 7: 78
記事で見る
スコープス (15)
PubMed
クロスリファレンス
グーグル奨学生
カン B.C.
ペ・S.J.
Lee S.
他。
植物における葉緑体およびミトコンドリアDNA編集。
Nat. Plants. 2021; 7: 899-905
記事で見る
スコープス (29)
PubMed
クロスリファレンス
グーグル奨学生
チェン X.
Liang D.
Guo J.
他。
ヒト3PN胚におけるDdCBEを介したミトコンドリア塩基編集。
Cell Discov. 2022; 8: 8
記事で見る
スコープス (0)
PubMed
クロスリファレンス
グーグル奨学生
Wei Y.
Xu C.
Feng H.
他。
ヒト裂開胚はDdCBEによる効率的なミトコンドリア塩基編集を可能にする。
Cell Discov. 2022; 8: 7
記事で見る
スコープス (3)
PubMed
クロスリファレンス
グーグル奨学生
リム・K.
Cho S.I.
キム J.S.
ジンクフィンガーデアミナーゼによるヒト細胞の核およびミトコンドリアDNA編集。
Nat. Commun. 2022; 13: 366
記事で見る
Scopus (7)
PubMed
クロスリファレンス
グーグル奨学生
Cho S.I.
リーS.
Mok Y.G.
他。
プログラム可能なデアミナーゼを用いたヒトミトコンドリアDNAの標的A-to-G塩基編集。
Cell. 2022; 185: 1764-1776.e12
記事で見る
スコープス (13)
PubMed
概要
全文
全文PDF
Google Scholar
Wei Y.
Li Z.
Xu K.
他。
ミトコンドリア塩基編集酵素DdCBEは、胚の核ゲノムにおいて実質的なDNAオフターゲット編集を引き起こす。
Cell Discov. 2022; 8: 27
記事で見る
スコープス (5)
PubMed
クロスリファレンス
グーグル奨学生
レイ・Z.
Meng H.
Liu L.
他。
ミトコンドリアのベースエディターは、核のオフターゲット変異を大幅に誘発する。
Nature. 2022; 606: 804-811
記事で見る
スコープス (6)
PubMed
クロスリファレンス
グーグル奨学生
シュー・P.D.
ランダーE.S.
Zhang F.
CRISPR-Cas9のゲノムエンジニアリングへの展開と応用。
Cell. 2014; 157: 1262-1278
記事で見る
スコープス (3496)
パブコメ
概要
全文
全文PDF
Google Scholar
ラン F.A.
シュー・P.D.
ライトJ.
他
CRISPR-Cas9システムによるゲノムエンジニアリング。
Nat. Protoc. 2013; 8: 2281-2308
記事で見る
スコープス (6129)
パブコメ
クロスリファレンス
グーグル奨学生
ガージ T.
ガースバッハC.A.
バーバス3世、C.F.
ZFN、TALEN、CRISPR/Casを用いたゲノムエンジニアリングのための手法。
Trends Biotechnol. 2013; 31: 397-405
記事で見る
スクープ(2414)
PubMed
概要
全文
全文PDF
Google Scholar
ガメージ・P.A.
モラエスC.T.
ミンチュク M.
ミトコンドリアゲノム工学:革命はCRISPR-Izedではないかもしれない。
Trends Genet. 2018; 34: 101-110
記事で見る
スコープス(139)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ルートル R.
ヘッケルA.M.
スミルノバA.
他
ミトコンドリアDNAはCRISPR化できるのか。プロとコントラ。
IUBMB Life. 2018; 70: 1233-1239
記事で見る
スコープス (28)
PubMed
クロスリファレンス
グーグル奨学生
ジョウ A.
ハム・S.
リーG.H.
他。
CRISPR/Cas9による効率的なミトコンドリアゲノム編集。
BioMed Res. Int. 2015; 2015: 305716
記事で見る
スコープス (121)
PubMed
クロスリファレンス
グーグル奨学生
ビアン W.P.
チェン Y.L.
Luo J.J.
他。
ヒトおよびゼブラフィッシュのミトコンドリアDNAを編集するためのmito-CRISPR/Cas9システムを用いたノックイン戦略。
ACS Synth. Biol. 2019; 8: 621-632
記事で見る
スコープス (27)
PubMed
クロスリファレンス
グーグル奨学生
アントンZ.
ムラリーG.
フォードH.C.
ら。
タイプIIとタイプVのCRISPRエフェクターを使用した場合に見られるミトコンドリア輸入、健康、mtDNAコピー数の変動。
J. Cell Sci. 2020; 133: jcs248468
記事で見る
スコープス (8)
PubMed
クロスリファレンス
グーグル奨学生
Wang B.
Lv X.
Wang Y.
他。
CRISPR/Cas9を用いたヒトミトコンドリアゲノムのマイクロホモロガス領域における変異誘発。
Sci. China Life Sci. 2021; 64: 1463-1472
記事で見る
スコープス(3)
PubMed
クロスリファレンス
グーグル奨学生
フセイン S.R.A.
ヤルヴァックM.E.
クーB.
他。
ミトコンドリアゲノムを標的としたCRISPR/Cas9システムの適応。
Front. Genet. 2021; 12: 627050
記事で見る
スコープス(24)
PubMed
クロスリファレンス
グーグル奨学生
ホフレイターM.
ヤエニッケV.
Serre D.
他
多重増幅によるDNA配列から、古代DNAのシトシン脱アミノ化によるアーチファクトが明らかになった。
核酸医薬研究会 2001; 29: 4793-4799
記事で見る
スコープス (493)
PubMed
クロスリファレンス
グーグル奨学生
劉 悟
ターラーD.S.
Libchaber A.
ブリッジングPCRにおけるシグナルとノイズ。
BMC Biotechnol. 2002; 2: 13
記事で見る
スコープス (16)
PubMed
クロスリファレンス
グーグル奨学生
ギルバート・M.T.P.
ハンセンA.J.
ウィラーズレフE.
他
死後損傷による遺伝的ミスコーディング病変の特徴づけ。
Am. J. Hum. Genet. 2003; 72: 48-61
記事で見る
スコープス (184)
パブコメ
概要
全文
全文PDF
Google Scholar
シルベストル J.
マルジョーA.
ジャックC.
他
ミトコンドリア近傍へのmRNAのソーティングにおける3'非翻訳領域の役割は、酵母からヒトの細胞まで保存されている。
Mol. Biol. Cell. 2003; 14: 3848-3856
記事で見る
スコープス (110)
パブコメ
クロスリファレンス
グーグル奨学生
ギンズバーグ M.D.
フェリシエロA.
ジョーンズJ.K.
他。
PKA依存的なミトコンドリアAKAP121タンパク質へのmRNAの結合。
J. Mol. Biol. 2003; 327: 885-897
記事で見る
スコープス (82)
PubMed
クロスリファレンス
グーグル奨学生
ガオ・ズー
ハーウィグA.
Berkhout B.
エレーラ-カリージョ E.
3型ポリメラーゼIIIプロモーターの+1位周辺のヌクレオチドの変異:転写活性と開始点使用率への影響。
Transcription. 2017; 8: 275-287
記事で見る
スコープス (24)
PubMed
クロスリファレンス
グーグル奨学生
Zhang D.
Zhang H.
Li T.
他。
完璧にマッチした20塩基のガイドRNA配列は、高忠実度のSpCas9ヌクレアーゼを用いた堅牢なゲノム編集を可能にする。
ゲノムバイオロジー 2017; 18: 191
記事で見る
スコープス (78)
PubMed
Crossref
グーグル奨学生
ヘー T.
ハテムE.
ヴェルニL.
他。
PRX1ノックダウンが癌細胞におけるビタミンK3毒性を増強する:古い薬剤の新しい治療法の可能性。
J. Exp. Clin. Cancer Res. 2015; 34: 152
記事で見る
スコープス (19)
PubMed
クロスリファレンス
グーグル奨学生
馮亦穆
ジアY.F.
Su L.Y.
et al.
アヘン中毒の海馬と末梢血におけるミトコンドリアDNAコピー数の減少は、オートファジーによって媒介され、メラトニンによって救済されうる。
Autophagy. 2013; 9: 1395-1406
記事で見る
スコープス (81)
PubMed
クロスリファレンス
グーグル奨学生
カジャンデルO.A.
カルフネンP.J.
ホルトI.J.
ジェイコブス H.T.
ヒト心筋における顕著なミトコンドリアDNA組換え中間体。
EMBO Rep. 2001; 2: 1007-1012
記事で見る
スコープス (82)
PubMed
クロスリファレンス
グーグル奨学生
ダーレリオ M.
ガジェフスキーC.D.
リンM.T.
他
ヒト細胞における異種ミトコンドリアDNA組換え。
Hum. Mol. Genet. 2004; 13: 3171-3179
論文で見る
スコープス (83)
PubMed
クロスリファレンス
グーグル奨学生
タディ S.K.
セバスチャンR.
ダハールS.
他。
ミトコンドリアDNA損傷時の二本鎖切断修復の主要なメディエーターはマイクロホモロジー媒介性エンドジョインである。
Mol. Biol. Cell. 2016; 27: 223-235
記事で見る
スコープス (77)
PubMed
Crossref
グーグル奨学生
ダハール S.
Dubey S.
ラガバン S.C.
哺乳類ミトコンドリアにおけるDNA二本鎖切断の相同組み換えを介した修復の動作。
Cell. Mol. ライフサイエンス. 2018; 75: 1641-1655
記事で見る
スコープス(37)
PubMed
クロスリファレンス
グーグル奨学生
Zhang X.
Li T.
Ou J.
他。
哺乳類胚のゲノム編集におけるCRISPR-Casヌクレアーゼによる相同性に基づく修復の誘導。
Protein Cell. 2022; 13: 316-335
記事で見る
スコープス (4)
PubMed
クロスリファレンス
グーグル奨学生
チー L.S.
ラーソンM.H.
ギルバートL.A.
他
CRISPRを遺伝子発現の配列特異的制御のためのRNA誘導型プラットフォームとして再利用する。
Cell. 2013; 152: 1173-1183
記事で見る
スコープス (2878)
パブコメ
概要
全文
全文PDF
Google Scholar
シェン B.
Zhang W.
Zhang J.
他。
CRISPR-Cas9ニッカーゼによる効率的なゲノム改変とオフターゲット効果の最小化。
Nat. Methods. 2014; 11: 399-402
記事で見る
スコープス (580)
PubMed
クロスリファレンス
グーグル奨学生
パー R.L.
マキJ.
レグリーB.
他。
擬似ミトコンドリアゲノムは異形成の解釈の間違いに影響する。
BMC Genom. 2006; 7: 185
記事で見る
スコープス (67)
PubMed
クロスリファレンス
グーグル奨学生
アンドリュース R.M.
クバッカI.
チネリーP.F.
他
ヒト・ミトコンドリアDNAのケンブリッジ・リファレンス配列の再解析と改訂。
Nat. Genet. 1999; 23: 147
記事で見る
スコープス (2521)
PubMed
クロスリファレンス
グーグル奨学生
辻淳一
フリスM.C.
冨井健一
Horton P.
哺乳類NUMT挿入は非ランダムである。
核酸医薬研究 2012; 40: 9073-9088
記事で見る
スコープス (68)
PubMed
クロスリファレンス
グーグル奨学生
アルドゥイ S.
アムールA.
ベルメッシュJ.R.
ヘスタンド M.S.
Single molecule real-time (SMRT) sequencing comes of age: Applications and utilities for medical diagnostics(1分子リアルタイム(SMRT)シーケンシングの時代:医療診断のためのアプリケーションとユーティリティ)。
ヌクレイック・アシッズ・レズ. 2018; 46: 2159-2168
記事で見る
スコープス(289)
PubMed
Crossref
グーグル奨学生
セージJ.M.
ギルデマイスターO.S.
ナイト K.L.
ヒトRad51の新規機能の発見:ミトコンドリアゲノムの維持。
J. Biol. Chem. 2010; 285: 18984-18990
記事で見る
スコープス (74)
パブコメ
概要
全文
全文PDF
Google Scholar
ミシュラ A.
サクセナ S.
Kaushal A.
Nagaraju G.
RAD51C/XRCC3は、ミトコンドリアDNAの複製を促進し、ミトコンドリアゲノムの完全性を維持する。
Mol. Cell Biol. 2018; 38: e00489-17
記事で見る
スコープス (27)
PubMed
Crossref
グーグル奨学生
宋 J.
ヤン D.
Xu J.
他。
RS-1はCRISPR/Cas9およびTALENを介したノックイン効率を高める。
Nat. Commun. 2016; 7: 10548
記事で見る
スコープス (263)
パブコメ
クロスリファレンス
グーグル奨学生
ピンダーJ.
サルスマンJ.
デレール G.
CRISPRベースのゲノム編集の低分子エンハンサーを評価・同定するための核ドメイン「ノックイン」スクリーニング。
ヌクレイック・アシッズ・レズ. 2015; 43: 9379-9392
記事で見る
スコープス (169)
PubMed
Crossref
グーグル奨学生
ジャヤティラカ K.
シェリダンS.D.
ボールドT.D.
他
ヒトの相同組換えタンパク質RAD51を刺激する化学物質。
Proc. Natl. Acad. Sci. USA. 2008; 105: 15848-15853
記事で見る
スコープス (95)
PubMed
クロスリファレンス
グーグル奨学生
ブドケ B.
ローガンH.L.
カリンJ.H.
他
RI-1:ヒト細胞において相同組換えを阻害するRAD51の化学的阻害剤。
核酸医薬研究 2012; 40: 7347-7357
記事で見る
スコープス (124)
PubMed
クロスリファレンス
グーグル奨学生
ヤオ Y.G.
コン Q.P.
サラス A.
バンデルト H.J.
疾患研究につきまとう偽ミトコンドリアゲノム。
J. Med. Genet. 2008; 45: 769-772
記事で見る
スコープス (93)
PubMed
クロスリファレンス
グーグル奨学生
ムスメチ O.
アンドリューA.L.
シャンスケ S.
他
mtDNAの遺伝子内逆位:ミトコンドリアミオパチー患者における新しいタイプの病原性突然変異。
Am. J. Hum. Genet. 2000; 66: 1900-1904
記事で見る
スコープス (43)
パブコメ
概要
全文
全文PDF
Google Scholar
ブレイクリー E.L.
レニー・K.J.
ジョーンズL.
他
ミトコンドリア DNA MTND1 遺伝子の散発性遺伝子内逆位による致死性乳児乳酸アシドーシス。
Pediatr. Res. 2006; 59: 440-444
記事で見る
スコープス (13)
PubMed
クロスリファレンス
グーグル奨学生
キング M.P.
アタルディG.
ヒト細胞へのミトコンドリアの注入は、内因性ミトコンドリアDNAの急速な置換をもたらす。
Cell. 1988; 52: 811-819
記事で見る
スコープス (207)
PubMed
要旨
全文PDF
Google Scholar
Hagström E.
フレイアC.
バッターズビーB.J.
他
マウス母方生殖細胞で50世代にわたりヘテロプラスミー後のmtDNAの組換えはない。
ヌクレイック・アシッズ・レズ 2014; 42: 1111-1116
記事で見る
スコープス (67)
PubMed
Crossref
グーグル奨学生
クーリンチェンコ M.
テンパーリーR.J.
メイソンP.A.
他
哺乳類ミトコンドリアの天然コンピテンスによるミトコンドリア遺伝子発現の分子生物学的検討。
Hum. Mol. Genet. 2006; 15: 143-154
記事で見る
スコープス (73)
PubMed
クロスリファレンス
グーグル奨学生
タラセンコ T.A.
クリメンコE.S.
タラセンコV.I.
他
植物ミトコンドリアは、様々なVDACアイソフォームが関与する代替的な膜複合体を介してDNAを輸入する。
Mitochondrion. 2021; 60: 43-58
記事で見る
スコープス (3)
PubMed
クロスリファレンス
グーグル奨学生
リウ・X.
Wang X.
Li J.
他。
mecciRNAの同定とタンパク質のミトコンドリア侵入におけるその役割。
中国生命科学誌 2020; 63: 1429-1449
記事で見る
スコープス (58)
PubMed
クロスリファレンス
グーグル奨学生
ボッシュP.
イブラヒムN.
ディートリッヒA.
ライトワラーズR.N.
ミトコンドリアDNAの膜結合は、哺乳類ミトコンドリアにおける塩基除去修復を促進する。
核酸医薬の研究 2010; 38: 1478-1488
記事で見る
スコープス (25)
PubMed
クロスリファレンス
グーグル奨学生
Wang G.
チェン H.W.
オクタイ Y.
他。
PNPASEはミトコンドリアへのRNA輸入を制御している。
Cell. 2010; 142: 456-467
記事で見る
スコープス (250)
パブコメ
概要
全文
全文PDF
Google Scholar
Chen Y.
Hu Y.
Wang X.
他。
CRISPR-Casヌクレアーゼの相乗効果による哺乳類ゲノム編集の実現。
Innovation. 2022; 3: 100264
記事で見る
Google Scholar
記事情報
掲載履歴
オンライン公開 2022年9月27日
受理されました。2022年9月23日
受理:2022年9月23日 2022年1月4日
識別情報
DOI: https://doi.org/10.1016/j.xinn.2022.100329
著作権について
© 2022 The Author(s).
ユーザーライセンス
クリエイティブ・コモンズ 表示 - 非商用 - 改変禁止 (CC BY-NC-ND 4.0) | 情報アイコンを再利用する方法
サイエンスダイレクト
この記事をScienceDirectで閲覧する
図
図のサムネイルfx1
図表の概要
図 サムネイル gr1
図1ミトCas9システムによるCas9タンパク質のミトコンドリアへの輸送とmtDNAコピー数の減少
図1Gr2
図2ミトCas9システムによる外来ssODNのmtDNAへの効率的なノックイン
図1.gr3
図3mito-Cas9システムによって導入されたmtDNA編集の第三世代シーケンサーによる同定
図1:gr4
図4RAD51はmito-Cas9システムを介したmtDNA編集に関与していた
図1RAD51が関与するmtDNA編集の様子(サムネイルgr5
図5HEK293T細胞のmtDNAに導入された病原性変異m.3902_3908invの様子
表
表1第二世代シーケンサーによるGAATTCノックインのリードの頻度
この記事が気に入ったらサポートをしてみませんか?
