腸内細菌叢はマウスの急性肺損傷後の肺線維化の重症度を調節する
オープンアクセス
公開日:2022年12月22日
腸内細菌叢は、マウスの急性肺損傷後の肺線維化の重症度を調節する
https://www.nature.com/articles/s42003-022-04357-x
オジオマ・S・チオマ、エリザベス・K・マロット、...ワンダー・P・ドレイク 著者一覧を見る
コミュニケーションズバイオロジー第5巻、記事番号:1401(2022)この記事を引用する
1 Altmetric
メトリクス詳細
概要
慢性肺疾患の病因に腸内細菌叢が重要であることは、独立した研究によって証明されている。しかし、肺線維化の進行における腸内細菌叢の役割については、ほとんど知られていない。我々は、ブレオマイシンモデルを用いて、無菌環境、動物バイオセーフティレベル1(ABSL-1)、動物バイオセーフティレベル2(ABSL-2)で飼育したC57BL/6 Jマウスの肺線維化を定量化し、無菌マウスは肺線維化から保護されるが、ABSL-1とABSL-2ではそれぞれ軽度と重度の肺線維化が進行することを明らかにした。メタゲノム解析の結果、ABSL-1とABSL-2の肺微生物叢に顕著な違いは見られなかったが、ABSL-1の腸内細菌叢にはABSL-2と比較してビフィドバクテリウムとラクトバチルスが増加し、より多様な微生物が存在していることが明らかになった。フローサイトメトリー解析により、ABSL-2マウスの肺CD4 + T細胞ではIL-6/STAT3/IL-17Aシグナルが増強されていることが明らかになった。ABSL-2の便を無菌マウスに移植すると、ABSL-1の便を移植したときよりも重度の線維化が再現された。乳酸菌上清は、IL-17AおよびTGFβ1刺激ヒト肺線維芽細胞におけるコラーゲン1 A産生を低下させる。これらの知見は、肺線維症の重症度を増大させる腸内細菌叢の機能的役割を支持するものである。
はじめに
小児喘息に対する初期の腸内細菌叢の影響など、腸内細菌叢が肺の病態生理に大きな影響を与えることを示唆する証拠が蓄積されている1。線維性肺疾患は、世界的に罹患率と死亡率の主要な原因であり、線維芽細胞が刺激され、炎症性シグナルに反応してコラーゲンや他の細胞外マトリックス成分を過剰に産生することで発症します2。現在の治療法は、疾患の進行を遅らせることに依存していますが、いくつかの線維性肺疾患の死亡率は、許容できないほど高いままです3,4,5。特発性肺線維症(IPF)の患者コホートにおける研究では、肺の微生物叢の変化が報告されており、肺の高細菌負荷と病気の悪化が相関しています6,7。さらに、全身性硬化症や珪肺症などの自己免疫性線維性肺疾患から採取した糞便サンプルのメタゲノム配列解析により、腸内細菌叢の多様性の欠如とディスバイオーシスが明らかになりました8,9。このような顕著な臨床的相関があるにもかかわらず、肺線維症の発症および進行における腸内細菌叢の役割を明確にするためのマウスモデルを用いた機構研究は欠落している。
腸で起こるプロセスが肺の病態の結果に関連するという、腸-肺の軸を支持する文献が増えつつあります10,11。腸内細菌叢は、いくつかの方法で肺の炎症環境に影響を与えることができます。線維症の発症に関与するIL-6などの炎症性サイトカインの産生は、腸内細菌によって誘導されることがあります12,13,14。IL-6シグナルの増強は、IL-6/STAT3/IL-17Aシグナル伝達経路を介して、間質性肺疾患(ILD)発症に寄与することが示されています15,16,17。一方、Bacteroidetes、Clostridia、Lactobacilliが産生する短鎖脂肪酸(SCFA)酪酸などの微生物代謝産物は、抗炎症作用を持ち、T細胞をTh17表現型ではなくTh1またはT調節型に偏らせることができる18,19。免疫活性化における腸内細菌叢のこれらの対照的な役割は、腸内コミュニティーの特定の微生物組成が、肺線維症に寄与する病原性免疫反応の増強または抑制に重要であることを示唆している。
本研究では、ブレオマイシン誘発マウスモデルにおいて、飼育環境および糞便微生物叢移植(FMT)を介した腸内細菌叢の直接的な調節を行い、機能的な腸-肺軸が肺線維化を調節することを証明した。無菌(GF)マウスはABSL-1またはABSL-2収容マウスに比べて肺線維化が明らかに少なかったが、ブレオマイシン投与前にABSL-2の便を無菌マウスにFMTすると、重度の線維化表現型が再現されることが明らかになった。これらの結果は、肺線維化の重症度は、腸内細菌叢の欠如や多様性によって調節されることを明示している。
研究成果
飼育環境が肺線維症の重症度に影響する
肺線維症の重症度に対する腸内細菌叢の寄与を評価するために、マウスを3つの異なる環境で飼育した。GF(微生物ゼロ)、ABSL-1(感染性物質を含む実験なし、マウスは常在菌のみを保有)、ABSL-2(人体に中程度の危険性を有する感染性物質を含む実験あり)。各環境の6週齢の雌雄マウスに生理食塩水またはブレオマイシンを経口投与し,14日間観察した.ブレオマイシンを経鼻投与した場合、すべてのGFマウスは100%の生存率を示した(図1a)。ブレオマイシンを投与されたABSL-2マウスは最大の死亡率を示し、ABSL-1の生存率はGFマウスとABSL-2マウスの中間であった(図1a)。ABSL-2マウスとGFマウスの生存率には顕著な差が認められた(p = 0.026, log-rank Mantel-Cox test)。生理食塩水を経鼻投与した場合、すべての飼育群のマウスは同様の生存期間(図S1a)、明確な体重減少(図S1b)、同様の肺コラーゲン量(図S1c)を示し、急性肺損傷はないことが示唆された。ブレオマイシンを投与したマウスには、体重減少の点で顕著な病的状態の違いが見られた。生理食塩水を投与したABSL-1およびABSL-2マウスは、ブレオマイシンを投与したマウスよりも体重減少が少なく(それぞれp < 0.0001 および p < 0.01; Tukeyの多重比較検定付きの二元配置分散分析)、gnotobiotic施設に収容したマウスはブレオマイシン処理により体重が減少しなかった(Fig. 1b)。また、ブレオマイシンを投与したGFマウスは、ABSL-1マウス(p < 0.001, 二元配置分散分析、テューキーの多重比較検定)およびABSL-2マウス(p < 0.01, 二元配置分散分析、テューキーの多重比較検定)と比べて体重減少が少なかった(図1b)。3つの異なる飼育環境において、ブレオマイシン投与後の肺の定性的および定量的な組織学的評価を実施した。3種類の飼育環境でブレオマイシンを投与したマウスの右中葉肺切片のヘマトキシリン・エオジン(H&E)染色およびトリクロム染色を用いて、肺の損傷を判定した(代表画像:図1c)。GFマウスでは、ABSL-1マウスと比較して、またABSL-2マウスと比較して、Ashcroftスコアリングにより線維化の重症度が低かった(図1d)。注目すべきは、Sircolアッセイによるコラーゲン含量の定量化で、ABSL-2マウスはGFマウス(p < 0.0001, Tukeyの多重比較検定を伴う二元配置分散分析)またはABSL-1マウス(p < 0.0001, Tukeyの多重比較検定を伴う二元配置分散分析)に比べて肺コラーゲン量が顕著に高いことであった。ABSL-1マウスは、GFマウスやABSL-2マウスとは異なる中間の肺線維化を示した(p < 0.01, 二元配置分散分析、Tukeyの多重比較検定)(Fig. 1e)。また、ブレオマイシンを投与したGFマウスは、生理食塩水を経鼻投与したマウスと同様に肺のコラーゲン量が多かった(Fig. 1e)。ABSL-1およびABSL-2マウスでコラーゲン量が多いというこれらの観察結果を、ブレオマイシン投与14日後に採取した肺サンプルについて、α平滑筋アクチン(α-SMA)分析のイムノブロット解析を行うことで確認した。その結果、GFまたはABLS-1マウスと比較して、ABSL-2マウスで高いα-SMA含量が認められた(図S1d, e)。α-SMAのイムノブロット解析の定量化を図S1eに示す。これらの知見は、マウス宿主の生活環境が肺線維化の重症化に寄与していることを示す。

図1:無菌マウスは肺線維症の罹患率および死亡率から保護される。
図1
a gnotobiotic、ABSL-1、またはABSL-2施設に収容し、0.04Unitsのブレオマイシンを含む75μlを鼻腔内接種したマウスの生存率曲線。対照動物には75μlの生理食塩水を経鼻接種した。 b 収容群および処置群のマウスの体重を1日目から14日目まで毎日連続的に測定・記録した。 c GF、ABSL-1およびABSL-2マウスのブレオマイシン損傷後14日のH&Eおよびトリクロム染色肺の代表画像(スケールバー、100μm)。d マウスのブレオマイシン投与後の飼育条件による三色染色肺のAshcroftスコアリング e Sircolアッセイによるgnotobiotic、ABSL-1、ABSL-2施設で飼育され、ブレオマイシンまたは食塩水処理にさらされたマウスのRLLの可溶性コラーゲン量;データは平均±SDとして報告し、各点は個々のマウスを表す、n = 6-32マウス。実験は独立して平均2回繰り返した。統計的有意性は、Tukeyの多重比較検定による二元配置分散分析で評価した。*P < 0.05 **P < 0.01, ***P < 0.001 ****P < 0.0001; GF: Germ-free, ABSL-1: Animal Biosafety Level 1, ABSL-2: Animal Biosafety Level 2, ns = no significance; RLL: Right Lower Lobe.
フルサイズ画像
腸内細菌の多様性の欠如は、肺線維症の重症度と関連する
ABSL-1飼育マウスとABSL-2飼育マウスの線維化の重症度の違いに腸内細菌叢が重要な寄与をしているという仮説を検討するために、各居住コホートのマウスの糞便ペレットについてメタゲノム解析を実施した。GFマウスの便には、予想通りシークエンスと培養による微生物の検出は見られなかった。種の豊富さと均一性の指標であるシャノンアルファ多様性は、Wilcoxon順位和検定を用いると、ABSL-1マウスではABSL-2マウスに比べてかなり高かった(W = 166, p = 0.01)(図2a)。シャノンのα多様性は、Wilcoxon順位和検定で処理間(ブレオマイシン対生理食塩水)に差がなかった(W = 367, p = 0.278)ことから、ブレオマイシン処理によって腸内細菌叢の多様性が変化しないことが示唆された。アルファ多様性は、種の均等性のみを示すPielouの均等性を用いて評価したところ、ABSL-1飼育マウスはABSL-2飼育マウスよりもPielouの均等性スコアが高かった(p = 0.009, Wilcoxon)(図S2a)。種の豊富さには、飼育環境による違いはない(Fig. S2b)。

図2:腸内細菌の多様性の向上は、線維症モデルマウスにおけるより良い転帰と関連する。
図2
a ABSL-1およびABSL-2施設に収容し、0.04Unitsのブレオマイシンまたは生理食塩水を含む75μlを経鼻接種したマウスのShannon diversity indexスコア(コホートあたりn = 13-27マウス)。箱は中央値、および25番目と75番目の四分位を示す。ひげは1.5*IQRまで伸びている。b ABSL-1マウスとABSL-2マウスの腸内細菌叢の系統的構成。 c 非線形多次元尺度法(MDS)プロットは、Jaccard非類似度に基づく微生物分類学的構成の違いを示す。 d 線形判別分析の結果、ABSL-1またはABSL-2マウスで過剰発現する分類群が示された。e ABSL1床およびABSL2床に収容されたマウスの肺マイクロバイオームサンプルのサンプル内多様性。 f ブレイ・カーティス非類似度に基づく非計量的多次元尺度プロットは、ABSL1床およびABSL2床に収容されたマウスの肺マイクロバイオームコミュニティを表示する。実験は1回ずつ独立して行った。
フルサイズ画像
次に、負の二項分布を持つ一般化線形モデル(GLM)を用いて、各ファイラの相対的な存在量を比較した。ABSL-1マウスは、Proteobacteria (GLM, χ2 = 20.221, p < 0.001) とVerrucomicrobia (GLM, χ2 = 4.487, p = 0.034) の相対量が有意に高かった (Fig. 2b)。プロテオバクテリアの増加は、クローン病20、喘息21、肺移植後22のように、炎症性の腸および気道環境の両方と関連することが分かっている。ABSL-1とABSL-2の微生物叢組成のβ多様性の違いは、分類群の有無と分類群の存在量の変化をそれぞれ考慮したJaccard指数(図2c)とBray-Curtis非類似度指標(図S3)の両方を用いて解析を行った場合にも有意に異なった(PERMANOVA、Jaccard: F2,47 = 4.735, R2 = 0.090, p = 0.003; Bray-Curtis: F2,47 = 4.676, R2 = 0.089, p = 0.006). 生理食塩水投与マウスとブレオマイシン投与マウスの腸内細菌叢を解析した結果、ABSL-1床ではその微生物叢に区別が認められたが、ABSL-2マウスでは認められなった。ブレオマイシン投与は、ABSL-1床のマウスの腸内細菌叢の分類学的構成と関連していたが、Jaccard距離を調べたときだけだった(Bray-Curtis: F1,17 = 0.727, R2 = 0.041, p = 0.507; Jaccard.B:F2,17=0.3.1.0.0.0.0.0.0.0)。F2,17 = 9.392, R2 = 0.356, p < 0.001)、先行報告23,24と同様であった。処理による区別は、ABSL2床の分類学的構成とは関連がなかった(Bray-Curtis: F1,29 = 0.577, R2 = 0.020, p = 0.547; Jaccard.F2,29=0.80、p=0.507)。Bray-Curtis: F1,29 = 0.577, R2 = 0.020, p = 0.547; Jaccard: F2,29 = 0.807, R2 = 0.027, p = 0.561) (Fig. 2c).
線形判別分析(LDA)を用いて腸内細菌叢の種レベルの違いを調べたところ、ABSL-1マウスでは10分類群が、ABSL-2マウスでは5分類群が過剰に発現していた(図2d)。ABSL-2マウスで過剰発現した分類群は、Lachnospiraceae bacterium A2、Lachnospiraceae bacterium 28-4、Firmicutes bacterium ASF500、およびRomboutsia ilealisであった。ブレオマイシン処理した線維化マウスの肺微生物叢では、Firmicutes属の相対存在度が高いことが報告されている7。ABSL-1マウスでは、Staphylococcus nepalensis、Dubosiella newyorkensis、Acetatifactor muris、Lactobacillus animalis、Lactobacillus murinus、Acutalibacter murisなどの種が過剰発現していることが確認された。注目すべきは、ABSL-1マウスで過剰発現していたラクトバチルス種で、他の実験動物モデルにおいてIL-17Aを介した疾患の重症度を軽減することが示されており25、26、27、呼吸器症状の顕著な軽減に関連していた28。
ABSL-1マウスとABSL-2マウスの間には、肺ではなく腸のマイクロバイオームの多様性が存在する
肺マイクロバイオームのサンプル内多様性は、シャノン多様性(フロア:W = 137, p = 0.447; 処理:W = 196, p = 0.410) またはシャノン均等性(フロア:W = 137, p = 0.447; 処理:W = 214, p = 0.171) のいずれかで調べたところフロア(ABSL1 vs. ABSL2)または処理(食塩水 vs. bleomycin)によって有意差がない(図2E)。マウスの肺のマイクロバイオームの構成は、Bray-Curtis非類似度(Floor.F1,F2,F3,F4,F4,F5,F5)を用いて調べたところ、フロア(ABSL1 vs. ABSL2)や治療(食塩水 vs. bleomycin)によって大きな違いはなかった。F1,37 = 1.041, R2 = 0.028, p = 0.388;治療法。F1,37 = 0.993, R2 = 0.027, p = 0.397) またはJaccard指数(Floor.F1,37 = 1.051, R2 = 0.028, p = 0.388)を用いて検討した。F1,37 = 1.058, R2 = 0.029, p = 0.343; Treatment: F1,37 = 0.733, R2 = 0.020, p = 0.948)(図2f)。
また、飼育環境と処理条件間のメタゲノム機能遺伝子プロファイルのベータ多様性の違いを、Jaccard距離(図3a、3b)およびBray-Curtis非類似度(図S4a、S4b)を用いて検討した。遺伝子ファミリーおよびMetaCyc反応経路の存在量に渡る機能プロファイルは、Jaccard距離を調べたところ、特に環境および治療と有意に関連していた(図3c)。MetaCyc反応経路の存在量は、ABSL-1マウスとABSL-2マウスの腸内細菌叢組成間で有意に異なっていた(Jaccard: F2,47 = 3.055, R2 = 0.058, p < 0.001) (Fig. 3c)。同様に、飼育環境も遺伝子ファミリープロファイルと有意に関連していた(PERMANOVA; Jaccard: F2,47 = 7.030, R2 = 0.125, p < 0.001) (Fig. 3b).Bray-Curtis非類似度ではなく、Jaccard距離のみを用いた場合に飼育環境間に差が生じたことから、低存在量の経路が飼育環境間の差を引き起こしていることが示唆された。シャノン多様性は、MetaCyc反応経路(W = 544, p < 0.001)、遺伝子ファミリー(W = 149, p = 0.003)ともにABSL-1マウスで高いが、生理食塩水処理とブレオマイシン処理の間で差はなかった。GLMでは、ABSL-1マウスとABSL-2マウスの間で異なる量のパスウェイは同定されなかった。しかし、LDAにより、ABSL-1マウスで過剰発現している24のパスウェイとABSL-2マウスで過剰発現している1つのパスウェイが同定された(Fig. 3d)。線維化の程度が異なる別々の飼育群のマウス間の微生物群集の構成と機能の違いは、腸内細菌叢が肺線維化の程度に直接寄与している可能性があるという仮説を支持するものであった。各飼育コホート実験に参加したマウスの糞便ペレットのメタゲノム解析は1回実施した。
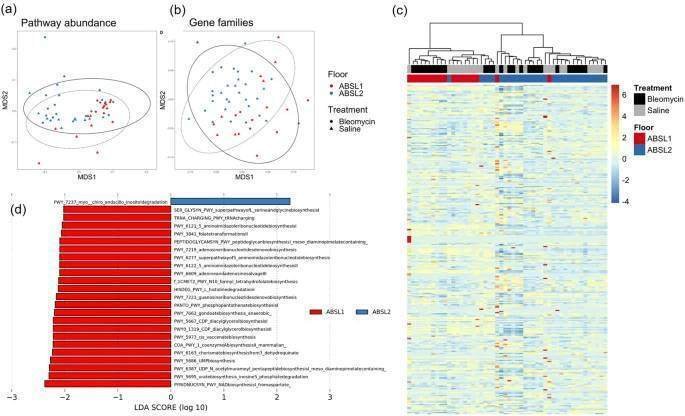
図3:機能性遺伝子プロファイルは、飼育環境および治療と有意に関連している。
図3
a Jaccard距離行列に基づく非線形多次元尺度法(MDS)プロットを用いたMetaCyc反応経路の存在量とb遺伝子ファミリーの存在量プロファイル。 c 飼育環境と処置間のMetaCyc反応経路存在量を正規化したヒートマップ。 d ABSL1またはABSL2マウスで過剰発現するMetaCyc反応経路を示した線形判別分析の結果) n =コホートあたり13〜27匹のマウスを対象。実験は独立して1回実施した。
フルサイズ画像
腸内細菌の多様性と分類群は炎症性肺反応と関連する
異なる飼育環境下での肺線維化の免疫学的要因を明らかにするため、生理食塩水またはブレオマイシンを接種して14日後のGF、ABSL-1、ABSL-2マウスから得た単細胞肺懸濁液のフローサイトメトリー分析を行った。ブレオマイシン処理により、GFまたはABSL-1マウスと比較して、ABSL-2マウスではCD4 + IL6 + T細胞の顕著な増加が認められた(図4a;図S5aの代表的ヒストグラム)。IL-6の共受容体であるgp130についても同じ傾向が見られ、ABSL-2コホートのブレオマイシン処理マウスでは、CD4 + gp130 + T細胞の割合が最も高かった(図4b、図S5bの代表的なヒストグラム)。我々は以前、PD-1 + Th17細胞が肺線維症の発症に寄与していることを報告した。我々は、ブレオマイシンで処理したABSL-2マウスが、ABSL-1またはGFマウスよりも、IL-17Aを分泌するPD-1 + CD4 + T細胞のレベルが高いことに注目した(図4c)。代表的なヒストグラムとゲーティング戦略を示す(図4d、e、S5c)。リン酸化STAT3(pSTAT3Y705)は、転写因子が活性化されたことを示し、下流の炎症性シグナルを誘導してTh17細胞の成熟を促進することができる。ブレオマイシン処理により、ABSL-2コホートマウスのCD4 + T細胞におけるpSTAT3発現が増加した(図4f)。STAT3 mRNAのPCR分析でも同じ傾向が示された(図4g、S5d)。ABSL-2ブレオマイシン処理コホートと生理食塩水処理コホートの間には、IL-23Rの発現において顕著な差異があった(図S6a)。異なる収容コホートのマウス間のCD4+IL-6+およびCD4+IL-17A+T細胞の割合における区別は、肺線維症におけるIL-6/STAT3/IL-17A経路に対する微生物誘導性の変化を支持するものであった。
図4:無菌マウスは、ブレオマイシン処理により炎症性反応を起こさない。

図4
マウスを無菌、ABSL-1、またはABSL-2施設に収容し、0.04単位のブレオマイシンを含む75μlまたは生理食塩水(対照)を鼻腔内接種した。接種後14日目にマウスを犠牲にし、肺から単細胞肺懸濁液を調製した。CD4 + a IL-6, b gp130, c PD-1+ IL-17A + , d gating strategy, e ABSL 2 cohort の代表的ヒストグラム、f pSTAT3Y705 expression on T cells. g 肺組織におけるSTAT3 mRNAの相対的発現を、単一細胞からのT細胞のフローサイト解析で行った。二元配置分散分析とTukey's post-hoc を用いてコホート間の比較を行った。*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001, ns: 有意ではない. 棒グラフは平均±SD;各記号は個々のマウスを表し、n = 6-29マウス。実験は独立して平均2回行った。
フルサイズ画像
微生物相が異なるマウスでは免疫変数に違いが見られたため、スピアマン相関検定を用いて個々の分類群存在量と免疫変数との関連を調べた。FirmicutesとProteobacteriaのメンバーを含むいくつかの分類群は、CD4 + PD-1+ IL-17A + T細胞およびCD4 + pSTAT3 + T細胞のレベルを含む複数の免疫学的値と負の相関があることがわかった(表1)。Romboutsia ilealisは、これらの免疫学的価値と正の相関があった(表1)。CD4 + IL-6 + T細胞レベルとは、正にも負にも相関しない微生物分類群はなかった。免疫活性化と負の相関を示す菌種には、Th17の分極を弱める酪酸を産生することが示されている乳酸菌種が含まれる18,19。
表1 個々の分類群存在量と免疫学的変数のスピアマン相関の関連性。
フルサイズの表
多様性の低い腸内細菌叢の再構成は肺線維症を促進する
腸内細菌叢が線維化の重症化を引き起こすという仮説を検証するために、糞便微生物叢移植(FMT)実験を実施した。GFマウスに、ブレオマイシン接種の1週間前から肺損傷誘発後の14日間、ABSL-1またはABSL-2の便を1日おきに摂取させた。未処置のGFマウスと、ABSL-1またはABSL-2のスラリー上清を与えたGFマウスの間に生存率の差はなかった(図5a)。ABSL-2便を投与したGFマウスでは、未投与のGFマウスやABSL-1便を投与したGFマウスと比較して、14日目の体重減少が増加する傾向が見られた(Fig. 5b)。ブレオマイシン経鼻投与14日後のGFマウス、GF+ABSL-1マウス、GF+ABSL-2マウスのマッソントリクローム染色肺組織切片(スケールバー付き)の代表画像を示す(Fig.5c)。ABSL-2便のFMTを行ったGFマウスでは、肺のコラーゲン量が著しく増加していることが確認された。ABSL-1便のFMTを行ったGFマウスでは、肺線維の増加は認められなかった(Fig. 5d)。また、ABSL-2便を摂取したGFマウスの肺単細胞懸濁液では、ABSL-1便またはGF便と比較してCD4+T細胞が多いことが、経口投与マウスのフローサイトメトリー解析で明らかになった(Fig.5e)。CD4 + T細胞の代表的な疑似カラープロットを示す(Fig. 5f)。このデータは、肺損傷だけでは線維化を誘導するのに十分ではなく、プロフィブロシスサイトカイン発現を誘導することができる細菌も腸内に存在する必要があることを示唆している。

図5:GFマウスにおけるABSL-2マイクロバイオームの再構成は、肺線維化の病的状態を回復させる。
図5
a GF、GF + ABSL-1、GF + ABSL-2マウスの生存曲線、ブレオマイシン傷害14日後 b 14日目の体重減少 c GF、GF + ABSL-1、GF + ABSL-2マウスのマッソントリクローム染色した肺の代表画像、ブレオマイシン傷害14日後 スケールバー、100 μm. d SircolアッセイによるRLLコラーゲン含量を、経口投与群にわたって測定した。 e 単細胞肺懸濁液を、GFまたはABSL-1、もしくはABSL-2施設に収容したマウスからの便で経口投与したマウスから得た(GF + ABSL-1 および GF + ABSL-2)。CD4 + T細胞についてフローサイトメトリー分析を行い、f代表的な疑似カラープロットを行った。各記号は個々のマウスを表す。統計的有意性は、Sidakの多重比較検定付き一元配置ANOVAを用いて評価した。*P < 0.05, **P < 0.01, ***P < 0.001, ns =有意差なし n = 4-6マウス。実験は独立して2回行った。
フルサイズ画像
ABSL-1の便サンプルに含まれる乳酸菌は、ヒト肺線維芽細胞(HLF)のコラーゲン産生を低下させる
ブレオマイシン投与マウスの腸内細菌叢を解析した結果、ABSL-1床に収容されたマウスでは、微生物の多様性が高いことが明らかになった。また、これらのマウスは肺線維化が抑制され、Th17細胞も少なかった。ABSL-1微生物のうち、より多く同定されたのは乳酸菌であり、これはIL-17Aの発現を低下させることが報告されている。我々は、対数増殖期のLactobacillus rhamnosusの上清が、プロフィブロティックサイトカインであるIL-17AとTGFβ1によって刺激されたヒト肺線維芽細胞(HLF)のコラーゲン生成に与える影響について検討した。我々は、5人の異なる個体から得た血清飢餓状態のHLFが、IL-17AとTGFβ1の添加によりcol1A産生の増加を示したことに注目した(P < 0.05, 不対両側t検定)(Fig.6a)。乳酸菌上清を添加しても、HLFのcol1A産生量は増加しなかった(Fig.6b)。乳酸菌上清は、IL-17AおよびTGFβ1コントロールによって誘導されるHLFコラーゲン産生を有意に抑制した(P < 0.05, 対立両側t検定)(図6c)。また、有意ではないが、酪酸ナトリウムの添加によるcol1Aの減少も認められた(P = 0.07, 無対立両側t検定)(Fig.6d)。細胞ライセートのcol1Aのイムノブロット解析により、これらの知見が確認された(図6e)。Col1Aのイムノブロット解析の定量を図6fに示す。これらの知見は、乳酸菌がHLFコラーゲン産生を抑制する能力を有することを示すものである。

図6:ABSL-1便サンプルに豊富に含まれる乳酸菌は、HLFコラーゲン産生を抑制する。
図6
5人の異なる個体のHLFを0.4%FBSで血清飢餓状態にした後、コラーゲン1型A(col1a)産生をアッセイした。HLFを、a rIL-17AおよびTGFβ1、b 対数期まで培養した乳酸菌の上清、c 対数期まで培養した乳酸菌の上清とrIL-17A+TGFβ1またはd 酪酸ナトリウムで処理した後のコラーゲン1a生成。 e HLF試料をコラーゲン1aおよびGAPDHに対する抗体を用いて免疫ブロットを行い、f 免疫ブロック分析の定量化を行う。各記号は個体名を表す。統計的有意性は、students t testを用いて評価した。*P < 0.05, ns = 無意図。実験は、5つの異なるHLF細胞株を用いて実施された。個々の細胞株はそれぞれ独立に三重で試験し、その後、実験を一回繰り返した。各実験における個々の細胞株の平均値を用いて、図を作成した。
フルサイズ画像
考察
異なる飼育環境下での肺線維症マウスモデルを用いて、腸内細菌多様性の変動が肺線維症の重症度に及ぼす影響を立証する。特に、重度の肺線維化を有するABSL-2マウスでは腸内細菌の多様性が低く、一方、ブレオマイシン投与後の肺線維化が少ないABSL-1マウスでは腸内細菌の多様性が高いことが分かりました(図2)。GFマウスはブレオマイシンの経鼻投与にもかかわらず、肺線維化を起こさなかった。ブレオマイシン投与前にABSL-2の便をGFマウスにFMTすると線維化の重症度が上昇し、腸内細菌組成と疾患転帰が直接関連することがわかった(図5)。
このことは、肺の病理学的変化を引き起こすには、急性肺損傷だけでは不十分であり、肺線維化を引き起こすには、1)急性肺損傷(ALI)、2)IL-17Aなどのプロフィブロティックサイトカインの発現を誘導できる微生物の存在、という「2ヒット」が必要であるという仮説を裏付けるものであった。驚くべきことに、GFマウスはブレオマイシンを鼻腔内に投与した後、コラーゲンの沈着を最小限に抑えた。肺線維化の進行に対する腸内細菌叢の重要性は、ABSL-2の便をGFマウスにFMTして線維性肺疾患の重症度を再現することでさらに裏付けられた(図5)。ABSL-1の便をGFマウスにFMTしても、顕著な肺線維化は引き起こされなかった。ブレオマイシン処理マウスモデルでは、肺の微生物多様性に顕著な違いは認められなかった(図2)。これは、肺線維症を有するヒトの肺マイクロバイオームに関する発表とは異なるものである。肺線維症の患者は、タバコの煙や抗生物質など、肺のマイクロバイオームを変化させる複数の要因にさらされている29,30。また、ヒトは移動するため、肺マイクロバイオームを変化させる可能性のある複数の異なる環境にさらされています。肺線維症患者における腸と肺のマイクロバイオームを同時に解析することは、興味深いことです。最近の臨床試験では、乳酸菌とビフィズス菌を含むプロバイオティクスに無作為に割り付けられた患者の上気道感染症の発生率が、プラセボと比較して減少したことが報告されており28、肺疾患における腸-肺軸の重要性がさらに支持されることになった。
異なるコホートマウスにおける肺の炎症環境を調査した結果、プロフィブロティックサイトカインの発現と微生物多様性の減少の間に興味深い関連性があることがわかった。肺の微生物叢の調節がうまくいかないと、IL-17Bの発現が増加し、肺線維化を促進することが指摘されている23。1) 樹状細胞におけるIsoLG-タンパク質付加物の形成、これがT細胞によるIFN-γおよびIL-17A産生を促進する。 31 2) 腸管透過性の増大により、腸内細菌叢から細菌性エンドトキシン(リポ多糖、LPS)が血液循環に移行し、層状膜由来のTh17細胞から微生物叢依存的にインターロイキン17A(IL-17A)分泌が起こる32 3) 酪酸などの短鎖脂肪酸の腸内細菌叢による発現低下がTh17細胞の増殖を促進する33 などのメカニズム。また、ビフィズス菌のような腸管透過性を改善することが示されている微生物株が、ABSL-1の便に最も多く含まれていたことも注目に値する(Fig.2)。重要なのは、Dubosiella newyorkensis、Staphylococcus nepalensis、2種のLactobacillusなど、ABSL-1集団に豊富に含まれる生物の多くも、免疫活性化の低下と相関があったことである(表1)。ABSL-2マウスでは、免疫活性化と正の相関を示した唯一の種であるRomboutsia ilealisが濃縮されていた。Romboutsia属は、肥満に伴う代謝の変化に関連しており34、これはサルコイドーシス肺の進行の独立した危険因子として機能している35。肺線維症に関連する代謝異常に対するRomboutsiaなどの特定の微生物種の影響について、さらなる調査が必要である。また、メタゲノム解析により、ABSL-1飼育マウスでは乳酸菌種の存在量が比較的多く(図2)、Th17細胞の減少が確認された(図4)。様々な乳酸菌種は、上皮細胞のTLR2/4を介して27、あるいは酪酸のような代謝産物の産生を介してIL-17Aの発現を低下させることができる25。酪酸のようなSCFAは、IL-17A合成を減少させ、T制御細胞の発達を通じてIL-10の生成を促進する能力を通じて、傷害後の炎症状態を軽減する19。我々は、IL-17AおよびTGF-β1によって誘導されるHLFコラーゲン産生の顕著な減少に注目した(図6)。また、Lactobacillus reuteriの経口投与によるマウスの腸内細菌叢の調節は、IL-17Aレベルを低下させることで多発性硬化症様疾患症状からマウスを保護することがわかった26。今後、肺線維症に対する微生物の多様性の影響について、肺線維症患者における疾患の重症度を軽減するためのラクトバチルス属菌によるプロバイオティクス治療の能力を評価することを含め、調査を行うことが必要である。
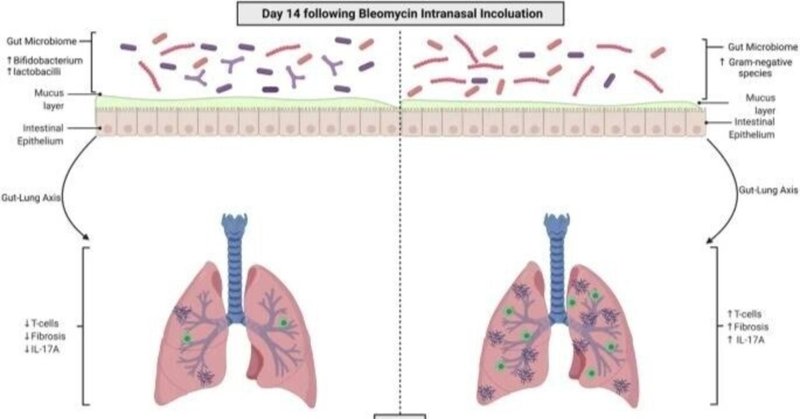
重度の肺線維症に関与する、あるいはそこから保護する可能性のある腸内細菌叢のメンバーを特定することに加え、我々の調査は、腸内コミュニティ組成の多様性の増加が肺疾患の重症度に関して有益であることを示唆している(図1、図5)。この観察は、多様性の高い生態系は、多様性の低い生態系よりも摂動に強いという生態学的原則に沿ったものである。生態系の構成員が動物、植物、微生物のいずれであっても、特定の微生物ではなく、多様性が、長期にわたるコミュニティの安定性と機能性の両方にとって有益であることが示されている36,37,38,39。さらに、マウスを用いた研究により、早期の段階で腸内細菌群集の多様性に乱れが生じると、アレルギー、乾癬、腸炎などの炎症性疾患が後々悪化することが示されています40,41。ABSL-1コホートマウスの腸内細菌群の多様性の増加は、健康で制御された免疫反応を促進する保護的な役割を担っているのかもしれない(図7)。

図7:線維性肺疾患に対する腸の寄与のモデル。
図7
ブレオマイシン誘発マウスモデルにおける腸内細菌叢の直接的な調節は、機能的な腸-肺軸が肺線維症を減弱させることを示唆している。
フルサイズ画像
ヒトの腸内細菌叢は、個人内および個人間で分類学的および機能的な多様性を持つ繁栄する生態系を表している42。糞便微生物叢移植(FMT)は、同種造血幹細胞移植後の合併症43やクロストリジウム・ディフィシル感染症44などに対処するため、腸内細菌の多様性を高める目的で臨床的に検討されています。FMTを用いたその他のマウス研究では、IL-17Aレベルを低下させることにより、急性肝損傷後および急性呼吸窮迫症候群中のマウスの生存率が向上することが実証されている45,46。この研究は、肺線維症患者の腸内細菌叢における機能的および分類学的多様性が臨床成果を改善する可能性があり、腸内細菌の多様性が低下すると、線維性肺疾患の症状がより重度になる傾向があることを示唆する、FMTに関する一連の文献を追加した(図1、図5)。ABSL-1便の分子生物学的検査では、喘息21や肺移植後の炎症性腸管・気道環境と関連するプロテオバクテリアなど、いくつかの炎症性細菌が存在することが示されたが22、コンパニオン微生物は、重度の肺疾患を誘発する能力を制限する可能性がある。
この調査には限界があります。我々のシーケンス研究は、腸内コミュニティの細菌メンバーに焦点を当てていますが、肺線維症に対する腸内細菌叢の影響に対する真菌およびウイルスの貢献の可能性を否定することはできません。さらに、宿主由来の細胞や代謝物を含む便の他の成分は、FMT中にナイーブな宿主に移される47。また、本研究では、異なる飼育環境におけるマウスの肺真菌およびウイルス群集を調査していない。肺微生物叢の変化は、ILD患者において重要であることが指摘されている7,48。腸内細菌叢が肺の微生物群集に与える影響、またその逆についても、さらなる調査が必要である。
全体として、我々の研究は、IL-6/STAT3/IL-17Aシグナル伝達経路を活性化する能力を通じて、多様性の低い腸内細菌叢が肺線維症の重症化の一因となることを示唆している。これらの知見は、微生物の多様性が低い宿主における急性肺損傷は、微生物の多様性が高い宿主と比較して、より重症の肺疾患につながることを支持するものである。ILD患者において、腸内細菌の多様性を高めることの潜在的な利点の検証が必要である。
研究方法
マウス肺線維化モデル
本研究の実験は、腸内細菌叢組成に及ぼす飼育環境の影響と、肺線維症の転帰に及ぼす影響を比較するために設計されたものである。そのために、Jackson Labsから購入したC57BL/6 Jマウス、またはルイビル大学で飼育されたマウスを、微生物との相互作用がない無菌状態(gnotobiotic)、感染が行われない動物バイオセーフティレベル1(ABSL-1)実験環境、または病原微生物との感染が行われる動物バイオセーフティレベル2(ABSL-2)環境のいずれかにて飼育した。いずれの施設でも、マウスへの微生物接種は行わず、ブレオマイシンのみを経鼻投与し、肺線維化を誘導した。マウスは1ケージ3匹で飼育され、各ケージのすべてのマウスに同じ治療が施された。対照群および治療群への実験単位の割り付けには無作為化を行わなかった。サンプルサイズの決定は、1群あたり最低6匹のマウスに基づいて行われた。平均して、1群あたり6-29匹のマウスがいた。特に無菌群のマウス数が少なかったのは、無菌マウスの肺の適応免疫細胞の数が限られていたためである。無菌マウスをさらに犠牲にすると、フローサイトメトリー解析を行うのに十分な免疫事象が保証されない。ブレオマイシン誘発肺線維症のマウスモデルには、体重約17〜22gの6〜8週齢のC57Bl6マウスを使用した。マウスに20 mg/ml Ketamine/1.8 mg/ml Xylazine溶液80 μlを腹腔内注射して麻酔をかけ、次に対照として生理食塩水(0.9%塩化ナトリウム)(Hospira Inc, Lake forest IL)中にブレオマイシン(Novaplus Lake Forest IL)0.04 Unitを含む75μlを報告49に従って各宿泊コホートのマウスに経鼻的に投与した。事後的に解析から動物を除外する基準は設けなかった。先験的には、ブレオマイシン投与後14日以内に便培養により感染が証明された無菌マウスを除外した。また、免疫解析とSircolアッセイから、肺線維症を発症するのに必要な期間である14日以前に死亡した野生型マウスも除外した。これらの基準に基づいて、6匹の無菌マウスと6匹の野生型マウスを除外した。肺は、報告されているように、組織学、フローサイトメトリー、または単細胞分離のために採取された50。結果測定は、生存率、体重減少、肺コラーゲン定量、IL-17Aシグナル伝達経路の免疫分析、およびマウスの便と肺のマイクロバイオーム分析を、それぞれ異なる住環境別に行った。成果測定を行う研究者は、各マウスの環境と治療法について盲検化されていた。各マウスは、我々の分析において個別のデータポイントとみなされた。すべてのマウス処置は、6-8週齢のC57Bl/6雄・雌マウスを用いて、Vanderbilt University Medical Center(プロトコル#M1700043;ABSL-1およびABSL-2施設、およびFMT実験)またはUniversity of Louisville(プロトコル#20786;無菌施設)のInstitutional Animal Care and Use Committeeにより承認されたプロトコルに従って実施された。Louisville大学の無菌隔離施設では、サンプリング(環境のスワブと少なくとも3-4個のランダムケージからの新鮮な糞便ペレット)を行い、Chocolate AgarとTSA w/ 5% Sheep Blood Agarで好気的に37℃で培養、Anaerobic PEA Agarで嫌気的に培養している。LKV/BBE 寒天(Laked Kanamycin Vancomycin/Bacteroides Bile Esculin)およびブルセラ寒天を、アイソレータを開けるたびに(だいたい1回/週だができるだけ数回開ける)37℃で培養した。今回使用したどのアイソレータでも、微生物の増殖は認められなかった。
肺線維化の解析
生理食塩水またはブレオマイシンを経鼻投与したマウスにおいて、肺線維化を定量的および定性的な両方で評価した。各肺の右下葉を酢酸中でホモジナイズし、製造業者のプロトコルに従ってSircolアッセイ(BioColor Ltd., Newton Abbey, UK)を用いてコラーゲン含量を測定した。各肺の右中葉を直ちにホルマリンに入れ、一晩固定した後、組織学のための包埋と切片化の前にエタノールに移し替えた。スライド作成はVanderbilt Translational Pathology Shared Resource (TPSR)が行った。スライドはヘマトキシリン・エオジン(H&E)染色とトリクロームブルー染色をTPSRが行った。盲検化されたスライドは、最新のAshcroftスコアリング・ガイドライン51を使用してスコアリングされた。
腸内細菌叢のメタゲノム解析
各飼育コホートのマウスから糞便ペレットと肺サンプルを採取し、Qiagen DNAeasy extraction kit(Qiagen, Valencia, CA)を用いて、製造者の指示に従ってゲノムDNA(gDNA)を抽出した。gDNA の濃度と品質は Bioanalyzer 2100 system (Agilent, Santa Clara, CA) を用いて確認した。
KneadData (v.0.7.6) でデフォルト値と C57BL マウス参照データベースを用いて、ペアエンド配列のトリミング、品質フィルタリング、宿主汚染物質の除去を行った。腸内細菌サンプルの分類学的組成は MetaPhlAn (v.3.0.4) を用いてプロファイリングし52 、機能的組成は HUMAnN3 (v3.0.0) を用いてプロファイリングした53 。品質フィルタリングとホストリードの除去後に残ったシーケンスリードが1000万未満のサンプルは、ダウンストリーム解析の前に削除されました。肺マイクロバイオームサンプルは細菌にマッピングされる配列の割合が低かったため、肺マイクロバイオームのすべての解析において、Kaiju (v.1.8)3 と nr_euk 2021-02-24 データベースを使って腸マイクロバイオームと肺マイクロバイオームサンプルの両方を分類した。肺と腸の微生物相の配列は、BioProject ID PRJNA899808に寄託されている。
Permutational Multivariate Analysis of variance (PERMANOVA) を用いて、種レベルの相対存在量表から構築した Bray-Curtis 非類似度行列および Jaccard 距離行列に対する住居 (ABSL-1 vs. ABSL-2) および治療 (生理食塩水 vs. bleomycin) の両方の影響を評価した。PERMANOVAは、R54,55のveganパッケージを使って実行した。ABSL-1とABSL-2環境間のシャノン多様性と均等性の違いを調べるために,RのWilcoxon Rank Sum検定を用いた。LEfSe56の線形判別分析を用いて、住居グループと処理グループの両方で異なる豊富な分類群およびパスウェイを同定した。さらに、R57のglmmTMBパッケージで負の二項分布を用いた一般化線形混合効果モデル(GLMM)を用いて、有意に豊富な分類群および機能パスウェイを同定した。スピアマン相関を用いて、個々の分類群の存在量と生理的変数との関連を検討した。コアマイクロバイオーム解析を用いて、所定のグループ内のサンプルの70%以上に存在する種を同定した(ABSL1マウスの腸内マイクロバイオーム、ABSL1マウスの肺マイクロバイオーム、ABSL2マウスの腸内マイクロバイオーム、ABSL2マウスの肺マイクロバイオーム、無菌マウスにABSL1の便を与えた腸内マイクロバイオーム、及び無菌マウスにABSL2の便を与えた腸内マイクロバイオーム、ならびに無菌マウスにABSL2の便を与えた肺マイクロバイオーム)。処理間のコアタクサ間のオーバーラップを用いて、便と肺のマイクロバイオーム間のオーバーラップを評価するとともに、糞便移植の成功度についても評価した。False discovery rate (FDR) で補正した p 値は R58 の fdrtool パッケージを使用して計算し、すべての GLMM と Spearman 相関について報告した。すべての解析のコードは、github.com/emallott/PulmonaryFibrosisMicrobiotaで見ることができる。
フローサイトメトリー
すべてのフローサイトメトリー実験は、LSR-IIフローサイトメーター(BD Biosciences)を用いて取得し、本研究で使用したすべての抗体に関する情報は、補足表1に記載した。生細胞は前方散乱と側方散乱の特性に基づいてゲーティングし、細胞の表面染色は報告されているように行った59。Th17細胞は、以前に記載されたようにフローサイトメトリーを用いて同定した60。細胞は、シングル、生CD3 +およびCD4 +細胞でゲーティングした。データ解析はFlowJoソフトウェア(Tree Star、Ashland、OR)を用いて行った。サンプルあたり最低50,000イベントを取得した。
糞便微生物叢移植実験
ABSL-1およびABSL-2施設に収容されたマウスから糞便ペレットを採取した。これらのペレットを滅菌PBSに懸濁し、100 mg feces/mL PBSの糞便スラリーを作製した。無菌マウスには、ブレオマイシンを鼻腔内接種する1週間前から、糞便スラリーの上澄み液100μLを1日おきに経口ガベージで投与した。便を経口投与された無菌マウスには、受け取った便と同じように、ABSL-1またはABSL-2施設に由来する非滅菌の餌も与えた。マウスは人道的に安楽死させ、ブレオマイシン処理から14日後に組織を採取した。
RNA 抽出および定量的リアルタイム PCR 解析
RNAは、Rneasy Mini kit (Qiagen, Hilden Germany)を用いて抽出した。その後、100 ng の RNA を iScript™ cDNA Synthesis Kit (Biorad USA) を用いて cDNA に変換した。Stat3のTaqman定量PCR分析を行い、データはGapdhハウスキーピング遺伝子に正規化した相対発現として報告した。
菌の調製と接種
Lactobacillus rhamnosus (a gift from Microbiology lab at VUMC) をMRS寒天に接種し、MRSブロス中、37℃、5% CO2で一晩振盪せずに増殖させた。細菌を対数期(1×109コロニー形成単位)まで増殖させ、3700 rpmで7分間遠心分離した。得られた上清を0.22μmフィルターでろ過し、このうち100μLを後述のHLF共培養実験に使用した。
ヒト肺線維芽細胞(HLF)と乳酸菌の上清の共培養実験
4つのヒト肺線維芽細胞(HLFs)細胞株は、Dr. Alexander Gelbard Department of Otolaryngology - Head & Neck Surgery Vanderbilt University Medical Centerから親切な贈り物として入手した。5番目の細胞株はSigma Aldrich #506 -05 Aから購入した(HLF DemographicsはTable 2に記載されている)。HLFは適切な培地でコンフルエンスまで増殖させ、10%牛胎児血清(FBS)、100 U/mL ペニシリン、100 mg/mL ストレプトマイシン添加のダルベッコ改変イーグル培地で37℃、5% CO2下で維持する。
表2 ヒト肺線維芽細胞のデモグラフィック。
フルサイズの表
HLFを96ウェルプレートに3,000細胞/ウェルの密度で一晩プレートした後、20ng/mlのrIL-17A(317ILB050、RHIL-17A 50 UG)および10ng/mlのrTGF-β1(240B002、rHTGF-β1 2 UG)を添加前に24時間、HLFを0.4%線維芽細胞基礎培地(FBM)中の血清飢餓によって静止させる。rIL-17AおよびrTGF-β1を添加したHLFは、その後、100μLのLactobacillus rhamnosus上清または1mMの酪酸ナトリウム(SB)(NC0718494、Sodium Butyrate 100 G)を24日間受け、その後、Abcamからのコラーゲン1α1キット(カタログ# ab210966)を使用して上清からCol1aが分析された。Lactobacillus rhamnosusを上記の方法で培養し、100μLの上清をHLFとの共培養に使用した。HLF細胞ペレットを回収し、それぞれELISA法またはイムノブロット法によるタンパク質発現解析に使用した。ウェスタンブロット解析は、24時間の培養期間後に実施した。細胞培養上清を回収し、ウェスタンブロット解析またはELISA解析のいずれかに使用した。
ライセート、SDS-PAGE、およびウェスタンブロッティング
細胞は報告されているように溶解した61。SDS-PAGEの準備として、HLF細胞溶解物を14,000RPM、4℃で15分間遠心分離した。すべての細胞ライセートは、ゲルロードとランの前に、Bradford Protein Assayを使用して、均一なローディングができるように調整した。細胞溶解物および上清をSDS-PAGEによって分解し、次いでコラーゲン-1(Cell Signaling)、およびα-SMA(Abcam)に対する抗体を用いてウェスタンブロッティングによって分析した。ゲル電気泳動後、タンパク質をImmobilon-FL PVDF膜(Millipore Corporation)上に転写した。ストリッピングとインキュベーションは、Odyssey Infrared Imaging System専用のLi-Corウェスタンブロット分析プロトコルに規定されているとおりに行った。バンド可視化とデンシトメトリーはLi-Cor Odyssey Infrared Imaging System (LI-COR Biosciences, Lincoln, NE) とスタジオソフトを使用して完了した。解析のために、バンド強度からバックグラウンド強度を差し引き、目的のタンパク質をGAPDHに正規化した。
統計学と再現性
多群間比較は、Tukeyのポストホックテストを用いた二元配置分散分析(ANOVA)で行った。すべての図の統計解析は、Prism version 7.02 (GraphPad Software)を用いて実施された。データは平均値±SDで報告され、各ドットは個々のマウスを表す。すべてのマウス実験は、少なくとも2回実施され、サンプルの入手可能性に基づいて4〜29匹のマウスコホートとなった。肺および腸の微生物叢分析は、13〜27匹のマウスからなるマウスコホートで1回実施された。複製は、少なくとも9匹の野生型マウスと少なくとも3匹の無菌マウスを用いて行われた実験と定義された。統計学的に有意とみなされる結果には、0.05未満のP値を使用した。
報告書の概要
研究デザインに関する詳細な情報は、この論文にリンクされているNature Portfolio Reporting Summaryをご覧ください。
データの入手方法
無菌マウス、ABSL-1マウス、ABSL-2マウスの肺と腸のマイクロバイオーム解析から得られたすべての配列は、BioProject ID, Accession number PRJNA899808 に寄託されています。本研究で得られたすべてのデータは、この論文に含まれています(Supplementary Data 1 file)。
コードの入手方法
すべての解析コードはgithub.com/emallott/PulmonaryFibrosisMicrobiotaに掲載されています。
参考文献
Stokholm, J. et al.腸内細菌群の成熟と小児期の喘息リスク。Nat. Commun. 9, 141 (2018).
論文
Google Scholar
Travis, W. D. et al. 米国胸部疾患学会/欧州呼吸器学会公式声明: 特発性間質性肺炎の国際的な学際的分類の更新。Am. J. Respir. Crit. Care Med 188, 733-748 (2013).
論文
Google Scholar
Raghu, G. et al. Idiopathic Pulmonary Fibrosis の診断。ATS/ERS/JRS/ALAT公式臨床実践ガイドライン。Am. J. Respir. Crit. Care Med 198, e44-e68 (2018).
論文
Google Scholar
Strongman, H., Kausar, I. & Maher, T. M. Incidence, Prevalence, and Survival of Patients with Idiopathic Pulmonary Fibrosis in the UK(英国における特発性肺線維症患者の発生率、有病率、生存率。アドバンス・サー. 35, 724-736 (2018).
論文
Google Scholar
Swigris, J. J. et al. 1988年から2007年までの米国におけるサルコイドーシス関連死亡率. Am. J. Respir. Crit. Care Med 183, 1524-1530 (2011).
論文
Google Scholar
Huang, Y. et al. Microbes Are Associated with Host Innate Immune Response in Idiopathic Pulmonary Fibrosis(特発性肺線維症における宿主自然免疫反応と微生物の関連性)。Am. J. Respir. Crit. Care Med 196, 208-219 (2017).
論文
キャス
Google Scholar
O'Dwyer, D. N. et al. Lung Microbiota Contribute to Pulmonary Inflammation and Disease Progression in Pulmonary Fibrosis.(肺微生物叢は肺線維症の肺炎症と疾患進行に寄与する)。Am. J. Respir. Crit. Care Med 199, 1127-1138 (2019).
論文
Google Scholar
Andréasson, K., Alrawi, Z., Persson, A., Jönsson, G. & Marsal, J. Intestinal dysbiosis is common in systemic sclerosis and associated with gastrointestinal and extraintestinal features of disease.腸内細菌症は全身性硬化症によく見られ、病気の消化器系および腸外系特徴と関連している。Arthritis Res Ther. 18, 278 (2016).
論文
Google Scholar
Zhou, Y., Chen, L., Sun, G., Li, Y. & Huang, R. Alterations in the gut microbiota of patients with silica-induced pulmonary fibrosis.(シリカ誘発肺線維症患者の腸内細菌叢の変化)。J. Occup. Med Toxicol. 14, 5 (2019).
論文
Google Scholar
Budden, K. F. et al. Emerging pathogenic links between microbiota and the gut-lung axis(微生物叢と腸-肺軸の間の新たな病原性関連性)。Nat. Rev. Microbiol 15, 55-63 (2017)。
論文
キャス
Google Scholar
Chioma, O. S., Hesse, L. E., Chapman, A. & Drake, W. P. Role of the Microbiome in Interstitial Lung Diseases.(間質性肺疾患におけるマイクロバイオームの役割)。Front Med (Lausanne) 8, 595522 (2021).
論文
Google Scholar
腸内細菌の有害な侵入に対する防御の最前線:ムチン、抗菌ペプチド、およびマイクロバイオータ(Lievin-Le Moal, V. & Servin, A. L. Clin. Microbiol Rev. 19, 315-337 (2006).
論文
CAS
Google Scholar
Ruiz, P. A., Hoffmann, M., Szcesny, S., Blaut, M. & Haller, D. Bifidobacterium lactisが無菌ラットのコロニー形成後に腸上皮細胞で一過性の炎症性宿主応答を活性化する自然発生的機構. Immunology 115, 441-450 (2005).
論文
CAS
Google Scholar
Schirmer, M. et al. Human Gut Microbiome to Inflammatory Cytokine Production Capacity(ヒト腸内細菌と炎症性サイトカイン産生能の関連性). Cell 167, 1125-1136.e1128 (2016).
論文
CAS
グーグル スカラー
Epstein Shochet, G., Brook, E., Bardenstein-Wald, B. & Shitrit, D. 特発性肺線維症(IPF)線維芽細胞由来の可溶性因子によるTGF-β経路活性化はIL-6トランスシグナルによって媒介されます。Respir. Res 21, 56 (2020).
論文
CAS
Google Scholar
Le, T. T. et al. IL-6 Transシグナル伝達の遮断は肺線維症を減弱させる。J. Immunol. 193, 3755-3768 (2014).
論文
CAS
Google Scholar
O'Donoghue, R. J. et al. Genetic partitioning of interleukin-6 signalling in mice dissociates Stat3 from Smad3-mediated lung fibrosis. EMBO Mol. Med 4, 939-951 (2012).
論文
Google Scholar
Chen, L. et al. Microbiota Metabolite Butyrate Differentially Regulates Th1 and Th17 Cells' Differentiation and Function in Induction of Colitis.(微生物叢代謝産物である酪酸は、大腸炎の誘発においてTh1およびTh17細胞の分化と機能を制御する。Inflamm. Bowel Dis. 25, 1450-1461 (2019).
論文
Google Scholar
Furusawa, Y. et al. 宿主微生物由来の酪酸は、大腸制御性T細胞の分化を誘導する。Nature 504, 446-450 (2013).
論文
CAS
Google Scholar
Vester-Andersen、M.K.ら、診断から7年後の侵襲性クローン病におけるプロテオバクテリアの存在量の増加。Sci. Rep. 9, 13473 (2019).
論文
CAS
Google Scholar
Sverrild, A. et al. 喘息患者における好酸球性気道炎症は、気道マイクロバイオームの変化と関連している。J. Allergy Clin. Immunol. 140, 407-417.e411 (2017).
論文
Google Scholar
Bernasconi, E. et al. Airway Microbiota Determines Innate Cell Inflammatory or Tissue Remodeling Profiles in Lung Transplantation(気道微生物叢は肺移植における自然免疫細胞の炎症または組織リモデリングのプロフィールを決定する。Am. J. Respir. Crit. Care Med 194, 1252-1263 (2016).
論文
CAS
Google Scholar
Yang, D. et al. Dysregulated Lung Commensal Bacteria Drive Interleukin-17B Production to Promote Pulmonary Fibrosis through Their Outer Membrane Vesicles.肺炎球菌は、肺炎球菌の外膜小胞を経由して肺線維症を促進する。Immunity 50, 692-706 e697 (2019).
論文
キャス
Google Scholar
Sencio, V. et al. インフルエンザ時の腸内ディスバイオーシスは、短鎖脂肪酸産生の変化を通じて肺炎球菌のスーパーインフェクションに寄与する. Cell Rep. 30, 2934-2947 e2936 (2020).
論文
CAS
Google Scholar
Arpaia, N. et al.常在菌が産生する代謝産物は、末梢性制御性T細胞の生成を促進する。Nature 504, 451-455 (2013).
論文
CAS
Google Scholar
He, B. et al. Lactobacillus reuteriは、腸内細菌叢の調節によりマウスの実験的自己免疫性脳脊髄炎の重症度を低下させる. Front Immunol. 10, 385 (2019).
論文
キャス
グーグル スカラー
Rizzo, A., Losacco, A., Carratelli, C. R., Domenico, M. D. & Bevilacqua, N. Lactobacillus plantarumはヒト上皮細胞におけるIL-17、IL-23およびToll様受容体2/4の発現を調節することによりStreptococcus pyogenes virulnessを低減させる。Int Immunopharmacol. 17, 453-461 (2013).
論文
CAS
Google Scholar
Michael, D. R. et al. A randomised controlled study shows supplementation of overweight and obese adults with lactobacilli and bifidobacteria reduces body weight and improves well-being。Sci. Rep. 10, 4183 (2020).
論文
CAS
Google Scholar
Panzer, A. R. et al. Lung Microbiota Is Related to Smoking Status and to Development of Acute Respiratory Distress Syndrome in Critically Ill Trauma Patients.肺微生物叢は、重症外傷患者における喫煙状況および急性呼吸窮迫症候群の発症と関係がある。Am. J. Respir. Crit. Care Med 197, 621-631 (2018).
論文
キャス
Google Scholar
Taylor, S. L. et al. Long-Term Azithromycin Reduces Haemophilus influenzae and Increases Antibiotic Resistance in Severe Asthma(長期アジスロマイシンは、重症喘息におけるインフルエンザ菌を減らし、抗生物質耐性を高める。Am. J. Respir. Crit. Care Med 200, 309-317 (2019).
論文
キャス
Google Scholar
Elijovich, F. et al. The Gut Microbiome, Inflammation, and Salt-Sensitive Hypertension.(腸内細菌、炎症、塩分感受性高血圧症)。Curr. Hypertens. Rep. 22, 79 (2020).
論文
CAS
Google Scholar
Brandsma, E. et al. 炎症性腸内細菌叢は、全身性炎症を増加させ、動脈硬化を促進する。Circ. Res 124, 94-100 (2019)に掲載されています。
論文
キャス
グーグル スカラー
Ivanov, I. I. et al. Specific microbiota direct the differentiation of IL-17-producing T-helper cells in the mucosa of the small intestine.(特定の微生物が小腸の粘膜でIL-17産生Tヘルパー細胞の分化を指示する)。Cell Host Microbe 4, 337-349 (2008).
論文
CAS
Google Scholar
Zeng, Q. et al. Discrepant gut microbiota markers for the classification of obesity-related metabolic abnormalities(腸内細菌叢マーカーによる肥満関連代謝異常の分類)。Sci. Rep. 9, 13424 (2019).
論文
Google Scholar
Cozier, Y. C. et al. 米国黒人女性におけるサルコイドーシス発症に関連する肥満および体重増加:Black Women's Health Studyからのデータ. Chest 147, 1086-1093 (2015).
論文
Google Scholar
Allan, E. et al. より多様な植物群落は、補完的な支配種のターンオーバーにより、長期的に高い機能を発揮する。Proc. Natl Acad. Sci. USA 108, 17034-17039 (2011).
論文
CAS
Google Scholar
マクノートン、S.J. 放牧生態系の生態学: セレンゲティ. Ecol. Monogr.55, 259-294 (1985).
論文
Google Scholar
10年にわたる草原実験における生物多様性と生態系の安定性. Nature 441, 629-632 (2006).
論文
CAS
Google Scholar
Wittebolle, L. et al.選択的ストレス下における初期群集の均一性は機能性に有利である。Nature 458, 623-626 (2009)。
論文
CAS
Google Scholar
腸内細菌の多様性は、長期的なIgEレベルを形成する。Cell Host Microbe 14, 559-570 (2013).
論文
CAS
Google Scholar
Zanvit, P. et al. 新生児期の抗生物質が実験的乾癬に対するマウスの感受性を高める。Nat. Commun. 6, 8424 (2015).
論文
CAS
Google Scholar
Lozupone, C. A., Stombaugh, J. I., Gordon, J. I., Jansson, J. K. & Knight, R. Diversity, stability and resilience of the human gut microbiota(ヒト腸内細菌叢の多様性、安定性および回復力)。Nature 489, 220-230 (2012).
論文
CAS
Google Scholar
Taur, Y. et al. 自己糞便微生物移植による抗生物質治療患者の腸内細菌叢の再構成. Sci Transl Med 10, aap9489 (2018).
Khanna, S. et al. A Novel Microbiome Therapeutic Increases Gut Microbial Diversity and Prevents Recurrent Clostridium difficile Infection(新規マイクロバイオーム治療薬は腸内細菌の多様性を高め、クロストリジウム・ディフィシル感染症の再発を予防する。J. Infect. Dis. 214, 173-181 (2016).
論文
Google Scholar
Alghetaa, H. et al. Resveratrol-mediated attenuation of superantigen-driven acute respiratory distress syndrome is mediated by microbiota in the lungs and gut.(レスベラトロールによるスーパー抗原駆動型急性呼吸窮迫症候群の軽減は、肺および腸の微生物相によって媒介される。Pharm. Res 167, 105548 (2021).
論文
CAS
Google Scholar
Liu, Y. et al. 糞便移植はTreg/Th17サイトカインバランスを調節することでマウスの急性肝損傷を緩和する. Sci. Rep. 11, 1611 (2021)。
論文
CAS
Google Scholar
Bojanova, D. P. & Bordenstein, S. R. Fecal Transplants: 何が転送されているのか。PLoS Biol. 14, e1002503 (2016).
論文
Google Scholar
Molyneaux, P. L. et al. 特発性肺線維症の病因と進行におけるバクテリアの役割. Am. J. Respir. Crit. Care Med 190, 906-913 (2014).
論文
CAS
Google Scholar
Lawson, W. E. et al.小胞体ストレスは、肺の線維性リモデリングを促進する。Proc. Natl Acad. Sci. USA 108, 10562-10567 (2011).
論文
CAS
Google Scholar
Celada, L. J. et al. CD4(+) T細胞上のPD-1アップレギュレーションは、STAT3を介したIL-17AおよびTGF-β1産生を介して肺線維化を促進します。Sci Transl Med 10, aar8356 (2018).
Hubner, R. H. et al. 組織学的サンプルにおける肺線維症の標準化された定量化。Biotechniques 44, 514-507 (2008)。507-511.
論文
Google Scholar
Segata, N. et al. 固有のクレード特異的マーカー遺伝子を用いたメタゲノム微生物群集のプロファイリング. Nat. Methods 9, 811-814 (2012).
論文
CAS
Google Scholar
Franzosa, E. A. et al. メタゲノムおよびメタトランススクリプトームの種レベルでの機能プロファイリング。Nat. Methods 15, 962-968 (2018)に掲載されています。
論文
CAS
Google Scholar
オクサネンJ.ら、Vol.R(2020).
Team, R. C. (https://www.R-project.org/), (2018)。
Segata, N. et al. Metagenomic biomarker discovery and explanation. Genome Biol. 12, R60 (2011).
論文
Google Scholar
Brooks, M. E. K. Kasper; van Benthem, Koen J.; Magnusson, Arni; Berg, Casper W.; Nielsen, & Anders; Skaug, H. J. M., Martin; Bolker, Benjamin M. glmmTMB ゼロ膨張一般化線形混合モデリングのためのパッケージ間で速度と柔軟性をバランスよく調整すること。R. J. 9, 378-400 (2017).
論文
Google Scholar
Strimmer, B. K. a. K. Vol. R (CRAN)、(2020).
Herazo-Maya, J. D. et al. 特発性肺線維症患者における転帰予測のための52遺伝子リスクプロファイルの検証:国際多施設共同コホート研究(Validation of a 52-gene risk profile for outcome prediction with idiopathic pulmonary fibrosis: an international, multicentre, cohort study. Lancet Respir. Med 5, 857-868 (2017).
論文
Google Scholar
Collins, S. L. et al. Vaccinia vaccine-based immunotherapy arrests and reverses established pulmonary fibrosis.(ワクチニアワクチンを用いた免疫療法は、確立した肺線維症を阻止し、逆転させる。JCI Insight 1, e83116 (2016).
論文
Google Scholar
Celada, L. J. et al. Programmed Death-1 Inhibition of Phosphatidylinositol 3-Kinase/AKT/Mechanistic Target of Rapamycin Signaling Impairs Sarcoidosis CD4(+) T Cell Proliferation.プログラムデス1阻害は、サルコイドーシスCD4(+) T細胞の増殖を阻害する。Am. J. Respir. Cell Mol. Biol. 56, 74-82 (2017)に掲載されています。
論文
キャス
グーグルスカラー
参考文献のダウンロード
謝辞
この研究は、NIH K24 HL127301-01、R56 RHL149129-01A1、およびW.P.DとVanderbilt Microbiome InitiativeへのEllen Dreiling Research Fund Endowmentによって支援されています。O.S.CはT32 Grant T32AR059039-10, K12 HL 143956-4, Foundation of Sarcoidosis Research FSR RFP 17-9041により支援されている。無菌マウスは、NIH/NIGMS CoBREグラント(P20GM125504)の支援を受けたat University of Coreの施設で飼育されている。S.R.B、S.DおよびB.Hは、P20GM1125504の支援を受け、またVanderbilt University School of Medicine Animal Facilityで飼育されている。モデルはBioRenderで作成した。
著者情報
著者および所属
Vanderbilt University School of Medicine, Department of Infectious Disease, Nashville, TN, USA(バンダービルト大学医学部感染症科
Ozioma S. Chioma、Austin Chapman、Joseph C. Van Amburg、Hongmei Wu、Binal Shah-Gandhi、Nandita Dey、Marina E. Kirkland & Wonder P. Drake
ヴァンダービルト大学生物科学部(米国テネシー州ナッシュビル
エリザベス・K・マロット&セス・R・ボーデンシュタイン
バンダービルト・マイクロバイオーム・イニシアチブ、バンダービルト大学、ナッシュビル、USA
エリザベス・K・マロット&セス・R・ボーデンシュタイン
消化器・肝臓・栄養研究部門、医学部、バンダービルト大学医学部、ナッシュビル、テネシー州、米国
M. Blanca Piazuelo
米国テネシー州ナッシュビル、バンダービルト大学医学部病理学・微生物学・免疫学教室
ジョイス・ジョンソン、セス・R・ボーデンシュタイン、ワンダー・P・ドレイク
米国テネシー州ナッシュビル、バンダービルト大学医学部、呼吸器・重症患者部門
ゴードン・R・バーナード
ルイビル大学医学部微生物学・免疫学教室(米国カンザス州ルイビル市
Sobha R. Bodduluri & Bodduluri Haribabu(ソバ・R・ボドゥルリ&ボドゥルリ・ハリバブ
ルイビル大学医学部比較医学研究ユニット(米国KY州ルイビル市
スティーブン・デイヴィソン
貢献内容
O.S.C.は実験の計画と実行、データ解析、原稿執筆を行った。E.K.M.はメタゲノム解析を実施し、原稿を執筆した。A.C., J.C.V., N.D., H.W., M.K., M.B.P., J.J., and B.S.G. は実験を実施した。S.R. BordensteinとG.R.B.は、知的内容、試験デザイン、原稿の編集に貢献した。S.D., S.R. Bodduluri, and H.B.は無菌実験に協力した。W.P.D.は研究の構想、実験計画、データ解析、原稿執筆を行った。
共著者
Wonder P. Drakeに連絡する。
倫理的宣言
利益相反
著者らは、競合する利害関係を宣言していない。
査読
査読情報
本論文の査読にご協力いただいたJin Su氏と他の匿名の査読者に感謝します。主な取扱編集者 Sridhar Mani、Christina Karlsson Rosenthal。査読者のレポートがあります。
その他の情報
出版社からのコメント Springer Natureは、出版された地図や所属機関に関する管轄権の主張に関して中立的な立場を維持しています。
補足情報
査読ファイル
補足情報
追加補足ファイルの説明
補足データ1
報告書概要
権利と許可
オープンアクセス この記事はクリエイティブ・コモンズ 表示 4.0 国際ライセンスの下に提供されており、原著者と出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更を加えたかどうかを示す限り、あらゆる媒体や形式での使用、共有、適応、配布、複製を許可しています。この記事に掲載されている画像やその他の第三者の素材は、素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれます。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法令上の規制で許可されていない場合、または許可された利用を超える場合には、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
クロスマークで通貨と真偽を確認する
この記事の引用
Chioma, O.S., Mallott, E.K., Chapman, A. et al. Gut microbiota modulates lung fibrosis severity following acute lung injury in mice(腸内細菌叢はマウス急性肺損傷後の肺線維症の重症度を調節する。Commun Biol 5, 1401 (2022)。https://doi.org/10.1038/s42003-022-04357-x。
引用文献のダウンロード
受領日
2021年7月27日
受理済
2022年12月09日
公開日
2022年12月22日発行
DOI
https://doi.org/10.1038/s42003-022-04357-x
この記事を共有する
以下のリンクを共有すると、誰でもこのコンテンツを読むことができます。
共有可能なリンクを取得する
コンテンツ共有イニシアチブ「Springer Nature SharedIt」により提供されます。
対象分野
メタゲノミクス
マイクロバイオーム
コメント
コメントを投稿することで、私たちの規約とコミュニティ・ガイドラインに従うことに同意したことになります。もし、誹謗中傷や規約・ガイドラインに反する内容を発見された場合は、不適切と判断しフラグを立ててください。
コミュニケーションバイオロジー(Commun Biol) ISSN 2399-3642 (オンライン)
ネイチャー・ドット・コム サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーズについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツ検索
ジャーナルA-Z
テーマ別記事
ナノ
プロトコル交換
ネイチャー・インデックス
出版ポリシー
ネイチャー・ポートフォリオ方針
オープンアクセス
著者・研究者サービス
リプリントとパーミッション
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
ネイチャーリサーチアカデミー
リサーチソリューション
図書館・機関
図書館サービス&ツール
図書館員ポータル
オープンリサーチ
図書館に推薦する
広告とパートナーシップ
広告・宣伝
パートナーシップとサービス
メディアキット
ブランデッドコンテンツ
キャリア開発
ネイチャーズキャリア
ネイチャーコンファレンス
ネイチャーイベント
地域別ウェブサイト
ネイチャーアフリカ
ネイチャー・チャイナ
インド
ネイチャー・イタリア
ネイチャー・ジャパン
ネイチャー・コリア
ネイチャー・ミドルイースト
プライバシーポリシー クッキーの使用 クッキーの管理/私のデータを売らない 法的通知 アクセシビリティに関する声明 利用規約 カリフォルニア プライバシーに関する声明
シュプリンガー・ネイチャー
© 2022 シュプリンガー・ネイチャー・リミテッド
この記事が気に入ったらサポートをしてみませんか?
