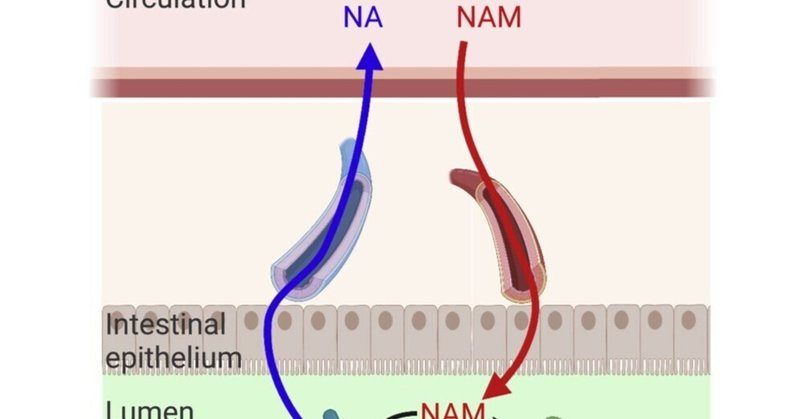
NAD前駆体は宿主組織と腸内細菌叢の間で循環している
論文| 34巻12号 p1947-1959.e5, 2022年12月06日号
NAD前駆体は宿主組織と腸内細菌叢の間で循環している
Karthikeyani Chellappa 7
メラニー・R・マクレイノルズ 6, 7
Wenyun Lu
Marie E. Migaud
Joshua D. Rabinowitz
ジョセフ・A・バウアー 8
すべての著者を表示
脚注を表示するDOI:https://doi.org/10.1016/j.cmet.2022.11.004
PlumXメトリクス
ハイライト
宿主循環からニコチンアミドが腸管内腔に入る
循環するニコチンアミドと食物繊維が微生物のNAD合成をサポートする
微生物が生成したニコチン酸は、宿主組織のNADサルベージ経路を迂回する
経口ニコチンアミドリボシドは、主に微生物のニコチン酸を経由してNAD合成に供給される
概要
ニコチンアミドアデニンジヌクレオチド(NAD)は、哺乳類および微生物に必須の酸化還元補酵素である。ここでは、同位体トレーシングを用いて、マウスの腸内細菌叢におけるNAD合成を支える前駆体を調査した。その結果、食餌性NAD前駆体は消化管の近位部で吸収され、遠位腸の微生物には利用されないことがわかった。その代わりに、循環している宿主のニコチンアミドが腸管内腔に入り、微生物のNAD合成をサポートする。マイクロバイオームは宿主由来のニコチンアミドをニコチン酸に変換し、宿主組織でのNAD合成に利用され、食事による摂取がない場合でも循環ニコチン酸濃度が維持される。さらに、広く利用されている栄養補助食品である経口ニコチンアミドリボシドから宿主NADへの主な経路は、腸内細菌によるニコチン酸への変換を経由するものである。このように、我々は、循環する宿主の微量栄養素が腸内細菌に供給され、宿主の代謝の柔軟性を高めるような方法で変換される能力を確立することができた。

図解要約
図のサムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
ナイアシン
ニコチン酸
NAD
リボシド
マイクロバイオーム
ニコチンアミド
モノヌクレオチド
フラックス
消化管
微生物
はじめに
ニコチンアミドアデニンジヌクレオチド(NAD)は、酸化型(NAD+)と還元型(NADH)の間で相互変換を行い、ヒドリドイオン(H-)の形で電子を移動させる還元酸化(レドックス)必須の共酵素である。NAD消費酵素はNAD分子を分解してニコチンアミド(NAM)を放出するため、NADの恒常性を維持するためには合成と消費のバランスが必要である。加齢、肥満、炎症性疾患、心血管疾患、神経変性疾患などの様々な病態において、NAD量が減少することが報告されています。多くの場合、細胞内のNAD量の減少は、ミトコンドリアおよび代謝の機能障害と相関しています。NADブーストは、げっ歯類の疾患モデルにおいて代謝障害を改善し1、2、3、4、5、6、また、いくつかのヒト臨床試験において有望視されているが7、8、他の試験では効果はわずかであるか全くない9、10、11。
動物は、腸内細菌叢を含む常在微生物との共進化を遂げてきました。腸内腔に生息する微生物は、摂取した食物および宿主由来の循環栄養素の両方にアクセスし、代謝活動を支援できる可能性があるという点でユニークである。しかし、小腸の近位部で吸収された栄養素は、腸管の遠位部に存在する微生物にはほとんど到達できない。さらに、循環している宿主の栄養素のうち、微生物群の代謝を促進するために上皮バリアを十分に透過するものがあるとすれば、それはどれなのかが不明であった。大腸マイクロバイオームの栄養源として確立されているのは、難消化性の複合糖質と宿主粘液の2つである12,13,14,15,16,17,18。
宿主細胞と同様に、NAD は微生物にとって必須である。哺乳類の組織や自由生活する微生物におけるNAD代謝を理解するために、過去1世紀にわたって多大な努力が払われてきた。一方、腸内細菌群におけるNAD代謝については、あまり広範に研究されていない。最近の研究では、無菌マウスの結腸細胞において、NADH/NAD+の酸化還元比が著しく低下していること(NADの絶対量は低下していない)が明らかになった19。
哺乳類では、NAD 生合成の 3 つの主要なルートは、(1) トリプトファンからのデノボ合成、(2) NAM からのニコチンアミドホスホリボシルトランスフェラーゼ (NAMPT) または NR キナーゼによるサルベージ合成22、および (3) ニコチン酸 (NA, また「ナイアシン」) からのニコチン酸リンボシル転移酵素 (NAPRT) によるプリスハンドラー合成である。トリプトファンからの NAD のデノボ合成は、主に肝臓で量的に重要であるが、腎臓および一部の免疫細胞もこの経路を利用して NAD を作る。23,24,25 NAD を消費する酵素によって NAM がターンオーバーし、全身循環系と交換される。これは、サルベージ経路を通じて NAD を生成するために使用できる前駆体の共通プールを提供する。NAD 合成は、NR やニコチンアミドモノヌクレオチド (NMN) などの中間体を外部から補充することで増加させることができる1, 6, 26, 27, 28。
ほとんどの微生物種は、アミノ酸からデノボで、あるいは「ビタミン B3」(NA、NAM、および NR やニコチン酸リボシド [NAR] などの関連誘導体の総称)の救済を通じて NAD を合成するために必要な酵素を一つ以上コードしている (Figure 1A ) 。 単細胞微生物では、トリプトファンから(哺乳類と同様)、またはより一般的にはL-アスパラギン酸オキシダーゼ(nadB)によってアスパラギン酸からデノボ合成される32。重要なことは、多くの細菌(哺乳類ではない)が、NAMからNAに変換する酵素(ニコチンアミドデアミドラーゼ(pncA))をコードしていることだ21,33,34 。
図サムネイルgr1
図1微生物によるNAD合成の大部分は、食餌性前駆体によって占められてはいない
キャプションを表示
大きな画像を表示するダウンロード 高解像度画像
本研究では、同位体トレーサーを用いて、微生物のNADプールがどのように確立されるかを明らかにします。その結果、食事性タンパク質とビタミンB3は、腸内細菌叢におけるNAD生合成の主要な前駆体ではないことがわかりました。その代わりに、宿主循環中のNAMが腸管内腔に入り、NAD生合成の材料となり、食物繊維の異化作用も大腸マイクロバイオーム内のNADに供給されることがわかった。宿主由来のNAMを消費するだけでなく、マイクロバイオームはNAMをNAに変換して、宿主組織に代替のNAD前駆体を提供し、NAMからのNADのサルベージ合成が阻害されたときに腸内細胞のNADレベルを回復させる。また、腸内細菌は経口投与されたNRをNAに変換し、NAが経口投与されたNRを高レベルで循環させ、NRが宿主のNADを増加させるのに重要であることを明らかにした。つまり、NAM-NA代謝サイクルは、宿主とマイクロバイオームの間でNAD前駆体を共有することを可能にするのである。
結果
水溶性食物繊維は大腸の微生物群のNAD合成に寄与する
我々は、食物繊維またはタンパク質が、消化管の長さに沿って存在する腸内マイクロバイオームによるデノボ NAD 生合成の前駆体を提供するかどうかを調べた(図 1B)。穀物ベースの飼料には、約 15%-20% の不溶性食物繊維(一般に代謝されない)と 3%-5% の水溶性食物繊維(大腸菌によって発酵される)が含まれています。35,36,37 マウスには、非標識イヌリン 5 w/w を混ぜた精製飼料を 14 日間与え、その後、犠牲の 24 時間前に U-13C-inulin 入り飼料に切り替えた。13Cの自然存在量を考慮した結果、盲腸内腔で検出されたNAD分子の約65%がイヌリン由来の1つ以上の標識炭素原子を含み、タンパク質由来は10%未満であった(図1Cおよび図1D)。盲腸内腔の前駆体(アミノ酸など)標識とNAD中の全炭素原子を考慮した定量的解析により、NAD合成への全炭素寄与の約37%が食物繊維であるのに対し、タンパク質では約3%に過ぎないことがわかった(図1Eおよび図S1A)。微生物NAD合成に対するイヌリンの寄与は、腸管内腔および腸管組織の他の部分では低かった(図S1B)。食物繊維は、主にアスパラギン酸およびリボース5-リン酸を介して、大腸内腔の微生物NADに寄与している(図1F)。アスパラギン酸依存的なNADのde novo合成と一致して、MS/MSによってNADのNAM部位に標識を検出することができた(図S1C-S1E)。
フルクトースのような単糖は通常、消化管の近位部で吸収されるが、過剰な栄養摂取の条件下では消化管内腔の遠位部まで到達することがある38。我々は、U-13C-フルクトースの経口ボーラスが、消化管内腔およびホスト組織中のNADを標識することを見出した(図S1FおよびS1G)。大腸内腔での NAD の質量シフト(M+19 まで)は、ニコチンアミド環を含む NAD のすべての部位を標識できることを示している。また、アスパラギン酸、キノリン酸、リボース5-リン酸といったNAD合成の中間体の標識も同様に検出され、大腸内腔のNADのMS/MSフラグメンテーションによりニコチンアミド環の標識を識別できた(図S1H〜S1K)。一方、ペントースリン酸経路からのリボースリン酸の利用は、小腸内腔や宿主組織で観察されるNADの標識を説明することができる。したがって、結腸に到達した炭水化物はde novo NAD合成に供給されるが、食事性タンパク質と食物繊維を考慮すると、NAD合成の大部分は説明できないままである。
食事性ニコチン酸は遠位腸に存在する微生物には利用できない
標準的なマウスの餌にはNAが含まれており、これが腸内細菌によるNAD合成の前駆体となる可能性がある。この可能性を検討するため、1日の摂取量の40%に相当する標識NA(2,4,5,6-2H-NA)をマウスに経口摂取させた。胃内腔では、最も早い時期から高レベルの完全標識NA(M+4 NA)が検出された(図1G)。血清中のラベル化されたNAは15分後にピークに達し、徐々に減少した(図S1L)。このトレーサーがNADに取り込まれると、レドックス活性(4)位からラベルが失われ、M+3代謝物が生成される。十二指腸と空腸の内腔には未代謝のM+4 NAが少量認められたが、遠位小腸と結腸ではM+3 NAのみが検出された。十二指腸内腔では経口NAが微生物のNAD合成に大きく寄与していたが(ボーラス後1時間で最大約32%)、遠位小腸および大腸ではその寄与はごくわずかであった(図1H)。これらのデータは、経口摂取したNAが回腸および結腸の内腔に到達する前に吸収または代謝されたことと矛盾しない。
次に、腸管内腔および循環系におけるNAに対する微生物の相対的な寄与を明らかにするために、NAを含むまたは含まない精製飼料をマウスに与えた。それぞれの飼料を与えられたマウスには、通常の飲料水か、微生物相を枯渇させるために抗生物質のカクテルで処理した水のどちらかが与えられた。大腸内腔のNAを枯渇させるには抗生物質だけで十分であったが、循環NAを減少させるにはNA欠乏食と抗生物質の組み合わせが必要であった(図1Iおよび図1J)。
循環ニコチンアミドは、内腔NADとニコチン酸の主要な前駆体である
驚くべきことに、抗生物質は腸管内腔のNAを枯渇させる一方で、内腔のNAMを増加させた(図1K)。無菌マウスの腸管内腔でも、内腔NAの減少とNAMの増加が同様に観察された(図1L、S1M、S1N)。これらのデータは、微生物に依存しない腸管内腔NAMの源が存在し、微生物がこのNAMをNAに変換している可能性を提起している。
腸管内腔のNAMの供給源は何だろうか?この可能性を探るために、我々はマウスに2,4,5,6-2H-NAMを静脈内注射した(図2A )。その結果、消化管内全域の内腔に完全に標識された NAM が検出された (図 2B )。また、M+4標識されたNAが消化管の長さ方向に沿った管腔内容物に検出された(図2C)。大腸の内腔でNAMが低いがNAが高いということは、微生物によるNAMのNAへの脱アミド化が速いことを示し、微生物の密な負荷と直接相関していることがわかる。注入されたNAMから生成されたNAは、血清中の標識NAによって証明されるように、循環に再参入している(図2D)。抗生物質処理および無菌マウスの大腸内腔にNADが存在しないことから、内腔のNADは主に微生物由来であると考えられる(図S1Oおよび図S1P)。標識されたNAD分子は、小腸と大腸の両方の内腔内容物に検出され、微生物プールに組み込まれたことを示した(図S2A)。同様に、静脈内投与したNAMトレーサーは、無菌マウスの血清およびGIルーメンに蓄積したが(図2EおよびS2B)、NAおよびNADに変換されなかった(図2F、S2C、およびS2D)。
図サムネイルgr2
図2循環するNAMが腸管内腔に入り、微生物のNAD生合成をサポートする様子
キャプションを表示
大きな画像を表示するダウンロード 高解像度画像
上記の結果が、静脈注射後の循環NAMレベルの大きな一過性の変動によるものであることを排除し、より定量的な下流分析を可能にするために、次に、最小限の摂動速度(0.2 nmol/g/min)で2,4,5,6-2H-NAMを連続静脈内注入する実験を行った。NAMの注入により、血清中のM+4 NAM標識は急速に増加し、組織中のNAD合成と分解のサイクルに由来する循環M+3 NAMはゆっくりと蓄積した(図3A)23, 40。注入した(M+4)NAMとリサイクルした(M+3)NAMは、内腔および血清M+4とM+3 NAとともに、腸内腔に検出された(図S3A-S3C)。NADは小腸と結腸全体で標識され、空腸と回腸内腔では12時間以内に、結腸では18時間後に定常状態に達した(図3B、S3D、およびS3E)。NAMの取り込みが高いにもかかわらず、NADの標識化は胃内腔では遅かった。血清中のNAM標識の割合に正規化することで、GI管のさまざまな部位におけるマイクロバイオームのNAD合成に対する循環NAMの定量的寄与を推定した(図3C)。回腸と空腸では循環型NAMが微生物のNAD合成の80%から90%を占め、結腸では45%であった(結腸マイクロバイオームがNADの約半分を繊維からde novo合成していることと一致する)。このように、循環中の宿主NAMは腸管内腔に入り、マイクロバイオームによってNADとNAの両方の合成に利用される。
図サムネイルgr3
図3ビタミンB3は宿主と腸内細菌叢の間で循環している
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
微生物による脱アミド化により、宿主の腸と肝臓でのサルベージ合成が回避される
サルベージ経路の律速酵素であるNAMPTを阻害すると、一般的にNADの消費量に比例して組織のNADレベルが減少する40。例えば、腸と脾臓のNAD回転速度はほぼ同じであるが、NAMPT阻害剤FK866で処理すると、脾臓では90%以上のNADが枯渇するが40、腸では約50%しか枯渇しない(図3D)。2,4,5,6-2H-NAM トレーサーを用いると、NAMPT 阻害剤存在下でも、注入した NAM から腸(脾臓ではなく)の NAD が持続的に標識されることが確認された(図 3E)。この持続的な合成は、微生物によるNAMの脱アミド化によって作られたNAの腸への取り込みを反映しており、したがって腸内細菌群の枯渇によってブロックされるだろうと仮定した。実際、FK866を投与すると、抗生物質投与マウスのNAMからのNAD標識が劇的に減少した(図3F)。それにもかかわらず、抗生物質のみで処理したマウスの腸では、NAM依存性合成によるより大きなフラックスを促進するために、潜在的にNamptの発現の増加を介して、NADプールサイズが維持されている(図S3FおよびS3G)。肝臓では、FK866または抗生物質のいずれかでマウスを処理すると、注入したNAMからのNADの標識が減少し、複合処理により静脈内NAMが肝NADに寄与することが完全に阻止された(図S3HおよびS3I)。このように、腸内細菌は、腸と肝臓において、NAMからNADへの代替経路を提供し、サルベージ合成経路を迂回する(図3G)。
ニコチンアミドリボシドは、ニコチン酸への分解および脱アミド化により、組織のNADプールを増加させる
NR は、NAD を増加させる栄養補助食品として広く宣伝され、消費されている。5 完全な NR は、細胞に取り込まれ、エネルギー的に高価な内因性代謝物ホスホリボシルピロリン酸や主要な救済酵素 NAMPT を必要とせずに NAD に変換される。しかし、経口投与されたNRの大部分は、循環および末梢組織に入る前に急速にNAMに分解されることが示されている23,29。さらに、最近、NR経口補給は、腸内微生物が存在しない場合には肝臓および腸組織のNADレベルを高める効果が非常に低く、脱アミド化ルートで取り込まれることと矛盾しないことが示されている21。NAは100倍以上増加し、50μMを超えた(図4A)。NAMも同様の傾向を示したが、持続時間はより長く、ピーク濃度はやや高かった(図4B)。NRの経口投与後に観察されたNAのピークレベルは、血漿脂質とリポタンパク質を低下させるためにNAを治療的に補給しているヒトにおけるレベルと同等であり41,42,43、GPR109A(「ナイアシン受容体」)の活性化に対するEC50を超えるものである44,45,46。
図 サムネイル gr4
図4経口NRは、主にNAへの変換を介して哺乳類組織におけるNAD合成をサポートする
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
NRからのNADおよびNAの生成は、(1)NR→NAD→NAM→NA、(2)NR→NAM→NA→NAD、(3)NR→NAR→NADおよび/またはNAなど、複数の方法で行われる可能性があります。NRは同量のNAMやNAよりも有効であることが報告されており47、また最近経口NMNの代謝は脱アミド化モノヌクレオチドを介して進むことが示唆されていることから48、我々は特に3)の可能性に興味をそそられるようになった。これらの経路を区別するために、NAM部分のアミド基に15N、13C、18O原子を導入し、リボース環の5つの炭素原子を13CとしたM+9アイソトープを合成した(図4C)。脱アミド化によってアミド基から標識窒素が常に除去され、再アミド化によって標識酸素も50%の確率で除去される49。経口投与されたNRはGI管に認められたが、他の末梢組織には認められず、NRが循環に入る前に急速に代謝されることを示していた(図S4A)。肝臓と小腸のNADのごく一部がM+9であり、NRの直接同化が最小限であることが示された(図S4B)。したがって、経路(1)の寄与はわずかである。
ルート (2) と (3) の両方において、NAD のニコチンアミド部分は M+1 と M+3 の混合物として標識されると予想され、脱アミド化種を介した合成が示される。NAまたはNARを経由して合成されることを示す。(3)では元の標識リボース部位が残っているため、M+6とM+8のNADが生成するため、この経路を区別することができる。M+1およびM+3標識NAD分子のみが宿主組織および腸内細菌叢で検出され(図S4B)、NAM/NA部位と標識リボースの分離、すなわち(2)経路での同化が示唆された。また、組織中にはM+1-およびM+3-ラベルのニコチン酸アデニンジヌクレオチド(NAAD)が検出された(図S4C)。脱アミノ化種を介したNR同化の予想通り、抗生物質による腸内細菌叢の枯渇は、血清中のNAMレベルの上昇にもかかわらず、NR由来のNAを完全に排除した(図4DおよびS4D)。同様に、微生物叢の枯渇は、腸内腔および宿主組織中のNAMを増加させる一方で、NAおよびNAADの喪失をもたらした(図S4E〜S4G)。NRの補給は、肝臓、腎臓、腸を含む複数の宿主組織でNADレベルを増加させ、この効果は抗生物質処理マウスで劇的に損なわれた(図4E-4G)。NRのNADへの直接取り込みは抗生物質投与マウスで高かったが、この経路からのNAD合成は、腸内細菌叢がない場合、総NADプールを有意に増加させるほどではなかった。興味深いことに、大腸菌群はNRから生成したNAとリボースリン酸の両方をNAD合成に利用している(図4H)。このように、NRは腸内細菌叢によってNAに異化され、得られたNAは宿主組織でのNAD合成を支えている。
考察
宿主とその腸内細菌は、複雑な共生関係を築くために共進化してきた。微生物が消化機能を拡張し、短鎖脂肪酸などの代謝物を産生することは広く認識されているが、宿主から微生物への代謝物のフラックスは、まだいくつかの例に限られている。また、宿主由来の胆汁酸は微生物によって代謝され、微生物群の増殖を抑制する効果がある54,55,56。いずれの場合も、微生物群による宿主分子の代謝は、たとえそれが相互に有益であっても、日和見的と考えられるかもしれない。本論文では、NAD生合成のための前駆体を共有するという、宿主と腸内細菌との間のユニークな双方向の相互作用について述べる。
また、我々の結果は、食事性NAD前駆体の代謝にも光を当てている。NAD合成のための主要な食物前駆体である食物タンパク質由来のアミノ酸とNAは、上部消化管で容易に吸収されるため、小腸や大腸の遠位部に存在する微生物が利用することはできない。NAMとNAの両方を含まない食事を摂っても、微生物のNA産生量は宿主の循環レベルを維持するのに十分なほど高いままである。水溶性食物繊維(13C-イヌリンでトレース)は、大腸におけるNAD合成の半分弱を占める。宿主由来のNAMは、小腸におけるマイクロバイオームのNAD生合成をほぼ完全に支え、大腸におけるNAD合成の残りの約半分を構成していることが分かった。これらの経路のいずれかで生成された微生物由来のNADは、NAMとNAに変換され、宿主の腸管組織に取り込まれ、Preiss-Handler経路でNADの再生産に利用されることができる。
本研究では、大腸マイクロバイオームがイヌリンをNAD合成のための食事源として利用していることを明らかにした。イヌリンの栄養補給は、ビフィズス菌や乳酸菌などの乳酸菌の増殖を促進する一方で、炎症性細菌のファミリーや属を減少させる57,58。したがって、イヌリン投与マウスにおけるNAD標識に対するマイクロバイオーム構成の影響を排除することはできない。さらに、ペクチン、キシラン、マンナン、ヘミセルロースなど、多様な微生物が利用できる多糖類がげっ歯類やヒトの食事に含まれている。したがって、食物繊維の種類と供給源が、腸内細菌叢がNAD合成に利用する経路に影響を与えるかどうかについては、さらなる研究が必要である。
哺乳類におけるNA依存性NAD合成(Preiss-Handler経路)の相対的重要性を確認することは困難であった。NAMと比較して、NAはほぼ1桁低い濃度で循環しており、回転フラックスも非常に低い。23,45,59 プリスハンドラー経路の律速酵素であるNAPRTは、複数の宿主組織で発現しているが、酵素活性レベルが最も高いのは肝臓と腎臓であり、60 主にこれらの臓器のNAD合成にNAが貢献しているかもしれないということが示唆される。しかし、多くのヒト細胞株では、外来性の NA は容易に NAD に取り込まれ60,61 、一部の腫瘍では NAPRT 遺伝子が増幅され、NAD を主にプリスハンドラー経路に依存する62,63,64。
直接の補給やマイクロバイオームによる NA への変換が可能な代替前駆体の供給など、NA の利用可能性が高まる条件下では、プリス・ハンドラー経路がより定量的に重要になり、他の NA 依存型メカニズムも関与する可能性がある。精製した酵素を NAD とインキュベートすると、NAMPT は阻害されるが65 、NAPRT は阻害されない66 。また、細胞を NA とプレインキュベーションすると NAM 依存性の NAD 合成は阻害されるが、逆はない67 。したがって、NAD レベルは理論的には NAM より NA によって増加させることができる。さらに、薬理学的用量のNAには脂質低下作用があり、一般的な副作用であるフラッシングの原因であるGPR109Aを作動させることができる。この濃度は、ヒトのNA経口摂取後の血漿中NA濃度41,42,43と同等であり、GPR109Aの一過性活性化やDGAT2の阻害に十分であると考えられるが、これまでNRとの関連性は考えられてこなかった作用機序であった。重要なことは、もしNA依存性の機序がマウスにおけるNRの有益な効果に関与しているならば、いくつかの臨床試験で効果が得られなかったことの説明に役立つことである。
我々はまた、NRからNADへの代謝経路を明らかにした。Shatsらと同様に21、我々は、NRのNAD増強効果が微生物による脱アミド化に依存することを見出した。また、複数の異なる原子を標識した NR を用いることで、NR からの NAD 合成が NAR と NA のどちらを経由して行われるかを区別することができた。NAR に依存する経路は魅力的であり、NR が NAD を高めるために NA や NAM よりも効果的であることを説明できる47。しかし、我々のデータは、NR が主に NA を介して NAD に寄与することを決定的に示している。
NAAD は、もともと NAD の脱アミド化から生じることが示唆されていたが、微生物が前駆体を脱アミド化することが発見され、NA から生じることが示唆されるようになった21。
本研究で得られた知見は、今後の研究のためにいくつかの興味深い仮説を提示している。微生物が宿主のNAMに依存していることから、宿主が内腔のNAMの利用可能性を制限することによってマイクロバイオームの組成や機能を調節している可能性がある。さらに、NAMの内腔輸送またはマイクロバイオームのNA産生が、メタボリックシンドロームなどのストレスによって影響を受けるかどうかは不明である72, 73, 74。大腸マイクロバイオームはさらに、NAD合成のために大腸で発酵される複合糖質に依存しているので、砂糖を多く含み食物繊維が少ない加工食品の摂取量が増えると、NAD恒常性に悪い影響を与える可能性がある。このような食事は、マイクロバイオームの構成と代謝活性を乱すことがすでに知られており、宿主における広範な代謝性疾患と関連している。38,77 代謝ストレス条件下で、宿主とマイクロバイオーム間のNAD前駆体の循環が宿主生理とどう相互作用するかを明らかにすることも重要であろう。
結論として、我々は小腸および大腸の微生物叢が NAD 合成に用いる主要な前駆体を決定し、宿主と微生物の間で NAD 前駆体を効果的に共有するビタミン B3 サイクルを同定するに至った。この結果は、宿主または微生物のいずれかでNAD代謝を乱すと、他方のNADホメオスタシスを乱し、生理機能に影響を与える可能性があることを示唆している。
STAR★Methods
主要リソース表
試薬またはリソースのソース IDENTIFIER
化学物質、ペプチド、リコンビナントタンパク質
[2,4,5,6-2H]NAM ケンブリッジアイソトープラボラトリーズ カタログ# DLM-6883
[2,4,5,6-2H]NAケンブリッジアイソトープラボラトリーズ カタログ# DLM-4578
U-13C6-フルクトース ケンブリッジアイソトープラボラトリーズカタログ# CLM-1553
U-13C-イヌリン(チコリ由来) Cambridge Isotope Laboratories; Sigma Aldrich Catalog# CLM-9181; Catalog# 900388
藻類粗タンパク質抽出物-13C Sigma-Aldrich Catalog# 642878
15N,13C6,18O-NR 本紙 N/A
NR エリジウム N/A
FK866 Selleck Chemicals カタログ# S2799
アンピシリン Sigma Aldrich Catalog# A9518
ネオマイシン Sigma Aldrich Catalog# N1876
メトロニダゾール Sigma Aldrich Catalog# M3761
シプロフロキサシン Sigma Aldrich Catalog# 17850
バンコマイシン Mylan Institutional LLC NDC コード 67457-340-01
イミペネム Fresenius Kabi USA, LLC NDC コード 63323-322-25
寄託データ
Metabolomics and isotope tracing raw dataset 本論文 https://massive.ucsd.edu/ProteoSAFe/QueryMSV?id=MSV000090481
Figures1C-1L, 2, 3A-3F, 4, and S1-S4 のソースデータ 本紙データ S1 - ソースデータ
実験モデル 生物/系統
C57BL/6J ジャクソン実験室 Stock No: 000664
C57BL/6J.Nia National Institute on Aging Rodent Colony N/A
C57BL/6 ジャームフリーマウス ペンシルバニア大学 Gnotobiotic Mouse Facility N/A
ソフトウェアおよびアルゴリズム
El-MAVEN ソフトウェア Elucidata https://www.elucidata.io/el-maven
Accucor GitHub https://github.com/XiaoyangSu/AccuCor
その他
実験用げっ歯類飼料 5010 Animal Specialties and Provisions LabDiet Catalog# 0006524
Niacin+ および Niacin- 飼料 Research Diets Modified D11112202
イヌリンおよびタンパク質標識実験用飼料プレミックス Research Diets Modified D22020201 飼料; 標識イヌリン実験:D22020201飼料1Kgあたり50gのイヌリンを50gの標識+非標識イヌリン(1:3 13C:12C)混合物に変更;タンパク質標識実験; D22020201 飼料1Kgあたり50gのイヌリン混合物に変更;D22020201飼料1Kgあたり50gのイヌリン混合物に変更。D22020201の25%カゼインを13C-Algalタンパク質に置換した。
新しいタブで表を開く
利用可能な資源
代表連絡先
リソースや試薬のリクエストや詳細については、主著者のJoseph Baur (baur@pennmedicine.upenn.edu)までお問い合わせください。
利用可能な材料
NR+9 (15N,13C6,18O-NR) は Marie Migaud (mmigaud@southalabama.edu) の研究室で合成され、この研究のために数量が限定されている。
実験モデルおよび被験者の詳細
動物実験は、ペンシルバニア大学およびプリンストン大学の Institutional Animal Care and Use Committee によって承認されたプロトコルに従って実施された。ジャクソン研究所から購入した10-12週齢のC57BL/6J雄マウス(Stock No: 000664)。国立老化研究所齧歯類コロニーから入手した3ヶ月齢の雄C57BL/6J.Niaマウスを、FK866処理による注入試験に使用した。8-12週齢の無菌C57BL/6雄マウスは、ペンシルバニア大学Gnotobiotic Mouse Facilityから入手した。この研究のマウスは、無菌マウスまたは再コロニー化無菌マウスとして明示されている場合を除き、特定病原体フリー(SPF)条件下での従来のマウスである。全てのマウスは、実験に使用する前に動物収容施設で少なくとも2週間馴化させ、chow diet (LabDiet, Laboratory Rodent Diet 5010) と水を自由に摂取させ、12時間の明暗サイクル (7AM- 7PM) で約21℃に維持した。動物施設に収容されたセンチネルマウスは、病原体の感染について定期的にチェックされている。
メソッドの詳細
In vivoにおける食事性タンパク質およびイヌリンのトレーシング
プリンストン大学にて、食餌性タンパク質とイヌリンのトレーシング実験を実施した。13C標識飼料は、藻類からの13C-Crude Protein extract (Sigma-Aldrich, 642878) または13C-Inulin (Sigma-Aldrich, 900388) をプレミックス(通常の飼料からタンパク質、イヌリン、デンプンの含有量を減らして改良した、 Research Diets, D22020201)に加えて調製された。各標識栄養素の最終的な濃縮度は25%で、両標識飼料は同じ栄養素組成(炭水化物63%、タンパク質20%、脂肪7%、イヌリン5%、セルロース2.5%)であった。8週齢の雄C57BL/6NCrlマウス(系統027;Charles River Laboratories)を、まず組成を合わせた非標識食に2週間適応させ、食餌切り替え時のマイクロバイオームの摂動を最小化した。非標識食は、犠牲の24時間前の朝9時に、標識および非標識タンパク質またはイヌリンを混合(1:3)した飼料に置き換えられ、その間、マウスは自由に水を摂取することができるようにされた。食餌標識実験では、まず、各代謝物の同位体ごとのイオンカウントを総イオンカウントで正規化してNAD濃縮度を算出した。次に、NAD中の標識炭素の割合を求め、食餌中の前駆体標識率(25%)で正規化することにより、NADに対するタンパク質またはイヌリンの炭素寄与率を算出した。
フルクトースのインビボトレース
12-14週齢のC57BL/6J雄マウスに、通常生理食塩水に溶解した2g/kg体重のU-13C-Fructose (Cambridge Isotope Laboratories, Tewksbury, MA)を経口投与した。マウスは2時間後に犠牲にし、消化管から組織と管腔内容物を採取した。
経口投与したNAのin vivoトレース
10〜12週齢のC57BL/6J雄マウスに1.96 μmoles of 2,4,5,6-2H-NA (Cambridge Isotope Laboratories, Tewksbury, MA) を口腔内投与した。経口投与量は、飼料中のNA含有量(120 ppm; 0.98 mM)とマウスの平均摂取量(飼料5 g/日)から算出した。投与前、投与30分後、および犠牲時に血液を採取した。管腔内容物および腸管組織は、GI管の指示された部分から採取した。
抗生物質処理
腸内細菌叢を減少させるため、アンピシリン(1 g/L)、バンコマイシン(0.5 g/L)、ネオマイシン(1 g/L)、メトロニダゾール(0.5 g/L)、シプロフロキサシン(0.2 g/L)およびプリモキシン(0.5 g/L)を組み合わせて飲水で3〜5週間投与してから実験に使用した。
NA飼料給与実験
NAを含む、または含まないカスタム飼料をResearch Diets社から購入した。繊維源としてセルロース(BW200)およびイヌリンを使用し、多量栄養素および繊維量は5010 chow dietと一致させた。無菌マウスの飼料として使用したNA飼料は、1.5倍のビタミンとミネラル酸カゼインを使用し、2回のガンマ線照射を行ったものである。14週齢のC57BL/6J雄マウスをSPF条件下で飼育し、NAを含む飼料または含まない飼料を与え、通常の飲料水または抗生物質カクテル入り飲料水を5週間摂取させた。無菌マウスと従来型マウスには、二重照射した飼料を2週間与えた。
無菌マウスのコロニー形成
無菌マウス(Ex-GF)のコロニー形成は、組織採取前に18日間、各ケージに2匹の成熟無菌マウスと1匹の特別病原体フリー(SPF)マウスを同居させた。
同位体標識したNAMのin vivoトレース
2,4,5,6-2H-NAMをCambridge Isotope Laboratories (Tewksbury, MA)から購入した。NAMトレーサーはPBS(眼窩後注射)または通常の生理食塩水(静脈内注入)に溶解させた。C57BL/6J雄マウスに、100μL容量の0.2〜5μモルの2,4,5,6-2H-NAMを眼窩後部注射し、図の説明文に示したように注射後15分または2時間のいずれかで尾静脈から血液サンプルを収集し、門脈と肝静脈から血液サンプルを収集するためにマウスを麻酔した。マウスは直ちに頸椎脱臼により安楽死させ、組織を採取し、液体窒素中でクランプした。
静脈内注入は、マウスを右頸静脈に外科的にカテーテルを留置し、1週間以内に注入を行った。NAMトレーサーの注入は、以前に記述したように行った23,40。簡単に言えば、4 mM 2,4,5,6-2H-NAM トレーサーを、図の説明で示したように異なる期間、0.2 nmol/g体重/minの一定の速度で頸静脈カテーテルから注入した。尾静脈からマイクロベット採血管(Sarstedt, Cat. # 16.440.100)を用いて約20μLの血液試料を採取した。注入期間の終了時に、マウスを頸椎脱臼により安楽死させ、組織を迅速に解剖し、液体窒素中でクランプした。
FK866処理
C57BL6/J雄マウスに通常の飲料水を与えるか、抗生物質カクテルで4週間前処理し、腸内細菌叢を枯渇させた。C57BL6/JまたはC57BL/6J.Niaマウスに、ビヒクル(45% Propylene glycol, 5% Tween 80, 50% water)または50 mg/kg FK866(Selleck Chemicals, Houston, Tx)を1回(5時間NAM注入)または8時間間隔で3回注入した(23時間NAM注入)。NAMの注入は、最初のFK866投与の1時間後に開始し、5時間後または23時間後にマウスを犠牲にした。
M+9 NRの合成
スキーム1:シリル化M+4 NAMの合成
図 サムネイル fx2
大きな画像を見るダウンロード 高解像度画像
スキーム2. シリル化されたM+9ニコチンアミドリボシドの合成
図 サムネイル fx3
大きな画像を見る 高解像度画像を見る
[A] 13C、18O、15N標識M+4ニコチンアミドの合成(3、Scheme 1)。化合物 (3) を既報の手順で調製した21。
[B] シリル化 M+4 NAM の合成 (4, Scheme 1): 13C, 18O および 15N 標識 M+4 NAM (0.40 g; 0.032 mol), HMDS (9.00 mL) および TMSCl (0.81 mL, 0.70 g, 0.0064 mol) の混合物を 105℃(オイルバス温度)において 20 時間加熱した。完了後、反応混合物を室温まで冷却し、無色透明の溶液をアルゴン下で25mL丸底一口フラスコにカニューレを通して移し、ロータリーエバポレーターで乾固し、その後高真空下で乾燥して、白い結晶性の生成物(0.623 g、100%)を与えた。
[C]1,2,3,5-テトラ-O-アセチル-α/β-D-[13C5]リボフラノシド([13C5]RTA,6,Scheme 2)の合成。化合物 (6) は、報告されている手順に従って調製した78。
[D] M+9 NR の合成の一般的手順.
M+9 NR 2,3,5-triacetate の合成 (Vorbruggen glycosylation, 化合物 7, Step-1)
アルゴン雰囲気下の火炎乾燥フラスコに、M+4 シリル化 NAM (0.37 g, 0.00187 mol, 1eqv) および M+5 ,13C 標識 -d-ribose tetraacetate (0.664 g, 0.00206 mol, 1.1 eqv) を乾燥 1,2-dichloroethane (12 mL) に添加した。rt で 5 分間撹拌した後、TMSOTf (0.40 mL, 0.00224 mol, 1.2 eqv) を同温度で撹拌している 1,2-dichloroethane 溶液に添加した。ここで、得られた混合物を40℃で出発物質が完全に消失するまで攪拌した。反応の進行は、粗混合物の1H NMR分析によってモニターした。完成後,得られた溶液を濃縮し,黄色い油状の粗生成物を精製せずにそのまま次のステップに使用した。
M+9 NRの合成(脱エステル化、化合物8、ステップ-4、)。
セプタムで閉じ、排気し、アルゴンで満たした圧力管に、[13C,18O,15N]-NRTA -OTf (1.14 g, 0.00187 mol, 1eqv) を無水メタノール (30 mL) に溶解させた。溶液を撹拌しながら-78 ℃まで冷却し、アンモニアガス(NaOH を満たしたチューブを通過)を長い金属針を通して溶液にバブリングし、ca. 5 分間。さらに、反応溶液を-78℃で10分間撹拌し、その後、セプタムを除去し、直ちにネジ付きPTFEキャップでチューブを閉じ、フリーザー(-20℃)に移し、-20℃で6日間保持した。圧力チューブを氷浴に移し、カニューレを用いて、同じ氷浴で0℃に冷却した回収フラスコにチューブの内容物を移した。回収フラスコをロータリーエバポレーターに取り付け、外部からの加熱や水浴への浸漬を行わずにアンモニアガスを蒸発させ、溶液温度を0℃以下に連続的に維持させた。アンモニアを除去した後、残留メタノールを約25℃で除去し、油状の残留物を高真空下で保持し、粘性の黄色い液体(1.0 g)を得た。1H NMRデータによると、生成物はアセトアミド、メタノールおよびM+4 Namの2.9%の混合物で含まれていた。1H NMR (400 MHz, D2O, δ, ppm): 9.53 (s, 1H, Ar-H), 9.20 (s, 1H, Ar-H), 8.93-8.91 (m, 1H, Ar-H), 8.23-8.91 (m, 1H, Ar-H), 8.23-8. 19 (m, 1H, Ar-H), 6.18 (d, J = 177 Hz, 1H, H-1), 4.66-3.99 (m, 3H, H-2, H-4&H-3), 3.82-3.79 (m, 1H, H-5a), 3.29-3.29 (m, 1H, H-5a), 3.29-3.29 (m, 1H, H-5a), 3.29-3.29 (m, 1H, Ar-H) 28-3.27 (m, 1H, H-5b); 13C NMR (100 MHz; D2O,δ, ppm): 170.60 (d, J = 17.5 Hz, CO), 165.69 (d, J = 18.7 Hz, CH3CONH2), 145.62 (d, J = 1.18 Hz, C-6NAM), 142.60 (C-2NAM), 140.34 (C-4NAM), 133.40 (d, J = 56.8 Hz, C-3NAM). 128.33 (d, J = 3.29 Hz, C-5NAM), 99.91 (dd, J = 40.02 Hz &3.08 Hz, C-1ribose), 87.67 (t, J = 39.9 Hz, C-4ribose), 77.67 (t, J = 39.9 Hz, C-5NAM). 42 (t, J = 38.32 Hz, C-2ribose), 69.75 (t, J = 36.19 Hz, C-3ribose), 60.17 (d, J = 41.06 Hz, C-5ribose); 19F NMR (377MHz, D2O) δF: -78.82 (s); HRMS calcd for 13C6 12C5H15 15N14N18O16O4 [M]+ 264.1189found 264.1194.
NR経口ガベージ
マウスに非標識NRとカスタム合成したM+9 NRを1:2.6の割合でPBSに混合したものを経口投与した(600 mg/kg 体重)。血液サンプルは異なる時点で採取した。経口投与の3時間後、マウスを麻酔して肝静脈および尾静脈から血液サンプルを採取し、頸部脱臼により犠牲にして組織を採取した。トレーサーが非標識分子で希釈された場合、その比率を質量分析で確認し、目的の代謝物に対する投与分子の寄与の合計を補正するために使用した。この方法は、あらゆる単一分子の追跡には正確であると期待されるが、標識リボースとNAMまたはNAから腸管内腔で標識NRまたはNARが再生するような、偶然に一緒になった2つの標識分子の頻度を過小評価する可能性がある。
血清および組織サンプルからの代謝物抽出
血清サンプルは、代謝物抽出前にウェットアイスで解凍しました。血清5ulに100%メタノール50ulを加え、ボルテックスしてドライアイス上で10分間インキュベートし、16000gで20分間遠心分離した後、血清抽出物40ulに水10ulを加え、LC-MS分析に使用した。凍結組織を秤量し、乳鉢と乳棒またはクライオミル(Retsch社製)で液体窒素を用いて粉砕した。凍結粉砕した組織を40:40:20アセトニトリル:メタノール:水(25mg組織/ml抽出バッファ)で抽出し、ボルテックスし、氷上で10分間インキュベートした。その後、組織サンプルを16,000 gで30分間遠心分離した。組織上清を新しいエッペンドルフチューブに移し、再度16,000 gで30分間遠心分離して残留する残渣を除去してからLC-MS分析を行った。
代謝物測定
抽出物は、質量分析計結合液体クロマトグラフィー(LC-MS)により36時間以内に分析された。LC-MS 法は、以前に報告されたように、Q Exactive PLUS 質量分析計 (Thermo Scientific) に結合した親水性相互作用クロマトグラフィー (HILIC) を用いた。79 LC 分離は XBridge BEH Amide カラム (150 mm 3 2.1 mm、粒子径 2.5 mm、 Waters, Milford, MA) で実施された。溶媒Aは95%。5%H2O:アセトニトリルに20 mM重炭酸アンモニウムを加えたもので、溶媒Bはアセトニトリルです。グラジエントは、0分、90%B、2分、90%B、3分、75%、7分、75%B、8分、70%、9分、70%B、10分、50%B、12分、50%B、13分、25%B、14分、25%B、16分、0%、20.5分、0%、21分、90%B、25分、90%B。その他のLCパラメータ:流量150μL/min、カラム温度25℃、注入量10 μL、オートサンプラー温度は5℃であった。質量分析計は、代謝物の検出のため、マイナスイオンとプラスイオンの両モードで動作させました。その他のMSパラメータは、m/z 200での分解能14万、自動ゲインコントロール(AGC)ターゲット3e6、最大注入時間200ms、スキャン範囲m/z 75-1000です。
ニコチン酸の検出
ニコチン酸の検出は、同じLCバッファとカラムを用い、流速300μL/minで異なるグラジエント:0 min, 90% B; 2 min, 90% B; 5 min, 0 %B; 8 min, 0% B; 9 min, 90% B; 13 min, 90% Bで13分間のメソッドを用いて行いました。
非標識および標識NADのMS/MS
PRM機能を用いて、m/z 664.1, 669.1, 674.1、NCE 20%の親イオンでターゲットMS/MSを実施。その他のパラメータは、分解能17500、AGCターゲット5e5、最大注入時間200ms、アイソレーションウィンドウ1.5m/z。LC条件は、水溶性代謝物に対する上記25分法と同じとした。
LC/MS 生データは、コマンドライン "msconvert" ユーティリティを使用して mzXML 形式に変換しました。80 データは MAVEN ソフトウェアにより、真正標準物質から確立した社内代謝物ライブラリーを使用して解析されました。同位体標識パターンは、AccuCor を使用して天然の 13C 存在量に対して補正されました81 。抽出バッファー中の NA、NAM、NAD の標準曲線を実行して、イオンカウントが調査範囲にわたって濃度に対して直線的に変化することを確認し、代謝物の絶対濃度を計算しました。
定量および統計解析
統計解析
統計解析は、Graphpad Prism 9 for macOS version 9.4.1 (Graphpad Software, San Diego, California USA) を用いて実施しました。特に断りのない限り、データは平均値±SEMで表示した。個々の図に対する統計的有意性は、図の凡例に記載されている。3つ以上のグループの比較には、一元配置または二元配置のANOVAとTukeyのポストホックテストを使用した。スチューデントのt-testは2群間比較、または名目上の有意性を判断するために使用された。図中のアスタリスクは統計的有意性を示す(p < 0.05; **, p < 0.01; **, p < 0.001)。この原稿で示されたデータの正規分布を検定するための統計的アプローチは採用されていない。
データおよびコードの入手方法
グラフのソースデータはData S1に含まれています。メタボロミクスデータはすべて MassIVE (Mass Spectrometry Interactive Virtual Environment) に寄託されており、論文発表時点で公開されています。メタボロミクスデータのアクセッション番号、データ解析および炭素補正に使用したソフトウェアとコードを主要リソース表に記載しました。
本論文で報告されたデータの再解析に必要な追加情報は、リクエストに応じて主担当者から提供されます。
謝辞
この研究は、K.C.のCrohn's and Colitis Career Development Award、Howard Hughes Medical InstituteとBurroughs Wellcome FundのPDEPとHanna H. Gray Fellow ProgramによるM.R.M.、NIHグラントCA211437とDP1DK113643とD.R. J., D. J.に資金援助とサポートを受けた。また、Penn Diabetes Research CenterのRegional Metabolomics and Fluxomics CoreおよびRodent Metabolic Phenotyping Core P30-DK19525 and S10-OD025098、CINJ Cancer Center Support Grant、Rutgers Cancer Institute of New Jersey Metabolomics Shared Resourceの支援(一部はNCI-CCSG P30CA072720-5923 による支援)に感謝している。
著者の貢献
K.C.、M.R.M.、J.D.R.、J.A.B.はプロジェクトの構想および設計を行った。K.C.とM.R.M.はほとんどの実験を実施し、分析した。W.L., X.Z., Y.R.B., S.R.L., H.C.D., T.C., L.J., C.J. は特定の in vivo 実験および解析を行った。M.M., F.H., M.E.M. は、M+9 NR の設計と合成を行った。K.C.とJ.A.B.は、全著者の意見を取り入れて原稿を執筆した。
利害関係者の宣言
J.D.R.はファイザー社のコンサルタントであり、コロラド・リサーチ・パートナーズ社、L.E.A.F.社、ラファエル社、Raze Therapeutics、Kadmon Pharmaceuticals、Agios Pharmaceuticalsのアドバイザーおよび株式所有者である。J.D.R.は、プリンストン大学が特許を取得したSHIN2および関連するSHMT阻害剤の共同発明者であり、Toran Therapeuticsの共同設立者でもあります。J.A.B.はファイザーとサイトキネティックスのコンサルタントで、肝障害におけるNAD前駆体の使用に関する特許の発明者であり、NAD前駆体に関心を持つエリジウムヘルスとメトロインターナショナルバイオテックから研究資金と資料を受け取っている。
インクルージョンと多様性
本論文の著者のうち1名以上が、研究分野または地理的に代表されない少数民族であることを自認している。本論文の著者のうち1名以上が、研究分野において性別によるマイノリティであることを自認している。本論文の著者のうち1名以上が、LGBTQIA+コミュニティのメンバーであることを自認している。本論文の著者のうち1名以上が、研究分野におけるマイノリティ代表の増加を目的としたプログラムからの支援を受けている。
補足情報
pdfをダウンロード(0.19 MB)
pdfファイルに関するヘルプ
資料S1. 図 S1-S4
.xlsxのダウンロード (.27 MB)
xlsx ファイルに関するヘルプ
データS1. 図 1C-1L、2、3A-3F、4、および S1-S4 の作成に使用したデータ
参考文献
Cantó C.
Houtkooper R.H.
Pirinen E.
Youn D.Y.
Oosterveer M.H.
セン・イー.
フェルナンデス・マルコス P.J.
山本 浩二
アンドリューP.A.
セトゥール-ローズP.
他
NAD(+)前駆体ニコチンアミドリボシドは酸化的代謝を促進し、高脂肪食誘発性肥満から保護する。
Cell Metab. 2012; 15: 838-847
https://doi.org/10.1016/j.cmet.2012.04.022
記事で見る
スコープス (746)
パブコメ
概要
全文
全文PDF
Google Scholar
ガーデル S.J.
ホップM.
カーン A.
ディスパーニャ M.
ハンプトン・セッションズE.
ファルター R.
カプール N.
ブルックス J.
カルバー J.
ペチュッチ C.
他。
NAMPTを活性化する低分子化合物でNAD(+)をブーストする。
Nat. Commun. 2019; 10: 3241
https://doi.org/10.1038/s41467-019-11078-z
記事で見る
スコープス(55)
パブコメ
クロスレフ
グーグル奨学生
ムコパディヤイP.
ホルヴァートB.
ラジェッシュ M.
ヴァルガ Z.V.
ガリアーニ K.
リュウ D.
Cao Z.
ホロバク E.
パーク O.
Zhou Z.
他。
PARP 阻害はアルコール性および非アルコール性脂肪性肝炎を予防する。
J. Hepatol. 2017; 66: 589-600
https://doi.org/10.1016/j.jhep.2016.10.023
記事で見る
スコープス (92)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
タラゴ M.G.
チニC.C.S.
金森健一
ワーナー G.M.
カライド A.
デ・オリベイラG.C.
ルド M.
サマニA.
ハイン・K.Z.
ホァン R.
他。
強力かつ特異的なCD38阻害剤は、組織NAD(+)の減少を逆転させることにより、加齢に伴う代謝機能不全を改善させる。
Cell Metab. 2018; 27: 1081-1095.e10
https://doi.org/10.1016/j.cmet.2018.03.016
記事で見る
スコープス(151)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
吉野 淳
バウアJ.A.
今井慎一郎
NAD(+)中間体:NMNとNRの生物学と治療の可能性.
Cell Metab. 2018; 27: 513-528
https://doi.org/10.1016/j.cmet.2017.11.002
記事で見る
スコープス (370)
パブコメ
アブストラクト
全文
全文PDF
Google Scholar
吉野淳一
ミルズK.F.
ユン M.J.
今井誠一
ニコチンアミドモノヌクレオチド、重要なNAD(+)中間体は、マウスのダイエットと年齢誘導糖尿病の病態生理を治療する。
Cell Metab. 2011; 14: 528-536
https://doi.org/10.1016/j.cmet.2011.08.014
記事で見る
スコープス (778)
パブコメ
概要
全文
全文PDF
Google Scholar
ピリネン E.
アウラネンM.
カーンN.A.
Brilhante V.
ウルホ N.
ペシア A.
ハッカライネン A.
ウラ・ハイノネン J.K.
シュミットM.S.
ハイミラハティ K.
他。
ナイアシンは、成人発症のミトコンドリアミオパチーにおける全身性NAD(+)欠乏を治癒し、筋パフォーマンスを向上させる。
Cell Metab. 2020; 32: 144
https://doi.org/10.1016/j.cmet.2020.05.020
記事で見る
スコープス (6)
パブコメ
概要
全文
全文PDF
Google Scholar
吉野正人
吉野 淳
カイザーB.D.
パティG.J.
フランチク M.P.
ミルズ K.F.
シンデラーM.
ピエトカ T.
パターソン B.W.
今井 聡一
クラインS.
ニコチンアミドモノヌクレオチドは糖尿病前女性における筋肉のインスリン感受性を増加させる。
Science. 2021; 372: 1224-1229
https://doi.org/10.1126/science.abe9985
記事で見る
スコープス(75)
PubMed
クロスリファレンス
グーグル奨学生
ドレルプO.L.
クリステンセンB.
スヴァートM.
シュミットM.S.
スレック K.
リングガード S.
ストゥディキルデ・ヨルゲンセン H.
モーラー N.
ブレンナー C.
トゥリーバク J.T.
Jessen N.
肥満男性におけるニコチンアミドリボシドの無作為プラセボ対照臨床試験:安全性,インスリン感受性,脂質流動化効果.
Am. J. Clin. Nutr. 2018; 108: 343-353
https://doi.org/10.1093/ajcn/nqy132
記事で見る
スコープス (131)
PubMed
クロスリファレンス
グーグル奨学生
エルハッサンY.S.
クルッコヴァK.
フレッチャー R.S.
シュミットM.S.
ガルテン A.
ドイグ C.L.
カートライトD.M.
オーキー L.
バーリーC.V.
ジェンキンソンN.
他。
ニコチンアミドリボシドは、老化したヒト骨格筋のNAD(+)メタボロームを増強し、トランスクリプトームおよび抗炎症シグネチャーを誘導します。
セル・リップ(Cell Rep.) 2019; 28: 1717-1728.e6
https://doi.org/10.1016/j.celrep.2019.07.043
記事で見る
スコープス(150)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
レミー C.M.E.
ルーマンス K.H.M.
ムーネン M.P.B.
コーネル N.J.
ハベックスB.
メーヴェンカンプ J.
リンデブームL.
デ・ウィット V.H.W.
ファン・デ・ウェイジャー T.
Aarts S.A.B.M.
他
ニコチンアミドリボシドの補給は、健康な肥満のヒトの身体組成と骨格筋のアセチルカルニチン濃度を変化させる。
Am. J. Clin. Nutr. 2020; 112: 413-426
https://doi.org/10.1093/ajcn/nqaa072
記事で見る
スコープス (48)
PubMed
クロスリファレンス
グーグル奨学生
デサイ M.S.
シーカッツA.M.
コロパトキンN.M.
鎌田直樹
ヒッキーC.A.
ウォルター・M.
プードロN.A.
北本誠一
テラポンN.
ミュラーA.
他。
食物繊維を欠く腸内細菌叢は、大腸粘液バリアを劣化させ、病原体感受性を高める。
Cell. 2016; 167: 1339-1353.e21
https://doi.org/10.1016/j.cell.2016.10.043
記事で見る
スコープス (1233)
PubMed
概要
全文
全文PDF
Google Scholar
マーテンス E.C.
チェン H.C.
ゴードン J.I.
粘膜糖鎖採食により、糖質分解ヒト腸内細菌共生体のフィットネスとトランスミッションが促進される。
Cell Host Microbe. 2008; 4: 447-457
https://doi.org/10.1016/j.chom.2008.09.007
記事で見る
スコープス (542)
パブコメ
概要
全文
全文PDF
Google Scholar
ピカード J.M.
モーリスC.F.
キネブリューM.A.
アブトM.C.
シェンテンD.
ゴロフキナT.V.
ボガティレフ S.R.
イスマジロフR.F.
パマー E.G.
ターンボーP.J.
チェルヴォンスキー A.V.
腸管上皮の迅速なフコシル化により、病気における宿主-共役共生が維持される。
Nature. 2014; 514: 638-641
https://doi.org/10.1038/nature13823
記事で見る
スコープス (351)
PubMed
クロスリファレンス
グーグル奨学生
サイヤ人 A.A.
バーセロッティJ.R.
ウエストS.E.
ウィルキンス T.D.
ヒト大腸由来Bacteroides属細菌によるムチンおよび植物多糖類の発酵。
Appl. Environ. Microbiol. 1977; 33: 319-322
https://doi.org/10.1128/aem.33.2.319-322.1977
記事で見る
スクープ (447)
PubMed
クロスリファレンス
グーグル奨学生
ソマー F.
Bäckhed F.
腸内細菌叢-宿主の発生と生理のマスター。
Nat. Rev. Microbiol. 2013; 11: 227-238
https://doi.org/10.1038/nrmicro2974
記事で見る
スコープス (2029)
PubMed
クロスリファレンス
グーグル奨学生
ソネンブルグE.D.
ソネンバーグJ.L.
私たちの微生物自身を飢えさせる:微生物がアクセスできる炭水化物の欠乏した食事の有害な結果。
Cell Metab. 2014; 20: 779-786
https://doi.org/10.1016/j.cmet.2014.07.003
記事で見る
スコープス(412)
パブコメ
概要
全文
全文PDF
Google Scholar
ソネンブルグ J.L.
Xu J.
ライプD.D.
チェン C.H.
ウェストオーバー B.P.
ウェザーフォード J.
ビューラーJ.D.
ゴードン J.I.
腸内共生細菌による生体内での糖鎖採餌活動
Science. 2005; 307: 1955-1959
https://doi.org/10.1126/science.1109051
記事で見る
スコープス (814)
パブコメ
クロスリファレンス
グーグル奨学生
ドノホーD.R.
ガージN.
ザン X.
サン W.
オコネル・T.M.
バンガー M.K.
Bultman S.J.
哺乳類大腸におけるマイクロバイオームと酪酸によるエネルギー代謝とオートファジーの制御。
Cell Metab. 2011; 13: 517-526
https://doi.org/10.1016/j.cmet.2011.02.018
記事で見る
スコープス (1035)
パブコメ
概要
全文
全文PDF
Google Scholar
Bäckhed F.
マンチェスターJ.K.
セメンコビッチC.F.
ゴードン J.I.
無菌マウスにおける食事誘発性肥満に対する抵抗性の基礎となるメカニズム。
Proc. Natl. Acad. Sci. USA. 2007; 104: 979-984
https://doi.org/10.1073/pnas.0605374104
記事で見る
スコープス (1889)
PubMed
クロスリファレンス
グーグル奨学生
シャッツ I.
ウィリアムズJ.G.
リュー J.
マカロフ M.V.
ウー X.
リー F.B.
デターディング・L.J.
リム C.
シュウ X.
ランダル T.A.
他。
バクテリアは、デアミド化生合成経路に関与することにより、哺乳類宿主のNAD代謝を促進する。
Cell Metab. 2020; 31: 564-579.e7
https://doi.org/10.1016/j.cmet.2020.02.001
記事で見る
Scopus (71)
PubMed
概要
全文
全文PDF
Google Scholar
ビエガノフスキー P.
ブレンナー C.
ニコチンアミドリボシドを栄養素とし、保存されたNRK遺伝子の発見により、菌類とヒトにおけるNAD+へのプリスハンドラーに依存しない経路が確立された。
Cell. 2004; 117: 495-502
https://doi.org/10.1016/s0092-8674(04)00416-7
記事で見る
スコープス (0)
パブコメ
概要
全文
全文PDF
Google Scholar
Liu L.
スー X.
クイン3rd、W.J.
ホイ S.
クルーケンバーグ K.
フレデリック・D.W.
レッドパス・P.
ザン L.
チェラッパ・K.
ホワイトE.
他。
NAD合成-分解フラックスの定量的解析。
Cell Metab. 2018; 27: 1067-1080.e5
https://doi.org/10.1016/j.cmet.2018.03.018
記事で見る
スコープス(222)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ミンハス P.S.
リュー・エルー
ムーンP.K.
ジョシ A.U.
ダブ C.
マートレ S.
コントルポワ K.
ワン Q.
リーB.A.
コロナド M.
他。
マクロファージのデノボNAD(+)合成は、老化と炎症における免疫機能を規定する。
Nat. Immunol. 2019; 20: 50-63
https://doi.org/10.1038/s41590-018-0255-3
記事で見る
スコープス (183)
PubMed
クロスリファレンス
グーグル奨学生
張 J.
タオ J.
Ling Y.
Li F.
Zhu X.
Xu L.
Wang M.
張 聡
マッコール C.E.
Liu T.F.
NADサルベージからデノボ生合成への切り替えが、SIRT1-RelB依存的な炎症耐性を維持する。
フロント。Immunol. 2019; 10: 2358
https://doi.org/10.3389/fimmu.2019.02358
記事で見る
スコープス(18)
クロスリファレンス
グーグル・スカラー
ジルー・ゲルベタント J.
ジョフロー M.
ジネル M.P.
セルシルーA.
バルトバ S.
マカロフ M.V.
サパタ=ペレス R.
サンチェス-ガルシア J.L.氏
ハウトクーパーR.H.
ミゴーM.E.
他
ニコチンアミドリボシドの還元型は、NAD(+)生合成のための新しい経路を定義し、経口生物学的なNAD(+)前駆体として機能する。
Mol. Metab. 2019; 30: 192-202
https://doi.org/10.1016/j.molmet.2019.09.013
記事で見る
スコープス (58)
PubMed
クロスレフ
グーグル奨学生
ヤン・ヤン
Zhang N.
Zhang G.
ソーブA.A.
NRHのサルベージとNAD(+)への変換には、アデノシンキナーゼによるNRHキナーゼ活性が必要である。
Nat. Metab. 2020; 2: 364-379
https://doi.org/10.1038/s42255-020-0194-9
記事で見る
スコープス (34)
PubMed
クロスリファレンス
グーグル奨学生
サパタ-ペレスR.
タマーロA.
ショメーカーズB.V.
スカントレベリーA.M.L.
デニス・S
エルフリンクH.L.
ジロー・ゲルベタント J.
カントー C.
ロペス-レオナルドC.
マッキンタイアR.L.
他
還元型ニコチンアミドモノヌクレオチドは、哺乳類細胞およびマウスにおける新規かつ強力なNAD(+)前駆体である。
FASEB J. 2021; 35: e21456
https://doi.org/10.1096/fj.202001826R
記事で見る
スコープス(24)
Crossref
Google Scholar
フレデリック D.W.
ロロ E.
リュー L.
ダビラJr.A.
チェラッパ・K.
シルバーマン I.M.
クイン3rd, W.J.
ゴザイ S.J.
ティッチー E.D.
デイビスJ.G.
他
NADのホメオスタシスの喪失は骨格筋の進行性かつ可逆的な変性をもたらす。
Cell Metab. 2016; 24: 269-282
https://doi.org/10.1016/j.cmet.2016.07.005
記事で見る
スコープス (199)
パブコメ
概要
全文
全文PDF
Google Scholar
ベレンキー P.
ラセットF.G.
ボーガン K.L.
マクルアJ.M.
スミス J.S.
Brenner C.
ニコチンアミドリボシドはNrkとUrh1/Pnp1/Meu1経路を介してSir2サイレンシングを促進し、NAD+に寿命延長をもたらす。
Cell. 2007; 129: 473-484
https://doi.org/10.1016/j.cell.2007.03.024
記事で見る
スコープス (303)
パブコメ
概要
全文
全文PDF
グーグルスカラー
マグヌスドッティル S.
ラヴチェフD.
ド・クレシー・ラガードV.
ティーレ I.
B-ビタミン生合成の系統的なゲノム評価は、腸内微生物の間の協力を示唆している。
フロント。Genet. 2015; 6: 148
https://doi.org/10.3389/fgene.2015.00148
記事で見る
スコープス (344)
PubMed
クロスリファレンス
グーグル奨学生
クルナソフO.
ゴラルV.
コラブロイK.
ゲルデスS.
アナンタS.
オスターマンA.
ベグリー T.P.
NAD生合成:バクテリアにおけるトリプトファンからキノリネートへの経路の同定。
Chem. バイオロジー 2003; 10: 1195-1204
https://doi.org/10.1016/j.chembiol.2003.11.011
記事で見る
Scopus (146)
パブコメ
概要
全文
全文PDF
Google Scholar
ボックボルト M.
ホーリーD.
ニエールM.
ゴスマンT.I.
ライナルツ I.
シュグ A.
ツィーグラー M.
ハイランド I.
NAD依存性シグナリングの進化的および動力学的ドライバーの同定。
Proc. Natl. Acad. Sci. USA. 2019; 116: 15957-15966
https://doi.org/10.1073/pnas.1902346116
記事で見る
スコープス (30)
PubMed
クロスリファレンス
グーグル奨学生
ガザニガF.
ステビンズR.
チャン・S.Z.
マクピーク M.A.
ブレンナー C.
微生物のNAD代謝:比較ゲノム学からの教訓。
Microbiol. Mol. Biol. Rev. 2009; 73: 529-541
https://doi.org/10.1128/MMBR.00042-08
記事で見る
スコープス (141)
パブコメ
クロスリファレンス
グーグル奨学生
Kaur A.
ローズD.J.
ルンパガポーンP.
パターソンJ.A.
ハマカー B.R.
ゆっくり発酵する」食物繊維を用いたin vitroバッチ式糞便発酵によるガスおよび短鎖脂肪酸産生の比較。
J. Food Sci. 2011; 76: H137-H142
https://doi.org/10.1111/j.1750-3841.2011.02172.x
記事で見る
スコープス (92)
PubMed
クロスリファレンス
グーグル奨学生
ペリゾンM.A.
Ricci M.R.
食事誘発性代謝疾患研究における不適切な対照食の一般的な使用は、データの解釈を混乱させる:食物繊維の要因。
Nutr. Metab. 2018; 15: 3
https://doi.org/10.1186/s12986-018-0243-5
記事で見る
スコープス(69)
クロスリファレンス
グーグルスカラー
ファン デル ヒー B.
ウェルズJ.M.
短鎖脂肪酸による宿主生理の微生物制御。
Trends Microbiol. 2021; 29: 700-712
https://doi.org/10.1016/j.tim.2021.02.001
記事で見る
スコープス(139)
パブコメ
概要
全文
全文PDF
Google Scholar
Jang C.
Hui S.
Lu W.
コーワン A.J.
モルシャーR.J.
リーG.
リウ・W.
テスツ G.J.
バーンバウム M.J.
ラビノウィッツJ.D.
小腸は食餌性フルクトースをグルコースと有機酸に変換する。
Cell Metab. 2018; 27: 351-361.e3
https://doi.org/10.1016/j.cmet.2017.12.016
記事で見る
スコープス (290)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ヘンダーソン L.M.
グロスC.J.
灌流ラット腸管におけるナイアシンおよびナイアシンアミドの代謝.
J. Nutr. 1979; 109: 654-662
https://doi.org/10.1093/jn/109.4.654
記事で見る
スコープス (17)
PubMed
クロスリファレンス
グーグル奨学生
マクレイノルズ M.R.
チェラッパK.
チャイルズE.
ヤンコウスキー C.
シェン Y.
チェン・L.
デスカンプ H.C.
ムカルジー S.
バット Y.R.
リンガラS.R.
他。
加齢マウスでは、組織内濃度が低下してもNAD(+)フラックスは維持される。
Cell Syst. 2021; 12: 1160-1172.e4
https://doi.org/10.1016/j.cels.2021.09.001
記事で見る
スコープス (15)
パブコメ
概要
全文
全文PDF
Google Scholar
カールソン L.A.
オーロL.
OstmanのJ。
高リポタンパク質血症患者における血漿脂質に対するニコチン酸の単回投与の効果。
アクタメッド。Scand。1968; 183: 457-465
https://doi.org/10.1111/j.0954-6820.1968.tb10508.x
記事で見る
スコープス (78)
PubMed
クロスリファレンス
グーグル奨学生
メノンR.
トルバートD.
セファリE.
徐放性ナイアシンおよびロバスタチン合剤と徐放性ナイアシン錠、ロバスタチン錠、徐放性ナイアシン錠およびロバスタチン錠の組み合わせとのバイオアベイラビリティの比較。
Biopharm. Drug Dispos. 2007; 28: 297-306
https://doi.org/10.1002/bdd.555
記事で見る
スコープス (12)
クロスリファレンス
Google Scholar
ライヒ I.
ウェストファルS.
マルテンス-ローベンホッファーJ.
トリューガー U.
ルーレイ C.
Bode-Böger S.M.
慢性腎臓病および透析患者におけるニアスパン(R)の薬物動態と投与量の推奨。
Nephrol. Dial. Transplant. 2011; 26: 276-282
https://doi.org/10.1093/ndt/gfq344
記事で見る
スコープス (12)
PubMed
クロスリファレンス
グーグル奨学生
曽我 崇
鴨原正彦
高崎順子
松本 聡一
齋藤徹
大石利彦
檜山秀樹
松尾亜弥
松島弘子
古市憲寿
ニコチン酸受容体の分子生物学的同定.
生物化学.Biophys. Res. Commun. 2003; 303: 364-369
https://doi.org/10.1016/s0006-291x(03)00342-5
記事で見る
スクープ (0)
パブコメ
クロスリファレンス
グーグル奨学生
トゥナル S.
ケロJ.
シャウプA.
Wufka C.
ブラウカット A.
プフェッファー K.
オッフェルマンズ S.
PUMA-GとHM74はニコチン酸の受容体であり、その抗リポリン効果を媒介する。
Nat. Med. 2003; 9: 352-355
https://doi.org/10.1038/nm824
記事で見る
スクープ (652)
PubMed
クロスリファレンス
グーグル奨学生
ワイズA.
フォードS.M.
フレイザーN.J.
バーンズA.A.
エルシュアバギーN.
アイラートM.
イグナーD.M.
マードックP.R.
ステプレフスキー K.
グリーンA.
他。
ニコチン酸に対する高および低親和性受容体の分子生物学的同定。
J. Biol. Chem. 2003; 278: 9869-9874
https://doi.org/10.1074/jbc.M210695200
記事で見る
スコープス (456)
パブコメ
概要
全文
全文PDF
Google Scholar
トラメル S.A.J.
シュミットM.S.
ワイデマンB.J.
レッドパスP.
ヤクシュ F.
デリンジャーR.W.
リー Z.
アベル E.D.
ミゴーM.E.
ブレンナー C.
ニコチンアミドリボシドはマウスとヒトでユニークかつ経口的にバイオアベイラブルである。
Nat. Commun. 2016; 7: 12948
https://doi.org/10.1038/ncomms12948
記事で見る
スコープス (355)
パブコメ
クロスリファレンス
グーグル奨学生
キム・リョウジ
チャルマーズT.J.
スミスG.C.
ダス A.
プーン E.W.K.
ワン・J.
タッカー S.P.
シンクレア D.A.
クエック・L.-E.
Wu L.E.(ウー・エル・イー
腸内細菌によるニコチンアミドモノヌクレオチド(NMN)の脱アミド化とNAD+メタボロームの間接的なアップレギュレーションの証拠。
bioRxivでのプレプリント。
https://doi.org/10.1101/2020.09.10.289561
記事で見る
スクープ (0)
クロスリファレンス
Google Scholar
フレンチ J.B.
セン・イー
Vrablik T.L.
シュウ P.
アレン E.
ハンナ-ローズW.
Sauve A.A.
ニコチンアミダーゼの特性:定常状態の動力学パラメータ、ニコチナルデヒドによるクラスワイド阻害、触媒機構。
Biochemistry. 2010; 49: 10421-10439
https://doi.org/10.1021/bi1012518
記事で見る
スコープス (40)
PubMed
クロスリファレンス
グーグル奨学生
フラーM.F.
リーズP.J.
腸内の窒素循環。
Annu。Rev. Nutr. 1998; 18: 385-411
https://doi.org/10.1146/annurev.nutr.18.1.385
記事で見る
Scopus (177)
PubMed
クロスリファレンス
グーグル奨学生
ニ・ジェイ
シェン T.C.D.
チェン・イー・ズ
ビッティンガー K.
ベイリー A.
ロッジアニ M.
シロタ-マディA.
フリードマン E.S.
チャウ L.
リンA.
他。
腸内細菌性ウレアーゼの腸内環境異常とクローン病における役割。
Sci. Transl. Med. 2017; 9: eaah6888
https://doi.org/10.1126/scitranslmed.aah6888
記事で見る
スコープス (103)
パブコメ
クロスリファレンス
グーグル奨学生
スチュワート G.S.
スミスC.P.
尿素窒素サルベージ機構と反芻動物、非反芻動物および人間への関連性。
Nutr. Res. Rev. 2005; 18: 49-62
https://doi.org/10.1079/NRR200498
記事で見る
スコープス (75)
PubMed
クロスリファレンス
グーグル奨学生
シャイマンJ.
ルーバーJ.M.
チャブキンT.A.
マクドナルドT.
トゥンA.
ファム・L.D.
ウィボウォ・M.C.
ウルトR.C.
プンタンベーカーS.
ティアニーB.T.
他
エリートアスリートのメタオミクス解析により、乳酸代謝を介して機能するパフォーマンス向上微生物を同定。
Nat. Med. 2019; 25: 1104-1109
https://doi.org/10.1038/s41591-019-0485-4
記事で見る
スコープス(293)
パブコメ
クロスレフ
グーグル奨学生
ボルグストロームB.
ダールクヴィストA.
Lundh G.
Sjovall J.
ヒトにおける腸内消化吸収の研究。
J. Clin. Invest. 1957; 36: 1521-1536
https://doi.org/10.1172/JCI103549
記事で見る
スクープ (513)
PubMed
クロスリファレンス
グーグル奨学生
ディン・J.W.
アンデルソンR.
ソルテスV.
ウィレンR.
Bengmark S.
ラットにおける閉塞性黄疸の細菌転位における胆汁および胆汁酸の役割。
Eur. Surg. Res. 1993; 25: 11-19
https://doi.org/10.1159/000129252
記事で見る
スコープス (114)
PubMed
クロスリファレンス
グーグル奨学生
ロレンソ-ズーニガV.
バルトリR.
プラナスR.
ホフマン A.F.
ビニャドB.
ハギーL.R.
エルナンデス J.M.
マニー J.
アルバレス M.A.
アウシナ V.
Gassull M.A.
経口胆汁酸は肝硬変ラットにおける細菌の過繁殖、細菌の転座、エンドトキシン血症を軽減する。
Hepatology。2003; 37: 551-557
https://doi.org/10.1053/jhep.2003.50116
記事で見る
スコープス (237)
PubMed
クロスリファレンス
グーグル奨学生
ギブソンG.R.
ビーティE.R.
ワン X.
カミングス J.H.
オリゴフルクトースおよびイヌリンによるヒト大腸内ビフィズス菌の選択的刺激。
Gastroenterology. 1995; 108: 975-982
https://doi.org/10.1016/0016-5085(95)90192-2
記事で見る
スコープス (1251)
パブコメ
要旨
全文PDF
Google Scholar
Muthyala S.D.V.
シャンカールS.
クレマシェビッチC.
ブレイジャーJ.C.
ヒルハウスA.
Wu C.S.
加齢マウスにおける水溶性食物繊維イヌリンの脂肪率低下および腸内細菌叢の変化に関する差異性効果。
J. Nutr. Biochem. 2022; 105: 108999
https://doi.org/10.1016/j.jnutbio.2022.108999
記事で見る
スクープ (3)
クロスリファレンス
Google Scholar
ジェイコブソン E.L.
デイムA.J.
パイレックJ.S.
ジェイコブソン M.K.
ヒトの発癌におけるナイアシンの役割の評価。
Biochimie. 1995; 77: 394-398
https://doi.org/10.1016/0300-9084(96)88152-1
記事で見る
スコープス (59)
PubMed
クロスリファレンス
グーグル奨学生
原直樹
山田耕筰
柴田哲男
長子浩二
橋本哲也
土屋雅弘
ニコチン酸による細胞内NAD濃度の上昇とニコチン酸ホスホリボシルトランスフェラーゼのヒト細胞への関与.
J. Biol. Chem. 2007; 282: 24574-24582
https://doi.org/10.1074/jbc.M610357200
記事で見る
スコープス (152)
パブコメ
概要
全文
全文PDF
Google Scholar
ザンポリーニ F.
ルッジェリS.
マッツォーラF.
アミーチ A.
オルソマンド G.
ラファエリ N.
ピリジンモノヌクレオチド合成活性を同時測定する新規アッセイにより、哺乳類細胞におけるNAD(+)生合成マシーナリーの解剖が可能になった。
FEBS J. 2014; 281: 5104-5119
https://doi.org/10.1111/febs.13050
記事で見る
スコープス (30)
PubMed
クロスリファレンス
グーグル奨学生
チャウドリーS.
ザンカC.
ラージクマールU.
古賀 孝
Diao Y.
ラヴィラムR.
リュウ・フー
ターナー K.
ヤン H.
ブランク E.
他。
癌におけるNAD代謝依存性は、遺伝子増幅とエンハンサーリモデリングによって形成される。
Nature. 2019; 569: 570-575
https://doi.org/10.1038/s41586-019-1150-2
記事で見る
スコープス (98)
パブコメ
クロスレフ
グーグル奨学生
Li X.Q.
レイ・ジェイ
Mao L.H.
Wang Q.L.
Xu F.
Ran T.
Zhou Z.H.
He S.
NADサルベージ合成経路の主要酵素であるNAMPTとNAPRTは、大腸がんにおいて予後不良であることが明らかになりました。
Front. Oncol. 2019; 9: 736
https://doi.org/10.3389/fonc.2019.00736
記事で見る
スコープス(19)
クロスリファレンス
グーグルスカラー
ピアチェンテ F.
カッファI.
ラヴェラ S.
ソシアリ G.
パッサラクア M.
ヴェローネ V.G.
ベッケリーニP.
レヴェルベリ D.
モナチェッリ F.
バレストレロ A.
他
ニコチン酸ホスホリボシルトランスフェラーゼは、がん細胞の代謝、NAMPT阻害剤に対する感受性、およびDNA修復を制御しています。
キャンサー・レズ 2017; 77: 3857-3869
https://doi.org/10.1158/0008-5472.CAN-16-3079
記事で見る
スコープス(58)
PubMed
Crossref
グーグル奨学生
エリオットG.C.
レヒシュタイナー M.C.
培養ヒト線維芽細胞における生理学的に活性なニコチンアミドホスホリボシルトランスフェラーゼの証拠。
Biochem. Biophys. Res. Commun. 1982; 104: 996-1002
https://doi.org/10.1016/0006-291x(82)91348-1
記事で見る
スクープ (0)
パブコメ
クロスリファレンス
グーグル奨学生
ゴートZ.N.
ソロモンH.M.
ニコチン酸アナログによるヒト血小板溶解液中のニコチン酸ホスホリボシルトランスフェラーゼの阻害.
Biochem. Pharmacol. 1971; 20: 2903-2906
https://doi.org/10.1016/0006-2952(71)90202-4
論文で見る
スコープス (14)
クロスリファレンス
Google Scholar
ヒリアードD.
レヒシュタイナーM.C.
オリベラB.M.
哺乳類培養細胞におけるピリジンヌクレオチド代謝。
J. Cell. 生理学 1973; 82: 165-179
https://doi.org/10.1002/jcp.1040820205
記事で見る
スコープス (38)
PubMed
クロスリファレンス
グーグル奨学生
ベニョー Z.
ジルA.
ケロ J.
Csiky M.
スチャーンコヴァー M.C.
ニュシング R.M.
モーアス A.
プフェッファー K.
オッフェルマンズ S.
GPR109A (PUMA-G/HM74A) はニコチン酸によるフラッシングを媒介する。
J. Clin. Invest. 2005; 115: 3634-3640
https://doi.org/10.1172/JCI23626
記事で見る
スクープ (284)
PubMed
クロスリファレンス
グーグル奨学生
ガンジS.H.
タビンタランS.
Zhu D.
Xing Y.
カマンナ V.S.
Kashyap M.L.
ナイアシンはHepG2細胞においてDGAT2活性を非競合的に阻害するが、DGAT1活性は阻害しない。
J. Lipid Res. 2004; 45: 1835-1845
https://doi.org/10.1194/jlr.M300403-JLR200
記事で見る
スコープス (189)
パブコメ
概要
全文
全文PDF
Google Scholar
Hu M.
チュー・W.C.W.
山下 悟
Yeung D.K.W.
Shi L.
Wang D.
増田大介
ヤン Y.
トムリンソンB.
ナイアシンによる肝脂肪低減は高トリグリセリド血症患者におけるDGAT-2多型に影響される。
J. Lipid Res. 2012; 53: 802-809
https://doi.org/10.1194/jlr.P023614
記事で見る
スコープス (42)
パブコメ
概要
全文
全文PDF
Google Scholar
ロマーニ M.
ホーファーD.C.
カチューバ E.
Auwerx J.
ナイアシン:新しいNAD(+)のドレスで古い脂質薬。
J. リピッド・レズ. 2019; 60: 741-746
https://doi.org/10.1194/jlr.S092007
記事で見る
スコープス(24)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
イブラヒム G.R.
シャー I.
ガリバラ S.
ヤシンJ.
バーカーJ.
サルマン アシュラフ S.
肥満エミラティ人口における血漿ニコチンアミド、ピリドキサール、ピリドキサミンリン酸レベルの有意な上昇:横断的研究。
Molecules. 2020; 25: E3932
https://doi.org/10.3390/molecules25173932
記事で見る
スコープス(4)
クロスリファレンス
Google Scholar
クアシ・ンズーゲットJ.
シャオ・デ・ラ・バルカJ.M.
グエルーズK.
Leruez S.
Coulbault L.
アルーシュ S.
ボッカ C.
ミュラー J.
アマティ=ボノー P.
ゴヒエP.
他。
原発性開放隅角緑内障におけるニコチンアミド欠乏症。
Invest. Ophthalmol. Vis. Sci. 2019; 60: 2509-2514
https://doi.org/10.1167/iovs.19-27099
記事で見る
スコープス (30)
PubMed
クロスレフ
グーグル奨学生
オダムE.P.
ワクウェV.C.
メタボリックシンドローム被験者の水溶性ビタミンの血漿中濃度
ニジェール J. Clin. Pract. 2012; 15: 442-447
https://doi.org/10.4103/1119-3077.104522
記事で見る
スコープス (21)
PubMed
クロスリファレンス
グーグル奨学生
ダイエンC.I.
ピンゲG.V.
タンJ.K.
マシア L.
腸と免疫のホメオスタシスに対する微生物アクセス可能な炭水化物欠乏食の有害な影響:概要。
フロント。Immunol. 2017; 8: 548
https://doi.org/10.3389/fimmu.2017.00548
記事で見る
スコープス (82)
PubMed
クロスリファレンス
グーグル奨学生
タン J.
マッケンジーC.
ポタミテスM.
ソーバーン A.N.
マッケイ C.R.
マキアL.
健康や病気における短鎖脂肪酸の役割。
Adv. Immunol. 2014; 121: 91-119
https://doi.org/10.1016/B978-0-12-800100-4.00003-9
記事で見る
スコープス (1144)
PubMed
クロスリファレンス
グーグル奨学生
趙 悟(Zhao S.
Jang C.
Liu J.
上原 圭一
Gilbert M.
イッツォ・L.
Zeng X.
トレフェリー S.
フェルナンデス S.
カレール A.
他。
食餌性フルクトースは、微生物叢由来の酢酸を経由して肝脂肪生成を促進する。
Nature. 2020; 579: 586-591
https://doi.org/10.1038/s41586-020-2101-7
記事で見る
Scopus (169)
PubMed
クロスリファレンス
グーグル奨学生
マカロフ M.V.
ハリスN.W.
ロドリゲスM.
Migaud M.E.
追跡可能なリボシル化NAD(+)前駆体のスケーラブルな合成。
Org. Biomol. Chem. 2019; 17: 8716-8720
https://doi.org/10.1039/c9ob01981b
記事で見る
スコープス (11)
PubMed
クロスレフ
グーグル奨学生
王 玲
Xing X.
Chen L.
Yang L.
Su X.
ラビッツ H.
ルー W.
Rabinowitz J.D.
アンターゲットLC-MSメタボロミクスのためのピークアノテーションおよび検証エンジン。
Anal. Chem. 2019; 91: 1838-1846
https://doi.org/10.1021/acs.analchem.8b03132
記事で見る
スコープス (45)
PubMed
クロスレフ
グーグル奨学生
Adusumilli R.
マリック P.
proteoWizard msConvertによるデータ変換。
Methods Mol. Biol. 2017; 1550: 339-368
https://doi.org/10.1007/978-1-4939-6747-6_23
記事で見る
スコープス (185)
パブコメ
クロスリファレンス
グーグル奨学生
蘇旭
Lu W.
Rabinowitz J.D.
オービトラップでの代謝物スペクトル精度。
Anal. Chem. 2017; 89: 5940-5948
https://doi.org/10.1021/acs.analchem.7b00396
記事で見る
スコープス (123)
PubMed
クロスリファレンス
グーグル・スカラー
記事情報
出版年譜
掲載されました。2022年12月6日
受理されました。2022年11月9日
改訂版受理 2022年7月8日
受理:2022年7月8日 2021年12月17日
身分証明書
DOI: https://doi.org/10.1016/j.cmet.2022.11.004
著作権
© 2022 Elsevier Inc.
サイエンスディレクト
ScienceDirectでこの記事にアクセスする
図
図のサムネイルfx1
グラフィカルアブストラクト
図のサムネイル gr1
図1微生物によるNAD合成の大部分は、食餌性前駆体によって占められていない。
図1微生物によるNAD合成の大部分は食餌性前駆体によるものではない(図1
図2循環しているNAMは腸管内腔に入り、微生物のNAD生合成を支えている。
図1GR3
図3ビタミンB3は宿主と腸内細菌群の間で循環している
図サムネイルgr4
図4経口NRは主にNAへの変換を介して哺乳類組織でのNAD合成をサポートする
図3.fx2
図サムネイルfx3







この記事が気に入ったらサポートをしてみませんか?
