乳酸菌のクエン酸代謝:ワイン中のOenococcus oeniに有益な効果はあるか?
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
187
総閲覧数
11
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 微生物学、2024年01月04日
微生物生理学・代謝学分野
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1283220
この論文は次の研究テーマの一部です。
微生物生理学・代謝学における女性:2023年
全8記事を見る
乳酸菌のクエン酸代謝:ワイン中のOenococcus oeniに有益な効果はあるか?
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1283220/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit
Camille Eicher1* Joana Coulon2 Marion Favier2 Hervé Alexandre1 Cristina Reguant3 Cosette Grandvalet1*.
1UMR PAM、ブルゴーニュ・フランシュ・コンテ大学、アグロ研究所、ブルゴーニュ大学、INRAE、ディジョン、フランス
2フランス・フロイラック、バイオラフォート
3スペイン、カタルーニャ、タラゴナ、ロビラ・イ・ビルジリ大学、バイオテクノロジー研究グループ、バイオクィミカ・バイオテクノロジー研究部門
乳酸菌(LAB)はグラム陽性菌で、食品産業において主に炭水化物を乳酸に変換する発酵に頻繁に使用される。さらに、これらの細菌は、食品によく含まれる有機酸であるクエン酸を代謝する能力も持っている。クエン酸の発酵は、ジアセチルなどの炭素数4の化合物の生成につながり、乳製品に好まれるバターのような風味をもたらす。クエン酸代謝は、LAB生理学にいくつかの有益な効果をもたらすことが知られている。それにもかかわらず、ワイン用細菌Oenococcus oeniの耐酸性にクエン酸が及ぼす影響については議論がある。この観察から、クエン酸がO. oeniの高酸性ワインにおけるマロラクティック発酵能力に及ぼす影響について疑問が生じる。本総説では、ワイン用細菌O. oeniを中心に、LABにおけるクエン酸代謝に関する現在の理解を要約することを目的とする。関連する酵素を用いた代謝について詳述し、cit遺伝子座に組織された関連遺伝子についても言及する。また、cit遺伝子座の発現制御の既知のシステムについても述べられている。最後に、LAB生理学におけるクエン酸異化の有益な効果について報告し、O. oeniで観察された負の影響について議論する。
1 はじめに
クエン酸は果物、野菜、牛乳などの食品によく含まれる有機酸である。この有機酸は乳酸菌(LAB)によって代謝され、バター、酸性クリーム、カッテージチーズなどの乳製品に好まれるバターのような香りの原因となるジアセチルを含む芳香族化合物に変換される。さらに、この代謝によって発生するCO2は、ある種のチーズの「目」の形成に寄与する。とはいえ、すべてのLABがこの有機酸を消費できるわけではない。実際、クエン酸の消費は、クエン酸の細胞内への取り込みとオキサロ酢酸への異化をそれぞれ可能にするクエン酸パーミアーゼとクエン酸リアーゼをコードする遺伝子の存在に依存している(Hugenholtz, 1993; Bekal et al.) いくつかの種では、これらの遺伝子はプラスミドにコードされており、LABにおけるこの代謝形質の不安定性を説明している(Drider et al.)
いくつかの先行研究で、LABの増殖にクエン酸が有益な効果をもたらすことが報告されている(Hugenholtz, 1993; Lolkema et al., 1995; Ramos and Santos, 1996; Magni et al.) 実際、クエン酸が細胞内に取り込まれ、オキサロ酢酸がピルビン酸に変換されると、1スカラプロトンが消費され、膜貫通プロトン運動力(PMF)が生じ、F0-F1 ATPアーゼを通じてATPが産生される(Ramosら、1994;Lolkemaら、1995;Marty-Tessetら、1996)。この機構は細胞内pH(pHi)の恒常性に関与し、その結果、LABの酸ストレス耐性に関与している。さらにヘテロ発酵菌では、クエン酸は糖と共代謝され、ヘキソース発酵で生成された補酵素の再酸化を促進する(Ramos and Santos, 1996; Zaunmüller et al.) この共代謝の結果、増殖速度が向上し、最終バイオマス量が増加する(Ramos and Santos, 1996; Zaunmüller et al.)
オエノコッカス・オエニは、ワイン発酵の第2段階で活躍するLABである。ワインを脱酸する過程で、リンゴ酸を消費してより弱い酸、すなわち乳酸を生成する能力を持つ。さらに、あらゆる栄養源を消費することで、この細菌がワイン中で増殖し、微生物の安定性をもたらす。オエノコッカス・オエニは、クエン酸代謝などの二次代謝のおかげで、ワインの有機的特性を改善する(Bartowsky, 2005)。クエン酸塩は、ブドウ果汁中に少量(0.13~0.90 g/L;Alexandreら、2008年)天然に存在する。O. oeniにおけるクエン酸の代謝は、酢酸と乳酸だけでなく、ジアセチル、アセトイン、2,3-ブタンジオールといった4-炭素化合物の生産にもつながる。ジアセチルの合成は、ワインにはごく少量しか望ましくない。実際、ジアセチルの生成はワインの "バターのような "特徴を生み出す原因であり、ある閾値を超えると好ましくない(Bartowsky and Henschke, 2004)。したがって、特にワインにおいては、最終製品の変質を避けるために、クエン酸の生成を制御することが重要である。
上述したように、クエン酸代謝はLABの成長と酸ストレス耐性の両方に有益な影響を及ぼすことが知られている。しかし、Augagneurら(2007b)は、O. oeni ATCC BAA-1163株に対するクエン酸の二重効果を報告している。実際、培養液にクエン酸塩を添加すると、最適pHでは菌の生育に有益な効果を示すが、低pHでは完全に生育を阻害すると報告している。この観察結果は、この菌株で低pHへの適応進化が行われ、cit遺伝子座に突然変異が生じたという最近の研究によって裏付けられた。これらの進化した集団が獲得した変異により、祖先株はできなかったのに対し、クエン酸存在下で低pHでの増殖が可能になった(Julliat et al.) 従って、少なくともO. oeniにおいては、細菌の生理学に対するクエン酸塩の影響についてコンセンサスは得られていない。本総説では、O. oeniを中心に、LABにおけるクエン酸代謝とそれに関連するクエン酸遺伝子座について説明する。続いて、様々なLABにおける既知の制御メカニズムを説明することにより、クエン酸代謝に関するゲノム的洞察を提供する。最後に、LABにおけるクエン酸の有益な効果についてより詳しく説明し、O. oeniにおける酸性ストレス応答への影響について議論する。
2 LABにおけるクエン酸代謝
LABにおけるクエン酸代謝には3つの主要なステップがあり、まずクエン酸パーメアーゼと呼ばれる特異的なパーメアーゼを介して、アニオンまたはジアニオンの形でクエン酸を取り込む。次にクエン酸はクエン酸リアーゼの作用で酢酸とオキサロ酢酸に変換され、最後にオキサロ酢酸はオキサロ酢酸デカルボキシラーゼによってピルビン酸に分解される。ピルビン酸はその後、このセクションの後半で詳しく述べる様々な経路に方向転換される。上述した酵素は、LABによって1つまたは2つのクエン酸クラスターに編成された異なる遺伝子によってコードされている。代表的なLABのクエン酸クラスターを以下に報告する。
2.1 クエン酸クラスター組織
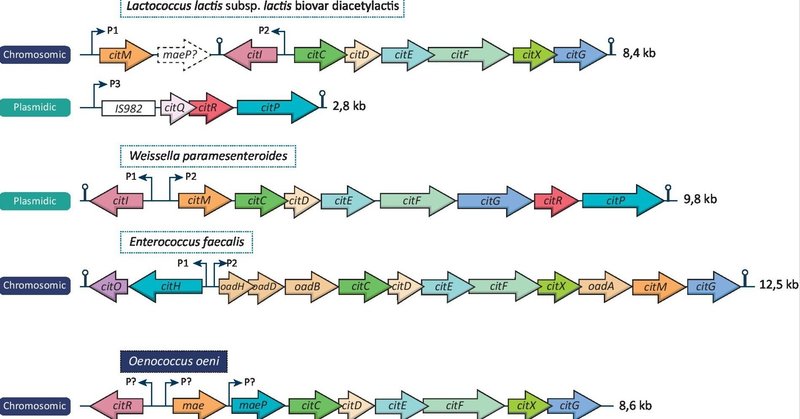
上述したように、すべてのLABがクエン酸を代謝できるわけではない。このような代謝は、クエン酸パーミアーゼとクエン酸リアーゼをコードする遺伝子の存在を意味する。これらの遺伝子は、LABによってプラスミドに局在しているか、染色体に組み込まれているかのどちらかである。図1は、Lactococcus lactis subsp. lactis biovar diacetylactis、Weissella paramesenteroides、Enterococcus faecalis、O. oeniに見られる、さまざまなクエン酸クラスター組織である。SorC/DeoRファミリーに属するオペロンの転写活性化因子をコードするcitI(Martin et al、 2004)、クエン酸トランスポーターをコードするcitP/maeP(Ramos et al., 1994; García-Quintáns et al., 2008)、クエン酸リアーゼの異なるサブユニットとその活性化成分を産生するcitC, D, E, F, X, G遺伝子(Bekal et al., 1998a)などがある。このタイプのクエン酸クラスターは、L. lactis bv. diacetylactis、W. paramesenteroides、Leuconostoc mesenteroides、O. oeniで特徴づけられている(図1;Bekal-Si Aliら、1999;Martínら、2000;Millsら、2005)。LABの種類によってクエン酸遺伝子に異なる名称がつけられているが、実際には同じ機能を共有しており、混乱を招きかねない状況にあることに注意すべきである。
図1
www.frontiersin.org
図1. 異なるLAB種のクエン酸クラスターの構成。Lactococcus lactis bv. diacetylactis、Weissella paramesenteroides、Enterococcus faecalis、Oenococcus oeniのクエン酸遺伝子座を表し、それぞれの大きさを示す。細い矢印は同定されたプロモーターを示す(推定プロモーターを示すO. oeniを除く)。エアピン構造は同定されたΡ-非依存性ターミネーターを表す。破線の矢印は、L lactis bv. diacetylactisのクエン酸遺伝子座に構築された偽遺伝子を示す。
フェカリス菌(E. faecalis)やカゼイ菌(Lacticaseibacillus casei)を含む他のLABでは、クエン酸クラスターにある種の変異が認められる。実際、クエン酸クラスターには、citIの代わりにGntRファミリーの転写活性化因子をコードする遺伝子citOが含まれ、膜結合型オキサロ酢酸デカルボキシラーゼはoadA,B,D,H遺伝子によってコードされている(Blancato et al.、2008;Mortera et al.、2013;Repizo et al.、2013)。また、ある種のLABは、同様の機能を持つタンパク質をコードする遺伝子を2つ持っている。これはL. lactis bv. diacetylactisとW. paramesenteroidesの場合で、citIとcitRという2つの異なる制御因子をコードしている。また、E. faecalisは、可溶性オキサロ酢酸デカルボキシラーゼをコードするcitM遺伝子と、膜結合型オキサロ酢酸デカルボキシラーゼ複合体をコードするクラスターoadHDBAの両方を持つので、この点でも挙げられる。さらに、L. lactis bv. diacetylactisのcit遺伝子座では、citMの後に偽遺伝子が見つかっている。その配列はO. oeniに見られるmaeP遺伝子と類似しているが、いくつかのフレームシフト変異により機能しない遺伝子となっている(Martín et al., 2004)。
2.2 LABにおけるクエン酸利用経路:クエン酸からピルビン酸への異化作用
LABにおけるクエン酸代謝は、最も一般的にピルビン酸、酢酸、CO2の生産につながる。まず、LABによって異なるが、citP、citHまたはmaeP遺伝子によってコードされるクエン酸パーミアーゼによってクエン酸が取り込まれる。L. lactis bv. diacetylactis、Lc. mesenteroides W. paramesenteroides、Lactiplantibacillus plantarumでは、citP遺伝子は2-ヒドロキシ-カルボン酸トランスポーターファミリーに属するトランスポーターをコードしている(García-Quintánsら、2008;Yangら、2022)。このアンチポーターは、ほとんどの場合、クエン酸のジアニオン型と乳酸の交換を触媒する(Marty-Tessetら、1996;Bandellら、1998;Driderら、2004)。La. caseiでは、クエン酸は、citH遺伝子にコードされるクエン酸-2価金属イオンファミリー(CitMHS)に属するトランスポーターによって、Ca2+と複合体として取り込まれる(Mortera et al.) 最後に、O. oeniでは、maeP遺伝子がMetabolite/H+シンポーターファミリーに属するユニポートをコードしており、アニオン型のクエン酸の取り込みを可能にしている(Ramos et al.、1994)。この細菌では、Augagneurら(2007b)の研究で、クエン酸の存在によって発現が正に制御されることから、別のクエン酸トランスポーターが示唆された。このトランスポーターはyaeP遺伝子によってコードされているが、その特性はまだ明らかにされていない。その機能を明らかにするために、この遺伝子の異種発現が行われたが、うまくいかなかった(Bonnin-Jusserand, 2011)。
クエン酸からオキサロ酢酸と酢酸への変換は、クエン酸リアーゼ複合体によって開始される。この多量体酵素は3つのサブユニットで構成されている:γ(補欠基を含むアシルキャリアタンパク質(ACP)、EC:4.1.3.6)、α(アセチル-ACP:クエン酸ACP-トランスフェラーゼ、EC:2.8.3.10)、β(シトリル-S-ACPオキサロ酢酸リアーゼ、EC:4.1.3.34、Lc. mesenteroidesではそれぞれ14、55、34 kDa; Bekal et al、 1998b). これらのサブユニットはLABのcitD、F、E遺伝子によってコードされている。図2は、クエン酸から酢酸とオキサロ酢酸への異化に必要な様々なステップを示している。
図2
www.frontiersin.org
図2. クエン酸リアーゼの合成とこの酵素によるクエン酸の異化。異なるクエン酸リアーゼ(CL)サブユニットと、この代謝に関与する3つの追加タンパク質をコードする遺伝子を示す。実線の矢印は酵素反応を表し、破線の矢印は他の経路への代謝産物の出所または方向転換を表す。(1) CitX(アポ-クエン酸リアーゼホスホリボシル-脱ホスホ-コエンザイムA)とCitG(トリホスホリボシル-脱ホスホ-コエンザイムA合成酵素)はATPと脱ホスホ-コエンザイムAから補欠基を合成する。 (2) CitC(酢酸:SH-クエン酸リアーゼリガーゼ)による補欠基のアセチル化による活性化。(3) CLのαサブユニット(アセチル-ACP:クエン酸ACP-トランスフェラーゼ)の触媒によるクエン酸のシトリル基とのアセチル基の交換と酢酸の生成。(4) CLのβ-サブユニット(シトリル-S-ACPオキサロアセテート-リアーゼ)によるシトリル基の開裂により、オキサロアセテートが放出され、アセチル基の再生が可能となる。
まず、クエン酸リアーゼのαサブユニットが、(クエン酸からの)シトリル基と(クエン酸リアーゼのγサブユニットであるACPの補欠基に結合した)アセチル基との交換を触媒し、酢酸とシトリル-S-ACPを放出する。最後に、クエン酸リアーゼのβサブユニットがシトリル-S-ACPをオキサロ酢酸とアセチル-S-ACPに切断し、アセチル基を再生する(Bekalら、1998a)。この酵素活性は、さらに3つのタンパク質の働きによって可能になっている: CitX(apo-citrate lyase phosphoribosyl-dephospho-coenzyme A, EC:2.7.7.61)、CitG(triphosphoribosyl-dephospho-coenzyme A synthase, EC:2.4.2.52)、CitC(acetate:SH-citrate lyase ligase, EC:6.2.1.22)であり、それぞれcitX、citG、citC遺伝子によってコードされている(Bott, 1997; Schneider et al.) CitGとCitXはATPと脱リン酸化コエンザイムAから補欠基の形成に関与し、CitCはアセチル化を介して補欠基の活性化を可能にする(García-Quintáns et al.)
クエン酸異化作用によって産生された酢酸は、菌のpHiに応じて、受動拡散またはパーミアーゼを介して細胞外培地に放出される。例えば、L. lactis bv. diacetylactisでは、酢酸がクエン酸パーミアーゼCitPの基質となり、クエン酸と交換されることが証明されている(Pudlik and Lolkema, 2011a)。しかし、O. oeniではペル ミアーゼMaePによるクエン酸の代謝産物との交換は証明されていない(Ramos他、 1994)。酢酸の未同定トランスポーターは、おそらくこの細菌にもう一つ存在する。酢酸が放出される一方で、クエン酸の第二生成物であるオキサロ酢酸は、オキサロ酢酸脱炭酸酵素(EC:1.1.1.38)によってピルビン酸とCO2に代謝される。この反応によりプロトンが1つ消費され、ΔpHが生じ、これがPMFを生成する重要なステップの1つである(Lolkema et al.、1995)。多くのLABでは、この反応はリンゴ酸酵素ファミリーに属し、LABによってはmaeとも呼ばれるcitM遺伝子によってコードされる可溶性オキサロ酢酸デカルボキシラーゼによって触媒される(Sender et al.) E. faecalisを含む他のLABでは、この反応はoadA、oadB、oadD、oadH遺伝子によってコードされる膜結合型オキサロ酢酸デカルボキシラーゼ複合体を意味する(Repizo et al.) とはいえ、オキサロ酢酸は不安定であることが知られており、二価の金属イオンを触媒として、自発的にピルビン酸に脱炭酸されることがある(Sender et al.、2004;Pudlik and Lolkema、2011b)。
Lactiplantibacillus属では、クエン酸の異化から生じるオキサロ酢酸も、還元的トリカルボン酸(TCA)サイクルの一部を使ってコハク酸に代謝される(Hugenholtz, 1993)。
2.3 ピルビン酸の運命
ピルビン酸は、ピルビン酸ノードとして知られるいくつかの代謝経路の交差点にある(図3)。その代謝はヘテロ発酵LABとホモ発酵LABの間で行われ、両者の違いについては以前に概説されている(Gemelas et al.) O. oeniやW. paramesenteroidesのようなヘテロ発酵性LABの場合、クエン酸異化作用から産生されたピルビン酸は、生育条件に応じて異なる経路に向きを変えることができる(Contreras et al.) ヘキソースが存在すると、ホスホケトラーゼ経路から来るNADHを再酸化するために、乳酸デヒドロゲナーゼ(EC:1.1.1.28)によってD-乳酸に代謝される(Zaunmüller et al.) O. oeniでは、乳酸デヒドロゲナーゼに一般的に関連する遺伝子はldhD遺伝子である(PSU-1ゲノムの遺伝子座タグOEOE_0413;Kimら、2011;Yangら、2019)。しかし、この細菌では他の5つの遺伝子が推定乳酸脱水素酵素としてアノテーションされている: OEOE_0025、OEOE_0701、OEOE_1182、OEOE_1672、OEOE_1709である。しかしながら、O. oeniのPSU-1株のプロテオームには、OEOE_0413とOEOE_1672遺伝子の産物しか検出されていない(Zaunmüller, 2008)。
図3
www.frontiersin.org
図3. Oenococcus oeniにおけるクエン酸代謝とピルビン酸の生成。クエン酸異化作用(緑色の部分)によって生成されたピルビン酸は、糖代謝によって生成された補酵素の再酸化のためにD-乳酸(青色の経路)に代謝される(ペントース-P経路、灰色で表示)。また、ピルビン酸はピルビン酸デヒドロゲナーゼ経路(ピンクで表示)またはピルビン酸オキシダーゼ経路(オレンジで表示)を通じて酢酸の生産に使用することもできる。最後に、アセト乳酸合成酵素(ALS)(紺色の経路)の作用により、2分子のピルビン酸(図では数字の2で示されている)がα-アセト乳酸に代謝され、ジアセチル、アセトイン、2,3-ブタンジオールが生成される。異なる酵素をコードする遺伝子は色のついたボックスで示されている。遺伝子名がない場合は、PSU-1株の遺伝子座タグを示す。O. oeniでは酢酸の輸送機構が明らかにされていないため、疑問符で示した。
ピルビン酸はATPの産生にも使われる。この方法では、ピルビン酸はピルビン酸デヒドロゲナーゼの作用でアセチル-CoAに脱炭酸されるが、これはコエンザイムAとチアミン二リン酸の存在に強く依存する(Hugenholtz, 1993)。この反応によって1分子のCO2が生成され、1分子のNAD+が還元されてNADH+H+となり、乳酸デヒドロゲナーゼによってもう1分子のピルビン酸がD-乳酸に変換されて再酸化される(Wagner et al.) Oenococcus oeniは、OEOE_0328、OEOE_0329、OEOE_0330、OEOE_0331遺伝子によってコードされるアセトイン/ピルビン酸デヒドロゲナーゼ複合体(EC:1.2.4.1/2.3.1.12/1.8.1.4)と注釈されるピルビン酸デヒドロゲナーゼを持つ。産生されたアセチル-CoAは、次にホスホトランスアセチラーゼ(EC:2.3.1.8、OEOE_1435によってコードされている)によってアセチル-Pに代謝され、このアセチル-Pはアセテートキナーゼ(EC:2.7.2.1、OEOE_1249によってコードされている)によって利用され、アセテートとATPを産生する(Wagner et al.)
O. oeni PSU-I株では、OEOE_1818にコードされるピルビン酸オキシダーゼ (EC:1.2.3.3)の働きにより、補酵素を還元することなくピルビン酸からATPを生産する別の方法が可能である。実際、この酵素はピルビン酸、無機リン酸、酸素をアセチル-P、H2O2、CO2に変換する触媒作用を持ち、アセチル-Pから酢酸とATPを生産する(Wagner et al., 2005)。この反応は好気的条件下でのみ可能である。最近、O. oeniでは、ピルビン酸オキシダーゼ経路を介したピルビン酸のアセチル-P生産へのチャネリングが、酸性条件下(pH = 3)で大幅に増加することが証明された(Qi et al.、2021)。しかし、この経路は酸素へのアクセスが制限されるため、醸造学的条件下では特権的であってはならない。
最後に、ピルビン酸はC4アロマ化合物(ジアセチル、アセトイン、2,3-ブタンジオール)に代謝される。これらのC4化合物は、主にクエン酸の異化によって生成されるピルビン酸から得られる(McKay and Baldwin, 1990)。細胞内にピルビン酸が蓄積すると、高ピルビン酸含量による推定上の毒性を防ぐために、これらの合成が増加する。実際、乳酸デヒドロゲナーゼを欠損したStreptococcus lactisまたはL. lactis bv. diacetylactisの変異株は、クエン酸存在下でα-アセト乳酸とジアセチルをより多く生産することが証明されている(McKay and Baldwin, 1974; Monnet et al.) この観察を完成させるために、Zuljanらは、ピルビン酸をC4化合物に代謝できなくなったL. lactis株が、低pHでこの有機酸の添加に敏感になることを示した(Zuljanら、2014)。
α-アセト乳酸とCO2を形成するためには、2分子のピルビン酸と1分子のチアミン二リン酸が必要であり、この反応はアセト乳酸合成酵素(EC:2.2.1.6、O. oeniではalsS遺伝子によってコードされている;Hugenholtz, 1993; Garmyn et al.) L. lactis bv. diacetylactisのアセト乳酸合成酵素は、ピルビン酸に対して低い親和性(Km = 50 mM)を示し、C4化合物を得るためには大量のピルビン酸が必要であることが確認された(Snoep et al., 1992)。α-アセト乳酸は、α-アセト乳酸脱炭酸酵素(EC:4.1.1.5)によってアセトインとCO2に代謝されるか、酸素の存在下でジアセチルとCO2に自然酸化される。α-アセト乳酸デカルボキシラーゼは、O. oeniではalsD遺伝子によってコードされ、alsS遺伝子と1つのオペロンで構成されている(Garmyn et al., 1996)。さらに、この遺伝子の発現はエタノール存在下で誘導される (Olguín et al., 2009)。ジアセチルはワインにバターのようなアロマを与える主要な分子で、主にクエン酸代謝に由来するピルビン酸から合成される。とはいえ、糖代謝やリンゴ酸代謝など、他の代謝もジアセチルの生成に寄与することが証明されている(Mink et al. 7mg/Lを超えると、ジアセチルはワインに好ましくないバターのような風味を与える(Bartowsky and Henschke, 2004)。そのため、ジアセチルの生成を制御することが重要である。残念なことに、O. oeniにおけるクエン酸代謝の制御は、今のところ不完全にしか解明されていない。この点については、他のLABにおけるクエン酸代謝の制御について後述する。
最後に、ジアセチルはアセトインに還元され、それ自体が2,3-ブタンジオールに還元される。この反応は、LABによってNADHまたはNADPHを補酵素として必要とする(Hugenholtz, 1993)。L. lactis bv. diacetylactisの研究によると、これら2つの反応は同じ酵素、すなわちアセトインレダクターゼ(EC:1.1.1.304/1.1.1.47)によって代謝される可能性があり、この酵素はジアセチルに対してより高い親和性を持つ可能性がある(Crow, 1990)。O. oeni PSU-1ゲノムでは、2つの遺伝子がアセトイン還元酵素としてアノテーションされている:OEOE_0693とOEOE_1602。以前の研究(Cogan, 1981; Hugenholtz, 1993)によると、この酵素はクエン酸存在下で部分的に阻害される可能性がある。
3 クエン酸代謝に関するゲノム的洞察:制御経路のあり方
LABのクエン酸遺伝子座が極めて多様であることは前述の通りである。実際、オペロンだけでなく、遺伝子座内の遺伝子の構成や局在も、種によって同じではない。このような多様性を考慮すると、クエン酸遺伝子座の発現制御は生物種に依存する可能性がある。環境は、種によって異なる方法でクエン酸遺伝子座の発現に影響を与えることが実際に証明されている。このセクションでは、特定のLABについて文献に記載されているクエン酸遺伝子座制御のメカニズムについて詳述する。その後、オペロンの発現に対する環境パラメータの影響について考察する。
3.1 クエン酸遺伝子座の発現制御
これまでの研究で、様々なLABにおけるクエン酸遺伝子座の発現制御メカニズムが検討されてきた。その結果、CitI、CitR、またはCitOと名付けられた活性化タンパク質が、転写および/または転写後レベルで作用していることが明らかになった。
W. paramesenteroidesでは、クエン酸代謝に関連する遺伝子は9.8kbの単一のプラスミドクラスターにまとまっている。最初のプロモーター(PcitI)はcitIの発現を制御し、2番目のプロモーター(Pcit)はcitMCDEFGRPオペロン全体の転写を確実にする(Martín et al.) クエン酸経路に関与する主要タンパク質、すなわちそれぞれオキサロ酢酸デカルボキシラーゼ、クエン酸パーミアーゼ、クエン酸リアーゼの異なるサブユニットをコードするcitM、citP、citCDEFG遺伝子に加えて、このクラスターには推定制御因子をコードする2つの遺伝子、citIとcitRが含まれる。CitIはSorCファミリーに属するタンパク質である。citMCDEFGRPクラスターの発現におけるその役割は探索されてきた(Martínら、2000;Martinら、2005)。実際、citMCDEFGRPクラスター発現における転写活性化因子としてのCitIの役割は、大腸菌での異種発現によって明らかにされた。遺伝子間領域citI-citMはA/T塩基に富み(77%)、本質的に曲がっている。この領域にはCitIが認識する2つのオペレーター部位(O1とO2)が同定され、CitIはこれらに協同的に結合することができる。CitIのDNAオペレーターに対する親和性はクエン酸によって直接増強され、その結果PcitとPcitIにおけるRNAポリメラーゼのリクルートメントが増加する。このように、クエン酸が存在しない場合、CitIはオペレーター部位との相互作用が弱く、その結果、クエン酸の細胞内への取り込みを確実にするクエン酸パーミアーゼのようなクエン酸経路酵素の発現レベルが低くなる。クエン酸が環境中に存在すると、それが細胞内に輸送され、CitIのDNAオペレーターに対する親和性を直接増加させ、cit遺伝子座の発現を増加させる(Martin et al.) 同様のオペレーター部位は、O. oeniを含む他のLABのクエン酸遺伝子座プロモーター領域にも見られるようである。従って、Martinら(2005)は、この制御機構は他のLABでも同様である可能性を示唆した。この細菌のcitR遺伝子に関しては、その産物がクエン酸クラスター発現に果たす役割はまだ調べられていない。
さらに、この細菌のcitMCDEFGRPクラスター発現は、おそらくエンドヌクレアーゼによって認識される複合体構造レベルでの特異的なプロセッシングによって、転写後制御を受けている(Martín et al.) すなわち、全てのcitMCDEFGRP遺伝子の転写物を含む8.8kbのRNA、citDからcitPまでの転写物を含む6.1kbのRNA、そして最後にcitMからcitRまでの転写物を含む7.2kbのRNAである(Martín et al.) 著者らは、このRNAプロセッシングによって、異なるタンパク質の合成を適切な割合で制御できる可能性を示唆している(Martín et al.)
L. lactis bv. diacetylactisでは、クエン酸代謝に関与するタンパク質をコードする遺伝子は2つの異なるクラスターで構成されている:プラスミド上に存在するcitQRPオペロンと染色体に組み込まれたcitMCDEFXGオペロンである(Martín et al.) この第二のクラスターには、発散方向を向いているcitI遺伝子も含まれている。プロモーター領域は同定されている:citQRPクラスター発現のためのISエレメントの前、citMCDEFXG発現のためのcitMの前、そしてcitIの前の発散方向のもう1つ(de Felipeら、1994;Martínら、2004)。citQRPの発現を可能にするプロモーターとcitMの前のプロモーターは非常によく似ており、A/T塩基が豊富である(Martín et al.) 2つのクエン酸クラスターには、制御タンパク質をコードする2つの遺伝子:citIとcitRが含まれる。パーミアーゼ遺伝子の発現に対するCitRの影響は、異種発現によって調べられてきた(de Felipe et al.、1994)。この13.1kDaのタンパク質は339bpのcitR遺伝子によってコードされ、W. paramesenteroidesのcitRと相同性を持つ。citRの過剰発現はcitPの転写に影響を与えなかったが、レポーター遺伝子の活性は著しく低下した。従って、CitRは転写後レベルで抑制因子として働く可能性がある。別の実験では、citRとcitPの両遺伝子をレポーター遺伝子と融合させ、構成的プロモーターの制御下で構築した。この実験の結果、citRにフレームシフト変異を導入すると、レポーター遺伝子の活性が低下することがわかった。この発見は、citRとcitPの連鎖翻訳がcitPの発現を高めていることを示唆している。従って、L. lactis bv. diacetylactisのCitRは転写後レベルで作用し、citPの発現に2つの異なる影響を与える可能性がある。リボソーム結合部位と開始コドンを含む、citR以前のmRNAの二次構造が検出された。仮説の一つは、CitRがこの二次構造を安定化させ、citRとcitPの連鎖翻訳を阻害している可能性である。L. lactis bv. diacetylactisの第二クエン酸クラスターに対するCitRの影響はまだ調べられていない。
L. lactis bv. diacetylactisのcitMCDEFXGは、citMとcitCの間に逆向きのcitI遺伝子を含んでいる。この930bp遺伝子はCitIと名付けられた34.8kDaの制御タンパク質をコードしている。L. lactis bv. diacetylactisの2つのcitクラスターの発現に対するこの遺伝子の影響はまだ調べられていない。それにもかかわらず、Martínら(2004)は、このゲノム位置のセンスとアンチセンスの転写物がRT-PCRで検出されたことから、RNAサイレンシング機構を介してcitI発現の転写後制御が可能であることを示唆した。実際、この遺伝子はcitMの前のプロモーター(P1)からも、それ自身のプロモーター(P2)からも転写される(図1)。さらに、クエン酸リアーゼ活性はpH7に比べてpH5で増加し、酸性条件下ではより多くのcitI転写物が検出されることが証明されている(Martín et al.) したがって、W. paramesenteroidesで同定されたものと同様の制御メカニズムが著者らによって提案された: CitIはcitMCDEFXGクラスターの転写活性化因子であり、その発現はおそらくpHの低下によって増強されると思われる。
E. faecalisの場合、GntRファミリーに属し、FadR C末端ドメインファミリーにクラスター化されたCitOという別の制御タンパク質がある。この細菌では、citO遺伝子を変異させるとクエン酸代謝が検出されないことから、citクラスター発現の転写活性化因子として働くことが示されている(Blancato et al.) CitOによる最適な転写活性化には、CitOのC末端ドメインのクエン酸イオンと金属イオン(Ni2+、Zn2+)によって誘導される分子修飾が必要である(Blancato et al.) 著者らはまた、CitOのプロモーター領域に2つのオペレーター部位を同定しており、クエン酸はCitOと相互作用し、DNAとの結合能力を調節しているようである。W. paramesenteroidesやL. lactis bv. diacetylactisのケースで示唆されたことと同様に、このLABのcitクラスターは転写後制御の対象である可能性がある。
O. oeniでは、クエン酸オペロンに含まれる推定制御因子CitRの役割を理解するための研究は行われていない。上記の全ての制御因子タンパク質と比較して、O. oeniのCitRタンパク質はL. lactis bv. diacetylactisのCitIタンパク質に最も近いと思われる。前述のように、Martinら(2005)はこのタンパク質の2つの推定オペレーター部位を提唱しており、おそらくcitRとmaeの間に位置している。促進領域に関しては、-10領域と-35領域に関連しそうな配列を持つ2つの推定プロモーターが同定された:最初のものは一見maeの前にあり、他のLABと同様に、オペロン全体の転写を可能にする可能性がある。このプロモーターは、W. paramesenteroidesやL. lactis bv. diacetylactisで報告されているように、A/T塩基に富んでいる。典型的な制御領域である-35と-10もmaePの前に見つかったことから、この菌ではクエン酸オペロンもこの推定プロモーターから発現される可能性がある。citR遺伝子は分岐して発現しているので、別のプロモーターがその前に位置しているに違いない。それにもかかわらず、この遺伝子近傍の-35と-10領域の特定は明らかでなく、リボソーム結合部位も不明である。citRの促進領域を正確に定義するには、+1転写開始部位を決定することが必要であろう。他のLABで見られたのと同様に、O. oeniのcitクラスター発現は転写後制御されている可能性がある。
3.2 クエン酸遺伝子座発現に対する環境の影響
上述したように、環境はLABにおけるクエン酸クラスターの発現に影響を与えうる。実際、ほとんどのLABにおいて、クエン酸はオペロンの発現を誘導する。このクエン酸のポジティブな効果は、W. paramesenteroides、Lc. mesenteroides、Limosilactobacillus panis、E. faecalisで報告されている(Bekal-Si Aliら、1999;Martínら、2000;Blancatoら、2008;Kangら、2013)。逆に、L. lactis bv. diacetylactisでは、クエン酸は検出されたcit転写物レベルを増強しなかったが、citクラスターの発現は低pHで誘導された(Martín et al.)
O. oeniでは、ATCC BAA-1163株を用いた以前のRT-qPCR研究により、クエン酸塩もpHもmae、maeP、citFの発現に影響を及ぼさないことが示された(Augagneur et al.、2007b)。これらの結果は、低pHでクエン酸リアーゼ遺伝子とmaeのアップレギュレーションを示したSD-2a株のRNAで行われたトランスクリプトーム解析とは一致しない(Liu et al.) ATCC BAA-1163株のクエン酸オペロンの塩基配列については、他の株と比較してcitR遺伝子の塩基配列に1塩基の欠失が認められ、早期の停止コドンが出現している(アミノ酸の長さは320ではなく256)。従って、この株では制御因子と推定されるCitRが機能していない可能性があり、この株で収集されたデータから導かれた結論は、全種に一般化できるものではないだろう。実際、W. paramesenteroidesの研究では、制御因子CitIの発現に対するクエン酸の直接的な正の効果が示されている(Martín et al.) もしO. oeniのATCC BAA-1163株でこの調節因子が機能していないとすれば、Augagneurら(2007b)の実験でクエン酸の添加と酸性条件にもかかわらず、cit遺伝子座の発現に変化が見られなかったのはこのためかもしれない。この仮説を確認し、この細菌のcit遺伝子座発現に影響を与える環境パラメータを特定するには、異なるO. oeni株の特徴付けに基づくさらなる実験が必要であろう。ワインのような」条件下で生育させたO. oeniに関する他のRTqPCRおよびトランスクリプトーム解析では、ワイン関連のストレス、特にエタノールによってクエン酸遺伝子座の特定の遺伝子が有意に誘導されることが示されている(Olguín et al.) さらに、別の研究では、低pHで誘導されるcitEの過剰発現が、フルクトースの存在によっても誘導されることが示された(Pretorius et al.) フェノール化合物の存在もまた、O. oeniのクエン酸代謝と酢酸生産に影響を与えるようである(Rozès et al.) これらの環境パラメータがO. oeniのcit遺伝子座の発現に与える影響、特に推定制御因子をコードするcitRの発現に与える影響について、さらに詳細に明らかにすることは興味深い。O. oeniにおけるクエン酸代謝制御をより深く理解することは、この細菌のストレス応答メカニズムの一つをより良く把握することに役立つであろう。これらの遺伝子は、ワインへの適応中にアップレギュレートされることが、いくつかの事例で報告されているからである(Bordas et al.)
ジアセチルに関しては、O. oeniによるその生産は、酸素の存在、ワインの酸化還元電位、ピルビン酸とクエン酸の濃度に影響される(Nielsen and Richelieu, 1998; Mink et al.) 従って、クエン酸代謝が活性化する状況を理解することで、ワインのアロマ・プロファイルにプラスの影響もマイナスの影響も与える可能性のある、ジアセチルのような生成物のクエン酸関連合成をより適切に制御できるようになる可能性がある。
4 LABの成長とストレス耐性に対するクエン酸の有益な効果
クエン酸経路はLABにおいて不安定な形質であり、主要な遺伝子のいくつかはいくつかの種でプラスミド化されている(Hugenholtz, 1993)。さらに、いくつかのLABでは、クエン酸そのものは細菌の増殖をサポートしないことが報告されている(García-Quintáns et al.) しかし、クエン酸を代謝できる細菌には、興味深い利点がある。実際、この代謝によってPMFが生成され、いくつかのスカラープロトンが消費され、酸性環境におけるpHiの維持に役立つ(Poolman et al.) さらに、ヘテロ発酵性LABでは、クエン酸から生産されたピルビン酸がさらにD-乳酸に代謝され、糖代謝から生じた補酵素を再酸化することができる。このように、糖質とクエン酸の共代謝は細菌の増殖を著しく促進する(Salouら、1994;RamosとSantos、1996;Kangら、2013)。
4.1 プロトン起電力の発生
PMFは、LABにおいてエネルギーが生成される主なメカニズムの一つである。PMFは化学的勾配(ΔpH)と電気的勾配(ΔΨ)からなり、膜電位とも呼ばれる。PMFを発生させるシステムは2つある:1つのプロトンの細胞外への移動からなる一次輸送システムと、この場合、化学的および電気的勾配の発生が連関する二次輸送システムである。クエン酸代謝は第二のカテゴリーに属する。この場合、pH勾配と膜電位は代謝の2つの異なるステップで発生する。実際、膜電位はクエン酸が細胞内に輸送される際に発生し、ΔpHはクエン酸が代謝される際に発生する(Ramosら、1994)。PMFによって放出される自由エネルギーは、F0-F1 ATPaseを活性化してATPを産生するのに十分な強さである(Poolmanら、1991;Poolman、1993;Ramosら、1994)。この現象をよりよく説明するために、L. lactis bv. diacetylactisの例を取り上げ、O. oeniのそれと比較する。
L. lactis bv. diacetylactisは乳発酵に使用され、乳糖を乳酸に変換するため、培地はpH7からpH4付近まで酸性化する(García-Quintánsら、1998)。この細菌ではクエン酸代謝が低pHで誘導されることが証明されており、pH4.5~5.5で最も高い取り込み率が観察された(Magni et al.) クエン酸のpKaは3.13、4.76、6.40である(Martell and Smith, 1982)。従って、培地のpHが4.5~5.5の場合、クエン酸は主にHcitrate2-型で見出される。クエン酸のこの形は、パーミアーゼCitPによって取り込まれるものである(図4;Magniら、1996)。このトランスポーターは、クエン酸が1つのプロトンと共輸送されることを意味するシンポーターとして働くことができる(Magniら、1996)。この場合、クエン酸は1分子の乳酸と交換される(図4; Marty-Tessetら, 1996; Bandellら, 1998; Pudlik and Lolkema, 2011a)。いずれの場合も、クエン酸の輸送により、細胞内に負電荷が1つ移動し、細胞内に負の電気勾配が生じる(Magniら、1994;Marty-Tessetら、1996)。次に、オキサロ酢酸からピルビン酸への脱炭酸により、スカラープロトンが消費され、PMFの第二の側面であるpH勾配が形成される(Lolkemaら、1995)。
図4
www.frontiersin.org
図4. Lactococcus lactis bv. diacetylactisおよびOenococcus oeniにおけるクエン酸代謝によるPMFの生成。1/ペルミアーゼCitPまたはMaePによるクエン酸のインターナリゼーションは、マイナス(ΔΨ)の内側に電気勾配を生じさせる。クエン酸塩の形は灰色で表され、細胞外pHに応じて2つのLABの各環境で形成される大半の形は太字で示されている。 2/ クエン酸代謝はスカラープロトンの消費を促進し、アルカリ性内部でΔpH勾配を形成する。
オエノコッカス・オエニは、L. lactis bv. diacetylactisよりも酸性環境で生育し、ワインのpHは3~3.6に達する。従って、ワイン中ではクエン酸塩は主に陰イオンのH2citrate-として存在する。この形態のクエン酸は、パーミアーゼCitPによって輸送される粒子である(Ramosら、1994年)。CitPは1つの負電荷(ΔΨ)を取り込むユニポーターとして働き、他のLABで実証されていることとは異なり、クエン酸代謝産物の1つではクエン酸を交換できないことが証明されている(Ramosら、1994;Marty-Tessetら、1996;Bandellら、1998)。PMFの第二部分は、クエン酸の異化の際に生じるスカラープロトンの消費によって生成される(図4;Ramosら、1994)。PMFの生成は、糖飢餓のためO. oeniがワインでエネルギーを生産する唯一の方法のひとつであり、重要である。従って、O. oeniのPMF生成の主な原因であるマロラクティック発酵と同様に、クエン酸代謝はワインのような過酷な環境における菌の生存に関与している。
4.2 細胞内pHホメオスタシス
LABは酸性環境で増殖し、特にO. oeniはpHが3より低くなることもあるワイン中で生き延びなければならない。低pHでは、多くの酸がプロトン化した形で存在し、単純な受動拡散によって細胞内に入ることができる。その結果、pHiが低下し、タンパク質の変性を引き起こし、酵素活性を低下させ、膜の硬直化をもたらし、トランスポーターの活性に影響を与える(Tourdot-Maréchalら、2000;Grandvaletら、2008)。これらの変化はすべて細胞のホメオスタシスを変化させ、細菌の生存に深刻な影響を及ぼす可能性がある。F0 F1-ATPaseによるプロトンの押し出しは、LABがpHiを維持するために用いるメカニズムの一つであるが、エネルギーを消費するため、一時的な反応である必要がある。上述したように、クエン酸代謝は数個のプロトンの消費につながり、乳酸や酢酸のような弱酸への異化がpHiの維持に寄与する。また、クエン酸代謝は、パーミアーゼCitPによるクエン酸と乳酸の交換により、L. lactisの細胞質における解糖により生成された乳酸の蓄積による増殖阻害を緩和することも報告されている(Magni et al.、1999)。さらに、L. lactisに関する別の研究では、低pHで毒性を示すピルビン酸の蓄積に対して、C4化合物の合成が有益であることが示された。実際、アセト乳酸合成酵素をコードするals遺伝子を破壊すると、ピルビン酸存在下で低pHで培養した場合、細胞がpHiを調節できなくなるため、細胞の生存能力が失われた(Zuljan et al.) 同じように、L. lactisにおけるmae遺伝子の破壊は、細胞内オキサロ酢酸蓄積を引き起こし、特に低pHでの増殖に大きな影響を与える(Augagneur et al., 2007a; Pudlik and Lolkema, 2011b)。クエン酸代謝は、LABが酸性環境に抵抗するために用いるストレス応答機構の一つであることは疑いない。
4.3 クエン酸とグルコースの共代謝
すなわち、解糖に相当し(Embden-Meyerhof-Parnas経路とも呼ばれる)、主に乳酸を生産するホモ発酵代謝と、ホスホケトラーゼ経路を使用し、乳酸だけでなくエタノール、酢酸、CO2も生産するヘテロ発酵代謝である(Kandler, 1983)。ヘテロ発酵性LABは2つの異なるグループに分けられる:解糖とホスホケトラーゼ経路によって糖を発酵させることができる通性ヘテロ発酵性LABと、O. oeniのような義務的ヘテロ発酵性LABは、解糖経路に関与する主要な酵素を欠くため、この代謝を利用することができない(Salvetti et al.)
ホスホケトラーゼ経路では1~2分子のATPが生産されるため、LABのエネルギー源となる。LAB環境で最も一般的なヘキソースであるフルクトースとグルコースは、グリセルアルデヒド-3-P、アセチル-P、CO2に代謝され、この反応には2つのNAD(P)+の還元が必要である(図3)。グリセルアルデヒド-3-Pは次にピルビン酸の生産に使われ、余分なNAD+が1つ還元されるが、この1つはピルビン酸から乳酸を生産する乳酸デヒドロゲナーゼの作用ですぐに再酸化される(Unden and Zaunmüller, 2009)。ヘキソース発酵によって最初に生成される2つのNAD(P)Hも再酸化される必要がある。この再酸化はアセチル-Pからエタノールへの変換によって行われるが、O. oeniではホスホケトラーゼ経路の酵素活性が高いのに比べ、この経路は非常に遅いようである(Maicas et al.) 糖代謝に関連する他の経路が、これらの補因子を再酸化するために細菌によって利用されている:エリスリトール、グリセロール、マンニトール経路である(Maicasら、2002;Richterら、2003;Zaunmüllerら、2006)。とはいえ、クエン酸代謝の場合のように、外部の電子受容体が用いられることもある。実際、クエン酸代謝はピルビン酸を生成し、このピルビン酸は乳酸デヒドロゲナーゼによってD-乳酸に変換され、1つの補酵素の再酸化を可能にする(Ramos and Santos, 1996; Zaunmüller et al.) その結果、O. oeniはクエン酸とグルコースの両方を含む培地では、グルコースのみの培地と比較して増殖が促進されることが実証された(Salou et al., 1994; Ramos and Santos, 1996)。同様の結論は、Li. panisを用いた研究でも導かれており、クエン酸塩の添加により、エタノールよりもグルコースからより多くの酢酸が生成され、より高いATP産生をもたらすという代謝シフトが起こった(Kang et al.)
一方、ホモ発酵LABでは、クエン酸と糖代謝の関連は、クエン酸が解糖の最終産物、すなわち乳酸と交換される場合にのみ現れる。この場合、グルコースの添加が細菌によるクエン酸の取り込みを促進するため、クエン酸代謝に有益な効果をもたらすのは糖代謝である(Pudlik and Lolkema, 2011a)。とはいえ、クエン酸とグルコースの共代謝は、ホモ発酵LABの増殖に有利な結果をもたらす(Starrenburg and Hugenholtz, 1991; Sánchez et al.)
5 オエノコッカス・オエニ(Oenococcus oeni)で強調されたクエン酸代謝の論争の的となる効果
LABの増殖におけるクエン酸代謝のいくつかの有益な効果については、上述した。しかし、O. oeniの酸ストレス耐性に対するクエン酸の二重の効果が強調されている (Augagneur et al., 2007b; Julliat et al., 2023)。実際、FT80m培地にクエン酸塩を添加すると、O. oeniの生育に最適なpHであるpH5.3では最終的なバイオマス量と生育速度が高くなったが、クエン酸塩を含むpH3.2培地では細菌の生育に有意な阻害効果が観察された(Augagneur et al.) さらに、O. oeniの耐酸性を向上させるために行われた実験的進化により、cit遺伝子座に固定変異が出現した。これらの変異はクエン酸遺伝子のダウンレギュレーションを引き起こし、その結果、試験した進化個体群ではクエン酸消費速度が低下した。この研究により、祖先株はpH3のFT80mでクエン酸を添加すると成長が損なわれるが、進化した個体群の成長には影響がないことが示された(Julliat et al.、2023)。O. oeniではクエン酸消費速度と耐酸性の間に相関関係があることが示された。観察された増殖阻害は、細菌がpHiを維持できないことに起因している可能性がある。Augagneurら(2007b)によると、クエン酸自体はpHiの維持に直接影響しないようである。そこで著者らは、クエン酸代謝産物のひとつである酢酸に注目した。この弱酸(pKa=4.74)は、主にpH4.8より低いpHでプロトン化された形で見出されるため、培地のpHが十分に低ければ容易に細胞内に再突入する。Augagneurら(2007b)が行った実験では、酢酸添加がバクテリアの増殖に有意な阻害効果を示し、pH勾配と膜電位の維持にはそれほど影響しないことが示されている。従って、クエン酸代謝だけでなく糖代謝による酢酸の迅速な生産は、細胞にとって毒性になる可能性がある。さらに、L. lactisでは、alsS変異の結果、C4化合物に代謝されなくなったピルビン酸が蓄積すると、細胞の生存能力が失われることが示されている(Zuljan et al.、2014年)。
これらの研究は、O. oeniに特異的な、低pHにおけるクエン酸の効果について議論を呼びそうだ。とはいえ、Augagneurら(2007b)が行った実験は、クエン酸20mM(3.8g/Lに相当)を添加した実験室で行われたことを念頭に置く必要がある。この濃度はワインに含まれる濃度の約10倍であり、試験条件がバクテリアの実際の環境から大きくかけ離れていたことを意味する(Alexandre et al.) さらに、実験にはATCC BAA-1163株を用いた。上述したように、この株は他の株と比較してcitR配列上に1塩基の欠失があり、その結果、早発停止コドンが出現する。従って、ATCC BAA-1163株はクエン酸消費に関して特殊な挙動を示す可能性がある。
O. oeniについては、低pHでのクエン酸添加が菌に与える影響を示すための追加研究は行われていない。しかしながら、O. oeniの他の菌株について、クエン酸存在下、低pHで糖と有機酸を消費する実験が行われている。これらの研究では、pH(いくつかの条件では3~3.5)やクエン酸濃度(Pretoriusらの研究では0.5 g/L、Viljakainen and Laakso, 2000の研究では5~8.5 g/L)にかかわらず、菌はリンゴ酸をすべて消費した。Augagneurら(2007b)の研究では、pH 3.2のクエン酸塩の添加によってリンゴ酸の総消費量が抑制されたため、このようなことはなかった。このことから、Viljakainen and Laakso(2000)とPretoriusら(2019)が試験した条件では、細菌は低pHでのクエン酸塩の存在によって影響を受けなかったことが示唆される。Augagneurら(2007b)によって観察されたO. oeniの耐酸性に対するクエン酸塩の論争的な効果を一般化し、この代謝がマロラクティック発酵に影響を与えうるかどうかを判断するには、他の研究が必要であろう。
6 結論と展望
本総説は、ワイン用細菌O. oeniを中心に、LABにおけるクエン酸代謝に関する現在の理解を要約することを目的とした。この代謝には3つの異なる複合タンパク質が必要である:パーミアーゼ、クエン酸リアーゼ、そして最後にオキサロ酢酸デカルボキシラーゼである(Hugenholtz, 1993; Bekal et al.) これらの酵素をコードする遺伝子は長いクエン酸オペロンで構成されており、LABによってプラスミドに組み込まれたり、染色体に組み込まれたりする(de Felipeら、1994;Driderら、2004;Martinら、2005;Blancatoら、2008)。クエン酸遺伝子座の発現制御機構については、いくつかのLABで報告されており、LABによってcitI、citR、citOと名付けられた遺伝子によってコードされる転写/転写後活性化因子の主要な役割が明らかにされている。O. oeniに見られる制御タンパク質をコードするcitRは、L. lactis bv. diacetylactisのcitRよりも遺伝学的にcitIに近い。
クエン酸遺伝子座の発現は、クエン酸の存在やpHなどの環境パラメーターによって誘導される可能性がある(Bekal-Si Aliら、1999;Martínら、2000、2004;Blancatoら、2008)。O. oeniでは、ある種のRT-qPCRおよびRNAseq研究によって、エタノールなどのワイン関連ストレスによっていくつかのクエン酸遺伝子座遺伝子がアップレギュレーションされることが実証されている(Bordas et al., 2015; Margalef-Català et al.
クエン酸代謝は、LABの成長と酸ストレス耐性に有益な影響を及ぼす。それにもかかわらず、O. oeniのATCC BAA-1163株の酸ストレス耐性については、クエン酸の効果が議論の的になっている(Augagneurら、2007b;Julliatら、2023)。この菌に対する低pHでのクエン酸のこの種の効果を報告した研究は他にないことから、この効果は菌株に依存する可能性がある。この仮説を確認するために、異なるO. oeni株におけるクエン酸代謝を研究することは興味深い。さらに、この菌株においてクエン酸塩がどのように増殖阻害の対象となるかを理解するために、補完的な研究を行うこともできるだろう。Augagneurら(2007b)は酢酸産生が有毒であることを疑ったが、L. lactisで実証されているように、ピルビン酸も重要な役割を果たす可能性がある(Zuljanら、2014)。より一般的な観点からは、O. oeniのクエン酸代謝、特にこの代謝がこの種でどのように制御されているかについてのさらなる知見が必要である。O. oeniにおけるクエン酸オペロンの制御因子とされるCitRの役割については、これまで研究が行われておらず、またcitクラスターの発現に対する環境の影響に関する情報もほとんど得られていない。これまでの研究で確認できた限りでは、クエン酸代謝はマロラクティック発酵に影響を与えないようである(Viljakainen and Laakso, 2000; Pretorius et al.) しかし、この代謝が菌株依存性である可能性がある限り、異なるpHで、異なるクエン酸濃度で、リンゴ酸およびクエン酸の消費後に異なるO. oeni株で発酵を実施することは、有益な方法である可能性がある。最後に、クエン酸代謝は、ワインの中で少量しか好まれないバターのような香りの原因となるC4化合物であるジアセチルの生成につながるため(Bartowsky and Henschke, 2004)、環境条件がクエン酸代謝にどのように影響するかをより正確に理解することで、ジアセチルの生成をより適切に制御できる可能性がある。
著者貢献
CE:執筆 - 査読と編集。JC:執筆-校閲・編集、資金獲得。MF:執筆-校閲・編集、資金獲得。HA:執筆-校閲・編集、監修。CR:執筆-校閲・編集、監督。CG:執筆-校閲・編集、監督。
資金提供
著者らは、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明する。本研究は、ラフォール(フランス)およびInstitut Agro(フランス)から資金援助を受けた。資金提供者は、本論文の執筆および投稿の決定に関与した。
謝辞
本総説の校正にあたり、有益な議論と協力をいただいたDominique Garmyn(Université de Bourgogne)に感謝する。
利益相反
著者のJCとMFはBiolaffort社に雇用されていた。
残りの著者は、潜在的な利益相反と解釈され得る商業的または金銭的関係がない中で研究が行われたことを宣言する。
著者は投稿時にFrontiers誌の編集委員であったことを申告した。このことは、査読プロセスおよび最終的な決定には影響しなかった。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のある製品、またはそのメーカーが主張する可能性のある主張は、出版社によって保証または支持されるものではない。
参考文献
Alexandre, H., Grandvalet, C., Guilloux-Benatier, M., Remize, F., and Tourdot-Maréchal, R. (2008). Les bactéries lactiques en œnologie. パリ、フランス: Lavoisier.
Google Scholar
Augagneur, Y., Garmyn, D., and Guzzo, J. (2007a). Lactococcus lactis subsp. lactisのオキサロ酢酸デカルボキシラーゼ遺伝子の変異は、クエン酸代謝中の生育を阻害する。J. Appl. Microbiol. 104:071010063119003. doi: 10.1111/j.1365-2672.2007.03582.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Augagneur, Y., Ritt, J.-F., Linares, D. M., Remize, F., Tourdot-Maréchal, R., Garmyn, D., et al. Oenococcus oeniにおける外部pHの関数としての有機酸の二重効果。Arch. Microbiol. 188, 147-157.
PubMed要旨|全文|Google Scholar
Bandell, M., Lhotte, M. E., Marty-Teysset, C., Veyrat, A., Prévost, H., Dartois, V., et al. ラクトコッカス(Lactococcus)属およびロイコノストック(Leuconostoc)属における炭水化物およびクエン酸の代謝におけるクエン酸トランスポーターのメカニズム。Appl. Environ. Microbiol. 64, 1594-1600.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Bartowsky, E. J. (2005). オエノコッカス・オエニとマロラクティック発酵 - 分子の領域へ。Aust. J. Grape Wine Res. 11, 174-187. doi: 10.1111/j.1755-0238.2005.tb00286.x.
クロスレフ・フルテキスト|Google Scholar
Bartowsky, E. J., and Henschke, P. A. (2004). ワインの「バターのような」属性-ジアセチル-不味さ、腐敗、そしてその先。Int. J. Food Microbiol. 96, 235-252. doi: 10.1016/j.ijfoodmicro.2004.05.013.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Bekal, S., Diviès, C., and Prévost, H. (1998a). 乳酸菌のクエン酸リアーゼ。doi: 10.1051/lait:199811
クロスレフ・フルテキスト|Google Scholar
Bekal, S., Van Beeumen, J., Samyn, B., Garmyn, D., Henini, S., Diviès, C., et al. Leuconostoc mesenteroidesクエン酸リアーゼの精製とcitCDEFG遺伝子クラスターのクローニングと特性解析。J. Bacteriol. 180, 647-654. doi: 10.1128/JB.180.3.647-654.1998.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bekal-Si Ali, S., Diviès, C., and Prévost, H. (1999). シチCDEF遺伝子座の遺伝子構成とLeuconostoc mesenteroides由来maeおよびclyR遺伝子の同定。J. Bacteriol. 181, 4411-4416. doi: 10.1128/JB.181.14.4411-4416.1999.
クロスレフ・フルテキスト|Google Scholar
Blancato, V. S., Repizo, G. D., Suárez, C. A., and Magni, C. (2008). Enterococcus faecalisのクエン酸遺伝子クラスターの転写制御には、GntRファミリーの転写活性化因子CitOが関与している。J. Bacteriol. 190, 7419-7430.
PubMedアブストラクト|全文|Google Scholar
Bonnin-Jusserand, M. (2011). ワイン乳酸菌のアミン代謝に関する研究。ブルゴーニュ大学(フランス)。
Google Scholar
Bordas, M., Araque, I., Bordons, A., and Reguant, C. (2015). ワイン様培地と赤ワインにおける適応のための選択されたOenococcus oeni遺伝子の発現の違い。Ann. Microbiol. 65, 2277-2285.
クロスレフ・フルテキスト|Google Scholar
Bott, M. (1997). 腸内細菌における嫌気性クエン酸代謝とその制御。Arch. Microbiol. 167, 78-88.
CrossRef 全文|Google Scholar
Campos, F. M., Figueiredo, A. R., Hogg, T. A., and Couto, J. A. (2009). ワインの乳酸菌によるグルコースと有機酸の代謝に及ぼすフェノール酸の影響。Food Microbiol. 26, 409-414. doi: 10.1016/j.fm.2009.01.006.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Cogan, T. M. (1981). Streptococcus lactis subsp. diacetylactisにおけるクエン酸代謝酵素の恒常性。J. Dairy Res. 48, 489-495. doi: 10.1017/S002202990002197X.
CrossRef 全文|Google Scholar
Contreras, A., Ribbeck, M., Gutiérrez, G. D., Cañon, P. M., Mendoza, S. N., and Agosin, E. (2018). 拡張ゲノムスケール代謝モデルを用いたOenococcus oeniのエタノールストレスに対する生理応答のマッピング。Front. Microbiol. 9:291. doi: 10.3389/fmicb.2018.00291
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Crow, V. L. (1990). クエン酸発酵に関連したLactococcus lactis subsp. lactis由来2,3-ブタンジオールデヒドロゲナーゼの特性。Appl. Environ. Microbiol. 56, 1656-1665. doi: 10.1128/aem.56.6.1656-1665.1990
パブコメ抄録|クロスリファレンス全文|Google Scholar
デ・フェリペ, F. L., マグニ, C., デ・メンドーサ, D., ロペス, P. (1994). Lactococcus lactis biovar diacetylactisのクエン酸利用遺伝子クラスター:組織化と発現制御。Mol. Gen. Genet. 246, 590-599.
抄録|全文|Google Scholar
Drider, D., Bekal, S., and Prévost, H. (2004). 乳酸菌におけるクエン酸パーミアーゼの遺伝子組織と発現。Genet. Mol. 3,273-281。
PubMed Abstract|Google Scholar
García-Quintáns,N.、Blancato,V.、Repizo,G.、Magni,C.、López,P. (2008). 「Molecular aspects of lactic acid bacteria for traditional and new applications. Mayo, B.; López, P.; Pérez-Martínez, G. (Kerala, India: Research Signpost), 65-88.
Google Scholar
García-Quintáns, N., Magni, C., de Mendoza, D., and López, P. (1998). Lactococcus lactis subsp. lactis biovar diacetylactisのクエン酸輸送系は酸ストレスによって誘導される。Appl. Environ. Microbiol. 64, 850-857. doi: 10.1128/AEM.64.3.850-857.1998
パブコメ要旨|全文|Google Scholar
Garmyn, D., Monnet, C., Martineau, B., Guzzo, J., Cavin, J.-F., and DiviÃs, C. (1996). Leuconostoc oenos由来α-アセト乳酸脱炭酸酵素をコードする遺伝子のクローニングと塩基配列決定。FEMS Microbiol. Lett. (2)遺伝子発現を解析した結果, α-アセト乳酸脱炭酸酵素をコードする遺伝子の塩基配列を決定した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Grandvalet, C., Assad-García, J. S., Chu-Ky, S., Tollot, M., Guzzo, J., Gresti, J., et al. エタノールおよび酸に適応したOenococcus oeni細胞における膜脂質組成の変化:異種相補によるcfa遺伝子の特徴づけ。微生物学 154, 2611-2619.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Gemelas, L., Degraeve, P., and Demarigny, Y. (2014). ホモおよびヘテロ発酵LABにおけるクエン酸代謝:複雑な生態系において他の微生物よりも優位に立つための選択的手段。doi: 10.4236/fns.2014.510106.
クロスレフ・フルテキスト|Google Scholar
Hugenholtz, J. (1993). 乳酸菌におけるクエン酸代謝。FEMS Microbiol. 12, 165-178. doi: 10.1111/j.1574-6976.1993.tb00017.x.
クロスレフ・フルテキスト|Google Scholar
Julliat, F., Eicher, C., Tourti, N., Glaser, P., Cabanel, N., Coulon, J., et al. Oenococcus oeni 酸耐性の実験的進化は、クエン酸遺伝子座の重要な役割を明らかにした。Res. Microbiol. 174:104048. doi: 10.1016/j.resmic.2023.104048.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kandler, O. (1983). 乳酸菌における炭水化物代謝。Antonie Van Leeuwenhoek 49, 209-224.
CrossRef 全文|Google Scholar
Kang, T. S., Korber, D. R., and Tanaka, T. (2013). 酸化還元電位の維持とATP産生におけるクエン酸の寄与:Lactobacillus panis PM1における代謝経路とその制御。Appl. Microbiol. Biotechnol. 97, 8693-8703.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kim, O. B., Richter, H., Zaunmüller, T., Graf, S., and Unden, G. (2011). Oenococcus oeniによるグルコース輸送における二次トランスポーターとリン酸化酵素系の役割。J. Bacteriol. 193, 6902-6911.
この論文では、オエノコッカス属オエニが、オエノコッカス属オエニから分泌されるオエノースを輸送するための酵素を発見した。
Liu, L., Zhao, H., Peng, S., Wang, T., Su, J., Liang, Y., et al. RNA-Seq によるOenococcus oeni SD-2a 酸ショック応答のトランスクリプトーム解析。Front. Microbiol. 8:1586. doi: 10.3389/fmicb.2017.01586.
CrossRef フルテキスト|Google Scholar
Lolkema, J. S., Poolman, B., and Konings, W. N. (1995). 乳酸菌の代謝エネルギー生成におけるスカラープロトンの役割。J. Bioenerg. Biomembr. 27, 467-473.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Magni, C., de Felipe, F. L., Sesma, F., López, P., and de Mendoza, D. (1994). Lactococcus lactis biovar diacetylactisにおけるクエン酸輸送:プラスミド産生クエン酸パーミアーゼPの発現 FEMS Microbiol. Lett. 118, 75-82. doi: 10.1111/j.1574-6968.1994.tb06806.x
クロスレフ・フルテキスト|Google Scholar
Magni, C., de Mendoza, D., Konings, W. N., and Lolkema, J. S. (1999). Lactococcus lactisにおけるクエン酸代謝のメカニズム:低pHにおける乳酸毒性に対する耐性。J. Bacteriol. 181, 1451-1457. doi: 10.1128/JB.181.5.1451-1457.1999.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Magni, C., López, P., and Mendoza, D. (1996). Lactococcus lactis ssp. lactis biovar diacetylactisのCitPが触媒するクエン酸輸送の特性。FEMS Microbiol. Lett. 142,265-269.doi:10.1111/j.1574-6968.1996.tb08441.x。
クロスレフ・フルテキスト|Google Scholar
Maicas, S., Ferrer, S., and Pardo, I. (2002). NAD(P)H再生はOenococcus oeniにおけるヘキソースのヘテロ乳酸発酵の鍵である。微生物学 148, 325-332.
クロステキスト|Google Scholar
Margalef-Català, M., Araque, I., Bordons, A., Reguant, C., and Bautista-Gallego, J. (2016). Oenococcus oeniのワインストレス条件への適応に関するトランスクリプトームおよびプロテオーム解析。Front. Microbiol. 7:1554. doi: 10.3389/fmicb.2016.01554
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Martell, A. E., and Smith, R. M. (1982). 臨界安定定数: 最初の補足。マサチューセッツ州ボストン: Springer US.
Google Scholar
Martin, M. G., Magni, C., de Mendoza, D., and López, P. (2005). 乳酸菌のクエン酸代謝制御に関与する転写因子CitI. J. Bacteriol. 187, 5146-5155. doi: 10.1128/JB.187.15.5146-5155.2005
パブコメ抄録|クロスリファレンス全文|Google Scholar
Martín, M., Magni, C., López, P., and de Mendoza, D. (2000). Leuconostoc paramesenteroidesのクエン酸発酵に関与する遺伝子をコードするクエン酸誘導性citMCDEFGRPオペロンの転写制御。J. Bacteriol. 182, 3904-3912. doi: 10.1128/JB.182.14.3904-3912.2000
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マルティン, M. G., センダー, P. D., ペイルー, S., デ・メンドーサ, D., マグニ, C. (2004). Lactococcus lactis biovar diacetylactis CRL264のクエン酸リアーゼ複合体をコードするオペロンの酸誘導性転写。J. Bacteriol. この論文では、Lactococcus lactis biovar diacetylactis CRL264のクエン酸リアーゼ複合体をコードするオペロンの転写を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Marty-Tesset, C., Posthuma, C., Lolkema, J. S., Schmitt, P., Divies, C., and Konings, W. N. (1996). ロイコノストック・メセンテロイデス(Leuconostoc mesenteroides)のシトロラクティック発酵によるプロトン起電力発生。J. Bacteriol. 178, 2178-2185. doi: 10.1128/jb.178.8.2178-2185.1996
McKay, L. L., and Baldwin, K. A. (1974). 乳酸脱水素酵素を欠損したStreptococcus lactis C2変異体における代謝の変化。J. Dairy Sci. 57, 181-186. doi: 10.3168/jds.S0022-0302(74)84857-5
パブコメ抄録|クロスリファレンス全文|Google Scholar
McKay, L. L., and Baldwin, K. A. (1990). バイオテクノロジーへの応用:乳酸菌の現在と将来の改良。FEMS Microbiol. Lett. 87, 3-14. doi: 10.1111/j.1574-6968.1990.tb04876.x
パブコメ抄録|クロスリファレンス全文|Google Scholar
ミルズ、D.A.、ローストホーン、H.、パーカー、C.、タミール、D.、マカロワ、K. (2005). Oenococcus oeni PSU-1のゲノム解析とワイン醸造との関連性。FEMS Microbiol. Doi: 10.1016/j.fmrre.2005.04.011.
CrossRef 全文|Google Scholar
Mink, R., Kölling, R., Sommer, S., Schmarr, H.-G., and Scharfenberger-Schmeer, M. (2015). Oenococcus oeniによるワイン醸造中の外因性ピルビン酸誘導によるジアセチル生成。Am. J. Enol. Vitic. 66, 85-90. doi: 10.5344/ajev.2014.14056.
クロスレフ・フルテキスト|Google Scholar
Mink, R., Sommer, S., Kölling, R., Schmarr, H.-G., and Scharfenberger-Schmeer, M. (2014). Saccharomyces cerevisiaeとOenococcus oeniの共培養による醸造中のジアセチル生成の時間経過:醸造中のジアセチル生成。Aust. 20, 194-198. doi: 10.1111/ajgw.12076.
CrossRef 全文|Google Scholar
Monnet, C., Aymes, F., and Corrieu, G. (2000). α-アセト乳酸デカルボキシラーゼを欠損し、乳酸デヒドロゲナーゼ活性が低いLactococcus lactis subsp. lactis biovar diacetylactis変異体によるジアセチルおよびα-アセト乳酸の過剰生産。Appl. Environ. Microbiol. 66, 5518-5520. doi: 10.1128/AEM.66.12.5518-5520.2000.
クロスレフ・フルテキスト|Google Scholar
Mortera, P., Pudlik, A., Magni, C., Alarcón, S., and Lolkema, J. S. (2013). Lactobacillus casei ATCC 334におけるCa 2+ -クエン酸の取り込みと代謝。Appl. Environ. Microbiol. 79, 4603-4612.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nielsen, J. C., and Richelieu, M. (1998). Oenococcus oeniによるマロラクティック発酵中および発酵後のワインの風味発現の制御。Appl. Environ. Microbiol. 65, 740-745. doi: 10.1128/AEM.65.2.740-745.1999.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Olguín, N., Bordons, A., and Reguant, C. (2009). Oenococcus oeniにおけるクエン酸経路の遺伝子発現に及ぼすエタノールとpHの影響。Food Microbiol. 26, 197-203. doi: 10.1016/j.fm.2008.09.004.
PubMedアブストラクト|クロスリード全文|Google Scholar
Olguín, N., Bordons, A., and Reguant, C. (2010). ワイン様条件下におけるOenococcus oeniの挙動を理解するためのアプローチとしての多遺伝子発現解析。Int. J. Food Microbiol. 144, 88-95. doi: 10.1016/j.ijfoodmicro.2010.08.032.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Poolman, B. (1993). 乳酸菌におけるエネルギー伝達。FEMS Microbiol. Rev. 12, 125-147. doi: 10.1111/j.1574-6976.1993.tb00015.x.
クロスレフ・フルテキスト|Google Scholar
Poolman, B., Molenaar, D., Smid, E. J., Ubbink, T., Abee, T., Renault, P. P., et al. マロラクティック発酵:電気的リンゴ酸取り込みとリンゴ酸/乳酸アンチポートが代謝エネルギーを生成する。J. Bacteriol. 173, 6030-6037. doi: 10.1128/jb.173.19.6030-6037.1991.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pretorius, N., Engelbrecht, L., and Du Toit, M. (2019). 合成ワインマトリックス中の異なる乳酸菌株のクエン酸代謝における糖とpHの影響。J. Appl. Microbiol. doi: 10.1111/jam.14401.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Pudlik, A. M., and Lolkema, J. S. (2011a). Lactococcus lactis IL1403におけるクエン酸代謝経路の中間体との交換によるクエン酸の取り込み。J. Bacteriol. 193, 706-714.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pudlik, A. M., and Lolkema, J. S. (2011b). Lactococcus lactis IL1403のオキサロ酢酸デカルボキシラーゼ欠損変異体によるクエン酸代謝のメカニズム。J. Bacteriol. 193, 4049-4056.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qi, Y., Wang, H., Chen, X., Wei, G., Tao, S., and Fan, M. (2021). 代謝戦略の変化:Oenococcus oeniが酸ストレスに応答して採用する精巧なメカニズム。J. Agric. Food Chem. 69, 2906-2918. doi: 10.1021/acs.jafc.0c07599.
クロスレフ・フルテキスト|Google Scholar
Ramos, A., Poolman, B., Santos, H., Lolkema, J. S., and Konings, W. N. (1994). クエン酸代謝におけるアニオン性クエン酸のユニポートおよびプロトン消費は、Leuconostoc oenosにおいてプロトン起電力を生成する。J. Bacteriol. 176, 4899-4905. doi: 10.1128/jb.176.16.4899-4905.1994
パブコメ抄録|全文|Google Scholar
Ramos, A., and Santos, H. (1996). Leuconostoc oenosにおけるクエン酸および糖の共発酵、13C核磁気共鳴法による研究。Appl. Environ. Microbiol. 62, 2577-2585. doi: 10.1128/aem.62.7.2577-2585.1996
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Repizo, G. D., Blancato, V. S., Mortera, P., Lolkema, J. S., and Magni, C. (2013). エンテロコッカス・フェカリス(Enterococcus faecalis)オキサロ酢酸デカルボキシラーゼ複合体の生化学的および遺伝学的特性解析。Appl. Environ. Microbiol. 79, 2882-2890.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Richter, H., Hamann, I., and Unden, G. (2003). Oenococcus oeniのフルクトース発酵におけるマンニトール経路の使用は、エタノール経路の酸化還元再生能力の限界によるものである。Arch. Microbiol. 179, 227-233.
PubMedアブストラクト|クロスリファレンス|Google Scholar
Rozès, N., Arola, L., and Bordons, A. (2003). ワイン由来のOenococcus oeniによるクエン酸と糖の共代謝に及ぼすフェノール化合物の影響。Lett. Appl. Microbiol. 36, 337-341. doi: 10.1046/j.1472-765X.2003.01323.x
パブコメ抄録|全文|Google Scholar
Salou, P., Loubiere, P., and Pareilleux, A. (1994). グルコースとクエン酸またはフルクトースとのコメ代謝におけるLeuconostoc oenosの成長とエネルギー。Appl. Environ. Microbiol. 60, 1459-1466. doi: 10.1128/AEM.60.5.1459-1466.1994.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Salvetti, E., Fondi, M., Fani, R., Torriani, S., and Felis, G. E. (2013). 解糖系とペントースリン酸経路の解析から描かれるラクトバチルス目乳酸菌の進化。Syst. Appl. Microbiol. 36, 291-305. doi: 10.1016/j.syapm.2013.03.009
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sánchez, C., Neves, A. R., Cavalheiro, J., dos Santos, M. M., García-Quintáns, N., López, P., et al. 低pHにおけるLactococcus lactis CRL264の増殖におけるクエン酸代謝の寄与。Appl. Environ. Microbiol. 74, 1136-1144.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Schneider, K., Dimroth, P., and Bott, M. (2000). クエン酸リアーゼの補欠基の生合成。生化学 39, 9438-9450.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sender, P. D., Martín, M. G., Peirú, S., and Magni, C. (2004). リンゴ酸酵素ファミリーに属するオキサロ酢酸脱炭酸酵素の特性。FEBS Lett. 570, 217-222. doi: 10.1016/j.febslet.2004.06.038
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Snoep, J. L., Teixeira de Mattos, M. J., Starrenburg, M. J., and Hugenholtz, J. (1992). Lactococcus lactis subsp. lactis bv.のピルビン酸デヒドロゲナーゼ複合体とα-アセト乳酸合成酵素の単離、特性決定、および生理学的役割。Diacetylactis. J. Bacteriol. 174, 4838-4841. doi: 10.1128/jb.174.14.4838-4841.1992
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Starrenburg, M. J. C., and Hugenholtz, J. (1991). ラクトコッカス属とロイコノストック属によるクエン酸発酵。Microbiol. 57, 3535-3540. doi: 10.1128/aem.57.12.3535-3540.1991.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Sternes, P. R., Costello, P. J., Chambers, P. J., Bartowsky, E. J., and Borneman, A. R. (2017). Oenococcus oeniの全トランスクリプトームRNAseq解析により、ジアセチル代謝に関与する遺伝子を含む、マロラクティック発酵中の特異的発現パターンが明らかになった。Int. J. Food Microbiol. 257, 216-224. doi: 10.1016/j.ijfoodmicro.2017.06.024
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tourdot-Maréchal, R., Gaboriau, D., Beney, L., and Diviès, C. (2000). Oenococcus oeniのストレス細胞の膜流動性。Int. J. Food Microbiol. 55, 269-273. doi: 10.1016/S0168-1605(00)00202-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Unden, G., and Zaunmüller, T. (2009). 「ワインと醪の乳酸菌による糖と有機酸の代謝" in Biology of Microorganisms on grapes, in must and in wine. H. König, G. Unden, and J. Fröhlich (Berlin, Heidelberg: Springer Berlin Heidelberg), 135-147.
Google Scholar
Viljakainen, S. K., and Laakso, S. V. (2000). グルコース、リンゴ酸、クエン酸を含む培地の脱酸のためのマロラクティックOenococcus oeni(ATCC 39401)の使用。Eur. Food Res. Technol. 211, 438-442.
クロスレフ・フルテキスト|Google Scholar
Wagner, N., Tran, Q. H., Richter, H., Selzer, P. M., and Unden, G. (2005). Oenococcus oeniとLeuconostoc mesenteroidesによるピルビン酸発酵と嫌気性発酵におけるピルビン酸脱水素酵素の役割。Appl. Environ. Microbiol. このような背景のもとで、日本農芸化学会は、日本農芸化学会誌「日本農芸化学会誌」を発行した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Yang, X., Zhao, L., Chen, Q., Wang, N., Shi, K., and Liu, S. (2022). ワイン用乳酸菌Lactiplantibacillus plantarumにおけるクエン酸トランスポーター遺伝子の機能検証。Front. Bioeng. Biotechnol. 10:894870.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yang, K., Zhu, Y., Qi, Y., Zhang, T., Liu, M., Zhang, J., et al. 細胞の凍結乾燥耐性に対する酸馴化の分子メカニズムにアクセスするための凍結乾燥Oenococcus oeniのプロテオーム応答の解析。Food Chem. 285, 441-449. doi: 10.1016/j.foodchem.2019.01.120.
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaunmüller, T. (2008). Oenococcus oeniにおけるヘキソースキャリアンの同定とリン酸化酵素の制御. University Johannes Gutenberg-Universität Mainz (Germany) (language = Deutsch).
Google Scholar
Zaunmüller, T., Eichert, M., Richter, H., and Unden, G. (2006). 糖および有機酸での生育過程における、バイオテクノロジーに関連するヘテロ発酵乳酸菌のエネルギー代謝における変動。Appl. Microbiol. Biotechnol. 72, 421-429.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zuljan, F. A., Repizo, G. D., Alarcon, S. H., and Magni, C. (2014). ラクトコッカス・ラクティスのα-アセト乳酸合成酵素は、酸ストレス条件下でのpHホメオスタシスに寄与する。Int. J. Food Microbiol. 188、99-107. doi: 10.1016/j.ijfoodmicro.2014.07.017.
PubMed Abstract|クロスリファレンス全文|Google Scholar
キーワード: 乳酸菌, クエン酸, Oenococcus oeni, 代謝工学, クエン酸遺伝子座, プロトン運動力
引用 乳酸菌のクエン酸代謝:ワインにおけるOenococcus oeniに有益な効果はあるか?Front. Microbiol. 14:1283220.
受理された: 25 August 2023; Accepted: 2023年12月08日;
発行:2024年01月04日
編集者
イラーナ・コロドキン・ガル、ライヒマン大学、イスラエル
査読者
セヴェリーノ・ザーラ(サッサリ大学、イタリア
Maret Du Toit(南アフリカ、ステレンボッシュ大学
Copyright © 2024 Eicher, Coulon, Favier, Alexandre, Reguant and Grandvalet. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣例に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Camille Eicher, camille.eicher@gmail.com; Cosette Grandvalet, cosette.grandvalet@institut-agro.fr
免責事項:本記事で表明されているすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
サトウキビに発生するアピオスポラ病菌に対するBacillus velezensis T9の生物防除能力
Jie Liao、Xuelian Liang、Huiling Li、Leixing Mo、Renfu Mo、Wei Chen、Yuning Wei、Tianshun Wang、Wenyan Jiang
菌類エンドファイトの自然管理への活用:生物防除の観点から
マンサビ・バールドワジ、スワダ・ケイルー、ラビヤ・タバッスム・カーン、ソフィア・シャリーフ・カーン、シャファク・ラスール
「活動への動機付けが必要なのは入居者だけではない」--スウェーデンの支援付き住宅における精神障害者への活動支援に関するスタッフの視点に関する質的研究
Rosita Brolin, Carina Tjornstrand, Mette Friis, Elisabeth Argentzell, Ulrika Bejerholm, Mona Eklund, David Brunt
COVID-19パンデミック時の精神科外来における仮想現実によるリラクゼーション介入の受容性、実現可能性、および利用者の満足度
Annika Humbert,Elisabeth Kohls,Sabrina Baldofski,Carola Epple,Christine Rummel-Kluge
ブルセラ菌(Brucella ovis)において予測された3つの亜鉛排出因子の特性解析により、ZntR-ZntAが病原性には必要とされない強力な亜鉛およびカドミウム排出系であることが明らかになった。
ベアトリス・タルティラン・チョーヤ、カルメン・テヘドール、ラケル・コンデ・アルバレス、ピラール・マリア・ムニョス、ニエベス・ビスカイノ
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
