エピジェネティック修飾因子としてのβ-ヒドロキシ酪酸: そのメカニズムと意義
本文へスキップ記事へスキップ
エルゼビアのロゴ
ヘリヨン
オンラインで入手可能 2023年10月17日, e21098
In Press, Journal Pre-proofこれは何ですか?
総説
エピジェネティック修飾因子としてのβ-ヒドロキシ酪酸: そのメカニズムと意義
https://www.sciencedirect.com/science/article/pii/S2405844023083068
著者リンク オーバーレイパネルを開くYanqiu He a b c d 1, Xi Cheng a b c d 1, Tingting Zhou a b c d 1, Dongze Li a b c d, Juan Peng e, Yong Xu a b c d, Wei Huang a b c d
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.heliyon.2023.e21098
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
要旨
ケトン体の主成分であるβ-ヒドロキシ酪酸(BHB)は、飢餓時のバックアップエネルギー源として、あるいはインスリン欠乏時に糖尿病性ケトアシドーシスを誘導する生理的重要性を有することがこれまでの研究で明らかにされている。ケトン食(KD)は100年以上前から代謝療法として用いられており、ケトン体やBHBがグルコースの代替燃料として役立つだけでなく、ヒストン脱アセチル化酵素(HDAC)やGタンパク質共役型受容体(GPCR)などのいくつかの標的タンパク質に結合することにより、抗酸化作用、抗炎症作用、心保護作用を誘導することがよく知られている。エピジェネティクスの最近の進歩、特に新規のヒストン翻訳後修飾(HPTM)は、BHBの理解を絶えず更新している。BHBはまた、ヒストンアセチル化、ヒストンβ-ヒドロキシブチリル化、ヒストンメチル化、DNAメチル化、マイクロRNAなどの一連のエピジェネティック現象を制御するシグナル伝達分子および修飾基質として作用する。これらのエピジェネティックな現象は、DNA構造を変化させることなく遺伝子の活性を変化させ、さらに関連疾患の発症に関与している。本総説では、心血管疾患、糖尿病および糖尿病の合併症、神経精神疾患、がん、骨粗鬆症、肝障害および腎障害、胚および胎児の発育、腸の恒常性維持におけるBHBの代謝過程とBHBを介したエピジェネティクスに焦点を当て、潜在的な分子メカニズム、創薬標的、および応用の展望について論じる。
キーワード
β-ヒドロキシ酪酸エピジェネティクスヒストン翻訳後修飾ケトジェニックダイエットDNAメチル化マイクロRNA
はじめに
β-ヒドロキシ酪酸(BHB)はケトン体の主成分であり、循環ケトン体プールの約70%を占める。これまでの研究では、生理的な量のBHBは、他のケトン体分子とは対照的に、身体のバックアップエネルギー源として働き、グルコースの供給が不十分であるか、あるいは障害されている場合に、肝外組織(例えば、脳、心筋、骨格筋)にエネルギーを供給することが示唆されている[[1], [2], [3]]が、糖尿病において過剰に生成されたBHBは、インスリン欠乏が起こると糖尿病性ケトアシドーシス(DKD)を引き起こす。体重減少のメカニズムや長期的な糖質制限の安全性についてはまだ議論されているにもかかわらず [4,5]、ケトジェニック食(KD)は100年以上にわたって代謝療法として利用されてきた。ケトン体は、グルコースに代わる補助的な燃料として機能するだけでなく、ヒストン脱アセチル化酵素(HDAC)やGタンパク質共役受容体(GPCR)などのいくつかの標的タンパク質に結合することにより、抗酸化作用、抗炎症作用、心保護作用を誘導することが広く知られている[[6]、[7]、[8]]。しかしながら、その根底にあるメカニズムはよくわかっておらず、他の分子メカニズムがあるかどうかもわかっていない(表1参照)。
表1. ヒト疾患のin vivoおよびin vitroモデルにおけるエピジェネティック修飾因子としてのBHB。
種類 モデル
投与量 エピジェネティック修飾 標的遺伝子/結果 参考文献
In vivo LPS誘発マウス(敗血症性心筋症) 1,3-ブタンジオール(3 mg/g/日)経口投与 H3K9ac LVEF↑, FS↑, CO↑, SOD↑, 血漿CK-MB↓, 血漿LDH↓, MDA↓ [56].
KKAy マウス(肥満、糖尿病) ダパグリフロジン(0.02 mg/mL) 自由摂取 H3K9bhb アディポネクチン↑、血漿インスリン↓、 HbA1c↓、血漿レプチン↓ [58]
STZ 誘発ラット(糖尿病) BHB(160, 200, 240 mg/kg/day)を i.h. 投与 H3K14ac クローディン-5↑, 微小血管透過性↓ [59].
STZ 誘発ラット(糖尿病) BHB(160, 200, 240 mg/kg/日):i.h.投与 H3K9bhb MMP-2↑, 血清クレアチニン↓, 尿蛋白↓, コラーゲンIV↓ [62].
STZ誘発ラット(糖尿病) BHB(160, 200, 240 mg/kg/日)をi.h. 投与 H3K9bhb NO↑、VEGF↑ [63]
ピロカルピン誘発発作ラット 時間制限摂食(20時間/日) H3K9ac、
H3K14ac P-AMPK↑、P-Akt↓ [66]
ピロカルピン誘発てんかんラット、ペンチレネテトラゾール誘発キンドリングマウス KD DNAメチル化 アデノシン↑、5-メチルシトシン↓ 【44
デキサメタゾン、空間拘束ストレス誘発性うつ病マウス BHB (300 mg/kg/日)を経口投与 H3K9bhb BDNF↑ [71] C57BL/6Jマウス
C57BL/6J マウス BHB (60 mg/kg、1 日 1 回) 経口投与 H3K27me3, H3K4me3 BDNF↑ [39,40] C57BL/6J マウス BHB (60 mg/kg、1 日 1 回) 経口投与 H3K27me3, H3K4me3 BDNF↑ [39,40
C57BL/6Jマウス 絶食(48時間) H3K9bhb 血漿中FFAs↑、肝TG↑、Irs2↑、 Sgk1↑、Adcy9↑、Idh2↑、 Sult1a1↑、Hmgcs2↑、 皮下脂肪↓、P-Akt↓、PS6↓ [72]
APP/PS1ダブルトランスジェニックマウス(アルツハイマー病) 交互空腹 H3K9ac, H4K12ac, miR-29a LPL↓ [78]
C5 ヘミコンチュージョン傷害 ラット KD; 隔日絶食; 隔日 KD H3K9ac, H3K14ac FOXO3a↑, Mt2↑, Mn-SOD↑, カタラーゼ↑, MDA↓ [79] 肝細胞癌
肝細胞癌マウス BHB (100 mg/kg/日)を i.p.投与 Kac Cleaved caspase3/8↑, Survivin↓ [84]
肝 IRI マウス 絶食(12 時間);
血清ALT↓、血清HMGB1↓、切断カスパーゼ3↓、 IL-6 ↓、IFNγ↓、TNF-α↓、 IL-1β↓、NLRP3↓、4-HNE↓、Bcl-2↑、 FOXO1↑、HO-1↑、LC3B↑ [95
腎臓 IRIラット KD Kac 血漿TG↓、血漿BUN↓、血漿クレアチニン↓、HSP70↓、p50↓、FN↓、α-SMA↓、8-OHdG↓、3-NT↓、4-HNE↓、TNF-α↓、IL-6↓、MCP-1↓、GPx↑、SOD↑ [97]
ハン:SPRDラット、PKD1マウス、
猫 ADPKD(多発性嚢胞腎) 時間制限摂食(8時間/日); KD; 急性絶食(24時間、48時間);
BHB(157.5mM)を自由摂取 記載なし 血清クレアチニン↓、切片あたりの嚢胞↓、嚢胞サイズ↓、SMA↓、Ki-67↓、P-AMPK↑、CPT1α↑↑ [98]
ダール食塩感受性ラット(高血圧) 1,3-ブタンジオール(20 %)自由飲用 記載なし 血清 Na+/K+比↓、血清マイクロアルブミン↓、 NLRP3↓、カスパーゼ1↓、 IL-18↓、IL-1β↓、LCN2↓、 Hif1α↓、Serpine1↓ [100]
腸上皮細胞のHmgcs2を条件付きで欠失させたマウス 摂食(24時間);絶食(24時間) H3K9bhb Hmgcs2↓, Fabp1↓, Acox1↓, Acox2↓ [111].
In vitro ラット心筋(H9C2)細胞 BHB (5 mM) H3K9ac FOXO3a↑, Mt2↑, SOD2↑, ROS↓ [56].
マウス脂肪細胞(3T3-L1) BHB(10 mM) H3K9bhb アディポネクチン↑、MCP-1↓、 PAI-1↓、IL-6↓、TNF-α↓ [58]
ヒト心臓微小血管内皮細胞(HCMECs) BHB(2 mM) H3K14ac クローディン-5↑ [59]
ラット初代心筋細胞 BHB (0.1, 0.3, 1, 3, 10 mM) Kac Trx1↑, P-S6K↑, P-4EBP1↑, P-ACC↑ [61] マウス初代皮質神経細胞 BHB (0.1, 0.3, 1, 3, 10 mM) H3K14ac Claudin-5↑ [59
マウス一次皮質ニューロン細胞 BHB(5, 10, 20 mM) H3K9bhb BDNF↑ [71]
マウス海馬ニューロン(HT22)細胞、ラット一次海馬ニューロン細胞 BHB (2 mM) H3K27me3, H3K4me3 BDNF↑, P-CREB↑, P-CAMKII↑, JMJD3↑ [39] [40
[40]
ヒト神経芽腫(SH-SY5Y)細胞 BHB (5 mM) H3K9ac, H4K12ac TrkA↑ 【77
ラット副腎褐色細胞腫(PC12)細胞 BHB(1, 5, 20 mM) H3K9ac, H3K14ac カタラーゼ↑、Mn-SOD↑、 FOXO3a↑、Nox2/4↓、活性酸素↓ 【80
ヒト肝細胞がん(HepG2、HLE)細胞 BHB(10 mM) H3ac 修飾カスパーゼ3/8↑、サバイビン↓ [84] ヒト肝細胞がん(HepG2、HLE)細胞 BHB(10 mM) H3ac 修飾カスパーゼ3/8↑、サバイビン↓ [84
ヒト肝細胞がん(PLC-PRF-5)細胞 BDH1(ノックアウト) H3K9bhb JMJD6↑、GREB3↑、GTPBP4↑、NPM1↑、TIMM23↑ 【85
MCT2発現ヒト乳がん細胞 BHB(1, 5, 10, 20 mM) H3K9ac L-1β↑, LCN2↑ [86]
マウス骨髄由来マクロファージ(BMDM) BHB(2, 4, 6 mM) Kac NFATc1↓、TRAF6↓、c-Fos↓、TRAF2↓ 【93
BHB (20 mM) H3K27bhb グルコース消費↓、
解糖系フラックス↑ [107]
ウシ接合体 BHB (6 mM) H3K9ac FOXO3a↑ [28]
マウスTE細胞 BHB (2 mM); AcAc (0.8 mM) H3K27ac グルコース消費↑, 解糖系フラックス↓, 胎児発育速度↓ [108] ウシ卵丘細胞 BHB (6 mM); AcAc (0.8 mM) H3K9ac FOXO3a↑ [28
ウシ卵丘細胞 BHB (2, 4, 6 mM) H3K9bhb COX1↑, COX2↑, ATP8↑, IGF1R↑, SMAD4↑ [109] ↑:アップレギュレーション;AcAc (0.8 mM) H3K27ac
↑はアップレギュレーション、↓はダウンレギュレーション。
エピジェネティクスとは、塩基配列の変化を伴わない、遺伝的な遺伝子発現や細胞表現型の変化であり、ゲノムと環境がどのように相互作用するかを制御するもので、ヒストン翻訳後修飾(HPTM)、DNAメチル化、ノンコーディングRNAなどが含まれる[9]。HPTMはエピジェネティクスの文脈でますます重要性を増しており、クロマチンのコンフォメーションに影響を与えて遺伝子発現を変化させる。高感度質量分析計の応用により、現在観測されているHPTMのカタログは膨大なものとなり、その数は増え続けている[10,11]。HPTMには、ヒストンのアセチル化(Kac)、メチル化(Kme)、リン酸化、ユビキチン化に加え、プロピオニル化、ブチリル化、クロトニル化、β-ヒドロキシブチリル化(Kbhb)などの新しい修飾も含まれ、これらの異なるHPTMは、動的かつ可逆的な制御プロセスにおいて、互いに、またDNAメチル化と相互作用することができる[12,13]。最近のエピジェネティクスの進歩により、BHBについての理解が絶えず更新されている。内因性低分子であるBHBは、エネルギー代謝産物としてだけでなく、Kme、Kac、Kbhbといった一連のエピジェネティック現象を制御し、遺伝子の転写や細胞機能を外部環境に結びつけるシグナル伝達分子や修飾基質としても考えられている。本総説では、心血管疾患、糖尿病および糖尿病の合併症、神経精神疾患、がん、骨粗鬆症、肝障害および腎障害、胚および胎児の発育、腸の恒常性維持におけるBHBの代謝過程およびBHBを介したエピジェネティクスに焦点を当て、考えられる分子メカニズム、潜在的な創薬標的、および応用の展望について議論する。この総説の目的は、BHBのエピジェネティックなメカニズムの概要を提供することではなく、読者を現在の研究上の関心分野へと導くことである。
BHBの代謝、制御および機能
ケトン合成は主に肝臓のミトコンドリアマトリックスで起こる。脂肪酸はまず、ミトコンドリアのβ酸化によってアセチルCoA(Ac-CoA)に代謝される、 そして、3-ヒドロキシ-3-メチルグルタリル-CoA合成酵素2(HMGCS2)がAc-CoAとアセトアセチルCoA(AcAc-CoA)を縮合して3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)となり、HMG-CoAリアーゼ(HMGCL)によってアセト酢酸(AcAc)が遊離される。その大部分はβ-ヒドロキシ酪酸デヒドロゲナーゼ1(BDH1)を触媒とするNAD+/NADH共役平衡反応によってBHBに変換され [14]、少量のAcAcは自然に脱炭酸してアセトンになる。哺乳動物では、ケト生成は主に肝臓で起こるが、HMGCS2の異常発現は他の組織でのケト生成に十分であり[[15]、[16]、[17]、[18]]、中でも腎臓が最も懸念される。しかし、絶食時には、内因性循環ケトンの産生に関与するのは肝臓だけである[19]。したがって、肝外組織におけるHMGCS2の機能とそのケトン生成作用を理解するためには、さらなる研究が必要である。
AcAcとBHBは、モノカルボン酸トランスポーター(MCT1と2)によって細胞膜から放出され、肝外臓器に輸送されるが [20]、ケトン体がミトコンドリア内膜をどのように通過するかは不明である。最も多く循環しているケトン体はBHBであり、BHBはAcAcよりもアセトンに自然分解しにくい。BHBが標的組織に吸収されると、BDH1によってAcAcに変換される。AcAcは3-オキソ酸CoA転移酵素(SCOT)によってAcAc-CoAとして活性化されるが、この酵素は肝細胞を除くミトコンドリアを含むすべての哺乳類細胞に発現しているため、肝臓ではBHBをエネルギーとして利用することができない。これは哺乳類で起こる数少ない平衡に近い反応の一つである。AcAc-CoAの加水分解は、スクシニル-CoAよりも多くの自由エネルギーを放出するので、AcAcの生産に有利である。2分子のAc-CoAは可逆的アセチル-CoAアセチルトランスフェラーゼ(ACAT)反応によって産生され、酸化のエネルギー源としてTCAサイクルに入るか、脂質合成に使われる。
GPR109AとGPR41は短鎖脂肪酸と結合する2つのGPCRであり、BHBはこれら両方のGPCRのリガンドである。BHBはGPR109Aを活性化して脂肪細胞における脂肪分解を抑制し、ケトアシドーシスを回避し、脂肪の有効利用を促すことが示された [21] 。脂肪細胞、単球、マクロファージ、血管内皮細胞など多数の細胞タイプがGPR109Aを発現している。GPR109Aを活性化することにより、特定量のBHBは免疫細胞誘発性の炎症およびアテローム性動脈硬化症を予防することができる [22,23]。最近の研究では、BHBがGPR41に拮抗することで交感神経の活動を抑制し、エネルギー消費を調節することが示されており、これはGβγ-PLCβ-MAPKシグナル伝達経路に関連している可能性がある [24] 。GPR41は、β細胞によるインスリン分泌を阻害し、体内のグルコースホメオスタシスを維持する役割を果たしていることが明らかにされた [25]。したがって、BHBは内因性GPCRリガンドとして、炎症性疾患、神経疾患、代謝性疾患において重要な役割を果たしている。
BHBはエピジェネティック現象を制御する
BHBは、空腹時や運動時に肝臓から末梢組織へエネルギーを運搬する役割を果たすと考えられている。図1に示すように、BHBはシグナル伝達分子および修飾基質としても作用し、Kme、Kac、Kbhb、マイクロRNAなどの一連のエピジェネティック現象を制御し、遺伝子の転写レベルに影響を与えることが、多くの研究によって明らかにされつつある。
図1
ダウンロード 高解像度画像ダウンロード(613KB)
ダウンロード フルサイズ画像のダウンロード
図1. BHBはエピジェネティクスを制御する。
ケトジェニック食(KD)、交互1日絶食(ADF)、時間制限摂食(TRF)、絶食、糖尿病性ケトアシドーシス(DKA)、SGLT-2阻害薬はBHB濃度の上昇を引き起こす。ミトコンドリアにおけるBHBの代謝はAc-CoAを増加させ、このAc-CoAはヒストンアセチルトランスフェラーゼ(HAT)の基質として核に輸送され、Kacを促進する。BHBはまた、ヒストン脱アセチル化酵素(HDAC)を直接阻害し、Kacを増加させる。しかし、BHB代謝中にNAD+が過剰になるとサーチュインが活性化され、Kacが減少する。BHBはアシル基転移酵素P300のもとで、アシル-CoA合成酵素2(ACSS2)により触媒されてBHB-CoAを生成し、Kbhbを促進すると考えられる。BHBは直接的にはcAMP/PKAシグナルを介してKmeを促進するが、間接的にはヒストン脱メチル化酵素JMJD3の発現を高めることによってKmeを阻害する。BHBはDNAメチルトランスフェラーゼ(DNMT)を阻害することによりDNAのメチル化を阻害する。さらに、BHBはマイクロRNAをアップレギュレートし、遺伝子発現に影響を与える。これらのBHBが制御するエピジェネティック効果は、酸化ストレス、炎症、線維症、腫瘍、神経生物学関連のシグナル伝達の制御に関与している。点線」はその過程をさらに検証する必要があることを意味し、実線はその過程が証明されたことを意味する。
3.1. ヒストン脱アセチル化酵素阻害
HPTMはエピジェネティクスの文脈でますます重要性を増しており、クロマチンのコンフォメーションに影響を与えて遺伝子発現を変化させる。BHBは、内因性および特異的なクラスIおよびIIa HDAC阻害剤を含む競合的酵素阻害剤として作用し、Kacを増加させ、DNA-ヒストン結合を弱め、クロマチン構造をゆるめ、転写を活性化することが知られている。はじめに、浸透圧ポンプでBHBをマウスに投与すると、腎臓のヒストン、特にヒストン3の9番と14番のリジン(H3K9/K14)が過剰にアセチル化された。BHBは、ヒト胚性腎臓293(HEK293)細胞のFOXO3aおよびMt2プロモーター上のKacを増加させ、さらにHDAC1またはHDAC2を阻害することによってこれらの遺伝子の発現を増加させたことから、HDAC阻害剤としてのBHBの直接的な役割が示唆された[26]。これはエピジェネティック修飾因子としてのBHBの最初の報告である。しかしながら、他の実験では、BHBはHDAC活性を阻害することは検出されず、in vitroでKacレベルを増加させることもなかった[27,28]。おそらく、HDAC阻害剤としてのBHBを再評価するには、さらに多くの実験が必要であろう。さらに、NF-κB、TP53、p53、c-Myc、MyoDのような非ヒストンタンパク質もHDACによって脱アセチル化される[[29]、[30]、[31]、[32]。BHBのAc-CoAへの変換は、ミトコンドリア内のAc-CoAレベルを増加させることができ、ミトコンドリアからのAc-CoAの出力は、主にクエン酸合成酵素(CS)とATP-クエン酸リアーゼ(ACLY)によって媒介される[33]。増加したAc-CoAは、ヒストンアセチルトランスフェラーゼ(HAT)の基質として核に輸送され、平衡反応をKacに向かわせる。一方、1分子のBHBから2分子のAc-CoAを代謝する場合、2分子のNAD+がNADHに変換されるだけであり、グルコース代謝に比べて使用されるNAD+分子が少ない。KDはNAD+の過剰を引き起こし、脱アセチル化に関与するNAD+依存性酵素(サーチュインを含む)の活性を調節する。要約すると、BHBはAc-CoAとNAD+の濃度を通して間接的にKacレベルにも影響を与える。
3.2. ヒストンβ-ヒドロキシブチリル化
Yingming Zhao教授の研究チームは、Kbhbマーカーが長期絶食またはストレプトゾトシン(STZ)によって誘発されたDKAマウスの肝臓で有意に誘導され、Kbhbレベルが細胞内のBHB濃度によって調節されることを最初に報告した。クロマチン免疫沈降(ChIP)-seqおよびRNA-seq解析により、Kbhbは活性遺伝子プロモーターに濃縮されたマーカーであることが示され、飢餓時のH3K9bhbレベルの増加は、飢餓に応答する代謝経路の遺伝子のアップレギュレーションと関連しており、不十分なエネルギー供給によって引き起こされる代謝の変化に対する身体の素早い適応を助けていた[34]。しかしながら、その後の研究で、腫瘍抑制タンパク質p53のKbhbは、p53 Kacのレベルと活性を著しく低下させ、がん細胞の増殖を促進することがわかった[35]。このように、Kbhbの生物学的機能は過小評価されるべきではない。修飾そのものは遺伝子発現をアップレギュレートし、間接的に他の修飾レベルを調節することができる。多くのアシル-CoA酵素は、酪酸やクロトン酸が対応するCoA誘導体に変換されるのと同様に、アシル-CoA合成酵素2(ACSS2)によって、その相同短鎖脂肪酸(SCFA)から誘導することができる[36,37]。しかしながら、ACSS2がBHBからBHB-CoAへの変換のメディエーターであることは確認されておらず、今後の研究によってさらに確認する必要がある。in vivoでもin vitroでも、アシルトランスフェラーゼp300はKbhbを触媒して下流の転写を促進し、HDAC1とHDAC2は酵素活性によってKbhbの除去を媒介した。HEK293細胞のKbhb修飾オミックスによって、1397個のタンパク質上の3248の修飾部位が同定され、主要な制御酵素("Writer"、"Reader"、"Eraser")とタンパク質の基質が明らかになった。これにより、様々な生物学的プロセスにおけるKbhbの機能を調べるための基礎が確立された[38]。したがって、新たに発見されたエピジェネティックなマークとして、Kbhbは代謝と遺伝子発現を組み合わせ、ヒトの重要な病態生理学的状態におけるクロマチン制御とBHBの様々な機能を探求する新しい方法を提供する。
3.3. ヒストンのメチル化
Kmeに対するBHBの効果に関する情報の一部は、脳由来神経栄養因子(BDNF)の転写制御から得られている。BHBはH3K27me3特異的脱メチル化酵素JMJD3の発現を増加させ、BDNFプロモーター上のH3K27me3結合を減少させた [39]。さらに、BHB処理後にBDNFプロモーター上のH3K4me3の濃度が上昇したことから、H3K4me3がBHBによって刺激されるBDNFの発現増加に関与していることが示され[40]、H3K27me3との相乗効果が考えられる。どちらもBDNFの転写を活性化または抑制的に直接制御し、cAMP/PKAシグナル伝達経路の活性化に依存していた。おそらく、メチル化状態に対するBHBの効果は、グリシンとともにS-アデノシルメチオニン(SAM)の合成に必要なAc-CoAプールにも関係しているのかもしれない[41]。このことは、今後の研究課題であることがわかる。
3.4. DNAメチル化
食事パターンの変化は、主要な代謝遺伝子のメチル化パターンを変化させ、それによってその発現を制御することができる [42]。エピゲノム配列解析により、慢性てんかんのラットでは海馬のDNAメチル化レベルが有意に上昇していることが示された。ケトジェニック高脂肪低炭水化物食を投与したところ、てんかん発作の進行が抑制され、DNAメチル化を介した遺伝子発現の変化が改善された。複数の研究により、これらの効果はBHBによる海馬アデノシンの増加に関連している可能性が示されている [44,45]。アデノシンの増加はS-アデノシンホモシステイン(SAH)の形成を促進し [46]、その結果DNAメチル化酵素(DNMT)が阻害され [47]、DNAメチル化レベルが低下し [46,48]、さらにメチオニンサイクルにも影響を及ぼす。これらの知見は、てんかんに関連するDNAメチル化変化の生物学的意義を証明するものである。
3.5. マイクロRNA
マイクロRNAは、標的遺伝子mRNAの3′-非翻訳領域(3′-UTR)と対になり、mRNAの安定性を切断または破壊し、真核生物遺伝子の転写後発現を阻害する、新しいクラスの短い(約22ヌクレオチド)非コードRNAである[49,50]。カロリー制限モデルマウスでは、miR-16-5p、miR-196b-5p、miR-218-5pの血清レベルが上昇し、脾臓、胸腺、結腸、胃におけるmiR-16-5pの発現レベルがかなり上昇した。注目すべきことに、miR-16-5pは炎症性サイトカインを抑制したことから、カロリー制限中のマイクロRNAレベルの変化が免疫恒常性を維持し、炎症を制御している可能性が示唆された [51]。ヒトのボランティアを対象とした研究では、KDを受けた患者は、栄養代謝やmTOR、PPAR、インスリン、サイトカインシグナル伝達経路に関与する特定の遺伝子のマイクロRNA制御を示した [52]。研究チームはまた、肥満の参加者は抗酸化および抗炎症シグナル伝達経路に関連するマイクロRNAのレベルが変化していたが、KDを終了するとこれらのレベルは正常レベルに回復することも発見した[53]。これらの結果は、マイクロRNAがエピジェネティックなメカニズムとして遺伝子発現を制御していることを示唆しているが、さらに多くの研究によって確認される必要がある。
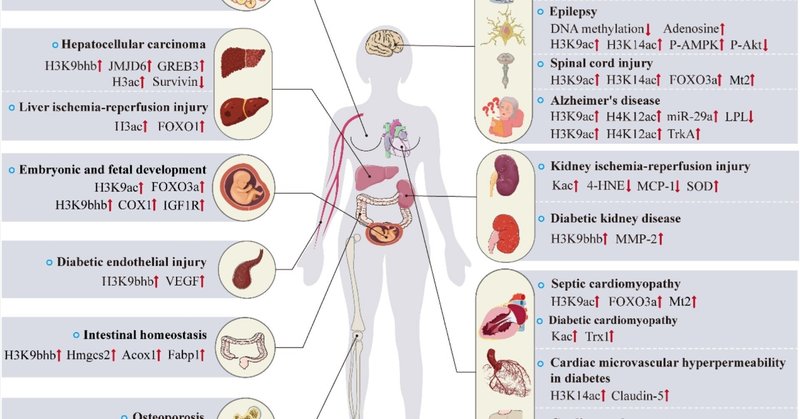
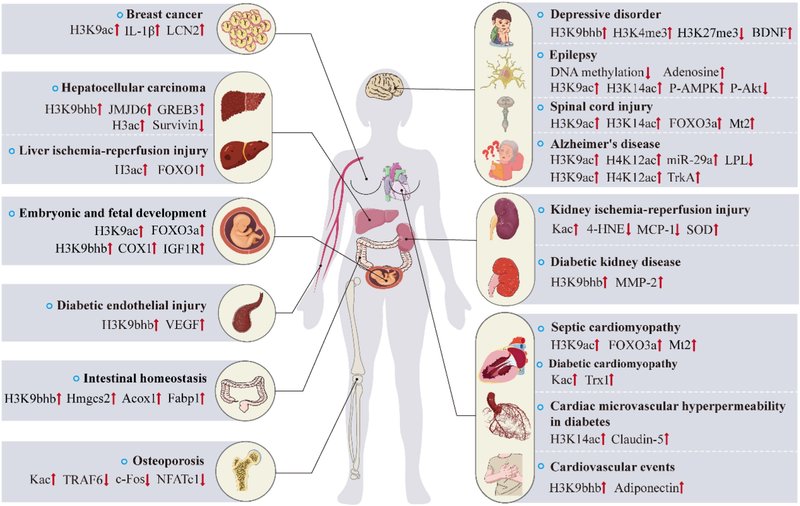
疾患および治療におけるエピジェネティック修飾因子としてのBHB
図2に示すように、BHBがエピジェネティック調節分子として、心血管疾患、糖尿病合併症、精神神経疾患、がん、骨粗鬆症、肝臓・腎臓障害、胚・胎児の発育、腸の恒常性維持などの病態や治療に重要な役割を果たしていることが、これまでの研究で明らかになっている。次に、分子メカニズムを個別に説明する。
図2
ダウンロード 高解像度画像ダウンロード(882KB)
ダウンロード フルサイズ画像のダウンロード
図2. BHBが制御するエピジェネティクスと疾患発症・治療における標的遺伝子の概要。
BHBはエピジェネティック修飾因子として、一方では、遺伝子のプロモーター領域におけるヒストンの翻訳後修飾、あるいはDNAメチル化やマイクロRNAによって標的遺伝子の転写を制御し、疾患関連シグナル経路の伝達に影響を与える。一方、BHBを介したエピジェネティクスはクロストークに存在し、心血管疾患、糖尿病合併症、中枢神経系疾患、癌、骨粗鬆症、肝臓・腎臓虚血再灌流障害、胚・胎児発育、腸の恒常性などにおいて、遺伝子の転写制御に共同で影響を及ぼしている。
略語 ↑はアップレギュレーション、↓はダウンレギュレーション、IL-1β、インターロイキン-1β、LCN2、リポカリン2、FOXO1、フォークヘッドボックスO1、FOXO3a、フォークヘッドボックスクラスO3a、IGF1R、インスリン様成長因子1受容体; VEGF、血管内皮成長因子;Acox1、アシル-コエンザイムAオキシダーゼ1;Fabp1、脂肪酸結合タンパク質1;TRAF6、腫瘍壊死因子受容体関連因子6;NFATc1、T細胞細胞質1; BDNF、脳由来神経栄養因子;P-AMPK、リン酸化-AMP活性化プロテインキナーゼ;P-Akt、リン酸化プロテインキナーゼB;Mt2、メタロチオネイン2;LPL、リポタンパク質リパーゼ;TrkA、チロシンキナーゼ受容体A; 4-HNE、4-ヒドロキシノネナール;SOD、スーパーオキシドジスムターゼ;MCP-1、単球走化性タンパク質1;MMP-2、マトリックスメタロプロテアーゼ-2;Trx1、チオレドキシン1;JMJD6、十文字ドメイン含有6;COX1、チトクロームcオキシダーゼサブユニット1。
4.1. 心血管疾患
ケトン体、主にBHBは、心臓血管系の重要な調節因子として浮上しており、「エネルギーに乏しい」人に追加のATP産生の重要な供給源を提供するだけでなく、心臓における抗酸化ストレスと別のシグナル経路による保護作用を促進する [54] 。BHBは活性酸素種(ROS)の産生を阻害し、酸化ストレスによって誘導されるアポトーシスを緩和する [55]。敗血症性心筋症の病理学的プロセスを模倣するために使用されたリポ多糖(LPS)-刺激マクロファージ-コンディショニング培地では、BHBがHDACを阻害し、H3K9acレベルを高め、抗酸化FOXO3a/Mt2経路を活性化し、活性酸素の産生を防止し、敗血症性心筋症におけるミトコンドリア保護を提供することが示された [56]。ナトリウム/グルコース共輸送体2(SGLT-2)阻害薬が心血管イベントを減少させるメカニズムは完全には解明されていないが、血糖コントロールの改善、体重、血圧、血清尿酸の減少などが含まれる。これらの要素に加えて、SGLT-2阻害薬の治療効果は血清BHBレベルの上昇に関係していることが示唆されている[57]。研究により、ダパグリフロジンは血漿および脂肪のBHB濃度を上昇させ、3T3-L1脂肪細胞におけるアディポネクチン濃度をアップレギュレートすることが明らかになった。そのメカニズムは、KacやKmeとは無関係に、アディポネクチンによるH3K9bhbの発現誘導を介して、心臓において保護的な役割を果たしているのかもしれない[58]。
4.2. 糖尿病と糖尿病の合併症
STZ誘発糖尿病モデルラットにおいて、異なる濃度のBHBはクローディン-5の産生を促進し、その機能不全は糖尿病の微小血管透過性亢進につながる。BHBはまた、ヒト心臓微小血管内皮細胞(HCMEC)の透過性亢進にも拮抗した。In vitroでは、HCMECにおけるHDAC3の発現阻害は、クローディン-5プロモーターにおけるH3K14ac濃度の特異的上昇を誘導し、クローディン-5の転写を活性化した。注目すべきことに、高グルコース群ではH3K9ac濃度が低下していたが、BHB処理はH3K9ac濃度には有意な影響を及ぼさなかった[59]。酸化ストレスの増加とミトコンドリア機能障害は、糖尿病性心筋症の進行の主な原動力である [60]。BHBは、用量および時間依存的にThioredoxin1(Trx1)をアップレギュレートし、Kacを誘導し、心筋細胞の抗酸化防御能を増強し、糖尿病性心筋症を保護した[61]。BHB投与は、糖尿病ラットの血清クレアチニン、24時間尿蛋白、糸球体の形態変化を緩和し、コラーゲンIV含量を減少させた。その機序は、BHBがマトリックスメタロプロテアーゼ-2(MMP-2)プロモーターにおけるH3K9bhbレベルをアップレギュレートし、MMP-2の発現を増強することであることが示された[62]。さらに、このチームは、適切な濃度のBHBがH3K9bhbレベルをアップレギュレートすることにより、糖尿病ラットの大動脈内皮傷害に拮抗し、血管内皮増殖因子(VEGF)の産生を促進することも報告している[63]。
4.3. 神経障害
現在までに、KD食やカロリー制限食などの代謝に基づく治療法には抗けいれん作用があり [64,65] 、てんかんの代謝代替療法として利用できることが様々な報告から示唆されている。時間制限摂食(TRF)は、哺乳類の覚醒期の短期間に食物の供給を制限する栄養チャレンジである。てんかん重積状態を誘発するリチウム-ピロカルピンモデルにおいて、TRFはBHB濃度を有意に増加させ、HDAC活性を阻害し、H3K9acとH3K14acの増加とクロマチン構造の変化をもたらし、抗けいれん作用をもたらす遺伝子のサブセットの転写を促進した [66] 。さらに、KD療法がDNAメチル化にエピジェネティックな影響を及ぼすという証拠も増えている。最近の研究では、KD療法はアデノシンを増加させ、DNAメチル化レベルを低下させることにより、疾患の進行を予防することが示された。注目すべきことに、KD療法によるDNAメチル化のダウンレギュレーションは、食事療法中止後も持続した [44]。これらの所見から、KD療法はアデノシン依存的なDNAメチル化調節を介して抗てんかん作用を発揮すると考えられる。
てんかんの治療における使用に加えて、BHBは精神病性疾患 [67,68] において神経保護的な役割を果たし、うつ病 [69] に対して抗うつ効果があることが実証されている。抗うつ薬は、うつ病性障害患者において低下したBDNFレベルを回復させることができる [70] 。内因性BHBとH3K9bhbはうつ病マウスの脳で減少し、外因性BHBはH3K9bhbレベルを直接増加させた。この修飾はBDNFのプロモーターを活性化し、mRNAとタンパク質レベルの発現を誘導した [71]。また、BHBによるH3K4me3とH3K27me3の誘導は、BDNFの転写を活性的または抑制的に直接制御し、プロモーターの占有とBDNFの発現を導くことが研究で示されている[39,40]。さらにCornutiらは、絶食マウスの大脳皮質でH3K9bhb含量が有意に増加していることを発見した。ChIP-seqやRNA-seqによって、H3K9bhbが絶食による遺伝子発現に関連するエピジェネティックマーカーであることが確認され、制御された遺伝子は脳組織の代謝だけでなく、シナプス伝達や可塑性経路にも関与している。エピジェネティックなレベルでも転写レベルでも、最も豊富な機能アノテーションのひとつが「概日リズム」であった。中核時計遺伝子(Per1、Cry1、Cry2、Bmal1など)の発現は、視覚野と視交叉上核において絶食によって変化することが観察され、絶食は運動リズムの正常な発達も阻害した。興味深いことに、これらの遺伝子の皮質発現には、再摂食後の対照群と比較して変化は認められなかった。このように、BHBは神経組織において直接的かつ特異的なヒストンマーカーを通じて、強力なエピジェネティック分子的役割を果たすことが示唆された [72]。
さらに、神経疾患は予防や治療にBHBを用いることで恩恵を受ける可能性がある [73,74]。アルツハイマー病(AD)の複雑な病因の重要な要素の一つは、βアミロイドペプチド(Aβ)の沈着である[75,76]。本研究では、ヒト神経芽細胞腫(SH-SY5Y)細胞において、BHBがAβ誘発神経毒性に対する保護機能を有することが実証された。その根底にあるメカニズムは、H3K9acとH4K12acレベルのアップレギュレーション、ADにおけるコリン作動性ニューロンの保護に重要なチロシンキナーゼ受容体A(TrkA)の発現の増加に関連している可能性がある [77]。別の研究では、交互日絶食(ADF)もまた、APP/PS1二重トランスジェニックADマウスモデルにおいて、皮質のH3K9acとH4K12acレベルを増加させ、脳由来リポ蛋白リパーゼ(LPL)の発現を減少させた。試験管内で行われた研究では、miR-29aがLPLの制御に必須であり、その一端はBHBを介してその発現を抑制することによることがわかった。miR-29aの発現に対するBHBの影響は、HDAC2/3と関連している可能性がある。
脊髄損傷(SCI)は通常、長期にわたる神経学的障害をもたらすが、SCIを標的とし、身体的リハビリテーション以上の機能回復を促進する臨床的に証明された治療法は今のところない。しかし、Wangらは、KD、1日おきの絶食(EODF)、および1日おきのKD(EODKD)を摂取させると、血清および脳脊髄液中のBHB濃度が有意に上昇し、H3K9acおよびH3K14acの発現が増加し、抗酸化ストレスタンパク質であるFOXO3aおよびMt2、ならびに関連タンパク質の発現が増加することを発見した[79]。さらに、研究チームは、ラットのSCI後のラット副腎褐色細胞腫(PC12)細胞において、BHBがHDAC活性を低下させ、H2O2誘導活性酸素産生を減少させたことを報告した [80]。
4.4. がん
KDは膠芽腫の補助療法として、また前立腺がん、結腸がん、膵臓がん、肺がんの予防にも使用されている [81,82]。グルコースは腫瘍細胞の主要なエネルギー源である。酸素の存在下でも、腫瘍細胞は急速な増殖の必要性を満たすために解糖を行う。これは「ワールブルグ効果」として知られている。したがって、KDは悪性細胞におけるグルコース代謝とグルコース依存性シグナル伝達の両方に影響を及ぼし、循環グルコースレベルの低下がKDの抗腫瘍効果の重要な理由であると思われる [83]。しかしながら、ケトン体の主成分であるBHBは、主にHDAC阻害剤としての役割により抗腫瘍特性を有することが示唆されている。BHBは、HDAC 3/6の発現を低下させることにより、シスプラチン誘発肝細胞がんの細胞毒性とアポトーシスを有意に増強し、サバイビンの減少をもたらした [84]。しかしながら、相反する結果もある。最近の研究によると、転移関連タンパク質2(MTA2)はHDAC2およびHDAC4と相互作用し、Rループ転写を介してBDH1を阻害し、肝細胞がんにおけるBHB蓄積をアップレギュレートおよび誘導し、H3K9bhbのレベルを増加させ、肝細胞がんの形成および進行にカスケード効果を示した[85]。MCT2を発現するヒト乳がん細胞のBHB処理は、H3K9acを増加させ、IL-1βやLCN2などの腫瘍促進遺伝子の転写をアップレギュレートする結果、腫瘍形成特性を増強する [86]。興味深いことに、Rodriguesらもまた、BHB投与が腫瘍の成長を促進することを確認したが、腫瘍はKacレベルの上昇を示さなかったことから、これはBHBの酸化的代謝により、Kacを阻害することで腫瘍の成長を抑制できるレベル以下に濃度が低下するためではないかと説明している[87]。まとめると、BHBのようなケトン体は、腫瘍において代謝的およびエピジェネティックな役割をまとめて果たすが、その作用は腫瘍の増殖に逆らったり、促進したりする可能性がある。
4.5. 骨粗鬆症
ポリヒドロキシ酪酸の分解産物はBHBである。BHBおよびその3-ヒドロキシ酪酸メチルエステル(3HBME)が酸化的損傷を軽減し、ミトコンドリアの呼吸障害を救済することが示されており [88]、BHBはまた、骨修復に必要なL型Ca2+チャネルを介して細胞内カルシウムの急激な増加を刺激し、細胞周期の進行に影響を及ぼす [89] 。KDは骨粗鬆症を引き起こすことが示されているが [4]、BHBは卵巣摘出によって誘発される閉経後骨粗鬆症を抑制する能力があることが報告されている [90]。しかしながら、AcAcはマウス胚骨芽細胞前駆体細胞(MC3T3-E1)およびマウス初代骨芽細胞におけるアルカリホスファターゼ(ALP)活性を濃度依存的に増強し、BHBとは対照的に、同じ実験セットアップでALP活性を低下させたが、ALP mRNAやタンパク質の発現には影響を与えなかった [91]。破骨細胞では、BHBは活性化T細胞細胞質核因子1(NFATc1)をダウンレギュレートし、破骨細胞の分化を阻害した。最近の研究では、BHBによる破骨細胞の制御は、GPR109A受容体の活性化よりもむしろHDACの阻害に主に依存している可能性が示唆されている [93]。A485は高選択的な触媒的p300阻害剤である。A485はRANKL誘発破骨細胞分化を抑制し、破骨細胞分化関連遺伝子の発現を時間および用量依存的にダウンレギュレートした。その分子機序は、MAPKシグナル伝達経路のリン酸化とNFATc1の活性化を阻害することによると考えられる[94]。
4.6. 肝臓と腎臓の傷害
マウス肝虚血再灌流障害(IRI)モデルにおいて、12時間の絶食は肝IRIを有意に改善した。その理由は、BHBの増加によりH3acが誘導され、FOXO1の発現が増加し、抗酸化酵素とオートファジー活性がアップレギュレートされ、炎症とアポトーシス細胞死を抑制することで肝IRIが改善されたためと考えられる。さらに、外因性BHBにもこの効果がある [95]。腎臓医学におけるKDの研究は、腎臓結石の可能性などの様々な禁忌によって制約されるかもしれないが [96]、近年のいくつかの研究で、KDがいくつかの腎臓病を改善することが示されている。KD投与3日後、IRI誘発腎障害モデルでは、血中ケトン体および肝臓と腎臓のKacが有意に増加した。これは、虚血性腎障害におけるKDの強力な抗酸化作用と抗炎症作用の一因と考えられる[97]。TRFとKDは、嚢胞形成と嚢胞拡大を強力に抑制し、血清クレアチニンを減少させた。TRFとKDを与えた多発性嚢胞腎(PKD)ラットでは、SMA陽性の筋線維芽細胞とKi-67陽性の嚢胞裏打ち細胞が減少し、コラーゲンの沈着が減少し、増殖が抑制された。続いて、BHB投与により線維化が有意に減少し、筋線維芽細胞がほぼ完全に消失し、腎機能が改善することが観察された。さらに、急性絶食は、マウス、ラットおよびネコのPKDモデルにおいて、嚢胞を裏打ちする上皮細胞の著しいアポトーシスを誘導し、腎嚢胞負荷を有意に逆転させた。このように、ケトーシスの誘導はPKDの進行を遅らせるが、その主な理由は、PKD細胞に影響を与える代謝産物またはシグナル伝達分子としてのBHBかもしれない[98]。さらに、BHBの外因性持続注入は、マウスの虚血性急性腎障害を緩和した [99]。BHBの前駆体である1,3-ブタンジオールを補給すると、血清マイクロアルブミンとNa+/K+比が減少し、ダール食塩感受性ラットの糸球体の形態変化が緩和された。食塩感受性高血圧に対するBHBのこの保護作用は、腸内細菌叢やTh17の活性化とは無関係であり、むしろ腎臓におけるNLRP3の過剰活性化を抑制することによって、カスパーゼ1、IL-1β、IL-18の放出を減少させたと考えられる。高血圧を軽減し腎機能を保護する1,3-ブタンジオールによる治療は、食塩感受性高血圧の臨床管理にとって興味深い戦略かもしれない[100]。
4.7. 胚および胎児の発育
BHBと胚発生との関係は、徐々に学術的に注目されるようになってきている。KDはホルモンおよび代謝の不均衡を是正することによって多嚢胞性卵巣症候群(PCOS)を改善するようであるが [101,102]、妊娠前および妊娠中の食事としての生殖安全性を支持する証拠は不十分である。妊娠中のKDが女性の脳と生殖能力に悪影響を及ぼし、子孫の身体的および神経学的発達を損なうと指摘する研究もある [103,104] 。注目すべきことに、出生前にKDに暴露されると、成人した子孫は不安や抑うつに対する感受性が低下することが示された [105]。以前の研究では、BHBが胚に対して催奇形作用を持つことが示されている [106]。着床前のBHB暴露はマウスの胚発生と移植後の生存率を損ない、胎児の成長を制限し、メスの子孫が最も深刻な影響を受けた。In vitroでは、2 mMのBHBへの暴露は、対細胞外胚葉(TE)細胞数とグルコース消費量を有意に減少させ、解糖系フラックスを増加させた。超生理学的濃度のBHB(20 mM)は、内部細胞量とTE細胞系譜のH3K27bhbを増加させたが、この研究で観察された代謝的および形態発達的適応に寄与するとは考えにくい[107]。その後、この研究チームは、0.8 mM AcAcと2 mM BHBへの複合暴露は胚盤胞の発育に影響を与えず、TEのH3K27acを有意に増加させたが、胎児の発育を低下させ、雌の子孫の発育を遅らせたことも観察した[108]。Whatleyらは、このような差のある効果は、AcAcによるACL/HATを介した(増殖促進)Kacに対して、BHBによるHDAC阻害剤(アポトーシス促進)によって、もっともらしく制御されていると示唆している。2-6mM濃度のBHBはまた、ウシの線維芽細胞および卵丘細胞においてH3K9bhbを有意に誘導した [109]。さらにSangalliらは、ウシの体細胞である卵丘細胞-卵母細胞複合体(COCs)をBHBに暴露する一連の実験を行ったが、いずれもKacレベルに変化はなかった。興味深いことに、体細胞核移植接合体をBHBで処理すると、H3K9acの上昇が起こり、それは胚盤胞の段階まで維持され、その結果FOXO3aの発現と胚盤胞の生産が促進された [28]。したがって、妊娠前または妊娠中のKDまたはBHBへの曝露は、今後非常に興味深いホットな研究テーマである。
4.8. 腸のホメオスタシス
腸は哺乳類の成体で最も頻繁に更新される臓器であり、食事制限やケトジェニック・プロセスに反応する。Chengらの最近の研究によると、ケトジェニック過程の律速酵素であるHMGCS2はLgr5+腸管幹細胞(ISC)に豊富に存在し、HMGCS2の欠失はBHBレベルを枯渇させ、Lgr5+ISCにおけるISCの自己複製と分化を損なうが、これは外因性BHBを補充することで回復することが示唆されている[110]。さらに、HMGCS2の欠損は絶食誘導H3K9bhbの能力を損ない、小腸陰窩における絶食関連遺伝子(HMGCS2、Fabp1、Acox1、Acox2など)の発現を変化させる[111]。BHBは腸のホメオスタシスを維持し、エピジェネティックなメカニズムによるリプログラミングと再生に重要な役割を担っていることが示唆される。
結論と展望
多くの疾患は、食事や生活習慣を含む環境因子や、個人の遺伝学やエピジェネティクスに関連している。BHBはバックアップエネルギー源としての役割に加え、DNA構造を変化させることなくエピジェネティックレギュレーターとして遺伝子転写の活性に直接影響を与え、さらに関連疾患の発症に関与している。BHBは、心血管疾患、糖尿病および糖尿病の合併症、神経精神疾患、がん、骨粗鬆症、肝障害および腎障害、胚および胎児の発育、腸の恒常性維持における病態生理学的調節メカニズムにおいて、3つのヒストン修飾タイプ(Kac、Kbhb、Kme)、DNAメチル化、およびマイクロRNAを仲介することが示されている。BHBは、多くの生理学的および病理学的環境において、これらのメカニズムを通じて多面的な効果を発揮し、潜在的な治療価値を有しており、内因性ケトーシスおよび外因性補給は、これらの疾患に対する有望な戦略であると考えられる。
本論文では、BHBのエピジェネティック効果に関する最近の進展を概説し、関連疾患の病態と治療標的を探索するための新たな方向性を提供する。しかし、BHBが介在するエピジェネティックなメカニズムの多くは、まだ基礎研究や動物モデルでしか見つかっておらず、臨床研究はまれである。さらに、BHBを介したエピジェネティック機構間に競合や拮抗があるのかどうか、また、これらのエピジェネティック機構がシグナル伝達機構(GPR109A、GPR41)やバックアップエネルギー源としてのBHBと交差するのかどうかについては、まだ明らかにされていない。BHBの主な供給源として、KDは脂肪肝、腎結石、ビタミン欠乏症、低タンパク血症、胃腸機能障害、さらには潜在的な心血管副作用などの悪影響を引き起こす可能性があり [112,113] 、これがKDのアドヒアランスを制限する要因の1つとなっている可能性がある。BHBが介在するエピジェネティックなメカニズムがこれらの副作用の発生や発症に関与しているのかどうか、またBHBの介入量と臓器特異性のバランスをどのようにとるべきかについては、未解決である。以上のような興味深い問題や領域については、さらに研究を進める必要がある。
著者貢献声明
記載されたすべての著者は、本論文の作成および執筆に多大な貢献をした。
データ利用声明
本論文に記載された研究に使用されたデータはない。
資金提供
本研究は、中国国家自然科学基金(第82170834号、第81970676号、第U22A20286号)、四川省科学技術計画(第2022YFS0617号、第2022YFS0612号)、瀘州市科学技術人材工作局(2020LZXNYDP02号、2021LZXNYD-G01号、2019LZXNYDJ40号)、四川省衛生委員会プロジェクト(第19PJ294号)の助成を受けた。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
利益相反宣言
著者らは利益相反がないことを宣言する。
参考文献
[1]
O.E.オーウェン、A.P.モーガン、H.G.ケンプ、J.M.サリバン、M.G.エレラ、G.F.ケーヒル・ジュニア
絶食時の脳代謝
J. Clin. Invest., 46 (10) (1967), 1589-1595頁, 10.1172/jci105650
記事を見る Scopusで見るGoogle Scholar
[2]
J. アバシ
ケトン体の補充-心臓病に対する新しいアプローチの可能性
JAMA (2021), 10.1001/jama.2021.8789
論文を見る Google Scholar
[3]
A.M.スルタン
灌流ラット心臓におけるD-3-ヒドロキシ酪酸代謝
Mol. Cell. Biochem., 79 (2) (1988), 113-118頁, 10.1007/bf02424552
記事を見る Scopusで見るGoogle Scholar
[4]
H. Zhu, D. Bi, Y. Zhang, C. Kong, J. Du, X. Wu, Q. Wei, H. Qin
ヒト疾患に対するケトン食:その基礎メカニズムと臨床応用の可能性
Signal Transduct. Targeted Ther., 7 (1) (2022), p. 11, 10.1038/s41392-021-00831-w
PDFを見る Google Scholar
[5]
H. Kolb、K. Kempf、M. Röhling、M. Lenzen-Schulte、N.C. Schloot、S. Martin
ケトン体:敵から友、そして守護天使へ
BMC Med., 19 (1) (2021), p. 313, 10.1186/s12916-021-02185-0
PDFで見るScopusで見るGoogle Scholarで見る
[6]
L. 王、陳、蕭
アンチエイジング代謝産物としてのβ-ヒドロキシ酪酸
Nutrients, 13 (10) (2021), 10.3390/nu13103420
論文を見る Google Scholar
[7]
S. Nasser, V. Vialichka, M. Biesiekierska, A. Balcerczyk, L. Pirola
ケトン食とケトン体が心臓血管系に及ぼす影響:濃度の問題
World J. Diabetes, 11 (12) (2020), pp.584-595, 10.4239/wjd.v11.i12.584
記事を見る Google Scholar
[8]
E.C.グラフ、H.ファン、D.ワンダース、R.L.ジャッド
ヒドロキシカルボン酸受容体2の抗炎症作用
メタボリズム, 65 (2) (2016), 102-113頁, 10.1016/j.metabol.2015.10.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
[9]
J.K.キム、M.サマラナヤケ、S.プラダン
哺乳類におけるエピジェネティック機構
Cell. Mol. 生命科学, 66 (4) (2009), 596-612頁, 10.1007/s00018-008-8432-4
PDFを見る Scopusで見るGoogle Scholar
[10]
C. ルー、M.コラディン、E.G.ポーター、B.A.ガルシア
質量分析ベースのアプローチによるエピジェネティック・ヒストン修飾分野の加速化
Mol. Cell. Proteomics, 20 (2021), Article 100006, 10.1074/mcp.R120.002257
PDFで記事を見るScopusで記事を見るGoogle Scholar
[11]
B.R.サバリ、D.チャン、C.D.アリス、Y.ザオ
ヒストンアシル化による遺伝子発現の代謝制御
Nat. Rev. Mol. Cell Biol., 18 (2) (2017), 90-101頁, 10.1038/nrm.2016.140
記事を見る Scopusで見るGoogle Scholar
[12]
T. Kouzarides
クロマチン修飾とその機能
Cell, 128 (4) (2007), 693-705頁, 10.1016/j.cell.2007.02.005
PDFを見る記事を見るScopusで見るGoogle Scholar
[13]
J.R.ドボシー、E.U.セルカー
DNAメチル化とヒストンアセチル化の新たな関連性
Cell. Mol. 生命科学, 58 (5-6) (2001), 721-727頁, 10.1007/pl00000895
記事を見る Scopusで見るGoogle Scholar
[14]
A.L.レニンガー、H.C.スッドゥース、J.B.ワイズ
ムイトコンドリアのD-β-ヒドロキシ酪酸デヒドロゲナーゼ
J. Biol. Chem., 235 (1960), 2450-2455頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[15]
S. ナセル、T.ソレ、N.ベガ、T.トーマス、A.バルサーチク、M.ストリジニ、L.ピローラ
高脂肪食摂取後のマウスにケトジェニック食を投与すると、体重減少、血糖正常化が促進され、肝臓および腎臓におけるケトジェニック経路の適応が誘導される。
Mol. Metabol., 65 (2022), 101578, 10.1016/j.molmet.2022.101578
PDFを見る記事を見るScopusで見るGoogle Scholar
[16]
D. チャン、ヤン、コン、ワン、マオ、ヤン、ワン、リュー、チャン、リー、チェン、ウー、ウェイ、ヤン、グアン、Y.
プロテオミクス解析により、2型糖尿病における糖尿病腎がケトン体産生臓器であることが明らかになった。
Am. J. Physiol. Metab., 300 (2) (2011), pp. E287-E295, 10.1152/ajpendo.00308.2010
PDFを見る Scopusで見るGoogle Scholar
[17]
A.E. Wentz、D.A. D'avignon、M.L. Weber、D.G. Cotter、J.M. Doherty、R. Kerns、R. Nagarajan、N. Reddy、N. Sambandam、P.A. Crawford
ケトジェニック栄養環境への心筋基質代謝の適応
J. Biol. Chem., 285 (32) (2010), 24447-24456頁, 10.1074/jbc.M110.100651
PDFを見る記事を見るScopusで見るGoogle Scholar
[18]
S. トゥメリン、M.フォレスティエ、J.ジラール、J.P.ペゴリエ
ラット肝臓、腸および腎臓におけるミトコンドリア3-ヒドロキシ-3-メチルグルタリル-CoA合成酵素遺伝子発現の発達的変化
第2報
Biochem. J., 292 (Pt 2) (1993), 493-496頁, 10.1042/bj2920493
記事を見る Scopusで見るGoogle Scholar
[19]
A.H.ベナブル、L.E.リー、K.フェオラ、J.サントヨ、T.ブルームフィールド、S.C.ヒューン
絶食による腎臓でのHMGCS2発現は循環ケトン体には寄与しない
Am. J. Physiol. Ren. Physiol., 322 (4) (2022), pp. F460-f467, 10.1152/ajprenal.00447.2021
PDFを見る Scopusで見るGoogle Scholar
[20]
A.P.ハレストラップ、D.メレディス
SLC16遺伝子ファミリー-モノカルボン酸トランスポーター(MCT)から芳香族アミノ酸トランスポーター、そしてその先へ
Pflügers Archiv, 447 (5) (2004), 619-628頁, 10.1007/s00424-003-1067-2
記事を見る Scopusで見るGoogle Scholar
[21]
A.K. Taggart、J. Kero、X. Gan、T.Q. Cai、K. Cheng、M. Ippolito、N. Ren、R. Kaplan、K. Wu、T.J. Wu、L. Jin、C. Liaw、R. Chen、J. Richman、D. Connolly、S. Offermanns、S.D. Wright、M.G. Waters
(D)-β-ヒドロキシ酪酸はニコチン酸受容体PUMA-Gを介して脂肪細胞の脂肪分解を阻害する。
J. Biol. Chem., 280 (29) (2005), pp.26649-26652, 10.1074/jbc.C500213200
PDFで記事を見るScopusで記事を見るGoogle Scholar
[22]
S.J.チャン、Z.H.リー、Y.D.チャン、J.チェン、Y.リー、F.Q.ウー、W.ワン、Z.J.キュイ、G.Q.チェン
ケトン体3-ヒドロキシ酪酸は受容体gpr109aを介したカルシウム流入を介して動脈硬化を改善する
Adv. Sci., 8 (9) (2021), Article 2003410, 10.1002/advs.202003410
PDFで見る Scopusで見るGoogle Scholar
[23]
A.K.リー、D.H.キム、E.バン、Y.J.チェ、H.Y.チョン
β-ヒドロキシ酪酸はgpr109aを介したシグナル伝達により老化肝臓の脂質蓄積を抑制する
Aging Dis, 11 (4) (2020), 777-790頁, 10.14336/ad.2019.0926
記事を見る Google Scholar
[24]
I. 木村, 井上大輔, 前田高志, 原孝典, 市村明宏, 宮内聡, 小林正樹, 辻本晃一, 平沢剛
短鎖脂肪酸とケトン体はGタンパク質共役型受容体41(GPR41)を介して交感神経系を直接制御する
Proc. Natl. Acad. Sci. U.S.A., 108 (19) (2011), pp. 8030-8035, 10.1073/pnas.1016088108
スコープで見るGoogle Scholar
[25]
C. Tang, K. Ahmed, A. Gille, S. Lu, H.J. Gröne, S. Tunaru, S. Offermanns
FFA2およびFFA3の欠損は、2型糖尿病におけるインスリン分泌を増加させ、耐糖能を改善する。
Nat Med, 21 (2) (2015), 173-177頁, 10.1038/nm.3779
スコープで見るGoogle Scholar
[26]
T. 島津忠彦、M.D. Hirschey、J. Newman、W. He、白川和彦、N. Le Moan、C.A. Grueter、H. Lim、L.R. Saunders、R.D. Stevens、C.B. Newgard、R.V. Farese Jr.、R. De Cabo、S. Ulrich、K. Akassoglou、E. Verdin
内因性ヒストン脱アセチル化酵素阻害剤β-ヒドロキシ酪酸による酸化ストレスの抑制
Science, 339 (6116) (2013), 211-214頁, 10.1126/science.1227166
スコープで見るGoogle Scholar
[27]
S. Chriett、A. Dąbek、M. Wojtala、H. Vidal、A. Balcerczyk、L. Pirola
ヒストン脱アセチル化酵素阻害剤、転写調節剤、抗炎症分子としてのβ-ヒドロキシ酪酸よりも酪酸の作用が顕著であること
Sci. Rep., 9 (1) (2019), p. 742, 10.1038/s41598-018-36941-9
Scopusで見るGoogle Scholar
[28]
J.R.サンガリ、R.V.サンパイオ、M.デル・コラード、J.C.ダ・シルヴェイラ、T.H.C.デ・ベム、F.ペレシン、L.C.スミス、F.V.メイレレス
ウシの細胞、卵子、胚におけるケトン体β-ヒドロキシ酪酸のH3K9acに対する代謝遺伝子発現およびエピジェネティック効果
Sci. Rep., 8 (1) (2018), Article 13766, 10.1038/s41598-018-31822-7
スコープで見るGoogle Scholar
[29]
M.A.グロザック、N.セングプタ、X.瀬戸 E.チャン
非ヒストンタンパク質のアセチル化と脱アセチル化
遺伝子, 363 (2005), 15-23頁, 10.1016/j.gene.2005.09.010
PDFを見る記事を見るScopusで見るGoogle Scholar
[30]
M. ニュー, H.La Olzscha, N.B. Thangue
HDAC阻害剤に基づく治療:コードの解釈は可能か?
Mol. Oncol., 6 (6) (2012), 637-656頁, 10.1016/j.molonc.2012.09.003
PDFで記事を見るScopusで記事を見るGoogle Scholar
[31]
X.J.ヤン、瀬戸英幸
リジン脱アセチル化酵素Rpd3/Hda1ファミリー:バクテリア、酵母からマウス、そして人間へ
Nat. Rev. Mol. Cell Biol., 9 (3) (2008), 206-218頁, 10.1038/nrm2346
スコープで見るGoogle Scholar
[32]
H. Olzscha, M.E. Bekheet, S.La Sheikh, N.B. Thangue
HDAC阻害剤
Methods Mol. Biol., 1436 (2016), pp.281-303, 10.1007/978-1-4939-3667-0_19
ScopusGoogle Scholarで見る
[33]
K.E.ウェレン、G.ハツィヴァシリウ、U.M.サクデヴァ、T.V.ブイ、J.R.クロス、C.B.トンプソン
ATP-クエン酸リアーゼは細胞代謝とヒストンアセチル化を結びつける
サイエンス, 324 (5930) (2009), 1076-1080頁, 10.1126/science.1164097
スコープで見るGoogle Scholar
[34]
Z. Xie、D. Zhang、D. Chung、Z. Tang、H. Huang、L. Dai、S. Qi、J. Li、G. Colak、Y. Chen、C. Xia、C. Peng、H. Ruan、M. Kirkey、D. Wang, L.M. Jensen, O.K. Kwon, S. Lee, S.D. Pletcher, M. Tan, D.B. Lombard, K.P. White, H. Zhao, J. Li, R.G. Roeder, X. Yang, Y. Zhao
ヒストンリシンβ-ヒドロキシブチリル化による遺伝子発現の代謝制御
Mol Cell, 62 (2) (2016), 194-206頁, 10.1016/j.molcel.2016.03.036
PDFを見る記事を見るScopusで見るGoogle Scholar
[35]
K. Liu, F. Li, Q. Sun, N. Lin, H. Han, K. You, F. Tian, Z. Mao, T. Li, T. Tong, M. Geng, Y. Zhao, W. Gu, W. Zhao
p53 β-ヒドロキシブチリル化はp53活性を減弱させる
Cell Death Dis., 10 (3) (2019), p. 243, 10.1038/s41419-019-1463-y
スコープで見るGoogle Scholar
[36]
B.R.サバリ、Z.タン、H.ファン、V.ヨンゴンサレス、H.モリーナ、H.E.コン、L.ダイ、M.シマダ、J.R.クロス、Y.ザオ、R.G.ローダー、C.D.アリス
細胞内クロトニル-CoAはp300触媒によるヒストンのクロトニル化を通じて転写を刺激する
Mol Cell, 69 (3) (2018), p. 533, 10.1016/j.molcel.2018.01.013
PDFで記事を見るScopusで記事を見るGoogle Scholar
[37]
F. Hao、M. Tian、X. Zhang、X. Jin、Y. Jiang、X. Sun、Y. Wang、P. Peng、J. Liu、C. Xia、Y. Feng、M. Wei
酪酸はCPT1A活性を増強し、脂肪酸酸化とiTreg分化を促進する。
Proc. Natl. Acad. Sci. U.S.A., 118 (22) (2021), 10.1073/pnas.2014681118
グーグル スカラー
[38]
H. Huang、D. Zhang、Y. Weng、K. Delaney、Z. Tang、C. Yan、S. Qi、C. Peng、P.A. Cole、R.G. Roeder、Y. Zhao
リジンβ-ヒドロキシブチリル化経路の制御酵素と基質タンパク質
Sci. Adv., 7 (9) (2021), 10.1126/sciadv.abe2771
Google Scholar
[39]
E. Hu、H. Du、X. Zhu、L. Wang、S. Shang、X. Wu、H. Lu、X. Lu
β-ヒドロキシ酪酸は適切なグルコース供給下で海馬ニューロンにおけるBDNFの発現を促進する
ニューロサイエンス, 386 (2018), 315-325頁, 10.1016/j.neuroscience.2018.06.036
PDFで記事を見るScopusで記事を見るGoogle Scholar
[40]
E. Hu、H. Du、S. Shang、Y. Zhang、X. Lu
β-ヒドロキシ酪酸は海馬ニューロンにおいてH3K4me3を増加させ、H2AK119ubを減少させることでBDNFの発現を促進する
Front. Neurosci., 14 (2020), Article 591177, 10.3389/fnins.2020.591177
スコープで見るGoogle Scholar
[41]
A. Dąbek, M. Wojtala, L. Pirola, A. Balcerczyk
ケトン体による細胞生化学、エピジェネティクスおよびメタボロミクスの調節。生体の生理学および病理状態におけるケトン食の意義
栄養素, 12 (3) (2020), 10.3390/nu12030788
Google Scholar
[42]
J. アリソン、A.カリシェフスカ、S.ウセダ、M.アリアス N.レイリズ
食事による成人脳のDNAメチル化の標的化
栄養素, 13 (11) (2021), 10.3390/nu13113979
Google Scholar
[43]
K. Kobow、A. Kaspi、K.N. Harikrishnan、K. Kiese、M. Ziemann、I. Khurana、I. Fritzsche、J. Hauke、E. Hahnen、R. Coras、A. Mühlebner、A. El-Osta、I. Blümcke
ディープシーケンスにより、ラット慢性てんかんにおけるDNAメチル化の増加が明らかになった。
Acta Neuropathol., 126 (5) (2013), 741-756頁, 10.1007/s00401-013-1168-8
スコープで見るGoogle Scholar
[44]
T.A.ルサルディ、K.K.アクラ、S.Q.コフマン、D.N.ラスキン、S.A.マシノ、D.ボイソン
ケトジェニック食は成体マウスおよびラットにおけるてんかん発生および疾患進行を抑制する
Neuropharmacology, 99 (2015), 500-509頁, 10.1016/j.neuropharm.2015.08.007
PDFを見る記事を見るScopusで見るGoogle Scholar
[45]
S.A.マシノ、T.リー、P.テオフィラス、U.S.サンダウ、D.N.ラスキン、B.B.フレドホルム、J.D.ガイガー、E.アロニカ、D.ボイソン
ケトジェニック食はアデノシンA₁受容体を介してマウスの発作を抑制する
J. Clin. Invest., 121 (7) (2011), pp.2679-2683, 10.1172/jci57813
スコープで見るGoogle Scholar
[46]
R.L. Williams-Karnesky、U.S. Sandau、T.A. Lusardi、N.K. Lytle、J.M. Farrell、E.M. Pritchard、D.L. Kaplan、D. Boison
アデノシン増強療法によって誘発されるエピジェネティックな変化がてんかん発症を予防する
J. Clin. Invest., 123 (8) (2013), 3552-3563頁, 10.1172/jci65636
スコープで見るGoogle Scholar
[47]
S.J. James、S. Melnyk、M. Pogribna、I.P. Pogribny、M.A. Caudill
S-アデノシルホモシステインの上昇とDNAの低メチル化:ホモシステイン関連病態のエピジェネティック機序の可能性
J. Nutr., 132 (8 Suppl) (2002), pp. 2361S-2366S, 10.1093/jn/132.8.2361S
Google Scholar
[48]
F. Chen, X. He, G. Luan, T. Li
薬物抵抗性てんかんに対するケトジェニック食事療法におけるDNAメチル化とアデノシンの役割:てんかん発生と関連合併症に焦点をあてて
Front. Neurol., 10 (2019), p. 119, 10.3389/fneur.2019.00119
Google Scholar
[49]
Y. Zhang、Z. Wang、R.A. Gemeinhart
マイクロRNAデリバリーの進歩
J. Contr. リリース, 172 (3) (2013), pp.962-974, 10.1016/j.jconrel.2013.09.015
PDFを見る記事を見るScopusで見るGoogle Scholar
[50]
M.R.ファビアン、N.ソネンバーグ、W.フィリポヴィッチ
マイクロRNAによるmRNAの翻訳と安定性の制御
Annu. Rev. Biochem., 79 (2010), 351-379頁, 10.1146/annurev-biochem-060308-103103
スコープで見るGoogle Scholar
[51]
K. 山田耕平, 滝澤慎一郎, 大角由紀夫, 浅見知行, 古谷和人, 山本和彦, 高橋文彦, 濱島千春, 稲葉千尋, 遠藤和人, 松井亮, 北村秀人, 田中慎一郎
マイクロRNA 16-5pはカロリー制限マウスで発現が上昇し、マクロファージの炎症性サイトカインを調節する
Gene, 725 (2020), Article 144191, 10.1016/j.gene.2019.144191
PDFを見る記事を見るScopusで見るGoogle Scholar
[52]
R. カンナタロ、M.ペリ、L.ガレッリ、M.C.カロレオ、G.シオーネE.デ・サッロ
ケトジェニックダイエットは身体のリモデリングとマイクロRNAの発現プロファイルに作用する
MicroRNA, 8 (2) (2019), pp.116-126, 10.2174/2211536608666181126093903
スコープで見るGoogle Scholar
[53]
R. Cannataro、M.C.Caroleo、A.Fazio、C.La Torre、P.Plastina、L.Gallelli、G.Cione E. Lauria
ケトジェニックダイエットと抗酸化生化学ホメオスタシスに関連するマイクロRNA
抗酸化物質, 8 (8) (2019), 10.3390/antiox8080269
グーグル スカラー
[54]
D. ロパシュク・ゲイリー、R.B.ダイク・ジェイソン
ケトン体と心臓血管系
Nature Cardiovascular Research, 2 (5) (2023), pp.425-437, 10.1038/s44161-023-00259-1
Google Scholar
[55]
M. 長尾昌宏, 藤理恵, 入野由香里, 森俊介, 中島弘幸, 原俊夫, 本庄毅, 里見小林聡美, 新家俊介, 田中宏幸, 石田卓也, 平田和人
心筋細胞における酸化ストレスに対する代償反応としてのβ-ヒドロキシ酪酸の上昇
Biochem. Biophys. Res. Commun., 475 (4) (2016), pp.322-328, 10.1016/j.bbrc.2016.05.097
PDFを見る記事を見るScopusで見るGoogle Scholar
[56]
L. ジー、Q.ヘー、Y.リュー、Y.デン、M.謝、K.ルオ、X.カイ、Y.ズオ、W.ウー、Q.リー、R.リーT.周
ケトン体β-ヒドロキシ酪酸は敗血症性心筋症における心筋酸化ストレスを予防する。
Oxid. Med. Cell. Longev., 2022 (2022), Article 2513837, 10.1155/2022/2513837
スコープで見るGoogle Scholar
[57]
E. フェラニーニ、M.マーク、E.メイユー
EMPA-REGアウトカムトライアルにおけるCV予防:「倹約的基質」仮説
糖尿病ケア, 39 (7) (2016), pp.1108-1114, 10.2337/dc16-0330
スコープで見るGoogle Scholar
[58]
S. 西谷昌宏, 福原昭彦, 申潤, 奥野恭子, 大槻雅之, 下村勇夫
ダパグリフロジン投与マウス脂肪組織のメタボロームおよびマイクロアレイ解析と脂肪細胞におけるアディポネクチン誘導に対する3-ヒドロキシ酪酸の影響
Sci. Rep., 8 (1) (2018), p. 8805, 10.1038/s41598-018-27181-y
スコープで見るGoogle Scholar
[59]
B. Li、Y. Yu、K. Liu、Y. Zhang、Q. Geng、F. Zhang、Y. Li、J. Qi
β-ヒドロキシ酪酸はヒストン脱アセチル化酵素3を阻害し、クローディン-5の生成を促進し、糖尿病における心臓微小血管透過性亢進を抑制する。
Diabetologia, 64 (1) (2021), 226-239頁, 10.1007/s00125-020-05305-2
スコープで見るGoogle Scholar
[60]
R.H.リッチー、E.D.アベル
糖尿病性心疾患の基本的メカニズム
Circ. Res., 126 (11) (2020), 1501-1525頁, 10.1161/circresaha.120.315913
スコープで見るGoogle Scholar
[61]
S.I. Oka, F. Tang, A. Chin, G. Ralda, X. Xu, C. Hu, Z. Yang, M. Abdellatif, J. Sadoshima
ケトン体の一種であるβ-ヒドロキシ酪酸は、心筋細胞においてチオレドキシン1のアップレギュレーションを介して抗酸化防御を増強する。
抗酸化物質, 10 (7) (2021), 10.3390/antiox10071153
Google Scholar
[62]
W. ルオ、Y. ユー、H. ワン、K. リュー、Y. ワン、M. ホァン、C. シュアン、Y. リー、J. チー
糖尿病ラットの糸球体硬化に拮抗するヒストンH3K9β-ヒドロキシブチリル化によるMMP-2のアップレギュレーション
Acta Diabetol., 57 (12) (2020), 1501-1509頁, 10.1007/s00592-020-01552-2
スコープで見るGoogle Scholar
[63]
X. Wu, D. Miao, Z. Liu, K. Liu, B. Zhang, J. Li, Y. Li, J. Qi
β-ヒドロキシ酪酸は糖尿病ラットにおいてVEGFの生成を促進することにより大動脈内皮傷害に拮抗する。
組織細胞, 64 (2020), 101345, 10.1016/j.tice.2020.101345
PDFで記事を見るScopusで記事を見るGoogle Scholar
[64]
K.J. Bough、P.A. Schwartzkroin、J.M. Rho
カロリー制限とケトジェニック食はin vivoでラットの歯状回における神経細胞の興奮性を低下させる
Epilepsia, 44 (6) (2003), 752-760頁, 10.1046/j.1528-1157.2003.55502.x
スコープで見るGoogle Scholar
[65]
C.E.スタフストローム、J.M.ロー
多様な神経疾患の治療パラダイムとしてのケトジェニックダイエット
Front. Pharmacol., 3 (2012), p. 59, 10.3389/fphar.2012.00059
Google Scholar
[66]
J. Landgrave-Gómez, O.F. Mercado-Gómez, M. Vázquez-García, V. Rodríguez-Molina, L. Córdova-Dávalos, V. Arriaga-Ávila, A. Miranda-Martínez, R. Guevara-Guzmán
ピロカルピン誘発発作モデルにおける時間制限摂食の抗けいれん効果:代謝およびエピジェネティックな意味合い
Front. Cell. Neurosci., 10 (2016), p. 7, 10.3389/fncel.2016.00007
ScopusGoogle Scholarで見る
[67]
Y. 柏谷陽子, 竹島隆, 森直樹, 中島啓介, クラーク・クラーク, R.L. ヴィーチ
D-β-ヒドロキシ酪酸はアルツハイマー病およびパーキンソン病モデルにおいて神経細胞を保護する。
Proc. Natl. Acad. Sci. U.S.A., 97 (10) (2000), pp. 5440-5444, 10.1073/pnas.97.10.5440
スコープで見るGoogle Scholar
[68]
L.B.アチャンタ、C.D.レー
脳におけるβ-ヒドロキシ酪酸:1分子、複数のメカニズム
Neurochem. Res., 42 (1) (2017), pp.35-49, 10.1007/s11064-016-2099-2
スコープで見るGoogle Scholar
[69]
P. マーフィー、S.リホディ、K.ナイレン、W.M.バーナム
ケトジェニック食の抗うつ特性
Biol. Psychiatr., 56 (12) (2004), pp.981-983, 10.1016/j.biopsych.2004.09.019
PDFを見る記事を見るScopusで見るGoogle Scholar
[70]
R. ガースナー、R.ガル、O.レビット、H.モシェ、A.ザンゲン
新規多因子性うつ病モデルラットにおける遺伝性行動、BDNF発現および治療反応
Int. J. Neuropsychopharmacol., 17 (6) (2014), pp.945-955, 10.1017/s1461145714000030
スコープで見るGoogle Scholar
[71]
L. 陳、苗、徐
β-ヒドロキシ酪酸は、ヒストン3-リジン9-β-ヒドロキシ酪酸化を増加させることにより、マウスの抑うつ行動を緩和する可能性がある。
Biochem. Biochem. Res. Commun., 490 (2) (2017), 117-122頁, 10.1016/j.bbrc.2017.05.184
PDFを見る記事を見るGoogle Scholar
[72]
S. Cornuti、S. Chen、L. Lupori、F. Finamore、F. Carli、M. Samad、S. Fenizia、M. Caldarelli、F. Damiani、F. Raimondi、R. Mazziotti、C. Magnan、S. Rocchiccioli、A. Gastaldelli、P. Baldi、P. Tognini
脳内ヒストンβ-ヒドロキシブチリル化は代謝と遺伝子発現を結びつける
Cell. Mol. 生命科学, 80 (1) (2023), p. 28, 10.1007/s00018-022-04673-9
スコープで見るGoogle Scholar
[73]
K. クラーク、K.チャバネンコ、R.ポーロスキー、E.カーター、M.トッド・キング、K.ムサ=ヴェロソ、M.ホー、A.ロバーツ、J.ロバートソン、T.B.バニタリー、R.L.ヴィーチ
健常成人における(R)-3-ヒドロキシブチル(R)-3-ヒドロキシ酪酸の動態、安全性および忍容性
Regul. Toxicol. Pharmacol., 63 (3) (2012), pp.401-408, 10.1016/j.yrtph.2012.04.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
[74]
A. 外茂田、N.G.ノルウィッツ、K.クラーク
なぜd-β-ヒドロキシ酪酸モノエステルなのか?
Biochem. Soc. Trans., 48 (1) (2020), pp. 51-59, 10.1042/bst20190240
ScopusGoogle Scholarで見る
[75]
K. ブレノー、M.J.デ・レオン、H.ゼッターバーグ
アルツハイマー病
Lancet, 368 (9533) (2006), 387-403頁, 10.1016/s0140-6736(06)69113-7
PDFを見る記事を見るScopusで見るGoogle Scholar
[76]
J.ハーディ、D.J.セルコー
アルツハイマー病のアミロイド仮説:治療への道のりの進展と問題点
サイエンス, 297 (5580) (2002), 353-356頁, 10.1126/science.1072994
Google Scholar
[77]
X. Li, Z. Zhan, J. Zhang, F. Zhou
An L., β-ヒドロキシ酪酸は、SH-SY5Y細胞においてHDAC1/3を阻害することにより、aβによるTrkA発現のダウンレギュレーションを改善する。
Am J Alzheimers Dis Other Demen, 35 (2020), Article 1533317519883496, 10.1177/1533317519883496
Google Scholar
[78]
J. 張、李、任、趙、興、姜、陳怡安
アルツハイマー病モデルマウスの脳におけるリポ蛋白質リパーゼ発現増加を間欠的絶食が緩和する:β-ヒドロキシ酪酸が介在する可能性
Front. Cell. Neurosci., 12 (2018), p. 1, 10.3389/fncel.2018.00001
PDFを見る記事を見るGoogle Scholar
[79]
X. Wang、X. Wu、Q. Liu、G. Kong、J. Zhou、J. Jiang、X. Wu、Z. Huang、W. Su、Q. Zhu
ケトン代謝はラットの脊髄損傷後のヒストン脱アセチル化酵素(HDAC)を阻害し、酸化ストレスを軽減する
ニューロサイエンス, 366 (2017), pp.36-43, 10.1016/j.neuroscience.2017.09.056
PDFを見る記事を見るGoogle Scholar
[80]
G. Kong、Z. Huang、W. Ji、X. Wang、J. Liu、X. Wu、Z. Huang、R. Li、Q. Zhu
ケトン代謝産物β-ヒドロキシ酪酸は、クラスIヒストン脱アセチル化酵素の抑制によって脊髄損傷における酸化ストレスを減弱させる
J. Neurotrauma, 34 (18) (2017), pp.2645-2655, 10.1089/neu.2017.5192
ScopusGoogle Scholarで見る
[81]
D.D. Weber、S. Aminzadeh-Gohari、J. Tulipan、L. Catalano、R.G. Feichtinger、B. Kofler
癌治療におけるケトジェニックダイエット-我々の立場は?
Mol. Metabol., 33 (2020), 102-121頁, 10.1016/j.molmet.2019.06.026
PDFを見る記事を見るScopusで見るGoogle Scholar
[82]
R.J.クレメント
がん患者に対するケトジェニック食の有益な効果:エビデンスと確認に焦点を当てた現実主義的レビュー
Med. Oncol., 34 (8) (2017), p. 132, 10.1007/s12032-017-0991-5
スコープで見るGoogle Scholar
[83]
T.N. Seyfried、T.M. Sanderson、M.M. El-Abbadi、R. Mcgowan、P. Mukherjee
実験的脳腫瘍の代謝制御におけるグルコースとケトン体の役割
Br. J. Cancer, 89 (7) (2003), pp.1375-1382, 10.1038/sj.bjc.6601269
スコープで見るGoogle Scholar
[84]
D. 三上大輔, 小林正樹, 上和田順子, 矢澤利彦, 神山和久, 西森健夫, 西川祐子, 横井聡, 谷口智之, 岩野正明
β-ヒドロキシ酪酸はヒト肝細胞癌細胞においてHDAC/survivin軸の阻害を介してシスプラチンの細胞毒性作用を増強する。
J. Pharmacol. Sci., 142 (1) (2020), pp.1-8, 10.1016/j.jphs.2019.10.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
[85]
H. Zhang、Z. Chang、L.N. Qin、B. Liang、J.X. Han、K.L. Qiao、C. Yang、Y.R. Liu、H.G. Zhou、T. Sun
MTA2トリガーRループはBDH1を介したβ-ヒドロキシブチリル化をトランス制御し、肝細胞癌幹細胞の増殖を増強する。
シグナル伝達 Targeted Ther., 6 (1) (2021), p. 135, 10.1038/s41392-021-00464-z
Google Scholar
[86]
黄 C.K., 張 P.H., 郭 W.H., 陳 C.L., 蒋 Y.M., 張 K.J., 周 J.Y., 胡 C.M., 李 W.H.
脂肪細胞はβ-ヒドロキシ酪酸を介してモノカルボン酸トランスポーター2の発現により乳腺腫瘍の悪性成長を促進する。
Nat. Commun., 8 (2017), Article 14706, 10.1038/ncomms14706
スコープで見るGoogle Scholar
[87]
L.M.ロドリゲス、S.ウリベ=ルイス、B.マドゥ、D.J.ホーネス、M.スタッブス、J.R.グリフィス
自然発生マウス乳腺腫瘍の成長、代謝およびグローバルヒストンH3アセチル化に対するβ-ヒドロキシ酪酸の作用:β-ヒドロキシ酪酸パラドックスの証拠
Cancer Metab, 5 (2017), p. 4, 10.1186/s40170-017-0166-z
グーグル奨学生
[88]
J. Zhang、Q. Cao、S. Li、X. Lu、Y. Zhao、J.S. Guan、J.C. Chen、Q. Wu、G.Q. Chen
ミトコンドリア保護機構を介したアルツハイマー病治療薬としての3-ヒドロキシ酪酸メチルエステル
バイオマテリアル, 34 (30) (2013), 7552-7562頁, 10.1016/j.biomaterials.2013.06.043
PDFで記事を見るScopusで記事を見るGoogle Scholar
[89]
S. Cheng、Q. Wu、F. Yang、M. Xu、M. Leski、G.Q. Chen
細胞増殖とカルシウム流入に対するDL-β-ヒドロキシ酪酸の影響
Biomacromolecules, 6 (2) (2005), pp.593-597, 10.1021/bm049465y
スコープで見るGoogle Scholar
[90]
Y. Zhao、B. Zou、Z. Shi、Q. Wu、G.Q. Chen
マウス骨芽細胞MC3T3-E1のin vitro分化および卵巣摘出ラットのin vivo骨形成に及ぼす3-ヒドロキシ酪酸の影響
バイオマテリアル, 28 (20) (2007), 3063-3073頁, 10.1016/j.biomaterials.2007.03.003
PDFを見る記事を見るScopusで見るGoogle Scholar
[91]
A. 斉藤, 吉村和彦, 宮本佳佑, 金子和彦, 近津大介, 山本雅人, 上條亮太
骨芽細胞培養におけるアセト酢酸およびβ-ヒドロキシ酪酸によるミネラル化の促進および抑制
Biochem. Biochem. Res. Commun., 473 (2) (2016), 537-544頁, 10.1016/j.bbrc.2016.03.109
PDFを見る記事を見るScopusで見るGoogle Scholar
[92]
Q. Cao, J. Zhang, H. Liu, Q. Wu, J. Chen, G.Q. Chen
模擬微小重力下における3-ヒドロキシ酪酸および誘導体の抗骨粗鬆症効果のメカニズム
Biomaterials, 35 (28) (2014), pp.8273-8283, 10.1016/j.biomaterials.2014.06.020
PDFを見る記事を見るScopusで見るGoogle Scholar
[93]
Y. Wu、Y. Teng、C. Zhang、Y. Pan、Q. Zhang、X. Zhu、N. Liu、X. Su、J. Lin
ケトン体β-ヒドロキシ酪酸は、NLRP3インフラマソームおよび破骨細胞分化を制御することにより、CoCrMo合金粒子による骨溶解を緩和する。
ナノバイオテクノロジー, 20 (1) (2022), p. 120, 10.1186/s12951-022-01320-0
Google Scholar
[94]
S. Huo、X. Liu、S. Zhang、Z. Lyu、J. Zhang、Y. Wang、B.Yue B. Nie
p300/CBP阻害剤A-485は破骨細胞の分化を抑制し、骨粗鬆症性骨量減少を予防する。
Int Immunopharmacol, 94 (2021), Article 107458, 10.1016/j.intimp.2021.107458
PDFを見る記事を見るScopusで見るGoogle Scholar
[95]
T. 宮内俊哉, 内田裕也, 角野和典, 平尾秀之, 川添潤一郎, 渡辺恒雄, 上田聡, 岡島裕之, 寺島秀樹, 上本眞理子
β-ヒドロキシ酪酸によるFOXO1の発現上昇と炎症抑制は、肝障害に対する食事制限の本質的な効果である。
Proc. Natl. Acad. Sci. U.S.A., 116 (27) (2019), pp.13533-13542, 10.1073/pnas.1820282116
スコープで見るGoogle Scholar
[96]
P. アチャリヤ、C. Acharya、C. Thongprayoon、P. Hansrivijit、S.R. Kanduri、K. Kovvuru、J. Medaura、P. Vaitla、D.F. Garcia Anton、P. Mekraksakit、P. Pattharanitima、T. Bathini、W. Cheungpasitporn
ケトジェニック食摂取患者における腎結石の発生率と特徴:系統的レビューとメタアナリシス
Diseases, 9 (2) (2021), 10.3390/diseases9020039
Google Scholar
[97]
P. ロハス-モラレス、J.C.レオン-コントレラス、M.サンチェス-タピア、A.シルバ-パラシオス、A.カノ-マルティネス、S.ゴンサレス-レイエス、A.S.ヒメネス-オソリオ、R.エルナンデス-パンド、H.オソリオ-アロンソ、L.G.サンチェス-ロサダ、A.R.トバール、J.タピアE.ペドラザ-チャベリ
ケトン食は急性および慢性虚血性腎障害を抑制し、酸化ストレスと炎症のマーカーを減少させる。
ライフサイエンス, 289 (2022), Article 120227, 10.1016/j.lfs.2021.120227
PDFを見る記事を見るScopusで見るGoogle Scholar
[98]
J.A. Torres, S.L. Kruger, C. Broderick, T. Amarlkhagva, S. Agrawal, J.R. Dodam, M. Mrug, L.A. Lyons, T. Weimbs
ケトーシスは多発性嚢胞腎における腎嚢胞の成長を改善する。
Cell Metab, 30 (6) (2019), 1007-1023.e5頁, 10.1016/j.cmet.2019.09.012
PDFを見る記事を見るScopusで見るGoogle Scholar
[99]
T. 田島, 吉藤明彦, 松井昭彦, 伊藤貴志, 内山和彦, 神田哲也, 徳山博之, 脇野修一, 伊藤博之
β-ヒドロキシ酪酸は抗パイロプトーシス作用により腎虚血再灌流障害を抑制する
Kidney Int., 95 (5) (2019), 1120-1137頁, 10.1016/j.kint.2018.11.034
PDFで記事を見るScopusで記事を見るGoogle Scholar
[100]
S. チャクラボルティ、S.ガラ、X.チェン、J.Y.ヨウ、B.メル、V.シン、B.ヨウ、P.サハ、A.V.マテュー、M.ジョー・B.ヴィジャイ・クマール
食塩応答性代謝産物β-ヒドロキシ酪酸は高血圧を抑制する
Cell Rep., 25 (3) (2018), 677-689.e4頁, 10.1016/j.celrep.2018.09.058
PDFで記事を見るScopusで記事を見るGoogle Scholar
[101]
J.C.マブロプロス、W.S.ヤンシー、J.ウェストマン E.C.ヘップバーン
多嚢胞性卵巣症候群に対する低炭水化物ケトン食の効果:パイロット研究
Nutr. Metab., 2 (2005), p. 35, 10.1186/1743-7075-2-35
スコープで見るGoogle Scholar
[102]
A. パオリ、L.マンシン、M.C.ジャコナ、A.ビアンコ、M.カプリオ
多嚢胞性卵巣症候群の過体重女性におけるケトジェニック食の効果
J. Transl. Med., 18 (1) (2020), p. 104, 10.1186/s12967-020-02277-0
スコープで見るGoogle Scholar
[103]
W. Kosiek, Z. Rauk, P. Szulc, A. Cichy, M. Rugieł, J. Chwiej, K. Janeczko, Z. Setkowicz
ケトジェニック食は新生ラットの神経発達を障害し、母体脳の生化学的組成に影響を及ぼす:仔ラットの機能回復の証拠
Brain Struct. Funct., 227 (3) (2022), 1099-1113頁, 10.1007/s00429-021-02450-1
スコープで見るGoogle Scholar
[104]
D. サスマン、J.エレグッド、M.ヘンケルマン
妊娠期のケトジェニック食は、母体の代謝状態だけでなく、新生児マウスの子孫の生理学的成長と脳構造を変化させる
BMC Pregnancy Childbirth, 13 (2013), p. 198, 10.1186/1471-2393-13-198
スコープで見るGoogle Scholar
[105]
D. サスマン、J.ジャーマン、M.ヘンケルマン
妊娠期のケトジェニックダイエットプログラムによる成体マウスの脳構造とうつ病および不安に対する感受性
Brain Behav, 5 (2) (2015), Article e00300, 10.1002/brb3.300
Google Scholar
[106]
L. シャム、T.W.サドラー
D,L,-β-ヒドロキシ酪酸誘導性催奇形性の生化学的基盤
Teratology, 42 (5) (1990), pp.553-563, 10.1002/tera.1420420512
スコープで見るGoogle Scholar
[107]
E.G. Whatley、T.T. Truong、D. Wilhelm、A.J. Harvey、D.K. Gardner
β-ヒドロキシ酪酸は、マウスの中胚葉を介した代謝異常を介し、胚盤胞の生存率を低下させる。
Hum. Reprod., 37 (9) (2022), 1994-2011頁, 10.1093/humrep/deac153
スコープで見るGoogle Scholar
[108]
E.G. Whatley、T.T. Truong、A.J. Harvey、D.K. Gardner
アセト酢酸とβ-ヒドロキシ酪酸は、代謝およびエピジェネティックな機序の違いによりマウス胚の生存率を低下させる。
Reprod. Biomed. オンライン, 46 (1) (2023), pp.20-33, 10.1016/j.rbmo.2022.09.018
PDFで記事を見るScopusで記事を見るGoogle Scholar
[109]
J.R. Sangalli、R.P. Nociti、M. Del Collado、R.V. Sampaio、J.C. Da Silveira、F. Perecin、L.C. Smith、P.J. Ross、F.V. Meirelles
ウシの組織、細胞および卵丘細胞-卵母細胞複合体におけるヒストンリジンβ-ヒドロキシブチリル化の特性化
Mol. Reprod. 89(9)(2022)、375-398頁、10.1002/mrd.23630
スコープで見るGoogle Scholar
[110]
C.W. Cheng, M. Biton, A.L. Haber, N. Gunduz, G. Eng, L.T. Gaynor, S. Tripathi, G. Calibasi-Kocal, S. Rickelt, V.L. Butty, M. Moreno-Serrano, A.M. Iqbal, K.E. Bauer-Rowe, S. Imada, M.S. Ulutas, C. Mylonas, M.T. Mylonas, M.S. Ulutas, M.T. C. Mylonas, M.T. Whary, S.S. Levine, Y. Basbinar, R.O. Hynes, M. Mino-Kenudson, V. Deshpande, L.A. Boyer, J.G. Fox, C. Terranova, K. Rai, H. Piwnica-Worms, M.M. Mihaylova, A. Regev, H. Yilmaz Ö
ケトン体シグナルは腸管幹細胞のホメオスタシスと食事への適応を媒介する
Cell, 178 (5) (2019), pp.1115-1131.e15, 10.1016/j.cell.2019.07.048
PDFで記事を見るScopusで記事を見るGoogle Scholar
[111]
C.J. Terranova、K.M. Stemler、P. Barrodia、S.L. Jeter-Jones、Z. Ge、M. De La Cruz Bonilla、A. Raman、C.W. Cheng、K.L. Allton、E. Arslan、H. Yilmaz Ö、M.C. Barton、K. Rai、H. Piwnica-Worms
H3K9bhbのリプログラミングは小腸における絶食の重要な特徴である。
Cell Rep., 37 (8) (2021), Article 110044, 10.1016/j.celrep.2021.110044
PDFを見る記事を見るScopusで見るGoogle Scholar
[112]
T.V. Luong、C.B. Abild、M. Bangshaab、L.C. Gormsen、E. Søndergaard
ケトン食と心臓の基質代謝
栄養素, 14 (7) (2022), 10.3390/nu14071322
Google Scholar
[113]
B. オニール、P.ラッジ
ケトン食:長所と短所
アテローム性動脈硬化症、292(2020)、119-126頁、10.1016/j.atherosclerosis.2019.11.021
PDFで記事を見るScopusで記事を見るGoogle Scholar
被引用回数 (0)
1
これらの著者は本研究に等しく貢献し、筆頭著者を共有している。
© 2023 Published by Elsevier Ltd.
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイト上のすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はElsevier B.V.に帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
