自閉症スペクトラム障害における一炭素代謝経路の遺伝学とエピジェネティクス: 性特異的脳エピゲノム?
Genes (Basel). 2021 May; 12(5): 782.
オンライン公開 2021年5月20日. doi: 10.3390/genes12050782
PMCID: PMC8161134
PMID: 34065323
自閉症スペクトラム障害における一炭素代謝経路の遺伝学とエピジェネティクス: 性特異的脳エピゲノム?
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8161134/
ジュリアナ・A・シルバ 3,† ジョバンナ・ロンゴ 3 イネス・ガッロ 3 アジェイ・V・シン 4,5 ダニエラ・ミラーニ 1 ドナート・ジェンマティ 2,3,6,*† ゼイネップ・ヒュマー
Zeynep HTümer、学術編集者
著者情報 論文ノート 著作権およびライセンス情報 免責事項
関連データ
データ利用声明
次のページへ
要旨
自閉症スペクトラム障害(ASD)は、行動やコミュニケーションに影響を及ぼす複雑な神経発達疾患であり、極めて多様な臨床表現型や特徴を呈する。ASDの病因は複合的かつ多面的であり、個々の疾患の病態生理学的過程や臨床的表現型の原因となるいくつかの原因や危険因子が存在する。遺伝的およびエピジェネティックな側面から、ASDに関連する可能性のあるいくつかの候補遺伝子が報告されており、それらは患者の約10-25%で検出される。葉酸遺伝子多型は、以前から他の精神疾患や神経変性疾患と関連しており、主にDHFR遺伝子(5q14.1;rs70991108、19bp ins/del)、MTHFR遺伝子(1p36.22;rs1801133、C677Tおよびrs1801131、A1298C)、CBS遺伝子(21q22.3;rs876657421、844ins68)の遺伝子変異に焦点が当てられている。特筆すべきは、ASDは発症リスクと進行に強い性差があることが特徴であるにもかかわらず、これらの遺伝子の役割が性差の観点から調査されたことはほとんどないことである。本総説の目的は、ASDに影響を及ぼす可能性のある再メチル化およびトランス硫酸化経路に影響を及ぼす細胞内葉酸リサイクルに関連する分子メカニズムを指摘することである。胎児期の脳エピゲノムは、ゲノム-環境相互作用の性差による異なる刷り込みを反映しており、その影響を解読することは困難である。ここでは、DHFR、MTHFR、CBSの3つの遺伝子に焦点を当て、その役割を性差を考慮した視点から解析することで、ASDエピジェネティクスに新たな視点をもたらすことを目的とする。
キーワード:脳エピゲノム、一炭素代謝遺伝子、葉酸、SNPs、遺伝子バリアント、エピジェネティクス、自閉症スペクトラム障害(ASD)、セックスギャップ、ジェンダーギャップ
次へ
はじめに
1943年、カナーは自閉症を、生物学的に決定された正常な、他者との感情的な接触を作り出す生得的な能力の欠如であると初めて体系的に定義した [1] 。現在、自閉性障害は、特定不能の広汎性発達障害(PDD-NOS)、アスペルガー症候群とともに、自閉症スペクトラム(ASD)と総称されるヒトの神経発達疾患の複雑な集合を表している[2]。どの年齢でも診断される可能性があるが、自閉症は発症年齢が早く、罹患している子供の1%以上が、一般集団におけるASDの特徴の幅広い重症度と連続的な分布によって特徴づけられる [3]。ASD患者は一般的に、社会的コミュニケーションや相互作用が困難で、興味が制限され、反復的な行動をとる [4]。実際、利用可能な技術の進歩や研究の革新的な実験的アプローチにもかかわらず、この複雑な障害の病因を完全に理解するための明確で直接的な因果関係やパターンはまだ存在しない。
その一方で、炎症性サイトカイン(神経炎症の鏡)の増加、酸化ストレスの受容、ミトコンドリア機能障害、脳以外の臓器の機能障害(消化管障害など)を特徴とする免疫調節障害や炎症など、他の疾患と共通する特異的な特徴を示す証拠がある [6,7,8]。これらを疾患の原因事象と考えるか、他の病因的プロセスの単なる結果と考えるかは明らかではないが、ASD治療の潜在的な標的として研究が進められている[8,9,10]。
ASDは遺伝的要素が強く、本質的にゲノムに基づくヒトの病気である [11]。実際、一卵性双生児は約90%の確率でこの病気を共有するが、二卵性双生児は5%から10%のリスクしか併存しないと報告されている [12]。それに加え、脆弱X症候群(FXS)は、知的障害(ID)やASDの最も一般的なX連鎖性単発性原因として報告されており、母親のゲノムにおける特定の遺伝子欠失と同様に、希少または一般的な遺伝子変異がASD発症に関与している可能性がある。認知された遺伝子関連症候群とともに、ASD患者の数人は染色体再配列を示し [14]、その損傷発症の重要な時期は、胚発生期の神経管閉鎖期であることが確認されている [15]。特筆すべきは、この事象は、男性の表現型の発達と骨格の成長に影響を及ぼす特定の遺伝子(すなわちSOX9)の役割により、性差があるという仮説が立てられていることである [16,17] 。これまでのところ、不完全な浸透性が観察されており、ASDの主要な原因である特定の遺伝子は明確に証明されていない[13]。
GWASは現在、ASDと他の神経発達/神経精神疾患との間に存在する知識のギャップを埋めつつあり、後者はより広範囲に研究されている。したがって、ASDと重複する神経発達性精神疾患である注意欠陥/多動性障害(ADHD)に有意に関連する12の独立した遺伝子座の存在も報告されており、共通遺伝子バリアントの発見におけるGWASの重要な役割を強調している[18,19]。さらに、主に神経細胞機能と皮質形成に関連するASDと有意に関連する共通リスク遺伝子変異が同定され、他の複雑な疾患や形質との遺伝的相関も確認されており、異なる病態の共通の病因と一致している [20] 。注目すべきは、様々なASDの臨床表現型は、複雑な多遺伝子構造と組織によって特徴づけられていることである [20] 。最後に、最近発表された最大規模のASDエクソームシークエンス研究において、102のリスク遺伝子が脳の発達や遺伝子発現の調節、神経細胞間のコミュニケーションと関連している [19]。
ASDの危険因子の定義に関しては、病因の多因子性の枠組みについて一致した見解があり、他の複雑な疾患についてしばしば実証されているように、ほとんどの場合、自閉症は複数の遺伝因子と環境因子の相互作用から生じることが示唆されている [21,22,23,24,25,26,27] 。このような流れの中で、エピジェネティクスやエピゲノミクスに影響を及ぼす遺伝と環境の間の役割と相互作用が、活発な研究の対象となっている [5,28,29]。食事や栄養エピジェネティクス [30] 、経済状態、ワクチン接種、一般的な健康状態、環境汚染物質、腸内細菌叢、口腔内細菌叢、膣内細菌叢など、ASDの環境要素を説明するための仮説が試みられており、後者は妊娠中のASDの胎内病因の可能性を示している [5,31,32,33]。全体として、いくつかの仮説があるにもかかわらず、個人のリスクと疾患の表現型を決定する遺伝的・環境的要因の正確な役割は、まだ完全に解明される必要がある。
疾患感受性の修飾に関連する遺伝子のうち、葉酸ホメオスタシスとメチオニン-ホモシステインリサイクリングに属する遺伝子は、さまざまな精神神経疾患との関連で関心を集めている [34,35] 。過去数十年の研究では、葉酸値やビタミンB12の低値とホモシステイン(Hcy)値の高値が、神経発達疾患、特に精神疾患や精神科患者における認知機能の低下と関連していることが示されている [36] 。この病態は、葉酸アイソフォームの循環とバランスを駆動する葉酸経路の特定の遺伝子多型の存在によって悪化する可能性がある [37] 。このラインでは、妊婦の遺伝子評価に基づく、妊娠中の個別化された葉酸補充が考慮されるべきである[37]。
全体として、ジヒドロ葉酸還元酵素(DHFR)、メチレンテトラヒドロ葉酸還元酵素(MTHFR)、およびシスタチオニン-β合成酵素(CBS)は、再メチル化およびトランス硫酸化経路に属する遺伝子であり、ASD感受性の修飾遺伝子として潜在的な候補である。
次へ一炭素代謝経路
葉酸サイクル、メチオニンサイクル、トランス硫酸化経路の3つの主要経路からなる統合複雑系である[38]。葉酸はビタミンB群(B9)に属し、栄養源(例えば、葉菜類、豆類、野菜、種子/豆類)から、または葉酸の形でサプリメントによって摂取することができる。葉酸は神経発達における重要な因子と考えられており、その欠乏が神経管欠損症(NTD)に関連することから、近年、いくつかの国で大規模な栄養強化プロトコルが実施されている [39] 。食事から摂取された葉酸は、プロトン結合葉酸トランスポーター(PCFT)と還元型葉酸キャリア(RFC)によって腸管レベルで吸収され、肝門脈を経由して肝臓に運ばれ、その後肝細胞に取り込まれる。血液循環中に分泌された葉酸は、GPIアンカー型細胞膜FRαとFRβ、および分泌型FRγの3つの葉酸受容体(FR)によって、いくつかの組織に到達し、細胞内に取り込まれる。FRαが細胞内への取り込みにおいて主な役割を果たすが、受容体は組織によって発現が異なる [40]。細胞内に取り込まれた還元型葉酸アイソフォームは、一炭素単位代謝の補酵素として働く [41,42]。重要なことは、ゲノムDNAのCpGプロモーター領域のシトシン残基にメチル基を転移させるための一炭素キャリアとして機能するため、葉酸はDNA合成/修復、プリン/ピリミジン合成、アミノ酸合成だけでなく、DNA/ヒストンのメチル化においても重要な役割を担っており、後者は健康な状態でも病気の状態でも遺伝子発現を変化/影響させることができる主なエピジェネティック過程の一つであることである [43,44,45]。全体として、葉酸は神経発達において極めて重要であり、遺伝学とエピジェネティクスの間のクロストークの効率的な媒介者である [40,46]。異なる細胞内葉酸アイソフォームの相互レベルの欠乏やアンバランスは、胎児の成長期に悪影響を及ぼし、小児がん、白血病、神経発達障害を促進する可能性がある [47,48,49,50,51] 。
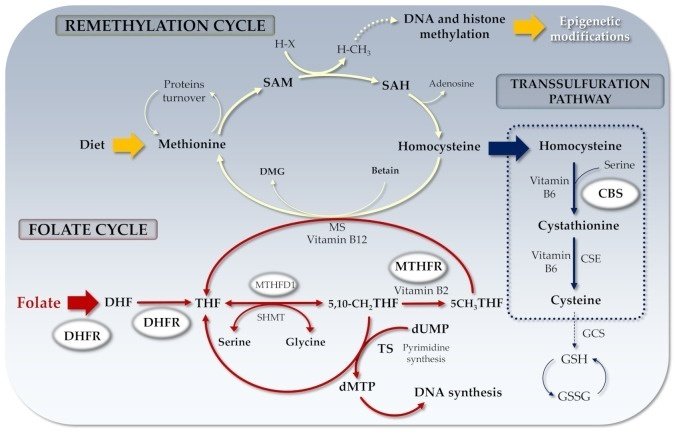
葉酸の生化学は過去に深く研究されてきた [43]。簡単に説明すると、葉酸は細胞内に入ると、NADPHとDHFRに依存する2段階のプロセスによって、テトラヒドロ葉酸(THF)活性型に変換される。図1に示すように、5,10-メチレンTHFはMTHFR酵素によって5-メチルTHFに変換され、メチオニン合成酵素(MS)によってTHFに再利用される。5-メチル-THFはメチル基をコバラミン(B12)に転移し、その結果生じるメチル-コバラミンがHcyのメチル供与体として働き、MSを介してメチオニンを生成することができる。最後に、Hcyの不可逆的な分解は、CBS酵素によるHcyからシステインへの硫黄移動を介したトランス硫化経路によって行われ、これは抗酸化グルタチオンの強力な構成成分であるシステイン合成[52]の唯一の方法と考えられている[53]。
図1
葉酸サイクルと関連遺伝子。DHF:ジヒドロ葉酸;THF:テトラヒドロ葉酸;SAM:S-アデノシルメチオニン;SAH:S-アデノシルホモシステイン;MTHFR:メチレンテトラヒドロ葉酸レダクターゼ;RCF:還元型葉酸キャリア;DHFR: ジヒドロ葉酸還元酵素;dUMP:ウリジン一リン酸;dTMP:チミジン一リン酸;DMG:ジメチルグリシン;MS:メチオニン合成酵素;CBS.シスタチオニン-β-シンターゼ;H-X: メチルアクセプター;H-CH3: メチル化アクセプター;TS:チミジル酸合成酵素;MTHFD1: メチレンテトラヒドロ葉酸デヒドロゲナーゼ-1(NADP+依存性);CSE:シスタチオニンγリアーゼ;GCS:γ-グルタミルシステイン合成酵素;GSH:グルタチオン;GSSG:グルタチオンジスルフィド。
通常、男性は女性に比べてHcyの循環濃度が高い(約10~15%高い)が、性差は女性の閉経移行期には減少する。葉酸欠乏は高ホモシステイン血症と関連しており、MTHFR遺伝子の変異対立遺伝子の数によって強い逆相関が認められる。全国的な葉酸強化プログラムが存在しないイスラエルで行われた最近の研究では、予想通り、男性は女性に比べて葉酸濃度が最も低かった[54]。Hcy値に対する葉酸の低値の結果として、B12値が正常であっても、また年齢やエストロゲンの影響とは無関係に、男性のHcy値は女性よりも高かった[54]。
多型遺伝子変異の有病率や影響における性差による説明の可能性がある [55] 。したがって、トランス硫酸化経路の異常や葉酸またはHcy代謝の調節障害は、酸化還元ホメオスタシスの異常や神経変性、ひいてはASD感受性の上昇につながる可能性がある [56,57,58]。いくつかの研究では、高Hcyおよび低葉酸、ビタミンB6、B12レベルとASDおよび重症度との相関関係が実際に報告されている[58,59]。特筆すべきは、ASD児が経験する胃腸障害も、循環Hcyの増加を引き起こすビタミンB群の摂取不足が原因である可能性があることである[60]。提案されている関連性の概念実証として、葉酸の補充はASD患者の臨床症状を改善し[61]、Hcyレベルを低下させ、グルタチオン代謝を最適化する[62,63]。
メチオニンと葉酸サイクルに属する代謝物のレベルの変化は、ASDのエピジェネティックな予測バイオマーカーであると同時に、潜在的な治療ターゲットであると考えられるが、ASDの病因/重症度との相関はまだ定義される必要がある[64,65]。全体として、将来の展望として、母子ゲノムとエピジェネティクスの相互作用は、革新的な治療介入の新たなターゲットになるかもしれない。
2.1. MTHFR遺伝子と機能
MTHFR遺伝子は第1染色体(1p36.22)に位置し、12個のエクソンからなり、697aaのタンパク質産物をコードする[66]。葉酸サイクルの中で、MTHFR酵素は活性型葉酸アイソフォーム(すなわち、5-メチル-THF)の合成を触媒し、DNA合成とメチル化過程に効率よく関与する [43,51] 。MTHFR遺伝子の欠損や変異は、様々な複雑な神経症状と関連している [67,68] 。
MTHFR一塩基多型(SNP)としては、C677T転座(rs1801133)とA1298C転座(rs1801131)が主に研究されており、臨床的に有効である。一般集団の60%以上がこの2つの多型対立遺伝子のいずれかを持ち、少なくとも10%がホモ接合体(677TTまたは1298CC)および/または複合ヘテロ接合体の両方の対立遺伝子を持ち、強い連鎖不平衡を考慮すると、シス型(CT/AC)はまれでトランス型(CT/CA)が多い[69]。
MTHFR C677T変異体は、エクソン4の677位のチミンがシトシンに変化し、アラニンがバリン(A223V)に置換された結果、酵素活性が低下した熱分解性酵素となり、特に葉酸欠乏状態で顕著となる [49,69]。正常患者と症例患者の両方において、異なるMTHFR遺伝子型による葉酸利用能とHcyレベルとの間には、強い直接的相関が存在する [43,49] 。例えば、ホモ接合のC677T(TT)状態は、Hcyの増加と葉酸レベルの低下と関連している [31] 。したがって、主に特定の遺伝的背景と食事との相互作用によって引き起こされる母親の葉酸の状態は、ASD感受性に有利に働く可能性があるため、妊娠中に特に重要である [70,71] 。
MTHFR A1298C変異体は、エクソン7の1298位のシトシンがアデニンに変化することにより、グルタミン酸がアラニン(E429A)に置換され、その結果、C677Tよりも程度は低いものの、ホモ接合体の1298CCの状態では、酵素活性が低下し、より有害である[72,73]。A1298CとNTDや精神疾患との関連については、ほとんど議論の余地がないようである [67]。このような多様な所見の説明として考えられるのは、NTDのリスクは、複合遺伝子多型および/または栄養因子の影響を受けた付加的な遺伝子や変異体によって左右される可能性があるということである [69,74] 。
2つのMTHFR変異体の複合ヘテロ接合体は、2つの単一ヘテロ接合体を別々に持つ場合よりもMTHFR酵素活性が低くなり、677TTホモ接合体と同程度にHcy高値と葉酸低値を引き起こす [75] 。MTHFR 677T/1298Cのシスハプロタイプはまれな病態であり、健康な新生児よりも自然流産でより頻繁に観察され、強い好ましくない影響を示唆している [76,77] 。
以前のメタアナリシスでは、小児および成人におけるMTHFR C677T多型とうつ病、不安との間に弱い相関があることが報告されており、1,119例の精神分裂病患者と1,308例の対照者を調査した結果、677TT遺伝子型はCC遺伝子型とCT遺伝子型を併せ持つ被験者と比較して、精神分裂病のリスクが最も高いことが報告されている(OR = 1.48; CI 95%, 1.18-1.86)[78]。同じ研究でCT遺伝子型とCCホモ接合体を比較したところ、有意なリスク関連は認められなかった(OR = 1.04; CI 95%, 0.87-1.25)[78]。
性と年齢が葉酸とHcyレベルに異なる影響を及ぼし、ひいては細胞特異的なメチル化状態に影響を及ぼすという知見は、MTHFR遺伝子型が様々な精神疾患に潜在的な役割を果たすことを示唆している [79] 。同様に、性ホルモンは精神疾患に対して標的効果を示し、エストロゲンは統合失調症における神経発達と社会的成熟に保護的な役割を果たす一方、テストステロンは神経伝達物質の調節に好ましくない影響を与えるため、男性の脆弱性を増大させる [79,80] 。
ASDにおけるMTHFRの役割は、統合失調症やうつ病などの他の精神疾患と比較してあまり調べられていないが、ASDのリスク確立におけるC677TおよびA1298C変異体の潜在的役割を強調した報告がいくつかある(表1)。興味深いことに、前臨床 [80] と臨床研究の両方で報告されているように、MTHFR多型と葉酸の状態は、妊娠中のASD確立の初期段階に関与している可能性がある(表1)。興味深いことに、母子二人を対象とした研究は、異なる民族における母子の遺伝子景観と周産期の葉酸サプリメント摂取のような状況的条件との間のクロストークの重要な役割を強く支持している。特に、CHARGE研究では、ASDにおいて、1炭素代謝遺伝子の母子遺伝子型と受胎時ビタミン摂取量との相関が報告されている [81] 。著者らは、ASD児における677TTホモ接合の頻度が健常対照児よりも高く、TT遺伝子型を持つASD児の母親は出生前ビタミンを摂取している可能性が低いことを強調している[71,81]。
表1
ASDとの有意な関連を報告したMTHFR、DHFR、CBS遺伝子に関する主な研究。
遺伝子主要所見遺伝子型/アリル参照MTHFR- ASDにおけるMTHFR C677Tの頻度の増加
ASDにおける正常MTHFR 1298AA遺伝子型の頻度が予想外に高い。
複合型MTHFR 677CT/1298ACハプロタイプがASDに多い677 CT/TT
1298AA[84]MTHFR-ASDでは血中メチオニンとSAM/SAH比が有意に減少している。ASDでは血中システイン、GSH、GSH/GSSG比が有意に減少している。
MTHFR C677TおよびA1298C677 CT+TTとの疾患関連
1298/677 AC/CTとRFC 80GAとの組み合わせ[85]DHFR- DHFR 19bp ins/delは葉酸多型とは独立して、また葉酸多型と関連してASDの危険因子である。DHFR 19bp ins/delとMTHFR C677TおよびA1298C19bp delの組み合わせ
19bp del+677T+1298C[86]MTHFR- MTHFR C677TがASDの主要なリスク因子として浮かび上がってきた。MTHFR A1298CはC677T677Tとの組み合わせでASDの付加的危険因子として浮上
677 T + 1298C[72]MTHFR- ASDにおけるMTHFR 677 T-対立遺伝子とTT-遺伝子型、677/1298 T/AおよびTT/AAハプロタイプの高い頻度罹患児における677 T-および1298 A-対立遺伝子、または677/1298 T/Aハプロタイプの親への優先的伝播677 T
1298 AA[87]MTHFR CBS- 受胎期間中のビタミン摂取は、遺伝的感受性の高い母子においてASD児を持つリスクを低下させる。母親がMTHFR 677TT、CBS rs234715 GT+TTで、子供がCOMT 472 AA遺伝子型の場合、ASDリスクが高い。
母親が他の炭素代謝遺伝子変異677TTと母子ともに他の炭素代謝遺伝子変異677TTを合併している場合、ASDリスクが高い[81]MTHFR- MTHFR C677Tキャリア(母子)677 CT+TT[88]MTHFR-ASD児にMTHFR 677TTの頻度が高い。
過活動はMTHFR 677TT遺伝子型と有意に関連(自閉症診断面接による層別化)677 TT[89]MTHFR- メタアナリシス:8件の症例対照研究が含まれる。
MTHFR C677T多型によりASDリスクが高い(すべての比較モデル)
MTHFR A1298C多型によるASDリスクの低下(劣性モデル)
MTHFR C677T多型とASDの関連(食品強化のない国のみ)677 CT+TT
1298 CC[71]MTHFR- MTHFR A1298CとASDとの関連MTHFR677CT/1298AC複合遺伝子型ではASDリスクが高い
女性では有意な関連なし1298 AC+CC
677/1298CT/AC[90]MTHFR-メタアナリシス:13件の研究が含まれる(白人9件、アジア人4件)。ASDとMTHFR C677T多型との有意な関連677 CT+TT
677 TT
677 T[91]MTHFR- ASDではMTHFR A1298Cの頻度が高い(AC:41.9%、CC:35.5%)。ASDではMTHFR C677T頻度が高い(CT:48.4%、TT:12.9)
ヘテロ接合体は重度の自閉症患者でも同様に検出された(46.2%)677 CT+TT
677 T
1298 AC+CC
1298 C[92]CBS- ASD患者ではCBS C699T頻度分布が高い(TTおよびCT+TT)。CBS C699T頻度が低いほど睡眠障害および消化管障害と関連する
CBS遺伝子型とASDの重症度との間に有意な関連なし699 CT+TT
699 TT[93]MTHFR- メタアナリシス:MTHFRに関する25の症例対照研究(C677T、18研究)(A1298C、7研究)ASDではMTHFR C677Tの頻度が高い。
MTHFR A1298CとASDリスクとの間に全体的な関連はない
白人でのみMTHFR A1298Cが有意に関連677 CT+TT
677 TT
677 T
1298 CC
1298 C[94]MTHFR- メタアナリシス:15研究MTHFR C677T多型にASDリスクが高い(すべての比較モデル)
MTHFR A1298CとASDの間に関連なし(すべての比較モデル)677 CT+TT
677 TT
677 T
677/1298 T/C[95]DHFR-DHFR遺伝子型層別化後でも、臍帯総葉酸とUMFAとの間に正の関連(調整なし)(黒人小児に限定)19bp del/del[96]。
別ウィンドウで開く
ASDのリスク確立に関与する可能性があるとしてC677Tの転移がより頻繁に報告されているが、2つのMTHFR SNPの間には相乗効果も現れており(表1)、ASDにおけるC677TとA1298Cの正確な役割についてはまだほとんど論争があるが、報告された結果は勇気づけられるものである[82]。特筆すべきは、自閉症における遺伝子検査の臨床応用が最近試みられたことで、自閉症のリスクが高い2歳の男児において、MTHFR遺伝子スクリーニングにより、従来の治療レジメンとして早期の葉酸補充が可能となった。このアプローチにより、臨床症状は著しく回復し、このような複雑な疾患における効果的な薬理遺伝学的アプローチが支持された [83] 。
全体として、研究に含まれるASD女性の数が少ないことも考慮すると、母子二人のゲノム比較に優先的に焦点を当てた遺伝学とエピジェネティクスの研究を追加する必要性があることは明らかである。
2.2. DHFR遺伝子と機能
DHFR遺伝子は第5染色体(5q14.1)にあり、6つのエクソンからなり、187 aaのタンパク質産物をコードしている [97,98]。機能的にはDHFからTHFへの変換、葉酸からDHFとTHFへの変換を触媒する [99]。DHFとTHFは、アミノ酸、脂質、ピリミジン、プリンなどの様々な必須代謝産物のde novo合成だけでなく、葉酸サイクルとHcy代謝に関与する2つの重要な葉酸アイソフォームである [68]。異なるDHFR酵素活性は、最適なDNAメチル化と忠実なDNA複製の相対的な比率にとって決定的である [43] 。DHFR遺伝子内の主な機能的多型の一つは、遺伝子のプロモーター/第一イントロンにおける19塩基対の挿入/欠失(19bp ins/del)(rs70991108)であり[68,100]、THFを5,10-メチレンTHFに変換する酵素の能力の制限と関連している[68]。DHFRは、ジヒドロビオプテリン(BH2)をテトラヒドロビオプテリン(BH4)に変換するという、葉酸に関連しない重要な役割も担っている。したがって、DHFR酵素活性のダウンレギュレーションは、BH4レベルの低下と、NO合成、内皮NO合成酵素からのスーパーオキシド放出の阻害、およびチロシン水酸化酵素(l-ドーパの産生に関与)、トリプトファン水酸化酵素、フェニルアラニン水酸化酵素を含む他の機能に必須であるBH4/BH2比の不均衡をもたらす [101,102,103]。
DHFR 19bp ins/delは、単独でまたは他の葉酸関連遺伝子変異と組み合わせて、ASDの有意なリスクと独立して関連しており、おそらく葉酸とグルタミン酸作動性神経系との相互作用によるものであろう(表1)[86]。葉酸アイソフォームはグルタミン酸残基と結合し、グルタミン酸の興奮性を促進する。このため、葉酸の再メチル化異常は、シナプス伝達に関与する興奮性グルタミン酸受容体のサブグループの内因性アゴニストとして作用するため、グルタミン酸作動性シグナル伝達に影響を及ぼす可能性がある。したがって、葉酸とグルタミン酸のホメオスタシスの調節異常は、ASD発症の鍵となる複合因子であると考えられる。したがって、自閉症ゲノムプロジェクトコンソーシアムは、過去に自閉症のリスク遺伝子座に関する研究を発表している。同コンソーシアムは、グルタミン酸経路が神経細胞の可塑性と発達に重要な役割を担っていることから、グルタミン酸関連遺伝子をASDの有望な候補とみなし、ASDがグルタミン酸作動性システムの障害である可能性を示唆した[104]。
注目すべきは、DHFR阻害剤を小児がん患者に使用する場合、長期的な副作用の可能性があるため、大きな懸念があることである。詳細には、葉酸拮抗薬であるメトトレキサートは、THFの利用可能性を低下させ、ピリミジンおよびプリン産生、ならびにRNAおよびDNA合成を低下させることにより、メトトレキサート治療を受けた小児における皮質下構造の容積の減少、認知障害、および自閉症様症状の有病率の増加と関連している [105,106] 。
また、葉酸サプリメントは、ヒトの肝臓でDHFR酵素を飽和させ、葉酸のTHFへの変換を遅らせる可能性があり、感受性の高いハプロタイプを持つ選択された個体では、5mgの葉酸を1回投与するのに12時間かかることが報告されており、過剰摂取に注意することが示唆されている [107,108]。未代謝葉酸(UMFA)については、特に特定のハプロタイプの存在下、特に選択された葉酸遺伝子変異体を有する妊婦において有害となる可能性があるとして、懸念が表明されている [109]。実際、妊娠中、葉酸アイソフォームの分布が不均衡になると、子孫に異常なエピジェネティックメカニズムを引き起こし、それを助長する可能性がある。それにもかかわらず、母親の葉酸補給は、NTDや口蓋裂などの先天性奇形を効率的に減少させるが、無差別な補給は、小児に重篤な病理学的状態を引き起こす可能性がある [109,110]。特定のDHFRおよびMTHFR遺伝子変異が存在する場合のように、葉酸の活性葉酸への変換が最適でない場合、特に妊娠などの重要な条件下でUMFA-閾値が低下し、否定的な副作用や懸念が悪化するため、薬理遺伝学的調査によって評価される安全な補給が示唆される [108,111]。
ASDの文脈では、DHFR 19bp ins/delが妊娠中の遺伝的修飾因子であることが示唆されており、その主な原因は、中枢神経系に蓄積される胚形成過程における未代謝のプテロイルモノグルタミン酸(すなわち治療用葉酸)に関連する異常なDHFR活性である [109] 。したがって、ASD患者ではMTHFR C677TとDHFR 19bp ins/delの間に正の相関が認められ、脳エピゲノムに変化を引き起こしている [86]。著者らは、葉酸の状態および/または関連遺伝子がASDの直接的な原因ではないかもしれないが、他の遺伝子産物に影響を与えることによる環境(すなわち栄養素)と遺伝子の相互作用は、主に全ゲノムに対する葉酸機構の包括的な影響により、ASDリスクを変化させるかもしれないと結論づけている[86]。
最後に、最近の多施設共同研究では、妊娠後期の葉酸補給を減らすことで、ASDだけでなく小児アレルギーや代謝性疾患のリスクと考えられている母親のUMFAも減らすことができるかどうかを明らかにすることを目的としている [112]。他の研究では、母親の血液中の高い葉酸濃度とASDの潜在的な関連性について、臍帯血中の異なる種類の葉酸がASDと特異的な関連性を持つかどうかに焦点を当てて調査しており、臍帯血中のUMFA濃度が高いが、5-メチル-THFや総葉酸濃度は黒人小児におけるASDのリスク上昇と関連しなかったと報告している[31,96]。
全体として、特定のDHFRおよびMTHFRハプロタイプに関連する潜在的なリスクを考慮し、GEMCDS(Genetic-Epigenetic-Mother-Child-Dyad-Study)の研究グループが最近発見した、母親または子供が持つ特定のハプロタイプによって小児白血病の発症年齢に予期せぬ正反対の影響を発見した関連性に照らしても[51]、さらなる調査が強く求められている。そして、文献上しばしば論争の的になる明確な関連性を断定したり否定したりする前に、母子双方のゲノムを考慮に入れ [96]、目標とする妊娠周期のサプリメント使用を適切に再検討する必要がある。
2.3. CBS遺伝子と機能
CBS遺伝子は21番染色体(21q22.3)に位置し、合計23のエクソンからなり、551aaのタンパク質産物をコードする [113] 。この遺伝子は、代替エクソン1(エクソンla-le)と、CBSタンパク質をコードする複数の代替スプライシング転写産物によって定義される他のエクソンを含む[113]。5′UTRは、5つの代替的に使用されるエクソンのうちの1つと常に存在する1つのエクソンを含み、3′UTRはエクソン16と17によってコードされる[113]。このタンパク質は63 kDaのサブユニットのホモ四量体として組織され、各サブユニットは2つの基質(すなわち、ホモシステインとセリン)と結合し[114]、Hcyからシステインへの不可逆的代謝を触媒する。必須補酵素としてビタミンB6を必要とし [115]、トランススルホ化経路 [116,117]によってHcyをメチオニンサイクルから不可逆的に除去し、Hcyを循環から低下させる [117]。Hcyとは異なり、システインは食事から摂取することができるが、システインの供給量が多い場合、酸化/脱硫経路のバランスが崩れる可能性がある。簡単に言うと、Hcyが高いと酸化還元バランスが崩れ、フリーラジカルの放出による酸化ストレスが生じるが、抗酸化物質であるシステインは、DNA、脂質、タンパク質にも影響を及ぼす酸化的損傷と強く対照をなし、ASD/刷り込み/エピジェネティック/障害の軸の役割を強調している[118,119]。
特筆すべきは、システインはタンパク質の産生とグルタチオン生成の基礎となることである。グルタチオンは、抗酸化作用と生体外物質に対する解毒作用を持つ強力なメディエーターである [115]。循環Hcy値が非常に高いことは、様々な病的状況の危険因子であり、50-100μmol/Lを超える値は、中等度-重度状態と考えられている[59]。上記の主な遺伝子変異の存在に起因する個体内変動がしばしば報告されており、最終的なHcy血中濃度には個人の遺伝学が世界的に関与している。
CBS酵素の機能欠損は古典的なホモシスチン尿症を引き起こし、メチオニン/ホモシステイン代謝の変化と、ASDを含む認知・行動疾患との関連性が示されている [120] 。CBS遺伝子の欠損は、自閉症、てんかん、パーキンソン病、アルツハイマー病、認知症などの様々な中枢神経系疾患において、正常な血管機能の低下、全身的な酸化ストレスの増加、脳の萎縮、神経障害の悪化と関連している [101,120,121] 。酸化ストレスの増加とメチル化スコアの低下のバイオマーカーを特定することを目的としたASD児の研究では、メチオニン、SAM、Hcy、シスタチオニン、システイン、総グルタチオンの血中濃度が低く、SAH、アデノシン、酸化グルタチオンの血中濃度が高いことが、行動障害と潜在的に関連していることが判明した [120]。著者らは、代謝プロフィールの異常、特にトランススルホ化経路の異常が、環境および/または細胞の酸化ストレスに対する感受性を高め、メチル化能力を低下させ、臨床的表現型の原因となっている可能性があると観察した [120]。上述したように、メチオニンとSAMによって制御されるCBS活性の低下は、システイン要求量を増加させ、総グルタチオン濃度の低下につながることから、ASD患者は、エピジェネティクスの観点からも、酸化ストレスに対してより感受性が高く、保護されていないことが示唆される [118,119,120]。制御不能で不均衡な酸化ストレスは、局所的な組織鉄沈着物の増加によっても悪化し、組織損傷と認知機能低下を決定する重要な因子であり、最近、鉄ホメオスタシス遺伝子とAPOEハプロタイプの遺伝的相互作用によって厳密に指示されることが判明した[23,122,123]。
複雑な疾患の原因として、エクソン3、8、10に集中する100以上の異なる変異がCBS遺伝子で報告されている[101,113]。統合失調症に関する研究では、68bp挿入の一般的なCBS多型(844ins68)と疾患リスクの増加との関連が報告されている[124]。他の研究では、CBS多型とASD児との関連が示されており [93]、C699T変異体(rs234706)では、699TTホモ接合体およびCTヘテロ接合体が健常対照と比較してASD症例に有意に多く、この多型は睡眠障害や胃腸障害にも関与している [93]。興味深いことに、T-アレルの頻度は、小児期自閉症評価尺度(CARS)の高得点やASD患者に関する他の臨床データと有意な関連があった。
最後に、低酸素虚血で脳症を発症した未熟児に関する最近の研究では、新生児の脳損傷と長期的なダメージがCBSのアップレギュレーションによるものであることが示唆され、未熟児の脳症に対抗するための潜在的な分子標的としてこの経路が強調された。
次へ
自閉症とその他の神経疾患における炭素代謝: 脳の性差に関連した洞察
神経疾患を含む多くの複雑な疾患において、性差は有病率、疾患の経過、転帰と関連している [126,127] 。行動異常の中でも、疫学研究では一貫してASDの有病率が女性に比べて男性で高いことが報告されており(男女比は約4:1)、ASD児の母親や父親で検出される異常の役割が異なることも考慮されている [16,126,128,129]。さらに、ASDの女性は病気の表現型があまり重度ではないことから、遺伝的な観点からも性差が強調されている[130]。
GWASは、募集と解析にバランスのとれた性別を含め、データを性で層別化することで、実験データの理解度と臨床への移植能力を強く向上させることを実証している [131] 。新たに就学前ASDと診断された児童を対象とした広範な前向き研究では、ASD患児の性別が、経時的な症状の軌跡の差の唯一の有意な予測因子であることが観察された [132] 。男児はより安定した重い症状を経時的に示したが、女児はより軽い症状を示し、経時的に改善した [132] 。
非常に若い患者における有病率を考慮した場合にも、性差の拡大がみられた [16] 。22ヵ月から39ヵ月の乳児を対象としたアトリスクサンプルを用いた場合、男女比は1.16:1.0であった [133,134] 。さらに、研究により、報告された比率は認知能力のレベルに影響され、注意欠陥が大きいほど男女比の差は小さくなることが強調された [133]。最後に、生後70~75ヵ月の乳児の男女比は全体で2.61:1.0であったが、IQが50未満の乳児のみを検査した場合、男女比は1.31:1.0に低下した[133,134]。したがって、特定の発達レベルも考慮しながら、男女間の症状の違いを調べることも重要であろう[135]。
さらに、自閉症の男性と女性では、男性では攻撃性や反復行動が強く、女性では不安や抑うつが強いという特異的な症状が異なる [136] 。また、症状像の違いから、女児と比較して男児を自閉症と診断する際にも齟齬があり、正式な診断基準では依然として男性中心の要素があり、これが世界的に男児を優先的に早期に診断する一因となっている[137,138]。
自閉症には男女間で明らかな違いがあるため、ASD発症の基礎となる生物学的経路に男女で違いがあることが指摘されている[134,136]。分子学的な観点から、葉酸代謝の欠陥は、治療や治療と同様に、性差に特異的な予防プログラムを達成するための標的とすることができる[12]。このアプローチのパラダイムとして、別の臨床状況では、MTHFR C677T多型が統合失調症患者において性差により層別化された異なるメチル化効果を有し、女性患者はグローバルメチル化率が低い傾向を示すことが示されている [139] 。性別とグローバルメチル化と相関する他の変数の組み合わせにより、性別とMTHFR遺伝子型は強く相互作用し、677TTホモ接合体の女性は男性に比べて全体的なメチル化率が最も低いことが明らかになった [139]。
興味深いことに、性別を対象とした前臨床研究では、MTFHRの多型状態とマウスで観察される行動との間に相関関係があることが示された [140]。特に、MTHFR 677TT遺伝子型を持つ新生マウスが抗てんかん薬に曝露された場合、雌雄で異なる社会的行動の変化が高いという正の相関が見られた [140]。この行動結果は、メスマウスの脳において、皮質のリーリングレベルの能力の違いや、興奮/抑制シナプスに関与する主要タンパク質の割合の変化と相関していた[140]。
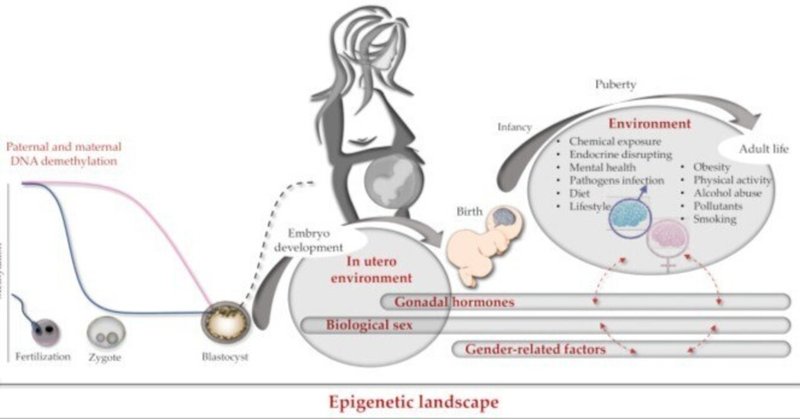
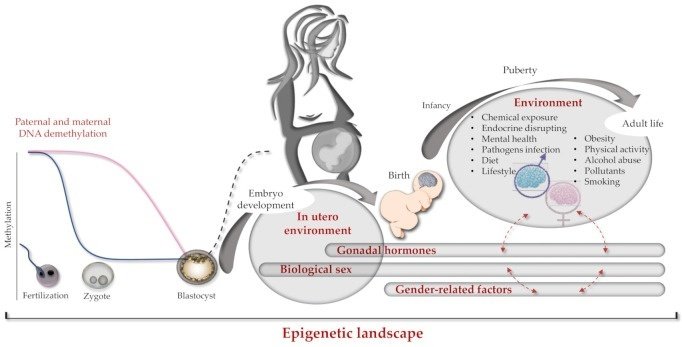
脳エピゲノムによるヒトの脳の発達の性差に関する情報や実験データは、非常に限られている。このような性差の一部は出生前の脳で明らかであるため、性刷り込み作用が主に母親に帰属し、発育中の胎児にはあまり帰属しない妊娠中に起こるはずである。出生後、新生児のゲノム、エピゲノム、性別が相互に作用しながら、最終的な脳のエピゲノムを決定する(図2)。
図2
脳エピゲノムの刷り込み。受胎から成人までの遺伝学とエピジェネティクスの相互作用の模式図。左側は、受精時に起こる父方と母方のヘミゲノムDNA脱メチル化過程(それぞれ青とピンクの線)。中央には、胚盤胞期におけるde novoグローバルゲノムメチル化を濃い破線で示す。右側では、赤の破線矢印が異なるエピジェネティクス因子間の相互作用を示す(例:性と性別)。
次へエピジェネティクスと遺伝学の役割: 葉酸サイクルのパラダイム
エピジェネティクスは、発生性疾患のような複雑な疾患における病態生理学的プロセスのメカニズムや洞察に異なる視点を提供し、革新的な治療ターゲットや戦略の同定につながる可能性がある [141] 。一言で言えば、エピジェネティクスとは、DNA配列の変化を伴わない、遺伝性の表現型変異の修正であり、エピゲノム調節異常は、いくつかの疾患の特徴として認識されている。哺乳類では、エピジェネティックな修飾は、DNAのメチル化やヒストンの修飾(すなわち、メチル化、アセチル化、リン酸化、スモイル化、ヒストン遺伝子の変異)と、小鎖および長鎖のノンコーディングRNA(すなわち、マイクロRNA)によって、世代を超えた遺伝に影響を及ぼす[19,142]。エピジェネティクスは、最近概説されたように、親の遺伝的/エピジェネティックなマークが子孫に継承されうる胚発生の最初の段階における修飾が重要な役割を果たす、複数のラウンドで起こる動的かつ可逆的なプロセスとして浮上している [142]。すなわち、父方のヘミゲノームでは接合初期に、DNA複製前の活発な酵素依存的メチル化消去によって特徴づけられ、母方のヘミゲノームではその後の細胞分裂の間に、より遅い速度で自発的にメチル化が消去される(図2)。この複雑なプロセスは、5-メチル-シトシンと5-ヒドロキシ-メチル-シトシンの相対比(5mC/5hmC)を評価することで測定可能であり、後者は5mCの活性脱メチル化における最初の酸化産物である[143,144]。
基本的に、脳では、DNAメチルトランスフェラーゼ(DNMT)によって駆動されるde novo DNAメチル化が学習と記憶活動に必要であり、メチル化の程度は特定の神経活動に関連している [145]。興味深いことに、脳DNAには5hmCが含まれており、全ゲノムバイサルファイトシークエンシング(WGBS)により、CpG以外のメチル化残基の割合が高いことが示され、最も一般的な塩基置換はアデニン(すなわちmCA)であることが明らかになった。世界的なメチロームの再編成は、胎児期から幼児期にかけて起こり、この時期に高度に保存された非CpGメチル化(すなわち、mCH)がヒトの脳ゲノムのメチル化の主流となる [146]。この修飾は、生後の脳の発達において、シナプス形成や状況的な個人的経験に伴って優勢となり、周産期のエストラジオール曝露時に変化する可能性のある細胞のアイデンティティを定義することに強く寄与する。
エピジェネティックな修飾は、遺伝子をどのように、どの程度発現させ、環境刺激に応答させるかを制御するため、環境因子とエピジェネティックな再プログラミングの間の正常な相互作用が乱れると、特定の病態の発生につながる可能性がある。このメカニズムは、発症年齢を含む自閉症の発症/進行についても示唆されている。最近の研究では、84のまれなエピジェネティック変異(エピバリエーション)が健常対照群と比較して自閉症で同定されており [147] 、エピバリエーションは、自閉症家族内の罹患していない兄弟/姉妹と比較して、罹患した自閉症患者に集積する傾向がある [147] 。ASDに関与する可能性のある多くの遺伝的・エピジェネティックな因子や、自閉症児における主要な腸内細菌叢の代謝物とエピジェネティックな変化との間のクロストークについても、最近議論され、レビューされている [148,149]。興味深いことに、DNAメチル化異常の程度を調べることで、自閉症児と性的に一致する非自閉症の兄弟との間に、性差による重要な違いがあることが判明した [150]。特に著者らは、いくつかの性特異的なメチル化パターン(ミトコンドリア機能障害や代謝障害と関連している)が、女性において自閉症に対するある程度の防御を提供する可能性があると報告しており、専門的な調査が必要な性特異的エピジェネティック形質を浮き彫りにしている[150]。注目すべきは、オキシトシン受容体遺伝子OXTRなどの重要な遺伝子における、性に基づくエピジェネティックな差異(すなわち、メチル化率)も最近報告されていることである [151]。しかしながら、これらのエピジェネティックな変化の根底にあるメカニズムはまだ不明であり、強く不均一である。示唆される重要な過程は、中枢神経系の発達の特定の重要な段階における主要遺伝子の転写レベルの変化と関連しており、遺伝的および/または環境的ダイナミクスの影響も受けている。
前駆因子の食事やライフスタイルを含むいくつかの環境因子が、遺伝性エピジェネティクス形質に影響を与えることが実証されていることから [142,152,153] 、葉酸と葉酸サイクルは、環境変動に応答するエピジェネティクスの始まりの典型的な例を示すと考えられる。上述したように、重要なエピジェネティクスの再プログラミングは、受精の段階から始まり、再構成された二倍体ゲノムが再メチル化プログラムを開始する morula/blastocystの段階まで潜在的な影響を及ぼす胚発生の最初の段階で起こる [154]。従って、遺伝的に受け継がれる素因および/または葉酸摂取の両方による母体/父体の葉酸状態は、グローバルな胚DNAメチル化プログラムに異なる影響を与える可能性がある [51,155]。注目すべきは、自閉症の前臨床モデルにおいて、新生児隔離モデルで誘導された自閉症様行動に関与する主要遺伝子(脳由来神経栄養因子遺伝子BDNFとグリア線維酸性タンパク質GFAP遺伝子)のエピジェネティックな調節異常(すなわち、メチル化低下)が、葉酸投与によって回復することが最近証明されたことである [156]。興味深いことに、この治療効果は、BDNFとGFAPのエピジェネティックな制御によって、2つの遺伝子プロモーターの低メチル化状態を回復させることと、抗酸化作用によって媒介され、トランスレーショナルな応用を刺激するものであった。
ヒストンメチルトランスフェラーゼ(HMT)によるヒストンメチル化プロセスは、母体が子孫に及ぼす影響の重要な部分である。これは、クロマチン状態のエピジェネティックなコード制御(色調の再編成を含む)を介して生じ、遺伝子発現に影響を与える可能性がある[152]。HMTの活性は細胞内のSAMレベルとHMT遺伝子の変異に依存しており、母子の代謝と細胞の栄養利用可能性を結びつけている [19,157]。葉酸欠乏と一炭素代謝遺伝子もまた、エピジェネティックなヒストン修飾の変化をもたらし、妊娠中は、ASDや注意欠陥多動性障害などの神経認知および/または神経行動障害のリスク増加と相関している [158] 。最後に、修飾されたヒストンは子宮環境に分泌され、世代を超えたエピジェネティックなヒストン修飾によって胚の脳の発達に影響を与える可能性がある [159]。
次へASDにおける結論と今後の展望
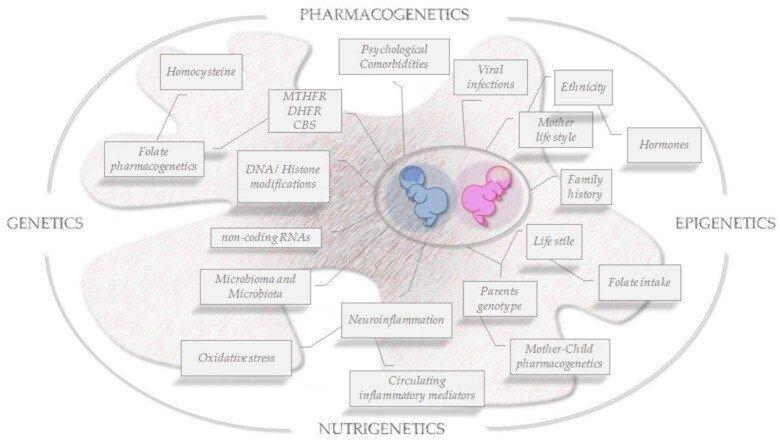
いくつかの複雑な病態において、葉酸アイソフォームのバランス/調節不全が重要な役割を果たしていることは証明されているが、ASDの成立に関与する最も重要な因子を決定的に特定するためには、さらなる努力と熱心な研究が必要である。特に、性特異的な因子が疾患の発症、重症度、発症時の異なる疾患表現型を調節する正確なメカニズムを解明し、有用な、あるいは安全でない特別な治療法の選択にどのように役立ち、導くことができるかを明らかにする必要がある。これらの課題に直面するためには、薬理遺伝学/ゲノム科学/OMICSアプローチ[160,161,162,163]や個別化医療[164]を含む先端技術と実験的/臨床的研究との相乗効果によって、複雑な神経発達/神経疾患の病態生理学的理解が進むことが期待される。有益な分子生物学的バイオマーカーを早期に同定し、適切な治療戦略を定義することは、他に類を見ない効果的な戦略である(図3)。したがって、ASD有病率における性差は約4:1(それぞれ男女比)と報告されているが、ASD女児を効率的に含まない潜在的な診断ジェンダーバイアスにより、より現実的には3:1に近いと思われ、そのため適切な早期診断を受けられないリスクが高い[165]。
図3
脳エピゲノムにおける葉酸OMICSと環境の相互作用。ASD発症の主な危険因子と、性/ジェンダーアプローチで直面する世代を超えた病態生理学的特徴のスナップショット。
結論として、人間の心理的・社会的性別と生物学的性別は相互に影響し合い、遺伝学的・エピジェネティクス的作用によって脳の発達に影響し合うことが避けられないため、脳のエピゲノム形成に及ぼす性別の影響を簡単に分離することはできない。そして、女性と男性の間の臨床的表現型に違いが現れるときはいつでも、セックスとジェンダーを合わせて考え始めなければならない[166]。
次へ
謝辞
カルロ・フォルナシーニ財団(イタリア、フェラーラ、ポッジョ・レナーティコ)に感謝する。
謝辞
著者貢献
構想、D.G.;執筆-原案作成および可視化、D.G.、J.A.S.およびV.T.;執筆-校閲および編集、D.G.、J.A.S.、V.T.、G.L.、I.G.、D.M.およびA.V.S. 著者全員が本原稿の出版版を読み、同意した。
次へ
資金提供
フェラーラ大学FARおよびFIRからの研究助成金(D.G.およびV.T.)。
研究助成金
施設審査委員会声明
該当なし。
次へ
インフォームド・コンセントに関する声明
該当なし
次へ
データ利用声明
データは論文に含まれている。
次のページへ
利益相反
著者は利益相反がないことを宣言している。
次へ
脚注
発行者注:MDPIは、出版された地図の管轄権の主張および所属機関に関しては中立を保ちます。
本文へ
参考文献感情接触の自閉症的障害。1968:100-136。[PubMed] [Google Scholar].
Bhat S., Acharya U.R., Adeli H., Bairy G.M., Adeli A. 自閉症: 原因因子、早期診断、治療法。Rev. Neurosci. 2014;25:841-850. doi: 10.1515/revneuro-2014-0056. [PubMed] [CrossRef] [Google Scholar].
一般集団における自閉症特性: 双生児研究。Arch. Gen. Psychiatry. 2003;60:524-530. doi: 10.1001/archpsyc.60.5.524. [PubMed] [CrossRef] [Google Scholar].
(accessed on 8 March 2021)]; Available online: https://www.nimh.nih.gov/health/topics/autism-spectrum-disorders-asd/index.shtml
Chaste P., Leboyer M. 自閉症の危険因子: 遺伝子、環境、遺伝子と環境の相互作用。Dialogues Clin. Neurosci. 2012;14:281-292. [PMC free article] [PubMed] [Google Scholar].
自閉症スペクトラムにおける生理的異常の研究動向のレビュー: 免疫調節異常、炎症、酸化ストレス、ミトコンドリア機能障害、環境毒物曝露。Mol. Psychiatry. 2012;17:389-401. doi: 10.1038/mp.2011.165. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Tisato V., Gonelli A., Voltan R., Secchiero P., Zauli G. TRAILの臨床的展望: 中枢神経疾患への洞察。Cell Mol. Doi: 10.1007/s00018-016-2164-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
自閉スペクトラム症における腸-脳軸: メタロプロテアーゼADAM10とADAM17を中心に。Int. J. Mol. 2020;22:118.doi:10.3390/ijms22010118.Int.J.Mol.Sci. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
バラノバJ.、ドラグナスG.、ボテリョM.C.S.、アユブA.L.P.、ブエノ-アルベスR.、アレンカールR.R.、パパイズD.D.、ソガヤルM.C.、ウルリッヒH.、コレアR.G.自閉症スペクトラム障害: シグナル伝達経路と将来の治療標的。Cell Mol. Neurobiol. 2020年 doi: 10.1007/s10571-020-00882-7. [PubMed] [CrossRef] [Google Scholar].
メラメドI.R.、ヘフロンM.、テストリA.、ライプK.自閉症に対する免疫グロブリン5%大量静注のパイロット研究: 自閉症スペクトラムと神経炎症マーカーへの影響。Autism Res. 2018;11:421-433. doi: 10.1002/aur.1906. [PubMed] [CrossRef] [Google Scholar].
自閉スペクトラム症の遺伝性。JAMA. 2017;318:1182-1184. doi: 10.1001/jama.2017.12141. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ゲラD.J. 自閉症スペクトラム障害の分子遺伝学: ゲノムメカニズム、神経免疫病理学、臨床的意義。Autism Res. 2011;2011:398636. doi: 10.1155/2011/398636. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
脆弱X症候群の発達研究。J. Neurodev. Disord. 2020;12:13. doi: 10.1186/s11689-020-09310-9. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Zafeiriou D.I., Ververi A., Dafoulis V., Kalyva E., Vargiami E. 自閉症スペクトラム障害: 遺伝的症候群の探求。Am. J. Med. Genet. B Neuropsychiatr. Genet. 2013;162B:327-366. doi: 10.1002/ajmg.b.32152. [PubMed] [CrossRef] [Google Scholar].
自閉症の発生学的起源: 脳神経運動核の発達異常。J. Comp. Neurol. 1996;370:247–261. doi: 10.1002/(SICI)1096-9861(19960624)370:2<247::AID-CNE8>3.0.CO;2-2. [PubMed][CrossRef][Googleスカラー]。
自閉症スペクトラムにおける性差. Curr. Opin. Neurol. 2013;26:146-153. doi: 10.1097/WCO.0b013e32835ee548. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Barrionuevo F., Scherer G. SOX E遺伝子: 哺乳類の精巣発生におけるSOX9とSOX8。Int. J. Biochem. 2010;42:433-436。doi: 10.1016/j.biocel.2009.07.015. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
注意欠陥・多動性障害のゲノムワイドで有意なリスク遺伝子座を初めて発見。Nat. Genet. 2019;51:63-75. doi: 10.1038/s41588-018-0269-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Satterstrom F.K., Kosmicki J.A., Wang J., Breen M.S., De Rubeis S., An J.Y., Peng M., Collins R., Grove J., Klei L., et al. Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism. Cell. 2020;180:568-584.e523. doi: 10.1016/j.cell.2019.12.036. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラム障害に共通する遺伝子リスク変異の同定(Grove J., Ripke S., Als T.D., Mattheisen M., Walters R.K., Won H., Pallesen J., Agerbo E., Andreassen O.A., Anney R., et al. Nat. Genet. 2019;51:431-444. doi: 10.1038/s41588-019-0344-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Pivina L., Semenova Y., Dosa M.D., Dauletyarova M., Bjorklund G. Iron Deficiency, Cognitive Functions, and Neurobehavioral Disorders in Children. J. Mol. Neurosci. 2019;68:1-10. doi: 10.1007/s12031-019-01276-1. [PubMed] [CrossRef] [Google Scholar].
Genovese A., Butler M.G. Clinical Assessment, Genetics, and Treatment Approaches in Autism Spectrum Disorder (ASD) Int. J. Mol. 論文名:「自閉症スペクトラム障害における臨床的評価と遺伝学的および治療的アプローチ」。[PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
鉄ホメオスタシスタンパク質のコーディング遺伝子と認知障害疾患におけるAPOE-対立遺伝子の遺伝子間相互作用。PLoS ONE. 2018;13:e0193867. doi: 10.1371/journal.pone.0193867. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Gemmati D., Varani K., Bramanti B., Piva R., Bonaccorsi G., Trentini A., Manfrinato M.C., Tisato V., Care A., Bellini T. "Bridging the Gap" ジェンダーオミクスとセックスオミクスの時代にジェンダー医学、薬理遺伝学、個別化医療を応用していれば避けられたであろうすべてのこと。Int. J. Mol. Sci. 2019;21:296. doi: 10.3390/ijms21010296. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tornese G., Iafusco D., Monasta L., Agnoletto C., Tisato V., Ventura A., Zauli G., Secchiero P. 1型糖尿病発症時の血中TRAIL濃度は、ケトアシドーシスがあり、インスリン必要量が最も高い患者で著しく低下する。Acta Diabetol. doi: 10.1007/s00592-013-0507-5. [PubMed] [CrossRef] [Google Scholar].
可溶性TRAILは再発流産で上昇し、in vitroでHTR8絨毛細胞の接着と遊走を阻害する。Hum. Reprod. 2012;27:2941-2947. doi: 10.1093/humrep/des289. [このような場合、泌尿器科の医師は、泌尿器科の専門医に相談する必要がある。
Gemmati D., Occhionorelli S., Tisato V., Vigliano M., Longo G., Gonelli A., Sibilla M.G., Serino M.L., Zamboni P. F13A1およびF13B遺伝子の遺伝的素因は腹部癒着形成を予測する: 性別予後指標の同定。Sci. Rep. 2018;8:16916. doi: 10.1038/s41598-018-35185-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Myers S.M.、Voigt R.G.、Colligan R.C.、Weaver A.L.、Storlie C.B.、Stoeckel R.E.、Port J.D.、Katusic S.K.、自閉症スペクトラム障害: 人口ベースの出生コホートにおける20年間の発生率と時間的傾向。J. Autism Dev. Disord. 2019;49:1455-1474. doi: 10.1007/s10803-018-3834-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Eshraghi A.A., Liu G., Kay S.S., Eshraghi R.S., Mittal J., Moshiree B., Mittal R. Epigenetics and Autism Spectrum Disorder: 相関はあるのか?最前線。Cell Neurosci. 2018;12:78. doi: 10.3389/fncel.2018.00078. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sedley L. Advances in Nutritional Epigenetics-A Fresh Perspective for an Old Idea. 教訓、限界、および将来の方向性。Epigenet. Insights. 2020;13:2516865720981924。[PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
Raghavan R.、Riley A.W.、Volk H.、Caruso D.、Hironaka L.、Sices L.、Hong X.、Wang G.、Ji Y.、Brucato M.、他:母親のマルチビタミン摂取、血漿葉酸およびビタミンB12レベルと子供の自閉症スペクトラム障害リスク。Paediatr. Perinat. Epidemiol. 2018;32:100-111. doi: 10.1111/ppe.12414. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
葉酸栄養の最近の動向。アドバンス。Food Nutr. Res. 2018;83:195-213. doi: 10.1016/bs.afnr.2017.12.006. [PubMed] [CrossRef] [Google Scholar].
Bordeleau M., Fernandez de Cossio L., Chakravarty M.M., Tremblay M.E. From Maternal Diet to Neurodevelopmental Disorders: 神経炎症の物語。フロント。Cell Neurosci. 2020;14:612705。[PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラムの診断における葉酸経路遺伝子多型の臨床的有用性。Psychiatr. Genet. 2016;26:281-286. doi: 10.1097/YPG.000000000152. [PubMed] [CrossRef] [Google Scholar].
MTHFR遺伝子検査: 論争と臨床的意味合い。Aust. Fam. Physician. 2016;45:237-240. [PubMed] [Google Scholar].
James S.J. Autism and Folate-dependent One-carbon Metabolism: Serendipity and Critical Branch-point Decisions in Science. Glob. Adv. Health Med. 2013;2:48-51. doi: 10.7453/gahmj.2013.088. [この論文では、科学的な枝葉末節の判断は、科学的な枝葉末節の判断とは異なり、科学的な枝葉末節の判断が重要であることを指摘している。
Lintas C. 遺伝学とエピジェネティクスのリンク: 神経発達障害における葉酸および葉酸関連経路の役割。Clin. Genet. 2019;95:241-252. doi: 10.1111/cge.13421. [PubMed] [CrossRef] [Google Scholar].
Xu J., Sinclair K.D. One-carbon metabolism and epigenetic regulation of embryo development. Reprod. Fertil. Dev. 2015;27:667-676. doi: 10.1071/RD14377. [PubMed] [CrossRef] [Google Scholar].
葉酸とヒトの生殖。Am. J. Clin. Nutr.2006;83:993-1016.DOI:10.1093/AJCN/83.5.993。[PubMed】【CrossRef】【Googleスカラー
葉酸輸送障害による発達障害の代謝基盤。Biochimie. 2016;126:31-42. doi: 10.1016/j.biochi.2016.02.012. [PubMed] [CrossRef] [Google Scholar].
葉酸: 栄養生化学、分子生物学、および疾患プロセスにおける役割。Mol. Genet。Metab. 2000;71:121-138。[PubMed] [CrossRef] [Google Scholar].
Lan X., Field M.S., Stover P.J. Cell cycle regulation of folate-mediated one-carbon metabolism. Wiley Interdiscip. Rev. Syst. Biol. Med. 2018;10:e1426. doi: 10.1002/wsbm.1426. [PubMed] [CrossRef] [Google Scholar].
Gemmati D. In: Folate-Pathway Gene Variants in Cancer: 血液悪性腫瘍。Gemmati D., editor. Transworld Research Network; Trivandrum, India: 2008. [Google Scholar].
Field M.S., Kamynina E., Chon J., Stover P.J. Nuclear Folate Metabolism. Annu. Rev. Nutr. 2018;38:219-243. doi: 10.1146/annurev-nutr-071714-034441. [PubMed] [CrossRef] [Google Scholar].
葉酸とDNAメチル化: 葉酸とDNAメチル化:分子メカニズムと葉酸の役割の証拠のレビュー。DOI:10.3945/AN.111.000992。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Cai S., Quan S., Yang G., Ye Q., Chen M., Yu H., Wang G., Wang Y., Zeng X., Qiao S. One Carbon Metabolism and Mammalian Pregnancy Outcomes. Mol. Nutr. 2020:e2000734。[PubMed] [CrossRef] [Google Scholar].
Gemmati D., De Mattei M., Catozzi L., Della Porta M., Serino M.L., Ambrosio C., Cuneo A., Friso S., Krampera M., Orioli E., et al. 成人急性リンパ芽球性白血病におけるDHFR 19-bp挿入/欠失多型とMTHFR C677T: 細胞内葉酸アンバランスによるリスク低下か?Am. J. Hematol. doi: 10.1002/ajh.21451. [PubMed] [CrossRef] [Google Scholar].
Gemmati D., Ongaro A., Scapoli G.L., Della Porta M., Tognazzo S., Serino M.L., Di Bona E., Rodeghiero F., Gilli G., Reverberi R., et al. 代謝性葉酸およびメチル化経路における共通遺伝子多型と成人における急性リンパ芽球性白血病および非ホジキンリンパ腫のリスク。Cancer Epidemiol. Biomark. Prev. 2004;13:787-794. [PubMed] [Google Scholar].
正常および血栓塞栓症患者における軽度高ホモシスチン血症の主要な決定因子としての低葉酸値および熱分解性メチレンテトラヒドロ葉酸還元酵素。動脈硬化。血栓。Vasc. 1999;19:1761-1767.Doi:10.1161/01.ATV.19.7.1761。[PubMed] [CrossRef] [Google Scholar].
成人急性リンパ芽球性白血病における葉酸代謝酵素の遺伝子多型: メトトレキサート関連毒性と生存率への影響。Haematologica. doi: 10.3324/haematol.2009.008326. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Tisato V., Muggeo P., Lupiano T., Longo G., Serino M.L., Grassi M., Arcamone E., Secchiero P., Zauli G., Santoro N., et al. 小児急性リンパ芽球性白血病の発症-潜伏期の調整におけるDHFRプロモーターとMTHFR遺伝子の母体ハプロタイプ: Genetic/Epigenetic Mother/Child Dyad Study (GEMCDS) Genes. 2019;10:634. doi: 10.3390/genes10090634. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ホモシステイン代謝におけるシスタチオニンβシンターゼの役割。抗酸化。Redox Signal. 2005;7:813-822. doi: 10.1089/ars.2005.7.813. [PubMed] [CrossRef] [Google Scholar].
Bhargava S., Ali A., Bhargava E.K., Manocha A., Kankra M., Das S., Mohan Srivastava L. Lowering homocysteine and modifying nutritional status with folic acid and vitamin B(12) in Indian patients of vascular disease. J.臨床。Biochem. 2012;50:222-226。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Cohen E., Margalit I., Shochat T., Goldberg E., Krause I. 葉酸レベルの性差: イスラエルからの大規模コホートの横断的研究。Isr. Med. 2021;23:17-22。[PubMed] [Google Scholar].
Russo G.T., Friso S., Jacques P.F., Rogers G., Cucinotta D., Wilson P.W., Ordovas J.M., Rosenberg I.H., Selhub J., Framingham Offspring Study C. Age and gender affects the relationship between methylenetetrahydrofolate reductase C677T genotype and fasting plasma homocysteine concentrations in the Framingham Offspring Study Cohort. J.栄養2003;133:3416-3421。[PubMed] [CrossRef] [Google Scholar].
マイルズE.W.、クラウスJ.P.シスタチオニンβシンターゼ: ホモシスチン尿症を引き起こす変異の構造、機能、制御、および位置。J. Biol. Chem. 2004;279:29871-29874. [PubMed] [CrossRef] [Google Scholar].
Gatarek P., Rosiak A., Borowczyk K., Glowacki R., Kaluzna-Czaplinska J. 自閉症児の尿中における低分子量硫黄化合物およびホモシステインチオラクトンの高濃度。分子。2020;25:973。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラム障害におけるホモシステイン値: 臨床アップデート。内分泌。Metab。免疫疾患。Drug Targets. 2018;18:289-296. doi: 10.2174/1871530318666180213110815. [PubMed] [CrossRef] [Google Scholar].
Azzini E., Ruggeri S., Polito A. ホモシステイン: リスク集団におけるその可能な新興の役割。Int. J. Mol. Sci.2020;21:1421。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Fulceri F., Morelli M., Santocchi E., Cena H., Del Bianco T., Narzisi A., Calderoni S., Muratori F. 自閉症スペクトラム障害の就学前児童における消化器症状と行動上の問題。ディグ。Liver Dis. 2016;48:248-254。DOI:10.1016/J.DLD.2015.11.026。[PubMed] [CrossRef] [Google Scholar].
孫C.、鄒M.、趙D.、夏W.、呉L. 葉酸サプリメントの有効性:構造化教育に参加する自閉症児における:オープンラベル試験。Nutrients. 2016;8:337。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jozefczuk J., Kasprzycka W., Czarnecki R., Graczyk A., Jozefczuk P., Magda K., Lampart U. Homocysteine as a Diagnostic and Etiopathogenic Factor in Children with Autism Spectrum Disorder. J.医学。Food. 2017;20:744-749. doi: 10.1089/jmf.2016.0150. [PubMed] [CrossRef] [Google Scholar].
自閉症における葉酸代謝異常: バイオマーカーの可能性。Biomark. Med. 2017;11:687-699. doi: 10.2217/bmm-2017-0109. [PubMed] [CrossRef] [Google Scholar].
自閉症における遺伝子-環境相互作用とエピジェネティック経路: 炭素代謝の重要性。ILAR J. 2012;53:322-340. doi: 10.1093/ilar.53.3-4.322. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
Wisniowiecka-Kowalnik B., Nowakowska B.A. Genetics and epigenetics of autism spectrum disorder-current evidence in the field. J. Appl. Genet. 2019;60:37-47. doi: 10.1007/s13353-018-00480-w. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
メチレンテトラヒドロ葉酸還元酵素(MTHFR)C677T多型: 疫学、代謝および関連疾患。Eur. J. Med. Genet. 2015;58:1-10. doi: 10.1016/j.ejmg.2014.10.004. [PubMed] [CrossRef] [Google Scholar].
MTHFRのAla222Val多型と臨床的特徴から、慢性統合失調症患者における自殺企図への感受性が示唆された。(1)統合失調症患者におけるMTHFR Ala222Val多型と自殺企図の関連性(2)統合失調症慢性患者におけるMTHFR Ala222Val多型と自殺企図の関連性. [この論文では、統合失調症患者における自殺企図が、慢性統合失調症患者における自殺企図と関連する可能性を示唆していることが示されている。
葉酸、葉酸と5-メチルテトラヒドロ葉酸は同じではありません。Xenobiotica. 2014;44:480-488。DOI:10.3109/00498254.2013.845705。[PubMed] [CrossRef] [Google Scholar].
MTHFRのC677TおよびA1298C多型の複合遺伝子型およびハプロタイプ分布: 中国人成人女性13,473人の横断記述的研究。Medicine (Baltim.) 2016;95:e5355. doi: 10.1097/MD.000000005355. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
DeVilbiss E.A.、Gardner R.M.、Newschaffer C.J.、Lee B.K.自閉症スペクトラム障害の危険因子としての母親の葉酸状態: 既存のエビデンスのレビュー。Br. J. Nutr. 2015;114:663-672。[PubMed] [CrossRef] [Google Scholar].
MTHFR遺伝子多型と自閉症スペクトラム障害のリスクとの関連: メタアナリシス。2013;6:384-392。[PubMed] [CrossRef] [Google Scholar].
葉酸代謝経路の異常と自閉症の感受性の変化。Psychiatr. Genet. 2009;19:171-176. doi: 10.1097/YPG.0b013e32832cebd2. [PubMed] [CrossRef] [Google Scholar].
Cunha A.L., Hirata M.H., Kim C.A., Guerra-Shinohara E.M., Nonoyama K., Hirata R.D.: Metabolic effects of C677T and A1298C mutations at the MTHFR gene in Brazilian children with neural tube defects. Clin. Chim. Acta. 2002;318:139-143。[PubMed] [CrossRef] [Google Scholar].
健康な集団における末梢血葉酸濃度に対するMTHFR A1298C多型の影響: 観察研究のメタアナリシス。Asia Pac. J. Clin. Nutr. 2018;27:718-727. doi: 10.6133/apjcn.122017.02. [PubMed] [CrossRef] [Google Scholar].
Stevens A.J.、Rucklidge J.J.、Kennedy M.A.エピジェネティクス、栄養とメンタルヘルス。関係はありますか?栄養。Neurosci. 2018;21:602-613. doi: 10.1080/1028415X.2017.1331524. [PubMed] [CrossRef] [Google Scholar].
Isotalo P.A., Donnelly J.G. Prevalence of methylenetetrahydrofolate reductase mutations in patients with venous thrombosis. Mol. Diagn. 2000;5:59-66. doi: 10.2165/00066982-200005010-00013. [PubMed] [CrossRef] [Google Scholar].
MTHFR677C>Tおよび1298A>C一塩基多型の遺伝子型およびハプロタイプ分布: メタアナリシス。J. Hum. Genet. 2003;48:1-7. doi: 10.1007/s100380300000. [PubMed] [CrossRef] [Google Scholar].
ルイスS.J.、ザミットS.、ガンネルD.、スミスG.D.MTHFR C677T多型と統合失調症リスクに関するメタアナリシス。Am. J. Med. Genet. B Neuropsychiatr. Genet. 2005;135B:2-4. doi: 10.1002/ajmg.b.30170. [PubMed] [CrossRef] [Google Scholar].
Wan L., Li Y., Zhang Z., Sun Z., He Y., Li R. Methylenetetrahydrofolate reductase and psychiatric diseases. 精神医学。Psychiatry. 2018;8:242. doi: 10.1038/s41398-018-0276-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Orenbuch A., Fortis K., Taesuwan S., Yaffe R., Caudill M.A., Golan H.M. Prenatal Nutritional Intervention Reduces Autistic-Like Behavior Rates Among Mthfr-Deficient Mice. Front. Neurosci. 2019;13:383. doi: 10.3389/fnins.2019.00383. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
シュミットR.J.、ハンセンR.L.、Hartiala J.、Allayee H.、シュミットL.C.、Tancredi D.J.、Tassone F.、Hertz-Picciotto I.出生前ビタミン、1炭素代謝遺伝子バリアント、および自閉症のリスク。疫学。2011;22:476-485. doi: 10.1097/EDE.0b013e31821d0e30. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
漢民族集団におけるビタミンB12および葉酸代謝関連遺伝子多型と小児自閉症スペクトラム障害との関連研究。Med. Sci. Monit. 2018;24:370-376. doi: 10.12659/MSM.905567. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fadila. 自閉症におけるメチレンテトラヒドロ葉酸還元酵素遺伝子検査の臨床的意義: 臨床結果が良好であった症例報告。Cureus. 2021;13:e12586. doi: 10.7759/cureus.12586. [PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
MTHFR遺伝子変異と自閉症との関連。J. Am. 2004;9:3。[Google Scholar].
James S.J., Melnyk S., Jernigan S., Cleves M.A., Halsted C.H., Wong D.H., Cutler P., Bock K., Boris M., Bradstreet J.J., et al. Metabolic endophenotype and related genotypes are associated with oxidative stress in children with autism. Am. J. Med. Genet. B Neuropsychiatr. Genet. 2006;141B:947-956. doi: 10.1002/ajmg.b.30366. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
自閉症発症における葉酸遺伝子多型19bp欠失-DHFRの関与に関する予備的証拠。Neurosci. 2007:24-29。doi: 10.1016/j.neulet.2007.05.025. [PubMed] [CrossRef] [Google Scholar].
MTHFR遺伝子とシンプレクス家系における特発性自閉症との関連性。J. Autism Dev. Disord. 2011;41:938-944. doi: 10.1007/s10803-010-1120-x. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
シュミットR.J.、タンクレディD.J.、オゾノフS.、ハンセンR.L.、ハーティアラJ.、アライエH.、シュミットL.C.、タッソーネF.、ハーツ-ピチョットI.CHARGE(遺伝と環境からの小児自閉症リスク)症例対照研究における母親の妊娠期葉酸摂取と自閉症スペクトラム障害および発達遅滞のリスク。Am. J. Clin. 2012;96:80-89。[PMCフリー記事] [PubMed] [クロスリーフ] [Google Scholar] 。
中国漢民族におけるメチレンテトラヒドロ葉酸還元酵素多型C677Tと自閉症リスク。Genet. テスト。Mol. Biomark. 2012;16:968-973. doi: 10.1089/gtmb.2012.0091. [この論文では、遺伝子発現を解析するために必要な遺伝学的知見について解説しています。
MTHFR 1298A>Cは韓国人集団における自閉症スペクトラム障害の危険因子である。精神医学研究2014;215:258-259. [PubMed] [CrossRef] [Google Scholar].
メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子C677T多型と自閉症との関連: 遺伝的感受性の証拠。Metab. Brain Dis. 2016;31:727-735. doi: 10.1007/s11011-016-9815-0. [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラム障害におけるMTHFR遺伝子のC677Tおよび1298AC多型の研究。電子。Physician. 2017;9:5287-5293。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
El Shafae M.、Sabry J.H.、Behiry E.G.、Elshahat S.A.、Zaki M.S.、Esmaiel N.N.自閉症児におけるシスタチオニンβ合成酵素遺伝子多型と認知障害との関連。J. Innov. Pharm. Biol. Sci. JIPBS. 2017;4:5. [Google Scholar].
Sadeghiyeh T., Dastgheib S.A., Mirzaee-Khoramabadi K., Morovati-Sharifabad M., Akbarian-Bafghi M.J., Poursharif Z., Mirjalili S.R., Neamatzadeh H. MTHFR 677C>Tおよび1298A>C多型と自閉症感受性の関連性: 系統的レビューとメタ分析。アジアJ.Psychiatr.2019;46:54-61.doi: 10.1016/j.ajp.2019.09.016. [PubMed] [CrossRef] [Google Scholar].
Li Y., Qiu S., Shi J., Guo Y., Li Z., Cheng Y., Liu Y.. MTHFR C677T/A1298Cと自閉症スペクトラム障害の感受性との関連: メタアナリシス。BMC小児科2020;20:449. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Raghavan R., Selhub J., Paul L., Ji Y., Wang G., Hong X., Zuckerman B., Fallin M.D., Wang X. A prospective birth cohort study on cord blood folate subtypes and risk of autism spectrum disorder. Am. J. Clin. 栄養2020;112:1304-1317。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ジヒドロ葉酸還元酵素欠損による先天性代謝異常の同定と特徴づけ。Am. J. Hum. Genet. 2011;88:216-225. doi: 10.1016/j.ajhg.2011.01.004. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ベイリーS.W.、アイリングJ.E.ヒト肝臓におけるジヒドロ葉酸還元酵素の極めて緩慢で可変的な活性とその葉酸大量摂取への影響。Proc. Natl. Acad. Sci. USA. 2009;106:15424-15429。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Stanislawska-Sachadyn A., Brown K.S., Mitchell L.E., Woodside J.V., Young I.S., Scott J.M., Murray L., Boreham C.A., McNulty H., Strain J.J., et al. ジヒドロ葉酸還元酵素(DHFR)遺伝子の挿入/欠失多型は女性の血清および赤血球葉酸濃度と関連する。Hum. Genet. 2008;123:289-295. doi: 10.1007/s00439-008-0475-y. [PubMed] [CrossRef] [Google Scholar].
多因子疾患発症における葉酸およびホモシステイン代謝に関与する遺伝子の分子遺伝学的変化の役割。Russ. J. Genet. 2017;53:528-541. doi: 10.1134/S1022795417040044. [CrossRef] [Google Scholar].
Ramaekers V.T., Sequeira J.M., Quadros E.V. The basis for folinic acid treatment in neuro-psychiatric disorders. Biochimie. 2016;126:79-90. doi: 10.1016/j.biochi.2016.04.005. [PubMed] [CrossRef] [Google Scholar].
機能的ヒトジヒドロ葉酸還元酵素遺伝子。J. Biol. Chem. 1984;259:3933-3943. doi: 10.1016/S0021-9258(17)43186-3. [このような遺伝子発現は、遺伝子発現に影響を及ぼす可能性がある。
第6章-テトラヒドロビオプテリン:一酸化窒素合成酵素およびアミノ酸水酸化酵素の必須補因子. In: Ignarro L.J., editor. 一酸化窒素。第2版。Academic Press; San Diego, CA, USA: 2010. [CrossRef] [Google Scholar].
自閉症ゲノムプロジェクト C., Szatmari P., Paterson A.D., Zwaigenbaum L., Roberts W., Brian J., Liu X.Q., Vincent J.B., Skaug J.L., Thompson A.P., et al. 遺伝的連鎖と染色体再配列を用いた自閉症リスク遺伝子座のマッピング。Nat. Genet. 2007;39:319-328. [PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
小児急性リンパ芽球性白血病に対する化学療法後の注意欠陥に関連する脳活動。J. Natl. Cancer Inst. 2019;111:201-209. doi: 10.1093/jnci/djy089. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zajac-Spychala O., Pawlak M., Karmelita-Katulska K., Pilarczyk J., Jonczyk-Potoczna K., Przepiora A., Derwich K., Wachowiak J. 小児急性リンパ芽球性白血病の長期生存者における抗白血病治療誘発神経毒性: 中枢神経系放射線療法および中~高用量メトトレキサートの減量の影響。白血病。Lymphoma. 2018;59:2342-2351. doi: 10.1080/10428194.2018.1434879. [PubMed] [CrossRef] [Google Scholar].
Wiens D., DeSoto M.C. Is High Folic Acid Intake a Risk Factor for Autism?-A Review. 脳科学2017;7:149. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
葉酸と自閉症スペクトラム障害のリスクとの関係. Healthcare. 2014;2:429-444。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
カナダ人妊婦コホートおよび臍帯血における葉酸および未代謝葉酸の高濃度。Am. J. Clin. Nutr.2015;102:848-857.DOI:10.3945/AJCN.115.110783。[PubMed] [CrossRef] [Google Scholar].
Obeid R., Kirsch S.H., Dilmann S., Klein C., Eckert R., Geisel J., Herrmann W. Folic acid causes higher prevalence of detectable unmetabolized folic acid in serum than B-complex: 無作為化試験。Eur. J.Nutr.2016;55:1021-1028。[PubMed] [CrossRef] [Google Scholar].
ルビンスキーM. 奇形、有害な生殖アウトカム、および胎児起源仮説関連効果のエピジェネティックな関連付け。J.アシスト。Reprod。Genet. 2018;35:953-964. doi: 10.1007/s10815-018-1197-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sulistyoningrum D., Green T., Palmer D., Sullivan T., Wood S., Makrides M., Skubisz M., Best K.P. Study protocol for a randomised controlled trial evaluating the effect of folic acid supplementation beyond the first trimester on maternal plasma unmetabolised folic acid in late gestation. BMJオープン。2020;10:e040416。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ヒトのシスタチオニンβシンターゼ(CBS)遺伝子の全塩基配列、代替スプライシング: 完全配列、代替スプライシング、多型。Genomics. 1998;52:312-324。doi: 10.1006/geno.1998.5437. [このような遺伝子は、遺伝子発現の解析に有用であることが示唆されている。
Meier M., Janosik M., Kery V., Kraus J.P., Burkhard P. ヒトシスタチオニンβシンターゼの構造: ユニークなピリドキサール5'-リン酸依存性ヘム蛋白質。この論文では、ヒトのシスタチオニンβシンターゼの構造を明らかにした。[PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
ホモシステインと葉酸代謝の概要。心血管疾患と神経管欠損症への特別な参照を持つ。J.遺伝。Metab. Dis. 2011;34:75-81。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Kim J., Kim H., Roh H., Kwon Y.. 高ホモシステイン血症の原因とその病理学的意義。Arch. Pharm. 2018;41:372-383. doi: 10.1007/s12272-018-1016-4. [PubMed] [CrossRef] [Google Scholar].
Morris A.A.、Kozich V.、Santra S.、Andria G.、Ben-Omran T.I.、Chakrapani A.B.、Crushell E.、Henderson M.J.、Hochuli M.、Huemer M.、他。 シスタチオニンβシンターゼ欠損症の診断と管理のためのガイドライン。J. Inherit. Metab. Dis. 2017;40:49-74. doi: 10.1007/s10545-016-9979-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Menezo Y., Mares P., Cohen M., Brack M., Viville S., Elder K. 自閉症、刷り込み、エピジェネティック障害: 幼児期からのホモシステインリサイクルの異常に関連したメタボリックシンドローム?J.アシスト。Reprod. Genet. 2011;28:1143-1145. doi: 10.1007/s10815-011-9645-2. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
自閉スペクトラム症症候群の有病率上昇と酸化ストレス、DNAメチル化、刷り込みとの関連: 環境の影響。JAMA Pediatr。2015;169:1066-1067.doi:10.1001/jamapediatrics.2015.2125。[PubMed] [CrossRef] [Google Scholar].
James S.J., Cutler P., Melnyk S., Jernigan S., Janak L., Gaylor D.W., Neubrander J.A. Metabolic biomarkers of increased oxidative stress and impaired methylation capacity in children with autism. Am. J. Clin. 栄養2004;80:1611-1617。[PubMed】【CrossRef】【Googleスカラー
自閉症バイオマーカー: 課題、落とし穴、可能性。J. Autism Dev. Disord. 2015;45:1103-1113. doi: 10.1007/s10803-014-2225-4. [PubMed] [CrossRef] [Google Scholar].
TognazzoS.、Gemmati D.、Palazzo A.、Catozzi L.、Carandina S.、Legnaro A.、Tacconi G.、Scapoli G.L.、Zamboni P.非治癒性静脈性下腿潰瘍における第XIII因子遺伝子変異の予後的役割。J. Vasc. Surg.2006;44:815-819。[PubMed] [CrossRef] [Google Scholar].
神経芽腫細胞におけるイオン性鉄の酸化還元状態のin vitro細胞毒性の検討。J. Neurosci. 農村。Pract. 2012;3:301-310. doi: 10.4103/0976-3147.102611. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
シスタチオニンβシンターゼ遺伝子の844ins68多型は統合失調症と関連する。精神医学 2009;170:168-171. [PubMed] [CrossRef] [Google Scholar].
Lechpammer M., Tran Y.P., Wintermark P., Martinez-Cerdeno V., Krishnan V.V., Ahmed W., Berman R.F., Jensen F.E., Nudler E., Zagzag D. 新生児低酸素虚血性脳損傷におけるシスタチオニンβシンターゼとp70S6K/S6のアップレギュレーション。Brain Pathol. 2017;27:449-458. doi: 10.1111/bpa.12421. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
神経発達障害における性差。Curr. Opin. Neurol. 2019;32:622-626. doi: 10.1097/WCO.000000000714. [PubMed] [CrossRef] [Google Scholar].
Piccini P., Montagnani C., de Martino M. 小児科における男女格差: 現在の文献のレビュー。Ital. doi: 10.1186/s13052-017-0437-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Braunstein V.L., Peniston N., Perelman A., Cassano M.C. The inclusion of fathers in investigations of autistic spectrum disorders. Res.自閉症スペクトラム。Disord. 2013;7:8.DOI:10.1016/J.RASD.2013.03.005。[CrossRef] [Google Scholar].
広汎性発達障害における性差。J.自閉症Dev. Disord. 1993;23:579-591。[PubMed] [CrossRef] [Google Scholar].
Szatmari、Liu X.Q.、Goldberg J.、Zwaigenbaum L.、Paterson A.D.、Woodbury-Smith M.、Georgiades S.、Duku E.、Thompson A.自閉症における反復的な固定観念行動の性差: 遺伝的責任への示唆。Am. J. Med. Genet. B Neuropsychiatr. Genet. 2012;159B:5-12. doi: 10.1002/ajmg.b.31238. [PubMed] [CrossRef] [Google Scholar].
神経精神疾患の性差を理解するための遺伝疫学のツールの使用。Genes Brain Behav. 2020;19:e12660. doi: 10.1111/gbb.12660. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Szatmari P., Georgiades S., Duku E., Bennett T.A., Bryson S., Fombonne E., Mirenda P., Roberts W., Smith I.M., Vaillancourt T., et al. 自閉症スペクトラム障害の就学前児童の初期コホートにおける症状の重症度と適応機能の発達的軌跡。JAMA Psychiatry. 2015;72:276-283. doi: 10.1001/jamapsychiatry.2014.2463. [PubMed] [CrossRef] [Google Scholar].
広汎性発達障害の疫学。Pediatr. Res.2009;65:591-598.DOI:10.1203/PDR.0b013e31819e7203。[PubMed] [CrossRef] [Google Scholar].
Geary D.C.認知的性差の広い文脈における自閉症。Proc. Natl. Sci. USA. 2018;115:12089-12091. doi: 10.1073/pnas.1817772115. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zander E., Sturm H., Bolte S. 自閉症診断面接-改訂版と自閉症診断観察スケジュールの併用による付加価値: スウェーデンの幼児と就学前児童の臨床サンプルにおける診断的妥当性。Autism. 2015;19:187-199. doi: 10.1177/1362361313516199. [PubMed] [CrossRef] [Google Scholar].
Gray D.E. Gender and coping: 高機能自閉症児の親。社会科学医学。2003;56:631-642. doi: 10.1016/S0277-9536(02)00059-X. [PubMed] [CrossRef] [Google Scholar].
Lai M.C., Lombardo M.V., Auyeung B., Chakrabarti B., Baron-Cohen S. Sex/gender differences and autism: 将来の研究のための舞台設定。J. Am. J. Am. Child Adolesc. Psychiatry. 2015;54:11-24. doi: 10.1016/j.jaac.2014.10.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
自閉症に関する最新情報: 科学、ジェンダー、法律。ジェンダー。医学。2006;3:73-78. doi: 10.1016/S1550-8579(06)80197-X. [PubMed] [CrossRef] [Google Scholar].
統合失調症患者におけるDNAメチル化: 性別とMTHFR 677C/T遺伝子型の違い。Epigenomics. 2012;4:261-268. doi: 10.2217/epi.12.25. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
マウス大脳皮質におけるシナプス蛋白質に対するMthfr遺伝子型と新生児ビガバトリン相互作用の性差効果。Neuropsychopharmacology. 2011;36:1714-1728. doi: 10.1038/npp.2011.52. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
臨床エピジェネティクス: 翻訳の機会をつかむ。Nat. Rev. Genet. 2019;20:109-127. doi: 10.1038/s41576-018-0074-2. [PubMed] [CrossRef] [Google Scholar].
Xavier M.J., Roman S.D., Aitken R.J., Nixon B. Transgenerational inheritance: 両親のエピジェネティックおよび遺伝情報への影響は、子孫の健康にどのように影響するか。Hum. Reprod. Update. 2019;25:518-540. doi: 10.1093/humupd/dmz017. [PubMed] [CrossRef] [Google Scholar].
山口 聡、Hong K.、Liu R.、井上 彰、Shen L.、Zhang K.、Zhang Y. 生殖細胞の初期化における5-メチルシトシンと5-ヒドロキシメチルシトシンの動態。細胞研究2013;23:329-339.doi: 10.1038/cr.2013.22. [この論文では、生殖細胞のリプログラミングにおける5-ヒドロキシメチルシトシンの役割について解説する。
第9章-ヒト神経発達障害におけるエピジェネティクスの新たな役割. In: Tollefsbol T.O., editor. Epigenetics in Human Disease. 第2版。Vol.6. Academic Press; Cambridge, MA, USA: 2018. [Google Scholar]
Gegenhuber B., Tollkuhn J. Sex Differences in the Epigenome: 脳の性分化の原因か結果か?Genes. 2019;10:432. doi: 10.3390/genes10060432. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Lister R., Mukamel E.A., Nery J.R., Urich M., Puddifoot C.A., Johnson N.D., Lucero J., Huang Y., Dwork A.J., Schultz M.D., et al. 哺乳類の脳発生におけるグローバルなエピゲノム再構成。Science. 2013;341:1237905。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
自閉症と統合失調症における稀なエピジェネティック変異のスクリーニング。Hum. Mutat. 2019;40:952-961. doi: 10.1002/humu.23740. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sabit H., Tombuloglu H., Rehman S., Almandil N.B., Cevik E., Abdel-Ghany S., Rashwan S., Abasiyanik M.F., Yee Waye M.M. 自閉症児の腸内細菌叢代謝産物: エピジェネティクスの観点から。Heliyon. 2021;7:e06105. doi: 10.1016/j.heliyon.2021.e06105. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
シナプス活動に焦点を当てた自閉症スペクトラム障害に関与する主な遺伝的、エピジェネティック、環境因子の概要。Int. J. Mol. 論文名:「自閉症スペクトラム障害の遺伝的・エピジェネティック・環境的要因の概要-シナプス活動に焦点をあてて-. [この論文では、自閉症スペクトラム障害におけるシナプス活動に焦点をあてた研究を行っている。
Hu V.W., Hong Y., Xu M., Shu H.T. 特発性自閉症の重症サブタイプにおけるDNAメチル化の変化: 特発性自閉症の重症サブタイプにおけるDNAメチル化の変化:影響を受ける代謝経路における性差の証拠。Autism. 2020;25:887-910. doi: 10.1177/1362361320971085. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
神経発達障害におけるオキシトシン受容体のDNAメチル化。J. Autism Dev. Disord. 2021 doi: 10.1007/s10803-020-04792-x. [PubMed][CrossRef][Googleスカラー]。
エピジェネティックな変化を引き起こす母体因子は、子孫の神経障害に寄与する。Genes. 2017;8:150. doi: 10.3390/genes8060150. [PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
Kundakovic M., Jaric I. The Epigenetic Link between Prenatal Adverse Environments and Neurodevelopmental Disorders. Genes. 2017;8:104. doi: 10.3390/genes8030104. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
哺乳類接合体における父系ゲノムの活性脱メチル化.J. Reprod. Dev. 2009;55:356-360. doi: 10.1262/jrd.20234. [PubMed][CrossRef][Googleスカラー]。
DHFR19bp欠失変異体による無脳症感受性の母体との関連と影響: 家族ベースのトライアド研究。Biomarkers. 2018;23:640-646. doi: 10.1080/1354750X.2018.1471619. [PubMed] [CrossRef] [Google Scholar].
葉酸はラットの新生児隔離誘発自閉症様行動を改善する: BDNFおよびGFAPプロモーターのエピジェネティック修飾」Appl. Physiol. Metab. 2021 doi: 10.1139/apnm-2020-0923. [PubMed] [CrossRef] [Google Scholar].
炭素代謝とエピジェネティクス: 特異性の理解。Ann. N. Y. Acad. 2016;1363:91-98。doi: 10.1111/nyas.12956。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
知的障害と自閉症スペクトラムに関与するヒストンメチルトランスフェラーゼEHMT1とKMT2Cの機能的収束。PLoS Genet. 2017;13:e1006864. doi: 10.1371/journal.pgen.1006864. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Van Winkle L.J., Ryznar R. 一酸化炭素代謝はエピジェネティックなDNAおよびヒストン修飾を介して胚性幹細胞の運命を制御する: 成人における世代を超えた代謝異常への示唆。Front. Cell Dev. 2019;7:300. doi: 10.3389/fcell.2019.00300. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ミトラI.、ホアンB.、ムサビN.、マーN.、ラムキンM.、ヤニッキーR.、シュライザー-ブルコS.、ロームラーK.E.、ジムレックM. de novoタンデムリピート変異のパターンと自閉症におけるその役割。Nature. 2021;589:246-250. doi: 10.1038/s41586-020-03078-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラム障害の病態生物学を明らかにするための大規模ゲノムデータセットの活用。Neuropsychopharmacology. 2021年;46:55-69. doi: 10.1038/s41386-020-0768-y.
全エクソーム塩基配列解析により、自閉症スペクトラム障害における6つの遺伝子ネットワークと相互作用する新規デノボ変異が同定された。Genes. 2020;12:1. doi: 10.3390/genes12010001. [PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
自閉症スペクトラム障害に関連する生物学的プロセスの検出をサポートするクラスタリング解析。Genes. 2020;11:1476。[PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
個別化医療への道を開く: バイオマーカー探索と患者層別化のための自閉症スペクトラム障害におけるマルチOMICSアプローチの現状と課題。J. Pers. Med. 2021;11:41. doi: 10.3390/jpm11010041. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
自閉スペクトラム症における男女比は?系統的レビューとメタ分析。J. Am. J. Am. Child Adolesc. Psychiatry. 2017;56:466-474. doi: 10.1016/j.jaac.2017.03.013. [PubMed] [CrossRef] [Google Scholar].
Cortes L.R., Cisternas C.D., Forger N.G. Does Gender Leave an Epigenetic Imprint on the Brain? Front. Neurosci. 2019;13:173. doi: 10.3389/fnins.2019.00173. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Genesからの記事はMultidisciplinary Digital Publishing Institute (MDPI)の提供でここに提供されます。
アマ アパ ムラ ニールエム
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、メリーランド州20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
この記事が気に入ったらサポートをしてみませんか?
