妊娠中の腸内細菌叢、微生物ネットワーク、および免疫の関連性(特定の細菌クラスターに焦点を当てて
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文研究トピックス編集委員会
ジャーナルについて
Frontiers.comについて
すべてのジャーナルすべての記事研究を投稿する
33総閲覧数
記事のインパクトを見る
オリジナル研究論文
Front. 微生物学、2023年12月13日
Sec.脊椎動物の消化器系における微生物
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1314257
妊娠中の腸内細菌叢、微生物ネットワーク、および免疫の関連性(特定の細菌クラスターに焦点を当てて
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1314257/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit
Hao Yan1† Xinyuan Liang1,2† Huijuan Luo1 Xiaomei Tang1 Xiaomin Xiao1* 1産科学教室
済南大学附属病院産婦人科
済南大学深圳第二臨床医学院(深圳人民病院)産科、中国、深圳
背景 腸内細菌叢の群集特性は十分に定義されておらず、個々の細菌の機能ほど広く研究されていない。本研究の目的は、腸内細菌叢のクラスター分析を行い、異なるクラスターと免疫状態との関係を分析することで、出産適齢期の女性における腸内細菌叢の群集組成を調査することである。
方法 15名の非妊娠女性と30名の妊娠後期女性を含む合計45名の妊娠可能年齢の女性を本研究にリクルートし、妊娠第3期に2回、具体的には32週と満期時に便サンプルを採取した。腸内細菌叢データは16S rRNAアンプリコンシークエンシングを用いて解析された。微生物のクラスタリングパターンを評価するために、Medoidsアルゴリズム周辺の分割を採用した。各クラスタの微生物ネットワークが実行され、クラスタにおける特定の属と免疫状態との関係を解析するために形質サイトカインが測定された。
結果 出産適齢期の女性における腸内細菌群集の構成には、3つの異なるクラスターが存在した。クラスター1(PAM_1)ではバクテロイデス属が多く、クラスター2(PAM_2)ではビフィドバクテリウム属とブラウチア属が多く、バクテロイデス属に対するファーミキューテス属の比率が有意に高かった。クラスター3(PAM_3)では、Escherichia-Shigellaが高濃度であった。PAM_1は非妊娠女性において最も優勢なクラスターであり、この優勢なクラスターは妊娠後期においても主要なクラスターの一つであった。満期産では、被験者の大多数が32週と同じクラスターを維持していたが、シフトを経験した被験者も少数いた。微生物相関ネットワークは3つのクラスターで異なり、PAM_1ではモジュール性が高く、結合数が少なかった。属と血漿中サイトカインとの相関を解析したところ、同じクラスター内でも妊娠中と非妊娠中とでサイトカインとの関連に有意な差が認められ、同じ属でもクラスターが異なれば効果も異なっていた。
結論 出産適齢期の女性は3つの腸内細菌叢分布パターンを示し、小規模集団では妊娠後期に腸内クラスターが再形成される。異なるクラスターは、異なる生理学的状態において多様な免疫調節作用を有する可能性がある。妊娠中の腸内細菌叢を研究する際には、健康な女性におけるクラスターの違いを考慮することが極めて重要である。
はじめに
ヒト体内の共生微生物からなる腸内細菌叢は、宿主の生理および病態生理と複雑に関連しており(de Vos et al., 2022)、環境、食事、宿主の因子によって影響を受ける可能性がある(Dong and Gupta, 2019)。母親のマイクロバイオームは、正常な妊娠の維持と子孫の健康の両方に大きな影響を与えると考えられている(EbioMedicine, 2021)。したがって、妊娠中の腸内細菌叢を包括的に理解することは非常に重要である。これまでの研究で、妊娠第3期における母体の腸内細菌叢の多様性の変化や、プロテオバクテリア(Proteobacteria)やアクチノバクテリア(Actinobacteria)の存在量の変動が報告されており(Koren et al. また、腸内細菌叢は妊娠中も比較的安定していることが観察されている(DiGiulio et al.) しかし、正常な妊娠中の女性の腸内細菌叢の組成を確認するためには、さらなる研究が必要である。妊娠は、胎児の成長と発達に伴って母体の免疫と代謝が大きく変化することを特徴とする特異な時期である(Zakariaら、2022年)。母体の免疫系は、陣痛が始まるまで胎児の成長を支えるため、妊娠第2期から第3期にかけて自然に抑制される(Menon, 2022; True et al.) 腸内細菌叢とその代謝産物は、局所および全身の免疫応答において調節的な役割を果たしており(Schluterら、2020;Wastykら、2021)、妊娠中の免疫状態の変化は、母体の腸内細菌叢と相関している可能性がある。
2011年に導入された「腸内型」という概念は、腸内細菌叢が集団内でいくつかの異なる微生物群集パターンに分類され、これらの腸内型が機能的差異と関連していることを示唆している(Arumugam et al.) 教師なしクラスタリング法を利用した最近の研究でも、ヒトの腸内細菌叢における潜在的なパターンが明らかになっている(Tap et al.) スペイン・地中海地域の産褥期の腸内細菌叢に焦点を当てた研究では、腸型クラスター分析により、母親の細菌叢は、それぞれプレボテラ属(クラスターI)とルミノコッカス属(クラスターII)を特徴とする2つの異なる腸内クラスターに分けられることが示された(Garcia-Mantrana et al.) さらに、妊娠の様々な段階を通して母豚の腸内細菌叢を調査した結果、妊娠初期と比較して妊娠後期には異なる群集パターンがあることが明らかになった(Berryら、2021)。腸内細菌叢組成には個体間で大きなばらつきが存在し、出産適齢期の女性、特に妊娠中の腸内細菌叢群集の違いについては、まだ完全には解明されていない。そこで本研究では、出産適齢期女性の群集組成の変化、微生物ネットワークの構造的特徴、および免疫状態との潜在的関連性を予備的に探索するための試験的研究として、腸内細菌叢の群集クラスター化に焦点を当てた。
材料と方法
研究デザインとサンプル収集
本研究では、済南大学第一付属病院で分娩を受けた地元在住の健康な非妊娠女性および妊娠後期の女性を対象とした。組み入れ基準は以下の通りである: (1)単胎で初回妊娠の中国人女性、(2)年齢は18~34歳、(3)妊娠中に合併症がなく、妊娠前の体格指数(BMI)が18.5~23.9kg/m2で正常、(4)広州に居住し、病院で定期的に妊婦検診を受けている。非妊婦は定期的な月経周期が必要であり、その他の採用基準は妊婦と同じであった(妊娠を除く)。除外基準は以下の通りであった: (1)胃腸疾患の既往歴および関連する胃腸疾患の家族歴、(2)妊娠中に抗生物質、プロバイオティクス、プレバイオティクスを服用していること(非妊婦の場合は過去6ヵ月以内に関連する薬剤の使用歴)、(3)現在の妊娠以前に慢性疾患があること。
妊娠第3期の女性30名と妊娠可能な年齢の非妊娠女性15名を本研究に組み入れ、すべての被験者に書面によるインフォームド・コンセントを提供した。すべての妊婦は定期的な妊婦検診を受け、それぞれ妊娠32週と分娩前の臨月の2回、糞便サンプルを採取した。糞便の採取方法は、尿と膣分泌液が混ざらないようにまず膀胱を空にし、約3cm3容積の大きさの糞便を採取し、滅菌綿棒を用いて糞便の内部の実質的な部分を3〜5g検体箱に採取し、30分以内に-80℃の冷蔵庫に入れた。糞便の採取には、統一された新しいサンプリングパッドシートを提供する。妊婦は自宅でも病院でも排便できるが、-80℃の冷蔵庫に移し、30分以内に低温環境で保存する必要がある。対照群では、月経周期の7~14日目に同じ方法で便サンプルを1回採取した。末梢静脈血は糞便採取日に採取し、血漿は遠心分離後-80℃冷蔵庫で保存した。母親と赤ちゃんの一般情報を収集する。非妊娠者を対照群、妊娠者を妊娠群とした。妊娠群は妊娠32週の妊娠後期(PL)群と妊娠満期(PT)群からなり、妊娠満期とは妊娠37週以降で陣痛が始まる前の妊娠と定義した。
DNA抽出と16S rRNA配列決定
サンプルのDNAはCTAB/SDS法で抽出し、アガロースゲル電気泳動でDNAの純度と濃度を検出した。適切な DNA サンプルを採取し、滅菌水で 1 ng/μl の濃度に希釈した。希釈したDNAを鋳型として、選択したV3-V4可変領域を、バーコード付き特異的プライマー341F-806RとDNAポリメラーゼを用いて、Bio-rad T100 gradient PCR装置で増幅した。イルミナTruSeq®DNA PCR-Freeライブラリー調製キットを用いてライブラリーを構築し、qubit解析を用いて定量および同定を行った。最後に、NovaSeq6000プラットフォームを用いてコンピューターシーケンスした。
16S rRNAシーケンスデータの解析
サンプルデータはバーコードとプライマー配列に従ってオフラインデータから分離され、生のタグデータはまずFLASHソフトウェアを用いてスプライシングされた。QIIME (V1.9.1)のタグ品質管理プロセスに従い、生タグをさらにスクリーニングして高品質のクリーンタグデータを得、これを生物種アノテーションデータベースと比較してキメラ配列を除去し、最終的な有効タグを得た。Uparse (v7.0.1001)を用いて、類似度閾値97%で有効タグを操作分類単位(OTU)にクラスタリングした。Silvaデータベースに基づいてOTUに分類を割り当てた。
血漿中サイトカイン検査
血漿中サイトカイン(インターロイキン[IL]IL-1β、IL-2、IL-6、IL-10、IL-12、インターフェロン-γ、腫瘍壊死因子-α)濃度は、Luminex® Discovery Assay Human Premixed Multi-Analyte Kit on Luminex® 200™ Systemを用いて測定した。
統計解析
統計解析はRソフトウェアおよびSPSSソフトウェアを用いて行った。測定値は平均値±標準偏差で示した。群間比較にはT検定とANOVAを用いた。クラスター分析は、Jensen-Shannon距離に基づくPartitioning Around Medoids(PAM)アルゴリズムを用いて行った。クラスター間の微生物特性の差異を特定するために、LDA(線形判別分析)効果量(LefSe)(Segata et al.、2011)を利用し、閾値LDA値は>4.0とした。存在量が0.1%を超え、サンプルの20%以上に存在する属は、Cytoscape(Shannon et al.) ネットワーク可視化の基準には、スピアマン相関分析によって決定された絶対rスコア > 0.6およびp < 0.05が含まれた。属とサイトカインの相関を示すヒートマップは、Rのpheatmapパッケージを用いて作成した。
結果
健康な非妊娠女性15名と妊娠後期の女性30名を本研究に組み入れた。すべての女性は漢民族で、中国南部に居住していた。登録された被験者の人口統計学的情報はほぼ同じであった(表1)。最終的に、75の糞便サンプルが16S rRNA配列決定のために送られた。
表1
表1. 本研究に登録された被験者の臨床的特徴。
腸内細菌叢の群集分布特性
妊婦と非妊婦の腸内細菌叢の構成を特徴付けるために、腸内細菌叢のクラスター解析を行った。支配的な分類群の存在量分布は、Jensen-Shannon距離を用いて定量化した。最適なグループ数を決定するため、Calinski-Harabasz(CH)指数を算出した。CH指数によると(図1A)、最適なクラスター数は3グループと決定され、クラスタリング後の主座標分析(PCoA)ではクラスター間の有意な分離が示された(図1B)。
図1
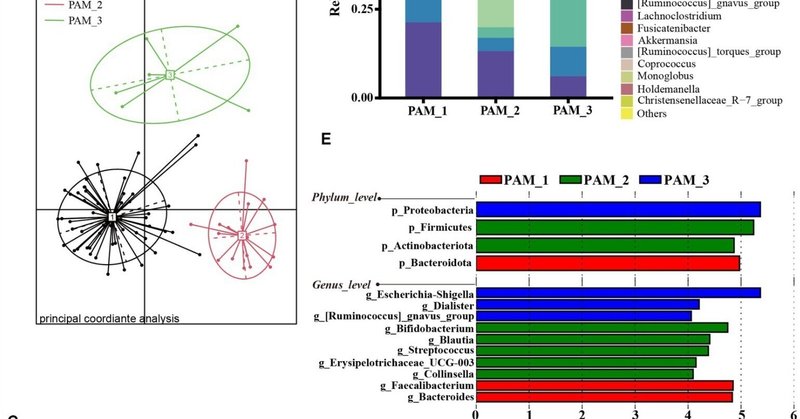
図1. 出産適齢期の女性における腸内細菌叢のクラスター解析。(A)支配的な分類群の存在量に従って、サンプルはPAMアルゴリズムによりCH指数が最も高い3つのクラスターにクラスタリングされた;(B)3つのクラスターからのJensen-Shannon距離に基づくサンプル分布;(C)3つのクラスターの主な系統構成;(D)3つのクラスターの上位30属の構成;(E)3つのクラスター間の門および属レベルでのLEfSe分析(LDAスコア>4. 0, p < 0.05); (F) 3クラスター間のF/B比の差。
3つのクラスターの構成を分析したところ(図1C)、クラスター1(PAM_1)は主にファーミキューテス(Firmicutes)で構成され、次いでバクテロイデーテス(Bacteroidota)で、それぞれ65.48%±13.91%、24.20%±13.21%であった(平均値±標準偏差)。クラスター2(PAM_2)でも、ファーミキューテス類が優勢で、次いでアクチノバクテリオータが続き、相対量はそれぞれ66.36%±12.60%、18.45%±8.94%であった。クラスター3(PAM_3)では、プロテオバクテリア(49.77%±17.20%)が優勢で、ファーミキューテス(32.71%±14.24%)が二次的に存在した。属レベルでは(図1D,E)、PAM_1ではFaecalibacterium(ファーミキューテス門)とBacteroides(バクテロイデス門)で有意な増加が観察された。PAM_2では、Bifidobacterium [phylum Actinobacteriota]、Blautia [phylum Firmicutes]、Streptococcus [phylum Firmicutes]、Erysipelotrichaceae_UCG-003 [phylum Firmiculus]、Collinsella [phylum Actinobacteriota]で顕著な増加が見られた。PAM_3は、Escherichia-shigella [プロテオバクテリア門]が有意に増加し、Dialister [ファーミキューテス門]と[Ruminococcus]_gnavus_group [ファーミキューテス門]も増加した。この差分属は各クラスターで優勢な門に対応しており、異なる腸内クラスター内で優勢な細菌の存在量にばらつきがあることを示している。さらに、ファーミキューテス属とバクテロイ ドータ属の比率(F/B比)は3つのクラスター間で有意差が認められ、PAM_2ではF/B比が有意に増加した(図1F)。
妊娠中の群集クラスターの変化
妊娠可能年齢の女性における腸内細菌叢のクラスター分布(図2A)に基づくと、主要クラスターはPAM_1で、対照群では15人中14人、PL群では30人中18人、PT群では30人中21人に存在した。さらに、PAM_2は妊娠第3期に多くみられ、PL群では30人中6人、PT群では30人中9人にみられたが、対照群では少なかった(15人中1人)。さらに、PAM_3はPL群でのみ観察され、一定の割合(30人中6人)を占めた。これらの知見は、妊娠32週における腸内細菌叢の複雑さを浮き彫りにしており、集団内の優勢な分類群の存在量には大きなばらつきがあった。
図2
図2. 腸内クラスター分布の特徴づけ。(A)対照群、PL群、PT群における3つのクラスターの構成;(B)PL期からPT期までの妊娠群の被験者の腸内クラスターの分布。
PL期からPT期にかけて、同じ被験者内でのクラスターの変化についてさらに解析を行った(図2B)。その結果、妊娠32週から臨月までの被験者の大部分(30人中21人、PAM_1に分類されたのが16人、PAM_2に分類されたのが5人)において、腸内クラスターは一貫したままであった。しかし、ごく一部の人(30人中9人)では、クラスター群に変化が見られた。これらの知見から、妊娠後期には、ほとんどの個体で腸内コミュニティは比較的安定しているが、この時期にクラスター・コミュニティに変化が生じる個体も少数ながら存在することが示唆された。
異なるクラスターの微生物ネットワークの特徴づけ
各クラスターについて、コントロール群とPL群の間で属レベルの相関ネットワークを比較した(図3A-D)。その結果、PAM_2およびPAM_3と比較して、PAM_1はモジュール性の高い疎なネットワークを示した。属間相関の数はPAM_1では少なく、正の相関が優勢であった。さらに、PAM_2とPAM_3では微生物ネットワークがより複雑になり、モジュール構造が減少し、属間の相関が増加し、負の相関の割合が高くなった。ネットワーク属性表(表2)は、PAM_1、PAM_2、PAM_3の違いをさらに際立たせている。この表では、直径はネットワーク内の任意の2つのノード間の最大距離、モジュール性はネットワークが意味のあるモジュールまたはコミュニティに分割されている度合い、クラスタリング係数はノードが隣接ノードに接続されている可能性を測定、平均次数は異なるノード間の関連性を測定、平均パス長はネットワーク内で接続パスを持つノードのペア間の平均距離である。PAM_1は、PAM_2やPAM_3と比較して、ネットワーク・ノードやエッジの数が少なかった。モジュール性係数はPAM_1の方が高く、より合理的なサブネットワークであることを示す一方、クラスタリング係数は低く、モジュール間のネットワークがより分散していることを示唆した。差異属間の相関ネットワークをさらに観察すると(図3E-H)、PAM_1では相関が少なく、差異属の数も少なかった。逆に、PAM_2とPAM_3は比較的複雑なネットワーク関係を示した。さらに、属間の相関はその存在量とは有意に関連していないことがわかった。例えば、PAM_1では存在量が優勢なBacteroidesは他の差属との有意な相関を示さず、PAM_3では存在量が優勢なEscherichia-Shigellaはネットワーク相関の数において優位性を示さなかった。
図3
図3. 属レベルの異なるクラスターの微生物ネットワーク。ネットワークはスピアマン相関分析に基づいている(r ≥ 0.6、p < 0.05)。各ノードはネットワーク内の属を表し、色はその門レベルで示される。ノードが大きいほど、ネットワーク内の相関関係の数が多い。赤い線は正の相関、青い線は負の相関で、各図の下に正と負の相関の割合を示す。相関係数rスコアが大きいほど線は太くなる。(A-D)各クラスターについて、0.1%以上の存在量を満たし、20%以上のサンプルで発現している属間の微生物相関ネットワーク。(A)対照群におけるPAM_1のネットワーク;(B)PL群におけるPAM_1のネットワーク;(C)PL群におけるPAM_2のネットワーク;(D)PL群におけるPAM_3のネットワーク。(E-H)異なるクラスターにおけるLEfSeから選択された差属の微生物相関ネットワーク。(E)対照群におけるPAM_1の差属ネットワーク;(F)PL群におけるPAM_1の差属ネットワーク;(G)PL群におけるPAM_2の差属ネットワーク;(H)PL群におけるPAM_3の差属ネットワーク。
表2
表2. 3つのクラスターの微生物ネットワーク位相係数。
腸内クラスターと形質サイトカインの相関性
異なるクラスターの機能を調べるために、異なる状態におけるクラスターとサイトカインの関係を解析した。妊娠後期では、サイトカインレベルは非妊娠時に比べて有意に低く、PL群ではクラスター間に統計学的な差は観察されなかった(表3)。差属と血漿中サイトカインとの相関分析を行った。その結果、妊婦におけるクラスターとサイトカインの相関は、非妊婦のそれと有意に異なることが示された(図4A,B)。さらに、同じ属でも非妊娠時と妊娠後期では相関傾向が異なっていた。例えば、Streptococcus属とBlautia属は、対照群のPAM_1クラスターではサイトカインと正の相関を示したが、PL群のPAM_1クラスターでは負の相関を示した。同様に、対照群のPAM_1クラスターで負の相関を示したFaecalibacteriumとBacteroidesは、PL群のPAM_1クラスターでは有意な相関を示さなかった。妊娠後期には、3つのクラスターとサイトカインの間にわずかな違いが観察された(図4B-D)。PAM_1では、各属は概してサイトカインと弱い相関を示した。PAM_1とPAM_2におけるBlautia属とサイトカインとの相関はほとんどが陰性であったが、PAM_3では主に陽性であった。Erysipelotrichaceae_UCG-003はPAM_3でIL-10と有意な正の相関を示し、PAM_2では負の相関を示したが、PAM_1では有意な相関は示さなかった。これらの知見から、属の役割は単一ではなく、状態や群集によって異なる免疫調節の役割を担っている可能性が示唆された。
図4
図4. 異なるクラスターにおけるサイトカインと差分属の相関ヒートマップ。差分属はLEfSe解析から選択した。(A)対照群のPAM_1;(B)PL群のPAM_1;(C)PL群のPAM_2;(D)PL群のPAM_3。p < 0.1、***p < 0.05、***p < 0.001、黒枠で示したものは統計的差異を示す。
表3
表3. 異なるクラスターにおける形質細胞サイトカインレベル。
考察
クラスター分析により、非妊娠時から妊娠後期、妊娠満期までの女性の腸内細菌叢のコミュニティーに違いがあることがわかった。妊娠後期では、腸内細菌叢はより複雑な組成を示し、腸内細菌叢の分布は複数の異なるクラスターを示した。さらに、異なるクラスターは独自の微生物ネットワークを示した。腸内細菌叢と血漿中サイトカインとの相関は、これらの異なるクラスター間で、また同じクラスター内でも妊娠中と非妊娠中といった異なる生理的条件下で異なっていた。
本研究では、妊娠後期および非妊娠時の出産適齢期の女性において、支配的な腸内細菌叢の存在パターンに3つの異なるクラスターが観察された。PAM_1とラベル付けされた第一の腸内クラスターは、女性において優勢であることが判明し、優勢な門としてファーミキューテス(Firmicutes)とバクテロイデーテス(Bacteroidota)を特徴とした。属レベルでは、このクラスターはFaecalibacteriumとBacteroidesの高い存在レベルを示した。これらの知見は、中国人集団における腸内細菌叢の存在量コミュニティを報告した先行研究(Luら、2021年)と一致している。バクテロイデス属とフェカリバクテリウム属は腸内の中心的な属であり、健康な腸内細菌叢において有意な存在量の優位性がある(Human Microbiome Project Consortium, 2012; Lopez-Siles et al.) 注目すべきは、本研究の参加者は長期にわたる地元住民であり、年齢やBMIなどの環境因子や身体的特徴が類似していたことである。これらの要因は、先行研究(He et al.、2018年)で報告されているように、微生物叢の変動と宿主の地理的位置との強い関連とともに、妊娠中および非妊娠中の女性の両方でPAM_1クラスターが優勢であったことを説明する可能性がある。
他の2つのクラスターは妊娠後期に優位に観察され、PAM_2がより豊富であった。PAM_2では、門レベルでActinobacteriotaの増加が妊娠第3期に一般的に観察されるが、これは妊娠中の腸内細菌叢の正常な変化である可能性がある(Koren et al.) 妊娠後期におけるビフィドバクテリウムの高い存在量もまた、プロゲステロンの影響を受け、その存在量に変化をもたらす可能性がある(Nuriel-Ohayonら、2019)。妊娠後期は、急速な胎児の成長を支えるために母体のグルコース産生と循環脂質が増加し、母体のインスリン抵抗性を伴うことが特徴である(Lockitch, 1997; Bowman et al., 2021)。妊娠後期の主要クラスターの一つであるPAM_2クラスターは、ファーミキューテス類とバクテロイデーテス類の比率が有意に高いことを示した。これまでの研究で、ファーミキューテス菌とバクテロイーダ菌の比率と、肥満やインスリン抵抗性などの代謝性疾患との間に密接な関連があることが示唆されている(Magne et al.) Blautiaは、潜在的なプロバイオティクスとして、宿主の健康を調節し、メタボリックシンドロームを緩和する役割を果たす可能性があり、その発現量は、健康な女性よりも妊娠糖尿病(GDM)の女性で低いことが報告されている(Ozato et al.、2019;Liu et al.、2021)。PAM_2におけるErysipelotrichaceae_UCG-003の存在は、妊娠第3期の耐糖能障害と関連することが判明した(Vavreckovaら、2022)。PAM_2におけるこれらの属の存在量の変化は、妊娠中の代謝状態の変化や母体の健康維持に関連している可能性がある。PAM_3クラスターは、妊娠32週の女性にのみ観察された。以前の研究では、妊娠T3週で一部の集団でプロテオバクテリアの増加が観察され、マイクロバイオームの移入により、無菌受容体マウスで著しい肥満と炎症が誘発された(Korenら、2012年)。健康で安定した状態では、ヒト腸内のプロテオバクテリアの相対量は45%まで増加する可能性があり(Caporaso et al. プロテオバクテリアと腸内細菌科細菌の拡大は、宿主のエネルギー不均衡と不安定な微生物群集(ディスバイオシス)を反映している(Shinら、2015;Litvakら、2017)。妊娠中の母親の脂質異常症に関する研究では、腸内細菌叢のクラスタリング解析で、Faecalibacterium属、Blautia属、Bacteroides属などが優勢で、総コレステロールとトリグリセリドのレベルが高いことがわかった(Yang et al.) これらの高濃度属は、本研究のクラスター1およびクラスター2と類似しており、いずれも妊娠後期の集団で最も一般的な群集組成であった。本研究で対象とした妊婦はすべて正常妊娠であり、妊娠第3期に観察されたクラスターは、妊娠によってもたらされた腸内細菌叢の変化の結果であり、妊娠後期の腸内細菌叢の複雑な組成を反映している可能性がある。一方、新生児腸内の初期コロニー形成者には、腸内細菌科やビフィドバクテリウム、連鎖球菌が含まれ、妊娠後期における関連分類群の増加も、腸内細菌叢の母子移行に必要である可能性がある(Xiao and Zhao, 2023)。
妊娠中の腸内細菌叢の変化に関する研究は現在も続けられており、プロテオバクテリアの増加やバクテロイーダ菌の減少など、腸内細菌叢の動的な変化を明らかにした研究もある(Korenら、2012;Liら、2023)。しかし、他の研究では、妊娠中の腸内細菌叢の安定した組成が報告されている(Jostら、2014;DiGiulioら、2015)。本研究では、妊娠後期の被験者のクラスター変化を追跡し、非妊娠女性のクラスターと比較した。これらの知見に基づき、妊娠可能な年齢のほとんどの女性の腸内細菌叢は、妊娠後期においても一般的に安定を保ち、妊娠に起因する変化を経験するグループは少数派である可能性が示唆された。腸内細菌叢のリモデリングは、異なる分類群間の存在量分布の変動に明らかである。さらに、微生物間の相互作用のネットワーク構造にも顕著な違いが観察された。同様のサイトカインレベルは、異なる腸内クラスターを持つ被験者の間で同様の免疫状態を予測していたことから、腸内細菌叢はより全体的な性格を持ち、全体的なユニットとして機能しているのではないかという仮説を立てた。変化した腸内細菌叢でも宿主の免疫バランスは維持されているため、腸内細菌叢の組成の変化が細菌属間の関係の変化に関係している可能性がある。
これまでの研究で、腸内細菌叢が宿主免疫の制御に一役買っている可能性が示されている(Blander et al.) 妊娠中、母体の免疫は、胎児の寛容と保護を確保するために複雑で動的な調節を受けている(Bonney, 2016)。健康な妊娠の着床と分娩には炎症反応が関与しているが、正常な胎児の発育をサポートするためには、寛容で抗炎症的な環境が確立される(Yockey and Iwasaki, 2018)。本研究では、PL群の被験者は全員陣痛が始まっていない段階であり、非妊娠群と比較して有意に低いサイトカインレベルが観察され、妊娠の免疫抑制状態を反映していた。分娩時の母親の腸型とアディポカインを相関させた研究では、プレボテラの腸型とリポカリンレベルとの間に有意な関連が認められた(Rio-Aigeら、2021年)。異なる腸内細菌叢群集と身体の免疫状態との関係を探るため、3つのクラスター間で異なる細菌属を特徴的な細菌属として取り上げた。異なる属とサイトカインを相関させることで、妊娠後期の異なる腸内細菌叢群集において、同じ属がサイトカインに及ぼす影響が異なることを見出した。これまでの微生物機能の探索から、個々の菌株が宿主免疫に及ぼす影響は、周囲の微生物群集の状況によって大きく異なることが示唆されている(Riceら、2022年)。したがって、腸内細菌叢の調節能力は、個々の細菌によってではなく、むしろコミュニティ全体によって集団的に発揮されている可能性がある。さらに、同じクラスター内であっても、1つの属が妊娠中と非妊娠中とで異なる免疫調節機能を示すことが観察された。我々は、属の機能は身体の免疫状態と密接に関係しており、属の機能は一様ではないという仮説を立てた。
本研究には、認識しておくべきいくつかの限界があった。第一に、サンプルサイズが小さかったことであり、サンプルサイズが大きければ、腸内群集のクラスター分析の一般化可能性が高まるであろう。第二に、この研究では同じ被験者について、非妊娠時と妊娠後の対照観察が欠けており、包括的な比較を確立することが困難であった。さらに、腸内型の違いは食事要因に影響される可能性があることを考慮する価値がある。本研究の対象者は妊婦検診時にバランスのとれた食事教育を受けているが、具体的な食事構成については十分に調査されておらず、食事による交絡因子の影響の可能性は排除できない。最後に、16Sアンプリコンシークエンシングでは属レベルでのみ正確な結果が得られ、特定の菌株のさらなる解析は不可能であることに留意することが重要である。
結論
本研究では、出産適齢期の女性における腸内細菌叢の特徴的な分布パターンが観察された。大多数の女性は安定した微生物群を示したが、ごく一部の女性は妊娠に反応して腸内コミュニティーの再形成を経験した。妊娠中の腸内細菌叢を研究する際には、健康な集団における群集構造の個人差を考慮することが極めて重要である。さらに、特定の属の群集特性にも注意を払う必要がある。異なる群集における同じ属が、免疫に異なる影響を及ぼす可能性があるからである。
データの利用可能性
本研究で発表されたデータセットは、オンラインリポジトリで見ることができる。リポジトリ名とアクセッション番号は下記を参照: BioProject, PRJNA997585.
倫理声明
ヒトを対象とした本研究は、済南大学第一付属病院のInstitutional Review Board for Human Subjects Researchにより承認された。本研究は、現地の法律および施設の要件に従って実施された。参加者は、本研究への参加について書面によるインフォームド・コンセントを提供した。
著者貢献
HY:方法論、ソフトウェア、視覚化、原案執筆、校閲・編集。XL:データキュレーション、調査、執筆-校閲・編集。HL:執筆-校閲・編集。XT: 執筆-校閲・編集。XX:構想、資金獲得、プロジェクト管理、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または発表のために財政的支援を受けたことを表明する。本研究は、中国国家自然科学基金会(81771644)の資金援助を受けた。
謝辞
中国国家自然科学基金会の資金援助と本研究に参加してくれた女性に感謝する。また、試料を保管してくださった済南大学第一付属病院バイオバンクに感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Arumugam, M., Raes, J., Pelletier, E., Le Paslier, D., Yamada, T., Mende, D. R., et al. ヒト腸内細菌叢の腸型。Nature 473, 174-180.
PubMed Abstract|全文|Google Scholar
Berry, A. S. F., Pierdon, M. K., Misic, A. M., Sullivan, M. C., O'Brien, K., Chen, Y., et al. 妊娠中の母親の腸内細菌叢のリモデリングは、分娩数によって形成される。微生物叢9:146. doi: 10.1186/s40168-021-01089-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Blander, J. M., Longman, R. S., Iliev, I. D., Sonnenberg, G. F., and Artis, D. (2017). 微生物叢と宿主との相互作用による炎症の制御。Nat. Immunol. 18, 851-860.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bonney, E. A. (2016). 妊娠中の免疫調節:視点の問題?Obstet. Gynecol. Clin. 43, 679-698.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bowman, C. E., Arany, Z., and Wolfgang, M. J. (2021). 母体と胎児の代謝コミュニケーションの制御。Cell. Mol. 生命科学 78, 1455-1486.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Caporaso, J. G., Lauber, C. L., Costello, E. K., Berg-Lyons, D., Gonzalez, A., Stombaugh, J., et al. ヒトマイクロバイオームの動画。ゲノム生物学 12:R50.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
de Vos, W. M., Tilg, H., Van Hul, M., and Cani, P. D. (2022). 腸内マイクロバイオームと健康:メカニズム的洞察。Gut 71, 1020-1032. doi: 10.1136/gutjnl-2021-326789
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
DiGiulio, D. B., Callahan, B. J., McMurdie, P. J., Costello, E. K., Lyell, D. J., Robaczewska, A., et al. 妊娠中のヒト微生物叢の時間的・空間的変動。Proc. Natl. Acad. 米国)112, 11060-11065.
パブコメ要旨|全文|Google Scholar
Dong, T. S., and Gupta, A. (2019). 初期生活、食事、環境がマイクロバイオームに及ぼす影響。Clin. Gastroenterol. Hepatol. 17, 231-242. doi: 10.1016/j.cgh.2018.08.067
PubMed Abstract|RefRef Full Text|Google Scholar
EbioMedicine (2021). 母親のマイクロバイオーム:母親と乳児をつなぐもう一つの架け橋。論文タイトル:「母体マイクロバイオーム:母親と乳幼児をつなぐもう一つの架け橋」。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Garcia-Mantrana、I.、Selma-Royo、M.、Gonzalez、S.、Parra-Llorca、A.、Martinez-Costa、C.、Collado、M.C.(2020年)。母親のマイクロバイオータクラスターは妊娠中の食事と関連している:生後18ヶ月の新生児マイクロバイオータと乳児の成長への影響。腸内細菌 11, 962-978. doi: 10.1080/19490976.2020.1730294
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
He, Y., Wu, W., Zheng, H. M., Li, P., McDonald, D., Sheng, H. F., et al. 地域差が健康な腸内細菌叢の基準範囲と疾患モデルの応用を制限している。Nat. Med. 24, 1532-1535. doi: 10.1038/s41591-018-0164-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Human Microbiome Project Consortium (2012). 健康なヒトのマイクロバイオームの構造、機能、多様性。Nature 486, 207-214.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jost, T., Lacroix, C., Braegger, C., and Chassard, C. (2014). 妊娠後期から授乳期初期における母親の腸内細菌叢の安定性。Curr. Microbiol. 68, 419-427. doi: 10.1007/s00284-013-0491-6
クロスレフ・フルテキスト|Google Scholar
Koren, O., Goodrich, J. K., Cullender, T. C., Spor, A., Laitinen, K., Backhed, H. K., et al. 妊娠中の腸内細菌叢の宿主リモデリングと代謝変化。細胞 150, 470-480.
パブコメ抄録|全文|Google Scholar
Li,M.、Zhang,G.、Cui,L.、Zhang,L.、Zhou,Q.、Mu,C.、他(2023)。中国人女性における妊娠中の腸内細菌叢の動的変化と影響因子:前向きコホート研究。Front. Microbiol. 14:1114228. doi: 10.3389/fmicb.2023.1114228.
パブコメ要旨|全文|Google Scholar
Litvak, Y., Byndloss, M. X., Tsolis, R. M., and Bäumler, A. J. (2017). Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunctionial. Curr. Opin. Microbiol. 39, 1-6. doi: 10.1016/j.mib.2017.07.003
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu,X.、Mao,B.、Gu,J.、Wu,J.、Cui,S.、Wang,G.、他(2021年)。Blautia-プロバイオティクス特性を持つ新しい機能性属?Gut Microbes 13, 1-21. doi: 10.1080/19490976.2021.1875796.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lockitch, G. (1997). 妊娠の臨床生化学。Crit. Rev. Clin. Clin. Lab. Sci.34、67-139。
CrossRef 全文|Google Scholar
Lopez-Siles, M., Duncan, S. H., Garcia-Gil, L. J., and Martinez-Medina, M. (2017). Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. ISME J. 11, 841-852. doi: 10.1038/ismej.2016.176.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lu, J., Zhang, L., Zhai, Q., Zhao, J., Zhang, H., Lee, Y. K., et al. 中国人の腸内細菌叢とその主食タイプ、民族、都市化との関連。NPJ Biofilms Microbiom. 7:71. doi: 10.1038/s41522-021-00245-0
パブコメ抄録|全文|Google Scholar
Magne, F., Gotteland, M., Gauthier, L., Zazueta, A., Pesoa, S., Navarrete, P., et al. ファーミキューテス/バクテロイデーテス比:肥満患者における腸内細菌異常症の関連マーカー?栄養12:1474.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Menon, R. (2022). 胎児と母体の境界面における胎児の炎症反応:正期産と早産における陣痛の必要条件。Immunol. 308, 149-167. doi: 10.1111/imr.13075.
パブコメ要旨|全文|Google Scholar
Nuriel-Ohayon, M., Neuman, H., Ziv, O., Belogolovski, A., Barsheshet, Y., Bloch, N., et al. プロゲステロンは妊娠後期のビフィズス菌相対量を増加させる。Cell Rep. 27, 730-736.e3. doi: 10.1016/j.celrep.2019.03.075
CrossRef フルテキスト|Google Scholar
大里直樹、斎藤慎一郎、山口智子、片島正明、徳田一郎、澤田和彦、他(2019).20-76歳成人における内臓脂肪蓄積と関連するBlautia属菌.NPJ Biofilms Microbiom. 5:28. doi: 10.1038/s41522-019-0101-x
パブコメ抄録|全文|Google Scholar
Rice, T. A., Bielecka, A. A., Nguyen, M. T., Rosen, C. E., Song, D., Sonnert, N. D., et al. 種間常在性相互作用は宿主免疫に非線形な影響を及ぼす。細胞宿主微生物 30, 988-1002.e6. doi: 10.1016/j.chom.2022.05.004
パブコメ抄録|全文|Google Scholar
Rio-Aige, K., Azagra-Boronat, I., Massot-Cladera, M., Selma-Royo, M., Parra-Llorca, A., Gonzalez, S., et al. 臍帯血のサイトカインと免疫グロブリンのプロファイルにおける母親の微生物叢と食事の関連性。Int. J. Mol. Sci.22:1778。doi: 10.3390/ijms22041778
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Schluter, J., Peled, J. U., Taylor, B. P., Markey, K. A., Smith, M., Taur, Y., et al. 腸内細菌叢はヒトの免疫細胞動態と関連している。Nature 588, 303-307.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Segata, N., Izard, J., Waldron, L., Gevers, D., Miropolsky, L., Garrett, W. S., et al. メタゲノム解析によるバイオマーカーの発見と説明。ゲノム生物学 12:R60.
メタゲノムバイオマーカーの発見と解説。
Shannon,P.、Markiel,A.、Ozier,O.、Baliga,N. S.、Wang,J. T.、Ramage,D.、他 (2003). Cytoscape:生体分子相互作用ネットワークの統合モデルのためのソフトウェア環境。遺伝子発現を解析する。
ゲノム配列の決定には、遺伝子発現の解析が必要である。
ゲノムRes.13, 24-2504。(2015). Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 33, 496-503. doi: 10.1016/j.tibtech.2015.06.011.
クロスレフ・フルテキスト|Google Scholar
Tap, J., Lejzerowicz, F., Cotillard, A., Pichaud, M., McDonald, D., Song, S. J., et al. ヒト腸内細菌叢のグローバルな分岐とローカルな状態は、環境因子や内在性因子との関連を定義している。Nat. Commun. 14:3310. doi: 10.1038/s41467-023-38558-7
パブコメ抄録|全文|Google Scholar
True, H., Blanton, M., Sureshchandra, S., and Messaoudi, I. (2022). 妊娠中の単球とマクロファージ:良いもの、悪いもの、そして醜いもの。Immunol. 308, 77-92. doi: 10.1111/imr.13080.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Vavreckova, M., Galanova, N., Kostovcik, M., Krystynik, O., Ivanovova, E., Roubalova, R., et al. 肥満女性を含むコホートにおいて、妊娠前半の特異的な腸内細菌および真菌の微生物叢パターンが妊娠糖尿病の発症に関連している。Front. Endocrinol. (ローザンヌ)13:970825.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wastyk, H. C., Fragiadakis, G. K., Perelman, D., Dahan, D., Merrill, B. D., Yu, F. B., et al. 腸内細菌叢を標的とした食事は、ヒトの免疫状態を調節する。細胞 184, 4137-4153.e14. doi: 10.1016/j.cell.2021.06.019
パブコメ抄録|クロスリファレンス全文|Google Scholar
Xiao, L., and Zhao, F. (2023). 微生物伝播、コロニー形成および継代:妊娠から乳児期まで。腸 72, 772-786. doi: 10.1136/gutjnl-2022-328970.
パブコメ要旨|全文|Google Scholar
Yang,X.,Zhang,M.,Zhang,Y.,Wei,H.,Guan,Q.,Dong,C.,他(2023)。妊娠中の腸内細菌叢の生態学的変化と脂質異常症への進展。NPJ Biofilms Microbiom. 9:14. doi: 10.1038/s41522-023-00383-7
パブコメ抄録|全文|Google Scholar
Yockey, L. J., and Iwasaki, A. (2018). 妊娠と胎児発育におけるインターフェロンと炎症性サイトカイン。doi: 10.1016/j.immuni.2018.07.017.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zakaria, Z. Z., Al-Rumaihi, S., Al-Absi, R. S., Farah, H., Elamin, M., Nader, R., et al. 妊娠中のマイクロバイオームと宿主間の生理的変化と相互作用。Front. Cell. Infect. Microbiol. 12:824925.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:腸内細菌叢、妊娠、クラスター解析、微生物ネットワーク、免疫
引用 妊娠中の腸内細菌叢、微生物ネットワーク、免疫の関連を特定の細菌クラスターに着目して解析した。Front. Microbiol. 14:1314257.
受理された: 2023年10月10日;受理:2023年11月28日;
発行:2023年12月13日
編集者
リカルド・アラウージョ、ポルト大学、ポルトガル
査読者
Yashu Kuang, 広州医科大学, 中国
Ji Youn Yoo, テネシー大学ノックスビル校(米国
Copyright © 2023 Yan, Liang, Luo, Tang and Xiao. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信欄:Xiaomin Xiao, Xiaomin Xiao, xiaoxiaomin55@163.com
これらの著者はこの研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
運動性細菌は生物集散を利用し、自然水環境における生態生理学的利益をもたらす
フランチェスコ・ディ・ネジオ、サムエレ・ローマン、アントワーヌ・ブエッティ=ディン、オスカー・セパルベダ・スタイナー、ダミアン・ブファール、アヌパム・セングプタ、ニコラ・ストレッリ
宇宙船の汚染除去に適した様々な滅菌技術を用いた材料表面の細菌および真菌のバイオバーデン減少
木村俊太,石川周,林信也,藤田和久,稲富裕子,鈴木志乃
河口潮間帯における土壌無機態窒素が細菌系統に与える影響.窒素代謝に関する研究
李思奇・劉天洋・劉成・孫東蕾・厳秦・高登州・張宗暁
訂正 K2レベルの歩行器による人工膝関節と人工足関節の使用:症例報告
Ann M Simon、Suzanne B Finucane、Andrea J Ikeda、R. James Cotton、Levi J Hargrove
成長中の大腸菌において、タンパク質チオールは細胞内活性酸素種の主要な標的ではないことの証拠
ステファニー・S・エベン、ジェームズ・A・イムレイ
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー|利用規約
この記事が気に入ったらサポートをしてみませんか?
