
敗血症関連脳症における短鎖脂肪酸の応用背景とメカニズム
0total views
記事を見る インパクト
MINI REVIEWの記事
フロント Cell. Infect. マイクロビオール、2023年3月28日
第2回 腸内細菌叢(ちょうないさいきんそう
第13巻~2023年|https://doi.org/10.3389/fcimb.2023.1137161
この記事は、「研究テーマ」の一部です。
感染時の微生物に及ぼす代謝物や微量ミネラルの影響を解明する
全4件の記事を見る
敗血症関連脳症における短鎖脂肪酸の応用背景とメカニズム
Qiulei Zhang1、Chang Lu2、Weixuan Fan1、Jingxiao Zhang1*、Yongjie Yin1*。
1吉林大学第二病院救急・救命科(中国・長春市
2吉林大学第二病院麻酔科、長春、中国
敗血症関連脳症(SAE)は、敗血症患者に頻繁に見られる脳機能障害であり、せん妄、認知障害、異常行動などの症状が現れる。特に、腸内細菌と短鎖脂肪酸(SCFA)は、SAE患者の神経炎症と関連しており、研究者の注目を集めている。また、脳機能と腸内細菌叢・脳軸との関連もしばしば報告されています。SAEの発生、発症、治療戦略については広く研究されているが、SAEは依然として敗血症の長期予後を決定する重要な要因であり、一般的に高い死亡率と関連している。本総説では、SCFAと中枢神経系のミクログリアとの相互作用に焦点を当て、遊離脂肪酸受容体への結合やヒストン脱アセチル化酵素阻害剤としての作用によるSCFAの抗炎症および免疫調節効果について議論した。最後に、SCFAを食事栄養素として用いた食事介入によるSAEの予後改善への展望を検討した。
はじめに
敗血症は、感染に対する宿主反応の調節不全によって引き起こされる生命を脅かす臓器機能障害です(Singer et al., 2016)。中枢神経系(CNS)は主に敗血症の経過で最初に影響を受け、典型的には敗血症関連脳症(SAE)とも呼ばれる認知機能障害として現れ、敗血症患者の長期予後不良に大きく関与しています(Feng et al., 2019)。残念ながら、敗血症は、輸液蘇生、スクリーニングの強化、病原因子のルーチン微生物培養、広域抗菌療法など、幅広い治療戦略にもかかわらず、高い罹患率と死亡率につながる不治の病です(Rhodes et al.、2017)。その結果、治療戦略を改善することが必要である。注目すべきは、敗血症は腸内微生物の多様性と存在量の変化、および短鎖脂肪酸(SCFA)の減少をもたらし、これが敗血症生存者の認知機能障害と関連している可能性があることです(Wu et al., 2020; Giridharan et al., 2022; Yuan et al.) したがって、SCFAがSAEの神経機能障害の治療に有益であるかどうかは、顕著に研究者の関心を集めている。
SCFAは、難消化性炭水化物の発酵による主要な最終産物である。大腸や糞便に最も多く含まれるSCFAには、酢酸、プロピオン酸、酪酸があります(Louis and Flint, 2017)。近年、数多くの研究により、神経損傷におけるSCFAが広く研究されています。酪酸の投与は、オリゴデンドロサイトの分化を促進し、脱髄の抑制に寄与し、キュプリゾン誘発脱髄マウスモデルにおける再骨髄化を促進する(Chen et al.、2019年)。SCFAは、ナイーブT細胞の制御性T(Treg)細胞への極性化を促進し、p38およびJNK1経路を抑制することにより、実験的自己免疫脳脊髄炎を改善する。これは、炎症性細胞浸潤の減少、脱髄の減弱、軸索保存の増加として現れます(Haghikia et al.、2015)。Sadlerらは、SCFAによって誘導される大脳皮質との接続が、脊髄のニューロン密度やシナプスの変化をもたらし、脳卒中モデルにおける四肢運動機能の回復を著しく改善することを確認しました(Sadler et al., 2020)。さらに、SCFAは、ミクログリアのM1炎症性表現型からM2抗炎症性表現型への変換を効果的に誘導することができるため、神経損傷後の炎症反応を軽減し、血液脳関門(BBB)の修復を促進し、うつ様行動のマウスにおける大脳機能を回復する(Tang et al., 2022)。注目すべきは、SCFAはグリア細胞の形態や機能に影響を与えることで、中枢神経系における神経炎症にも影響を与えるため、その後の研究の基礎となることである。
ここでは、SAEにおける食事性栄養素としてのSCFAの適用背景とメカニズムをレビューし、腸-微生物叢-脳軸との関連性の可能性を解明し、SAE治療分野におけるSCFAの適用についてより好ましいエビデンスを提供します。
敗血症におけるSCFAsの応用背景
SCFAは、嫌気性腸内細菌叢による食物繊維の発酵の最終生成物である。食物繊維はヒトのマイクロバイオームの代謝に影響を与え、宿主の健康状態を変化させる(Tanes et al.、2021)。敗血症では、腸内細菌叢の乱れにより、糞便や血液中のSCFAの各種成分濃度が低下し、前頭前野や海馬のGFAP陽性細胞数の増加に伴う認知障害が誘発されると考えられます(Giridharan et al.、2022)。また、敗血症では、病原性コロニー形成により入院後6週間のSCFAs濃度が低下する(Yamada et al., 2015)。そこで、敗血症にSCFAを適用するための理論的根拠となる背景や基礎的なメカニズムについてまとめた。
細胞表面に存在する部分的なGタンパク質共役受容体(GPR)は、遊離脂肪酸受容体(FFAR)として機能し、疾患制御に重要な役割を担っている。特に、FFAR2(GPR43)およびFFAR3(GPR41)はSCFAによって活性化される(Kimura et al.、2020)。SCFA(酢酸:プロピオン酸:酪酸を3:1:1の割合で)の外因性投与は、SAEマウスのCLP-誘導酢酸およびプロピオン酸の減少レベルを有効に緩和する。また、アロバクラムのようなSCFAs産生菌の相対的な存在量を著しく増加させることができる。SCFAsは、FFAR2を通じてSAE患者の神経炎症を緩和し、認知機能障害を改善するのに重要である(Liao et al.、2022)。さらに、腸内細菌叢とその代謝物である酪酸は、宿主のSAE感受性に重要な役割を担っています。特に、SCFA受容体GPR109Aに関連する酪酸の抗酸化ストレスおよび神経保護作用は、SAEの長期認知機能障害の改善に寄与する(Zhang et al.、2022)。以上の研究により、SCFAを受容体に結合させることが、神経炎症と認知機能障害の改善に必須であることが支持されました。一方、敗血症発症前にSCFAを投与した研究では、SCFAによる治療効果を十分に確認することはできませんでした。しかし、根本的なメカニズムは、これらの受容体に関連するだけではなく、ヒストン脱アセチル化酵素(HDAC)に関連する細胞内標的も関連した役割を担っています。HDACは、染色体構造の改変や遺伝子発現の制御において本質的に重要である。SCFAはHDACの天然阻害剤である。酪酸ナトリウムは、ヒストン脱アセチル化酵素阻害剤(HDACi)として、セカル結紮穿刺(CLP)手術後のHDAC活性を低下させることにより、敗血症動物の回避的記憶を回復させる可能性があります(Steckertら、2015)。異なる時間や異なる経路でのSCFAの投与に加え、敗血症マウスの腸内異バイオシスの変調に寄与するトリプトファン(食事からの補給に由来する必須アミノ酸)の微生物叢代謝物としてのインドール-3-プロピオン酸(IPA)の研究は、異なる経路を通じて敗血症の病理生理学における腸微生物群およびその代謝物の役割を示している(Fang et al., 2022).さらに、酪酸は、ヒストン脱アセチル化酵素を阻害することにより、シナプス可塑性を高め、うつ病様行動や認知能力を改善する可能性がある(Citraroら、2020年;Yuら、2020年)。合わせて、HDACiとしてのSCFAの投与は、認知機能障害を伴う神経機能障害を管理するための新しい治療戦略に寄与する。
さらに、SCFAは、抗炎症作用、抗酸化作用、免疫調節作用を発揮することができる。SCFAの外因性投与は、マクロファージ機能を高め、K. pneumoniaeが誘発する肺炎を改善し、肺炎敗血症の症状を改善する(Wu et al.) 敗血症発症後の酪酸ナトリウムの投与は、CLP誘発敗血症ラットにおいて核因子κB(NF-κB)の活性化を抑制することにより、炎症性サイトカイン産生を抑制し、腸管損傷を減弱させ、生存率を向上させることができ、酪酸ナトリウムの臨床応用が全身炎症反応と順次起こる臓器機能障害の抑制に寄与する可能性を示唆している(Fu et al., 2019)。一方、酪酸塩の前処理は、LPS誘発敗血症マウスやLPSで刺激したマウスマクロファージ様RAW264.7細胞におけるTNF-α、IL-6、IL-1βといった炎症性メディエーターのレベル上昇を抑制した。さらに、抗炎症性IL-10の発現を有意に上昇させることは、酪酸が敗血症の炎症反応を緩和する重要な方法である(Wang et al., 2017)。これらの研究は、SCFAが敗血症の重症度を改善し、抗炎症経路を通じて生存率を高める可能性さえあることを示唆しました。Filipponeらは、プロピオン酸ナトリウムの抗炎症作用と抗酸化作用を確認しました(Filipponeら、2020)。しかし、SCFAが積極的な抗炎症作用を持つかどうかは、その濃度、血清pH、病因に依存する(Tedelind et al., 2007)。さらに、Wengらは臨床研究において、プロピオン酸値が敗血症の重症度や予後情報とよく相関することを報告しており、次のフォローアップ研究にとって大きな意義があります(Wengら、2018)(表1)。一方、先行研究では、臨床的な敗血症患者において、便のSCFA濃度が有意に低いことも確認されている(Valdés-Duque et al.、2020)。さらに、敗血症の誘発から10日後、動物は依然としてSCFAs濃度の低下に関連した認知障害を患っており、これは微生物叢-腸-脳軸の恒常性の崩壊が引き金となっていた(Giridharan et al.、2022)。したがって、特に敗血症発症後にSCFAsの濃度を維持するためにSCFAsを投与することは、敗血症の重症患者におけるSCFAsの信頼性をより示唆するものであると考えられる。しかし、この問題をさらに解決するためには、今後の研究が必要である。さらに、SCFAがTリンパ球に取り込まれると、SCFA由来のアセチル基が細胞内のアセチルCoAの増加に寄与し、IL-10の産生促進を含むヒストンのアセチル化やサイトカイン遺伝子発現に影響を与えると考えられる(Sun et al, 2018; Luu and Visekruna, 2019)。しかし、SCFAは、ナイーブCD4+ T細胞のTreg細胞への分化を促進し、自己免疫疾患を治療するための有効な標的を供給することが判明しています(Bhutia and Ganapathy, 2015; Asarat et al., 2016)。これらの知見は、SCFAの抗炎症作用、抗酸化作用、免疫調節作用を確認するものである。エネルギー代謝におけるSCFAの役割は注目される。これまでの研究で、SCFAは基質として脂肪、コレステロール、グルコース代謝に関与し、細胞のエネルギー代謝を調節できることが示されています(den Besten et al., 2013; Perry et al., 2016)。SCFAである酢酸によって是正されるミクログリアのミトコンドリア機能不全は、神経変性時のミクログリア代謝の改善と形ある自然免疫機構につながる(Erny et al.、2021)。まとめると、これらの知見は、敗血症に関連するSCFAの研究背景をより明確にし、SAEにおけるSCFAの適用メカニズムに関するさらなる研究の土台を築くものである。
表1
表1 敗血症モデルへのSCFAの適用背景の概要
SAEに応用されたSCFAのメカニズム
腸内細菌叢は、腸内分泌細胞(EEC)が産生する内分泌シグナルを制御することで、神経内分泌系に影響を与える。そして、腸管神経系(ENS)とCNSの相関関係を通じて、大脳機能をさらに調節する可能性があります(Rao and Gershon, 2018)。腸内細菌叢や一部の代謝産物は、腸から門脈を経て遠隔臓器に、あるいは腸間膜リンパ節を経て胸管に移行し、最終的に血液に移行して脳に影響を与える可能性があります(Doig et al., 1998; Deitch, 2012)(図1)。しかし、腸内の病原性微生物叢の増加やSCFAなどの腸内微生物叢産物の減少は、不安、痛み、うつ、自閉症、アルツハイマー病、パーキンソン病などの脳疾患を悪化させる可能性があります(Nagpalら、2019;Sharonら、2019;Zhuら、2020)。敗血症では、これに続いてSAEが起こることがある。SAEの病態生理は、神経炎症とミクログリアの活性化、BBB機能障害、ミトコンドリア機能障害、神経伝達物質機能障害等からなる(Mazeraud et al.、2020)。これまでの研究で、SCFAとSAEに関連するメカニズムは、以下のような側面があるのではないかと指摘されています。
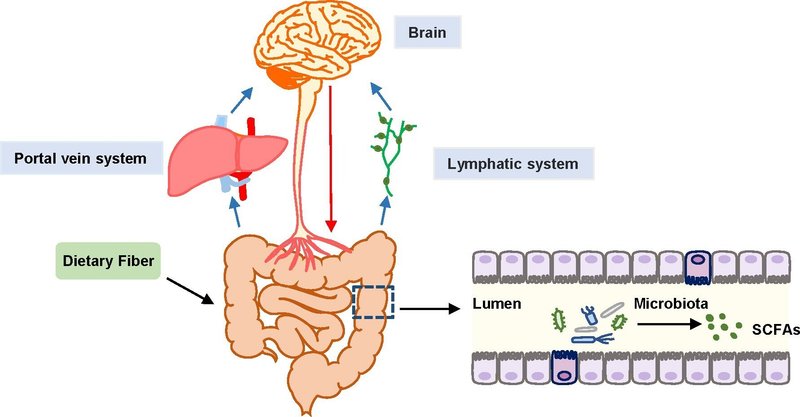
図1
図1 腸-微生物-脳軸の模式図。黒矢印は、腸内細菌叢で代謝された食物繊維の発酵の最終生成物であるSCFAを表す。青矢印は、SCFAが腸から門脈または胸管を通って遠隔臓器に運ばれ、その後、腸間膜リンパ節を経て、最終的に血液に移行することを表しています。赤い矢印は、腸管神経系(ENS)と中枢神経系の関連を表し、脳機能の調節に寄与している。
神経炎症と免疫制御
神経炎症は、SAE発症の基礎となる主なメカニズムです(Nardelli et al.、2016)。SCFA(酢酸塩:プロピオン酸塩:酪酸塩を3:1:1の割合で配合)は、SAEマウスにおける反射・感覚機能の低下、精神神経状態、運動行動などの行動障害を有意に回復させることができます。また、CLP誘発SAEモデルにおいて、BBBの完全性に関連するZO-1およびオクルディンのレベルを有意に増加させ、JNKおよびNF-kBシグナル伝達経路を抑制することにより神経炎症を有意に抑制できる(Liu et al., 2021)。さらに、SCFAとして酢酸とプロピオン酸は、NF-κB経路を通じてIL-1β、IL-6、腫瘍壊死因子-α(TNF-α)などの炎症性サイトカインの発現レベルを低下させる(Guo et al.、2021)。また、SCFAは抗炎症因子IL-10の発現量を増加させる(Wang et al., 2017)。しかし、Liらは、SCFAがペルオキシソーム増殖剤活性化受容体-γ(PPAR-γ)活性化とは独立して大腸NLRP6インフラマソームを活性化し、海馬のDCX+新生ニューロンを増加させることによって海馬の神経炎症を改善できることを示唆した(Liら, 2019)。したがって、SCFAは神経炎症を抑制することで、神経疾患を改善する可能性がある。
ミクログリアは、脳内の自然免疫細胞として機能し、サイトカイン(IL-1β、IL-6、TNF-aなど)の分泌に関与していると考えられる。そのため、神経疾患や精神疾患の発生・発症に大きく関わっています(Wendeln et al., 2018; Li et al., 2020)。いくつかの研究により、SCFAが宿主免疫に及ぼすメカニズムが明らかにされており、その中でSCFAのFFARへの結合が重要な役割を担っています。FFAR2およびFFAR3は、細胞内Ca2+放出、環状アデノシン一リン酸(cAMP)蓄積の抑制、マイトジェン活性化タンパク質キナーゼ(MAPK)および細胞外シグナル制御キナーゼ½(ERK1/2)活性化に関連し、免疫および炎症反応の調節に寄与すると報告された(Le Poul et al., 2003)。FFAR2はミクログリアでは直接発現していないが、FFAR2はマクロファージの変容、特にミクログリアから抗炎症性のM2表現型マクロファージへの変容に重要な役割を持つ(Erny et al., 2015; Nakajima et al., 2017)。まとめると、SCFAは免疫系を保護する効果がある。SCFAの結合は、FFARでマクロファージの表現型を変化させ、それによって炎症性因子の放出を減少させる、これらの効果を達成することができます。
BBB
我々の知る限り、BBBはCNS保護と脳の恒常性維持に寄与する主要なバリアとして機能する。BBBの破壊は、ミクログリア細胞の活性化と炎症性サイトカインの分泌につながり、敗血症患者の脳損傷をさらに悪化させる可能性があります(Danielski et al.、2018)。Branisteらは、細菌が産生するSCFAまたは代謝物が、前頭葉皮質および海馬におけるオクルディンの発現レベルを上昇させることにより、BBB透過性に影響を及ぼす可能性を示唆した(Braniste et al., 2014)。また、酢酸やプロピオン酸は、海馬におけるタイトジャンクション(TJ)タンパク質の発現量を増加させ、認知機能障害を緩和することによりBBBの破壊を改善することができる(Luo et al., 2021)。しかし、SCFAであるプロピオン酸は、核因子-エリスロイド2 p45関連因子2(NRF2、Nfe2l2としても知られる)シグナル伝達経路による酸化ストレスに対するBBBの保護作用を示した(Hoyles et al., 2018)。一方、酪酸は低酸素誘導因子-1(HIF-1)を安定化し、BBB機能を保護します(Kelly et al., 2015)。さらに、ストレス下のM1表現型ミクログリアは誘導性一酸化窒素合成酵素(INOS)を大量に誘導する可能性があり、その際、INOSを介したNOの大量生産により代謝性低酸素状態に陥り、徐々にミトコンドリアの酸化的リン酸化障害に進む可能性があります。その後、活性酸素種(ROS)の産生の増加は、アポトーシスを誘導し、神経学的損傷を悪化させる可能性があり、これはBBBのさらなる破壊とも関連している(Zhaoら、2019;Moraesら、2021)。まとめると、SCFAはBBBにおけるTJタンパク質の発現レベルを調節し、ミクログリアやミトコンドリアと協調して、BBB機能と神経炎症の発症を制御していると考えられます。
エネルギー代謝
SCFAはミトコンドリアの酸化やトリカルボン酸サイクル(TAC)の基質として使用され、SCFAはエネルギー摂取とエネルギー消費を調節することにより、体重コントロールにプラスの効果をもたらすと考えられています。敗血症の間、ミトコンドリア内生合成は酸化ストレスの影響を受け、細胞内解糖、酸化的リン酸化(OXPHOS)、およびエネルギー産生の適応的変化をもたらす(Sun et al., 2019)。代替解糖経路は、アデノシン三リン酸(ATP)生成時に大量のROSを発生させ、その後の細胞損傷、さらには細胞死に至る。さらに、過剰なROSの発生は、HIF-1αの産生を増加させ、炎症反応に関連するIL-1βの放出を促進します(Mills et al., 2016)。しかし、酪酸やプロピオン酸などのSCFAは、Kelch-like ECH-associated protein 1-nuclear erythroid 2-related factor 2(Keap1-Nrf2)抗酸化防御経路の活性化因子であり、細胞の酸化還元恒常性維持に寄与する。酪酸投与は、特に炎症マーカーと活性酸素の産生を抑制することができます(González-Boschら、2021年)。さらに、腸内細菌由来の酪酸は、認知機能と関連するROS産生の増加という状況下で、ミトコンドリア活性を調節し、遺伝子レベルでミトコンドリア機能を強化することができます(Rose et al., 2018)。SCFAの投与は、エネルギー代謝に関連するミトコンドリア機能を改善し、炎症反応を改善し、敗血症時の酸化ストレスに対して抗酸化作用を発揮すると考えられます。したがって、SCFAはシグナル伝達および主要なエネルギー分子として、神経炎症の改善、免疫調節およびBBB機能の安定化、エネルギー代謝の改善に寄与すると考えられる(図2)。しかし、これらのメカニズムがSAEの予後に直接関係しているかどうかは、さらに検討する必要がある。
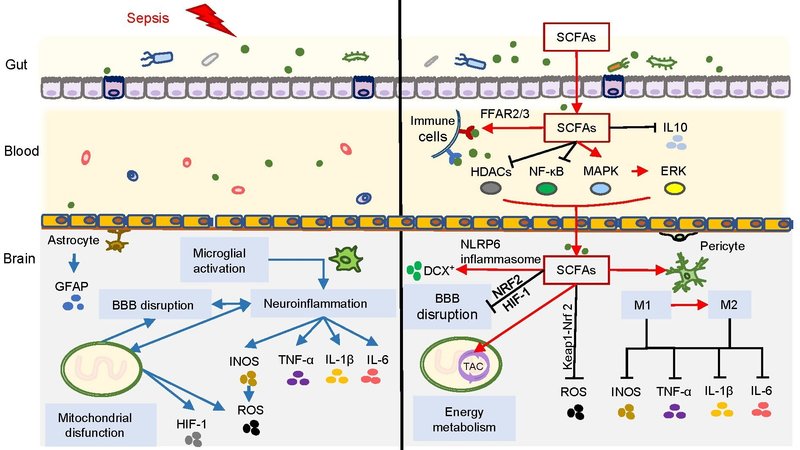
図2
図2 SAEと相関のあるSCFAsの概要。図中左側の青い矢印は、SAEの病態として考えられる、ミクログリア活性化による神経炎症、BBB損傷、ミトコンドリア機能不全を表している。図右側は、SAE発症時にSCFAが異なる経路で発揮する神経炎症の抑制、免疫調節、BBB機能の改善、エネルギー代謝を表しています(赤矢印は促進、黒線は抑制を表す)。
今後の展望
マイクロバイオームとSCFAの変化が脳機能に及ぼす影響は以前に確認されており、SAEの食事介入のターゲットとなる可能性がある(Wu et al.、2021)。しかし、糞便微生物叢移植(FMT)に起因する新しいレシピエントへの感染因子の伝達など、予測可能なリスク因子とのバランスをとることが不可欠である(Blaser, 2019)。残された課題は、以下のようにまとめられる: (1)SAE寛解のためにSCFAの供給源として使用できる食事栄養素は何か、SAEにおけるSCFAの代謝に関連する腸内細菌叢の種および存在量に関する定性的および定量的基準は何かは依然として不明である、(2)敗血症の炎症反応中のmRNAレベルでのSCFAと炎症性および抗炎症性のサイトカインの変化には密接な相関があるが(Wang et al、 2017; Fu et al., 2019; Wu et al., 2020)、SCFAが脳細胞の遺伝子発現に及ぼす影響についてはさらなる研究が必要である、(3)SAE患者におけるSCFAの異なる成分と脳のエネルギー代謝およびエネルギー獲得との正確な関係、および過剰摂取と毒性が関与するかどうかについて、さらなる研究が必要である。以上のような問題点を解決し、正確なメカニズムを解明することは、SAE患者の予後にとって著しく有益であると考えられる。
おわりに
SCFAは、複数の経路を通じて神経炎症、免疫、BBB機能、エネルギー代謝などを調節することにより、SAEの発症に関与していると考えられる。さらに重要なことは、SCFAは腸-微生物叢-脳軸を通して中枢神経系に作用し、いくつかの神経心理学的介入効果を発揮することである。したがって、直接投与や食事介入によるSCFAsの成分の変化は、有望なアプローチであると考えられる。今後、SCFAsの異なる成分がSAEに及ぼす影響について、腸内細菌叢との関連で研究し、正確なメカニズムを明らかにし、SAEの予後を改善する必要があります。
著者寄稿
QZ:構想、プロジェクト管理、原稿の一次稿の作成に貢献した。CLとWF: 資料やデータの調査、キュレーションに貢献した。JZとYYは、監督、資金獲得、原稿のレビューに貢献した。最終原稿はすべての著者が読み、承認した。
資金提供
本研究は、吉林省財政部(助成番号:2019SCZT053|受領者:JZ)、吉林省財政部(助成番号:2019SCZT022|受領者:YY)、吉林省科学技術部(助成番号:3D5212814429|受領者:YY)により支援されています。
利益相反について
著者らは、本研究が、潜在的な利益相反と解釈されうる商業的または金銭的関係がない状態で行われたことを宣言する。
出版社からのコメント
本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
参考文献
Asarat, M., Apostolopoulos, V., Vasiljevic, T., Donkor, O. (2016). 短鎖脂肪酸は、in vitroでヒト末梢血単核細胞のサイトカインとTh17/Treg細胞を制御する。Immunol. インベスト. 45 (3), 205-222. doi: 10.3109/08820139.2015.1122613
PubMed Abstract|CrossRef Full Text|Google Scholar
Bhutia, Y. D., Ganapathy, V. (2015). Short, but smart: SCFAs train T cells in the gut to fight autoimmunity in the brain. Immunity. 43 (4), 629-631. doi: 10.1016/j.immuni.2015.09.014.
PubMed Abstract|CrossRef Full Text|Google Scholar
Blaser, M. J. (2019). dysbiosisに対する糞便微生物叢移植-予測可能なリスク。N Engl. J. Med. 381 (21), 2064-2066. doi: 10.1056/NEJMe1913807.
PubMed Abstract|CrossRef Full Text|Google Scholar
Braniste, V., Al-Asmakh, M., Kowal, C., Anuar, F., Abbaspour, A., Toth, M., et al. (2014). 腸内細菌叢は、マウスの血液脳関門透過性に影響を与える。Sci. Transl. Med. 6 (263), 263ra158. doi: 10.1126/scitranslmed.3009759.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chen, T., Noto, D., Hoshino, Y., Mizuno, M., Miyake, S. (2019). 酪酸は脱髄を抑制し、再髄化を促進する。J. Neuroinflammation. 16 (1), 165. doi: 10.1186/s12974-019-1552-y
PubMed Abstract|CrossRef Full Text|Google Scholar
Citraro, R., Leo, A., De Caro, C., Nesci, V., Gallo Cantafio, M. E., Amodio, N., et al. (2020). WAG/Rijラットのてんかんと精神疾患の発症に対するヒストン脱アセチル化酵素阻害剤の効果。Mol. Neurobiol. 57 (1), 408-421. doi: 10.1007/s12035-019-01712-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Danielski, L. G., Giustina, A. D., Badawy, M., Barichello, T., Quevedo, J., Dal-Pizzol, F., et al. (2018). 敗血症における神経炎症の原因および結果としての脳関門の破壊。モル. Neurobiol. 55 (2), 1045-1053. doi: 10.1007/s12035-016-0356-7
PubMed Abstract|CrossRef Full Text|Google Scholar
ダイチ、E. A. (2012). 腸を起源とする敗血症:概念の進化。Surgeon. 10 (6), 350-356. doi: 10.1016/j.surge.2012.03.003
PubMed Abstract|CrossRef Full Text|Google Scholar
den Besten, G., van Eunen, K., Groen, A. K., Venema, K., Reijngoud, D. J., Bakker, B. M. (2013). 食事、腸内細菌叢、宿主のエネルギー代謝の間の相互作用における短鎖脂肪酸の役割。J. Lipid Res. 54 (9), 2325-2340. doi: 10.1194/jlr.R036012
PubMed Abstract|CrossRef Full Text|Google Scholar
Doig, C. J., Sutherland, L. R., Sandham, J. D., Fick, G. H., Verhoef, M., Meddings, J. B. (1998). 腸管透過性の上昇は、重症のICU患者における多臓器不全症候群の発症と関連している。Am. J. Respir. Crit. Care Med. 158 (2), 444-451. doi: 10.1164/ajrccm.158.2.9710092
PubMed Abstract|CrossRef Full Text|Google Scholar
Erny, D., Dokalis, N., Mezö, C., Castoldi, A., Mossad, O., Staszewski, O., et al. (2021). 微生物叢由来の酢酸は、健康時と疾患時の脳自然免疫システムの代謝的なフィットネスを可能にする。セル・メタブ. 33 (11), 2260-76.e7. doi: 10.1016/j.cmet.2021.10.010
PubMed Abstract|CrossRef Full Text|Google Scholar
Erny, D., Hrabe de Angelis, A. L., Jaitin, D., Wieghofer, P., Staszewski, O., David, E., et al. (2015). 宿主の微生物叢は、CNSにおけるミクログリアの成熟と機能を絶えず制御している。Nat. ニューロサイエンス(Neurosci. 18 (7), 965-977. doi: 10.1038/nn.4030
PubMed Abstract|CrossRef Full Text|Google Scholar
Fang, H., Fang, M., Wang, Y., Zhang, H., Li, J., Chen, J., et al. (2022). 敗血症による腸内細菌叢の乱れの治療薬としてのインドール-3-プロピオン酸の可能性(INDOLE-3-Propionic acid as a potential therapeutic agent for sepsis-induced gut microbiota disturbance). マイクロビオール.Spectr. 10 (3), e0012522. doi: 10.1128/spectrum.00125-22.
PubMed Abstract|CrossRef Full Text|Google Scholar
Feng, Q., Ai, Y. H., Gong, H., Wu, L., Ai, M. L., Deng, S. Y., et al. (2019). 敗血症と敗血症関連脳症の特徴。J. Intensive Care Med. 34 (11-12), 938-945. doi: 10.1177/0885066617719750.
PubMed Abstract|CrossRef Full Text|Google Scholar
Filippone, A., Lanza, M., Campolo, M., Casili, G., Paterniti, I., Cuzzocrea, S., et al. (2020). プロピオン酸ナトリウムの抗炎症作用と抗酸化作用について。Int. J. Mol. Sci. 21 (8), 3026. doi: 10.3390/ijms21083026.
PubMed Abstract|CrossRef Full Text|Google Scholar
Fu, J., Li, G., Wu, X., Zang, B. (2019). 酪酸ナトリウムは、セカール結紮・穿刺誘発敗血症のラットモデルにおいて、腸管傷害を改善し生存率を向上させる。Inflammation. 42 (4), 1276-1286. doi: 10.1007/s10753-019-00987-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Giridharan, V. V., Generoso, J. S., Lence, L., Candiotto, G., Streck, E., Petronilho, F., et al. (2022). 敗血症による認知機能低下における腸と脳のクロストーク。J. Neuroinflammation. 19 (1), 114. doi: 10.1186/s12974-022-02472-4
PubMed Abstract|CrossRef Full Text|Google Scholar
ゴンザレス・ボッシュ、C.、ブールマン、E.、ズンズン、P.A.、マン、G.E.(2021). 健康および疾患における酸化還元シグナル伝達のモジュレーターとしての短鎖脂肪酸。レドックスバイオル 47, 102165. doi: 10.1016/j.redox.2021.102165
PubMed Abstract|CrossRef Full Text|Google Scholar
Guo, C., Wang, Y., Zhang, S., Zhang, X., Du, Z., Li, M., et al. (2021). Crataegus pinnatifida polysaccharide alleviate colitis via modulation of gut microbiota and SCFAs metabolism. Int. J. Biol. Macromol. 181, 357-368. doi: 10.1016/j.ijbiomac.2021.03.137.
PubMed Abstract|CrossRef Full Text|Google Scholar
Haghikia, A., Jorg, S., Duscha, A., Berg, J., Manzel, A., Waschbisch, A., et al. (2015). 食餌性脂肪酸は小腸を介して中枢神経系自己免疫に直接影響を与える。Immunity. 43 (4), 817-829. doi: 10.1016/j.immuni.2015.09.007.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hoyles, L., Snelling, T., Umlai, U. K., Nicholson, J. K., Carding, S. R., Glen, R. C., etc. (2018). 微生物-宿主系相互作用:血液-脳関門に及ぼすプロピオン酸の保護効果. Microbiome. 6 (1), 55. doi: 10.1186/s40168-018-0439-y
PubMed Abstract|CrossRef Full Text|Google Scholar
Kelly, C. J., Zheng, L., Campbell, E. L., Saeedi, B., Scholz, C. C., Bayless, A. J., et al. (2015). 微生物叢由来の短鎖脂肪酸と腸管上皮HIFのクロストークは、組織バリア機能を増強する。Cell Host Microbe 17 (5), 662-671. doi: 10.1016/j.chom.2015.03.005.
PubMed Abstract|CrossRef Full Text|Google Scholar
木村伊織・市村明美・大上北野倫子・五十嵐真理子(2020).健康と病気における遊離脂肪酸受容体. Physiol. Rev. 100 (1), 171-210. doi: 10.1152/physrev.00041.2018.
PubMed Abstract|CrossRef Full Text|Google Scholar
Le Poul, E., Loison, C., Struyf, S., Springael, J. Y., Lannoy, V., Decobecq, M. E., et al. (2003). 短鎖脂肪酸のヒト受容体の機能的特徴および多形核細胞の活性化におけるその役割. J. Biol. Chem. 278 (28), 25481-25489. doi: 10.1074/jbc.M301403200
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, Y., Yin, L., Fan, Z., Su, B., Chen, Y., Ma, Y., et al. (2020). ミクログリア: 敗血症関連脳症と敗血症関連慢性疼痛の潜在的治療標的。Front. Pharmacol. 11. doi: 10.3389/fphar.2020.600421
CrossRef Full Text|Google Scholar
Li, J. M., Yu, R., Zhang, L. P., Wen, S. Y., Wang, S. J., Zhang, X. Y., et al. (2019). 食餌性フルクトース誘発腸内細菌異常症はマウス海馬の神経炎症を促進する:短鎖脂肪酸の利点。Microbiome. 7 (1), 98. doi: 10.1186/s40168-019-0713-7.
PubMed Abstract|CrossRef Full Text|Google Scholar
Liao, H., Li, H., Bao, H., Jiang, L., Du, J., Guo, Y., et al. (2022). 短鎖脂肪酸はGPR43を介して敗血症関連脳症マウスの認知機能を保護する。Front. Neurol. 13. doi: 10.3389/fneur.2022.909436
CrossRef Full Text|Google Scholar
Liu, J., Jin, Y., Ye, Y., Tang, Y., Dai, S., Li, M., et al. (2021). マウスの敗血症関連脳症に対する短鎖脂肪酸の神経保護効果. Front. Immunol. 12. doi: 10.3389/fimmu.2021.626894
CrossRef Full Text|Google Scholar
Louis, P., Flint, H. J. (2017). ヒト大腸微生物叢によるプロピオン酸および酪酸の形成。エンバイロン. Microbiol. 19 (1), 29-41. doi: 10.1111/1462-2920.13589.
PubMed Abstract|CrossRef Full Text|Google Scholar
Luo, A., Li, S., Wang, X., Xie, Z., Li, S., Hua, D. (2021). セファゾリンは、血液脳関門機能、腸内細菌、短鎖脂肪酸の調節により、麻酔や手術による認知機能障害を改善する。Front. Aging Neurosci. 13. doi: 10.3389/fnagi.2021.748637
PubMed Abstract|CrossRef Full Text|Google Scholar
Luu, M., Visekruna, A. (2019). 短鎖脂肪酸:T細胞の免疫代謝を変調させる細菌メッセンジャー。Eur. J. Immunol. 49 (6), 842-848. doi: 10.1002/eji.201848009.
PubMed Abstract|CrossRef Full Text|Google Scholar
Mazeraud, A., Righy, C., Bouchereau, E., Benghanem, S., Bozza, F. A., Sharshar, T. (2020). 敗血症関連脳症:包括的レビュー。ニューロセラピューティクス. 17 (2), 392-403. doi: 10.1007/s13311-020-00862-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Mills, E. L., Kelly, B., Logan, A., Costa, A. S. H., Varma, M., Bryant, C. E., et al. (2016). コハク酸デヒドロゲナーゼは、炎症性マクロファージを駆動するためのミトコンドリアの代謝的再利用をサポートする。Cell. 167 (2), 457-70 e13. doi: 10.1016/j.cell.2016.08.064
PubMed Abstract|CrossRef Full Text|Google Scholar
Moraes, C. A., Zaverucha-do-Valle, C., Fleurance, R., Sharshar, T., Bozza, F. A., d'Avila, J. C. (2021). 敗血症における神経炎症: ミクログリア活性化の分子経路. Pharm. (バーゼル)14 (5), 416. doi: 10.3390/ph14050416
CrossRef Full Text|Google Scholar
Nagpal、R.、Neth、B. J.、Wang、S.、Craft、S.、Yadav、H. (2019). 修正地中海ケトジェニックダイエットは、軽度認知障害のある被験者のアルツハイマー病マーカーとの関連において、腸内細菌叢と短鎖脂肪酸を調節します。EBioMedicine. 47, 529-542. doi: 10.1016/j.ebiom.2019.08.032.
PubMed Abstract|CrossRef Full Text|Google Scholar
中島 敦、中谷 敦、長谷川 聡、入江 淳、小澤 圭、辻本 悟、他 (2017). 短鎖脂肪酸受容体GPR43は、脂肪組織M2型マクロファージにおける炎症シグナルを制御する。PloS One 12 (7), e0179696. doi: 10.1371/journal.pone.0179696.
PubMed Abstract|CrossRef Full Text|Google Scholar
Nardelli, P., Vincent, J. A., Powers, R., Cope, T. C., Rich, M. M. (2016). 運動ニューロンの興奮性の低下は、敗血症のラットモデルにおける衰弱の重要な一因である。Exp. Neurol. 282, 1-8. doi: 10.1016/j.expneurol.2016.04.020.
PubMed Abstract|CrossRef Full Text|Google Scholar
Perry, R. J., Peng, L., Barry, N. A., Cline, G. W., Zhang, D., Cardone, R. L., et al. (2016). 酢酸はマイクロバイオーム-脳-β細胞軸を媒介してメタボリックシンドロームを促進する。ネイチャー(Nature).534 (7606), 213-217. doi: 10.1038/nature18309
PubMed Abstract|CrossRef Full Text|Google Scholar
Rao, M., Gershon, M. D. (2018). 腸管神経系の発達:何が間違っている可能性があるのか?Nat. Rev. Neurosci. 19 (9), 552-565. doi: 10.1038/s41583-018-0041-0
PubMed Abstract|CrossRef Full Text|Google Scholar
ローデス、A.、エヴァンス、L.E.、アルハザニ、W.、レヴィ、M.M.、アントネッリ、M.、フェレール、R.、他(2017). Surviving sepsisキャンペーン: 敗血症と敗血症性ショックの管理のための国際ガイドライン:2016年版。Intensive Care Med. 43 (3), 304-377. doi: 10.1007/s00134-017-4683-6.
PubMed Abstract|CrossRef Full Text|Google Scholar
Rose, S., Bennuri, S. C., Davis, J. E., Wynne, R., Slattery, J. C., Tippett, M., et al. (2018). 酪酸は、自閉症男児由来の細胞株において、酸化ストレス時のミトコンドリア機能を強化する。Transl. Psychiatry 8 (1), 42. doi: 10.1038/s41398-017-0089-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Sadler, R., Cramer, J. V., Heindl, S., Kostidis, S., Betz, D., Zuurbier, K. R., et al. (2020). 短鎖脂肪酸は免疫学的なメカニズムで脳卒中後の回復を改善する。J. Neurosci. 40 (5), 1162-1173. doi: 10.1523/JNEUROSCI.1359-19.2019.
PubMed Abstract|CrossRef Full Text|Google Scholar
Sharon, G., Cruz, N. J., Kang, D. W., Gandal, M. J., Wang, B., Kim, Y. M., et al. (2019). 自閉症スペクトラム障害のヒト腸内細菌は、マウスの行動症状を促進する。Cell. 177 (6), 1600-18 e17. doi: 10.1016/j.cell.2019.05.004
PubMed Abstract|CrossRef Full Text|Google Scholar
Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., et al. (2016). 敗血症と敗血症性ショックの第3次国際合意定義(Sepsis-3).Jama. 315 (8), 801-810. doi: 10.1001/jama.2016.0287.
PubMed Abstract|CrossRef Full Text|Google Scholar
Steckert, A. V., Comim, C. M., Igna, D. M., Dominguini, D., Mendonca, B. P., Ornell, F., et al. (2015). 敗血症に服したラットの回避的記憶に対する酪酸ナトリウムの効果。ニューロサイエンス(Neurosci. Lett. 595, 134-138. doi: 10.1016/j.neulet.2015.04.019.
PubMed Abstract|CrossRef Full Text|Google Scholar
Sun, M., Wu, W., Chen, L., Yang, W., Huang, X., Ma, C., et al. (2018). 微生物叢由来の短鎖脂肪酸はTh1細胞IL-10産生を促進し、腸のホメオスタシスを維持する。Nat. Commun. 9 (1), 3555. doi: 10.1038/s41467-018-05901-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Sun, J., Zhang, J., Tian, J., Virzi, G. M., Digvijay, K., Cueto, L., et al. (2019). 敗血症によるAKIにおけるミトコンドリア。J. Am. Soc. Nephrol. 30 (7), 1151-1161. doi: 10.1681/ASN.2018111126
PubMed Abstract|CrossRef Full Text|Google Scholar
Tanes, C., Bittinger, K., Gao, Y., Friedman, E. S., Nessel, L., Paladhi, U. R., et al. (2021). ヒト腸内細菌叢とそのメタボロームの回復における食物繊維の役割。Cell Host Microbe 29 (3), 394-407 e5. doi: 10.1016/j.chom.2020.12.012.
PubMed Abstract|CrossRef Full Text|Google Scholar
Tang, C. F., Wang, C. Y., Wang, J. H., Wang, Q. N., Li, S. J., Wang, H. O., et al. (2022). 短鎖脂肪酸は、海馬の神経新生低下と血液脳関門損傷を救済することにより、高フルクトース摂取マウスのうつ病様行動を改善する。ニュートリエンツ 14 (9), 1882. doi: 10.3390/nu14091882
PubMed Abstract|CrossRef Full Text|Google Scholar
Tedelind, S., Westberg, F., Kjerrulf, M., Vidal, A. (2007). 短鎖脂肪酸の酢酸とプロピオン酸の抗炎症作用:炎症性腸疾患に関連する研究。World J. Gastroenterol. 13 (20), 2826-2832. doi: 10.3748/wjg.v13.i20.2826
PubMed Abstract|CrossRef Full Text|Google Scholar
Valdés-Duque, B. E., Giraldo-Giraldo, N. A., Jaillier-Ramírez, A. M., Giraldo-Villa, A., Acevedo-Castaño, I., Yepes-Molina, M. A., et al. (2020). 敗血症の重症患者における便中短鎖脂肪酸。J. Am. Coll. Nutr. 39 (8), 706-712. doi: 10.1080/07315724.2020.1727379
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang, F., Liu, J., Weng, T., Shen, K., Chen, Z., Yu, Y., et al. (2017). 敗血症性ショックにおいて、リポポリサッカライドによって誘発される炎症は、短鎖脂肪酸である酪酸によってIL-10のアップレギュレーションを介して緩和され得る。Scand. J. Immunol. 85 (4), 258-263. doi: 10.1111/sji.12515.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wendeln, A. C., Degenhardt, K., Kaurani, L., Gertig, M., Ulas, T., Jain, G., et al. (2018). 脳における自然免疫記憶は、神経疾患の特徴を形成する。Nature. 556 (7701), 332-338. doi: 10.1038/s41586-018-0023-4
PubMed Abstract|CrossRef Full Text|Google Scholar
Weng, J., Wu, H., Xu, Z., Xi, H., Chen, C., Chen, D., et al. (2018). 診断時のプロピオン酸の役割は、敗血症性ショック患者における死亡率を予測する。J. Crit. ケア 43, 95-101. doi: 10.1016/j.jcrc.2017.08.009.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, L., Han, Y., Zheng, Z., Peng, G., Liu, P., Yue, S., et al. (2021). 無記名性軽度認知障害とアルツハイマー病における腸内細菌代謝物の変化: 宿主と微生物の相互作用におけるシグナル。ニュートリエンツ 13 (1), 228. doi: 10.3390/nu13010228
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, T., Xu, F., Su, C., Li, H., Lv, N., Liu, Y., et al. (2020). klebsiella pneumoniae誘発性肺炎における腸内細菌叢とセカール代謝物の変化。Front. Immunol. 11. doi: 10.3389/fimmu.2020.01331
CrossRef Full Text|Google Scholar
山田 崇、清水 圭、小倉 浩、浅原 孝、野本 圭、山川 圭、他(2015).全身性炎症反応症候群の重症患者における糞便中短鎖脂肪酸の急速かつ持続的な長期減少. JPEN J. Parenter Enteral Nutr. 39 (5), 569-577. doi: 10.1177/0148607114529596.
PubMed Abstract|CrossRef Full Text|Google Scholar
Yu, L., Zhong, X., He, Y., Shi, Y. (2020). プロピオン酸ではなく酪酸は、母親の食事によって誘発された子孫の神経認知障害を逆転させる。Pharmacol. Res. 160, 105082. doi: 10.1016/j.phrs.2020.105082.
PubMed Abstract|CrossRef Full Text|Google Scholar
Yuan, Y., Liu, S., Ding, X., Li, Y., Zhang, X., Song, H., et al. (2022). 敗血症の高齢・成体マウスにおける初期腸内細菌叢の変化。Front. Cell Infect. Microbiol. 12. doi: 10.3389/fcimb.2022.1061444
CrossRef Full Text|Google Scholar
Zhang, H., Xu, J., Wu, Q., Fang, H., Shao, X., Ouyang, X., et al. (2022). 腸内細菌叢は酪酸によるマウスの敗血症関連脳症への感受性を媒介する。J. Inflammation Res. 15, 2103-2119. doi: 10.2147/JIR.S350566
CrossRef Full Text|Google Scholar
Zhao, J., Bi, W., Xiao, S., Lan, X., Cheng, X., Zhang, J., et al. (2019). リポポリサッカライドで誘発される神経炎症は、マウスの認知障害を引き起こす。サイ・レプ 9 (1), 5790. doi: 10.1038/s41598-019-42286-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhu, S., Jiang, Y., Xu, K., Cui, M., Ye, W., Zhao, G., et al. (2020). 脳疾患に関連する腸内細菌叢研究の進展。J. Neuroinflammation. 17 (1), 25. doi: 10.1186/s12974-020-1705-z
PubMed Abstract|CrossRef Full Text|Google Scholar
キーワード:短鎖脂肪酸、敗血症関連脳症、腸-微生物-脳軸、神経炎症、ミクログリア、食事療法介入
引用元:日本経済新聞 Zhang Q, Lu C, Fan W, Zhang J and Yin Y (2023) sepsis-associated encephalopathyにおける短鎖脂肪酸の応用背景とメカニズム。Front. Cell. Infect. Microbiol. 13:1137161. doi: 10.3389/fcimb.2023.1137161.
受理された: 04 January 2023; Accepted: 2023 March 20;
発行:2023年3月28日
編集者
アンドリュー・J・モンテース(テネシー大学ノックスビル校、アメリカ合衆国
レビューした人
Elizabeth Fozo, The University of Tennessee, Knoxville, United States(テネシー大学ノックスビル校、アメリカ合衆国
ルイジアナ州立大学 William Beavers氏(米国
Copyright © 2023 Zhang, Lu, Fan, Zhang and Yin. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、学術的に認められた慣行に従って、他のフォーラムでの使用、配布または複製が許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Jingxiao Zhang, zhangjingxiao@jlu.edu.cn; Yongjie Yin, yinyj@jlu.edu.cn
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
こんな人も見ています
肺炎マイコプラズマ感染症における肺胞マクロファージと上皮細胞との相互作用について
薛雅志、王孟耀、韓宏炳
SARS-CoV-2感染Calu-3細胞のプロテオームに対するアリシンの影響について
キルティン・メスバウアー、ヴェレーナ・ナディン・フリッチュ、ロレンツ・エイドリアン、イェルク・ベルンハルト、マーティン・クレメンス・ホルスト・グルーク、アラン・ジョン・スルスレンコ、ダニエラニーマイヤー、ハイケ・アンタルマン
ガボン人患者におけるCOVID-19重症度に関連する生化学的および血液学的因子: レトロスペクティブ・コホート研究
ナディーン・ンディリマバカ、ディエウドネ・ムングイ・ムングイ、ソニア・エテンナ・レカナ・ドウキ、マリスカ・カンデット・ヤッタラ、ジュディカエル・オバメ・ンコゲ、ニール・ミシェル・ロンゴ・ペンディ、イングリッド・プリシヤ・クンバ・クンバ、 Octavie Lauris Banga Mve-Ella、Schedy Koumba Moukouama、Cresh Emelya Dzembo、Lauriane Yacka Bolo、Prudence Biyie-Bi-Ngoghe, Guignali Laurette Mangouka, Jean-Raymond Nzenze, Jean-Bernard Lekana-Douki
敗血症患者の死亡率に対するβ遮断薬の効果: 傾向スコアマッチング解析
葛成龍、張李娜、艾玉芳、陳魏、葉志文、周瑜、彭倩毅
Campylobacter jejuniの生存における生菌だが非培養状態の役割について
レティシア・シルヴァ・サントス、ダイズ・アパレシダ・ロッシ、ラケリーヌ・フィゲイレド・ブラス、ベルキオリーナ・ベアトリス・フォンセカ、ミカエラ・グイドッティ・竹内、ロジアン・ナシメント・アルベス、マルセロ・エミーリオ・ベレッティ、ヘブレイア・オリヴェイラ・アルメイダ=ソウザ、ラリサ・プラド・マイア、パウラ・ド・ソウザ・サントス、ジェシカ・ブリト・デ・スーザ、ロバータ・トーレス・デ・メーロ
フッター
ガイドライン
エクスプロア
アウトリーチ
接続
フォローする
© 2023 Frontiers Media S.A. All rights reserved.
プライバシーポリシー|ご利用規約
この記事が気に入ったらサポートをしてみませんか?
