サルモネラは宿主を操作し、インターロイキン1βの誘導を介して病原性を促進する
研究論文
サルモネラは宿主を操作し、インターロイキン1βの誘導を介して病原性を促進する
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002486

Mor Zigdon, Jasmin Sawaed, Lilach Zelik, Dana Binyamin, Shira Ben-Simon, Nofar Asulin, [...view 15 more...], Shai Bel
これは未校正です。
詳細
概要
サルモネラ・チフスムリウムのような細胞内病原体による急性消化管感染は、炎症性サイトカインであるインターロイキン1β(IL-1β)の放出を誘発する。しかし、サルモネラ菌に対する腸管防御におけるIL-1βの役割は、依然として不明である。ここで我々は、IL-1βの産生がサルモネラ感染時に有害であることを示した。IL-1βを欠失させたマウス(IL-1β -/-)は、感染時に好中球を腸に集めることができず、組織損傷を軽減し、短鎖脂肪酸(SCFA)を産生する常在菌の枯渇を防いだ。サルモネラの増殖を抑制したIL-1β -/-マウス感染では、エネルギー産生を脂肪酸酸化から発酵に切り替えるなど、通常病原体の増殖を支持する上皮細胞代謝の変化が見られなかった。さらに、IL-1βが補体アナフィラトキシンの発現を誘導し、補体不活化因子であるカルボキシペプチダーゼN(CPN1)を抑制することも見いだした。IL-1βの欠損によってこの過程が阻害されると、サルモネラ菌に感染したIL-1β -/-マウスの死亡率が減少した。最後に、IL-1βの発現は、敗血症患者における補体レセプターの発現と相関しているが、非感染患者や健常人では相関していないことがわかった。このように、サルモネラはIL-1βシグナルを利用して常在微生物に打ち勝ち、腸内コロニー形成を確立する。さらに、今回の知見から、侵襲性サルモネラ症における死亡率の制御に関与する重要な宿主因子として、IL-1βシグナル伝達系と補体系が交差していることが明らかになった。
引用 Zigdon M, Sawaed J, Zelik L, Binyamin D, Ben-Simon S, Asulin N, et al. (2024) サルモネラは宿主を操作し、インターロイキン1βの誘導を介して病原性を促進する。PLoS Biol 22(1): e3002486. doi:10.1371/journal.pbio.3002486
学術編集者 Ken Cadwell, ニューヨーク大学医学部, アメリカ合衆国
受理された: 2023年12月12日受理: 受理:2023年12月12日; 受理:2024年1月5日; 掲載:2024年1月18日 2024年1月18日発行
Copyright: © 2024 Zigdon et al. 本論文は、Creative Commons Attribution Licenseの条項の下で配布されたオープンアクセス論文であり、原著者および出典のクレジットを条件として、いかなる媒体においても無制限の使用、配布、複製が許可されている。
データの利用可能性 すべてのRNAおよび微生物の16S配列データはNCBI GEO GSE252071で入手可能。主図および補足図の全データは、補足S1データに掲載されている。
資金提供 本研究は、Azrieli Foundation Early Career Faculty Fellowship(SBへ)、イスラエル科学財団(ISF)(SBへ925/19および1851/19)、欧州研究会議(ERC)スターティンググラント(SBへGCMech 101039927)、米国・イスラエル二国間科学財団(SEWおよびSBへ2021025)の支援を受けた。資金提供者は、研究デザイン、データ収集と解析、発表の決定、原稿の作成には関与していない。
競合利益: 著者らは、競合する利害関係は存在しないと宣言している。
略語 ANCOM、マイクロバイオーム組成解析;CBC、全血球算定;CPN1、カルボキシペプチダーゼN;d.p.i.、感染後日数;ICU、集中治療室;LPS、リポ多糖;M.L.N...、 腸間膜リンパ節;MOI、感染多重度;MPO、ミエロペルオキシダーゼ;NE、好中球エラスターゼ;PCA、主成分分析;PCoA、主座標分析;SCFA、短鎖脂肪酸;TLR、toll様受容体;WT、野生型
はじめに
サイトカインであるインターロイキン1β(IL-1β)は、主に急性および慢性の炎症時に活性化された骨髄細胞から放出される炎症性アラミンである。IL-1βの迅速な分泌を促進するために、IL-1βはプロペプチドとして細胞内に貯蔵され、侵入した細菌によってインフラマソームが活性化されると、カスパーゼ1によって成熟型に切断される。IL-1βのインフラマソーム介在性分泌はよく知られているが、IL-1βはインフラマソーム非依存性メカニズムでも分泌されることが知られている [1]。一旦分泌されると、IL-1βはIL-1レセプターに結合することにより、様々な細胞に影響を及ぼす [2]。特に、IL-1βの分泌は内皮細胞の透過性に影響を及ぼし、末梢から感染組織への好中球の大量浸潤を可能にする [3] 。これらの活性化された好中球は細菌の殺傷に貢献する一方で、宿主組織にもダメージを与える。
食品由来病原体であるサルモネラ腸炎菌(Salmonella enterica serovar Typhimurium、以下サルモネラ)は、汚染された食品の摂取によって引き起こされる急性胃腸炎の一般的な原因である。この感染症は通常、健康なヒトでは自然治癒するが、免疫不全のヒトでは生命を脅かす菌血症に至ることがある。C57BL/6バックグラウンドのマウスのように、Nramp1遺伝子に変異を持つマウスでは、経口感染により急性大腸炎とサルモネラの全身播種が起こり、最終的には数日以内に死に至る[4]。Nramp1遺伝子はマクロファージに発現するイオンチャネルをコードしており、この遺伝子が欠損すると、貪食細胞が細胞内細菌の増殖を制御できなくなると考えられている[5]。しかし、マウスがサルモネラ菌に感染して死亡するメカニズムは明らかになっていない。
サルモネラは汚染された食物から摂取されると宿主の腸に到達し、そこで腸内細菌叢と対峙する。これらの微生物は腸内の特殊な環境に適応しているため、腸内の限られた資源をめぐってサルモネラに対抗するのに適している [6]。宿主との共生関係も維持しており、宿主の食事から摂取された食物繊維は、微生物叢、主にクロストリジウム属の細菌によって発酵され、短鎖脂肪酸(SCFA)を産生する [7]。これらのSCFAは、宿主の大腸細胞によって脂肪酸の酸化を介してエネルギー源として利用されるが、この過程で組織内の酸素が利用されるため、腸管内腔は低酸素状態になる [7]。腸内で足場を築くために、サルモネラは宿主に影響を与え、炎症を通じて腸管ニッチのリモデリングを促進する [8]。
マウスを使った研究から、サルモネラは宿主の自然免疫反応を悪用して自らの増殖を可能にすることが明らかになった。Toll様受容体(TLR)2、4、9を欠損させたマウスは、TLR2、4を欠損させたマウス、あるいは4、9を単独で欠損させたマウスよりもサルモネラ感染に対して抵抗性が高く、宿主による細菌の感知が有害であることを示している[9]。別の例では、サイトカインIL-22を欠損したマウスは、野生型マウス(WT)よりもサルモネラの腔内増殖を抑制することがわかった。IL-22の制御下でリポカリン-2とカルプロテクチンが分泌されると、サルモネラと直接競合する常在微生物が抑制されるからである[10]。このように、サルモネラは宿主の防御機構を利用することで、サルモネラ自身を有利にするように進化してきた [11]。ここで我々は、サルモネラ感染時に宿主のIL-1β産生が防御的であるかどうかを調べることに着手し、病原体がこのサイトカインを悪用して病原性を促進することを発見した。
結果
マウスでIL-1βを欠損させると、サルモネラ菌の負荷が減少し、経口感染時の死亡率が減少する。
これまでの研究で、IL-1βは化学物質誘発性大腸炎において、傷害後の上皮修復を促進することで保護的な役割を果たすことが示されている [12]。IL-1βが感染誘発性大腸炎の宿主防御に必要であるかどうかを調べるために、ストレプトマイシン処理したWTマウスとIL-1β -/-マウス(C57BL/6バックグラウンド;Nramp1s S1 Fig)にサルモネラを単回経口投与した。ストレプトマイシンによる前処理は、強固な消化管炎症を引き起こすために極めて重要である[13]。その結果、IL-1β -/-マウスの感染後4日目(d.p.i.)では、サルモネラ菌量がWTマウスに比べて100倍減少していた(図1A)。IL-1β -/-マウスは、腸間膜リンパ節(M.L.N.)、脾臓および肝臓におけるサルモネラの保有量も、WTマウスに比べて10倍少なかった(図1B-1D)。IL-1β -/-マウスにおけるこのような細菌量の減少は、組織学的な大腸組織損傷の顕著な減少を伴っていた(図1E-1G)。感染前の腸内細菌叢の組成は、サルモネラの腸内での増殖能力に影響を与える可能性がある [14] 。WTマウスとIL-1β -/-マウスの間の感染前の微生物叢組成の違いがサルモネラのコロニー形成に影響するかどうかを調べるために、(微生物叢組成を正常化するために[15])同居実験を行ったところ、同居では別々に飼育したマウスと異なる結果は得られなかった(S2A-S2D図)。このように、IL-1βの欠損は、腸管内腔および全身部位におけるサルモネラの増殖を制限する。
拡大サムネイル
図1. IL-1βの欠損はin vivoでのサルモネラの増殖を抑制し、経口感染による死亡を防ぐ。
(A-D)107C.F.U.のSalmonella enterica serovar typhimurium(SL1334)に感染させたマウスの、20mgのストレプトマイシンで前処理した24時間後の糞便内容物(A)、M.L.N.(B)、脾臓(C)および肝臓(D)におけるサルモネラのC.F.U.。(E,F)2d.p.i.後のWTマウス(E)とIL-1β -/-マウス(F)の大腸組織の代表的組織像(G)E,Fと同様のマウスの組織学的損傷解析(H)サルモネラ菌を経口または静脈内感染(全身感染)させたマウスの生存率。(A-DおよびG)各点はマウスを表す。*p < 0.05; **p < 0.01; ****p < 0.0001。(A-DおよびG)Mann-Whitney検定。(H)マンテル・コックス検定。(EとF)スケールバー、100μm。これらのデータは少なくとも4回の独立した実験を代表するものである。数値はS1データに記載。C.F.U.はコロニー形成単位、d.p.i.は感染後日数、M.L.N.は腸間膜リンパ節、WTは野生型。
doi:10.1371/journal.pbio.3002486.g001
詳細 "
次に、IL-1βの欠損が感染による死亡率に影響を及ぼすかどうかを検証した。驚くべきことに、IL-1β -/-マウスは感染による死亡率に対して完全に抵抗性であったのに対し、WTマウスはすべて感染に屈した(図1H)。このIL-1β -/-マウスの抵抗性は、WTマウスとIL-1β -/-マウスを同居させた実験でもみられた(S2E Fig)ことから、感染前の微生物叢の違いは、これらの実験での死亡率には影響しないことがわかった。この感染抵抗性が感染様式に依存するかどうかを調べるため、マウスにサルモネラを静脈内感染させた。その結果、低用量のサルモネラ菌を静脈内感染させたIL-1β -/-マウスは、WTマウスと同様に感染により死亡することがわかった(図1H)。これらの結果は、IL-1βがサルモネラ経口感染時の死亡率に関与していることを示している。
IL-1β -/-マウスはサルモネラ感染時に好中球を腸に動員できない
次に、IL-1βの産生が腸管内腔でのサルモネラ菌の増殖をどのように促すかを明らかにしたいと考えた。C57BL/6マウスのような変異型Nramp1対立遺伝子を持つマウスは、マクロファージの機能に欠陥があるため、サルモネラの増殖を制御できないと考えられている[4]。そこで我々は、IL-1βがマクロファージによるサルモネラの細胞内死滅を阻害するという仮説を立てた。これを検証するために、WTマウスとIL-1β -/-マウスから腹膜マクロファージを抽出し、in vitroで細胞内サルモネラ菌を殺す能力を試験した。我々の仮説に反して、IL-1β -/-マウスのマクロファージは細胞内サルモネラを殺す効率が低いことがわかった(S3A Fig)。この結果は、IL-1βの欠損が、マクロファージによる細胞内殺傷に依存しない形でサルモネラの増殖を障害することを示している。
IL-1β欠損がサルモネラ感染時の大腸組織にどのような影響を与えるかを理解するために、我々はバルクRNA配列決定と、それに続く発現差のある遺伝子のパスウェイ解析を行った。その結果、IL-1β -/-マウスで発現が低下した遺伝子は、好中球の機能と大腸への動員に関わっていることがわかった(図2A)。実際、好中球や単球を大腸に誘引する主要なケモカインは、リポカリン-2やカルプロテクチンなどの好中球特異的転写産物とともに、感染IL-1β -/-マウスでは発現レベルが低かった(図2B)。このような違いは、感染していないWTマウスやIL-1β -/-マウスでは見られなかった(S4図)。感染マウスの大腸組織切片でミエロペルオキシダーゼ(MPO)陽性細胞と好中球エラスターゼ(NE)陽性細胞をカウントすることによって、これらの所見を検証した。その結果、IL-1β -/-マウスでは、大腸内の好中球が平均して4倍少なかった(図2C-2E)。次に、IL-1βの欠損が、好中球の発生不全、あるいは好中球を大腸組織にリクルートできないために、サルモネラ感染時の好中球レベルの低下につながるかどうかを検証した。ナイーブマウスと感染マウスの循環血液を分析したところ、IL-1βの欠損は定常状態の循環好中球レベルには影響せず、むしろ感染時の好中球の循環へのリクルートを妨げることがわかった(図2Fと2G)。従って、IL-1β -/-マウスのサルモネラ菌に対する抵抗性は、好中球を感染部位に引き寄せることができないので、抗菌反応の亢進によるものではない。
拡大サムネイル
図2. IL-1βの欠損はサルモネラ感染時の腸への好中球の動員を障害する。
(A)サルモネラ感染IL-1β -/-の大腸組織でGO生物学的機能に従って発現低下している転写産物のパスウェイ解析。バーは-log(P値)を表し、ドットはパスウェイ内の遺伝子数を表す。(B)P<0.05で差次的に発現した自然免疫遺伝子を描いたヒートマップ。各列はマウスを、各行は遺伝子を表す。(C, D) 4 d.p.i.サルモネラ感染マウスの大腸切片におけるNE陽性細胞数(C)およびミエロペルオキシダーゼ陽性細胞数(D)。 (E) 抗好中球エラスターゼ抗体で染色したサルモネラ感染マウスの大腸切片の代表的な免疫組織化学像。スケールバー、50μm。(F)4d.p.i.で示したように感染させたWTマウスとIL-1β -/-マウスの血清中の好中球の割合と(G)好中球の濃度 *P < 0.05; **P < 0.01; ***P < 0.001; ****P < 0.0001。(CとD)スチューデントのt検定。(FとG) 一元配置分散分析。d.p.i., 感染後日数; S. Tm, Salmonella typhimurium。これらのデータは2回の独立した実験の代表値である。数値はS1 Dataにある。この図の基礎データはGSE252071に掲載されている。NEは好中球エラスターゼ、WTは野生型。
doi:10.1371/journal.pbio.3002486.g002
詳細 "
IL-1βはサルモネラ感染時の腸内短鎖脂肪酸産生クロストリジウムの崩壊をもたらす
常在腸内微生物は、病原体の増殖を直接阻害したり、宿主に影響を与えたりすることで、コロニー形成抵抗性を提供する[16]。次に、IL-1β -/-マウスの腸内細菌叢の変化が、サルモネラ感染に対する抵抗性を説明できるかどうかを検証した。我々は、好中球が腸に動員されないことで、感染によって誘発された炎症が微生物叢に与える有害なダメージが弱まるのではないかと考えた[16]。感染したWTマウスとIL-1β -/-マウスの糞便の16S rRNA微生物叢を解析したところ、サルモネラ感染後のWTマウスの方がより多様な微生物叢を含んでいた(図3A)。Jaccard解析により、感染IL-1β -/-マウスの腸内細菌組成はWTマウスのそれとは異なることが確認された(図3B)。マイクロバイオーム組成解析(ANCOM)では、感染IL-1β -/-マウスの腸内ではクロストリジウム属の細菌が濃縮されていたのに対し、感染WTマウスの腸内ではこれらの微生物はほとんど見られなかった(図3CおよびS5A)。これまでの報告では、サルモネラ感染によってSCFA産生クロストリジウム属微生物が減少することが示されている[7]。我々は、ナイーブなWTマウスとIL-1β -/-マウスでは、クロストリジウム菌のレベルは同程度であることを見いだした。しかし、サルモネラ菌に感染させると、WTマウスではクロストリジウム菌のレベルは劇的に低下したが、IL-1β -/-マウスではこれらの微生物に影響はなかった(図3D)。WTマウスとIL-1β -/-マウスを同居させ、ストレプトマイシンを投与しても、クロストリジウム菌のレベルに差は見られなかった(S5B図)。従って、サルモネラ感染によって、IL-1β -/-マウスにおけるSCFA産生クロストリジウム菌が減少することはない。
拡大サムネイル
図3. サルモネラ感染によってIL-1β -/-マウスの腸からSCFA産生クロストリジウム菌は枯渇しない。
腸内細菌叢組成の特徴を明らかにするために16 S rRNA配列決定を行った。(A)サルモネラ感染マウスの腸内細菌叢の微生物多様性を表すShannon指数。(B)Jaccard類似度係数に基づく糞便微生物叢のPcoA。C)クラスレベルでの相対的分類学的組成。各列はマウス1匹を表す。 (D) qPCRによる未発症マウスまたは感染マウスにおけるClostridia属のレベルの解析。各ドットはマウスを表す。*A)スチューデントのt検定、(D)一元配置分散分析。d.p.i.は感染後日数、S. Tmはサルモネラ・チフスムリウム。これらのデータは少なくとも2回の独立した実験を代表するものである。数値はS1 Dataにある。この図の基礎データはGSE252071に掲載されている。PCoA、主座標分析;SCFA、短鎖脂肪酸。
doi:10.1371/journal.pbio.3002486.g003
詳細 "
IL-1β -/-マウスにおけるSCFA産生菌の保存は、大腸細胞のβ酸化と腸内の低酸素状態を維持することによりサルモネラの増殖を抑制する
次に、感染IL-1β -/-マウスにおけるこの異なる微生物叢が、大腸組織にどのような影響を及ぼすかを明らかにしたいと考えた。その結果、感染IL-1β -/-マウスの大腸で発現が上昇した遺伝子は、代謝経路に富んでいることがわかった(図4A)。具体的には、脂肪酸β酸化を介したエネルギー産生に関与するタンパク質をコードする遺伝子が、感染したWTマウスに比べてIL-1β -/-マウスで発現上昇していた(図4B)。このような違いは、感染していないWTマウスやIL-1β -/-マウスには見られなかった(S6AおよびS6B Fig)。
拡大サムネイル
図4. IL-1β -/-マウスにおける脂肪酸β酸化の維持は、in vivoでのサルモネラの増殖を抑制する。
(A) サルモネラに感染したIL-1β -/-マウスの大腸組織でGO生物学的機能に従って発現が上昇している転写産物のパスウェイ解析。バーは-log(P値)を表し、ドットはパスウェイ内の遺伝子数を表す。(B) 脂肪酸酸化に関与する発現の異なる遺伝子をP < 0.05で表したヒートマップ。各列はマウス、各行は遺伝子を表す。(C) 糖化経路で発現が異なる遺伝子をP < 0.05で示したヒートマップ。解糖系における各遺伝子の酵素活性を左側に示す。各列はマウスを、各行は遺伝子を表す。(D)マウスの大腸切片の免疫蛍光顕微鏡写真。赤色染色は低酸素レベルを示すピモニダゾールを示す。核はDAPIで染色した。スケールバー、50μm。(E)(D)の赤色シグナルの定量。F)4d.p.i.投与した感染マウスの糞便内容物中のサルモネラC.F.U.。各点はマウスを表す。**P<0.01、***P<0.0001;(E)一元配置分散分析;(F)マン・ホイットニー検定。d.p.i.は感染後日数;S. Tmはサルモネラ・チフスムリウム。これらのデータは2回の独立した実験の代表値である。数値はS1データにある。この図の基礎データはGSE252071に掲載されている。
doi:10.1371/journal.pbio.3002486.g004
詳細 "
常在クロストリジウム菌が産生するSCFAは、大腸細胞にとって好ましいエネルギー源として機能する。これらの上皮細胞は、SCFAのβ酸化を介してATPを産生するが、この過程は酸素を利用するため、大腸内腔を低酸素状態にする。サルモネラ感染により、大腸からSCFA産生菌が減少し、大腸細胞は解糖によるエネルギー産生を余儀なくされることが示されている [7]。この過程は酸素を必要としないため、サルモネラ菌感染によって大腸内腔の酸素濃度が効果的に上昇する。内腔の酸素は、義務的嫌気性常在細菌叢にとっては有毒であり、サルモネラ菌にとっては、これらの常在細菌が提供するコロニー形成抵抗性を破壊するため、有益である [16]。実際、IL-1β -/-マウスと比較して、感染したWTマウスでは解糖経路のすべての遺伝子が上昇していた(図4C)。これらの違いは、感染していないWTマウスやIL-1β -/-マウスには見られなかった(S6C-S6E図)。従って、サルモネラ菌感染中、IL-1β -/-マウスの大腸細胞は低酸素状態を維持する一方、WTマウスの大腸は酸素リッチになることがわかった(図4Dおよび4E)。
これらの観察から、IL-1β -/-マウスでは好中球が動員されないため、SCFA産生クロストリジウム菌が温存され、大腸の低酸素状態が維持されているのではないかと考えられた。その結果、サルモネラの増殖に重要な酸素濃度が低下し、直接競合することによって、サルモネラの増殖が阻害される可能性がある [16]。我々の仮説を検証するために、WTマウスとIL-1β -/-マウスの大腸から、標準的なストレプトマイシン処理に加えてバンコマイシン処理によってクロストリジウム菌を減少させ、その後これらのマウスにサルモネラ菌を感染させた。バンコマイシン処理によって、クロストリジウム属[17]の主要なSCFA産生メンバーが実際に枯渇したことを、16S配列決定によって検証した(S7図)。実際、IL-1β -/-マウスの腸内でのサルモネラの増殖は、バンコマイシン処理後のWTマウスと区別がつかないことがわかった(図4F)。このように、IL-1β -/-マウスではSCFA産生菌が保たれているため、β酸化によるエネルギー産生と腸内の低酸素状態が維持され、サルモネラの増殖が抑制されている。
IL-1βはアナフィラトキシン不活性化因子カルボキシペプチダーゼNを抑制することにより、サルモネラ感染マウスの死亡率を高める。
次に、SCFAを産生するクロストリジウムを温存することが、サルモネラ感染IL-1β -/-マウスの死亡率を防ぐメカニズムであるかどうかを調べたいと考えた。しかし、バンコマイシンを投与したIL-1β -/-マウスは、サルモネラ菌経口感染後も生存していた(S8A図)。そこで我々は、IL-1β -/-マウスがサルモネラ菌感染に抵抗性を示すのは、感染を排除できるためではないかと考えた。しかし、17d.p.i.でさえ、これらのIL-1β -/-マウスはサルモネラにコロニー化しており(S8B図)、WT宿主への感染は依然として致死的であったことから、病原体は依然として完全に病原性であることがわかった(S8C図)。
IL-1β -/-マウスがなぜサルモネラ感染で死なないのかを理解するために、WTマウスが瀕死の状態になる6d.p.i.のマウスのRNA配列を決定した。WTマウスの2d.p.i.およびIL-1β -/-マウスの6d.p.i.と比較して、WTマウスの6d.p.i.で発現が異なる遺伝子は、死亡に至る過程に関連していると推論した。IL-1β -/-マウスでは2d.p.i.と6d.p.i.で発現が異なる遺伝子は、これらのマウスは感染で死亡していないため、死亡率とは関係がないとして除外した(図5A)。パスウェイ解析の結果、WTマウスは6d.p.i.で血管形態に関連する遺伝子を発現していた(図5A)。病原体による全身感染時に起こる敗血症性ショックは、血管の透過性、拡張、重篤な血圧低下反応によって特徴づけられることから、これは興味深いことであると我々は考えた[18,19]。血管系に対するこのような有害な変化は、アナフィラトキシンとしても知られる補体タンパク質によって媒介され、補体タンパク質はナノモル以下の濃度で血管透過性に影響を与えることができる [18]。我々は、補体C3遺伝子と補体レセプターC3ar1遺伝子の転写レベルが、WTマウスでは6d.p.i.で高度に誘導されることを見いだした(図5Bと5C)。これらの遺伝子はIL-1β-/-マウスでも誘導されたが、2d.p.i.と6d.p.i.でのレベルはやはりWTマウスより有意に低かった(図5Bと5C)。このように、IL-1βはサルモネラ感染時にアナフィラトキシンタンパク質とレセプターの発現を促進する。
拡大サムネイル
図5. IL-1βはアナフィラトキシンの発現を促進し、サルモネラ感染マウスの死亡率を高めるカルボキシペプチダーゼNの発現を阻害する。
(A)サルモネラ菌感染マウスの大腸組織において、GO生物学的機能に従ってベン図に示されるように発現が異なる転写産物のパスウェイ解析。棒グラフはフォールドエンリッチメントを表し、点はパスウェイに含まれる遺伝子数を表す。(B-D)マウスの大腸から得られたRNAシーケンスに基づく、示された遺伝子の正規化されたリード。E)サルモネラ感染マウスにビヒクルまたはCPN1阻害剤を投与した場合の生存率。*p < 0.05, ****p < 0.0001。(B-D)スチューデントのt検定。(E)Mantel-Cox検定。d.p.i.は感染後日数、CPNはカルボキシペプチダーゼN。これらのデータは2回の独立した実験の代表値である。数値はS1データにある。この図の基礎データはGSE252071に掲載されている。
doi:10.1371/journal.pbio.3002486.g005
詳細 "
正常な条件下では、アナフィラトキシンの損傷作用はカルボキシペプチダーゼN(CPN1)によって均衡が保たれており、CPN1は生理的濃度であれば数秒以内にペプチドを切断してアナフィラトキシンを不活性化する[20,21]。IL-1β -/-マウスでは、サルモネラ感染後、Cpn1の転写レベルがWTマウスに比べて4倍高いことがわかった(図5D)。実際、IL-1受容体シグナルがCpn1の発現を阻害するという以前の報告がある[22]。これらの結果は、IL-1β -/-マウスでは補体系の低発現と不活性化が、感染時の生存能力を維持することを示唆している。これを検証するために、CPN1阻害剤でマウスを処理した。その結果、感染していないマウスでCPN1を阻害しても生存率には影響しないことがわかった(S9A Fig)。感染したWTマウスでは、CPN1阻害剤の投与は生存率に影響しなかった(図5E)。しかし、CPN1阻害剤を投与した感染IL-1β -/-マウスは60%以上の死亡率を示したが、ビヒクル投与IL-1β -/-マウスは感染による死亡率に全く抵抗性であった(図5E)。阻害剤がサルモネラの増殖に影響を与えないことも確認した(S9B図)。このように、IL-1βの欠損は、CPN1発現の抑制を取り除くことにより、サルモネラ菌による死亡からマウスを保護する。
補体3受容体の発現は敗血症患者におけるIL-1β発現と相関する
最後に、今回マウスで示した補体系、IL-1βと生命を脅かす感染症との関連が、ヒトの疾患にも関連するのかどうかを明らかにしたいと考えた。われわれはまず、リポ多糖(LPS)の静脈注射による実験的内毒素血症を受けた健常人の全血転写データセットを解析した[23]。その結果、LPSを投与すると、IL-1β、C3AR1、IL-1β受容体IL1R1の発現レベルが上昇することがわかった(図6A-6C)。さらに、LPSを投与した個体ではIL-1βの発現がC3AR1の発現と正の相関を示したが、未投与の対照個体では見られなかった(図6Dと6E)。このように、内毒素血症はヒトにおいてIL-1βの発現と補体レセプター遺伝子C3AR1の発現との間に正の相関をもたらす。
拡大サムネイル
図6. 敗血症患者におけるIL-1βの発現とC3レセプター遺伝子の発現との相関。
(A-E)2ng/kgの大腸菌リポ多糖(LPS)を静脈内投与した健常人の全血転写マイクロアレイデータの解析(GSE134356)。(F-J)入院敗血症患者と健常対照者の全血RNAシーケンスデータの解析(GSE154918)。(K-M)敗血症でICUに入院した患者、敗血症でない患者、健常対照者の全血転写マイクロアレイデータの解析(GSE134347)。各ドットは患者を表す。**p < 0.01; ***p < 0.001; ****p < 0.0001。(A-CおよびF-H)スチューデントのt検定。(D、E、I-M)単回帰。TPM、transcripts per million。数値はS1データに記載。ICU、集中治療室;LPS、リポ多糖。
doi:10.1371/journal.pbio.3002486.g006
詳細 "
次に、敗血症患者コホートからの末梢血RNAシーケンスデータを解析した[24]。その結果、敗血症患者ではIL-1β、C3AR1、IL1R1の転写産物レベルが高く(図6F-6H)、敗血症患者ではIL-1βとC3AR1の発現レベルの間に正の相関が認められたが、健常対照群では認められなかった(図6Iおよび6J)。最後に、敗血症で集中治療室(ICU)に入院した患者、非感染性疾患でICUに入院した患者、および健常対照者を含むコホートから得られた全血転写データを解析した[25]。その結果、敗血症患者においてのみ、IL-1βとC3AR1の発現に正の相関が認められた(図6K-6M)。これらの結果から、IL-1β、IL-1β受容体、補体3受容体の転写産物の発現は、敗血症に罹患したヒトで誘導され、IL-βとC3AR1の発現の正の相関は、敗血症患者でのみ起こることが示された。
考察
サルモネラは宿主の反応を巧みに操るように進化してきた。サルモネラは腸内の急性炎症を促進することで、宿主を介して競合微生物を死滅させる。実際、最近の研究では、実験的な設定において、(TLRシグナル伝達、IL-22産生、またはSTAT2シグナル伝達の消失により)免疫低下した宿主の方が、サルモネラ感染を阻止する能力が高いことが示されている [9,10,26]。ここで我々は、IL-1βがサルモネラによる宿主操作の中心的な構成要素であることを示す。IL-1βシグナルを利用してコロニー形成を促進することは、サルモネラ菌が展開する効果的なメカニズムであり、複数の微生物検出装置がIL-1βの処理と放出に集約されるからである[1,27]。実際、IL-1βの分泌は、インフラマソームの活性化がなくても [1]、またパイロプトーシスに至らなくても行われる [28]。このように、IL-1βの分泌を促進する異なる経路が存在することは、今回IL-1β -/-マウスで示したようなサルモネラ菌感染に対する抵抗性が、なぜインフラマソームの個々の構成要素を欠損させたマウスでは示されなかったのかを説明することもできる[29]。最近の報告では、NLRC4インフラマソーム依存性の細胞死を促進するすべての経路の複合欠損(Asc、カスパーゼ1、カスパーゼ11の同時欠損)のみが、致死的なサルモネラ感染からマウスを保護できることが示されている[30]。これらの研究は、ここに示したデータとともに、特定のインフラマソームやカスパーゼを欠失または阻害しても、IL-1β産生が完全に消失するわけではないことを示している。したがって、サルモネラは宿主のコロニー形成においてIL-1βに依存するように進化してきた可能性がある。たとえすべての病原体検出機構が発動されなくても、感染によってIL-1βの分泌が常に起こるからである。
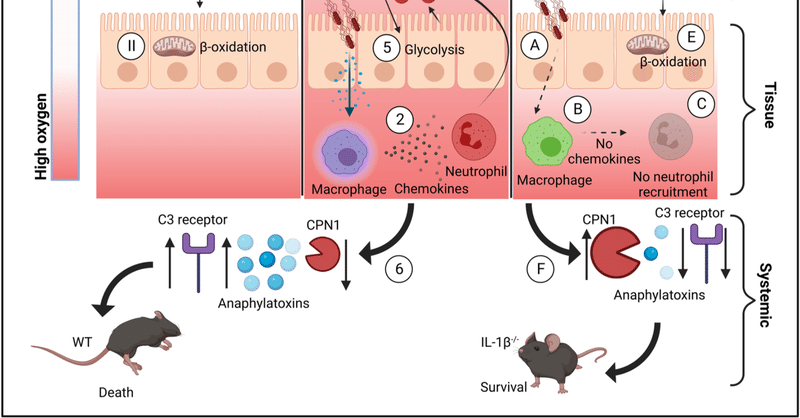
サルモネラ感染に対する宿主応答におけるインフラマソームの役割については、複数の研究がある [29] 。これらの研究の大半は、肝臓や脾臓などの内部組織における細菌の増殖を抑えるためのインフラマソーム活性化の能力に焦点を当てている。そこで私たちは、IL-1βの産生・放出の様式よりも、腸管ニッチのリモデリングにおいてIL-1βが果たす役割に焦点を絞って研究を進めることにした。われわれの結果は、サルモネラ菌がIL-1βを利用して、管腔ニッチに足場を築くことを浮き彫りにした。私たちは、感染に反応してIL-1βが産生されると、常在細菌叢の構造が傷つけられ、大腸内腔に酸素が放出されるという一連の現象が活性化されることを示している(図7)。この結果、サルモネラは最終的に、腸内の資源をめぐる直接的な競争ではなく、宿主の免疫反応を利用することによって、常在腸内微生物に打ち勝つことができるのである。
拡大サムネイル
図7. IL-1βはサルモネラによる宿主操作の重要な軸である。
(I)ナイーブマウスでは、常在微生物はSCFAを産生する。(II)これらのSCFAは、大腸細胞によるβ-酸化を介してエネルギー産生に使われる。この過程で酸素が使われるため、腸管内腔は低酸素状態に保たれる。(1)WTマウスにおけるサルモネラ感染では、IL-1βが分泌され、(2)好中球を腸管内腔に引き寄せるケモカインが産生される。(3)これらの好中球は活性酸素とNOSを産生し、金属キレーターを分泌する。このため、大腸細胞は酸素を使わない発酵によってエネルギーを生産せざるを得なくなり(5)、その結果、酸素が腸管内腔に浸透し、微生物叢にさらなるダメージを与えることになる。(6)感染後のIL-1βの放出は、アナフィラトキシンレベルの上昇とCPN1レベルの抑制を引き起こし、死亡率につながる。(A)IL-1β欠損マウスでは、サルモネラ感染(B)はケモカインの産生をもたらさず、(C)は好中球を腸管内腔に引き寄せない。(D)これらはSCFAを産生する常在菌を維持し、(E)結腸細胞がβ酸化を介してエネルギーを産生することを可能にし、サルモネラの増殖を妨げる内腔低酸素状態を維持する。(F)IL-1βの欠如はアナフィラトキシンレベルを低下させ、死亡率を防ぐCPN1の高レベルを維持する。CPN1、カルボキシペプチダーゼN;SCFA、短鎖脂肪酸。
doi:10.1371/journal.pbio.3002486.g007
詳細 "
免疫学や病原体の分野における多くの研究は、病原性の測定可能な指標としてマウスの死亡率を用いている。今回の研究では、IL-1β -/-マウスがサルモネラ菌感染に屈しないことを発見した。この抵抗性をもたらすメカニズムを明らかにするために、C57BL/6 WTマウスでサルモネラ感染が致死的である理由を理解するための文献検索を行った。しかし、非チフス性サルモネラ感染症で死亡するメカニズムに関する文献検索では、決定的な説明が得られなかったことに驚いた。Nramp1の感受性対立遺伝子を持つマウスの非チフス性サルモネラ症による死亡は、マクロファージが細胞内細菌を制御できないことに起因するとされている[5]。しかし、この考えを支持する決定的な証拠は見つからなかった。別の研究では、静脈内感染による死亡率は細菌のリピドAに依存し、IL-1βの強力な分泌が特徴であることが判明している[31]。しかし、死亡率につながるIL-1βの下流標的は不明であった。IL-1βがin vivoで補体タンパク質の発現を劇的にアップレギュレートし、補体不活性化因子の発現をダウンレギュレートするという我々の発見により、サルモネラ菌による死亡率のメカニズムが明らかになった(図7)。このような調節様式は、補体の発現を促進すると同時にその分解を抑制するため、補体系の抗菌活性を最大限に高めることができる。
ヒトにおいて、世界的な系統的レビューとメタアナリシスによると、非チフス性サルモネラ感染症に関連した合併症と死亡の最も一般的な理由は敗血症であった [32] 。クリーブランド・クリニックによれば、敗血症の定義は「細菌が血流に入り、広がることによって起こる感染症」である[33]。マウスの場合と同様、この説明は検証可能なメカニズムを示していない。非ヒト霊長類を用いた研究では、補体タンパク質を阻害することで、静脈内細菌感染による死亡を予防できることが示されている[34]。補体蛋白質は血管透過性を高め、平滑筋収縮を引き起こし、心筋症を促進することが知られており、これらはすべて致命的な転帰をもたらす。したがって、補体発現の制御は、急性の免疫活性化と関連させながら、過剰な損傷を防ぐために厳密に制御する必要がある。IL-1βが補体アナフィラトキシンの発現を促進し、補体を不活性化するCPN1の発現を抑制するという我々の発見は、補体系の免疫制御が暴走して死に至る例を示している(図7)。このことはまた、非チフス性サルモネラ菌が誘発する死亡率のメカニズムの可能性を示している。我々は、敗血症に罹患したヒトにおいて、IL-1βの発現と補体レセプターC3AR1との間に相関関係があることを示したが、これがヒトにおいて敗血症による死亡をもたらすメカニズムであるかどうかは、今後検証する必要がある。
最後に、われわれの研究は、サルモネラ菌に感染したIL-1β -/-マウスを用いた結果であり、同じくサルモネラ菌に感染したIL-1β -/-マウスを用いたRaupachらの以前の報告とは異なっている[36]。Raupachらの研究では、腸管内腔の細菌量は調べていないが、IL-1β -/-マウスの内部組織ではWTマウスに比べて細菌量が多いことがわかった。また、Raupachたちは、IL-1β -/-マウスがサルモネラ菌による死亡率を減少させることを見いださなかった。この相違の理由のひとつは、われわれがストレプトマイシン欠乏モデル[13]を用いたことで、感染前の微生物叢(これは動物施設によって異なる可能性がある)の影響が減少したのに対し、Raupachたちはマウスを抗生物質で前処理しなかったことかもしれない。実際、感染前の微生物叢のばらつきは、特に抗生物質による前処置を行わない場合、感染結果やマウスの生存率に大きく影響する可能性がある[14]。この食い違いのもう1つの理由として考えられるのは、Raupachらの実験では、今回われわれが使用した用量に比べて10倍高い接種量を使用したことである。このような高投与量(108 C.F.U.)では、宿主は遺伝的差異があまり影響しないところまで圧倒されるかもしれない。実際、IL-1βを失っても、全身感染時の死亡率から保護されないこともここで示した。最後に、カスパーゼ1欠損マウスの場合と同様に、マウスの遺伝的背景もこの矛盾を説明するかもしれない[36-38]。
材料と方法
倫理声明
動物を用いたすべての実験と処置は、Bar-Ilan大学の機関動物飼育使用委員会(IACUC)の承認を得た(研究ID#14-02-2020)。本研究は、国内の法律および規制、ならびに実験およびその他の科学的目的に使用される動物の保護に関するEU指令に準拠して実施された。Bar-Ilan IACUCは、動物に与える苦痛とプロジェクトの利益との倫理的なバランスを考慮した上で、動物実験を承認した。この承認は、科学的目的のために使用される動物の使用を代替、削減、改良するという3Rの原則にしっかりと基づいています。
マウス
C57BL/6 WTマウスとIL-1β -/-マウス(10世代以上C57BL/6に戻し交配[12])を別々に飼育し、イスラエルのBar-Ilan大学Azrieli Faculty of Medicineの通常のバリアで維持した;8~14週齢のマウスをすべての実験に使用した。同居実験では、感染の2週間前からマウスを同居させたが、これは微生物叢の違いをなくすのに十分な期間であることが示されている[15]。
Nrampジェノタイピング
マウスの尾からDNAを標準的なジェノタイピング法を用いて抽出した。Nramp遺伝子を以下のプライマーを用いて増幅した:フォワード- 5′-AAGTGACATCTCGCCATAGGTGCC-3′およびリバース- 5′-TTCTCTCACCATAGTTATCCAAGAAG-3′。精製されたPCR産物は、プライマー5′-CCCCATCTATGTTATCACCC-3′を用いて配列決定された。
サルモネラ感染
マウスは、107 C.F.U.のSalmonella enterica serovar typhimurium(SL1334)による経口感染または105 C.F.U.のSalmonellaによる静脈内感染の24時間前に、20 mgのストレプトマイシンを経口投与した。バンコマイシン投与モデルでは、感染期間中、ストレプトマイシン300 mgおよびバンコマイシン150 mgを300 mlの飲料水中でマウスに投与した。指定された時点でマウスを安楽死させ、糞便内容物、肝臓、脾臓、および腸間膜リンパ節を摘出し、重量を測定し、PBS中でホモジナイズし、連続希釈に従ってストレプトマイシンを含むLB寒天プレート上にプレーティングした。生存アッセイでは、触ったり、冷やしたりしても無反応であったり、餌に手が届かなかったりしたマウスを安楽死させた。
ゲンタマイシン保護アッセイ
マウスに1mlのチオグリコール酸を腹腔内注射し、5日後に安楽死させた後、5mlのPBSを腹腔内に注入し、穏やかに混合した。その後、細胞を含むPBSを抜き取り、氷上で保存した。溶液を400gで10分間遠心し、上清を捨て、細胞ペレットを血清入りDMEM1mlで再懸濁し、40μmフィルターで濾過した。濾過した細胞を数え、106個の細胞を37℃で一晩、細胞培養プレートにプレーティングした。ウェルをPBSで3回洗浄し(37℃)、サルモネラ菌を感染多重度(MOI)=3で90分間インキュベートした。感染した細胞をPBSで3回洗浄し(37℃)、200 mg/mlのゲンタマイシンと共に90分間インキュベートした後、PBSで洗浄した。その後、1%のTriton X-100で15分間溶解を行った。溶解液を希釈し、ストレプトマイシンを含むLB寒天プレートに播種して一晩培養した。
RNA配列決定と解析
凍結大腸組織からのRNAはQiagen RNeasy Universal kitを用いて抽出した。単離されたRNAの完全性は、Bar-Ilan大学Azrieli医学部のGenome Technology Centerで、Agilent TS HS RNA KitとTapeStation 4200を用いて解析し、1,000 ngの全RNAをNEBNext poly (A) mRNA Magnetic Isolation Module (NEB, #E7490L )で処理した。RNA シークエンシングライブラリーは、NEBNext Ultra II RNA Library Prep Kit for Illumina(NEB #E7770L )を用いて作製した。ライブラリーの定量は、dsDNA HSアッセイキットとQubit(Molecular Probes、Life Technologies)を用いて行い、定性はAgilent TS D1000キットとTapeStation 4200を用いて行い、各ライブラリー250 nMをプールし、NextSeqメーカーの指示に従って4 nMに希釈した。ライブラリーはIllumina NextSeq 550プラットフォームで、製造元の指示に従って75サイクルのシングルエンドリードでシーケンスした。シーケンシングデータは、Partekバイオインフォマティクスソフトウェアを用いてアライメントし、正規化した(100万マップあたりのリード数)。パスウェイ解析は、ShynyGO webtool [39]を用いて行った。ヒートマップ、主成分分析(PCA)プロット、ボルケーノプロットはGraphPad Prismソフトウェアを用いて作成した。生データはGSE252071に寄託されている。
組織学、免疫組織化学、炎症スコアリング
遠位結腸組織を4%パラホルムアルデヒドで固定し、パラフィン包埋、切片化し、ヘマトキシリン・エオジンで染色した。病理組織学的解析および半定量的スコアリングは、Cooperら [40] が記載したスコアリングシステムに従い、前述 [41] のように炎症および潰瘍形成の進展度(側方、粘膜に沿って、および粘膜、粘膜下層、および/または筋層への深達度)を考慮して、毒物学認定病理医が行った。解析は盲検下で行った。好中球エラスターゼおよびミエロペルオキシダーゼの免疫組織化学は、それぞれBioss bs-6982R抗体およびAbcam ab9535抗体を用いて、製造者の指示に従って行った。陽性に染色された細胞は無作為に選んだ6フィールドでカウントした。
血液サイトメトリーおよび化学検査
全血を心臓穿刺により採取した。血液サンプルは、全血球算定(CBC)用に50μl、生化学用に180μlを採血管に採取した。サンプルは4度の温度でサービスおよび分析研究所に送られた: イスラエル、ヘルズリヤのAmerican Medical Laboratories (AML)に送られた。
微生物叢のプロファイリングと分析
細菌DNAは、Mobio PowerSoil DNA抽出キット(MoBio)を用い、2分間のビーズビート工程(Biospec)を経て糞便から抽出した。16S rRNA遺伝子のV4は、バーコード付きプライマーを用いたPCRで増幅した。その後、AMPURE XP磁気ビーズ(Beckman Coulter)を用いてDNAを精製し、Quant-iT PicoGreen dsDNA Assay(Thermo Fisher)を用いて定量し、等量のDNAをプールして塩基配列を決定した。Faculty of Medicine Genomic Center(Bar Ilan University、Safed、イスラエル)のIllumina MiSeqプラットフォームでシーケンスした後、シングルエンドのシーケンスリードをインポートし、QIIME 2(バージョン2023.2)を用いてデマルチプレックスした[42]。配列エラーはDADA2 [43]で修正し、分類学的分類はGreengenes参照データベースを用いて信頼閾値99% [44]で行った。主座標分析(PCoA)は、特徴の有無の差を計算するJaccard距離を用いて行った[45]。ANCOMは、発現量の異なる分類群を同定するために使用された[46]。生データは GSE252071 に寄託されている。
qRT-PCR
クロストリジウムの定量には、2分間のビーズビーティングステップ(Biospec)の後、Mobio PowerSoil DNA抽出キット(MoBio)を用いて糞便から細菌DNAを抽出した。DNAはQuant-iT PicoGreen dsDNA Assay(Thermo Fisher)を用いて定量した。サンプルの濃度は100 ngに希釈した。qPCRは以下のプライマーを用いてCyber Greenで行った:
Pan Bacterial 16s:
フォワード:5′-CCTACGGGAGGCAGCAG-3′、
リバース 5′-ATTACCGCGCTGCTGG-3′。
クロストリジア
フォワード:5′-ACTCCTACGGGAGGCAGC-3′、
リバース 5′- GCTTCTTAGTCAGGTACGTCAT -3′。
マウス遺伝子発現については、RNAをQiagen RNeasy Universal kitを用いて抽出し、Thermo High-Capacity cDNA Reverse Transcription Kitを用いてcDNAを調製した。qPCRは、S1 Tableに詳述したプライマーを用いてCyber Greenで行った。
生体内低酸素症の検出
マウスを安楽死の1時間前にピモニダゾール塩酸塩(Hypoxyprobe Kit)の1.2 mg溶液で腹腔内処理した。遠位結腸組織を4%パラホルムアルデヒドで固定し、パラフィン包埋、切片化し、11.23.22.r Rat Mabで1時間染色した。採点は盲検下で行った。
カルボキシペプチダーゼ阻害剤処理
マウスを上記のようにサルモネラ菌に経口感染させた。感染後、8時間ごとに1.25 mgのDL-ベンジルコハク酸(10%エタノール中)を腹腔内注射した。注射の前後にマウスを身体検査し、処置による損傷を除外した。注射中に傷ついたマウスは実験から除外した。
統計分析
結果はGraph-Pad Prism 10ソフトウェア(GraphPad, La Jolla, California, United States of America)を用いて解析した。
参考情報
S1 図:IL-1β -/-マウスはNrampSである。
CBAマウス(Nrampr)、WT C57BL/6マウス(NrampS)、およびC57BL/6バックグラウンドのIL-1β -/-マウス(NrampS)のゲノムDNAの塩基配列。赤い四角は感受性変異G->Aを強調している。
doi:10.1371/journal.pbio.3002486.s001
(TIFF)
S2 図. IL-1β -/-マウスとWTマウスを同居させた場合のサルモネラ感染抵抗性。
(A-D)107C.F.U.のSalmonella enterica serovar typhimurium(SL1334)に感染させた同腹マウスの、20mgのストレプトマイシン前処理24時間後の糞便内容物(A)、M.L.N.(B)、肝臓(C)、脾臓(D)における感染4日後のサルモネラC.F.U.。(E) サルモネラ菌経口感染マウスの生存率。(A-D)各点はマウスを表す。これらのデータは1実験の代表である。*p < 0.05; **p < 0.01; ****p < 0.0001。(A-D)マン・ホイットニー検定。(E)マンテル・コックス検定。C.F.U.、コロニー形成単位;Sep、別々に飼育;Co、同居;d.p.i.、感染後日数。数値はS1データに記載。
doi:10.1371/journal.pbio.3002486.s002
(TIFF)
S3 図:IL-1β -/-マウスのマクロファージは、細胞内サルモネラを除去する能力が低下している。
(A)生体外でサルモネラに感染させたマウスからMOI 3で抽出した腹膜マクロファージを用いたゲンタマイシン防御アッセイ。*P < 0.05;スチューデントのt検定。数値はS1データに記載。
doi:10.1371/journal.pbio.3002486.s003
(TIFF)
S4 図:IL-1βの欠損は、ナイーブマウスにおけるLcn2とCxcl9の転写レベルに影響を与えない。
(AおよびB)ナイーブマウスの大腸における(A)Lcn2および(B)Cxcl9転写産物のqPCR解析。発現は18Sで正規化した。nsは統計的に有意ではない;RQは相対量。スチューデントのt検定。数値はS1データに記載。
doi:10.1371/journal.pbio.3002486.s004
(TIFF)
S5 図. IL-1β -/-マウスに感染してもクロストリジウムは減少しない。
(A)サルモネラ感染マウスの腸内細菌叢におけるクロストリジウムOTUの絶対数(図3と同様)。 (B)非感染マウスのクロストリジウムクラスレベルのqPCR解析。各点はマウス1匹を表す。これらのデータは1実験の代表である。*P < 0.05. スチューデントのt検定。OTUは操作上の分類単位、RQは相対量。数値はS1データに記載。この図の基礎データはGSE252071に掲載されている。
doi:10.1371/journal.pbio.3002486.s005
(TIFF)
S6 図:IL-1βの欠損は、ナイーブマウスにおける代謝遺伝子の転写レベルに影響を与えない。
ナイーブマウスの大腸における(AおよびB)脂肪酸代謝に関与する転写産物および(C-E)解糖に関与する転写産物のqPCR解析。発現は18Sで正規化した。ns, 統計的に有意ではない; RQ, 相対量。スチューデントのt検定。数値はS1データに記載。
doi:10.1371/journal.pbio.3002486.s006
(TIFF)
S7 図:バンコマイシン処理により、マウスのSCFA産生クロストリジウムが減少した。
バンコマイシンを3日間投与したマウスの腸内細菌叢組成を特徴付けるために16S rRNA配列決定を行った。クロストリジウム(Clostridia)クラスのSCFA産生メンバーのファミリーレベルでの相対的存在量(左)と絶対的OTUリード数(右)。各シンボルはマウスを表す。OTUは操作上の分類単位。これらのデータは1実験の代表値である。**P < 0.01; スチューデントのt検定。数値はS1データに記載。
doi:10.1371/journal.pbio.3002486.s007
(TIFF)
S8 図:バンコマイシンを介したSCFA産生菌の減少はIL-1β -/-マウスの生存に影響しない。
(A)経口感染させたバンコマイシン処理マウスの生存率。(B) 17 d.p.i.のIL-1β -/-マウスの指示臓器におけるサルモネラC.F.U.。 (C) 21 d.p.i.のIL-1β -/-マウスから分離したサルモネラに感染したWTマウスの生存率。(A)Mantel-Cox検定。d.p.i.は感染後日数。数値はS1 Dataを参照。
doi:10.1371/journal.pbio.3002486.s008
(TIFF)
S9 図. カルボキシペプチダーゼ阻害剤による処理はマウスでは致死的ではなく、サルモネラの増殖にも影響しない。
(A)図5と同様に処理した未感染マウスの生存率。 B)指示通りに処理したサルモネラの増殖曲線。これらのデータは1実験の代表値である。数値はS1 Dataに記載。
doi:10.1371/journal.pbio.3002486.s009
(TIFF)
S1表。qPCRに使用したプライマー。
doi:10.1371/journal.pbio.3002486.s010
(XLSX)
S1 データ。図中のグラフやチャートの作成に使用した数値。
doi:10.1371/journal.pbio.3002486.s011
(XLSX)
謝辞
参考文献
1.Netea MG, van de Veerdonk FL, van der Meer JWM, Dinarello CA, Joosten LAB. IL-1ファミリーサイトカインのインフラマソーム非依存的制御。Annu Rev Immunol. 2015;33:49-77.doi:10.1146/annurev-immunol-032414-112306.pmid:25493334
2.Mantovani A, Dinarello CA, Molgora M, Garlanda C. Interleukin-1 and Related Cytokines in the Regulation of Inflammation and Immunity. Immunity. 2019;50:778-795. doi: 10.1016/j.immuni.2019.03.012. pmid:30995499.
3.Zhu W, London NR, Gibson CC, Davis CT, Tong Z, Sorensen LK, et al. Interleukin receptor activates a MYD88-ARNO-ARF6 cascade to disrupt vascular stability. Nature. 2012;492:252-255. doi: 10.1038/nature11603.
4.Tsolis RM, Xavier MN, Santos RL, Bäumler AJ. トップモデルになるには: ヒトサルモネラ感染症研究における動物実験の影響。Infect Immun. 2011;79:1806-1814. doi: 10.1128/IAI.01369-10.
5.Vidal S, Tremblay ML, Govoni G, Gauthier S, Sebastiani G, Malo D, et al. Ity/Lsh/Bcg遺伝子座:細胞内寄生虫の感染に対する自然抵抗性はNramp1遺伝子の破壊により消失する。J Exp Med. 1995;182:655-666。doi: 10.1084/jem.182.3.655.
6.Spragge F, Bakkeren E, Jahn MT. マイクロバイオームの多様性は、栄養ブロックによって病原体から身を守る。Science. 2023;382:eadj3502. doi: 10.1126/science.adj3502. pmid:38096285.
7.Rivera-Chávez F, Zhang LF, Faber F, Lopez CA, Byndloss MX, Olsan EE, et al. 腸内細菌叢からの酪酸産生クロストリジウムの枯渇はサルモネラの好気性管腔拡大を促進する。Cell Host Microbe. 2016;19:443-454. doi: 10.1016/j.chom.2016.03.004. pmid:27078066.
8.Radlinski LC, Bäumler AJ. 食卓に居場所はない。Science. 2023;382:1244-1245. doi: 10.1126/science.adl5891.
9.Arpaia N, Godec J, Lau L, Sivick KE, McLaughlin LM, Jones MB, et al. TLRシグナル伝達はサルモネラ・チフス菌の病原性に必須である。Cell. 2011;144:675-688. doi: 10.1016/j.cell.2011.01.031.
10.Behnsen J, Jellbauer S, Wong CP, Edwards RA, George MD, Ouyang W, et al. サイトカインIL-22は、関連する常在細菌を抑制することで病原体のコロニー形成を促進する。Immunity. 2014;40:262-273. doi: 10.1016/j.immuni.2014.01.003. pmid:24508234.
11.Rogers AWL, Tsolis RM, Bäumler AJ. サルモネラ対マイクロバイオーム。Microbiol Mol Biol Rev. 2020;85:e00027-e00019. doi: 10.1128/MMBR.00027-19.
12.Bersudsky M, Luski L, Fishman D, White RM, Ziv-Sokolovskaya N, Dotan S, et al. マウスにおける急性結腸炎症時のIL-1αとIL-1βの非冗長な特性。Gut. 2014;63:598-609. doi: 10.1136/gutjnl-2012-303329. pmid:23793223.
13.Barthel M, Hapfelmeier S, Quintanilla-Martínez L, Kremer M, Rohde M, Hogardt M, et al. マウスをストレプトマイシンで前処理することで、病原体と宿主の両方を解析できるSalmonella enterica serovar Typhimurium大腸炎モデルが得られる。Infect Immun. 2003;71:2839-2858. doi: 10.1128/IAI.71.5.2839-2858.2003.
14.Velazquez EM, Nguyen H, Heasley KT, Saechao CH, Gil LM, Rogers AWL, et al. 内在性腸内細菌科細菌がサルモネラ菌感染感受性の変動に関与している。Nat Microbiol. 2019;4:1057-1064. doi: 10.1038/s41564-019-0407-8. pmid:30911125
15.Caruso R, Ono M, Bunker ME, Núñez G, Inohara N. Dynamic and Asymmetric Changes of the Microbial Communities after Cohousing in Laboratory Mice. Cell Rep. 2019;27:3401-3412.e3. doi: 10.1016/j.celrep.2019.05.042. pmid:31189120.
16.Litvak Y, Byndloss MX, Bäumler AJ. 大腸細胞の代謝が腸内細菌叢を形成する。Science. 2018;362:eaat9076. doi: 10.1126/science.aat9076. pmid:30498100.
17.Nogal A, Valdes AM, Menni C. 短鎖脂肪酸の役割は、心臓代謝の健康における腸内細菌叢と食事の相互作用。腸内細菌。13:1897212. doi: 10.1080/19490976.2021.1897212.
18.Hollmann TJ, Mueller-Ortiz SL, Braun MC, Wetsel RA. C5a受容体遺伝子の破壊は、急性グラム陰性菌血症および内毒素性ショックに対する抵抗性を増加させる:C3aとC5aの相反する役割。Mol Immunol. 2008;45:1907-1915.doi:10.1016/j.molimm.2007.10.037.pmid:18063050.
19.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315:801-810. doi: 10.1001/jama.2016.0287. pmid:26903338.
20.Huey R, Bloor CM, Kawahara MS, Hugli TE. 血清カルボキシペプチダーゼ N(SCPN)阻害剤を用いた生体内でのアナフィラトキシンの増強。肺組織における致死性と病理学的影響。Am J Pathol. 1983;112:48-60.
21.Mueller-Ortiz SL, Wang D, Morales JE, Li L, Chang J-Y, Wetsel RA. カルボキシペプチダーゼN(CPN1)のマウス小サブユニットをコードする遺伝子の標的破壊は、C5aアナフィラトキシン媒介性ショックに対する感受性を引き起こす。J Immunol. 2009;182:6533-6539. doi: 10.4049/jimmunol.0804207.
22.Cataisson C, Salcedo R, Hakim S, Moffitt BA, Wright L, Yi M, et al. ケラチノサイトの形質転換と発癌におけるIL-1R-MyD88シグナル。J Exp Med. 2012;209:1689-1702. doi: 10.1084/jem.20101355.
23.Scicluna BP, Uhel F, van Vught LA, Wiewel MA, Hoogendijk AJ, Baessman I, et al. 敗血症の重症患者における白血球ノンコーディングRNAランドスケープ. 9:e58597. doi: 10.7554/eLife.58597.
24.Herwanto V, Tang B, Wang Y, Shojaei M, Nalos M, Shetty A, et al. 非合併性細菌感染症および敗血症患者の血液トランスクリプトーム解析。BMC Res Notes. 2021;14:76. doi: 10.1186/s13104-021-05488-w. pmid:33640018
25.Malmström E, Khan HN, Veer C van 't, Stunnenberg M, Meijer MT, Matsumoto H, et al. Long Non-Coding Antisense RNA JHDM1D-AS1 Regulates Inflammatory Responses in Human Monocytes. Front Cell Infect Microbiol. 2022;12:934313. doi: 10.3389/fcimb.2022.934313.
26.Wilson RP, Tursi SA, Rapsinski GJ, Medeiros NJ, Le LS, Kotredes KP, et al. STAT2依存的なI型インターフェロン応答は、腸内病原体サルモネラ・チフスムリウムの生育異常と管腔拡大を促進する。PLoS Pathog. 2019;15:e1007745. doi: 10.1371/journal.ppat.1007745. pmid:31009517.
27.Evavold CL, Kagan JC. インフラマソーム: 自然免疫系の脅威評価オルガネラ。Immunity. 2019;51:609-624. doi: 10.1016/j.immuni.2019.08.005. pmid:31473100.
28.Li Y, Jiang Q. Uncoupled pyroptosis and IL-1β secretion downstream of inflammasome signal. Front Immunol. 2023;14. Available from: https://www.frontiersin.org/articles/10.3389/fimmu.2023.1128358.
29.Clare B. サルモネラ菌によるインフラマソームの活性化。Curr Opin Microbiol. 2021;64:27-32. doi: 10.1016/j.mib.2021.09.004. pmid:34563937.
30.NLRC4インフラマソーム依存性の細胞死は、3つの死経路の相補的な系列によって起こり、マウスの致死を決定する。[doi: 10.1126/sciadv.abi9471.
31.Khan SA, Everest P, Servos S, Foxwell N, Zähringer U, Brade H, et al. サルモネラ感染症における脂質Aの致死的役割。Mol Microbiol. 1998;29:571-579. doi: 10.1046/j.1365-2958.1998.00952.x. pmid:9720873
32.Marchello CS, Birkhold M, Crump JA, Martin LB, Ansah MO, Breghi G, et al.非チフス性サルモネラ菌侵入性疾患の合併症と死亡率:グローバルな系統的レビューとメタアナリシス。Lancet Infect Dis. 2022;22:692-705. doi: 10.1016/S1473-3099(21)00615-0. pmid:35114140
33.敗血症(血液中毒): 原因、管理。In: Cleveland Clinic [Internet]. [2023 年 5 月 23 日引用)。https://my.clevelandclinic.org/health/diseases/21539-septicemia.
34.Inhibition of complement C5 protects against organ failure and reduce mortality in a baboon model of Escherichia coli sepsis. [cited 2023年5月24日]. https://www.pnas.org/doi/10.1073/pnas.1706818114。
35.Klos A, Tenner AJ, Johswich K-O, Ager RR, Reis ES, Köhl J. The Role of the Anaphylatoxins in Health and Disease. Mol Immunol. 2009;46:2753-2766. doi: 10.1016/j.molimm.2009.04.027.
36.Raupach B, Peuschel S-K, Monack DM, Zychlinsky A. Caspase-1を介したインターロイキン-1β(IL-1β)とIL-18の活性化は、Salmonella enterica Serovar Typhimurium感染に対する自然免疫防御に寄与する。Infect Immun. 2006;74:4922. doi: 10.1128/IAI.00417-06.
37.Lara-Tejero M, Sutterwala FS, Ogura Y, Grant EP, Bertin J, Coyle AJ, et al. Salmonella typhimurium病原体形成におけるカスパーゼ-1インフラマソームの役割。J Exp Med. 2006;203:1407-1412. doi: 10.1084/jem.20060206.
38.Monack DM, Hersh D, Ghori N, Bouley D, Zychlinsky A, Falkow S. Salmonella exploits caspase-1 to colonize's Peyer's patches in a murine typhoid model. J Exp Med. 2000;192:249-258. doi: 10.1084/jem.192.2.249.
39.Ge SX, Jung D, Jung D, Yao R. ShinyGO: a graphical gene-set enrichment tool for animals and plants. Bioinformatics. 2020;36:2628-2629.doi:10.1093/bioinformatics/btz931.pmid:31882993.
40.Cooper HS, Murthy SN, Shah RS, Sedergran DJ. デキストラン硫酸ナトリウム実験マウス大腸炎の臨床病理学的研究。Lab Invest. 1993;69:238-249. http://www.ncbi.nlm.nih.gov/pubmed/8350599. pmid:8350599.
41.Naama M, Telpaz S, Awad A, Ben-Simon S, Harshuk-Shabso S, Modilevsky S, et al. オートファジーは、小胞体ストレスを緩和することにより、腸杯細胞からの粘液分泌を制御する。Cell Host Microbe. 2023;31:433-446.e4. doi: 10.1016/j.chom.2023.01.006. pmid:36738733
42.Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. 2019;37:852-857. doi: 10.1038/s41587-019-0209-9. pmid:31341288.
43.Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP. DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat Methods. 2016;13:581-583.doi:10.1038/nmeth.3869.pmid:27214047。
Greengenes、ARBと互換性のあるキメラチェック済み16S rRNA遺伝子データベースおよびワークベンチ。Appl Environ Microbiol. 2006;72:5069-5072. doi: 10.1128/AEM.03006-05.
45.Beta-diversity distance matrices for microbiome sample size and power calculations - How to obtain good estimates. 計算と構造。doi: 10.1016/j.csbj.2022.04.032. pmid:35664226
46.Mandal S, Van Treuren W, White RA, Eggesbø M, Knight R, Peddada SD. マイクロバイオームの組成分析:微生物組成を研究するための新しい方法。Microb Ecol Health Dis. 2015;26:27663. doi: 10.3402/mehd.v26.27663. pmid:26028277.
図を見る(7)
読者コメントを見る
著者について
指標を見る
メディア掲載
ピアレビューを見る
記事をダウンロード(pdf)
引用のダウンロード
この記事をメールで送る
PLOSジャーナル
PLOSブログ
トップに戻る
トップに戻る
PLOS
PLOSについて
フルサイト
フィードバック
連絡先
プライバシーポリシー
利用規約
メディアお問い合わせ
PLOSは非営利の501(c)(3)法人(#C2354500)で、米国カリフォルニア州サンフランシスコを拠点としています。
この記事が気に入ったらサポートをしてみませんか?
