土壌バイオクラスト中のシアノバクテリアに対するバクテリア捕食の高い影響
オープンアクセス
出版:2022年8月17日
土壌バイオクラスト中のシアノバクテリアに対するバクテリア捕食の高い影響
https://www.nature.com/articles/s41467-022-32427-5









ジュリー・ベサニー
シャノン・リン・ジョンソン
フェラン・ガルシア=ピシェル
ネイチャー・コミュニケーションズ13巻、論文番号:4835(2022) この記事を引用する
3940 アクセス
6件の引用
85 Altmetric
指標詳細
概要
多様な細菌は、多くの環境において病原体や他の細菌の捕食者として生活している。しかし、自然環境における新たな生態学的プロセスへの影響は、まだ評価されていない。ここでは、バイオクラスト中の土壌シアノバクテリアを捕食する、広範囲に分布する新しいタイプの偏性細胞内捕食細菌について述べる。この捕食者であるCandidatus Cyanoraptor togatusは、肉眼でも確認できる数cmサイズの局所的な流行を引き起こし、シアノバクテリアの純一次生産性を消し去り、窒素循環、ダストトラップ、保湿といった重要なバイオクラストの特性に深刻な影響を与える。局所的な罹患率の高さと面的な発生率の複合的な影響により、生態系スケールではバイオクラストの生産性が10%近く低下する。我々の発見は、細菌の捕食が微生物群集の構造だけでなく機能をも形成する重要な損失要因になりうることを示している。
はじめに
生物学的土壌クラスト(バイオクラスト)は、光合成生物によって駆動される表土微生物群集であり、特に乾燥地など、高等植物被度がまばらな生態系で一般的に発達する1,2。そこでは、炭素固定3や窒素固定4から、土壌の侵食抵抗性5、粉塵の巻き込み5、土壌表面温度の調節6、水文学7に至るまで、重要な生態系サービスを提供している。世界的に見ても、バイオクラストは生物地球化学サイクルに多大な貢献をしている: 陸域純一次生産性の15%、生物学的窒素固定量の50%近くを占めている8。
75年以上前から9,10、他のバクテリアを捕食する生活を送る多くのバクテリアが報告されている11。これらの「捕食性原核生物」は、いくつかの細菌門の中で独自に進化し、海洋12や淡水13,14、堆積物11、土壌15,16、下水14、人工システム17,18、宿主に関連する腸内細菌叢19,20など、多くのマイクロバイオームから報告されている。しかし、自然環境における新たな生態学的プロセスへの影響は、まだ評価されていない。われわれは最近、乾燥地の土壌修復を目的としたバイオクラストのシアノバクテリアの植え付け時に、未知の原核生物である捕食性細菌が壊滅的な影響を与えたことを記録した18。
ここでわれわれは、人工的な環境におけるバイオクラスト生産の壊滅的な失敗の発見を、優占性の非ヘテロシスト性糸状バイオクラスト形成シアノバクテリアを捕食する、天然に存在する新規の義務的捕食性バクテリアの存在に突き止めた。他の既知の捕食性原核生物とは無関係に、細胞内分裂と細胞外攻撃段階の両方を持つ典型的な内生捕食者のライフサイクルを持ち、待ち伏せ捕食者という珍しい特徴を持つ。さらに、この生物、あるいは近縁の生物が、バイオクラスト中に世界的に分布していることも明らかにした。重要なことは、この生物の活動は、局所的にバイオクラストの機能性(純一次生産性、保湿性、塵の巻き込み、炭素・窒素プールのシフト)を著しく低下させ、生態系スケールでは一次生産性の10%低下という正味の影響に近づくことである。
結果と考察
巨視的プラークによる捕食症状の追跡
培養バイオアッセイ(Expanded Microcoleus Mortality Assay、EMMA)(図1、「材料と方法」参照)は、土壌がバイオクラストの基礎となる藍藻Microcoleus vaginatusを完全に死滅させる能力に基づくもので、バイオクラスト生産施設で検出された病原体から、自然のバイオクラストにおけるcmサイズのプラーク(藍藻の透明化帯)の発生までを追跡するのに役立った。これらの斑点は、土壌が湿っているとき(つまり、雨が降った後)に肉眼で確認することができた(図2)。米国南西部の異なる場所(n=6;表S1)から採取したこのようなプラーク(n=30)から得られた土壌サンプルは、常にEMMA+であり、病原菌は常に孔径0.45~1µmのフィルターでろ過可能であったが、それ以上ではろ過できず、真核生物阻害剤シクロヘキシミドには常に感受性がなかった。これらのエンドポイントEMMA溶液は、さらに培養してもシアノバクテリアの再増殖を起こさず、新鮮なシアノバクテリア培養液への感染性を6ヶ月間維持した。マイクロコア22を用いて、プラークを2mm間隔で1回だけ小規模にサンプリングしたところ、プラークの境界が感染性の終点であり、プラークから0-2mm外側のサンプルは非感染性であった。さらに、健康な天然のバイオクラストにEMMA +懸濁液を接種すると、バイオクラスト斑が局所的に形成され、これらの斑の土壌はそれ自体がEMMA +であり、コッホの定理の一部を満たしていた。しかし、標準的な微生物学的プレーティングでは、EMMA +の単離株は得られなかった(30種のユニークな単離株をテストした)。
図1:バイオクラスト病原体の研究に用いたEMMAバイオアッセイ(Expanded Microcoleus Mortality Assay)。
a Microcoleus vaginatus PPC 9802に対する病原性を圃場および濃縮系で試験するために使用した、試験する土壌または培養物を接種したEMMAが陽性である場合の典型的な視覚的経過。b EMMA中のシアノバクテリアバイオマスの典型的な分解を電子顕微鏡で表示したもの:健全なMicrocoleus vaginatus PPC 9802のフィラメント(上)には、豊富な光合成膜(白矢印)、ペプチドグリカン横断壁(黄矢印)、カルボキシソーム(緑矢印)が見られる。感染が進むにつれて(下方に)、細胞内構造の特許分解が進み、末端細胞の特徴的に肥大化したペプチドグリカン「バンパー」(赤矢印)を含む、ペプチドグリカン壁の残骸(黄矢印)の形をした細胞ゴーストのみが残る。細胞内バチロイド菌が観察されることもある(青矢印)。シアノバクテリアの培養は生存能力を失う。スケールバー=1 µm。4つの独立した実験から得られたn=250の画像。 c フローサイトメトリー/セルソーティングで使用されるアッセイ修正。上2行に捕食陽性の濃縮物を示し、その下に捕食陰性の濃縮物を示す。 d 病原菌の性質を確認するためのEMMAでのテストとコントロール。
フルサイズ画像
図2:自然界における症状:バイオクラストプラーク。
メイン: シアノバクテリア・バイオクラストによってコロニー形成され、複数のプラークに覆われた土壌表面の巨視的写真。挿入図: 境界が明瞭で、中央部に典型的なシアノバクテリアのコロニーが見られる。
フルサイズ画像
シアノバクテリア病原体の培養、同定、顕著なゲノム形質
これらの生物を研究するために、我々は、EMMAによる反復継代と、希釈から絶滅へのアプローチと組み合わせたサイズ差濾過に基づく、病原体と餌生物の共培養の濃縮に目を向け、次いでフローサイトメトリー/細胞選別による精製を行った。このプロセスは16S rRNA遺伝子アンプリコンシークエンシングによってモニターされ、最終的にリードの80%以上を占める遺伝的に均一な(1つの単一アンプリコンシークエンスバリアント)集団を持つシアノバクテリウムの高度に濃縮された共培養が得られた(図3 a, b)。我々はこのASVに代表される生物をCandidatus Cyanoraptor togatusと命名した。最終濃縮で検出された17のASVのうち、すべての感染プロセスで一貫して検出されたのは10だけであり、その中で我々の候補ASVだけが濃縮プロセスを通じて相対的存在量が着実に増加したという事実が、このASVが実際に捕食者に対応していることを裏付けている(図3 a, b)。このC. togatusの最終濃縮物であるLGM-1は、下流の生物学的および分子生物学的解析の基礎となった。LGM-1のASVは、バクテロイデーテス門キチノアナタケ科のあまり知られていないメンバーに最も類似していた。LGM-1のゲノムは配列決定され、1,781の推定遺伝子と1,328の仮説遺伝子を持つ3.3 Mbのコンティグに組み立てられた(表S3)。LGM-1の2つの同一コピーから得られた16S rRNA遺伝子の配列は、BLAST(バージョンBLAST + 2.11.0)検索によると、培養中の最も近い分離株の配列と90%しか類似していなかった。この塩基配列はLGM-1の系統分類を絞り込むのに使われた(図3c)。この塩基配列はキチノアナタケ科のメンバーとの親和性を示しているが、基本的にはキチノアナタケ科のメンバーであり、科レベルでの明確な分類を不確かなものにするほど区別できる。注目すべきことに、LGM-1に関連する他の捕食性原核生物は報告されていないが、少なくとも1つのケースでは、キチノファーガ属との系統学的親和性を示す真菌内共生体が報告されている24。LGM-1は、捕食性原核生物という悪名高い多系統のギルドにとって、新たな分岐を意味する。他の捕食性細菌とのゲノム比較もできる(表S3)。義務的共生細菌とは異なり、捕食性細菌はゲノムサイズを縮小しない25。シアノラプトルのゲノムサイズは、多少小さいとはいえ、4.5Mb前後に集まるキチン食菌科のメンバーと比較しても、典型的なものではない。多くの細菌性捕食者は、完全なアミノ酸生合成経路を持たない26。同様に、シアノラプトルもグルタミンとアスパラギンの完全な生合成経路しか持っていない。このことは、餌に依存しない培養物が得られなかったことと合わせて、シアノラプトルが義務的に捕食していることを示唆している。さらに、捕食者は幅広い加水分解酵素を持ち、クオラムセンシング遺伝子を持たない傾向がある26。このパターンに当てはめると、シアノラプトルの遺伝子の3%が加水分解酵素に割り当てられ、クォーラムセンシング遺伝子も欠いていた。最後に、捕食性細菌に共通するゲノム上の特徴は、イソプレノイド生合成のためのメバロン酸経路の存在である。捕食生物は、ピルビン酸とG3Pからアセチル-CoAを合成するエネルギーコストのかかるプロセスを使わず、この経路の最初の分子であるアセチル-CoAをスカベンジできることが示唆されている。しかしシアノラプトルはこれとは異なり、一般的なバクテリアの経路しか持っていない。シアノラプトルは、どのライフステージにおいても明らかに非運動性であり、目に見える鞭毛を持たず、既知の運動機能(鞭毛または滑空)に類似した遺伝子や税金をゲノムに持たない。これは、既知の他の捕食性原核生物とは異なる。
図3:捕食者の同定。
a M.vaginatusを除く16S rRNAアンプリコンの解析に基づく、異なるアプローチによる捕食者/被捕食者共培養の段階的濃縮における細菌の群集組成。Flavisolibacter属には2つのASVが検出された。EMMAはExpanded Microcoleus Mortality Assayを示す。 b 各ステージで検出された10のASV(amplicon sequence variants)の相対存在量の詳細な動態。ASVは可能な限り細かい分類学的割り当てに従ってラベル付けされている。c 全ゲノム配列から得られたCyanoraptor togatus LGM-1の16S rRNA遺伝子全塩基配列と、キチン食菌科(Chitinophagaceae)の現存する全単離株の塩基配列との系統関係(Saprospiraceae科のものをアウトグループとして使用)。ツリーには181の配列が含まれ、わかりやすくするために折りたたまれている。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
C. togatusの分子検出と存在量
LGM-1の16S rRNA配列から、プラークとそれを取り囲む健康なクラストにおけるC. togatusの存在について、バイオクラスト群集を調査することもできた。その結果、Cyanoraptor togatusまたはそれに近縁のASVは、検査したすべてのプラーク(7ヶ所、n=15)で検出されたが、プラーク周囲の明らかに健康な部分(4ヶ所、n=12;表S4)でも、有意に低い割合ながら分子学的に検出された(図4)。上述したように、このような地域では感染性がないことから、この検出は土壌環境に典型的な現象であるシアノラプトルの遺物DNAの存在によるものと考えなければならない27。しかし、全体的に見ると、プラーク内でもCyanoraptorのようなASVが優勢になることはなかった(リードの3.6%未満;表S5)。同様に、私たちが実施した物理的調査以外にも、多くの地理的地域で行われたバイオクラストの分子生物学的調査のアーカイブデータから、Cyanoraptor様配列の存在を検出することができた(表S6)。これらのデータセットでは、シアノラプトル様配列はさらにまれであったが、これはおそらく予想されたことで、これらのデータセットがプラークを捕捉するために設計されたものではなく、むしろ広くバイオクラストの多様性を調査するために設計されたためである。
図4:プラークの境界を越えたバイオクラストにおける機能パラメーターと組成(相対)存在量のペア比(丸印)、赤棒は各グループの比の中央値、棒の背景色は中央値が有意に単一と異なるp値(ウィルコクソンのペア比両側検定)、灰色は有意でない(p>0. 1)、薄いオレンジは0.05 > p < 0.1、中くらいのオレンジは0.05 > p < 0.005、濃いオレンジはp < 0.005。
正確なp値は補足表4、8、9、10にある。TOC、TIC、TON、TINはそれぞれ、全有機炭素、全無機炭素、全有機窒素、全無機窒素を表す。EPSはexopolysaccharideを表す。 n = 生物学的に独立したペアサンプルの数。絶対値は表S4、S8~S10に、生データはSource Dataファイルとして提供されている。
フルサイズ画像
ライフサイクルと超微細構造の特徴
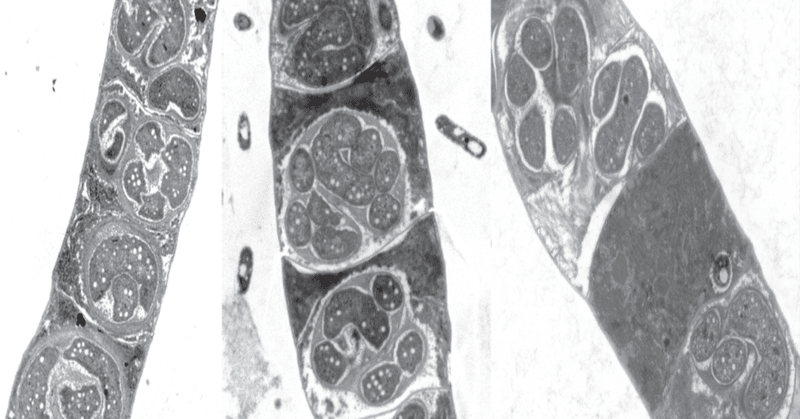
透過型電子顕微鏡と共焦点顕微鏡を用いて、典型的なEMMA内の感染ダイナミクスを追跡することにより、Cyanoraptorのライフサイクルを研究した。終点EMMAでは、必ずミクロコレウスの健全なフィラメントが存在せず(細胞質を欠いた死骸のようなゴーストフィラメントのみが観察された;図1b)、多数の小さな(直径0. これらは、(i)サイズが小さく、(ii)数が多く、(iii)死滅したシアノバクテリアに近接していることから、シアノラプトルの細胞外増殖体と考えられる。これらの増殖体の中には分裂している細胞は検出されなかった(n = 250; TEM写真から調査)。増殖体の内側の電子密度の高いコンパートメントには、典型的なフィブリル状のヌクレオイドがあり(図5b、図S1)、グラム陰性テグメントに典型的なように、電子透明領域で区切られた2つの膜で囲まれていた(図5c)。細菌の内部が2つの膜で仕切られていることは、これまで放線菌のGemmata obscuriglobus28でのみ知られていた。厚さ0.1〜0.4 µmの外側のコンパートメント(「トーガ」)は電子線透過性で、細胞外腔とも透明な間隙を持つ2枚の膜で隔てられていた(図5c)。新鮮な餌生物に感染すると、M. vaginatusに近接した球菌は、ドッキングゾーンを思わせるようなテグメント構造を形成し(図5d)、感染が進むにつれて、捕食細胞はシアノバクテリアの細胞質内に侵入した。一旦内部に侵入すると、細胞は区画化の痕跡を失い、擬似的なフィラメント状に成長し始め(図5eと6)、大量の細胞質封入体を伴って、M. vaginatus細胞は分解され、チラコイドやカルボキシソーム29のような健康な細胞に典型的な高分子構造の特許喪失、細胞壁の強度喪失による細胞テグメントの膨張、細胞質内容物の喪失を示した(図5e, h)。この損傷と感染は、シアノバクテリア・フィラメント内の侵入細胞に隣接する複数の細胞に広がることが多かった(図5h)。複数の細胞分裂がシアノラプトルの細胞内段階で起こったのは、疑似フィラメント後期のみであり(図5f)、予備ポリマーの消失、周囲に線維性の繭の形成(図5fと7)、大量の10-20 nmサイズの膜結合型細胞外小胞の排泄(図5gと8)を伴っていた。M.vaginatus細胞が完全に分解された後、伝播体は放出され(図5j, k)、集団で保持されたままであった。我々は、この外側のコンパートメントが、捕食性細菌によく見られる戦略である、獲物に向かう加水分解酵素の貯蔵庫として機能していると推測している30。ポリマーヒドロラーゼとしてアノテーションされたLGM-1の遺伝子のほとんど(3%)が、排泄のためのシグナルペプチドを備えていることも、この主張を支持している。この外側のコンパートメントは、細胞と繊維状の繭の間に閉じ込められた細胞外小胞の融合によって形成されるようである。シアノラプトルには運動性がないことから、待ち伏せ捕食戦略をとり、シアノバクテリアの運動性を利用して、遭遇、ドッキング、そしておそらく分散を行うと思われる。このことは、シアノラプトルに感受性のあるシアノバクテリア株はすべて滑空運動する(表S7)という、実験室で確立された捕食範囲と一致する。プロテオバクテリア、バクテロイデーテス(Bacteroidetes)、ファーミキューテス(Firmicutes)など様々な細菌が細胞外でシアノバクテリア細胞を溶解することができるが31、シアノラプトルは義務的な細胞内捕食性細菌であり、シアノバクテリアの捕食者として初めてのタイプである。
図5:LGM-1とM. vaginatusの共培養感染時の顕微鏡によるシアノラプトルのライフサイクルの側面。
a 健全なMicrocoleusのフィラメントに近接した、内部に区画された細胞外増殖体のグループ。b 細胞外増殖体の超構造のクローズアップ。ヌクレオイド(N; Fig. S1)を含む内部コンパートメントと、電子線が照射される外部コンパートメントまたはトーガを持つ。 c グラム陰性タイプの内部コンパートメント(ICM)と外部コンパートメント(OCM)の膜の詳細。e 非コンパートメント化した、シアノラプトル菌体内部の仮性フィラメント細胞(図6も参照)。7)、仮性フィラメントの段階で別の感染細胞(下部感染)、およびシアノバクテリア構造体の全般的な分解(図1も参照)。 h, i M. vaginatusのフィラメントの光学および共焦点ペア画像。j, k 完全に分解されたシアノバクテリアのフィラメントの光学顕微鏡像と共焦点顕微鏡像のペア。a-gとh-kはそれぞれ、4つの異なる完全な実験から得られた250枚の顕微鏡写真と、6つの異なる完全な実験から得られた28枚の顕微鏡写真から選択した。
フルサイズ画像
図6:EM解析から得られたシアノラプトルのシアノバクテリア内初期段階における成長の仮性フィラメント性。
4つの異なる完全な実験から得られた250枚の顕微鏡写真から、3つの例を選んで示す(n = 観察)。
フルサイズ画像
図7:EM標本で見たCyanoraptorの細胞内後期に典型的な繊維状繭の側面。
4つの例を選び、繭を矢印で示す(4つの異なる完全な実験から得られた250枚の顕微鏡写真のn = 観察)。
フルサイズ画像
図8:EMで見た後期段階のシアノラプトルによる細胞外小胞の産生の詳細。
小胞を矢印で示した4枚の模範的な顕微鏡写真を示す(4つの異なる完全な実験から得られた250枚の顕微鏡写真のn=観察結果)。
フルサイズ画像
培養と野外での餌生物特異性
EMMAを用いて餌生物に代えて試験した70株(14属)のシアノバクテリアのうち、14株(4属)だけが攻撃に感受性であった(表S7)。感受性株の共通点は、混雑した大きなフィラメントの束を形成することと、滑空運動で移動することであり、これはそれぞれ餌生物の死亡率と伝染を促進するため、疫学的な基本原則と一致していた32。16S rRNAをベースとした群集組成の比較と、ペアサンプル(プラークの内側と外側)における定量的PCRによる絶対定量化の比較から、野外伝染病ではシアノバクテリアの個体数が有意に減少することが示された(p = 0.002;ウィルコクソン対比検定;図4、表S4)。他の細菌(すなわち非シアノバクテリア)では絶対的な増加を引き起こす傾向が見られたが、これは統計的に有意ではなかった(図4)。他の単一の細菌門では、流行による有意な絶対的利益または絶対的減少は見られなかった。フィールドデータセットで同定された29のシアノバクテリア分類群のうち、Microcoleus vaginatus、Allocoleopsis sp.、Potamolinea sp.、Xeronema sp.のみが、培養で示された餌生物範囲と一致して、明らかに有意かつ一貫した損失を被った(p < 0.05;表S8)。シアノラプトルは、陸上シアノバクテリアの中で最も豊富であると思われるM. vaginatus33や、大陸に広く分布するコレオファシキュラ科のいくつかの細菌34と親和性があり、まさに世界的なビュッフェを提供している。
C. togatusの流行がもたらす機能的影響
シアノラプトルの流行が生態学的にどのような結果をもたらすかは、プラークの境界を越えて関連するバイオクラストの特性がどのような影響を受けるかを比較することで評価した。実施した試験の結果をまとめたものが図4で、データと統計の全セットは表S9とS10にある。最も深刻な影響を及ぼしたのは純一次生産性であり、健全なバイオクラストからプラークへ移行する際に、必ず完全に消失し、純呼吸系に変化した。酸素系光合成への機能的影響は、シアノバクテリアの16S rRNA遺伝子の欠損から推測されるよりもはるかに深刻であり、シアノラプトルによる罹病の全容を残存シアノバクテリアDNAがぼやかす可能性があることを再び示している。全有機炭素(TOC)と全有機態窒素(TON)の含有量も一貫して低下し(それぞれ平均13%と38%)、同時に溶存無機態窒素(DIN)の土壌レベルが平均300%上昇した。バイオクラストの水文学的およびダストトラップ特性35 の一因である細胞外多糖類(EPS)の含有量も、プラークでは一貫して減少していた(平均53%)。驚くべきことではないが、バイオクラストの重要な機能特性である乾燥時の水分保持能やホコリ捕捉能力も、それぞれ67%と36%の悪影響を受けた(図4、9c)。比較的まれな細菌が、このような壊滅的で連鎖的な影響を引き起こすとは、驚くべきことかもしれない。しかし、シアノラプトルの摂食は非常に非効率的で、刈り取る以上のものを破壊し、シアノバクテリアのバイオマスを他の様々な不定棲菌が利用できるようにしているようだ。顕微鏡画像からこのバイオマス移動効率を概算すると、1%をはるかに下回る値である(表S11)。
図9:プラークの内側と外側のパラメーターのペア解析から得られたシアノラプトルの流行の機能的結果。
a プラーク境界を横断する純一次生産性の典型的な分布(一番上の写真) b プラーク内部と外部における土壌乾燥の典型的な動態 c ダスト散布前(左)と散布後のプラーク内部と周辺におけるダスト捕捉の差の例。再現実験の結果を表S9に示す。ソース・データはソース・データ・ファイルとして提供される。
フルサイズ画像
生態系レベルへの影響の拡大
上述した影響はすべて、数cmのスケールに及ぶ集中的な伝染病に関するものである。しかし、このような影響を生態系レベルに拡大するには、個々のプラークの発生率と分布をはるかに大きなスケールで評価する必要がある。調査したすべての場所でプラークが見つかったが、より定量的にスケールアップするために、バイオクラストの被度が高い場所を選び、プラークが目立つように雨天時に実施した3地点の9本の直線トランセクトに沿って、195本の1m2四分円形ラットの3mm以上のプラークの発生率を写真で実地調査した(図10、補足データ1)。単一トラ ンセクトのプラーク密度は1~23m-2、平均9.0±8.6m-2で、調査したバイオクラスト面積の8.3±14.3%に影響した。単一クアドラットではプラークは0~263 m-2、面積感染率は0~98%であった。プラークは、quadrats内でも、スケール(図10)を超えて凝集分布に強く従った(ニアレストネイバー検定;p = 0.01)。単一のプラークの機能的影響を面積ベースで単純計算すると、シアノラプトルの感染による生態系レベルの影響もまた重要であり、一次生産性を10%程度低下させることになる。これは過小評価と考えなければならない。というのも、3mm以上の完全に形成されたプラークのみがカウントされ、シアノラプトルは目立つプラークのない地域でも分子学的に検出されたからである。
図10:生態系への影響を評価するために用いた3地点におけるプラーク発生率の景観スケール調査。
各色は別々のトランセクトを表し、サイト平均は緑色の水平線である。全データセットは補足データ1にある。
フルサイズ画像
損失要因としてのバクテリアの捕食と土壌修復への影響
バイオクラストにおけるウイルス感染や原生生物/メイオファウナルディの放牧による損失はまだ定量化されていないため、原核生物の捕食は、今のところ、これらのマイクロバイオームにおける唯一で最も重要な生物学的損失要因として位置づけられている。我々の研究に照らせば、原核生物の捕食は、他の生物学的損失要因とともに、マイクロバイオームにおける個体群動態の重要な決定要因の可能性があると考えるべきである。さらに、バイオクラストの修復において、植え付け用培養液の生産に生物群集全体を使用することは、感染を拡大させる危険性があるため、慎重に行うべきである。シアノバクテリアの死滅による壊滅的な失敗の最初の報告18以来、私たちは、出発材料中の診断プラークを検査し、プラークを含むものを下流の生産で廃棄するだけで、病気の拡散を回避することに成功している。
新属新種Candidatus Cyanoraptor togatusの解説
Candidatus Cyanoraptor, gen. nov., Cy.a.no.rap'.tor, Latinized Gr. m.n. Cyanos, blue-green and L. raptor m.n, plunderer, M.L. Cyanoraptor m. n 青緑色(シアノバクテリア)の略奪者。
キチン食菌科に属するバクテロイデーテス門の餌料依存性細胞内グラム陰性捕食性細菌で、その生活環において細胞内と細胞外の明確な段階への顕著な細胞分化を示す。細胞外増殖体は非分裂性の球菌で、内部は二重膜で区画されている。内側のコンパートメントにはヌクレオイドがある。細胞内ステージは外側のコンパートメントを持たず、ロッドに成長し、最終的には擬フィラメントに成長し、同時に複数の細胞分裂を行う。運動期は存在しない。鞭毛はない。多くのアミノ酸に対して従属栄養である可能性が高い。
シアノラプトル候補。to.ga´.tus, L. togatus m. adj.、ローブまたはトーガに身を包む、増殖体の外側の区画を指す。
細胞外球菌は0.93±0.15µm、細胞内細胞は幅1.02±0.41µm、長さ5µm以上。非ヘテロシスト性で運動性の糸状陸生シアノバクテリアを捕食する。濃縮株LGM-1Tとそのゲノムがタイプ物質である。そのゲノムは3.3 Mbで、G + C含量は42%。米国アリゾナ州の生物学的土壌クラストから分離された。餌料としてM. vaginatus PCC 9802と共培養。
方法
サンプリングと調査
我々は、ソノラン砂漠とチワワン砂漠の7つの異なる場所から、10cmペトリ皿を倒立させて湿ったシアノバクテリアのバイオクラストをサンプリングし、下流処理のために保管する前に野外で乾燥させた。サンプリングに使用した場所は表S1にある。これらの場所のいくつかは、バイオクラストが広く分布していたため、集中的な空間調査に選ばれた。プラークが見えやすいように、常に大雨の後に各サイト3本ずつ、計9本の直線トラ ンセクトを実施した。トランセクトの長さは45mで、第9地点ではクアドラットの間隔は1m、その他の場所では85mでクアドラットの間隔は8.5mであった。クアドラットは写真で記録され(図2)、写真はImageJ Fiji36を用いて分析された。得られたパラメータは、(a)プラークによる影響を受けたバイオクラストの面積の割合、(b)プラークの面密度、(c)プラークの空間分布を特徴付けるための、プラークから最も近い隣までの距離であった。
Expanded Microcoleus Mortality Assay(EMMA)
シアノバクテリアに病原性を持つ原核生物の存在を調べるため、Microcoleus vaginatus (PCC 9802)の軸生培養の運命に基づいたバイオアッセイを開発した。75mLの通気キャップ付き組織培養フラスコにJaworskiの最小液体培地10mLを入れ、PCC 9802(0.2mg(Chla)l-1)を餌として、また試験する土壌のホモジネートから25mgを接種し、12時間の光周期で10μmol m-2s-1の照明下で培養した。アッセイには必ず、a) 接種していない陰性対照、b) 接種前に土壌をオートクレーブ滅菌した陰性対照が含まれた。すべてのアッセイとコントロールは(少なくとも)3連で同時に行った。フラスコは5日間培養した後、簡単な検査で陽性か否かを判定した。陽性であれば、まずクロロシスが認められ、シアノバクテリアのバイオマスは完全に分解された(図1a)。(1)陽性の終点懸濁液1mLを培養液に接種し、真核生物阻害剤であるシクロヘキシミドを最終12.5μg/mlまで添加し、陽性の場合は非真核生物の病原体であることを示した。0.45µm以下の陰性菌は、非ウイルス剤であることを示した。
シアノラプトルの濃縮培養
まず、1.5%アガロースで固化したトリプシン土壌ブロス上に、EMMAアッセイで陽性となった菌のサイズフィルターでろ過した内容物を直接プレーティングした。濃縮については、まずEMMA陽性菌のエンドポイントアリ コートをサイズ分画(SF)し、公称サイズ0.2 µm-1 µmの細菌を濃縮した。その後、SFの調製液に基づいて1/10ステップで10-7まで希釈し、希釈を10回繰り返した。それでもM.vaginatusが死滅した最高希釈度を用いて、DTEを繰り返した。しかし、SF/DTEでは捕食者と被食者の純粋な共培養は得られなかった。そこで、フローサイトメトリー/セルソーティング(FCCS)を用いて、濃縮物をさらに精製した。SF/DTE調製物をフィルターにかけ(<1 µm)、BD FACSAria Iluセルソーターに注入した。直径0.79 µmから1.3 µmの細胞を、健全なaxenic M. vaginatus (PCC 9802)培養物を含む100枚の96ウェルプレートに選別し、標準的なMMA条件下で培養した(図1c)。このFCCS手順を連続して2回行った。最終的な濃縮段階は、LGM-1株という名称で下流の解析に使用された。
16S rRNA遺伝子群集分析
Qiagen DNeasy PowerSoil Kit(QIAGEN、カタログ番号12888-50)を用いて、培養物または野外サンプルからDNAを抽出した。プライマー515 Fと806R37を用いて16S rRNA遺伝子のV4領域を増幅した。PCR反応、増幅定量、およびイルミナシーケンスは公表されている18。生のFASTQファイルは、MiSeq Illuminaワークフロー内でデフォルトパラメーターでデマルチプレックスされた。ペア配列はQiime2 2019.738でデマルチプレックスおよび解析を行い、DADA2プラグインを使用して代表配列(ASV)とその出現頻度を含むフィーチャーテーブルを作成した。分類はGreengenes 13.8リリースで学習させたNaive Bayes分類器で割り当てた。シアノバクテリア(=oxyphotobacterial39)の配列は、Cydrasil40を用いて個別に系統分類した。フィールドまたはデータベースデータセットにおけるシアノラプトル様配列の存在を評価・定量化するため、BLASTによりCandidatus C. togatusの16S rRNA全塩基配列との一致を探した。
ゲノム配列決定
LGM-1からMonarch Genomic DNA Purification Kit(Thermo Fisher社製、カタログ番号K0512)を用いてDNAを抽出し、G-tube(Covaris社製)を用いてメーカー推奨の方法で4000rpmでせん断した。ビーズクリーンアップ後、約8~15kbのDNAを使用し、Pacbio Express IIのプロトコールと試薬(SMRTbell Express、カタログ番号NC1811322)を用いてPacbioシーケンスライブラリー(10kb)を構築した。シーケンシングは、Pacbio Sequl II装置(Pacbio社)を用い、製造元のプロトコールに従い、以下のパラメータで行った:バインディングキット2.0、プライマーV4、シーケンシングプレート2.0、8M v2セル、ローディング濃度55pM、シーケンシング時間30時間、CCSモード、FASTQファイル。生シーケンスデータ収集後、SMRT Link V8のデフォルト設定を用いてCCS解析を行い、平均品質スコアはQV41であった。未処理のFASTQファイルをEDGE(Empowering the Development of Genomics Expertise)41のローカルインスタンスにインポートし、10%のデータを用いてコンティグアセンブリーを行った。Irasm-wtdbg2を用いて、22.97倍カバレッジの1416コンティグにアセンブルした。コンティグのビニング、同定、品質チェックにはCheckM42を使用した。既存の部分的な16S rRNA遺伝子情報を用いて捕食細菌のゲノムを同定し、得られた(単一の)ビンをRAST-Server(Rapid Annotation using Subsystems Technology)43上のSEEDでキュレーションした。最初のアノテーションはProkka44を用い、最も近縁のChitinophaga pinensisから移植した。仮説遺伝子ではなく、すべての推定遺伝子は、UniProt(Universal Protein Resource)45を用いてクロスリファレンスされた。目的のタンパク質は、NCBIデータベースのpBLASTを用いて確認した。KEGG データベース(Kyoto Encyclopedia of Genes and Genomes)46を使用して、さらに手作業でアノテーションを行い、目的の代謝経路の存在を検出した。
系統的配置
キチノホソミド科の培養メンバーから公的に入手可能な145の16S rRNA配列(1485+塩基)と、アウトグループとしてSaprospiraceaeの培養メンバーから36の配列から、SSU-ALIGNでアライメントした後、最尤+徹底的なブートストラップ(1000反復)法とGTRGAMMAモデルを用いて参照木を作成した。アライメント不良の列は95%信頼度プロファイルに基づいて削除した。樹木トポロジーは、XSEDE上のRAxML-HPC2ワークフローを使用して、CIPRES47ハイパフォーマンスコンピューティングクラスター上で推定した。得られたツリーはiTOL48 3サーバーにインポートされ、可視化された。
顕微鏡観察
TEMでは、菌株LGM-1の濃縮液を用い、5日間にわたって毎日サブサンプリングしながら、2回の個別感染サイクルを追跡した。サブサンプルをペレット化し、2.5%グルタルアルデヒドとカコジル酸ナトリウム洗浄バッファー(0.1M、pH7.4)で室温で2時間固定した後、アガロースに懸濁し、1%緩衝OsO4で4℃、2時間固定し、0.5%酢酸ウラニルで4℃、一晩ブロック染色した。その後、ペレットを室温で回転させながら、連続レベル(10%、25%、75%、100%)のエポキシ樹脂でそれぞれ1、2、8、12時間浸潤した。浸潤したペレットを新鮮な100%樹脂に包埋し、60℃で24時間保持した。樹脂中のペレットを薄切片化し(70 nm)、2.5%酢酸ウラニル/クエン酸鉛で後染色した。切片はJEOL 1200EX TEMとPhilips CM 12 TEMを用いて80 kVで画像化した。LGM-1株の調製物は、2.5%グルタルアルデヒドで固定し、Zeiss SM 880顕微鏡で0.1 mg/mL DAPI (4'-6-ジアミノ-2-フェニルインドール)で染色した後、共焦点蛍光顕微鏡およびDIC顕微鏡で感染サイクル中も観察した。DAPIで染色したLGM-1細胞を、励起波長358 nm、発光波長461 nmで観察した。M. vaginatusは光合成色素に基づく自家蛍光で観察した(620~630 nmの励起で663 nmの発光)。
シアノバクテリア色素
クロロフィルaとスキトネミンの面積濃度は、バイオクラスト中のシアノバクテリアバイオマスとヘテロシスト性シアノバクテリアバイオマスのプロキシとして用いた。直径3mm、深さ1cmのコアを採取し、アセトンで抽出し、Giraldo-Silva49の方法に従って分光光度計で色素濃度を測定した。
CおよびN含有量
全有機態窒素(TON)、全有機態炭素(TOC)、全無機態窒素(TIN)、全無機態炭素(TIC)含量は、深さ0.5cm、直径0.5cmのコアから、プラーク内およびプラーク端から5cm以内の健全なバイオクラスト内の含量を測定した。コアはSPEX Certiprep 8000Dミルで微粉砕し、5分間粉砕した。TOC/TICについては、Perkin Elmer series II CHNS/Oアナライザーで酸燻蒸を行った。TONとTIN含有量については、上記のように粉砕したコアを、硝酸塩とアンモニウムの塩化カリウム(KCl)抽出、または燃焼分析装置での全窒素(TN)に用いた。
細胞外多糖類含有量(EPS)
EPSは深さ1cm、幅1cmのコアからEDTA法50で抽出し、Sigma-Aldrichの市販キット(カタログ番号MAK104)を用いてフェノール-硫酸法51で定量した。
純一次生産性/純呼吸
一次生産性は、地殻表面の酸素交換速度の測定22 を用いて評価した。これには、測定面積12.6 mm2(直径4 mmの円形開口部)、総容量26 µLに小型化された底生フラックスチャンバー52を使用した。この小型化により、対流による内部混合が確保された。チャンバーには、O2測定用マイクロオプトード(先端直径50 µm)が内蔵され、Fire-Sting O2酸素メーターに接続された(いずれもPyroscience Gmbh製)。チャンバーはマイクロマニピュレーターを使って地殻の上に設置した。オプトードは100%飽和で校正され、リアルタイムで温度補正された(19~20℃)。培養には、15cmのシャーレの底に入れたバイオクラストを脱イオン水で飽和まで濡らし、20μmol photons m-2s-1の照度で4時間静置した後、大きめのガラス製円形容器(直径17cm、高さ6. 5cm)の中に入れ、脱イオン水に地殻表面から約2.5mmの高さまで浸し、気流駆動流の下で350μmol m-2s-1の飽和白色光(Fiber-Lite Illuminator model 190)を照射した(量子メーター(Li-Cor model LI-250)で測定)。その後、マイクロマニピュレーターを使用して、底質チャンバーを目的の場所に下ろし、地殻表面と密閉した。各スポットの測定は3回ずつ行った。O2交換率は、測定面積、チャンバー容量、O2飽和度8.79mg/L(19.5℃、塩分濃度0%、標高335m)を用いて逆算した。慣例により、O2交換率は地殻からのO2の純輸出を意味する場合は正の符号を、O2消費率は負の符号を示す。
乾燥ダイナミクス
バイオクラストの乾燥ダイナミクスは、ref.53に従って、2つの温度補正された市販(UP Umweltanalytische Produkte GmbH)の導電率ベースのミニプローブを用いて追跡した。53に従って、深さ2 mmのプラークの内側または外側に設置した。飽和土壌からスタートし、頭上のファンで乾燥速度を速め、10分ごとに同時測定を行った。その結果、地殻の外側では典型的に乾燥の遅れが見られたので、この遅れを含水率80%飽和に達するのに必要な時間として報告する。
微分ダスト捕捉・結合アッセイ
バイオクラストサンプルを蒸留水で濡らし、上から撮影し、50g L-1の珪藻土懸濁液をクラスト表面から4~5cmの高さまで満たした大きめの容器の中に入れ、粒子が沈殿するまで数時間放置した。サンプルを注意深く取り出し、表面が完全に乾くまで、緩やかな空気の流れの下で静置した。乾燥した珪藻土層は、地殻に強い表面反射率を与えた。試料を再び大皿に入れ、蒸留水を地殻から約1cm上まで満たし、空気流で表面粒子を洗った。試料を皿から取り出し、空気流の下に置いてゆっくりと乾燥させ、順次撮影して、差分捕捉の定性的な空間パターンを「現像」した。定量化のために、青色チャンネルを使用したRGB画像解析(Fiji)を用いて、対象領域(プラークまたはその周囲の健全なバイオクラスト)を解析した。平均画素強度は、試験後の任意のエリアについて計算し、試験前の同じエリアの平均画素強度で正規化した。バイオクラスト領域上のプラークの平均画素強度を正規化し、2つの領域で比較したものを、ダスト捕捉の差の尺度として求めた。
統計
プラークの内側と外側のパラメータ間の一般的なパターンにおける統計的有意性を検定するため、各プラークにおける一対の値(内側対外側)の比を計算し、比のコレクションの中央値が単一値から有意に異なる確率を比の対標本ウィルコクソン検定で評価した54。さらに、必要な場合には、部位による平均値の差異をWelchのt検定を用いて評価した。微生物群集の分析では、従属栄養細菌についてはASV(アンプリコン配列バリアント)レベル、シアノバクテリアについては種レベルでの組成シフトの有意性も、9999通りの並べ替えから得られた相対存在量のBray Curtis類似度行列で計算したペアワイズPERMANOVAで検定した。ASVレベルでの群集組成シフトの潜在的な促進因子を決定するために、maaslin2パッケージ55を使用した。計算はすべてR56を用いて行った。
報告概要
実験計画に関する詳細は、本論文にリンクされているNature Research Reporting Summaryを参照されたい。
データの利用可能性
この研究で作成されたシーケンスデータは、BioProject PRJNA786587、BioProject PRJNA730549、BioProject PRJNA730811としてNCBIデータベースに寄託されている。この研究で作成された他のすべてのデータは、補足情報に記載されている。ソースデータは本論文とともに提供される。
参考文献
Garcia-Pichel, F. 砂漠環境:生物学的土壌地殻。環境微生物学百科事典。(ed. Bitto, G.) vol. 6. p. 1019-1023 (Wiley-Interscience, New York, 2003)。
Belnap, J., Weber, B. & Büdel, B. Biological Soil Crusts: An Organizing Principle in Drylands (eds Bettina Weber, Burkhard Büdel, & Jayne Belnap) 3-13 (Springer International Publishing, 2016).
Garcia-Pichel, F. & Belnap, J. Microenvironments and microscale productivity of cyanobacterial desert crusts. J. Phycol. 32, 774-782 (1996).
記事 Google Scholar
米国南西部の生物地理学的地域を横断する砂漠の生物学的土壌地殻における窒素循環。Biogeochemistry 108, 171-182 (2012).
論文 Google Scholar
砂漠の生物学的土壌地殻の風食に対する脆弱性:地殻の発達、土質、攪乱の影響。J. arid Environ. 39, 133-142 (1998).
記事ADS Google Scholar
Couradeau, E. et al. バクテリアがサンスクリーンの生産を通じて乾燥地の土壌表面温度を上昇させる。Nat. Commun. 7, 1-7 (2016).
論文 CAS Google Scholar
乾燥地の水循環における生物学的土壌地殻の潜在的役割。Hydrological Process: Int. J. 20, 3159-3178 (2006).
記事ADS CAS Google Scholar
Elbert, W. et al.炭素と窒素の地球循環におけるクリプトガスの寄与。Nat. Geosci. 5, 459-462 (2012).
論文ADS CAS Google Scholar
シュトルプ、H.&ペッツォルト、H.シュードモナス・バクテリアンに寄生する義務的寄生性微生物に関する研究。J. Phytopathol. 45, 364-390 (1962).
Google Scholar
Pérez, J., Moraleda-Muñoz, A., Marcos-Torres, F. J. & Muñoz-Dorado, J. バクテリアの捕食: 75年を数える!Environ. Microbiol. 18, 766-779 (2016).
論文 PubMed Google Scholar
捕食性原核生物の生物学、生態学、進化学。Vol.4 (Springer Science & Business Media, 2006).
Richards、G. P. et al.大西洋、太平洋、メキシコ湾岸海水中のビブリオ捕食者バクテリオボラクスの季節的レベル。Int. J. Microbiol. 2013, 375371 (2013).
硫黄湖におけるクロマチ科細菌を加害する捕食性細菌の分布。Microb. Ecol. 24, 171-179 (1992).
論文 CAS PubMed Google Scholar
下水処理場,河川水および堆積物におけるBdellovibrio bacteriovorusの分布.Appl. Environ. Microbiol. 31, 469-474 (1976).
論文ADS CAS PubMed PubMed Central Google Scholar
土壌中の細菌を捕食する細菌。Int. J. Syst. Evolut. Microbiol. 32, 339-345 (1982).
Google Scholar
ダヴィドフ、Y.、フリージュン、A.およびユルケヴィッチ、E.培養依存および培養非依存法により明らかにされた土壌中のBdellovibrio-and-like organisms(BALOs)の高い多様性。Environ. Microbiol 8, 1667-1673 (2006).
論文 CAS PubMed Google Scholar
養殖ゼロ放流系における捕食性細菌の存在量、多様性および季節動態。FEMS Microbiol. Ecol. 89, 149-161 (2014).
論文 CAS PubMed Google Scholar
Bethany、J.、Giraldo-Silva、A.、Nelson、C.、Barger、N.N.& Garcia-Pichel、F. 乾燥地土壌の修復のための苗床ベースの生物学的土壌クラストの生産の最適化。Appl. Environ. Microbiol. 85, e00735-00719 (2019).
論文ADS CAS PubMed PubMed Central Google Scholar
Iebba, V. et al. 健康な被験者のヒト腸内におけるBdellovibrio bacteriovorusの高い有病率と存在量。PloS one 8, e61608 (2013).
論文ADS CAS PubMed PubMed Central Google Scholar
Mosca, A., Leclerc, M. & Hugot, J. P. 腸内細菌叢の多様性とヒトの疾患:生態系における主要な捕食者を再導入すべきか?Front. Microbiol. 7, 455 (2016).
論文 PubMed PubMed Central Google Scholar
シアノバクテリアは砂漠の土壌で水を追跡する。Nature 413, 380-381 (2001).
論文ADS CAS PubMed Google Scholar
Garcia-Pichel, F. & Belnap, J. In Biological soil crusts: Structure, function, and management 193-201 (Springer, 2001).
Nunes da Rocha, U. et al. 砂漠の生物学的土壌地殻から非好光性多様性のかなりの部分を分離した。Front. Microbiol. 6, 277 (2015).
論文 PubMed PubMed Central Google Scholar
フザリウム・ケラトプラスティクム(F. solani種複合体、ネクチリア科)による炭素源の利用を変化させる菌内共生細菌(キチノファーガ、バクテロイデス属)。Front. Microbiol. 8, 350 (2017).
論文 PubMed PubMed Central Google Scholar
昆虫の共生細菌における代謝的役割の収斂進化。Proc. Natl Acad. Sci. 106, 15394-15399 (2009).
論文ADS CAS PubMed PubMed Central Google Scholar
遺伝子によって彼らを知る:捕食性細菌のゲノムシグネチャー。(2013年).
論文 CAS PubMed Google Scholar
土壌中に豊富に存在するレリックDNAが、土壌微生物の多様性の推定を不明瞭にしている。Nat. Microbiol. 2, 1-6 (2016).
Google Scholar
Fuerst, J. A. & Webb, R. I. 真正細菌Gemmatata obscuriglobusにおける膜結合型ヌクレオイド。Proc. Natl Acad. Sci. 88, 8184-8188 (1991).
論文ADS CAS PubMed PubMed Central Google Scholar
微生物学百科事典(第3版)(Moselio Schaechter編) 107-124 (Academic Press, 2009).
Tudor, J., McCann, M. & Acrich, I. bdellovibriosによる餌細胞の侵入に関する新しいモデル。J. Bacteriol. 172, 2421-2426 (1990).
論文 CAS PubMed PubMed Central Google Scholar
シアノバクテリアの細菌捕食. Microb. Physiol.31, 99-108 (2021).
論文 PubMed Google Scholar
グリーンバーグ、R.S.、ダニエルズ、S.R.、フランダース、W.D.、エリー、J.W.&ボーリング、J.R.医学疫学(アプルトン&ランゲ、1996)。
Garcia-Pichel, F. in Encyclopedia of microbiology 107-124 (Elsevier Inc., 2009).
Coleofasciculaceae, a Monophyletic Home for the Microcoleus steenstrupii Complex and Other Desiccation-tolerant Filamentous Cyanobacteria. J. Phycol. 57, 1563-1579 (2021).
論文 CAS Google Scholar
シアノバクテリア土壌クラストからの細胞外多糖:乾燥地土壌プロセスにおける役割のレビュー。J. Arid Environ. 75, 91-97 (2011).
記事ADS Google Scholar
Fiji: 生物学的画像解析のためのオープンソースプラットフォーム。Nat. methods 9, 676-682 (2012).
論文 CAS PubMed Google Scholar
Caporaso, J. G. et al. 1サンプルあたり数百万配列の深さにおける16S rRNA多様性のグローバルパターン。Proc. Natl Acad. Sci. 108, 4516-4522 (2011).
論文ADS CAS PubMed Google Scholar
Caporaso, J. G. et al. 高スループットコミュニティシーケンスデータの解析を可能にするQIIME。Nat. methods 7, 335-336 (2010).
論文 CAS PubMed PubMed Central Google Scholar
シアノバクテリア(シアノバクテリアの一種)、シアノバクテリア(シアノバクテリアの一種)、シアノバクテリア(シアノバクテリアの一種)、シアノバクテリア(シアノバクテリアの一種)、シアノバクテリア(シアノバクテリアの一種)。シアノバクテリアの場合。J. Phycol. 56, 1-5 (2020).
論文 PubMed Google Scholar
Roush, D., Giraldo-Silva, A. & Garcia-Pichel, F. Cydrasil 3, a curated 16S rRNA gene reference package and web app for cyanobacterial phylogenetic placement. Sci. Data 8, 1-6 (2021).
論文 CAS Google Scholar
CheckM:分離株、単細胞、メタゲノムから回収した微生物ゲノムの品質評価。Genome Res. 25, 1043-1055 (2015).
論文 CAS PubMed PubMed Central Google Scholar
ゲノムアノテーションへのサブシステムアプローチと1000ゲノムアノテーションプロジェクトでの利用。ゲノムアノテーションのためのサブシステムアプローチと1000ゲノムアノテーションプロジェクトでの利用。
論文 CAS PubMed PubMed Central Google Scholar
RASTサーバ:サブシステム技術を用いた迅速なアノテーション。遺伝子発現を網羅的に解析したデータベース。
論文 CAS Google Scholar
Prokka: 迅速な原核生物ゲノムアノテーション。バイオインフォマティクス 30, 2068-2069 (2014).
論文 CAS PubMed Google Scholar
UniProt:タンパク質知識の世界的ハブ。Nucleic acids Res. 47, D506-D515 (2019).
論文 CAS Google Scholar
KEGGにおけるゲノム変異理解のための新しいアプローチ. Nucleic acids Res. 47, D590-D595 (2019).
論文 CAS PubMed Google Scholar
CIPRES science gateway: a community resource for phylogenetic analyses. 2011年TeraGrid会議録: Extreme Digital Discovery. 41, 1-8 (Salt Lake City, 2011).
Interactive Tree Of Life (iTOL) v4: 最近のアップデートと新展開。Nucleic acids Res. 47, W256-W259 (2019).
論文 CAS PubMed PubMed Central Google Scholar
Giraldo-Silva, A., Nelson, C., Barger, N. N. & Garcia-Pichel, F. Nursing biocrusts: isolation, cultivation, and fitness test of indigenous cyanobacteria. Restor. Ecol. 27, 793-803 (2019).
記事 Google Scholar
Rossi, F., Potrafka, R. M., Pichel, F. G. & De Philippis, R. The role of the exopolysaccharides in enhancing hydraulic conductivity of biological soil crusts. Soil Biol. Biochem. 46, 33-40 (2012).
論文 CAS Google Scholar
デュボア、M.、ジル、K.A.、ハミルトン、J.K.、レバース、P.T.&スミス、F. 糖および関連物質の測定のための比色法。Anal. Chem. 28, 350-356 (1956).
論文 CAS Google Scholar
微生物マットにおける光合成と酸素交換の塩分依存的制限。J. Phycol. 35, 227-238 (1999).
論文 Google Scholar
Weber, B. et al. 表層土壌と生物学的土壌クラストの含水量を定量化する新規センサーの開発と校正。Methods Ecol. Evolution 7, 14-22 (2016).
記事 Google Scholar
Beraldi-Campesi, H., Hartnett, H., Anbar, A., Gordon, G. & GARCIA-PICHEL, F. 土壌元素濃度に対する生物学的土壌地殻の影響:生物地球化学への影響と陸上古代生物の追跡可能なバイオシグネチャーとして。Geobiology 7, 348-359 (2009).
論文 PubMed CAS Google Scholar
集団規模のメタオミック調査における多変量関連性。Submission. Available online: https://huttenhower.sph.harvard.edu/maaslin2/(accessed on 4 May 2020) (2020).
Team, R. C. R: A language and environment for statistical computing. (2013).
参考文献のダウンロード
謝辞
アリゾナ州立大学イーリング材料センターおよびバイオデザイン研究所コア施設の支援に感謝する。本研究の財政的支援は、NSF助成金DEB 2129537およびENG 1449501によるものである。JBは、BYU Charles Redd Center for Western Studies、Friends of the Sonoran Desert、Jornada Basin Long Term Ecological Research Site(DEB 2025166)の支援を受けた。
著者情報
著者および所属
アリゾナ州立大学生命科学部、テンピ、アリゾナ州、85287、USA
ジュリー・ベサニー&フェラン・ガルシア=ピシェル
アリゾナ州立大学バイオデザイン研究所基礎・応用マイクロバイオミクスセンター(米国アリゾナ州テンピ、85287
ジュリー・ベサニー&フェラン・ガルシア=ピシェル
ロスアラモス国立研究所(米国ニューメキシコ州ロスアラモス
シャノン・リン・ジョンソン
貢献
F.G.P.、J.B.は研究を考案し、実験を計画・実施した。J.B.、S.J.がゲノムデータの解析、J.B.、F.G.P.が結果について議論、J.B.、F.G.P.が原稿執筆・編集。
著者
Ferran Garcia-Pichel宛。
倫理申告
競合利益
著者らは競合する利益はないと宣言している。
査読
査読情報
Nature Communications誌は、本研究の査読にご協力いただいた匿名査読者に感謝する。
追加情報
出版社注:Springer Natureは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足情報
追加補足ファイルの説明
報告概要
補足データ1
ソースデータ
ソースデータ
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合はその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
この記事の引用
Bethany、J.、Johnson、S.L.& Garcia-Pichel、F. 土壌バイオクラストのシアノバクテリアに対するバクテリア捕食の高い影響。Nat Commun 13, 4835 (2022). https://doi.org/10.1038/s41467-022-32427-5
引用文献のダウンロード
2022年2月1日受領
2022年8月1日受理
2022年8月17日発行
DOIhttps://doi.org/10.1038/s41467-022-32427-5
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有リンクを取得
コンテンツ共有イニシアチブ「Springer Nature SharedIt」提供
テーマ
細胞微生物学
微生物生態学
土壌微生物学
この論文の引用元
大規模乾燥土壌修復のためのバイオクラスト苗床としての太陽光発電所の二重利用
アナ・メルセデス・ヘレディア=ベラスケス
アナ・ジラルド-シルバ
フェラン・ガルシア=ピシェル
自然の持続可能性(2023年)
パイオニアシアノバクテリア種の空間的自己分離がバイオクラストにおけるマイクロバイオーム構成を促進する
コーリー・ネルソン
アナ・ジラルド=シルヴァ
フェラン・ガルシア=ピシェル
ISMEコミュニケーションズ(2022)
コメント
コメントを投稿することで、利用規約とコミュニティガイドラインを遵守することに同意したことになります。もし、罵詈雑言や規約・ガイドラインにそぐわないものを見つけた場合は、不適切なものとしてフラグを立ててください。
ネイチャー・コミュニケーションズ (Nat Commun) ISSN 2041-1723 (online)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
ナノ
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
キャリア開発
ネイチャー・キャリア
ネイチャーコンファレンス
ネイチャーイベント
地域ウェブサイト
ネイチャー アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー
クッキーの使用
プライバシーポリシー/クッキーの管理
法的通知
アクセシビリティに関する声明
利用規約
アメリカ合衆国のプライバシー権
© 2023 シュプリンガー・ネイチャー・リミテッド
この記事が気に入ったらサポートをしてみませんか?
