臨床における糞便微生物叢移植: 現在の論争と将来の展望
本文へスキップ記事へスキップ
エルゼビアのロゴ
hLife
オンラインで入手可能 2024年2月2日
In Press, Journal Pre-proofこれは何ですか?
レビュー
臨床における糞便微生物叢移植: 現在の論争と将来の展望
https://www.sciencedirect.com/science/article/pii/S2949928324000087






著者リンク オーバーレイパネルを開く田 宏亮 1 2 3 4 #, 王 新軍 1 2 3 5 #, 方 志順 1 2 3 4, 李 龍 1 2 3, 呉 春燕 2 7, 畢 徳熙 6, 李 寧 1 2 3, 陳 琪伊 1 2 3, 秦 煥龍 1 2 3 5
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.hlife.2024.01.006
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
糞便微生物叢移植(FMT)療法で観察される有効性は、急性腸炎>機能性腸疾患>器質性腸疾患または慢性腸炎>腸症状を伴わない腸外疾患である。
FMTdbは、包括的な臨床マルチオミクスデータベースとして、腸内細菌叢異常と多様な疾患との因果関係の理解を深め、最終的にFMT治療の奏効率を向上させるのに役立つ。
FMT治療においては、ドナーの移植菌に対するレシピエントの常在菌のコロニー形成拮抗作用を克服するために、高度なアジュバント治療戦略を用いる必要がある。
要旨
腸内細菌叢はヒトが共有できる唯一の「臓器」であり、糞便微生物叢移植(FMT)技術を通じて様々な腸管および腸管外疾患の治療に広く応用されている。ドナーの選択戦略を最適化することで、FMTは再発性クロストリジウム・ディフィシル感染症などの急性腸炎に対して最高の有効性(90%以上)を示した。しかし、腸管機能性疾患(60%以上)、慢性腸炎や器質的疾患(60%未満)、腸管外疾患、特に消化器症状を伴わない疾患(50%未満)に対処する場合には、その有効性は低下する。多様な疾患におけるFMTの治療効果を高めるための継続的な努力が、現在の臨床研究の中心的な焦点となっている。本総説では、ドナーの選択、レシピエントの管理、正確なドナーとレシピエントのマッチング、移植菌に対する在来菌の拮抗機序、さまざまな疾患に対する標的治療戦略などに焦点を当て、FMTの臨床効果を向上させるための実践的な戦略を提供することを目的とする。
グラフィカル抄録
画像1
ダウンロード 高解像度画像ダウンロード(279KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
糞便微生物叢移植臨床研究コロニー形成拮抗作用
はじめに
高齢化社会の到来と社会的ストレスの増大により、薬物介入によって誘発される腸管病変の有病率が上昇し、腸管の問題を伴う慢性疾患が著しく増加している [1] 。70歳以上の高齢者では、約32%が消化管病変を合併している [2] 。このような患者、特に複雑な病態を有する患者において、腸管病変に対する薬物介入で最適な治療成績を達成することは非常に困難である。最近の研究では、腸内細菌叢のアンバランスと、糖尿病、肥満、腫瘍、アルツハイマー病など80以上の慢性疾患との密接な関連が明らかにされている [3,4] 。その結果、疾患と腸内細菌叢の根本的な関係を解明し、糞便微生物叢移植(FMT)療法を科学的に実施することが、臨床治療における画期的な戦略として浮上してきた。
FMT療法の起源は、中国の東晋時代の「周北方方」にまでさかのぼり、1958年に米国のEiseman博士が現代医学におけるFMT療法の先駆者となった[5]。最新の疫学、臨床、オミックス研究は、細胞実験や動物実験データとともに、腸内細菌叢やマイクロバイオームがヒトの様々な腸疾患に対する感受性や治療反応を決定する上で極めて重要な役割を果たしていることを示す証拠を提供している[4,6]。現在、FMTは、特に再発性クロストリジウム・ディフィシル感染症(rCDI)の治療において非常に成功した治療アプローチとして登場しており、その成功率は90%にも達している[7]。さらに、FMT療法はrCDI治療の合併症を減少させ、患者の全生存期間を延長し、rCDIに関連する血流感染や関連する外科的介入の発生率を減少させる可能性を示している [8] 。しかし、rCDIに対するFMT療法で観察された成功は、他の疾患の治療では再現されていない。例えば、炎症性腸疾患(IBD)の治療におけるFMTの有効性は50%程度である[9,10]。腸管疾患と腸管外疾患の両方に対するFMT治療の有効性をさらに高める方法は、現在のFMT臨床研究の中心的課題として際立っている。
FMT治療効果の向上は、ドナーの選択、レシピエントの準備、移植片の作製、FMTの実施と管理プロセスという4つの重要な要素に影響される[11]。このうち、効果的なドナーを特定することが最も重要なステップであると考えられている。これを達成するために、一連の国際的な専門家によるコンセンサス会議が行われ、ドナーのスクリーニング基準は3つの段階を経て発展してきた。第一段階は病歴と薬歴のスクリーニングである[11]。第2段階は、これに加えて生活歴のスクリーニングを取り入れたものである[12]。第3段階は、個人歴を追加し、血液検査と便検査を実施することによって基準を拡大するものである[13,14]。これらのFMT治療コンセプトの進歩により、FMT治療効果は著しく向上しており、これらの開発は中国における数万件のFMT臨床を通じて検証されている[2,3,15]。
2012年以来20,000人以上の患者がFMT治療を受けている当科では、最初のドナースクリーニングは臨床検査評価のみで、このアプローチでは2000人以上の患者の統計に基づくFMT有効率は42.8%であった[15]。その後、私たちは包括的な6次元ドナー・スクリーニング・プログラムを実施し、8000人以上の患者の統計によると、FMT有効率は68.7%に増加した[15]。その後、8547人の患者を5年間追跡調査した結果、腸の急性炎症、機能性疾患、慢性炎症または器質性疾患、腸症状を伴う腸外疾患、純粋な腸外疾患の順に有効性が低下することが明らかになった[2]。
現在、FMTの臨床は混沌の時代から精度の時代へと移行している。その結果、ドナーの標準化、レシピエントの適応/禁忌の特定、ドナーとレシピエントの正確なマッチング、さまざまな疾患に対する差別化された治療アプローチなど、FMTの治療効果に影響を与える新たな要因が出現している。このような背景から、FMTの過程でドナーの微生物叢がレシピエントの腸内でコロニー形成される際に関与する拮抗メカニズムをさらに理解することが極めて重要である。ここでは、世界的なFMTの臨床応用で観察された反応特性の要約を提供し、治療反応をさらに高めることができる因子を掘り下げ、現在の論争に対処することを目的とし、FMTの有効性を改善するための実践的な戦略を提示する。
FMTの有効性に関する臨床的洞察
FMT技術の発展に伴い、現在、世界中で80以上の疾患を対象とした数百のFMT関連の臨床研究が行われている[3]。このうち、30件の研究がランダム化比較試験(RCT)として発表されており、消化器疾患、精神疾患、神経発達疾患、皮膚疾患、代謝性疾患、薬剤耐性菌感染症、腫瘍、結合組織疾患、神経変性疾患の9つのカテゴリーに分類されている(図1A)。腸疾患はFMTが最初に適用された領域であり、現在も中心的な研究分野となっている。このカテゴリーは主に、rCDI、IBD、過敏性腸症候群(IBS)の3つの疾患から構成されている。さらに、FMT技術発祥の地である中国では、このアプローチは、先に述べた3つの疾患に加えて、機能性便秘、放射線腸炎、慢性下痢などの腸疾患にも広く用いられている[2]。
図1
ダウンロード 高解像度画像のダウンロード(970KB)
ダウンロード フルサイズ画像のダウンロード
図1 (A)消化器疾患、精神疾患、皮膚疾患など9つのカテゴリーにまたがるFMT関連のランダム化比較試験の結果。(C)中国で報告された8036人の患者を対象に、1ヵ月および12ヵ月の追跡調査を通じてFMTの有効性を評価した[2]。数値注釈は、有効率統計の算出に考慮した症例数を示す。略語 ASD、自閉症スペクトラム障害、FMT、糞便微生物叢移植、IBD、炎症性腸疾患、IBS、過敏性腸症候群、rCDI、再発性クロストリジウム・ディフィシル感染症。
FMTの実施戦略に関しては、国際的なFMTガイドラインは主に欧米における中小規模の臨床試験の結果に基づいて策定されている[[11]、[12]、[13]、[14]]。一方、中国のFMTガイドラインは、主に単一施設における1万人以上の臨床治療結果に基づいて策定されている[16]。したがって、中国のFMTガイドラインは、国際的なFMTガイドラインに準拠することを基本として、国際的なFMT臨床ガイドラインよりも厳格なドナーとレシピエントの組み入れ基準と、より詳細なFMT管理スキームを導入し、より多くの適用可能な疾患タイプを含んでいる。とはいえ、国際的なFMT臨床診療であれ、中国における大規模単一施設臨床診療であれ、FMT療法は一貫して以下のような特異的な有効パターンを示している。
腸の急性炎症に対するFMTの有効性は、慢性炎症よりも優れている。下痢性大腸菌、C. difficile、赤痢菌などの病原性細菌に起因する下痢性疾患は、主に急性感染症である[17,18]。1159例を網羅した国際的なRCTや中国の単施設研究では、これらの患者に対するFMTの有効率は通常90%を超えている。放射線性腸炎などの急性腸炎反応でも、FMT治療に対する奏効率は72.7%に達する。一方、IBDやIBSのような慢性炎症性疾患では、FMTの有効率は低く、通常60%程度である(図1Bおよび1C)。
腸管機能性疾患のFMT効果は器質性疾患より優れている。IBSと便秘は特徴的な腸管機能性疾患であり、FMT治療の有効率はそれぞれ65.3%と64.5%である。一方、IBDは器質的な腸疾患であり、IBDに対するFMT治療の有効率は58.4%と比較的低い(図1C)。
腸管疾患に対するFMTの有効性は、腸管症状を伴う腸管外疾患よりも優れている。パーキンソン病は代表的な細菌-腸-脳軸疾患である。今回のデータには、主に消化器症状を示す患者が含まれている[2]。この文脈におけるFMT治療の有効率は48.3%であり、純粋な腸疾患よりも低かった(図1C)。
腸管症状を伴う腸管外疾患に対するFMTの有効性は、腸管症状を伴わない疾患よりも優れている。全身性エリテマトーデス、シェーグレン症候群、関節リウマチ、皮膚筋炎などの自己免疫疾患と診断された患者は、腸内細菌叢異常症を示すが、典型的な消化器症状はない。このグループのFMT奏効率はわずか40.4%で、世界的なRCTや中国でのFMT適用例で観察されたように、腸管症状を伴う腸管外疾患で観察された奏効率よりも低かった(図1Bおよび1C)。
自閉症スペクトラム障害(ASD)は、細菌-腸-脳軸を通して治療することができる。ASDの病因に腸内細菌叢のアンバランスが関与しているかどうかについては、現在最も大きな論争の一つとなっている。さらに、この論争は、FMTによってASDを効果的に治療できるかという問題にも及んでいる。ある研究者は、ASDは腸内細菌とは無関係であるという見解を示している。彼らは、ASDにおけるマイクロバイオームの違いは、診断上の特徴に関連した食事の嗜好を反映している可能性を示唆する、Yapの研究結果を確実な証拠として指摘している[19]。これらの研究者たちは、ASDにおけるマイクロバイオームの原因的役割を主張することに対して慎重な姿勢を強調している。この視点は、ASD以外にも、診断が特定の行動や食事の選択と複雑に関連し、その結果マイクロバイオームに影響を及ぼすような病態が数多く存在するのではないかと疑うまでに広がっている[20]。しかし、細菌-腸-脳軸の存在とASDの発症・進行との密接な関連性を裏付ける証拠は数多くある。注目すべきは、無菌マウスで行われたFMT実験が、これらの仮説の重要な基礎となっていることである。シャロンによる極めて重要な研究は、腸内細菌叢が神経活性代謝産物の産生を介してマウスのASD行動を制御していることを示している[21]。この研究は、ASDの病態生理学に寄与する腸と脳のつながりの重要性を強調している[21]。ASDの治療法としてのFMTの理論的裏付けは、さらに無菌マウスを用いた実験から得られている。これらの実験では、テトラヒドロビオプテリン合成経路の代謝産物をアップレギュレートすることによって、標的微生物介入によってCntnap2-/-ASDマウスの社会的欠損が効果的に緩和されることが確認されている[22]。ASDにおける腸脳軸の病因説に反対する人々は、子どもの脳の発達における重要な時期、特に3歳以前を見落としている。この理論の支持者は、ヒトの腸内細菌叢とマウスの腸内細菌叢の間に大きな相違があることを認めながらも、ヒトを対象としたより直接的な研究結果を示すという課題に直面している。その結果、FMTによるASD児の治療は、上記の論争に対処するための最も直接的で実践的なアプローチとして浮上し、具体的なエビデンスとして実際の症状改善に頼ることになる。2020年、私たちは中国で、FMT治療を受けた15の病院にわたる318人のASD患者を対象とした、極めて重要な多施設共同二重盲検無作為化プラセボ対照試験を実施した[23]。この臨床試験の結果は、細菌-腸-脳軸障害とASD発症との関連をめぐる現在進行中の論争を根本的に解決するものと期待されている。この臨床試験に先立ち、消化器症状を示すASD患者137人が、臨床試験と同じ計画に従って治療を受けた。1年間の追跡調査の結果、これらの患者の62.5%がASD症状の有意な改善を経験した(図1C)。その結果、FMTはASDにとって非常に有望な治療法であり、ASDの早期スクリーニング、診断、治療の基準を確立するためのさらなる研究が必要である。
FMT治療に対する患者の反応に影響を与える決定要因
現在、FMT治療の有効性は、ドナーの微生物叢の健康状態、FMT前の患者管理、FMT投与経路、治療計画の全体設計など、さまざまな要因に影響されるという見解が主流である(図2)。これらの側面は、過去の画期的なレビュー[2,15,24]や専門家のコンセンサス[[11], [12], [13], [14]]に幅広く詳述され、統合されている。これらに基づくと、FMTはrCDIと下痢の治療において優れた結果を示している。それにもかかわらず、他の疾患に対するFMTの有効性には、改善の余地が大きく残されている。ドナーおよびレシピエント双方の腸内細菌叢の多様性と特異的組成、免疫系、宿主の遺伝学など、いくつかの新たな因子がFMTの治療効果に関連していると考えられている。便量、注入菌数、投与経路、補助療法などの治療レジメンの側面も、FMTの成功に大きく寄与している。さらに、最近の知見は、ドナーの微生物生着の程度とFMTの臨床的成功との間に関連性がある可能性を示している。このような既存のエビデンスを踏まえると、ドナー、レシピエント、および臨床の各要因がどのように協調して、ドナーの微生物叢のコロニー形成効率を高め、移植菌に対する患者の常在菌のコロニー形成拮抗作用を緩和し、FMTの全体的な有効性を向上させ、再発率を低下させるかをさらに調査することが不可欠である。この目的を達成するためには、以下の課題に取り組むことが不可欠である。
図2
ダウンロード 高解像度画像ダウンロード(488KB)
ダウンロード フルサイズ画像のダウンロード
図2. FMTの治療効果は、ドナー、レシピエント、医療従事者が関与する要因によって決定される。
スーパードナー」とは?
FMTの適用における「スーパードナー」とは、移植片として使用された場合に、臨床的転帰を良好にするために特に効果的な便を持つ個人を指す。このような人は、レシピエントの腸の健康回復に特に有益な微生物叢組成を持っていると考えられている。しかし、316件のFMT臨床研究から得られたメタゲノミクスデータを分析したピア・ボークの最近の研究は、臨床転帰の改善を「スーパードナー」だけに頼るという考え方に疑問を投げかけている。この研究によると、レシピエントの微生物叢の健康状態と、ドナーとレシピエントの正確なマッチングが、FMTの成功を決定する重要な要因であるとしている[25]。
ディスバイオーシスとは、腸内細菌叢の典型的な組成の不均衡や崩壊を意味し、実際、ディスバイオーシスの特異的な微生物叢は、異なる疾患間で異なる可能性がある [26] 。重要なことは、マイクロバイオームの構成には個人差があるということであり、ある人の微生物欠乏症が別の人のそれを反映するとは限らないということである [27]。その結果、FMT治療に対する反応には非常に個人差があり、同じドナーを用いても患者の反応は異なる可能性がある。すべての疾患を治療できる「完璧なドナー」という概念は、理論的には魅力的かもしれないが、現実には、ディスバイオシスの多様性のために、万能の解決策は存在しない。しかし、"スーパードナー "の存在は、様々な理由により、特定の個人が、ほとんどのレシピエントにおいて一貫して良好な結果をもたらす微生物叢を持っている可能性があることを示唆している。
スーパードナー」という概念は、潰瘍性大腸炎を治療するためにFMTが検討されたLancet誌に掲載された臨床試験から注目されるようになった[28]。この試験では、同定された「スーパードナー」からの細菌叢は、「非スーパードナー」と比較して、患者の症状を緩和する効果が2倍(37%対18%)であった。その後、潰瘍性大腸炎に対するFMTに焦点を当てた別の臨床試験では、特定のドナーからの微生物叢を使用した場合、すべての患者で顕著な寛解効果が得られたことが報告された[9,29]。過去5年間のFMT臨床実践の中で、90%以上の有効率で糞便微生物叢をFMT治療に使用した「スーパードナー」症例も発見した[2]。ドナーは女性、24歳、体重57kg、身長164cm、BMI21.2kg/m2。元の便サンプル、糞便菌液、および糞便菌カプセルを用いた16S rRNAシークエンシングにより、有害または病原性の微生物は検出されなかった。シャノン多様性指数が高く、バクテロイデス、フェーカリバクテリウム、ラクノスピラが豊富であることが彼女の腸内細菌叢の特徴であった。
高い細菌多様性と低い細菌変動頻度という特徴は、潜在的な "スーパードナー "において好ましいと考えられている一般的な理解と一致している。Peer Borkの研究によると、FMT中に同じ種の菌株を多く導入することで、ドナーの微生物叢のコロニー形成効率を高めることができる[25]。スーパードナー」がより重要な細菌コロニー形成能力を有している可能性があるというこの示唆は、その微生物叢がレシピエントの腸により強固に統合される性質を有していることを示唆している。
ドナーの募集は、綿密な「5段階6次元」計画に従って行われる [15]。移植片の調製は、標準化された手順に沿って行われる[16]。移植経路の選択は、レシピエントの治療計画に基づいて決定される [2]。
5段階のスクリーニング・プロトコル」は、潜在的な「スーパードナー」を選択するための重要な基準である(図3)[15]。このプロトコールと並行して、ドナーの腸内細菌叢を健康に保つためには、食物繊維の大量摂取、プロバイオティクス/プレバイオティクス食品、十分な水分摂取、多様な食品などの食事ガイドラインが不可欠である。優れた品質を保証するためには、菌液の調製と保存の手順を強化することが不可欠である。次世代シーケンシングや多様なラボアッセイを含む包括的な分析による徹底的な精査が、移植された各細菌液について実施される。これらの分析により、細菌組成が効果的に定義され、有害な細菌が特定され、薬剤耐性遺伝子が特定される。このような厳格な分析が、FMT手順用のすべての細菌液に一貫して適用されている。さらに、溶液の有効性と信頼性を維持するためには、調製後1週間以内に使用する必要がある。しかし、この分野の研究はまだ発展途上であり、「スーパードナー」の同定と特徴づけは、疾患によって異なる可能性があることに注意することが肝要である。
図3
ダウンロード 高解像度画像のダウンロード(849KB)
ダウンロード フルサイズ画像のダウンロード
図3. FMT治療の手順
ドナーの標準化のために何をすべきか?
FMTドナーの標準化は、腸内細菌叢の変動、ドナーの多様な個人歴、彼らの生活歴の制御不能な性質のために、重要な課題である。こうした課題にもかかわらず、ドナーの標準化はFMTの精度を高めるために不可欠である。取り組むべき第一の課題は、異なるバッチ間でドナーの糞便微生物叢の一貫性を維持しながら、有効性を確保することである。
この課題に対処するために一般的に採用されている戦略は、複数のドナーからの微生物叢移植を組み合わせることである[28,30,31]。この方法は、移植される微生物叢の多様性を著しく高め、異なるレシピエントが同じ組成の微生物を受けられるようにすることを目的としているが、バッチ間の影響は持続する可能性がある。IBD患者に対するFMT治療のメタアナリシスでは、複数ドナーの併用戦略の使用により、FMT治療に対する奏効が2倍以上になることが明らかになった [32] 。複数のドナーの微生物叢を組み合わせることで、細菌の多様性を著しく高めることができる一方で、課題も生じる。多様性が高まると、腸内細菌叢の変動がより顕著になる可能性がある [33]。その結果、この変動性の増大が、治療反応に伴う微生物の頻繁な喪失の一因となる可能性がある [8] 。FMTプロトコールを最適化する上で、多様性強化の利点と潜在的な変動という課題のバランスをとることは、現在進行中の検討課題である。
最近、「人工糞便」という概念が、FMTのバッチ間の一貫性を達成するために、細菌の多様性と変動のバランスをとるという上記の課題に対処することを目的としている[34]。この革新的なアプローチでは、無菌マウスなどのモデル動物の腸内に100以上の高存在ヒト腸内細菌株をコロニー形成させ、モデル動物の腸内細菌叢が安定したバランスのとれた状態になるまで、健康なヒトの糞便サンプルを用いてFMTを複数回実施する。この方法により、「スーパードナー」の糞便微生物叢の特徴をモデルにした「人工スーパー糞便」の作製が容易になる。さらに、モデル動物をヒトの消化管シミュレーション装置に置き換えることで、「人工スーパー糞便」の大規模な標準化生産の可能性が開かれ、将来的にはヒトドナーの代替となる。
標準化されたドナーの微生物叢生産はまだ研究の初期段階にあるが、複合微生物叢移植戦略はrCDIの臨床治療において有望視されている。複合微生物叢移植の2つの主要なアプローチは、菌株移植と胞子移植である。MET-2は40菌株からなる製剤であり、rCDIの治療において95%という驚くべき有効性を示した [35] 。もう一つの戦略であるSER-109は、精製したファーミキューテス属の芽胞を移植に利用するもので、調製過程における生菌の生存率に関する懸念に対処し、rCDIの治療において90%以上の有効性を達成している[36]。他の疾患への複合微生物叢移植の応用はまだ十分に検討されておらず、コロニー形成拮抗作用などの課題に直面しているが、この方法は長期的にはFMT移植片の標準化を改善する上で大きな可能性を秘めている。
FMT療法の適応と禁忌は?
現在、臨床ガイドラインと専門家のコンセンサスは、rCDIとIBDの治療にFMTを推奨している[11,13,14]。これら2つの消化器系疾患以外にも、FMTの適応にはIBS、機能性便秘、下痢が含まれる。中国では、20,000例以上のFMTの臨床例に基づいて、その他の疾患に対するFMTの適応を体系的にまとめている[2,15,16]。腸内細菌叢の乱れに起因する腸管外疾患を治療するためには、FMTの適応は消化器症状を伴うか、腸内細菌叢の乱れとの関連が確認されなければならない。パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、てんかんなどの神経疾患は、FMT療法の適応と考えられている。ASD、うつ病、チック症候群などの精神疾患も適応症として認められている。メタボリックシンドローム、糖尿病、肥満、脂肪肝、高脂血症などの代謝性疾患も適応症に含まれる。自己免疫性肝炎、全身性エリテマトーデス、強直性脊椎炎、免疫性変形性関節症、アトピー性皮膚炎、特発性血小板減少性紫斑病などの免疫系疾患も適応症として認められている。さらに、FMTは移植片対宿主病の治療にも使用され、腫瘍免疫療法の増感剤として機能することがある[16]。
FMT療法の禁忌には、敗血症、消化管の活動性大出血、穿孔、その他腸管バリアの重度の損傷を伴う状態、劇症大腸炎または中毒性巨大結腸症が含まれる; 重度の下痢、著しい繊維性腸管内腔狭窄、重度の消化管出血、高スループット腸瘻、および50%経腸栄養療法に耐えられない患者に関与するその他の理由;先天性または後天性免疫不全疾患;高リスクの免疫抑制剤または細胞毒性薬による最近の治療;重度の免疫抑制患者;妊娠中または授乳中の女性。
FMT治療を実施する前に、患者が典型的なバイタルサインを示し、発熱、重症感染症、敗血症、全身性炎症反応症候群(SIRS)などの炎症性疾患に罹患していないことを確認することが極めて重要である[2,8]。さらに、患者は十分な経口栄養または経腸栄養に耐えられる必要がある。下痢またはrCDIの患者には、抗生物質の準備(バンコマイシンの経口投与)が必要であり、その他の患者には移植前に腸の準備(浣腸またはポリエチレングリコールの経口投与)が必要である。FMT治療中の抗生物質、ホルモン剤、免疫抑制剤は一般に推奨されない。
現在、FMTの主な移植経路には、経口移植、経鼻胃管移植、大腸内視鏡移植がある(図3)[2,11,14]。栄養不良で小腸と大腸の両方に病変がある患者には、経鼻胃管ルートを選択することが勧められる。高齢者や小児など経鼻胃管に耐えられない患者は、経口カプセルを選択すべきである。病変が大腸に限局しており、1回の治療効果が良好な患者には、大腸内視鏡補助下FMTが望ましい。病変が直腸とS状結腸に限局している場合は、注腸FMTを行う。治療効果が良好で、治療成績の維持が必要な患者には経口カプセルが適している。
経鼻胃管移植法では、新鮮な凍結健常ドナーの菌液(100mL)を、空腸近位端に留置した経鼻胃管から連続6日間注入する[2]。あるいは、経口カプセルFMTは、カプセル化された凍結乾燥糞便接種液を利用するもので、患者は絶食の上、朝夕4カプセルを6日間連続で摂取する。この48カプセルには、ドナー基準に従ってスクリーニングされた非血縁ドナーの糞便抽出物600mLから得られた濃縮凍結乾燥粉末が含まれていた。大腸内視鏡補助下FMTでは、1回の便注入(600mL)が行われ、患者は1時間右側に横たわるように指示された。浣腸群では、使い捨ての浣腸チューブを使用し、肛門から深さ20cmの浣腸チューブを通し、毎回100mLの菌体抽出液を注入し、浣腸後1時間は右側臥位で6日間連続するよう指示した。
ドナーとレシピエントの微生物叢の健康状態を定量的に評価するには?
FMTを受けた患者の予後に関連する微生物叢に関する定量的データを得ることは、ドナーとレシピエント双方の微生物叢の健康状態を評価する上で極めて重要である。この目的のためには、ドナーとレシピエントの広範なコホートを集めることが不可欠であることは間違いないが、可変的なスクリーニング方法を選択することが、この目標の達成可能性を判断するための前提条件となる。
FMT研究には、ドナーとレシピエントが正確に一対一に対応するという固有の特徴がある。従って、この文脈に最適な変数選択アルゴリズムは、ドナーとレシピエント間の対比較を考慮しなければならない。この脈絡で、最近導入されたベイズ差分ソートアルゴリズムは注目すべき利点を示している[37]。このアルゴリズムは、ドナーとレシピエントの年齢、性別、移植時期などの重要なデータポイントを包括的に取り入れることにより、明確な優位性を提供する。この総合的なアプローチにより、バックグラウンドの誤差が効果的に最小化され、その結果、患者群内で広範囲に濃縮を示す腸内菌株や顕著に欠失する腸内菌株をより正確に識別することができる。
FMTのマッチング調査において、もう一つの顕著な特徴は、介入可能性の概念である。ベイジアン微分順位変数選択アルゴリズムによって導き出される特徴的な微生物は、本質的にランダムな誤差を伴う。FMTに内在する介入可能性を活用することで、有望な道が開ける:クラスター分析の応用である[38]。このアプローチは、治療反応に実質的な重要性を示す腸内微生物群集の選択を容易にする態勢を整えている。そうすることで、重要なバイオマーカーの特定に役立つだけでなく、FMT治療の最終的な成否に光を当てる因果関係の証拠も得られる。
ドナーの微生物叢をレシピエントに移植することに成功した場合、多くの場合、そのコロニー形成率よりもむしろ、移植された細菌のコロニー形成が重要視される。この重点は、ドナーの細菌種が移植される典型的なオール・オア・ナッシングの方法に由来しており[39]、移植されたドナーの細菌に対するレシピエントの常在菌の影響を直接知ることができる。マイクロバイオーム内の治療反応に関連する微生物株のコロニー形成事象を解明するには、頻度ベースの特徴選択アルゴリズムに根ざしたアプローチが不可欠となる[40]。この手法では、コロニー形成事象の頻度とコロニー形成細菌の存在量の両方が重要なスクリーニング基準として浮上し、治療反応に関連する細菌群の同定が可能になる。
FMTの予後に関連する微生物叢のスクリーニング方法は、疾患の種類とコホートの特徴を考慮して考案されるべきである。FMT治療反応と正または負の相関を示す主要な細菌種または菌株を同定し、それらを定量化することが不可欠である。腸内細菌叢指標(GMI)の確立は、腸内細菌叢の健康状態を記述する便利な数学的ツールを提供し、その数学的表現は以下のように記述できる[40]:
ここで
は、FMT後の治療反応と正の相関がある菌株の「シャノン指数」を表す;
は、治療反応と負の相関を示す菌株の「シャノン指数」を表す。したがって、GMIは、患者とドナーの両方の糞便微生物叢における「有益菌」と「病原性菌」の比率を効果的に描き出すことができる。言い換えれば、GMI>1の人は、糞便中の「有益菌」の割合が「病原性菌」をはるかに上回っていることを示す。
腸管または腸管外疾患のドナーとレシピエントを正確にマッチングするには?
治療反応に関連する微生物叢情報に基づき、ドナーとレシピエントのマッチングアルゴリズムを開発することは、現在のFMT治療における重要な課題である。これには、どのドナーがFMTを受ける患者に最も適しているかということと、レシピエントの症状がFMT後に改善するかどうかという2つのレベルの意味合いが含まれる。
分析的階層過程は、最も適したドナーを選択するための古典的な評価モデルである。最近の研究では、α-多様性、β-多様性、「有益菌」、「病原性菌」をドナーとレシピエントのマッチングの基準として用いており、この方法で70%以上のマッチング成功率を達成できることが確認されている[41]。
腸型または腸シグネチャーは、レシピエントのマッチングにおいて重要な基準となる。最近の研究では、ドナーおよびレシピエントの腸型およびマイクロバイオーム・プロファイルが、ランダムフォレスト・モデルを訓練するための入力変数として利用された。このアプローチは前向き臨床試験で検証され、ドナーとレシピエントの正確なマッチングが93.3%の精度で達成できることが実証された[42]。
現在のFMT臨床応用では、FMTドナーとレシピエントの適合性を予測・評価するために、意思決定、分類、予測モデルを含む様々な精密な計算ツールや方法論が利用可能であり、積極的に活用されている。これらの高度なモデルは、多様なパラメーターや基準に基づいてドナーとレシピエントの最適な組み合わせに関する貴重な洞察を提供することにより、FMTの精度と有効性を実際に高めている。とはいえ、ドナーとレシピエントをマッチングさせるためのプロトコルは、特に異なる疾患、特に腸管疾患と腸管外疾患の区別を扱う場合には、より明確にする必要がある。様々な疾患にわたる10,000人以上からなる包括的なコホートを作成することは、FMT治療におけるドナーとレシピエントのマッチングを支配する基本原理を解明する可能性を秘めている。この基礎的理解は、その後、各疾患や適応症に合わせた特定のマッチングプログラムを開発するための基礎となる。
FMTデータベースの構築と応用
多様な疾患に対する標的化されたFMT治療を実現するために、我々はFMTdbデータベース(gift2disease.net/FMTdb/)を構築し、現在3000サンプル以上のメタゲノムデータを網羅している(図4A)。さらに、このデータベースには、人口統計学、健康診断結果、経時的な便サンプルのシーケンスデータを含む包括的なドナー情報が含まれている。レシピエントの人口統計学的詳細、移植前の臨床評価、治療結果、治療後の臨床変化、腸内細菌叢シーケンス結果も網羅されている(図4B)。
図4
ダウンロード: 高解像度画像のダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図4. FMTデータベースの構築と応用。(A)FMTdbデータベースは現在、数十種類の疾患にまたがる3000以上のサンプルのメタゲノミクスデータとFMT関連の臨床情報を網羅している。(B)FMTdbデータベースのスキーマ。(C)FMTdbデータベースを用いてランダムフォレスト分類モデルを構築し、18疾患の診断に役立てた。(D)FMTdbデータベースを用いてドナー-レシピエントマッチングモデルを構築し、90%以上のマッチング精度を達成した。略語 ASD、自閉症スペクトラム障害、IBD、炎症性腸疾患、IBS、過敏性腸症候群、SVM、サポートベクターマシン、ANN、人工ニューラルネットワーク、RF、ランダムフォレスト、AUC、曲線下面積。
マイクロバイオームの属、種、株レベルのアノテーション
現在、腸内細菌叢の探索では、16Sアンプリコン・シーケンスの利用を中心としたアプローチが主流である。このアプローチは、再現性、双方向性、スケーラビリティ、費用対効果など、いくつかの要因によって選択されている[43]。現在、主に属レベルの細菌群集アノテーションのためのソフトウェアソリューションがいくつかある。QIIME 2 [43]、mothur [44]、phyloseq [45]などである。これらのマイクロバイオームデータ解析ツールは、細菌群集の属レベルの同定を可能にする。
16Sアンプリコンシーケンスアプローチと比較して、アノテーション結果の精度が優れていることで認知されているメタゲノムデータアノテーションでは、分類学における種レベルの細菌群集アノテーションの探求が活発に行われている。この分野での先駆けは、メタゲノム解析のためのツールとして広く受け入れられているMetaPhlAn 4である[46]。MetaPhlAn 4は、メタゲノム集合体と単離された微生物ゲノムのデータを統合していることが特徴で、メタゲノム分類学的解析に広範かつ微妙な視点を提供している。驚くべきことに、MetaPhlAn 4は、26,970の種レベルのゲノムライブラリのユニークなマーカー遺伝子を定義することに成功し、そのうちの4992は、他の方法では認識されないまま、種レベルの分類学の頂点を占めている[46]。MetaPhlAn 4が、ほとんどの国際的なヒト腸内細菌叢のリードの約20%を解明していることは注目に値するが、この数値は、ルーメン微生物叢というあまり開拓されていない領域のような環境では、40%以上にまで上昇する。さらに特徴的なのは、包括的な評価において既存の代替品と比較した場合、精度の点で優れていることが実証されていることである。さらに、分離株を培養する必要がなく、信頼性の高い定量化に優れています。
腸内細菌叢の種レベルのアノテーションは、FMTに関連するほとんどのアプリケーションのニーズに応えているが、菌株レベルでの精度を提供できるマイクロバイオームアノテーションアルゴリズムに対する差し迫った需要が残っている。この要求に応えるため、種レベルのゲノムビン(species-level genome bins:SGBs)が、マイクロバイオーム内の菌株レベルのアノテーションを実現するための、特に興味深いソリューションとして登場している[47]。SGBのリポジトリは、154,723の微生物ゲノムの豊富な基盤を利用しており、より深いレベルのマイクロバイオーム解析とメタゲノム・データのシームレスな統合を可能にしている。この進歩は、リードのマッピング可能性の顕著な向上によって強調されており、腸内マイクロバイオームでは平均67.76%から87.51%に、口腔内では65.14%から82.34%に向上している。その結果、この方法論は、未知の種や培養不可能な微生物であっても、菌株レベルのアノテーションを提供できる強力なツールである。FMTdbの有効性は、菌株のコロニー形成に焦点を当てた先行研究 [48,49]における広範な利用を通じて検証されている。
FMTdbデータベースは現在、すべての臨床症例サンプルの属レベルおよび種レベルのアノテーション情報を提供しており、SGBsのアノテーション結果も継続的に更新されている。この高解像度のアノテーションは、様々な疾患の正確なFMT治療や、正確なドナーとレシピエントのマッチングのための基礎データとなる。
様々な疾患におけるディスバイオージスの特徴の同定
FMTdbデータベースは、10万人以上の患者のマイクロバイオームデータを保存する広範なリポジトリでもある。データは主に発表された研究から得られたもので、18の異なる疾患カテゴリーをカバーしている。この包括的なデータセットはマルチオミクス情報を統合しており、含まれる全サンプルの細菌種、代謝物、臨床指標の詳細を網羅している。ディープラーニング技術の能力を活用し、疾患マッチングにおいて最高精度を示す74の特徴を特定した。分析範囲を拡大し、機械学習アルゴリズムを構築して、18の異なる疾患の固有の腸内マイクロバイオームに対する補助診断モデルを構築した。
分類モデルは3つのレベルで構成されている。最初のレベルでは、病気の種類、ライブラリーの構築方法、配列決定方法、データの種類、基本情報などの基本的な特徴を網羅しており、合計で5種類の特徴がある。第2レベルでは、病期、年齢、性別、BMIなどの因子を含む11の特徴を追加している。3番目のレベルでは、細菌種と代謝物にまたがる66の特徴からなる包括的なセットが導入される。驚くべきことに、このモデルは90%以上という卓越した分類精度を達成し、異なる疾患タイプに特異的なディスバイオーシスの特徴を正確に同定することを可能にした(図4C)。これらの洞察を活用することで、このモデルは個別化された疾患治療計画の正確な策定を支援し、よりテーラーメイドで効果的な治療介入に向けて大きく前進する。
移植されたドナー細菌に対するレシピエントのFMT反応の予測
高度な可変スクリーニングアルゴリズムにより、専門家は患者の回復に不可欠な有益な細菌群を見分けることができる。この基盤の上に、どの細菌がレシピエントの体内で効果的にコロニー形成を確立できるかを特定することが極めて重要な問題である。このコロニー形成は、ドナーとレシピエント双方の年齢、性別、腸内微生物の構成、FMT実施計画の詳細、移植のタイミングなど、多くの要因に左右される[39,42,48]。
これらの重要な要素を活用することで、ランダムフォレスト [48] やLASSO回帰アルゴリズム [25] などの機械学習技術は、レシピエントの腸内におけるドナーの微生物のコロニー形成状態をより正確に予測する方法を提供する。その中でもランダムフォレストアルゴリズムは、クロスコホート研究において卓越した頑健性を示し、近年傑出した選択肢として浮上している[39,48]。
ドナー細菌のコロニー形成事象の予測は、通常、二段階のプロセスを経て展開される。まず、レシピエントの腸内環境をコロニー形成する能力を有する細菌コホートを同定する。その後、これらのコロニー形成細菌の存在量を予測する。注目すべきは、この手順の軌跡の中で、ドナーとレシピエントの微生物叢から引き出される入力データは、相対的な存在量の指標に頼るのではなく、定量的な形をとることが理想的である。この試みにおける一般的な戦略は、定量的指標として菌株の存在量または配列の深さを用いることである[39,48]。
ここで我々は、移植された微生物叢に対するレシピエントの反応を頑健に反映する、FMTdbデータベース内の58の明確な特徴を同定した。我々は、5つの一般的な機械学習アルゴリズムを採用することにより、患者の治療反応を確実に予測することができ、94%という素晴らしい平均受信者動作特性(ROC)曲線下面積を達成した(図4D)。FMTdbを通じてアクセス可能なこれらのデータと特性は、世界中のFMTアプリケーションの有効性を強化する上で極めて重要な役割を果たす態勢が整っている。
レシピエントの常在菌はドナーの移植菌と拮抗する
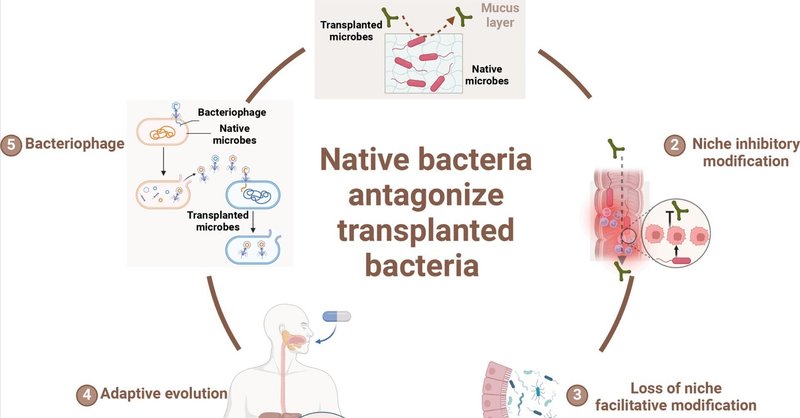
腸内細菌叢は、他者と共有される唯一の「臓器」である。臓器移植と同様、拒絶反応の克服はFMTの臨床実施における基本的な課題である[50,51]。生態学的研究から得られた証拠は、生態学的群集の初期形成や回復は、種が到着する順序に依存することを示している [52] 。早く到着した種は、資源や環境条件を変化させることによって、後から到着した種に影響を与えることがあり、この影響はしばしば否定的で、後から到着した種の成長を阻害する[53]。腸内環境では、細菌株相互作用の36%にアメンザリズム、32%に競合、26%に搾取が関与している。このことは、FMT治療中にかなりのレベルのコロニー形成拮抗作用があることを示唆している[25]。近々発表予定の論文では、異なるコホートにわたって発表された30件のFMT臨床研究を分析し、その結果、ドナー株とのコロニー形成率は一貫して50%を下回っていることが明らかになった。このことは、おそらくレシピエントの腸内環境における細菌相互作用の複雑な動態に影響されていると思われるが、FMT中に微生物生着を成功させることの難しさを強調している(図5)。
図5
ダウンロード 高解像度画像のダウンロード(464KB)
ダウンロード フルサイズ画像のダウンロード
図5. FMT中にレシピエントの腸内細菌叢と腸内微小環境がドナー移植菌のコロニー形成に抵抗するメカニズム
常在腸内細菌は宿主の腸管ニッチを占有し、ドナー移植菌のコロニー形成を妨げることができる。この顕著な例が新生児微生物叢の形成であり、自然分娩で生まれた乳児は分娩中にバクテロイデス種に曝露され、バクテロイデス優位の微生物叢となる。逆に、帝王切開で生まれた乳児は、最初にファーミキューテス属にコロニー形成される可能性が高く、生後6~18ヵ月以内にバクテロイデス属にコロニー形成されるのは困難である。ニッチの先取りは主に、既存の細菌と移植された細菌との間の栄養的・空間的競合によって決定される [52] 。FMTに先立ち、レシピエントの常在細菌はすでに生態学的ニッチにおいて優位性を確立しており、特に粘液層の結合部位を占め、炭素源としてムチンを利用するムチンに富む細菌が優位性を確立している [56]。この結果、移植された細菌はコロニー形成に苦戦し、利用可能な炭素源を十分に利用できず、コロニー形成の拮抗を引き起こす。抗生物質はこの状況をかなり緩和することができるが、治療中に赤痢菌のような好粘液性耐性菌の増殖を不注意に促進する可能性がある [57] 。これにより、これらの耐性菌がより多くの生態学的ニッチを獲得し、ドナーから移植された細菌のコロニー形成における拮抗関係を悪化させる可能性がある [58] 。
ニッチ先取りメカニズムに加えて、宿主の常在細菌は腸内微小環境を改変することにより、ドナー移植菌のコロニー形成を阻害することができる。このメカニズムはニッチ阻害性修飾として知られている [52]。炭素源の競合を伴うニッチ先取りとは異なり、ニッチ抑制的修飾は、特に宿主の免疫反応による腸内微小環境の変化に依存している。例えば、短鎖脂肪酸を産生する細菌は、腸管上皮細胞を刺激して抗菌ペプチドを放出させ、移植された細菌のコロニー形成拮抗につながる [52]。さらに、常在細菌は細菌間相互作用を通じて移植細菌のコロニー形成を直接阻害することができる。例えば、ラクトバチルス株はエンテロコッカス・フェカリスのコロニー形成を阻害するためにバクテリオシンを産生することができ、一方、フェカリス菌はラクトバチルス株のコロニー形成を選択的に阻害するためにエンテロトキシンを分泌することができる [59] 。
特定の菌株による最初のコロニー形成は、移植された菌株のコロニー形成が成功しやすいように環境を変化させる。この現象はニッチ促進的修飾と呼ばれる。このコロニー形成促進効果は、腸内細菌叢の健全なバランスを維持する上で、特に短鎖脂肪酸を産生する微生物の間で広く見られる。酪酸産生菌の多くは、酪酸をデノボで合成することができない[60]。バクテロイデーテス属、ビフィドバクテリウム属、アッケマンシア属などの基礎細菌に依存して酢酸を生成する。その後、酪酸産生菌が酢酸を利用して酪酸を合成する。しかし、罹患状態ではこの協力関係が崩れ、レシピエントの腸内でコロニー形成を支える本来の細菌が大幅に減少する。その結果、ドナーから移植された細菌のコロニー形成効果は著しく弱まる。このことは、ドナーの同属の特定の菌株が「all or nothing」型のコロニー形成を示すという観察からも明らかである[39]。
患者の腸内微小環境の疾患特性もまた、移植された健康な微生物叢に環境選択圧を与え、ドナーの移植微生物叢の適応進化をもたらす。この適応進化はファーミキューテス属で頻繁に起こり、ファーミキューテス属と宿主の高度に特殊化した共代謝行動や、代謝調節遺伝子の活発な発現に現れている。しかし、この適応進化は胞子形成活性を犠牲にしており、その結果、ファーミキューテス属のコロニー形成能力は必然的に弱くなる[8,48,61,62]。
腸内ファージもまた、ドナーから移植された細菌のコロニー形成拮抗に大きく寄与している。その顕著な例がE. faecalis V583で観察され、他のE. faecalis株に感染して死滅させることができるファージを含んでいることから[63]、ドナー微生物叢のコロニー形成拮抗につながる。さらに、レシピエントの腸内に存在する温帯性ファージは、溶菌サイクルに入ることでドナー移植菌に感染し、移植微生物叢の崩壊をさらに助長する可能性がある[52]。腸内細菌叢の動態にファージが関与することで、FMTの結果はさらに複雑なものとなり、腸内環境における細菌とウイルスとの相互作用を包括的に理解する必要性が強調される。
上述のコロニー形成拮抗メカニズムを考慮すると、レシピエントの移植前管理を強化することが望ましい。これには、ドナー株のコロニー形成に必要な生態学的ニッチを修復するためのスキームを最適化することが含まれ、これには栄養補助や在来菌の家畜化技術が関与する。さらに、抗生物質、ファージ療法、菌株間相互作用の操作など、標的を絞った介入技術を採用して、在来菌の量を減らすこともできる。具体的には、これらの介入によって戦略的に在来菌の存在量を減少させることが、ドナー菌のコロニー形成効率を向上させる有効なアプローチとなる。これらの対策を実施することで、ドナー微生物叢のコロニー形成効率が向上し、最終的には様々な疾患におけるFMTの奏効率の改善につながると期待される。
機会と課題
腸内細菌叢は、他者と共有できる唯一の「臓器」である。マイクロバイオームの理論と技術の絶え間ない進歩に伴い、FMTは、以前は難治性であった疾患でさえも、腸および腸外疾患の治療において有効性を増してきている。このような前向きな進歩にもかかわらず、未解決の問題も残っており、継続的な探求と注意が必要である。
FMT製品の改良
現在のFMTの主な方法は、凍結乾燥したドナー菌粉末やドナー菌分散液である。しかし、FMT患者では嘔吐などの有害事象が報告されており、製品改良における効果的な脱臭・脱色工程の必要性が浮き彫りになっている。さらに、これらの既存のFMT製品は、その大きさや糞便微生物叢の活性に影響を与える可能性から、乳幼児への適用には限界がある。これらの課題に対処するため、サイズが小さく、FMT製品の活性を損なわない新しいFMT製品を開発する必要がある。この点では、3Dプリンティング技術が実現可能な解決策であると思われる。3Dプリンティング技術は、より小さく、より制御されたFMT製剤の開発を可能にし、有害事象を低減し、特に小児症例におけるFMTの適用性を高める可能性がある。さらに、複合細菌または胞子成分の組み込みは、価値ある改良点であることが確認されている。この改良は、FMT適用の精度と制御性を根本的に改善する可能性があり、微生物叢移植の文脈において、より的を絞った効率的な介入を提供する。
FMTによる個別化精密治療
炎症性・非炎症性の腸管・腸管外疾患の治療におけるFMTの有効性は、著しい不均一性を示す。このことは、様々な病理学的・疾患的特徴と関連した規則的なディスバイオシスの特徴を示唆している。より高分解能の分析手法と定量的検出技術を活用することで、これらの特徴的な機能の同定に貢献することができる。この基礎の上に、微生物生態ネットワーク内のドナー菌のコロニー形成プログラムを研究することが極めて重要になる。微生物群集内の複雑な相互作用と動態を理解することで、個別化されたFMT治療計画を開発することができる。この個別化アプローチは、個々の患者に関連する特異的なディスバイオシスパターンと、その患者固有の疾患特性を考慮し、より的を絞った効果的な治療介入を目指すものである。
FMTコロニー形成拮抗メカニズムの高解像度解明
実際、FMTの効率は、常在菌、移植菌、腸内微小環境間の相互作用に影響される。菌株レベルでの相互作用は研究によって明らかにされているが、FMTのコロニー形成拮抗のメカニズムを掘り下げるには、遺伝子やタンパク質のレベルに深く焦点を当てる必要がある。高深度の第3世代シーケンシングと第2世代シーケンシング技術を組み合わせることで、包括的な遺伝子およびアイソザイム情報を提供することができる。この高度なシーケンス技術により、微生物群集内の遺伝子およびタンパク質レベルの相互作用をより詳細に理解することができる。このような洞察は、コロニー形成の拮抗に関与する特定の遺伝子やタンパク質を特定する上で極めて重要である。作用している分子メカニズムをより深く理解することで、より正確な方法で細菌集団を標的にし、改変することが可能になる。これは、遺伝子やタンパク質レベルの知見に基づく標的介入によってコロニー形成拮抗作用を緩和することで、FMTの効率を向上させる可能性を秘めている。
食事補助戦略によるFMT反応の向上
臨床実践の結果から、FMT治療に対する反応を高めるためには栄養補助療法が重要であることが示唆される。IBDに対するFMT治療を例にとると、目標とする経腸栄養剤の50%に耐えられない患者は、FMT後8週間以内に最大75%の再発率を示すが、腸管機能が正常な患者の再発率はわずか5.6%と著しく低い [10] 。食事管理は、レシピエントの腸内に移植された健康な微生物叢にとって好ましい生態学的ニッチを作り出し、それによって微生物叢固有の抗炎症作用を増強するために不可欠である [64] 。このアプローチは、FMT治療に対する全体的な反応を改善することが広く実証されている[64,65]。FMT中の食事管理では、主にグルテン穀物、乳製品、赤肉、精製糖などの炎症性食品を避ける[[64]、[65]、[66]、[67]]。腸管機能が正常な条件下では、アリール炭化水素受容体(AhR)リガンドを豊富に含む新鮮な果物や野菜を適切に摂取することが有益であると考えられている [64] 。
プレバイオティクスは、FMT治療に対する反応を高めるためのもう一つの重要な手段である。FMTカプセル移植を受ける患者には、健康な微生物叢のコロニー形成を助けるためにペクチンが推奨されている [16]。ペクチンは、腸内微生物によって十分に利用される食物繊維であり、腸内の「微生物叢食物連鎖」にとって実質的な炭素源となる [60] 。その結果、移植菌に対するレシピエントの常在菌のコロニー形成拮抗作用を緩和し、ドナー菌の良好なコロニー形成を促進することができる。FMTの専門家のコンセンサスによって提唱された併用薬の基準に基づくと、ペクチンと併用したFMT療法は、特に便秘、IBD、重度の下痢、栄養不良などの症状に対して、FMT療法単独と比較して高い治療効果を示す[16]。さらに、FMT治療中にペクチンを補充することで、腸内の酪酸レベルが上昇し、腫瘍免疫療法の効果が高まる可能性がある [68]。
人工細菌とファージの応用
移植細菌のコロニー形成拮抗は、現在のFMT治療分野における最大の問題の一つである。この問題に対する実現可能な解決策は、レシピエントの糞便微生物叢を分離、培養し、遺伝子改変することである。分離された微生物はレシピエントに由来するため、この人工細菌はコロニー形成拮抗の問題に直面することはほとんどなく、腸内微小環境を正確に修復する「トロイの木馬」の役割を果たし、それによってドナー細菌によるコロニー形成生態学的ニッチをより多く提供することができる。同様に、ファージ療法もレシピエントの常在細菌を標的とし、FMT前にドナー菌のコロニー形成を阻害する因子を特異的に除去することで、最終的にレシピエントの腸内におけるドナー菌の健康な微生物のコロニー形成を改善する。
無菌動物モデルを用いた疾患治療におけるFMTの因果関係の確認
疾患治療におけるFMTの因果関係を効果的に検証する上で、無菌動物システムの確立が重要であることが証明されている。2006年にジェフリー・ゴードン(Jeffrey Gordon)が、無菌マウスモデルを用いたFMT実験を通じて、微生物叢と肥満との因果関係を確立した画期的な研究以来[69]、無菌動物システムは、腸内菌株の機能を解明するための重要なツールへと発展してきた[70]。時を経て、こうした動物システムはマウスから線虫、ミバエ、ハチ、ゼブラフィッシュ、ラット、そして様々なブタ種へと拡大し、その規模と多様性は飛躍的に増大した [71]。これらの無菌動物システムを通じて、うつ病 [72]、ASD [21]、筋萎縮性側索硬化症 [73]、特に腫瘍 [74]、[75]、[76] などの病態における特定の菌株や常在菌の治療効果や薬剤感作効果が、革新的な研究によって検証されている。無菌動物を用いたイメージング技術、標識技術、ゲノム定量法の統合は、正確なFMT介入プログラムやFMT関連製剤の開発に不可欠なツールとなるだろう。
利益相反宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係はないことを宣言する。
著者貢献
X.W.、H.T.、H.Q.が発案した。H.T.、L.L.、Q.C.は臨床データを提供した。C.W.とD.B.はバイオインフォマティクスのモデル結果を提供した。L.L.はFMTdbデータベースを構築した。X.W.、Z.F.、H.T.が原稿を執筆した。N.L.はFMT臨床応用に関する内容の校正を担当した。X.W.、Q.C.、H.Q.は共同で本プロジェクトを監修した。著者全員がこの最終版を読み、掲載のための査読を行った。著者全員が最終原稿を読み、承認した。
利益宣言
☐ √ 著者らは、本論文で報告された研究に影響を及ぼすと思われる競合的な金銭的利益や個人的関係がないことを宣言する。
謝辞
本研究は、中国国家自然科学基金(81972221、81730102、82300753)、中国博士研究員科学基金(2022M722412)、上海市最優先プロジェクト(076478684Q/2023-00154)、張江市主要プロジェクト(ZJ2022-ZD-005)、上海科学技術委員会臨床研究計画(SHDC2020CR4026、SHDC2020CR1030B、SHDC2022CRS041)の支援を受けた; 上海市科学技術委員会計画(YDZX20213100003690)、上海市衛生委員会計画(19YF1431000およびZHYY-ZXYJHZX-202105)、安徽省重点研究開発計画(202304295107020025)、同済大学第十人民医院臨床研究計画(2021SYPDRC045)。本原稿の文法表現の修正にはGrammarlyソフトウェアを使用した。
参考文献
[1]
Y. Wang, Y. Huang, R.C. Chase, T. Li, D. Ramai, S. Li, et al.
消化器疾患の世界的負担: 世界疾病負担調査の系統的分析、1990年から2019年まで
Gastroenterology, 165 (2023), p. 773
83.e15
PDFを見る記事を見るCrossRefGoogle Scholar
[2]
H. ティエン、S. チャン、H. チン、N. リー、Q. チェン
中国における消化器疾患に対する糞便微生物叢移植の長期安全性
Lancet Gastroenterol Hepatol, 7 (2022), 702-703頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[3]
Y. 王、S. 張、T.J. ボロディ、F. 張
便微生物移植百科事典:85疾患の治療における有効性のレビュー
Chin Med J, 135 (2022), pp.
CrossRefView in ScopusGoogle Scholar
[4]
Y. ファン、O. ペダーセン
ヒトの代謝の健康と疾患における腸内細菌叢
Nat Rev Microbiol, 19 (2021), pp.
CrossRefScopusで表示Google Scholar
[5]
J. ストリップリング、M. ロドリゲス
ヒト疾患における糞便微生物叢移植の送達と治療的使用における現在のエビデンス-クロストリジウム・ディフィシル病とその後
Am J Med Sci, 356 (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[6]
S.V.リンチ、E.G.フィミスター、O.ペダーセン
健康と疾患におけるヒト腸内マイクロバイオーム
N Engl J Med, 375 (2016), pp.2369-2379
スコープで見るGoogle Scholar
[7]
Y.T.リー、H.F.カイ、Z.H.ワン、J.シュー、J.Y.ファン
メタ解析による系統的レビュー:クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植の長期成績
Aliment Pharmacol Ther, 43 (2016), 445-457頁
CrossRefView in ScopusGoogle Scholar
[8]
H. Tian, J. Cui, C. Ye, J. Zhao, B. Yang, Y. Xu, et al.
クロストリジウム・ディフィシル(Clostridium difficile)感染症再発患者において、ファーミキューテス属の酪酸産生微生物の枯渇はFMT療法の不応答を予測する。
Gut Microbes, 15 (2023), Article 2236362
スコープで見るGoogle Scholar
[9]
C. Haifer, S. Paramsothy, N.O. Kaakoush, A. Saikal, S. Ghaly, T. Yang, et al.
潰瘍性大腸炎に対する凍結乾燥経口糞便微生物叢移植(LOTUS):無作為化二重盲検プラセボ対照試験
Lancet Gastroenterol Hepatol, 7 (2022), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[10]
D. Zhao、C. Ye、S. Zhang、X. Lv、B. Yang
糞便微生物叢移植後の炎症性腸疾患の早期臨床的再発の危険因子の分析
Am J Transl Res, 13 (2021), pp.12875-12886
スコープで見るGoogle Scholar
[11]
G. Cammarota, G. Ianiro, H. Tilg, M. Rajilić-Stojanović, P. Kump, R. Satokari, et al.
臨床における糞便微生物叢移植に関する欧州コンセンサス会議
Gut, 66 (2017), 569-580頁
CrossRefView in ScopusGoogle Scholar
[12]
G. Cammarota, G. Ianiro, C.R. Kelly, B.H. Mullish, J.R. Allegretti, Z. Kassam, et al.
臨床における糞便微生物叢移植のための便バンクに関する国際コンセンサス会議
Gut, 68 (2019), 2111-2121頁
CrossRefView in ScopusGoogle Scholar
[13]
C. Haifer, C.R. Kelly, S. Paramsothy, D. Andresen, L.E. Papanicolas, G.L. McKew, et al.
臨床診療における糞便微生物叢移植の規制、生産、使用に関するオーストラリアのコンセンサス・ステートメント
Gut, 69 (2020), pp.
CrossRefView in ScopusGoogle Scholar
[14]
L.R. Lopetuso, S. Deleu, L. Godny, V. Petito, P. Puca, F. Facciotti, et al.
炎症性腸疾患における腸内細菌叢と糞便微生物移植に関する第1回ローマ国際コンセンサス会議
Gut, 72 (2023), 1642-1650頁
CrossRefView in ScopusGoogle Scholar
[15]
S. Zhang, Q. Chen, C.R. Kelly, Z. Kassam, H. Qin, N. Li, et al.
中国における糞便微生物叢移植のためのドナーのスクリーニング: 8483人の候補者の評価
Gastroenterology, 162 (2022), p. 966
8.e3
PDFで記事を見るScopusで記事を見るGoogle Scholar
[16]
便微生物移植の臨床応用管理に関する専門家のコンセンサス(2022年版)
Chin J Gastrointest Surg, 25 (2022), p. 747-756
Google Scholar
[17]
L.-P. Wang, S.-X. Zhou, X. Wang, Q.-B. Lu, L.-S. Shi、X. Ren、他。
中国における急性下痢の病因、疫学、臨床的特徴
Nat Commun, 12 (2021), p. 2464
スコープで見るGoogle Scholar
[18]
Q. 林(リン)、李(リー)、陸(ルー)、徐(シュー)、楼(ルー)、陳(チェン)、他。
ブデソニド(抗炎症薬)はクロストリジオイデスディフィシル大腸炎を増悪させる。
Biomed Pharmacother, 167 (2023), Article 115489
PDFで記事を見るScopusで記事を見るGoogle Scholar
[19]
C.X. Yap, A.K. Henders, G.A. Alvares, D.L.A. Wood, L. Krause, G.W. Tyson, et al.
自閉症に関連した食事の嗜好が自閉症と腸内細菌叢の関連を媒介する
Cell, 184 (2021), p. 5916
31.e17
PDFを見る記事を見るScopusで見るGoogle Scholar
[20]
E. コツィリティ
腸内マイクロバイオームと自閉症スペクトラム障害
Nat Rev Gastroenterol Hepatol, 19 (2022), p. 6
CrossRefScopusで表示Google Scholar
[21]
G.シャロン、N.J.クルーズ、D.-W. Kang、M.J. Gandal、B. Wang、Y.-M. Kim, et al.
自閉症スペクトラム障害のヒト腸内細菌叢はマウスの行動症状を促進する
Cell, 177 (2019), p. 1600
18.e17
PDFで記事を見るScopusで記事を見るGoogle Scholar
[22]
S.A. Buffington, S.W. Dooling, M. Sgritta, C. Noecker, O.D. Murillo, D.F. Felice, et al.
複雑な行動における宿主遺伝学とマイクロバイオームの寄与の解明
Cell, 184 (2021), p. 1740
56.e16
PDFで記事を見るScopusで記事を見るGoogle Scholar
[23]
Y. Y. Chen, Z. Xueying, C. Jiaqu, C. Qiyi, Q. Huanlong, L. Ning, et al.
FTACMT試験プロトコール:自閉症スペクトラム障害に対する糞便微生物叢移植の多施設、二重盲検、無作為化、プラセボ対照試験
BMJ Open, 12 (2022), Article e051613
CrossRefView in ScopusGoogle Scholar
[24]
S. Porcari, N. Benech, M. Valles-Colomer, N. Segata, A. Gasbarrini, G. Cammarota, et al.
糞便微生物叢移植の成功の主な決定要因: マイクロバイオームから臨床へ
細胞宿主微生物, 31 (2023), pp.712-733
PDFで記事を見るScopusで記事を見るGoogle Scholar
[25]
T.S.B. Schmidt, S.S. Li, O.M. Maistrenko, W. Akanni, L.P. Coelho, S. Dolai, et al.
糞便微生物叢移植後の菌株動態の推進要因と決定要因
Nat Med, 28 (2022), 1902-1912頁
CrossRefView in ScopusGoogle Scholar
[26]
C. デュヴァレ、S.M.ギボンズ、T.ガリー、R.A.イリザリー、E.J.アルム
腸内マイクロバイオーム研究のメタアナリシスにより、疾患特異的反応と共有反応が特定される
Nat Commun, 8 (2017), p. 1784
ScopusGoogle Scholarで見る
[27]
B.C.ウィルソン、T.ヴァタネン、W.S.カットフィールド、J.M.オサリバン
糞便微生物叢移植におけるスーパードナー現象
Front Cell Infect Microbiol, 9 (2019), p. 2
グーグル・スカラー
[28]
S. Paramsothy, M.A. Kamm, N.O. Kaakoush, A.J. Walsh, J. van den Bogaerde, D. Samuel, et al.
活動性潰瘍性大腸炎に対するマルチドナー集中糞便微生物叢移植:無作為化プラセボ対照試験
Lancet, 389 (2017), 1218-1228頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[29]
C. ハイファー、L.D.W.ルウ、S.パラムソティ、T.J.ボロディ、R.W.レオン、N.O.カークーシュ
UCに対する糞便微生物叢移植における有効なドナーの微生物学的決定因子
Gut, 72 (2023), 90-100頁
CrossRefView in ScopusGoogle Scholar
[30]
S. Paramsothy, S. Nielsen, M.A. Kamm, N.P. Deshpande, J.J. Faith, J.C. Clemente, et al.
潰瘍性大腸炎患者における糞便微生物叢移植の反応に関連する特定の細菌および代謝産物
Gastroenterology, 156 (2019), p. 1440
54.e2
PDFで記事を見るScopusで記事を見るGoogle Scholar
[31]
B.C. Wilson, T. Vatanen, T.N. Jayasinghe, K.S.W. Leong, J.G.B. Derraik, B.B. Albert, et al.
肥満に対するマルチドナー糞便微生物叢移植試験における菌株生着競争と機能増強
Microbiome, 9 (2021), p. 107
スコープで見るGoogle Scholar
[32]
B. Levast、M. Fontaine、S. Nancey、P. Dechelotte、J. Doré、P. Lehert
潰瘍性大腸炎における糞便微生物叢移植産物調製のための単一ドナーとプール戦略: 系統的レビューとメタアナリシス
Clin Transl Gastroenterol, 14 (2023), Article e00568
CrossRefGoogle Scholar
[33]
J.フー、D.R.アモール、M.バルビエ、G.ブニン、J.ゴア
生態系の多様性とダイナミクスの創発段階をマイクロコズムでマッピング
サイエンス, 378 (2022), pp.
スコープで見るGoogle Scholar
[34]
A.G. チェン、P.-Y. Ho, A. Aranda-Díaz, S. Jain, F.B. Yu, X. Meng, et al.
複雑な腸内細菌叢の設計、構築、およびin vivoでの増強
Cell, 185 (2022), p. 3617
36.e19
PDFで記事を見るScopusで記事を見るGoogle Scholar
[35]
D. Kao, K. Wong, R. Franz, K. Cochrane, K. Sherriff, L. Chui, et al.
再発性Clostridioides difficile感染に対する微生物生態系治療薬(MET-2)の効果:第1相非盲検単群試験
Lancet Gastroenterol Hepatol, 6 (2021), pp.282-291
PDFで記事を見るScopusで記事を見るGoogle Scholar
[36]
M.D. Sims, S. Khanna, P. Feuerstadt, T.J. Louie, C.R. Kelly, E.S. Huang, et al.
再発性Clostridioides difficile感染を有する成人におけるマイクロバイオーム治療薬としてのSER-109の安全性と忍容性: 第3相非盲検単群試験
JAMA Network Open, 6 (2023), Article e2255758
Scopusで見るGoogle Scholarで見る
[37]
J.T.モートン、D.-M. Jin、R.H. Mills、Y. Shao、G. Rahman、D. McDonald、他。
腸-脳軸のマルチレベル解析により、自閉症スペクトラム障害に関連する分子および微生物プロファイルが示された。
Nat Neurosci, 26 (2023), pp.1208-1217
CrossRefView in ScopusGoogle Scholar
[38]
W.-L.サン、S.ホア、X.-Y. Li、L. Shen、H. Wu、H.-F. Ji
微生物産生ビタミンB12はシリマリンの脂質低下作用に寄与する
Nat Commun, 14 (2023), p. 477
スコープで見るGoogle Scholar
[39]
C.S. Smillie, J. Sauk, D. Gevers, J. Friedman, J. Sung, I. Youngster, et al.
ストレイントラッキングにより、糞便微生物叢移植後のヒト腸における細菌移植の決定因子が明らかになる
細胞宿主微生物、23(2018)、229頁
40.e5
PDFで記事を見るScopusで記事を見るGoogle Scholar
[40]
V.K. Gupta, M. Kim, U. Bakshi, K.Y. Cunningham, J.M. Davis, K.N. Lazaridis, et al.
種レベルの腸内細菌叢プロファイリングを用いた健康状態の予測指標
Nat Commun, 11 (2020), p. 4635
スコープで見るGoogle Scholar
[41]
B. 張、楊、寧、曹、陳、Q. Chen、他。
A Matching Strategy To Guide Donor Selection for Ulcerative Colitis in Fecal Microbiota Transplantation: メタ分析と分析階層過程
Microbiol Spectr, 11 (2023), Article e0215921
スコープで見るGoogle Scholar
[42]
R. He, P. Li, J. Wang, B. Cui, F. Zhang, F. Zhao
ドナーとレシピエント間の腸内細菌叢の相互作用が糞便微生物叢移植の有効性を決定する
腸内細菌, 14 (2022), Article 2100197
スコープで見るGoogle Scholar
[43]
E. Bolyen, J.R. Rideout, M.R. Dillon, N.A. Bokulich, C.C. Abnet, G.A. Al-Ghalith, et al.
QIIME 2を用いた再現性、対話性、拡張性のあるマイクロバイオームデータサイエンス
Nat Biotechnol, 37 (2019), pp.852-857
CrossRefView in ScopusGoogle Scholar
[44]
P.D. Schloss, S.L. Westcott, T. Ryabin, J.R. Hall, M. Hartmann, E.B. Hollister, et al.
微生物群集の記述と比較のための、オープンソース、プラットフォーム非依存、コミュニティ支援型ソフトウェア。
Appl Environ Microbiol, 75 (2009), pp.
ScopusGoogle Scholarで見る
[45]
M. ワトソン、P.J.マクマーディ、S.ホームズ
Phyloseq:マイクロバイオームセンサスデータの再現性のあるインタラクティブな解析とグラフィックスのためのRパッケージ
PLoS One, 8 (2013), Article e61217
Google Scholar
[46]
A. Blanco-Míguez、F. Beghini、F. Cumbo、L.J. McIver、K.N. Thompson、M. Zolfo、他。
MetaPhlAn 4を用いたメタゲノム分類学的プロファイリングの拡張と未同定種の改良
Nat Biotechnol, 41 (2023), 1633-1644ページ
CrossRefView in ScopusGoogle Scholar
[47]
E. Pasolli, F. Asnicar, S. Manara, M. Zolfo, N. Karcher, F. Armanini, et al.
年齢、地理、生活習慣にまたがるメタゲノムから得られた15万以上のゲノムによって明らかになった、広範な未解明のヒトマイクロバイオームの多様性
Cell, 176 (2019), p. 649
62.e20
PDFで記事を見るScopusで記事を見るGoogle Scholar
[48]
G. Ianiro, M. Punčochář, N. Karcher, S. Porcari, F. Armanini, F. Asnicar, et al.
異なる疾患における糞便微生物叢移植後の菌株生着のばらつきとマイクロバイオーム組成の予測可能性
Nat Med, 28 (2022), pp.1913-1923
CrossRefView in ScopusGoogle Scholar
[49]
M. Valles-Colomer, A. Blanco-Míguez, P. Manghi, F. Asnicar, L. Dubois, D. Golzato, et al.
腸内細菌叢と口腔内細菌叢の個人間伝播ランドスケープ
ネイチャー, 614 (2023), 125-135頁
CrossRefView in ScopusGoogle Scholar
[50]
V. Aggarwala、I. Mogno、Z. Li、C. Yang、G.J. Britton、A. Chen-Liaw、他。
糞便微生物叢移植後の細菌株の正確な定量化により、長期の生着が明らかになり、転帰が説明できる。
Nat Microbiol, 6 (2021), 1309-1318頁
CrossRefView in ScopusGoogle Scholar
[51]
D. Podlesny、C. Arze、E. Dörner、S. Verma、S. Dutta、J. Walter、W.F. Fricke
SameStrを用いたメタゲノム菌株検出:糞便移植により移植可能な持続性コア腸内細菌叢の同定
Microbiome, 10 (2022), p. 53
スコープで見るGoogle Scholar
[52]
R. デブレイ、R.A.ハーバート、A.L.ジャッフェ、A.クリッツ-クリストフ、M.E.パワー、B.コスケラ
マイクロバイオーム構築における優先効果
Nat Rev Microbiol, 20 (2022), 109-121ページ
CrossRefScopusで見るGoogle Scholarで見る
[53]
J.D.パーマー、K.R.フォスター
細菌種が一緒に働くことは稀である
サイエンス, 376 (2022), 581-582頁
CrossRefView in ScopusGoogle Scholar
[54]
O.S. Venturelli, A.V. Carr, G. Fisher, R.H. Hsu, R. Lau, B.P. Bowen, et al.
合成ヒト腸内マイクロバイオームコミュニティにおける微生物間相互作用の解読
Mol Syst Biol, 14 (2018), p. e8157
スコープで見るGoogle Scholar
[55]
M. ヤスール、T. ヴァタネン、H. シルヤンデル、A.-M. Hämäläinen, T. Härkönen, S.J. Ryhänen, et al.
乳児腸内細菌叢の自然史と抗生物質投与が細菌株の多様性と安定性に及ぼす影響
Sci Transl Med, 8 (2016), p. 343ra81
スコープで見るGoogle Scholar
[56]
P. パオーネ、P.D.カニ
粘液バリア、ムチン、腸内細菌叢:期待されるぬるぬるパートナー?
Gut, 69 (2020), pp.
CrossRefView in ScopusGoogle Scholar
[57]
S. Isaac, J.U. Scher, A. Djukovic, N. Jiménez, D.R. Littman, S.B. Abramson, et al.
ヒト腸内細菌叢に対する経口バンコマイシンの短期および長期的影響
J Antimicrob Chemother, 72 (2017), pp.128-136
CrossRefView in ScopusGoogle Scholar
[58]
T.-C.D. Shen, S.G. Daniel, S. Patel, E. Kaplan, L. Phung, K. Lemelle-Thomas, et al.
直腸粘膜付着微生物叢はアルコール関連肝硬変に特有の特徴を含む
腸内細菌, 13 (2021), 記事 1987781
スコープで見るGoogle Scholar
[59]
K.D.ゼイゼ、R.J.ウッズ、G.B.ハフナグル
消化管におけるカンジダ・アルビカンスと乳酸菌の相互作用:コロニー形成抵抗性、微生物保菌、日和見感染、および宿主免疫への影響
Clin Microbiol Rev, 34 (2021), Article e0032320
Google Scholar
[60]
A. コウ、F. デ・バダー、P. コヴァチェヴァ=ダッチャリー、F. ベッケド
食物繊維から宿主生理学へ: 主要な細菌代謝産物としての短鎖脂肪酸
Cell, 165 (2016), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[61]
H.P. Browne, A. Almeida, N. Kumar, K. Vervier, A.T. Adoum, E. Viciani, et al.
腸内細菌における宿主適応は、胞子形成の喪失と感染サイクルの変化に関連している。
ゲノム生物学, 22 (2021), p. 204
スコープで見るGoogle Scholar
[62]
J.K.ニコルソン、E.ホームズ、J.キンロス、R.バーセリン、G.ギブソン、W.ジャ、S.ペッターソン
宿主と腸内細菌叢の代謝的相互作用
サイエンス, 336 (2012), 1262-1267頁
CrossRefView in ScopusGoogle Scholar
[63]
Q.R. Ducarmon、R.D. Zwittink、B.V.H. Hornung、W. van Schaik、V.B. Young、E.J. Kuijper
腸内細菌叢と腸内細菌感染に対するコロニー形成抵抗性
Microbiol Mol Biol Rev, 83 (2019), p. e00007
19
グーグル スカラー
[64]
S. Kedia, S. Virmani, S. K Vuyyuru, P. Kumar, B. Kante, P. Sahu, et al.
抗炎症食を併用した糞便微生物叢移植(FMT-AID)と抗炎症食のみの併用は、軽度から中等度の潰瘍性大腸炎における1年間の寛解導入と維持に有効である:無作為化比較試験
Gut, 71 (2022), 2401-2413頁
CrossRefView in ScopusGoogle Scholar
[65]
C. Sarbagili Shabat, F. Scaldaferri, E. Zittan, A. Hirsch, M.C. Mentella, T. Musca, et al.
軽度から中等度の活動性潰瘍性大腸炎に対する新しい食事療法を併用した糞便移植の使用: CRAFT UCランダム化比較試験
J Crohns Colitis, 16 (2022), 369-378頁
CrossRefGoogle Scholar
[66]
H. ティルグ、A.R.モッシェン
食物、免疫、マイクロバイオーム
消化器病学、148(2015)、1107-1119頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[67]
S. Devkota、Y. Wang、M.W. Musch、V. Leone、H. Fehlner-Peach、A. Nadimpalli、他。
食餌性脂肪誘導性タウロコール酸は、Il10-/-マウスにおいて病原体の拡大と大腸炎を促進する。
ネイチャー, 487 (2012), 104-108頁
CrossRefGoogle Scholar
[68]
S.-L. Zhang, Y.-Q. Mao, Z.-Y. Zhang, Z.-M. Li, C.-Y. Kong, H.-L. Chen, et al.
ペクチンサプリメントは、大腸がん患者の腸内細菌叢でヒト化した担癌マウスにおいて、抗PD-1効果を有意に増強した。
Theranostics, 11 (2021), 4155-4170頁
CrossRefView in ScopusGoogle Scholar
[69]
R.E.レイ、P.J.ターンボー、S.クライン、J.I.ゴードン
微生物生態学:肥満と関連するヒト腸内微生物
ネイチャー, 444 (2006), pp.
CrossRefView in ScopusGoogle Scholar
[70]
J. Li, H. Wei
機能的マイクロバイオーム研究をサポートする効率的な無菌動物システムの確立
Sci China Life Sci, 62 (2019), pp.1400-1403
CrossRefScopusで見るGoogle Scholar
[71]
U. テイフン
腸内細菌叢研究における無菌動物実験
Curr Opin Pharmacol, 49 (2019), pp.
グーグル スカラー
[72]
J. Yang, Z. Zhang, Z. Xie, L. Bai, P. Xiong, F. Chen, et al.
メトホルミンは微生物叢由来のイノシンを調節し、メタンフェタミン誘発性不安およびうつ様離脱症状を改善する。
Biomed Pharmacother, 149 (2022), Article 112837
PDFで記事を見るScopusで記事を見るGoogle Scholar
[73]
E. Blacher, S. Bashiardes, H. Shapiro, D. Rothschild, U. Mor, M. Dori-Bachash, et al.
マウスのALS調節における腸内細菌叢と代謝産物の潜在的役割
Nature, 572 (2019), 474-480ページ
CrossRefView in ScopusGoogle Scholar
[74]
B. Routy, E. Le Chatelier, L. Derosa, C.P.M. Duong, M.T. Alou, R. Daillère, et al.
腸内細菌叢は上皮性腫瘍に対するPD-1に基づく免疫療法の有効性に影響を及ぼす
サイエンス, 359 (2018), 91-97頁
CrossRefView in ScopusGoogle Scholar
[75]
V. Gopalakrishnan, C.N. Spencer, L. Nezi, A. Reuben, M.C. Andrews, T.V. Karpinets, et al.
腸内細菌叢はメラノーマ患者における抗PD-1免疫療法に対する反応を調節する
サイエンス, 359 (2018), 97-103頁
CrossRefView in ScopusGoogle Scholar
[76]
H. 川鍋松田、武田和彦、中村雅人、牧野聡、柄崎俊彦、垣見和彦、他。
食事性乳酸菌由来エクソポリサッカライドは免疫チェックポイント阻害療法を増強する
Cancer Discov, 12 (2022), 1336-1355頁
CrossRefScopusで見るGoogle Scholarで見る
引用者: (0)
これらの著者は本研究に等しく貢献した。
中国科学院微生物学研究所に代わってエルゼビアB.V.が発行。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当サイトではクッキーを使用しています。クッキー設定
このサイトのすべてのコンテンツ: 著作権 © 2024 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
