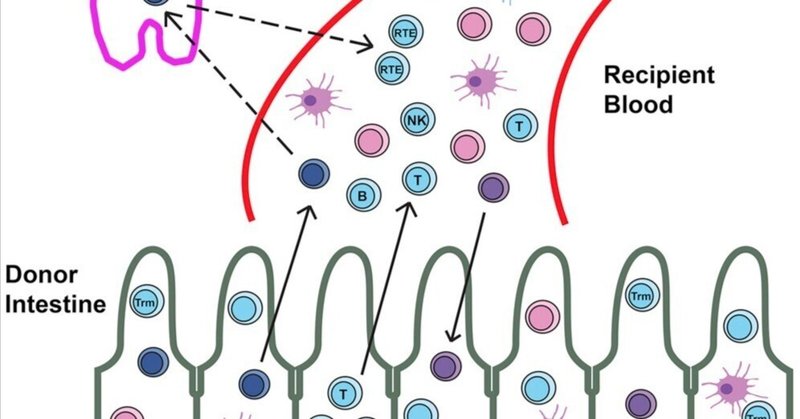
ヒト腸移植片は循環プールによって維持される機能的造血幹細胞および前駆細胞を含む
細胞幹細胞
第24巻 第2号 2019年2月7日 227-239.e8ページ
論文
ヒト腸移植片は循環プールによって維持される機能的造血幹細胞および前駆細胞を含む
https://www.sciencedirect.com/science/article/pii/S1934590918305435?pes=vor
著者リンクはオーバーレイパネルを開くJianing Fu 1, Julien Zuber 1, Mercedes Martinez 2, Brittany Shonts 1, Aleksandar Obradovic 1, Hui Wang 1, Sai-ping Lau 1, Amy Xia 1, Elizabeth E. Waffarn 1, Kristjana Frangaj 1, Thomas M. Sim. サベージ 1、マイケル・T・シンプソン 1、スシャオ・ヤン 1、グオ・シンジェン・V・グオ 3、ミシェル・ミロン 1 4、センダ・タカシ 1 5、コートニー・ロジャース 1、アディーブ・ラーマン 3、ホー・シウホン 1、シェン・ユーフェン 6...メーガン・サイクス 1 4 5 7
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.stem.2018.11.007
権利とコンテンツの取得
エルゼビア・ユーザーライセンスに基づく
オープンアーカイブ
参考文献
腸管移植後のヒト回腸生検から分離された上皮内T細胞および固有層T細胞のキメリズムと表現型解析
STARプロトコル、第4巻、第2号、2023年6月16日、102192ページ
キャサリン・D・ロング, Jianing Fu
PDFを見る
もっと寛容が必要だ 腸管移植由来のヒト幹細胞の役割
細胞幹細胞、第24巻、第2号、2019年2月7日、197-198ページ
ノーマ・スー・ケニオン
PDFを見る
ハイライト
ヒト腸管には造血幹細胞と複数のタイプの前駆細胞が存在する
ドナーの移植HSPCはレシピエントの多系統血液キメラに寄与する
長期間循環しているドナーのT細胞はレシピエントに対して寛容であるが、機能的である。
腸管HSPCsは循環プールからレシピエントによって置換される。
まとめ
ヒト腸管移植では、移植患者においてドナーとレシピエントの血液が長期にわたって混合キメラとなることが多い。われわれは、腸移植を受けた21人の患者のキメラ末梢血細胞の表現型を5年間にわたって追跡した。ドナーのリンパ球の表現型から、移植片からの造血幹細胞および前駆細胞(HSPC)の寄与が示唆された。意外なことに、腸粘膜、パイエル板、腸間膜リンパ節、肝臓でドナー由来のHSPCsが検出された。ヒト腸管HSPCsは表現型的に骨髄HSPCsに類似しており、in vitroおよびin vivoで多系統分化能を有する。移植後に循環するドナーT細胞の解析から、ドナーT細胞はレシピエントのリンパ系臓器で選択を受けて免疫寛容を獲得することが示唆される。腸移植片に含まれるヒトHSPCsの縦断的研究から、HSPCsのターンオーバー動態と、循環プールからドナー由来HSPCsに徐々に置き換わっていくことが示された。このように、われわれはヒト腸内に機能するHSPCsが存在することを証明し、移植レシピエントにおける寛容の促進に示唆を与えている。
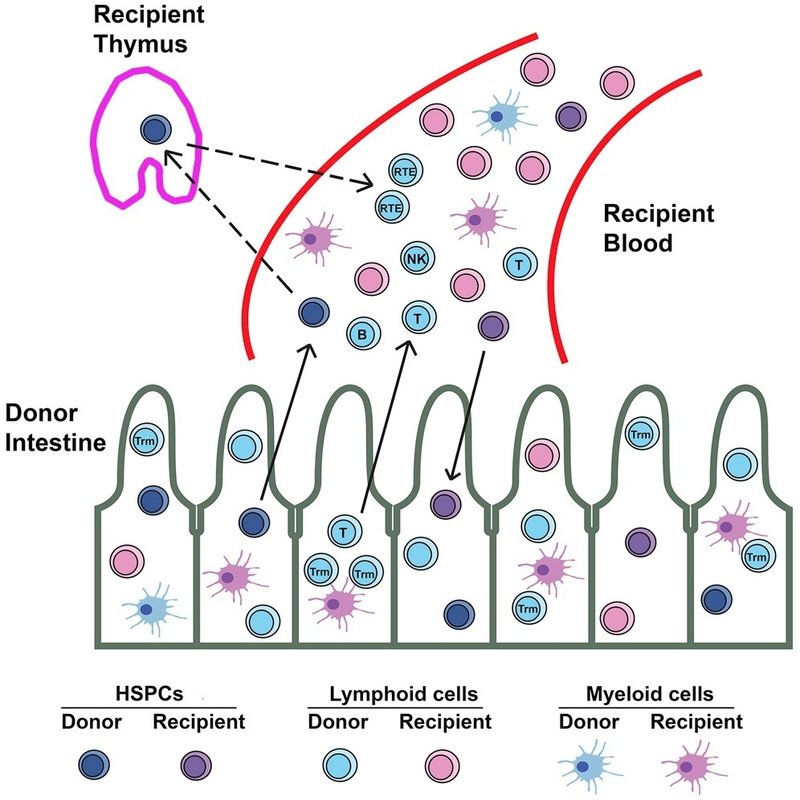
グラフィカルアブストラクト
ダウンロード 高解像度画像ダウンロード(242KB)
ダウンロード フルサイズ画像のダウンロード
前の記事次の記事
キーワード
腸移植腸移植造血幹細胞造血前駆細胞混合キメラ免疫寛容胸腺浸潤T細胞受容体レシピエント再増殖循環プール
はじめに
腸管移植(ITx)は末期腸管不全患者に対する唯一の長期的選択肢である(Kubal et al.) ITxは単独で行われることもあれば(iITx)、多臓器移植(MVTx)の一部として行われることもある(Kubal et al.) ITxは高い移植片不全率と関連しており、5年時点で約50%である(Smithら、2018年)が、iITxと比較してMVTxではこれらの率は低下する(Abu-Elmagdら、2012年、Katoら、2006年)。腸移植片ではリンパ球の負荷が大きいため、移植片対宿主病(GVHD)が患者の5%~9%にみられる(Bergerら、2012年)。このように、ITxでは、移植片の拒絶反応、GVHD、過剰な免疫抑制による日和見感染症の微妙なバランスが重要です。
血液キメラとは、移植後にドナーとレシピエントの両方の造血細胞が共存することを意味する。血液キメリズムは、持続的であれ一過性であれ、GVHDを伴わずに達成することができ、一過性であっても、動物やヒトにおいてドナー特異的寛容を促進することができる(Kawai et al.) 我々は最近、ITx後の血液中に、通常GVHDを伴わない高レベルのドナーT細胞マクロキメリズム(4%以上のドナーCD3+ T細胞を示す)がしばしば出現することを報告した(Fu et al. これはiITxレシピエントよりもMVTxレシピエントでより頻繁に起こる。マクロキメリズムは、移植片拒絶反応の少なさ(Zuberら、2015)および移植片内でのレシピエントによるT細胞置換の遅さと相関する(Zuberら、2016)。特にMVTx患者では、T細胞、B細胞、ナチュラルキラー(NK)細胞において、長期間持続するドナー血キメラが観察される。骨髄キメラはより一過性である(Zuberら、2015)。
CD45+CD34+細胞は、成人のヒト小腸(Lynchら、2006年)や肝臓(Golden-Mason and O'Farrelly、2002年、Wangら、2012年)において報告されているが、腸におけるそれらの詳細な解析は報告されていない。われわれは、移植片に常在する造血幹細胞および前駆細胞(HSPC)が、ヒトITx後の長期にわたる多系統血液キメラ形成に寄与していると仮定した。ヒトの造血に関する現在の分化スキーム(Görgens et al.、2013)を用いて、造血幹細胞と、多能性前駆細胞(MPP)、リンパ球刺激多能性前駆細胞(LMPP)、共通リンパ球前駆細胞(CLP)、骨髄系前駆細胞(MP)、およびCD56を共発現する未分類の前駆細胞(Golden-Mason and O'Farrelly、2002、Lynch et al、 2006)。ヒトの回腸粘膜、パイエル板(PP)、腸間膜リンパ節(MLN)、肝臓におけるコロニー形成細胞(Colony-forming cell、CMLN)。コロニー形成細胞(CFC)アッセイ、長期培養開始細胞(LTC-IC)アッセイ、ヒト化マウスモデルにより、腸管HSPCの分化能が証明された。さらに、腸移植片内でのレシピエントによるHSPC置換の動態を調べ、循環プールからの補充を実証した。
結果
ITx後の長期多系統キメリズム
我々は、末梢血キメリズムの縦断的前向き研究(患者[pt]1-7、9、10)(Zuberら、2015)を拡張し、さらに12人の患者(pt 13-24)をリクルートして、合計10人のMVTx、1人のLITx、および10人のiITxレシピエント(表S1)をITx後5年まで追跡した。ドナーおよび/またはレシピエント特異的HLAマーカーと汎HLA-ABCモノクローナル抗体(mAb)を組み合わせることで、記載されているように(Zuberら、2015年)、ドナー細胞とレシピエント細胞を確実に区別することができた(図S1A;表S2)。ドナーリンパ球(T、B、NK)および骨髄球キメラは、iITxレシピエントよりもMVTxレシピエントの方が高レベル(10%以上)かつ長期間(術後日[POD]>90)認められた(図S1B-S1DおよびS1F-S1H)。血中ピークドナーT細胞キメリズムの低レベル(<4%)は、早期(POD<90)の中等度から重度の移植片拒絶反応の発症と有意に関連しており(図S1J)、我々の以前の観察結果(Zuber et al.) 骨髄キメラはMVTx患者でも一般的に低レベルで一過性であった(Zuberら、2015)。しかし、MVTxレシピエントのPT15(POD255)とPT18(POD314)ではTx後期にCD14+単球の間でドナーキメリズムの再発(>10%)が観察され、MVTxレシピエントのPT19ではCD14+単球の間で比較的持続的(>2ヵ月)なドナーキメリズムが観察された(図S1EおよびS1I)。
循環しているドナー由来T細胞は、最近の胸腺移行型とT細胞受容体切除円に富んでいる。
上皮内リンパ球(IEL)および固有層リンパ球(LPL)T細胞は組織常在表現型(Zuber et al、 2016)、ほとんどがメモリーT細胞から構成されていたが、循環ドナーT細胞は、組織常在T細胞ではなく、循環T細胞と一致するCD28highCD69-CD103-表現型を発現し(CD28low/- CD69+ CD103+/dim)、ナイーブ(CD45RA+)とメモリー(CD45RO+)の両方の表現型を含んでいた(図1Aおよび1B)。血中ドナーのCD4 T細胞は、5歳以上の患者ではレシピエント細胞と比較して、最近胸腺に移入した(recent thymic emigrant:RTE)表現型に著しく富んでいた(図1C)(図1D、1G、S2A、S2B)。若年レシピエントは一般に、レシピエントおよびドナーの RTE レベルが高く(図 1D および S2B)、これはおそらく強固な胸腺機能を反映していると考えられる。同様の傾向が、循環しているドナーのCD8 T細胞でも観察された(図1E-1G、S2A、およびS2B)。RTE は、Tx 後初期(POD ≤100)、中期(POD 100-200)、および後期(POD >200)において、レシピエント CD4 T 細胞と比較して、循環ドナー CD4 T 細胞で有意に濃縮された(図 S2C)。同様の増加が、POD 100-200のドナー対レシピエントCD8 T細胞のRTEでも認められた。CD4 T 細胞上の CD31 発現は RTE マーカーとして十分に検証されているが (Kimmig et al., 2002)、CD8 T 細胞上の発現は他の因子の影響を受ける可能性がある (Tanaskovic et al., 2010)。最近の胸腺由来の指標としてのT細胞受容体切除円(TREC)の解析(Hazenbergら、2001年)により、pt 1および健常対照(HC)のドナー由来T細胞およびレシピエントT細胞の両方において、CD45RA+ CD4 T細胞がCD45RO+細胞よりもはるかに高レベルのTRECを発現していることが確認された(図1H)。患者15、16、18および19からTx後167-786日目に得られたドナーとレシピエントのCD45RA+CCR7+ T細胞は、いずれもTRECが顕著に濃縮されていた(図1I)。全体として、RTE表現型とTRECの濃縮は、Tx後の循環ドナーT細胞のde novo生成の概念を強く支持している。長期多系統キメリズムを有する患者の循環ドナー由来δ1+ T細胞およびCD19+ B細胞もまた、ナイーブ集団に富んでいた(図S3)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図1. 循環中のドナー由来T細胞はドナーの年齢に関係なくRTE表現型とTRECに富んでいる。
(A)POD127で分離されたpt 7のPBMCまたは回腸IELおよびLPLからのドナーCD4およびCD8 T細胞におけるCD28、CD69およびCD103の発現。
(B)POD45のpt 7の回腸IELとLPL、およびPOD45とPOD121のPBMCからのドナーまたはレシピエントCD4 T細胞上のCD45RAとCD45ROの発現。
(C-F) POD 246のpt 1 PBMCにおけるCD4+ RTE(CD45RA+CD45RO-CD31+)のFCMゲーティング(C)とPOD 83のpt 15 PBMCにおけるCD8+ RTE(CD45RA+CCR7+CD31+)のFCMゲーティング(E)。健常対照(HC、灰色)PBMCまたは循環しているドナー由来(赤色)またはレシピエント由来(黒色)のCD4(D)またはCD8(F)T細胞中のRTEの割合(Tx後)。
(G)少なくとも5歳のレシピエントのTx後の同一サンプル(線で結んで示す)中の循環ドナー("D")またはレシピエント("R")T細胞集団中のCD4およびCD8 T細胞中のRTEの割合。同一サンプルにおけるドナーとレシピエントの表現型は、両側対のStudentのt検定を用いて比較した。
(H)2人のHCのPBMCおよびPOD 246/365のpt 1のPBMCからのCD45RA+またはCD45RO+CD4 T細胞において検出されたTRECの数。
(I)1人のHCのPBMCおよびPOD 255、786、314、および167にそれぞれ採取されたpt 15、16、18、および19のPBMCからのナイーブ(CD45RA+CCR7+)または非ナイーブCD3+T細胞において検出されたTRECの数。
図S1、S2、S3、S7および表S1、S2も参照。
移植前または移植片ドナーのT細胞と循環しているドナー由来のナイーブT細胞とのレパートリーの重複の欠如
ナイーブT細胞は高いレパートリー多様性を示すため、同一個体内の異なる組織間でクローンの重複を検出することは困難である(Thomeら、2016b)。一貫して、Tx後101日目から136日目に採取したpt 7 PBMCからナイーブドナーT細胞とメモリードナーT細胞を選別し、ハイスループットTCRβ CDR3配列決定を行ったところ、Tx前のドナーリンパ組織と重複するクローンは、メモリードナーT細胞(209/579ユニーク配列=36.1%)でのみ検出されたが、ナイーブドナーT細胞では検出されなかった(図2A)。PBMC中のナイーブドナーT細胞はまた、メモリーT細胞と比較して、回腸生検初期T細胞(POD 24)との重複が非常に少なかった(図2A)。POD101-136におけるナイーブT細胞のクローナリティ(0.061)は、メモリーT細胞のクローナリティ(0.150)よりも低かった。
ダウンロード 高解像度画像ダウンロード(788KB)
ダウンロード フルサイズ画像をダウンロード
図2. プレTx T細胞と循環しているドナー由来T細胞のレパートリー重複の欠如
(A)POD101-136のPBMC、Tx前のドナー脾臓(非刺激[D4UとD8U]、CFSElow刺激T細胞[D4LとD8L]を含む)、PT7のTx後の回腸生検(POD24)から選別されたドナーメモリーT細胞とナイーブT細胞のTCRクローンの重複を示すベン図。D4UおよびD8Uは、それぞれ非刺激ドナーCD4およびCD8 T細胞を表し、D4LおよびD8Lは、それぞれMLRにおけるCFSElowドナーCD4およびCD8 T細胞反応者を表す。各集団のクローナリティを示す。
(BおよびC)白金18 PBMC POD 357(B)または白金15 PBMC POD 143(C)およびTx前のドナーの脾臓またはMLNにおける選別されたドナーT細胞間のTCRクローン重複を示す比例ベン図。"Non-mappable "パーセンテージは、Tx前のドナー脾臓またはMLNで検出されなかったドナーPBMC中のTCR配列のパーセンテージである。
(D)POD143のPt15 PBMC(緑)、および脾臓からのTx前D4U(黒)およびD8U(赤)T細胞、またはMLNからの全T細胞(青)の選別されたドナーT細胞から検出された非マッパブルクローンの存在量プロットは、存在量の対数順位(x軸:低頻度から高頻度)に対するTCR配列の相対対数存在量(y軸)を示す。絶対値が多様性(DeWolf et al., 2018)として直接変化する存在量プロットのべき乗則の傾きを示す。
表S1およびS2も参照のこと。
POD357およびPOD143におけるpt 18のPBMCおよびpt 15のPBMCにおけるドナーT細胞の選別および配列決定も同様に、TCRの高い割合(それぞれ96.3%および98.2%)が、Tx前のドナーリンパ組織において検出不可能(すなわち、「非appable」)であることを明らかにした(図2Bおよび2C)。POD143にpt 15の選別されたドナーPBMC T細胞から同定された48,042個の非appableクローンは、クローンの大部分を捕捉する新しい多様性指標(勾配)を用い(DeWolfら、2018)、クローナリティ測定によって、Tx前のドナーの非刺激脾臓およびMLNと同様に高い多様性を示した(図2C、D)。まとめると、ドナーの循環T細胞におけるRTEとTRECの濃縮と組み合わせた、Tx前のドナーリンパ球とのレパートリーの重複の欠如は、これらのドナーの循環ナイーブT細胞がTx後にレシピエントでde novoに発達したことを示唆している。
長期(POD > 200)循環ドナー細胞はGvH反応性ではなく、機能的である。
POD83とPOD214に採取されたpt15 PBMCから選別されたT細胞についてMLRを行ったところ、ドナーT細胞のキメラ率はそれぞれ27%と26%であった。レシピエント抗原に旺盛に反応した脾臓からのT細胞とは対照的に、TX後のPBMCからの循環ドナーT細胞は、レシピエント抗原には増殖しなかったが、第三者抗原には強く反応した(図3A)。しかし、選別されたT細胞反応者からCD25+細胞を除去すると、レシピエント刺激物質に対するドナーCD4 T細胞の反応が明らかになった(図3A)。同様の特異的なドナーT細胞のレシピエントに対する低応答性は、pt 7のPBMC(POD 253、1.5%のドナーT細胞キメラ)とpt 16のPOD 786の脾臓細胞を用いて観察された。3人の患者すべてにおけるドナーT細胞の低感受性は、レシピエント特異的であり(図3B)、レシピエントとのHLAミスマッチは第3者と同等かそれ以上であった(図3E)。
ダウンロード 高解像度画像ダウンロード(913KB)
ダウンロード フルサイズ画像のダウンロード
図3. 長期間循環するドナー細胞はGvH寛容を示す
(A)POD83およびPOD214に採取されたレシピエントPBMCから選別されたPT15Tx前ドナー脾臓細胞またはTx後全T細胞またはCD25-T細胞をレスポンダーとして、照射されたレシピエントTx前脾臓細胞またはサードパーティPBMCをスティミュレーターとして用いた機能的MLR。ゲーティングされたドナーCD4およびCD8 T細胞のCFSE増殖プロフィールを示す。
(B)照射刺激物に対する反応物として、Tx前ドナー脾臓細胞(pt 15、7、16)、またはTx後PBMC(pt 15 POD 214およびpt 7 POD 253)、または脾臓細胞(pt 16 POD 786)を用いた機能的MLRにおける、%CFSElowドナーCD4およびCD8 T細胞の要約。スチューデントのt検定を用いて、対になったデータを比較した(*p<0.05、**p<0.01、**p<0.001;n.s.:有意差なし)。平均値とSDは棒グラフで示した。
(C)ドナーHLA+CD3+CFSElow細胞は、POD 83 PBMCから選別したCD25- T細胞をレスポンダーとして、照射したレシピエントのプレTx脾細胞をスティミュレーターとして用いたMLRの6日目に選別した。選別されたドナーのHLA+CD3+CFSElow細胞についてTCRβ CDR3 DNA配列決定を行い、ドナーのマッピング可能なクローン内の全配列のパーセンテージとしてのGvHクローンの累積頻度を示した。「ドナーマッピング可能なクローン」とは、ドナーのTx前の脾臓、リンパ節、および/またはMLR CFSElow T細胞集団で検出可能なクローンを指す。このようなクローンは、合計124のユニークな配列の中で4つ同定された。
(D)患者4、7、13、15のTx前ドナー脾臓またはMLN、Tx後早期(POD <70)および後期(POD >140)回腸生検(Bx)、早期(POD <70)および後期(POD >250)PBMCで検出された代表的なGvHクローンの全TCR配列中の頻度の合計。
(E)15例のドナーとレシピエントおよび第3者のHLAタイピング(HLA-A、-B、-C、DRB1、DQ)とHLAミスマッチ数(赤)を示す。白金15のドナーは、レシピエントとのHLAミスマッチ数が8/10と、第三者とのHLAミスマッチ数(7/10)よりも多かった。白子7と白子16のドナーはそれぞれ、レシピエントと第三者とのHLAミスマッチ数が等しく、それぞれ5/10と8/10であった(データは示さず)。
図S1、表S1、S2も参照。
pt 15 POD 83 MLRから選別されたドナーHLA+CD3+CFSElow細胞のTCR配列決定により、CD25+細胞の枯渇により明らかになった弱いGvH反応には、サンプルサイズが小さくユニーククローンの数が少ない(124)にもかかわらず、支配的な既存のドナーGvHクローンが含まれていることが示された(図3C)。CDR3配列によってTx前のMLRで同定された追加のGvHクローンは、高頻度(Zuberら、2016年)の同種移植片(POD >140)および低頻度(図3D)のレシピエント末梢血(POD >250)の両方で長期間持続した。
これらのデータは、レシピエントの胸腺におけるナイーブT細胞のde novo発生、およびレシピエント特異的制御性T細胞(Treg)が腸移植片からのGvH T細胞の寛容を促進する可能性と一致しており、レシピエントのリンパ球コンパートメントにおける長期ドナーT細胞の間で、レシピエントに対する寛容が誘導されたことを示唆している。
HSPCはヒト腸粘膜、PP、MLN、肝臓に存在する。
血中のドナーT細胞キメラのピークレベルが高い(4%以上)患者における長期にわたる多系統キメラと一致して(図S1)、我々は7人中7人の患者において、循環するドナーHLA+造血前駆細胞(Lin-CD45+CD34+)(図4A)を検出した(図4B)。CD45+CD34+細胞は成人のヒト小腸(Lynchら、2006年)や肝臓(Golden-MasonとO'Farrelly、2002年、Wangら、2012年)で報告されていることから、我々はこれらが移植片に由来すると仮定した。ヒト造血に関する現在の分化スキーム(Görgens et al., 2013)を用いて、さらにフローサイトメトリー(FCM)により、造血幹細胞およびMPP、LMPP、CLP、MP、CD56+前駆細胞(Golden-Mason and O'Farrelly, 2002, Lynch et al., 2006)を含む前駆細胞の組織における存在を評価した(図4CおよびS4)。複数の死亡臓器ドナーの腸粘膜、PP、MLN、BMのHSPCsを分析した(図4C、4D、S4;表S3)。これらの組織はすべて、様々なレベルでHSPCsを含んでいた(図4D)。回腸LPLには、IELやMLNの細胞よりも高い割合の造血幹細胞が含まれていた(図4D)。驚くべきことに、回腸IEL、LPL、PPのCD45+/dimCD34+細胞では、造血幹細胞とLMPPの割合が、成体BMや胎児肝細胞よりも高かった(図4D)。回腸LPLにおけるLin-CD45+/dimCD34+細胞の割合、あるいはLin-CD45+/dimCD34+細胞中の造血幹細胞の割合は、ドナーの年齢や性別に依存しなかった(図S5)。ITx前のドナー肝生検(n = 2)とドナー臓器灌流液(n = 8)が得られた少数の移植患者では、様々なレベルの造血幹細胞を検出することができた(図4Eと4F)。したがって、肝臓と腸の両方がHSPCsの貯蔵庫であり、iITx患者よりもMVTx患者でより頻繁に見られる、長期間持続するドナー混合キメラを部分的に説明できるかもしれない。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. ヒトの回腸、パイエル板、MLN、肝臓にはHSPCsが存在する。
(A) POD 44のPt 7 PBMC中のDAPI-HLA-ABC+Lin-CD45+/dimCD34+ HP中のドナーHLA+細胞の代表的FCMゲーティング。Lin-:CD3-CD5-CD14-CD19-。
(B)指示された患者およびPODからの血液中のDAPI-HLA-ABC+Lin-CD45+/dimCD34+ HPのうちドナー細胞の割合(左)と濃度(右)。
(C)死亡ドナーD#265(24歳[y/o]、男性)の回腸LPL中のHSPCの代表的FCMゲーティング。
(D)複数の死亡臓器ドナーのヒト回腸(IEL、LPL)、PP、MLN、BMにおけるHSPCの割合と構成。回腸IEL、LPL、PPs、MLNを含む一対の組織間の統計的比較にはStudentのt検定を用いた(*p<0.05、**p<0.01)。平均値とSDを示す。2人の胎児肝臓ドナーの細胞を参考として用いた。
(EおよびF)ITx前の15、16、17、18、20、21、23および24例のドナーから採取した肝生検(E)および臓器灌流液(F)における、DAPI-Lin-CD45+/dimCD34+細胞中のCD45+/dimCD34+細胞の割合と、DAPI-Lin-CD45+/dimCD34+細胞中の造血幹細胞、MPP、LMPP、CLP、MPおよびCD56+前駆細胞の割合。
図S4、S5、表S1、S2、S3も参照。
腸管LPL HSPCsはBM HSPCsと表現型が似ている
同じ臓器ドナーのBMと回腸LPL由来のCD45+/dim細胞を区別するために、バーコードを含むCyTOFを用い、特定の造血系譜(CD3/CD4/CD8/γδTCR/CD14/CD11c/CD11b/CD56)と前駆細胞(CD34/CD38/CD10/CD90/CD45RA)、および胸腺ホーミング能(CCR9)のマーカーを解析した。同じドナーの回腸LPLとBMからのLin-CD45+/dimCD34+細胞は、viSNEプロットで類似の表現型特性(局在)を示した(図5A)。回腸LPLとBMのLin-CD45+/dimCD34+細胞はともに、前駆胸腺ホーミングマーカーCCR9(Haddadら、2006、Zlotoff and Bhandoola、2011)を発現する亜集団(図5B)と、CD45RAとCD7(Haddadら、2004、Haddadら、2006)を共発現するT/NK系列に偏った前駆細胞を含んでいた(図5C)。これらの表現型は広い年齢範囲(26-76歳)で観察された。
ダウンロード 高解像度画像のダウンロード(919KB)
ダウンロード フルサイズ画像のダウンロード
図5. 腸管HSPCsはCyTOF解析においてBM HSPCsと表現型が類似している。
(A)各臓器ドナー(D#259、D#280、D#305、D#337)において、系統を除去したBM細胞と回腸LPLから得られたCD45+/dimCD34+細胞のviSNEプロットと密度ドットプロット。CD45+/dimCD34+細胞(ドットプロットに示すようにゲーティングされた)はviSNEプロットでは赤で示されている。
(B)各臓器ドナーのCD45+/dim系統を欠失したBM細胞と回腸LPLのviSNEプロットにおけるHP胸腺ホーミングマーカーCCR9の発現。CD34+のゲーティングは(A)と同じにした。CCR9+細胞(赤)とこれらのゲーティングされた集団との重なりがviSNEプロットに示されている。
(C)成人死亡臓器ドナーD#280、D#305、D#337のBMと回腸LPLにおけるCD45RAとCD7を共発現するHSPCsの解析。NA, 該当なし。
表S3も参照。
In vitroおよびin vivoにおける腸管LPL HSPCsの多分化能
回腸LPLおよびBM Lin-CD34濃縮細胞はともにCFCアッセイで骨髄系および赤血球系コロニーを形成したが、回腸由来はBM CD34細胞より効率が低かった(図6AおよびS6A)。シングルソーティングした回腸LPL造血幹細胞をMS5-DL1ind100フィーダー細胞(Calvo et al. 同じドナーから選別されたBMおよび回腸LPL造血幹細胞は、LTC-ICアッセイにおいて同程度のコロニー形成細胞の割合を示した(図6B)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. In vitroおよびIn vivoにおけるヒト腸管HSPCの多系統分化能
(A)D#259(46歳/男性)のBMまたは回腸LPLから採取したLin- CD34濃縮細胞の短期CFCアッセイによる代表的コロニー。スケールバーは100μm。棒グラフは35mmディッシュあたりの正規化コロニー数を示す。
(B)D#305(28歳/女性)およびD#332(38歳/男性)のBMまたは回腸LPLから単細胞選別した造血幹細胞をMS5-DL1ind100間質細胞と共培養した長期LTC-ICアッセイからの代表的コロニー。CD3+T細胞(緑)、CD20+B細胞(赤)およびCD14+骨髄系細胞(紫)は、蛍光顕微鏡で42日目にコロニー内で検出可能であった。HCヒトPBMCは陽性染色コントロールであった。スケールバー、20μm。棒グラフは、単細胞選別したBMまたは回腸LPL造血幹細胞から形成されたコロニーのパーセンテージを示す。
(C)ヒト胸腺移植(HLA-A3+A2-A9-)で解析した3匹のマウスのうち、皮下照射した代表的なNSGマウス(#110)に、D#293回腸LPL(53歳/雌)からFACS選別したCD45+/dimCD34+細胞(1×106)を投与した、 HLA-A3-A2+A9-)とD#291 BM(26歳/女性、HLA-A3-A2-A9+)のCD34+磁気活性化細胞選別(MACS)分離細胞(1×105)を10: 1. 代表的なFCMゲーティングは、マウスの血液におけるT、B、NK、骨髄系譜の再構成を養子縁組後約19週目に示し(2段目)、マウスのBMにおけるT、B、NK、骨髄系譜の再構成を養子縁組後24週目に示した(3段目)。ヒトHC PBMC(HLA-A3-A2+A9-)を陽性対照としている(1段目)。24週目の終了時に別のNSGマウス(#558)から採取したヒト胸腺移植(HLA-A3+A2-A9-)(4段目)には、腸由来のCD4+CD8+ T細胞とCD34+前駆細胞が含まれている。マウス#558は、D#291回腸LPLからのCD45+/dimCD34+ FACS選別細胞(4.5×105)とD#293 BMからのCD34+ MACS分離細胞(2.5×105)を1.8:1の比率で受けた。
(D)NSGマウス(#110)血液中のhCD45+mCD45-集団中の回腸(赤)、BM(紫)、胸腺由来(緑)細胞の割合。
(E)D#293回腸由来のHLA-A3-A2+A9-コンパートメントのうち、NSGマウス(#110)の血液中に再増殖した異なる系統の割合。
図S6、表S3およびS4も参照。
ヒト化マウスモデルを用いて、ヒト腸管Lin-CD45+/dimCD34+細胞がin vivoで造血系譜を再構成する能力を調べた(表S4)。ある動物(#110)では、異なる系統の腸管HSPC由来細胞がFCMで同定された(図6C-6E)。ヒト胸腺移植片の残存T細胞がNSGレシピエント(#110)の血液中でほぼ消失した頃(Tx後12週頃)(図6D)、D#293由来のヒト腸由来細胞がヒトCD45+細胞の中で優位を占め(図6D)、T、B、NK、骨髄系のde novo生成が証明された(図6E)。Tx後24週目に、レシピエント(#110)から採取したBMにおいて、ヒト腸由来細胞(HLA-A2+A9-A3-)が多系統分化を示した(図6C)。腸由来のCD34+細胞の小さな集団がBM内に残っており(図6C)、造血幹細胞が移植されたことを示唆している。ヒト胎児胸腺移植を受けた別の動物(#558)では、24週目のヒト胸腺移植片において、腸由来のCD45+/dimCD34+前駆細胞とCD4+CD8+ T細胞が、腸由来胸腺細胞(HLA-A2-A3-A9+)の0.21%と60%を占めた(図6C)。ヒト胸腺移植を受けなかったさらに2匹のマウス(#329と#382)では、回腸由来とBM由来のHSPCを6.4:1または4:1の比率で注入した(図S6)。D#238またはD#332由来のヒト腸由来細胞は、移植後2週間ほどでマウスPBMC中のhCD45+細胞の90%以上を占めた。この割合は8週目には10%-50%に減少し、移植後10週目には1.5%未満となり、17週目から22週目にかけて一時的に回復した(図S6DおよびS6F)。我々の研究に参加した10匹のヒト化マウス(表S4)のうち、4匹は短期間(2-3週間)のみ追跡された。長期(24週以上)追跡した6匹のマウスのうち、ヒト腸管HSPC由来細胞はすべてのマウスの末梢血で検出可能であり、キメラは4匹で12週以上持続した。移植後24週目または28週目に終了した時点で、ヒト腸管HSPC由来細胞は6匹中5匹のマウスの1つ以上の組織(BMおよび/または脾臓および/または胸腺)で検出可能であった(表S4)。CD4 T細胞、NKT細胞、B細胞、単球が腸管HSPC由来の主要な系譜であった。これらのデータを総合すると、ヒト腸管HSPCは多系統分化能(T、B、NK、骨髄系)を持ち、いくつかの実験ではBM HSPCより少ないものの、自己複製が可能である可能性が高い。
循環系からの腸管HSPCsの置換
10人のITxレシピエントから、ストーマの再手術や閉鎖、小腸の摘出(POD 28-1,606)から十分なサンプルが得られた時に採取した腸移植片生検標本(空腸、回腸、結腸)のHSPCsの起源を追跡した。ドナー由来とレシピエント由来のHSPCsを区別する代表的なFCMゲーティングを図7Aに示す。POD532にpt14の本来の結腸から採取した標本は、レシピエント由来HSPCsを含むコントロールとして使用した(図7B-7Dおよび7G)。腸管粘膜のDAPI-CD45+/dim Lin-細胞の中に、さまざまな割合のCD34+細胞が検出された(図7B)。驚くべきことに、Tx後1ヵ月の時点で、レシピエントHSPCsはすでにいくつかの移植片に移植され始めていた(pt 23 POD 28回腸とpt 19 POD 32回腸、図7C)。初期のレシピエントの寄与は、pt 16(POD 47)、pt 19(POD 32)、pt 23(POD 37)では主にLMPP、CLP、MP細胞であった(図7C)。造血幹細胞は、患者の年齢や初期臨床転帰に関係なく、レシピエントよりドナーのLin-CD45+/dimCD34+細胞に濃縮される(80%以上)傾向があり(表S1)、この傾向は少なくとも6人の患者でTx後長期(POD >100)に維持された(pt 20, POD 104; pt 19, POD 105; pt 23, POD 37); pt 19, POD 105; pt 17, POD 243; pt 16, POD 786; pt 15, POD 347, 1,041; pt 2, POD 1,544)において、この傾向はTx後4年を超えても維持された(図7Cおよび7G)。他の患者では、レシピエントによるドナー造血幹細胞の置換は時間の経過とともに進行し(例えば、pt 17、図7Cと7G)、他の患者では、レシピエントによるドナー造血幹細胞の完全またはほぼ完全な置換が長期にわたって観察された(例えば、pt 4、POD 1,606およびpt 13、POD 1,032;図7Cと7G)。全体として、ドナー腸管造血幹細胞は8例中6例で移植片中に長期間(POD 100-1,600)残存していた(図7G、右)。一般に、移植片LPL中のLin-CD45+/dimCD34+ドナー細胞は、造血幹細胞とMPPの割合が高かったが、レシピエントコンパートメントは主にMPから構成されていた(図7D)。POD >100の全検体において、移植片LPL(n = 9検体)中のドナーLin-CD45+/dimCD34+細胞はレシピエント(n = 13検体)よりも造血幹細胞の割合が有意に多く(図7E)、レシピエントコンパートメント(n = 13)はドナー(n = 9)よりもMPPの割合が有意に多かった(図7F)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図7. 移植片内のドナーHSPCsのレシピエント細胞による置換の動態
(A)POD1,544に採取されたPt2小腸切除の空腸LPLを用いた代表的フローサイトメトリーゲーティング戦略。Lin-:CD3-CD5-CD14-CD19-。
(BおよびC)DAPI-CD45+/dimLin- LPL中のCD34+細胞の割合(B)およびドナー由来とレシピエント由来の各細胞タイプの割合(C)。腸管LPL中のDAPI-Lin-CD45+/dimCD34+細胞、造血幹細胞、MPP、LMPP、CLP、MP、およびCD56+前駆細胞は、ストーマの再造設または閉鎖、あるいは小腸切除の際に、異なる患者からTx後の複数の時点(POD 28-1,606)で採取した。
(D)Tx後の複数の時点における、異なる患者のドナーまたはレシピエントのDAPI-Lin-CD45+/dimCD34+ LPLにおける造血幹細胞、MPP、LMPP、CLP、およびMPの割合による構成(Aを参照)。
(EおよびF)Tx後100日後に患者の腸粘膜から分離されたドナーまたはレシピエントのLin-CD45+/dimCD34+ LPL中の造血幹細胞(E)およびMP(F)の割合を箱ひげ図に示した(箱内の線は中央値を示す)。両側対応のないスチューデントのt検定を用いてドナーとレシピエントの区画を比較した。
(G)Tx後2,000日までの末梢血中のドナーT細胞(左)と腸管中のドナー造血幹細胞(右)の割合。
(H)Tx後の様々な時点でストーマの再形成または閉鎖、あるいは小腸切除を受けた患者(MVTxは丸、LITxは四角、iITxは三角)の個々の検体について、同様の時点(POD >100)における腸管内のドナー造血幹細胞の割合と血液中のドナーT細胞の割合。カイ二乗検定は、末梢血(T細胞)または腸移植片(造血幹細胞)のドナーのキメリズムを0.2%にカットオフして実施した。
図S1、表S1およびS2も参照のこと。
持続性T細胞キメリズム(>0.2%)を有するすべての患者が持続性腸管造血幹細胞キメリズムを有していたが(pt 2、16および19)、腸管造血幹細胞キメリズムの持続期間はT細胞キメリズムの持続期間よりも長かった(図7G)。初期の一過性ドナーT細胞キメラがPOD23-463の間に低値または検出不能(0%-0.33%)となった1例(pt16)は、POD786までにドナーT細胞キメラが4%以上まで復活したが、この時点でも移植片中に50%以上のドナー造血幹細胞が残存していた(図7G)。全体として、持続的ドナーキメリズム(POD >100)は末梢血よりも同種移植片で有意に多かった(図7H、p = 0.0062)。これらのデータを総合すると、移植片由来のHSPCがドナー血液キメラの長期持続に寄与している可能性が高く、これらのドナー細胞は腸に帰巣する循環中のレシピエントHSPCと徐々に置換されることが示された。
考察
我々はここで、ヒトの腸には多分化能を持つHSPCsが存在し、腸内同種移植の場合、これらの細胞は循環中のT、B、NK、骨髄系細胞プールに寄与し、循環から徐々に補充されることを証明した。ナイーブT細胞を持つリンパ濾胞、PP、MLNが腸移植片と一緒に移植され、若いドナーの腸粘膜にはナイーブT細胞が含まれていることから(Thome et al. しかし、いくつかの証拠が、循環しているドナーRTE様細胞、特にTx後期に検出されたRTE様細胞が、レシピエントの胸腺でde novoに発生した可能性を裏付けている。第一に、成人ドナー移植片を持つ10代の患者(3例目)と成人患者(7例目)は、腸移植片の年齢にもかかわらず、レシピエントと比較してドナー由来のRTEが顕著に豊富であった。第二に、ドナー移植片から離脱したナイーブT細胞は、リンパ球減少に伴う増殖(LIP)(Onoe et al.
循環しているドナー由来T細胞の表現型は、レシピエントの胸腺由来を強く示唆しているが、腸自体など、T細胞が発生する可能性のある他の部位も考慮しなければならない。Lin-c-kit+HPはマウスの腸クリプトパッチで同定され、TCR αβおよびγδ IEL T細胞を産生することが判明している(Saitoら、1998)。しかし、αβT細胞はこの部位で産生される少数集団であり、この経路は正常な胸腺が存在すると抑制される(Guy-Grandら、2003)。MLNや腸粘膜のリンパ球減少症では、臓器外Tリンパ球増生が亢進しており(Guy-Grandら、2003)、ATGによるリンパ球減少症は、ITx後の患者において、腸管HSPCsからのT細胞のde novo局所発生を促進する可能性もある。私たちのセンターでは、ATG誘導は一般に最初の1週間以内に行われるので、このようなことが起こるのはITx後早期と考えられる。
ヒトの腸管における細胞外T細胞発生に関する証拠は限られている(Howieら、1998、Lynchら、2006、Williamsら、2004)。未熟なT細胞やリンパ系前駆細胞が、TdT遺伝子やRAG遺伝子の発現とともに、胎児や乳児の腸で報告されているが、生後18ヵ月までに消失している(Howieら、1998年、Williamsら、2004年)。我々のITxドナーの多く(12/21 = 57.1%)は18ヵ月齢以上(2-48歳、Table S1)であったことから、循環しているナイーブドナーT細胞は移植片のその場では発達しなかったと考えられる。我々の研究では、血液、IEL、LPLのCD8 T細胞の大部分はCD8αβであり、末梢血中にはドナーまたはレシピエントのCD8αα T細胞はほとんど検出されなかったので、CD8ααの表現型は腸管由来の細胞を明確に同定するものではなかった(図S7)。従って、我々の研究は、ITx後のレシピエント血液中に検出されたRTE様ドナーT細胞の上皮内起源を否定するものではないが、これらの細胞集団の表現型、高いTREC含量、高いTCR多様性、およびMLRにおけるレシピエント刺激物質に対する耐性は、これらの細胞がドナー移植片中に運ばれた前駆細胞からレシピエント胸腺で発生し、循環に入り、直接胸腺に移動するか、またはレシピエントBMに定着した後、以前の前駆細胞から分化するという仮説を支持している。実際、CyTOF分析により、前駆胸腺ホーミングマーカーCCR9を発現するサブセットを含め、BMと回腸腸管LPLから得られたLin-CD45+/dimCD34+細胞の表現型が類似していることが明らかになった(Haddadら、2006、Zlotoff and Bhandoola、2011)。我々は長期キメラ患者の循環血液中にドナーのLin-CD45+/dimCD34+前駆細胞を検出し、移植片からドナーのHSPCsがレシピエントの循環血液中に移動し、BMや他の造血可能部位に移動し、そこで分化して循環白血球プールに寄与しているという仮説を支持した。
我々は、9-93歳の複数の死亡ドナーの回腸において、年齢とLin-CD45+/dimCD34+細胞の割合、あるいはLin-CD45+/dimCD34+細胞の中の造血幹細胞の割合との間にいかなる関係も観察しなかった。以前の研究では、前胸腺細胞の候補に相当するT/NK系列に偏ったCD34+CD45RA+CD7+ HPが胎児のBMと臍帯血で検出され、出生前後で減少し、成人のBMでは低レベルで持続していた(Haddad et al.) 対照的に、我々は26-76歳の3人のドナーのBMにおいて、Lin-CD45+/dimCD34+集団の中に高い割合(9%-76%)のCD45RA+CD7+細胞を検出した。また、Lin-CD45+/dimCD34+ CD45RA+CD7+細胞は、全ドナーではないが一部のドナーの回腸LPLでも検出された。
髄外造血は消化管を含む多様な組織で報告されており、通常、骨髄線維症、炎症、感染などの病理学的過程に関連している(Granickら、2012、Saenzら、2010)。従って、ドナー移植片から、おそらく炎症に反応して、レシピエントBMに中間滞留することなく、循環するドナー単球も出現する可能性は否定できない。マウスを用いた研究では、肺が終末血小板産生の主要部位であることが示されており(Lefrançaisら、2017)、造血前駆細胞が血流に乗って移動し、様々な臓器で分化する可能性が示唆されている。
私たちの最近の研究では、レシピエントによる腸移植片T細胞再増殖(Zuberら、2016年)と血液T細胞マクロキメリズム(Fuら、2017年)を決定する上で、双方向の同種反応性が果たす役割が示唆されている。移植片における宿主対宿主(HvG)クローンと比較した移植片対宿主(GvH)クローンの濃縮、de novoクラスIドナー特異的抗体(DSA)の非存在、および中等度および/または重度拒絶反応からの解放は、血中ドナーT細胞マクロキメリズムと関連している(Fuら、2017、Zuberら、2016)。我々は、早期リンパ造血GvH応答(LGVHR;臨床的GVHDを誘導しないGvH応答)(Sykesら、1988a、Sykesら、1988b)がレシピエント造血細胞を攻撃し、移植片内に運ばれたHSPCsを含むドナー細胞の生着を可能にする「空間」をレシピエントBM内に形成するという仮説を立てた。
われわれは以前、肝移植のみのレシピエントでは、低レベルで一過性のリンパ球または骨髄球キメラしか実証していない(Zuberら、2015)。しかし、成人のヒト肝臓(Wangら、2012)には、再増殖能を有する多能性造血幹細胞が含まれており、MVTxレシピエントにおけるドナーキメリズムに寄与している可能性がある。腸粘膜で局所的に増殖するGvH反応性クローンの負荷が大きいため(Zuberら、2016)、LTxレシピエントと比較して、MVTxではキメリズムがより大きく、より長期化する可能性がある(Zuberら、2015)。
連続腸生検標本の解析により、循環レシピエント細胞による腸管HSPC再増殖の動態を測定することができた。マウスの研究では、造血幹細胞が循環を介して異所性ニッチに移動することが証明されている(Christensenら、2004年、Wrightら、2001年)。造血幹細胞は12~18週齢のヒト胎児の血液中に検出され(Gallacherら、2000年)、長期的に再増殖する造血幹細胞が成人ヒト定常末梢血で実証された(Bourdieuら、2017年、Brunet de la Grangeら、2013年)。我々は今回、ヒトの循環プールからの「異所性」ニッチ造血幹細胞のターンオーバーを実証した。
本研究は、レシピエント血液中にドナー混合キメラが持続する根本的なメカニズムを明らかにし、ヒトHSPCsの動態に関するユニークな情報を提供する。我々のデータは、ヒトの腸が、循環白血球に寄与するHSPCの重要な滞留部位として機能していることを示唆している。このことがITxに加えて生理的条件下でも当てはまるかどうかについては、さらなる調査が必要である。移植片由来のHSPCが血中混合キメラの持続に寄与していることは、ITxレシピエントにおいて移植片寛容を促進する可能性を示唆している。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
マウスモノクローナル抗ヒト HLA-ABC APC BD Biosciences Cat# 555555; RRID: AB_398603
マウスモノクローナル抗ヒト HLA-ABC PE BD Biosciences Cat# 555553; RRID: AB_395936
マウスモノクローナル抗ヒト HLA-A2/28 PE BD Biosciences Cat# 558570; RRID: AB_647220
マウスモノクローナル抗ヒト HLA-A2/28 FITC One-Lambda Cat# FH0037; RRID: N/A
マウスモノクローナル抗ヒト HLA-A2/28 ビオチン One-Lambda Cat# BIH0037; RRID: N/A
マウスモノクローナル抗ヒト HLA-A9 FITC One-Lambda Cat# FH0964; RRID: N/A
マウスモノクローナル抗ヒト HLA-A9 ビオチン One-Lambda Cat# B1H0964; RRID: N/A
マウスモノクローナル抗ヒト HLA-A3 APC eBioscience Cat# 17-5754-42; RRID: AB_2573220
マウスモノクローナル抗ヒト HLA-B8 FITC One-Lambda Cat# FH0536A; RRID: N/A
マウスモノクローナル抗ヒト HLA-B12 FITC One-Lambda Cat# FH0066; RRID: N/A
マウスモノクローナル抗ヒト HLA-A30/31 ビオチン One-Lambda Cat# BIH0067; RRID: N/A
マウスモノクローナル抗ヒト HLA-B27 FITC One-Lambda Cat# B27F50X; RRID: N/A
マウスモノクローナル抗ヒト CD45 V500 BD Biosciences Cat# 560777; RRID: AB_1937324
マウスモノクローナル抗ヒト CD3 PerCP-Cy5.5 BD Biosciences Cat# 552852; RRID: AB_394493
マウスモノクローナル抗ヒト γδ TCR PE-Cy7 Beckman Coulter Cat# PN B10247; RRID: N/A
マウスモノクローナル抗ヒト CD4 Alexa Fluor 700 Tonbo Biosciences Cat# 80-0048; RRID: AB_2621976
マウスモノクローナル抗ヒト CD8 APC-Cy7 BD Biosciences Cat# 557834; RRID: AB_396892
マウスモノクローナル抗ヒト CD56 ブリリアントバイオレット 605 BioLegend Cat# 318334; RRID: AB_2561912
マウスモノクローナル抗ヒト CD19 パシフィックブルー BioLegend Cat# 302224; RRID: AB_493653
マウスモノクローナル抗ヒト CD28 Pacific Blue BioLegend Cat# 302928; RRID: AB_10641279
マウスモノクローナル抗ヒト CD69 Brilliant Violet 650 BioLegend Cat# 310934; RRID: AB_2563158
マウスモノクローナル抗ヒト CD103 FITC BioLegend Cat# 350204; RRID: AB_10639865
マウスモノクローナル抗ヒト CD103 PE BD Biosciences Cat# 550260; RRID: AB_393564
マウスモノクローナル抗ヒト CD45RO ブリリアントバイオレット 711 BioLegend Cat# 304236; RRID: AB_2562107
マウスモノクローナル抗ヒト CD161 BV711 BD Biosciences Cat# 563865; RRID: AB_2738457
マウスモノクローナル抗ヒト HLA-DR ブリリアントバイオレット 711 BioLegend Cat# 307644; RRID: AB_2562913
マウスモノクローナル抗ヒト CD314 (NKG2D) ビオチン BioLegend Cat# 320804; RRID: AB_492958
ストレプトアビジン Alexa Fluor 594 Life Technologies Cat# S32356; RRID: N/A
マウスモノクローナル抗ヒト CD33 AF700 BD Biosciences Cat# 561160; RRID: AB_10561683
マウスモノクローナル抗ヒト CD11c PE-Cy5 BD Biosciences Cat# 551077; RRID: AB_394034
マウスモノクローナル抗ヒト CD14 パシフィックブルー BD Biosciences Cat# 558121; RRID: AB_397041
マウスモノクローナル抗ヒト CD141 BV711 BD Biosciences Cat# 563155; RRID: AB_2738033
マウスモノクローナル抗ヒト CD123 Biotin BD Biosciences Cat# 555643; RRID: AB_396000
マウスモノクローナル抗ヒト CD1c PE-Cy7 BioLegend Cat#331516; RRID: AB_2275574
マウスモノクローナル抗ヒト CD15 PE BioLegend Cat# 301906; RRID: AB_314198
マウスモノクローナル抗ヒト CD127a/b (Sirpa/b) PE BioLegend Cat# 323806; RRID: AB_830705
マウスモノクローナル抗ヒト CD45RA Alexa Fluor 700 BioLegend Cat# 304120; RRID: AB_493763
マウスモノクローナル抗ヒト CD3 ブリリアントバイオレット 650 BioLegend Cat# 303430; RRID: AB_2650934
マウスモノクローナル抗ヒト CD19 ブリリアントバイオレット 650 BioLegend Cat# 302238; RRID: AB_2562097
マウスモノクローナル抗ヒト CD56 ブリリアントバイオレット 650 BioLegend Cat# 318344; RRID: AB_2563838
マウスモノクローナル抗ヒト CD5 BV711 BD Biosciences Cat# 563170; RRID: AB_2738044
マウスモノクローナル抗ヒト CD45 PE-CF594 BD Biosciences Cat# 562279; RRID: AB_11154577
マウスモノクローナル抗ヒト CD34 PE Beckman Coulter Cat# IM1250U; RRID: N/A
マウスモノクローナル抗ヒト CD38 PE-Cy7 BioLegend Cat# 303516; RRID: AB_2072782
マウスモノクローナル抗ヒト CD45RA BV510 BioLegend Cat# 304143; RRID: AB_2562822
マウスモノクローナル抗ヒト CD90 PerCP-Cy5.5 eBioscience Cat# 45-0909-42; RRID: AB_10718245
マウスモノクローナル抗ヒト CD10 APC-Cy7 BioLegend Cat# 312212; RRID: AB_2146550
マウスモノクローナル抗ヒト CD197(CCR7)PE-サイ7 BioLegend Cat# 353226; RRID: AB_11126145
マウスモノクローナル抗ヒト CD31 BV605 BD Biosciences Cat# 562855; RRID: AB_2737841
マウスモノクローナル抗ヒト CD24 PE BioLegend Cat# 311106; RRID: AB_314855
マウスモノクローナル抗ヒト CD27 ブリリアントバイオレット 711 BioLegend Cat# 302834; RRID:AB_2563809
マウスモノクローナル抗ヒト IgM PE-CF594 BD Biosciences Cat# 562539; RRID:AB_2737641
マウスモノクローナル抗ヒト IgA1/IgA2 ビオチン BD Biosciences Cat# 555884; RRID: AB_396196
マウスモノクローナル抗ヒト IgG V450 BD Biosciences Cat# 561299; RRID: AB_10611575
マウスモノクローナル抗ヒト CD11a PE BD Biosciences Cat# 555384; RRID: AB_395785
マウスモノクローナル抗ヒト TCR Vdelta2 FITC Beckman Coulter Cat# IM1464; RRID: AB_131019
ラットモノクローナル抗マウス CD45 BV711 BD Biosciences Cat# 563709; RRID:AB_2687455
マウスモノクローナル抗ヒト CD3 Alexa Fluor 488 BioLegend Cat# 300454; RRID:AB_2564149
マウスモノクローナル抗ヒト CD14 Alexa Fluor 647 BioLegend Cat# 325611; RRID: AB_830684
ウサギモノクローナル抗ヒト CD20 標識なし Abcam Cat# ab78237; RRID: AB_1640323
ロバポリクローナル抗ウサギ IgG (H+L) Alexa Fluor 555 Thermo Fisher Scientific Cat# A-31572; RRID: AB_162543
精製マウスモノクローナル抗ヒト CD45 BioLegend Cat# 304002; RRID: AB_314390
抗ヒト CD45-165Ho (MaxPar X8 Antibody Labeling Kit, 165Ho を用いたコンジュゲーション) Fluidigm Cat# 201165B
抗ヒト CD45-175Lu(MaxPar X8 Antibody Labeling Kit, 175Lu を用いてコンジュゲート) Fluidigm Cat# 201175B
抗ヒト CD45-89Y Fluidigm Cat# 3089003B; RRID: AB_2661851
抗ヒト CD326-141Pr Fluidigm Cat# 3141006B; RRID: AB_2687653
精製マウスモノクローナル抗ヒト CD19 BioLegend Cat# 302202; RRID: AB_314232
抗ヒト CD19-142Nd (MaxPar X8 Antibody Labeling Kit, 142Nd を用いたコンジュゲーション) Fluidigm Cat# 201142B
抗ヒト CD117-143Nd Fluidigm Cat# 3143001B; RRID: AB_2687630
抗ヒト CD38-144Nd Fluidigm Cat# 3144014B; RRID: AB_2687640
精製マウスモノクローナル抗ヒト CD4 BioLegend Cat# 300502; RRID: AB_314070
抗ヒト CD4-145Nd(MaxPar X8 Antibody Labeling Kit, 145Nd を用いてコンジュゲート) Fluidigm Cat# 201145B
精製マウスモノクローナル抗ヒト CD8 BioLegend Cat# 301002; RRID: AB_314120
抗ヒト CD8-146Nd(MaxPar X8 Antibody Labeling Kit 146Nd を用いてコンジュゲート) Fluidigm Cat# 201146B
抗ヒト CD7-147Sm Fluidigm Cat# 3147006B; RRID: N/A
精製マウスモノクローナル抗ヒト CD127 BioLegend Cat# 351302; RRID: AB_10718513
抗ヒト CD127-149Sm (MaxPar X8 Antibody Labeling Kit, 149Sm を用いたコンジュゲーション) Fluidigm Cat# 201149B
精製マウスモノクローナル抗ヒト γδ TCR BioLegend Cat# 331202; RRID: AB_1089222
抗ヒト γδ TCR-152Sm(MaxPar X8 Antibody Labeling Kit, 152Sm を用いてコンジュゲート) Fluidigm Cat# 201152B
抗ヒト CD62L-153Eu Fluidigm Cat# 3153004B; RRID: N/A
抗ヒト CD3-154Sm Fluidigm Cat# 3154003B; RRID: AB_2687853
抗ヒト CD10-156Gd Fluidigm Cat# 3156001B; RRID: N/A
抗ヒト CCR4-158Gd Fluidigm Cat# 3158006A; RRID: AB_2687647
抗ヒト CD90-159Tb Fluidigm Cat# 3159007B; RRID: N/A
精製マウスモノクローナル抗ヒト CD14 BioLegend Cat# 301810; RRID: AB_314192
抗ヒト CD14-160Gd(MaxPar X8 Antibody Labeling Kit, 160Gd を用いてコンジュゲート) Fluidigm Cat# 201160B
抗ヒト CD11c-162Dy Fluidigm Cat# 3162005B; RRID: AB_2687635
精製マウスモノクローナル抗ヒト HLA-ABC BioLegend Cat# 311402; RRID: AB_314871
抗ヒト HLA-ABC-163Dy(MaxPar X8 Antibody Labeling Kit, 163Dy を用いたコンジュゲーション) Fluidigm Cat# 201163B
抗ヒト CD34-166Er Fluidigm Cat# 3166012B; RRID: N/A
抗ヒト CCR9-168Er Fluidigm Cat# 3168011A; RRID: N/A
抗ヒト CD45RA-170Er Fluidigm Cat# 3170010B; RRID: AB_2687861
抗ヒト CD11b-172Yb Fluidigm Cat# 3172012B; RRID: AB_2661809
精製マウスモノクローナル抗ヒト HLA-DR BioLegend Cat# 307602; RRID: AB_314680
抗ヒト HLA-DR-174Yb(MaxPar X8 Antibody Labeling Kit, 174Yb を用いたコンジュゲーション) Fluidigm Cat# 201174B
抗ヒト CD56-176Yb Fluidigm Cat# 3176008B; RRID: AB_2661813
生物学的サンプル
ドナー末梢血、脾臓、および/またはリンパ節
臓器灌流液 本紙 N/A
ドナー肝生検 本論文 N/A
患者末梢血、脾臓、および/またはリンパ節 この論文 N/A
患者末梢血、腸管生検、ストーマ再造設組織 本紙 N/A
死亡ドナーの回腸、パイエル板、MLN、BM(Table S3) 本論文 N/A
ヒト胎児胸腺および胎児肝組織 Advanced Bioscience Resources N/A
健常対照末梢血
化学物質、ペプチド、組換えタンパク質
ジチオスレイトール Sigma-Aldrich Cat# 43816
0.5M EDTA ライフテクノロジーズ Cat# 15575020
コラゲナーゼ D Roche Cat# 11088882001
ペニシリン-ストレプトマイシン Thermo Fisher Scientific Cat# 15140122
DNase Sigma-Aldrich Cat# D4527
DAPI カルビオケム、EMD ミリポア Cat# 268298
RPMI 1640 培地 Thermo Fisher Scientific Cat# BW12-167F24
カルボキシフルオレセインスクシンイミジルエステル(CFSE) CellTrace CFSE Proliferation Kit, Molecular Probes Cat# C34554
バイオレット増殖色素 450 BD Horizon Cat# 562158
AIM-V 培地 Life Technologies Cat# 12055-091
ヒト AB 血清 Gemini Bio-Products Cat# 100512
HEPES バッファー Life Technologies Cat# 15630-080
2-メルカプトエタノール Sigma-Aldrich Cat# M3148
ジメチルスルホキシド Sigma-Aldrich Cat# D2650
ヒトメチルセルロース完全培地 R&D Systems Cat# HSC003
α-MEM培地 Life Technologies 社 Cat# 12571-063
組み換えヒト SCF PeproTech Cat# 300-07
組み換えヒト FLT3 リガンド PeproTech Cat# 300-19
インスリンSigma-Aldrich Cat# I9278
組み換えヒト IL-7 R&D Systems Cat# 207-IL-005
ドキシサイクリン Sigma-Aldrich Cat# 24390-14-5
抗 CD2 Ab BioXcell カスタム製品
1xPBS Thermo Fisher Scientific Cat# 10010049
EQ 四元素キャリブレーションビーズ Fluidigm Cat# 201078
ウシ胎児血清(FBS) Thermo Fisher Scientific Cat# SH30071.03HI
リベラーゼ Roche CustomBiotech, Indianapolis, IN Cat# 5401119001
Cell-ID Intercalator-103Rh Fluidigm Cat# 201103A
重要な市販アッセイ
High-throughput TCRβ CDR3 DNA sequencing Adaptive Biotechnologies, Seattle, WA https://www.adaptivebiotech.com/
シグナルジョイント TREC (sjTREC) 解析 Duke Regional Biocontainment Laboratory (RBL) の免疫学ユニット https://shared-resources.dhvi.duke.edu/rbl/rbl-immunology
Mass cytometry (CyTOF) Icahn School of Medicine at Mt. Sinai の Human Immune Monitoring Center https://icahn.mssm.edu/research/human-immune-monitoring-center
BD Influxセルソーターを用いたバルクおよびシングルセルソーティング コロンビア大学CCTIフローサイトメトリーコア http://www.cumc.columbia.edu/ccti/research/cores/flow-cytometry-core
ヒト化マウスモデル コロンビア大学 CCTI のヒト化マウスコア http://www.cumc.columbia.edu/ccti/research/cores/humanized-mouse-core
寄託データ
TCRβ CDR3 DNA シークエンシングデータ ImmuneACCESS, Adaptive Biotechnologies, Seattle, WA https://doi.org/10.21417/FU112018
TCRβ CDR3 DNA配列の解析に使用したRコード GitHubリポジトリ https://github.com/Aleksobrad/TCR-analysis
実験モデル 細胞ライン
マウス MS5-DL1ind100 Lab of Francoise Pflumio; Calvo et al.
実験モデル 生物/株
NOD.scid.Il2Rg-/- (NSG) The Jackson Laboratory Stock# 005557
ソフトウェアとアルゴリズム
GraphPad Prism 6 GraphPad Software https://www.graphpad.com/scientific-software/prism/ RRID:SCR_002798
FlowJo v9 FlowJo, LLC https://www.flowjo.com/solutions/flowjo RRID:SCR_008520
ImmunoSEQ Analyzer 2.0 Adaptive Biotechnologies http://clients.adaptivebiotech.com/login
CyTOF software for viSNE Cytobank https://www.cytobank.org/
R R財団 https://www.r-project.org/
R Studio Foundation for Open Access Statistics (FOAS) https://www.rstudio.com/
EulerAPE Micallef and Rodgers, 2014 該当なし
その他
QIAGEN DNeasy Blood and Tissue Kit QIAGEN Cat# 69504
カスタマイズ系統除去(CD3, CD14, CD19, CD33, CD11b, CD326)MACSキット Miltenyi Biotec Order # 130-095-212
CD34 MicroBead MACS キット Miltenyi Biotec Cat# 130-046-702
試薬およびリソースの共有に関するお問い合わせ
リソースおよび試薬に関するさらなる情報およびリクエストは、主担当者であるMegan Sykes (megan.sykes@columbia.edu)までご連絡ください。
実験モデルと被験者の詳細
被験者の募集と臨床プロトコール
本研究は、コロンビア大学施設審査委員会(IRB# AAAJ5056)の承認を得た。すべての被験者または法的保護者は、書面によるインフォームド・コンセントを提供した。プロトコール生検は、前述(Zuber et al., 2016)のようにITx後の初期に採取され、原因のために追加生検が行われた。移植片拒絶反応は、以前に報告された病理学的スコアリングスキーム(Remotti et al.) 血液サンプルは移植後1ヵ月間に最大4回採取され、その後可能であれば少なくとも1ヵ月に1回採取された。ドナー肝生検と灌流液は、ITxの直前に手術室のバックテーブルで採取した。すべての患者(表S1)は、抗胸腺細胞グロブリン(ATG)導入療法(総投与量:6~10mg/kg)を受け、その後タクロリムスとステロイドを含む維持療法を受けた。
死亡臓器ドナー(表S3)からの回腸(可能であればPPを含む)、MLN、および骨髄(BM)サンプルは、臨床移植のための臓器調達時に、以前に記載されたように(Carpenter et al.) ドナーは慢性疾患や癌がなく、B型肝炎、C型肝炎、HIV陰性であった。使用したサンプルは、組織が死亡した個人から得られたものであるため、コロンビア大学IRBによって確認されたように、ヒト被験者には該当しない。
ヒト胎児胸腺および肝臓組織(妊娠期間、17週から21週)はAdvanced Bioscience Resourcesから入手した。胎児胸腺片は、10%ジメチルスルホキシド(Sigma-Aldrich、ミズーリ州セントルイス)および90%ウシ胎児血清(FBS、Thermo Fisher scientific、マサチューセッツ州ウォルサム)中で凍結保存した。胎児肝臓片を100mg/mLのリベラーゼ(Roche CustomBiotech, Indianapolis, IN)で37℃で20分間処理し、細胞懸濁液を得た。
マウス
この研究は、コロンビア大学のInstitutional Animal Care and Use Committee(IACUC#AC-AAAM8850)の承認を得た。免疫不全NOD.scid.Il2Rg-/-(NSG)マウスは、ジャクソン研究所から購入し、コロンビア大学IACUCに従って、12時間の明暗サイクルで、特定の病原体フリー、Helicobacter/pasteurella pneumotropicaフリーマウス施設で繁殖、飼育、収容し、餌と水を自由摂取させた。本試験でレシピエントとして用いたNSGマウスはすべて8週齢のメスであった。
細胞株
MS5-DL1ind100細胞株は、マウス間質MS5細胞におけるヒトNOTCHリガンドDelta-like 1(DL1)の発現を制御する条件付きテトラサイクリン誘導系として以前に樹立された(Calvo et al. MS5-DL1ind100細胞株の性別は、文献上不明である。我々はパリ・ディドロ大学のFrancoise Pflumio博士とJulien Calvo博士からMS5-DL1ind100細胞株を入手した。MS5-DL1ind100細胞は、10% FBSと1% PenStrep/L-Glutamineを添加したα-MEM培地(Gemini Bio-Products、Broderick、CA)で培養した。
方法の詳細
上皮内リンパ球(IEL)および固有層リンパ球(LPL)の分離
IELおよびLPLは、以前の報告(Bindaら、2009年)から適応され、以前に記載された(Zuberら、2016年)プロトコールに従って、ストーマ閉鎖/切除時に移植片生検標本または外科的に得られた移植片、あるいは死亡ドナーの回腸粘膜から分離した。簡単に説明すると、検体を2mmol/Lジチオスレイトールで37℃で20分間処理した後、0.5mmol/L EDTAで37℃の水浴中で攪拌を続けながら30分間のインキュベーションを2回行った。残りの組織からLPLを単離し、コラゲナーゼ含有培地(RPMI 1640、1mg/mL Collagenase D、100I.U/mL penicillin-streptomycin)中で消化、攪拌した。DNase(0.1mg/mL)をEDTAおよびコラゲナーゼ培地に添加し、大腸粘膜標本を処理した。
ヒト白血球抗原(HLA)特異的染色および細胞染色
候補のモノクローナルHLAクラスI対立遺伝子特異的抗体(mAb)を、分子HLAタイピング情報に基づいて、ドナーと移植前(pre-Tx)レシピエント細胞を識別する能力についてスクリーニングした。FITC、PEまたはビオチン結合HLA特異的mAbはOne LambdaまたはBD Biosciencesから購入した。各HLA特異的mAb(表S2)は、汎HLA-ABC-APCまたはPE (G46-2.6)抗体と組み合わせて使用し、特異性の品質管理を行った。ドナーとTx前のレシピエント末梢血単核細胞(PBMC)を容易に区別するものは、以前に報告されたように、抗体の系統特異的パネルに含まれた(Zuberら、2015)。簡単に言えば、マルチカラーT細胞パネルには、抗CD45-V500(HI30)、CD3-PerCP-Cy5(UCHT1)、γδTCR-PE-Cy7(immu510)、CD4-AF700(OKT4)、CD8-APC-Cy7(SK1)、CD56-BV605(HCD56)、CD19(HIB19)/CD28(V-CD28. 05)-パックブルー、CD69-BV650(FN50)、CD103-PE/FITC(Ber-ACT8)、CD45RO(UCHL1)/CD161(DX12)/HLA-DR(L243)-BV711、NKG-2Dビオチン(1D11)-Strep-AF594およびDAPI。骨髄系譜パネルには、抗CD45-V500、CD33-AF700(WM53)、CD11c-PECy5(B-ly6)、CD14-Pac Blue(M5E2)、HLA-DR-PV711(L243)が含まれた、 CD141-BV711(1A4)、CD123-ビオチン(9F5)-Strep-AF594、CD1c-PE-Cy7(L161)、CD15(HI98)/Sirpα/β(SE5A5)-PE、CD45RA-AF700(HI100)およびDAPI。HSPCパネルには、抗CD3(OKT3)/CD19(HIB19)/CD56(HCD56)-BV650、CD5-BV711(UCHT2)、CD14(M5E2)/CD19(HIB19)-Pac Blue、CD45-PE-CF594(HI30)、CD34-PE(QBEnd10)、CD38-PE-Cy7(HIT2)、CD45RA-BV510(HI100)、CD90-PerCP-Cy5. 5(eBio5E10)、CD10-APC-Cy7(HI10A)、DAPI。ナイーブメモリーT細胞パネルには、抗CD3-PerCP-Cy5.5(UCHT1)、CD4-AF700(OKT4)、CD8-APC-Cy7(SK1)、CD45RA-BV510(HI100)、CCR7-PE-Cy7(G043H7)、CD31-BV605(WM59)、CD28-Pac Blue(V-CD28.05)、HLA-ABC-APC(G46-2.6)およびDAPIが含まれた。Naive B細胞パネルには、抗CD45-V500(HI30)、CD19-BV650(HIB19)、CD38-PE-Cy7(HIT2)、CD24-PE(ML5)、CD27-BV711(O323)、IgM-PE-CF594(G20-127)、IgA-ビオチン(G20-359)-Strep-AF594、IgG-V450(G18-145)およびDAPIが含まれた。ナイーブγδT細胞パネルには、抗CD3-PerCP-Cy5.5(UCHT1)、CD4-AF700(OKT4)、CD8-APC-Cy7(SK1)、CD45RA-BV510(HI100)、CD27 BV711(O323)、CD28-Pac Blue(V-CD28.05)、CD11a-PE(HI111)、δ2-FITC(immu389)、γδTCR-PE-Cy7(immu510)およびDAPIが含まれた。データはLSR IIフローサイトメーター(BD Biosciences, San Jose, CA)を用い、DIVAソフトウェアを用いて取得した。解析はFlowJoソフトウェア(TreeStar, Inc, Ashland, OR)を用いて行った。
カルボキシフルオレセインスクシンイミジルエステル(CFSE)-MLR、細胞選別およびTCRβ CDR3 DNA配列決定
これらは記載されたとおりに実施した(Morrisら、2015、Zuberら、2016)。簡単に言えば、移植片対宿主(GvH)および宿主対移植片(HvG)混合リンパ球反応(MLR)は、解凍したTx前のドナーとレシピエントの細胞を用いてセットアップした。MLR培地(AIM-Vに5%AB熱不活化ヒト血清、0.01M HEPES、50μm 2-メルカプトエタノールを添加)中の丸底96ウェルプレートの各ウェルに、20万個のCFSE標識レスポンダー細胞と20万個のバイオレット色素標識照射(35Gy)刺激細胞をプレーティングした。MLR培養液を37℃で6日間培養し、培養終了時にMLRを回収した。細胞を抗CD3、CD4およびCD8で染色した後、BD™ InfluxセルソーターでFACSソーティングを行い、それぞれCD4+およびCD8+レシピエント-抗ドナー(またはドナー-抗レシピエント)反応性T細胞(「刺激」)を表す、2つの個別のバイオレット色素陰性細胞集団(CD3+CD4+CFSElo、CD3+CD8+CFSElo)を分離した。非刺激細胞集団については、脾臓またはMLNから採取したTx前のドナーとレシピエントの細胞を解凍し、抗CD3、CD4、CD8で染色した後、CD3+CD4+とCD3+CD8+の集団にFACSソーティングした(「unstims」)。QIAGEN DNeasy Blood and Tissue Kit(メリーランド州ジャーマンタウン)を用いて、ソートされた細胞集団からゲノムDNAを単離した。DNAは-20℃で凍結保存され、Adaptive Biotechnologies社(ワシントン州シアトル)にドライアイスで輸送され、高スループットTCR配列決定が行われた。TCR配列決定データはAdaptive社のImmunoseqソフトウェアから取得した。
PCR 増幅、リード配列決定、およびマッピングは、バイアス補正および内部コントロールとともに Adaptive Biotechnologies が実施し、全サンプルにわたる固有のクローン CDR3 DNA 配列に対応するリードカウントを表にして返した。これらから、クローン間のサンプルリード数を検出頻度に正規化した。CD8とCD4のソートエラーは、5:1未満の高頻度と低頻度の比率で両方の集団に存在するあいまいな配列を除去することで補正した。ドナーとレシピエントが共有するCDR3やあいまいな配列は除去された。この後、Tx前の参照サンプル、CFSElow刺激細胞、生検におけるクローン発現頻度を含むCD4とCD8の別々の表がコンパイルされ、再正規化された。アロレアクティブクローンは、刺激されていないプレTx細胞と比較して刺激されたプレTx細胞で2倍以上の拡大があること、およびCFSElowでは最小頻度が0.001%であることで定義され、これは検出力分析(Morris et al.) クロナリティは0から1の範囲で、主に多様性の尺度として用いられ、クロナリティが高いほど多様性が低いことを示す(Langerak et al.、2007)。我々の最近の研究では、存在量プロットのべき乗則の傾きを測定することで、定量的な個体群多様性比較のための新しいアプローチを確立した(DeWolf et al.)
いくつかの実験では、機能的MLRを、反応体としてTx前のドナー脾臓細胞、またはレシピエントPBMCもしくは脾臓細胞(2nd Tx前の脾臓摘出から単離された)から選別されたTx後の全T細胞もしくはCD25- T細胞、および刺激体として照射されたレシピエントのTx前の脾臓細胞または第3者PBMCを用いて設定した。さらに、ドナーHLA+CD3+CFSElow細胞を、MLRの6日目に選別し、その際、Tx後のPBMCから選別したCD25-T細胞をレスポンダーとして用い、照射したレシピエントのTx前の脾臓細胞をスティミュレーターとして用いた。選別されたドナーのHLA+CD3+CFSElow細胞についてTCRβ CDR3 DNA配列決定を行い、ドナーのマッピング可能なクローン内の全配列のパーセンテージとしてのGvHクローンの累積頻度を解析した。「ドナーマッピング可能なクローン」とは、配列決定されたTx前のドナーの脾臓、リンパ節および/またはMLR CFSElow T細胞集団において検出可能なクローンを指す。
ヒトT細胞受容体切除円(TREC)の定量化
Pt1(POD246/365)と2人の健常対照ドナーのPBMCから、ナイーブ(CD45RA+)とメモリー(CD45RO+)CD4+ T細胞を選別した。ナイーブ(CD45RA+CCR7+)および非ナイーブ(CD45RA-CCR7+またはCD45RA-CCR7-またはCD45RA+CCR7-)CD3+ T細胞を、1人の健常対照ドナーから選別した。ナイーブ(CD45RA+CCR7+)CD3+ T細胞は、Pt15(POD255)、Pt16(POD786)、Pt18(POD314)およびPt19(POD167)のPBMCから選別した。細胞ペレットは分析前に-80℃で保存した。シグナル結合TREC(sjTREC)解析は、Duke Regional Biocontainment Laboratory(RBL)の免疫学ユニットで実施した。TREC含量は、ヒトTRECの既知分子の標準曲線を用いた確立されたリアルタイムPCR法を用いて定量した(Geenenら、2003、Sempowskiら、2002)。以下のプライマーとプローブ配列を用いた: 5′プライマー、5′-CACATCCCTTTCAACCATGCT- 3′;3′プライマー、3′GCCAGCTGCAGGGTTTAGG-3′;プローブ、5′-6-FAM-CAGGGCAGGTTTTTGTAAAGGTGCTCACTT-3′BHQ1(ブラックホールクエンチャー)。
マスサイトメトリー(CyTOF)
同じ死亡臓器ドナーから単離したBMおよび回腸LPL細胞をフィコールして単核細胞層を回収した。カスタマイズしたMACSキット(Miltenyi Biotec, Bergisch Gladbach, Germany)を用いて、CD34細胞を濃縮するために系統除去(CD3, CD14, CD19, CD33, CD11b, CD326を含むビオチン標識抗体カクテル)を行った。林BMおよび回腸LPLを染色し、Mt.Sinai Icahn School of MedicineのHuman Immune Monitoring Centerでマスサイトメトリー(CyTOF)(Bendall et al. 簡単に説明すると、細胞を0.2%BSAを含むPBSで洗浄し、死細胞を標識するために1μM Cell-ID Intercalator-103Rh(Fluidigm, South San Francisco, CA)を含むRPMI培地でインキュベートした。洗浄後、BMおよび回腸LPLについて、それぞれCD45-165HoおよびCD45-175Luで細胞をバーコード化した。次に、バーコード化した細胞を組み合わせ、氷上で30分間、選択した表面マーカーに対する抗体で染色した。抗体(CD45-89Y、CD326-141Pr、CD19-142Nd、CD117-143Nd、CD38-144Nd、CD4-145Nd、CD8-146Nd、CD7-147Sm、CD127-149Sm、γδTCR-152Sm、CD62L-153Eu、CD3-154Sm、CD10-156Gd、CCR4-158Gd、CD90-159Tb、CD14-160Gd、CD11c-162Dy、 HLA-ABC-163Dy、CD34-166Er、CCR9-168Er、CD45RA-170Er、CD11b-172Yb、HLA-DR-174YbおよびCD56-176Yb)は、Fluidigmからプレコンジュゲートされた形で入手するか、MaxPar X8コンジュゲーションキット(Fluidigm)を用いて社内でコンジュゲートした。その後、細胞を洗浄・固定し、EQ Four Element Calibration Beads(Fluidigm)を含むdiH2Oに再懸濁し、CyTOF2 Mass Cytometer(Fluidigm)で取得した。データファイルは、ビーズベースの正規化アルゴリズム(CyTOFソフトウェア、Fluidigm)を用いて正規化し、CD45ゲーティングを用いてデバーコードした。ゲーティングされた集団は、Cytobank (https://www.cytobank.org/)のviSNE (Amir et al., 2013)を用いて低次元で可視化され、CD45+/dimCD34+細胞が同定され、CCR9を含む追加マーカーの発現レベルがさらに解析された。
コロニー形成細胞(CFC)アッセイ
死亡臓器提供者から単離したBMおよび回腸LPL細胞をフィコリングし、カスタマイズしたMACSキット(Miltenyi Biotec)を用いてCD34細胞を濃縮するためにリネージ(CD3、CD14、CD19、CD33、CD11b、CD326)を除去した。CD34濃縮BMおよび回腸単核球のCFCアッセイは、記載されているように行った(Kaufmanら、2001、Pereiraら、2007)。細胞再懸濁液と、組換えヒトSCF、GM-CSF、IL-3およびEPOを含むメチルセルロースベースの培地は、R&D Systems社(ミネソタ州ミネアポリス)から購入した。培養期間終了時(14~16 日)に少なくとも 40 個の細胞からなるコロニーを数え、コロニーの種類は細胞の形態によって決定した(Kaufman ら、2001、Pereira ら、2007)。CFU-E:コロニー形成単位-赤血球、CFU-G:コロニー形成単位-顆粒球、BFU-E:バースト形成単位-赤血球、CFU-M:コロニー形成単位-マクロファージ、CFU-GEMM:コロニー形成単位-顆粒球、赤血球、マクロファージ、巨核球。
長期培養開始細胞(LTC-IC)アッセイ
個々の造血幹細胞(Lin-CD45+/dimCD34+/CD38-/lowCD45RA-CD90+)をヒト回腸LPLからBD™ Influxセルソーターで選別し、完全培地50μl中の96ウェルプレートに入れ、10%FBS(Gemini Bio-Products、Broderick、 組換えヒト幹細胞因子(50ng/ml、PeproTech、Rocky Hill、NJ)、rhFlt3-リガンド(20ng/ml、PeproTech、Rocky Hill、NJ)、インスリン(20nM、Sigma-Aldrich、St Louis、MO)およびrhIL-7(10ng/ml、R&D Systems、Minneapolis、MN)の存在下で、10%FBS(Gemini Bio-Products、Broderick、CA)および10%ヒトAB血清(Gemini Bio-Products、Broderick、CA)を補充した再構成α-MEM中でMS5/DL1ind100細胞と接触させた。最初の21日間、培地は週2回半交換した。21日目に、細胞をドキシサイクリン(1μg/ml、Sigma-Aldrich、MO)を添加した新鮮培地に入れた。培養は、週に2~3回培地をリフレッシュしながら21日間続けられた。42~45日目に細胞を回収し、DAPIと3種類の抗ヒト抗体(Alexa 488標識マウス抗ヒトCD3、精製ウサギ抗ヒトCD20と二次標識Alexa 555標識ロバ抗ウサギAb、Alexa 647標識マウス抗ヒトCD14)で標識し、Leica DMI 6000B蛍光顕微鏡(Leica Microsystems, Buffalo Grove, IL)を用いて免疫蛍光イメージング解析を行った。
ヒト化マウスモデル
死亡臓器ドナーから分離したBMおよび回腸LPL細胞をフィコールで遠心分離し、単核細胞層を回収した。BM細胞は陽性選択MACSキット(Miltenyi Biotec)を用いてCD34をさらに濃縮した。回腸LPLを系統除去(CD3、CD14、CD19、CD33、CD11b、CD326)し、カスタマイズしたMACSキット(Miltenyi Biotec)を用いてCD34細胞を濃縮した後、FACSソーティングしてCD45+/dimCD34+集団を集めた。ドナー "A "から得たBM CD34濃縮細胞とドナー "B "から得た腸内Lin-CD45+/dimCD34+細胞を1.5:1から10:1の比率で組み合わせ、放射線照射した(day-1に1Gy/マウス)NSGマウスに静脈注射した。一部の実験では、ヒト胸腺内でのT細胞発生を可能にするために、ドナー「C」からの約1mm3のヒト胎児胸腺組織(妊娠20~21週で採取)も、day-1に腎被膜下にマウスに移植した(Kalscheuerら、2012)(表S4)。NSGマウスは、Tx後最初の2週間に抗CD2 Abを0.4mg/マウスで2-3回投与された。ドナー "A"、"B "および "C "は、FCMにおける対立遺伝子群特異的mAbsを用いて、異なるHLA-A遺伝子座発現により区別した(例えば、ドナー "A": A9+A2-A3-、B: A2+A9-A3-、ドナー "C": A3+A2-A9-)。尾の出血は2~4週目に行い、以後24週目または28週目頃に実験が終了するまで2~4週ごとに行った。ヒト化マウスの末梢血におけるT細胞、B細胞、NK細胞および単球キメリズムの発達をFCMでモニターした。実験終了後、末梢血、BM、脾臓、移植胸腺を採取した。系統マーカー、CD34およびドナー特異的HLA-A遺伝子座を染色し、FCMを用いて解析した。
定量化と統計解析
TCRβレパートリーデータの解析は、標準的なコマンドを用いてRおよびRstudioで行った。EulerAPE(Micallef and Rodgers, 2014)を用いて比例ベン図を作成した。追加の統計および図は、GraphPad Prism(GraphPad Software, La Jolla, CA)を用いて作成した。一対の群間の統計的比較にはスチューデントのt検定を用いた。カイ二乗検定は、末梢血(T細胞の場合)または腸移植片(造血幹細胞の場合)におけるドナーのキメリズムを0.2%として行った。血中T細胞ピークキメリズムが4%以上と4%未満の患者における中等度から重度の拒絶反応からの自由度のKaplan-Meierプロットについて、ログランク(Mantel-Cox)検定を行った。
データとソフトウェアの利用可能性
生のTCR配列データはhttps://doi.org/10.21417/FU112018。TCR配列の解析に使用したコードは、GitHubの公開リポジトリ(https://github.com/Aleksobrad/TCR-analysis)からダウンロードできる。
謝辞
Nicole Casio氏には原稿の提出を手伝っていただき、Isabelle André-Schmutz博士と藤崎丈二博士には原稿の査読をしていただいた。また、Monica Velasco氏、Peter Liou氏、Tamas Gonda氏、Shilpa Ravella氏には腸管移植レシピエントのケアをしていただき、Alina Iuga氏には病理レビューをしていただき、Constantin Aschauer氏にはサンプル処理を手伝っていただいた。MS5-DL1in100細胞株を快く提供してくださったFrancoise PflumioとJulien Calvoに感謝するとともに、LTC-ICの共培養条件の最適化についてご指導いただいた。また、Columbia Center for Translational Immunology(CCTI)およびMt.Sinai Human Immune Monitoring CenterのFlow Cytometry Core、ならびにDuke Medical CenterのRegional Biocontainment Laboratoryの免疫学ユニットの素晴らしいサービスにも感謝する。この研究は、V. Segal and S. Segal CCTI Biobank Coreの支援により得られたサンプルにより一部可能となった。臓器提供組織の調達については、移植コーディネーターおよびLiveOnNYのAmy Friedman博士に感謝する。この研究を可能にしてくれたドナー家族、ITx患者およびその家族の寛大さに感謝する。本研究は、米国国立衛生研究所(NIH)アレルギー感染症研究所(P01 AI106697)の助成を受けた。D.L.F.はNIH助成金AI106697およびAI128949の支援を受けた。ここで報告された研究は、NIHのOffice of the Director(S10RR027050およびS10OD020056)から一部支援を受けたCCTIフローサイトメトリーコアで行われた。
著者貢献
J.F.、J.Z.、M.S.が研究を計画した。J.F.、J.Z.、B.S.、H.W.、S.-p.L.、A.X.、E.E.W.、K.F.、T.M.S.、M.T.S.、X.V.G.が実験を行った。J.F.、J.Z.、M.Martinez.、B.S.、H.W.、S.-p.L.、S.Y.、M.Miron、T.S.、K.R.、A.G.、T.K.がデータを収集した。D.L.F.は臓器提供者からの組織入手をコーディネートし、T.S.とM.Mironは臓器提供者の組織を入手して準備した。J.F.、J.Z.、M.Martinez.、B.S.、A.O.、H.W.、S.-p.L.、A.X.、E.E.W.、K.F.、T.M.S.、M.T.S.、A.R.、S-h.H.、Y.S.、D.L.F.、T.K.、M.S.がデータ解析を行った。Y.S.(上級生物統計学者)とA.O.は、同反応性クローンを同定・追跡するコードを作成し、統計解析を行った。J.F.、J.Z.、M.S.が最終報告書を執筆した。著者全員が最終報告書の編集に貢献した。すべての著者は、提出された原稿の内容すべてに同意した。
利害関係
著者らは、競合する利益はないと宣言している。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード: Acrobat PDFファイルのダウンロード (3MB)
ドキュメントS1。図S1-S7および表S1-S4。
ダウンロード アクロバットPDFファイルのダウンロード(9MB)
資料S2. 論文と補足情報。
参考文献
アブ=エルマグド他、2012年
K.M. Abu-Elmagd、B. Kosmach-Park、G. Costa、M. Zenati、L. Martin、D.A. Koritsky、M. Emerling、N. Murase、G.J. Bond、K. Soltys、他。
腸移植および多臓器移植後の長期生存、栄養学的自律性およびQOL
Ann. Surg., 256 (2012), pp.
スコープで見るGoogle Scholar
アミールら、2013年
el-A.D.アミール、K.L.デイビス、M.D.タドモア、E.F.サイモンズ、J.H.レバイン、S.C.ベンダル、D.K.シェンフェルド、S.クリシュナスワミ、G.P.ノーラン、D.ペエル
viSNEは高次元の単一細胞データの可視化を可能にし、白血病の表現型の不均一性を明らかにする。
Nat. Biotechnol.
CrossRefスコープで見るGoogle Scholar
ベンダルら、2011年
S.C. Bendall, E.F. Simonds, P. Qiu, A.D. Amir, P.O. Krutzik, R. Finck, R.V. Bruggner, R. Melamed, A. Trejo, O.I. Ornatsky, et al.
単一細胞マスサイトメトリーによるヒト造血系連続体における免疫反応と薬物反応の差異の解析
サイエンス, 332 (2011), 687-696頁
CrossRefView in ScopusGoogle Scholar
Bergerら, 2012
M. Berger, A. Zeevi, D.G. Farmer, K.M. Abu-Elmagd
小腸移植における免疫学的課題
Am. J. Transplant., 12 (Suppl 4) (2012), pp.
PDFを見るCrossRefを見るGoogle Scholarを見る
ビンダら、2009
E. Binda, D. Erhart, M. Schenk, C. Zufferey, P. Renzulli, C. Mueller
エルトリエーション遠心法によるマウスおよびヒト腸管上皮内リンパ球の定量的分離
J. Immunol. Methods, 344 (2009), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
ブルデューら、2017年
A. Bourdieu, M. Avalon, V. Lapostolle, S. Ismail, M. Mombled, C. Debeissat, M. Guerinet, P. Duchez, J. Chevaleyre, M. Vlaski-Lafarge, et al.
定常状態の末梢血は、本物の造血幹細胞の機能的・代謝的特徴を持つ細胞を提供する。
J. Cell. Physiol., 233 (2017), pp.
Google Scholar
ブルネット・ド・ラ・グランジュら、2013年
P. Brunet de la Grange, M. Vlaski, P. Duchez, J. Chevaleyre, V. Lapostolle, J.M. Boiron, V. Praloran, Z. Ivanovic
ヒト定常末梢血における長期再増殖造血幹細胞と "サイド集団"
Stem Cell Res. (Amst.), 11 (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
カルボら、2012年
J. カルボ、A.ベンユセフ、J.バイエル、M.C.ルイエ、F.プフルミオ
単一in vitroスクリーニング系を用いたヒト多能性造血幹細胞/前駆細胞の可能性評価
PLoS ONE, 7 (2012), p. e50495
CrossRefスコープで見るGoogle Scholar
カーペンターら、2017年
D.J.カーペンター, T.グラノット, 松岡 直樹, 千田 勉, B.V. Kumar, J.J.C. Thome, C.L. Gordon, M. Miron, J. Weiner, T. Connors, et al.
臓器提供者を用いたヒト免疫学的研究:組織および循環における免疫パラメータへの臨床的変異の影響
Am. J. Transplant., 18 (2017), 74-88頁
ScopusGoogle Scholarで見る
クリステンセンら、2004
J.L.クリステンセン、D.E.ライト、A.J.ウェジャーズ、I.L.ワイズマン
胎児造血幹細胞の循環と走化性
PLoS Biol., 2 (2004), p. E75
グーグル・スカラー
デウルフら、2018
S. DeWolf, B. Grinshpun, T. Savage, S.P. Lau, A. Obradovic, B. Shonts, S. Yang, H. Morris, J. Zuber, R. Winchester, et al.
ヒトT細胞アロレスポンスのサイズと多様性の定量化
JCI Insight, 3 (2018), p. 121256
スコープで見るGoogle Scholar
フーら、2017年
J. Fu, J. Zuber, B. Shonts, A. Obradovic, S.-p. ラウ、T. サベージ、A. シャ、M. シンプソン、S. ヤン、M. ミロン
ヒト腸管移植レシピエントの末梢血におけるドナーT細胞キメリズムの早期と持続のメカニズムの違い
移植, 101 (2017), S63-S64頁
CrossRefGoogle Scholar
Gallacher et al.
L. Gallacher, B. Murdoch, D. Wu, F. Karanu, F. Fellows, M. Bhatia
新規循環ヒト胚性血液幹細胞の同定
ブラッド, 96 (2000), 1740-1747頁
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
ゲーネンら、2003年
V. Geenen, J.F. Poulin, M.L. Dion, H. Martens, E. Castermans, I Hansenne, M. Moutschen, R.P. Sékaly, R. Cheynier
胸腺機能を推定するためのT細胞受容体再配列切除円の定量化:内分泌免疫生理学のための重要な新ツール
J. 内分泌, 176 (2003), 305-311頁
CrossRefScopusで見るGoogle Scholarで見る
ゴールデン-メイソンとオファレリー, 2002
L. ゴールデン-メイソン、C.オファレリー
すべてを手に入れる?成人ヒト肝臓における幹細胞、造血およびリンパ球形成
Immunol. 細胞生物学, 80 (2002), 45-51頁
スコープで見るGoogle Scholar
ゲルゲンスら、2013年
A. Görgens, S. Radtke, P.A. Horn, B. Giebel
ヒト造血系譜の新たな関係は、多能性造血幹細胞および前駆細胞の検出を容易にする
セルサイクル, 12 (2013), 3478-3482頁
CrossRefScopusで見るGoogle Scholarで見る
グラニックら、2012年
J.L.グラニック、S.I.サイモン、D.L.ボージェソン
自然免疫におけるエフェクターとしての造血幹細胞および前駆細胞
骨髄研究, 2012 (2012), p. 165107
Google Scholar
ガイ=グランら, 2003
D. Guy-Grand, O. Azogui, S. Celli, S. Darche, M.C. Nussenzweig, P. Kourilsky, P. Vassalli
臓外T細胞リンパ球増生:無胸腺および真性マウスにおける発生と腸管上皮内リンパ球への寄与
J. Exp. Med., 197 (2003), 333-341ページ
スコープで見るGoogle Scholar
Haddadら、2004年
R. Haddad, P. Guardiola, B. Izac, C. Thibault, J. Radich, A.L. Delezoide, C. Baillou, F.M. Lemoine, J.C. Gluckman, F. Pflumio, B. Canque
臍帯血中の初期ヒトT/NKおよびBリンパ系前駆細胞の分子学的特性解析
Blood, 104 (2004), 3918-3926頁
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
Haddadら、2006年
R. Haddad, F. Guimiot, E. Six, F. Jourquin, N. Setterblad, E. Kahn, M. Yagello, C. Schiffer, I. Andre-Schmutz, M. Cavazzana-Calvo, et al.
ヒト発生過程における胸腺膠着細胞の動態
免疫, 24 (2006), 217-230頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
ヘイゼンバーグら、2001年
M.D. Hazenberg, M.C. Verschuren, D. Hamann, F. Miedema, J.J. van Dongen
最近の胸腺移民のマーカーとしてのT細胞受容体切除円:基本的側面、技術的アプローチ、解釈の指針
J. Mol. Med. (Berl.), 79 (2001), pp.
ScopusGoogle Scholarで見る
Howieら、1998年
D. Howie, J. Spencer, D. DeLord, C. Pitzalis, N.C. Wathen, A. Dogan, A. Akbar, T.T. MacDonald
生後早期におけるヒト腸管外T細胞分化
J. Immunol. 161 (1998), 5862-5872頁
CrossRefScopusで見るGoogle Scholarで見る
Kalscheuer et al.
H. Kalscheuer, N. Danzl, T. Onoe, T. Faust, R. Winchester, R. Goland, E. Greenberg, T.R. Spitzer, D.G. Savage, H. Tahara, et al.
ヒト免疫応答性のin vivo個別化解析モデル
Sci. Transl. Med., 4 (2012), p. 125ra30
スコープで見るGoogle Scholar
加藤ら, 2006
T. Kato, A.G. Tzakis, G. Selvaggi, J.J. Gaynor, A.I. David, A. Bussotti, J.I. Moon, T. Ueno, W. DeFaria, S. Santiago, et al.
小児における腸移植と多臓器移植
Ann. Surg., 243 (2006), 756-764頁
スコープで見るGoogle Scholar
カウフマンら、2001年
D.S.カウフマン、E.T.ハンソン、R.L.ルイス、R.アウエルバッハ、J.A.トムソン
ヒト胚性幹細胞由来の造血コロニー形成細胞
Proc. Natl. Acad. USA, 98 (2001), 10716-10721頁
スコープで見るGoogle Scholar
河合ら, 2011
T. 河合、A.B.コジミ、D.H.サックス
一過性混合キメラによる腎移植寛容誘導に関する前臨床および臨床研究
Curr. Opin. 臓器移植, 16 (2011), pp.366-371
スコープで見るGoogle Scholar
河合ら, 2013
T. 河合、D.H.サックス、M.サイクス、A.B.コジミ、免疫寛容ネットワーク
維持免疫抑制を必要としないHLA不一致腎移植
N. Engl. J. Med., 368 (2013), pp.
CrossRefスコープで見るGoogle Scholar
Kimmigら、2002年
S. Kimmig, G.K. Przybylski, C.A. Schmidt, K. Laurisch, B. Möwes, A. Radbruch, A. Thiel
ヒト成人末梢血におけるT細胞受容体切断円含有量の異なる2つのナイーブTヘルパー細胞サブセット
J. Exp. Med., 195 (2002), pp.
スコープで見るGoogle Scholar
クバルら、2015
C.A.クバル、R.S.マンガス、A.J.テクター
腸移植と多臓器移植:現状と今後の方向性
Curr. Gastroenterol. Rep., 17 (2015), p. 427
Google Scholar
ランゲラックら、2007年
A.W. Langerak, P.J. Groenen, J.H. Jm van Krieken, J.J. van Dongen
免疫グロブリン/T細胞受容体クローナリティ診断法
Expert Opin. Med. Diagn., 1 (2007), 451-461ページ
CrossRefView in ScopusGoogle Scholar
ルフランセら、2017
E. Lefrançais, G. Ortiz-Muñoz, A. Caudrillier, B. Mallavia, F. Liu, D.M. Sayah, E.E. Thornton, M.B. Headley, T. David, S.R. Coughlin, et al.
肺は血小板の生合成部位であり、造血前駆細胞のリザーバーである
Nature, 544 (2017), pp.
CrossRefView in ScopusGoogle Scholar
リンチら、2006年
L. Lynch、D. O'Donoghue、J. Dean、J. O'Sullivan、C. O'Farrelly、L. Golden-Mason
ヒト成体小腸における造血幹細胞の検出と特徴づけ
J. 免疫学, 176 (2006), 5199-5204頁
CrossRefScopusで見るGoogle Scholarで見る
ミカレフ、ロジャース、2014
L. ミカレフ、ロジャース
eulerAPE:楕円を用いた面積比例3ベン図の描画
PLoS ONE, 9 (2014), p. e101717
クロスリーフScopusで表示Google Scholar
モリスら、2015
H. Morris, S. DeWolf, H. Robins, B. Sprangers, S.A. LoCascio, B.A. Shonts, T. Kawai, W. Wong, S. Yang, J. Zuber, et al.
ドナー反応性T細胞の追跡: 寛容な腎移植患者におけるクローン欠失の証拠
Sci. Transl. Med., 7 (2015), p. 272ra10
スコープで見るGoogle Scholar
尾上ら、2010
T. 尾上、H. Kalscheuer、M. Chittenden、G. Zhao、Y.G. Yang、M. Sykes
ヒトT細胞の恒常的な増殖と表現型の転換は、末梢のAPCとの相互作用に依存する
J. 免疫学, 184 (2010), 6756-6765頁
CrossRefView in ScopusGoogle Scholar
ペレイラら、2007年
C. ペレイラ、E.クラーク、J.ダーメン
造血コロニー形成細胞アッセイ
Methods Mol. Biol., 407 (2007), 177-208ページ
CrossRefView in ScopusGoogle Scholar
Remotti et al.
H. Remotti, S. Subramanian, M. Martinez, T. Kato, M.S. Magid
小腸および多臓器移植レシピエントの管理における小腸移植片生検:病理組織学的レビューと臨床的相関性
Arch. Pathol. Lab. Med., 136 (2012), pp.
スコープで見るGoogle Scholar
サエンツら, 2010
S.A. Saenz, M.C. Siracusa, J.G. Perrigoue, S.P. Spencer, J.F. Urban Jr., J.E. Tocker, A.L. Budelsky, M.A. Kleinschek, R.A. Kastelein, T. Kambayashi, et al.
IL25はT(H)2サイトカイン応答を促進する多能性前駆細胞集団を誘発する
ネイチャー, 464 (2010), 1362-1366頁
CrossRefView in ScopusGoogle Scholar
斎藤ら、1998
H. 斉藤秀樹, 金森康夫, 竹森俊夫, 成内秀樹, 久保田英幸, 高橋・岩永宏之, 岩永毅, 石川博之
腸管クリプトパッチに存在する前駆細胞からの腸管T細胞の生成
サイエンス, 280 (1998), 275-278ページ
スコープで見るGoogle Scholar
センポウスキーら、2002年
G.D. Sempowski、M.E. Gooding、H.X. Liao、P.T. Le、B.F. Haynes
加齢マウスにおける胸腺造血のT細胞受容体切除円評価
Mol. 免疫学, 38 (2002), 841-848頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
スミスら、2018
J.M.スミス、T.ウィーバー、M.A.スキーンズ、S.P.ホースレン、A.M.ハーパー、J.J.スナイダー、A.K.イスラーニ、B.L.カシスケ
OPTN/SRTR 2016年年次データ報告:腸
Am. J. Transplant., 18 (Suppl 1) (2018), 254-290頁
PDFを見る記事を見るCrossRefScopusで見るGoogle Scholar
サイクスら、1988a
M. サイクス、M.A.シアード、D.H.サックス
放射線骨髄キメラにおけるT細胞枯渇の影響。II. 寛容破壊に対するその後の抵抗性についての再構成骨髄接種における同種T細胞の必要性
J. Exp. Med., 168 (1988), 661-673ページ
ScopusGoogle Scholarで見る
サイクスら、1988b
M. サイクス、M.A.シアード、D.H.サックス
移植片対宿主関連の免疫抑制は、宿主またはドナーのリンパ造血細胞に対するアロレスポンスによって混合キメラで誘導される。
J. Exp. Med., 168 (1988), 2391-2396頁
ScopusGoogle Scholarで見る
Tanaskovic et al.
S. タナスコヴィッチ、S.フェルナンデス、P.プライス、S.リー、M.A.フレンチ
CD31(PECAM-1)は、ARTに反応したHIV患者において、CD4+ T細胞における最近の胸腺移民のマーカーであるが、CD8+ T細胞やガンマデルタT細胞のマーカーではない。
Immunol. 細胞生物学, 88 (2010), pp.
CrossRefView in ScopusGoogle Scholar
Thomeら、2016a
J.J. Thome, K.L. Bickham, Y. Ohmura, M. Kubota, N. Matsuoka, C. Gordon, T. Granot, A. Griesemer, H. Lerner, T. Kato, D.L. Farber
粘膜およびリンパ系組織におけるヒトT細胞の分化と制御機能の初期コンパートメント化
Nat. Med., 22 (2016), 72-77頁
CrossRefView in ScopusGoogle Scholar
トメら、2016b
J.J.トメ、B.グリンシュプン、B.V. Kumar, M. Kubota, Y. Ohmura, H. Lerner, G.D. Sempowski, Y. Shen, D.L. Farber
リンパ組織部位におけるin situホメオスタシスによるヒトナイーブT細胞の長期維持
科学免疫学, 1 (2016), p. eaah6506
スコープで見るGoogle Scholar
ワンら, 2012
X.Q. Wang, C.M. Lo, L. Chen, C.K. Cheung, Z.F. Yang, Y.X. Chen, M.N. Ng, W.C. Yu, X. Ming, W. Zhang, et al.
肝移植患者における造血キメラと成人ヒト肝臓における造血幹/前駆細胞
肝臓学, 56 (2012), 1557-1566頁
CrossRefView in ScopusGoogle Scholar
Wekerleら、2000年
T. Wekerle, J. Kurtz, H. Ito, J.V. Ronquillo, V. Dong, G. Zhao, J. Shaffer, M.H. Sayegh, M. Sykes
共刺激遮断を用いた同種骨髄移植は、細胞還元的宿主治療を行わずにマクロキメリズムと寛容を誘導する。
Nat. Med., 6 (2000), 464-469頁
スコープで見るGoogle Scholar
ウィリアムズら、2004年
A.M. Williams、P.W. Bland、A.C. Phillips、S. Turner、T. Brooklyn、G. Shaya、R.D. Spicer、C.S. Probert
ヒト乳幼児における腸管αβT細胞の分化と抗原受容体遺伝子のin situ再配列
J. 免疫学, 173 (2004), 7190-7199頁
CrossRefView in ScopusGoogle Scholar
ライトら、2001年
D.E. Wright、A.J. Wagers、A.P. Gulati、F.L. Johnson、I.L. Weissman
造血幹細胞および前駆細胞の生理的移動
サイエンス, 294 (2001), 1933-1936頁
スコープで見るGoogle Scholar
ZlotoffおよびBhandoola, 2011
D.A.ズロトフ、A.バンドーラ
造血前駆細胞の成体胸腺への移動
Ann. N Y Acad. Sci., 1217 (2011), 122-138ページ
CrossRefスコープで見るGoogle Scholar
Zuber et al.
J. Zuber, S. Rosen, B. Shonts, B. Sprangers, T.M. Savage, S. Richman, S. Yang, S.P. Lau, S. DeWolf, D. Farber, et al.
腸移植におけるマクロキメリズム:GVHDを伴わない低拒絶反応率および多臓器移植との関連性
Am. J. Transplant., 15 (2015), pp.
PDFを見る記事を見るCrossRefScopusで見るGoogle Scholar
Zuber et al.
J. Zuber, B. Shonts, S.P. Lau, A. Obradovic, J. Fu, S. Yang, M. Lambert, S. Coley, J. Weiner, J. Thome, et al.
双方向の移植片内反応性はヒト腸移植片の再増殖を促進し、臨床転帰と相関する。
科学免疫学, 1 (2016), p. eaah3732
Scopusで見るGoogle Scholar
引用者: (36)
腸管移植後のヒト回腸生検から分離した上皮内T細胞および前膜T細胞のキメリズムと表現型解析
2023, STARプロトコル
抄録を表示
ヒト腎臓由来造血幹細胞は、多系統造血を長期間維持できる
2023, Kidney International
引用抜粋:
したがって、アザチオプリンやミコフェノール酸モフェチルのようなプリン合成を阻害する薬剤を含む免疫抑制レジメンは、SIOD免疫細胞の増殖をさらに阻害することにより、移植後のバランスをドナーT細胞側に傾ける可能性がある。混合キメラの持続は、肝移植、腸移植、多臓器移植8,12,18後に自然発生する可能性があり、これは移植臓器に存在する造血組織に由来するドナーのHSPCsがレシピエントのBMを再増殖する能力に起因する。
抄録を表示
骨髄外の造血幹細胞および前駆細胞:どこで、いつ、そしてなぜ
2021年、実験血液学
引用抜粋:
私たちのグループは、ヒト脾臓にも再増殖HSPCsが存在することを突き止めたが、その頻度や生着レベルは低い[55]。さらに、肝移植や腸移植を受けた患者の中には、移植後5年まで、混在した、そしてしばしば多系統の血液キメラが観察されることがある[25,32,60]。このことは、ヒトの前駆細胞や幹細胞の機能が、EM組織で長期間維持できることを示している。1つの重要な疑問は、EM HSPCがそのEM組織の永続的な住人なのか、それとも一過性の住人なのかということである。
抄録を表示
ヒト固形臓器および造血幹細胞移植後のアロエ反応性T細胞クローンの定義と追跡のための統合解析ツールセット【数式あり
2021年、ソフトウェアへの影響
抄録を表示
LauroとZorzettiへの反応
2021年、粘膜免疫学
同種固形組織受容のための工学的戦略
2021年、分子医学の動向
抄録を表示
全ての引用論文をScopusで見る
7
リードコンタクト
© 2018 Elsevier Inc.
エルゼビアのロゴとワードマーク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect®はElsevier B.V.の登録商標です。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
