発がんにおける口腔連鎖球菌の謎を解く
2024年3月20日
発がんにおける口腔連鎖球菌の謎を解く
https://journals.asm.org/doi/10.1128/mmbr.00095-23?utm_source=twitter&utm_medium=social&utm_content=ASM&utm_id=falcon&utm_campaign=MicrobiologyandMolecularBiologyReviews
著者 Sangeetha Senthil Kumar https://orcid.org/0000-0002-1004-0773, Michael D. L. Johnson https://orcid.org/0000-0002-6347-0208 mdljohnson@arizona.edu, Justin E. Wilson https://orcid.org/0000-0002-2803-3280 wilsonje@arizona.eduAUTHORS 情報と提携
DOI: https://doi.org/10.1128/mmbr.00095-23
引用
アクセス
MMBR
オンライン・ファースト
概要
参考文献
情報&寄稿者
指標と引用
アクセス
参考文献
シェア
要旨
ストレプトコッカス属は、分類学的に多様なグラム陽性菌群から構成されており、その生理学的および病原学的特性により、科学的に大きな関心を集めている。ストレプトコッカス属の中でも、ビリダンス型連鎖球菌(VGS)は口腔内の生態系において重要な役割を果たしており、口腔バイオフィルムの約80%を構成している。付着、代謝シグナル伝達、クオラムセンシングなどの多面的な相互作用を伴う口腔における先駆的なコロニー形成者としての連鎖球菌の主な役割は、口腔バイオフィルムの複雑な動態に大きく寄与し、口腔の健康と疾患の転帰を形成している。口腔内連鎖球菌の組成の乱れは口腔内のディスバイオシスを引き起こし、その結果、宿主と病原体の相互作用に影響を与え、口腔内の炎症を引き起こし、日和見病原体としてのVGSを代表する。食道、胃、膵臓、結腸にまたがる遠隔臓器の腫瘍における口腔内連鎖球菌の関連は、口腔内連鎖球菌、炎症、腫瘍形成の間の潜在的な関連性を明らかにしている。この知見は、粘膜の恒常性維持における口腔連鎖球菌の役割と発癌への関与についてさらなる研究が必要であることを強調している。従って、ここでは、口腔連鎖球菌のバイオフィルム動態における意義と、その摂動が癌の文脈における粘膜免疫病態形成にどのような影響を及ぼす可能性があるかについて概説し、癌の介入や非侵襲的癌診断の開発のために口腔連鎖球菌を利用することを展望する。
この論文にアクセスする
購入可能なオプションをすべて表示し、この記事にフルアクセスする。
アクセスする
既に購読されていますか?個人として、または所属機関を通じてサインインする
参考文献
1.
Whipps JM, Lewis K, Cooke RC. 1988. 菌類寄生と植物病害防除, p 161-187. In Burge NM (ed), Fungi in biological control systems. Manchester University Press.
Google Scholar
2.
Prescott SL. 2017. 医学の歴史:マイクロバイオームという用語の起源とそれが重要な理由。Human Microbiome J 4:24-25.
Crossref
Google Scholar
3.
Lederberg J, McCray AT. 2001. Ome sweet 'Omics - a genealogical treasury of words. 言葉の系譜の宝庫。Sci 15:8.
Google Scholar
4.
Aggarwal N, Kitano S, Puah GRY, Kittelmann S, Hwang IY, Chang MW. 2023. マイクロバイオームとヒトの健康:現在の理解、工学、実現技術。Chem Rev 123:31-72.
クロスレフ
PubMed
国際標準化機構
Google Scholar
5.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. 2018. ヒトマイクロバイオームの現在の理解。Nat Med 24:392-400.
Crossref
PubMed
国際微生物学連合
Google Scholar
6.
Sender R, Fuchs S, Milo R. 2016. ヒトと細菌の体内細胞数の推定値の改訂。PLoS Biol 14:e1002533.
Crossref
PubMed
国際標準化機構
Google Scholar
7.
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, et al. 2010. メタゲノム配列決定によって確立されたヒト腸内細菌遺伝子カタログ。Nature 464:59-65.
クロスレフ
PubMed
ISI研究所
Google Scholar
8.
Kilian M, Chapple ILC, Hannig M, Marsh PD, Meuric V, Pedersen AML, Tonetti MS, Wade WG, Zaura E. 2016. The oral microbiome - an update for oral healthcare professionals. Br Dent J 221:657-666.
Crossref
PubMed
国際標準化機構
Google Scholar
9.
Hou K, Wu Z-X, Chen X-Y, Wang J-Q, Zhang D, Xiao C, Zhu D, Koya JB, Wei L, Li J, Chen Z-S. 2022. 健康と疾患における微生物叢。Sig Transduct Target Ther 7:135.
Crossref
PubMed
グーグル奨学生
10.
Caselli E, Fabbri C, D'Accolti M, Soffritti I, Bassi C, Mazzacane S, Franchi M. 2020. 全ゲノムシークエンシングとレジストーム解析による口腔マイクロバイオームの定義:健康像の複雑さ。BMC Microbiol 20:120.
Crossref
PubMed
ISIについて
Google Scholar
11.
McLean AR, Torres-Morales J, Dewhirst FE, Borisy GG, Mark Welch JL. 2022. 口腔マイクロバイオームにおける連鎖球菌の部位対向性。Mol Oral Microbiol 37:229-243.
クロスレフ
PubMed
Google Scholar
12.
Gross EL, Beall CJ, Kutsch SR, Firestone ND, Leys EJ, Griffen AL. 2012. Streptococcus mutans(ミュータンス連鎖球菌)を超えて:16S rRNAコミュニティ分析による複数の菌種に関連するう蝕の発症。PLoS One 7:e47722.
クロスレフ
PubMed
ISI社
Google Scholar
13.
Richards VP, Alvarez AJ, Luce AR, Bedenbaugh M, Mitchell ML, Burne RA, Nascimento MM. 2017. 齲蝕状態の異なる小児の部位特異的歯垢のマイクロバイオーム。Infect Immun 85.
クロスレフ
国際齲蝕学会
Google Scholar
14.
Abusleme L, Dupuy AK, Dutzan N, Silva N, Burleson JA, Strausbaugh LD, Gamonal J, Diaz PI. 2013. 健康状態および歯周炎における歯肉縁下マイクロバイオームと、コミュニティバイオマスおよび炎症との関係。ISME J 7:1016-1025.
クロスレフ
PubMed
国際歯周病学会
Google Scholar
15.
Ai D, Huang R, Wen J, Li C, Zhu J, Xia LC. 2017. Integrated d metagenomic dalysis demonstrates that a loss of diversity in oral microbiota is associated with periodontitis. BMC Genomics 18:1041.
Crossref
PubMed
ISI社
Google Scholar
16.
Dani S, Prabhu A, Chaitra KR, Desai NC, Patil S, Rajeev R. 2016. 健康対歯肉炎および慢性歯周炎におけるストレプトコッカス・ミュータンスの評価:臨床微生物学的研究。Contemp Clin Dent 7:529.
Crossref
PubMed
Google Scholar
17.
Rams TE, Degener JE, van Winkelhoff AJ. 2014. ヒト慢性歯周炎の細菌叢における抗生物質耐性。J Periodontology 85:160-169.
クロスレフ
PubMed
国際歯周病学会
Google Scholar
18.
López-López A, Camelo-Castillo A, Ferrer MD, Simon-Soro Á, Mira A. 2017. 口腔プロバイオティクスとしての健康関連ニッチ住民:Streptococcus dentisaniの場合。Front Microbiol 8:379.
Crossref
PubMed
国際インフルエンザ学会
Google Scholar
19.
Marsh PD, Do T, Beighton D, Devine DA. 2016. 唾液が口腔微生物叢に及ぼす影響。Periodontology 2000 70:80-92.
Crossref
PubMed
国際歯周病学会
Google Scholar
20.
Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner ACR, Yu W-H, Lakshmanan A, Wade WG. 2010. ヒト口腔マイクロバイオーム。J Bacteriol 192:5002-5017.
クロスレフ
PubMed
ISI研究所
Google Scholar
21.
Baker JL, Mark Welch JL, Kauffman KM, McLean JS, He X. 2024年。口腔マイクロバイオーム:多様性、生物地理学、ヒトの健康。Nat Rev Microbiol 22:89-104.
Crossref
PubMed
ISI研究所
Google Scholar
22.
Kleinberg I. 2002. う蝕の原因における口腔内細菌の役割を理解するための混合細菌生態学的アプローチ:ストレプトコッカス・ミュータンスと特異的プラーク仮説の代替案。Crit Rev Oral Biol Med 13:108-125.
クロスレフ
PubMed
Google Scholar
23.
高橋直樹 2005.口腔内の生態系:生態学的ニッチにおける代謝の多様性と口腔疾患との関係. Inter Cong Ser 1284:103-112.
Crossref
Google Scholar
24.
Donlan RM, Costerton JW. 2002. バイオフィルム:臨床的に重要な微生物の生存メカニズム。Clin Microbiol Rev 15:167-193.
クロスレフ
PubMed
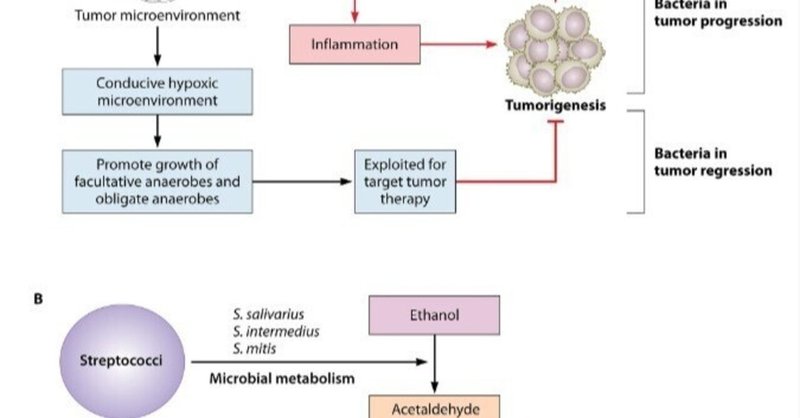
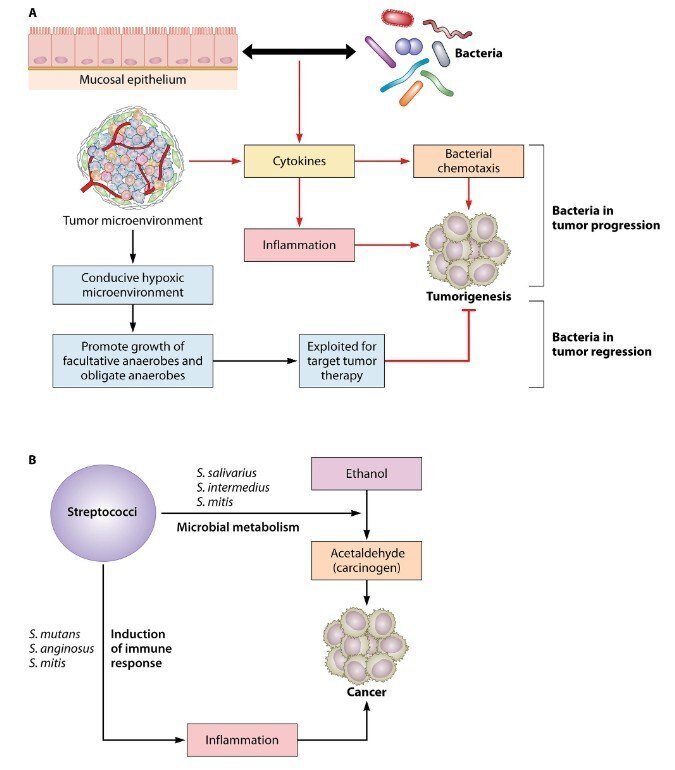
国際医療福祉大学
Google Scholar
25.
Almeida E, Puri S, Labossiere A, Elangovan S, Kim J, Ramsey M. 2023. 口腔常在菌Corynebacterium matruchotiiとStreptococcus mitisの生物地理学的配置は、細菌の多種間相互作用メカニズムによって決まる。
クロスレフ
パブコメ
Google Scholar
26.
Zuber P, Kreth J. 2023. 口腔連鎖球菌の代謝多様性の側面:霧の下の風景を想像する。Mol Microbiol 120:508-524.
Crossref
PubMed
国際標準化機構
Google Scholar
27.
Thomas AM, Gleber-Netto FO, Fernandes GR, Amorim M, Barbosa LF, Francisco ALN, de Andrade AG, Setubal JC, Kowalski LP, Nunes DN, Dias-Neto E. 2014. Alcohol and tobacco consumption affects bacterial richness in oral cavity mucosa biofilms. BMC Microbiol 14:250.
Crossref
PubMed
国際標準化機構
Google Scholar
28.
Marsh PD. 2003. 歯科疾患は生態学的大災害の例であるか?微生物学(読書)149:279-294。
クロスレフ
PubMed
国際インフルエンザ学会
Google Scholar
29.
Mark Welch JL, Rossetti BJ, Rieken CW, Dewhirst FE, Borisy GG. 2016. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci U S A 113:E791-800.
クロスレフ
PubMed
国際標準化機構
Google Scholar
30.
Mark Welch JL, Dewhirst FE, Borisy GG. 2019. 口腔マイクロバイオームの生物地理学:部位特異的仮説。Annu Rev Microbiol 73:335-358.
Crossref
パブコメ
ISI社
Google Scholar
31.
アンドレAC、デバンデL、マルテインBS。2021. 通性嫌気性菌の選択的優位性は、感染時に変化する酸素レベルに対処する独自の能力に依存している。Cell Microbiol 23:e13338.
Crossref
PubMed
ISI研究所
Google Scholar
32.
Stieglmeier M, Wirth R, Kminek G, Moissl-Eichinger C. 2009. 宇宙船関連クリーンルームからの嫌気性・通性嫌気性細菌の培養。Appl Environ Microbiol 75:3484-3491.
クロスレフ
PubMed
国際標準化機構
Google Scholar
33.
Echlin H, Frank MW, Iverson A, Chang T-C, Johnson MDL, Rock CO, Rosch JW. 2016. Streptococcus pneumoniae(肺炎球菌)の代謝とカプセル生合成の間の重要なリンクとしてのピルビン酸オキシダーゼ。PLoS Pathog 12:e1005951.
Crossref
PubMed
ISI社
Google Scholar
34.
Lisher JP, Tsui H-CT, Ramos-Montañez S, Hentchel KL, Martin JE, Trinidad JC, Winkler ME, Giedroc DP. 2017. Streptococcus pneumoniaeにおける内因性過酸化水素産生に対する生物学的および化学的適応。
Crossref
PubMed
Google Scholar
35.
Redanz S, Treerat P, Mu R, Redanz U, Zou Z, Koley D, Merritt J, Kreth J. 2020. 口腔連鎖球菌によるピルビン酸分泌は、過酸化水素依存性の拮抗作用を調節する。ISME J 14:1074-1088.
Crossref
PubMed
国際標準化機構
Google Scholar
36.
山本恭子、Poyart C、Trieu-Cuot P、Lamberet G、Gruss A、Gaudu P. 2005. B群レンサ球菌の呼吸代謝は環境中のヘムやキノンによって活性化され、病原性に寄与する。Mol Microbiol 56:525-534.
クロスレフ
PubMed
ISI研究所
Google Scholar
37.
Abranches J, Zeng L, Kajfasz JK, Palmer SR, Chakraborty B, Wen ZT, Richards VP, Brady LJ, Lemos JA. 2018. 口腔連鎖球菌の生物学。Microbiol Spectr 6:10-128.
Crossref
Google Scholar
38.
前田泰志、Goldsmith CE、Coulter WA、Mason C、Dooley JS、Lowery CJ、Moore JE. 2010. ビリダンス型連鎖球菌。Rev Med Microbiol 21:69-79.
クロスレフ
ISIについて
Google Scholar
39.
Doern CD, Burnham C-AD. 2010. 緑色であることは容易ではない:ビリダンス群連鎖球菌、小児の臨床症状を中心に。J Clin Microbiol 48:3829-3835.
Crossref
PubMed
国際インフルエンザ学会
Google Scholar
40.
Yaniv LG, Potasman I. 2000. 異所性髄膜炎:耐性ビリダンス型連鎖球菌の役割の増大?症例報告と過去20年間のレビュー。Scand J Infect Dis 32:693-696.
クロスレフ
PubMed
ISI研究所
Google Scholar
41.
Cahill TJ, Prendergast BD. 2016. 感染性心内膜炎。Lancet 387:882-893.
Crossref
PubMed
国際放射線学会
Google Scholar
42.
Salman HA, Senthilkumar R, Imran K, Selvam KP. 2017. う蝕活動性の被験者からのStreptococcus mutansおよびStreptococcus sobrinusの分離とタイピング。Contemp Clin Dent 8:587.
Crossref
PubMed
Google Scholar
43.
河村祐一郎、Hou XG、Sultana F、三浦博之、江崎友紀:1995.Streptococcus mitisおよびStreptococcus gordoniiの16S rRNA塩基配列の決定と系統樹。Streptococcus mitisおよびStreptococcus gordoniiの16S rRNA配列の決定とStreptococcus属のメンバー間の系統関係。Int J Syst Bacteriol 45:406-408.
クロスレフ
パブコメ
Google Scholar
44.
Menon T. 2016. ビリジアン群連鎖球菌の理解:我々はまだそこにいる?Indian J Med Microbiol 34:421-426.
Crossref
PubMed
国際標準化機構
Google Scholar
45.
Dhotre S, Suryawanshi N, Nagoba B, Selkar S. 2016. ヒト口腔から分離されたビリダンス連鎖球菌のまれで珍しい菌株。Indian J Pathol Microbiol 59:47-49.
Crossref
PubMed
国際インフルエンザ学会
Google Scholar
46.
O'Connell LM, Blouin T, Soule A, Burne RA, Nascimento MM, Richards VP. 2022. 口腔内連鎖球菌の分類学的プロファイリングにおける30S-S11 rRNA遺伝子の最適化と評価。Appl Environ Microbiol 88.
クロスレフ
PubMed
ISI社
Google Scholar
47.
高田和彦、林和彦、佐々木健一、佐藤貴志、平澤正明 2006.イヌ口腔連鎖球菌に対するmitis salivarius寒天培地の選択性と新しい選択培地. J Microbiol Methods 66:460-465.
クロスレフ
PubMed
国際標準化機構
Google Scholar
48.
Hardie JM, Whiley RA. 2006. ストレプトコッカス属--口腔内。The prokaryotes 4:76-107.
Crossref
Google Scholar
49.
Krzyściak W, Pluskwa KK, Jurczak A, Kościelniak D. 2013. レンサ球菌属の病原性。Eur J Clin Microbiol Infect Dis 32:1361-1376.
Crossref
PubMed
ISIについて
Google Scholar
50.
Lannes-Costa PS, de Oliveira JSS, da Silva Santos G, Nagao PE. 2021. J Appl Microbiol 131:1600-1620.
クロスレフ
PubMed
国際標準化機構
Google Scholar
51.
Haenni M, Lupo A, Madec JY. 2018. ストレプトコッカス属における抗菌薬耐性 Microbiol Spectr 6.
Crossref
Google Scholar
52.
Sanchez-Rosario Y, Johnson MDL. 2021. 歴史的、近代的な肺炎球菌増殖培地と、それらが影響する実験を検証する。Front Cell Infect Microbiol 11:613623.
Crossref
PubMed
ISI社
Google Scholar
53.
Jakubovics NS, Kolenbrander PE. 2010. The road to ruin: the formation of disease associated oral biofilms. Oral Dis 16:729-739.
Crossref
PubMed
ISI研究所
Google Scholar
54.
スキャナピエコFA。1994. 口腔微生物生態学における唾液と細菌の相互作用。Crit Rev Oral Biol Med 5:203-248.
Crossref
PubMed
グーグル奨学生
55.
Kolenbrander PE, Palmer RJ, Rickard AH, Jakubovics NS, Chalmers NI, Diaz PI. 2006. 歯垢の形成過程における細菌の相互作用と継代。Periodontology 2000 42:47-79.
クロスレフ
PubMed
国際歯周病学会
Google Scholar
56.
Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. 2005. 口腔の正常細菌叢の定義。J Clin Microbiol 43:5721-5732.
Crossref
PubMed
ISI研究所
Google Scholar
57.
Bik EM, Long CD, Armitage GC, Loomer P, Emerson J, Mongodin EF, Nelson KE, Gill SR, Fraser-Liggett CM, Relman DA. 2010. 健康な10人の口腔内の細菌多様性。ISME J 4:962-974.
Crossref
PubMed
国際医療福祉大学
Google Scholar
58.
倉光宏, He X, Lux R, Anderson MH, Shi W. 2007. 口腔微生物群集における種間相互作用。Microbiol Mol Biol Rev 71:653-670.
Crossref
PubMed
国際標準化機構
Google Scholar
59.
Li J, Helmerhorst EJ, Leone CW, Troxler RF, Yaskell T, Haffajee AD, Socransky SS, Oppenheim FG. 2004. ヒト歯科用バイオフィルムにおける初期コロニー形成微生物の同定。J Appl Microbiol 97:1311-1318.
Crossref
PubMed
国際インフルエンザ学会
Google Scholar
60.
Nyvad B, Kilian M. 1990. う蝕活動者とう蝕非活動者におけるエナメル質上の初期連鎖球菌微生物叢の比較。Caries Res 24:267-272.
Crossref
PubMed
国際インフルエンザ学会
Google Scholar
61.
Diaz PI, Valm AM. 2020. 口腔コミュニティにおける微生物間相互作用は、創発性バイオフィルムの特性を媒介する。J Dent Res 99:18-25.
Crossref
PubMed
ISI研究所
Google Scholar
62.
Rosan B, Lamont RJ. 2000. 歯垢の形成。Microbes Infect 2:1599-1607.
クロスレフ
PubMed
国際歯垢学会
Google Scholar
63.
Couvigny B, Kulakauskas S, Pons N, Quinquis B, Abraham A-L, Meylheuc T, Delorme C, Renault P, Briandet R, Lapaque N, Guédon E. 2018. パイオニア常在細菌Streptococcus salivariusの接着能力を調節する新規因子の同定。Front Microbiol 9:273.
Crossref
PubMed
国際標準化機構
Google Scholar
64.
Nobbs AH, Zhang Y, Khammanivong A, Herzberg MC. 2007. Streptococcus gordonii hsaは、Streptococcus sanguinisの唾液コーティングハイドロキシアパタイトへの競合的結合を環境的に制約する。J Bacteriol 189:3106-3114.
クロスレフ
PubMed
ISI社
Google Scholar
65.
クックGS、コスタートンJW、ラモントRJ。1998. Porphyromonas gingivalisおよびStreptococcus gordoniiによるバイオフィルム形成。J of Periodontal Research 33:323-327.
Crossref
PubMed
国際歯周病学会
Google Scholar
66.
前田和彦, 永田裕之, 山本恭子, 田中幹男, 田中淳一, 南野直樹, 雫石誠一郎, 2004. Streptococcus oralisのGlyceraldehyde-3-phosphate dehydrogenaseはPorphyromonas gingivalis major fimbriaeのcoadhesinとして機能する。Infect Immun 72:1341-1348.
クロスレフ
PubMed
ISI研究所
Google Scholar
67.
Park Y, Simionato MR, Sekiya K, Murakami Y, James D, Chen W, Hackett M, Yoshimura F, Demuth DR, Lamont RJ. 2005. porphyromonas gingivalisの短いフィンブリアとStreptococcus gordoniiとの接着におけるその役割。Infect Immun 73:3983-3989.
日本
PubMed
ISI研究所
Google Scholar
68.
Bamford CV, d'Mello A, Nobbs AH, Dutton LC, Vickerman MM, Jenkinson HF. 2009. Streptococcus gordonii(ゴルドニー連鎖球菌)は、カンジダ・アルビカンス(Candida albicans)のバイオフィルム形成を世代間コミュニケーションを通じて調節する。Infect Immun 77:3696-3704.
Crossref
PubMed
ISI研究所
Google Scholar
69.
Xu H, Jenkinson HF, Dongari-Bagtzoglou A. 2014. Streptococcus-candida interactions in oral health and disease: Mechanism and roles of Streptococcus-candida interactions in oral health and disease. Mol Oral Microbiol 29:99-116.
クロスレフ
PubMed
Google Scholar
70.
Yang R, Liu T, Pang C, Cai Y, Lin Z, Guo L, Wei X. 2022. Fusobacterium nucleatumとStreptococcus gordoniiの共凝集がヒト歯肉上皮細胞に対する相乗毒性に及ぼす制御効果。Front Cell Infect Microbiol 12:879423.
クロスレフ
PubMed
ISI社
Google Scholar
71.
Kaplan CW, Lux R, Haake SK, Shi W. 2009. フソバクテリウム・ヌクレアタム(Fusobacterium nucleatum)外膜タンパク質RadDは、種間接着と多種バイオフィルムの構造構築に必要なアルギニン阻害性接着剤である。Mol Microbiol 71:35-47.
クロスレフ
PubMed
ISI社
Google Scholar
72.
Lima BP, Shi W, Lux R. 2017. Streptococcus gordoniiとの物理的相互作用およびバイオフィルム形成に関与する新規Fusobacterium nucleatumアドヘシンの同定と特性解析。Microbiologyopen 6:e00444.
クロスレフ
PubMed
Google Scholar
73.
Daep CA, Novak EA, Lamont RJ, Demuth DR. Porphyromonas gingivalisのStreptococcus gordoniiへの接着を阻害するペプチドの構造解析とInvivoでの有効性。Infect Immun 79:67-74.
Crossref
PubMed
国際医療福祉大学
Google Scholar
74.
Hendrickson EL, Beck DAC, Miller DP, Wang Q, Whiteley M, Lamont RJ, Hackett M. 2017. Time-coursed RNA-Seqによって明らかになった動的な多細菌シナジーへの洞察。Front Microbiol 8:261.
Crossref
PubMed
国際標準化機構
グーグル
75.
Kuboniwa M, Houser JR, Hendrickson EL, Wang Q, Alghamdi SA, Sakanaka A, Miller DP, Hutcherson JA, Wang T, Beck DAC, Whiteley M, Amano A, Wang H, Marcotte EM, Hackett M, Lamont RJ. 2017. Metabolic crosstalk regulates porphyromonas gingivalis colonization and virulence during oral polymicrobial infection. Nat Microbiol 2:1493-1499.
クロストーク
PubMed
Google Scholar
76.
Nes IF, Diep DB, Holo H. 2007. 連鎖球菌と腸球菌におけるバクテリオシンの多様性。J Bacteriol 189:1189-1198.
Crossref
PubMed
ISI社
Google Scholar
77.
Upton M, Tagg JR, Wescombe P, Jenkinson HF. 2001. サリバリウス連鎖球菌(Streptococcus salivarius)と化膿連鎖球菌(Streptococcus pyogenes)間の、SalAおよびSalA1ランタ抗生ペプチドを介した種内および種間シグナル伝達。J Bacteriol 183:3931-3938.
クロスレフ
PubMed
ISI社
Google Scholar
78.
Kreth J, Zhang Y, Herzberg MC. 2008. 口腔バイオフィルムにおけるレンサ球菌の拮抗作用: Streptococcus sanguinisとStreptococcus gordoniiのStreptococcus mutansに対する干渉。J Bacteriol 190:4632-4640.
クロスレフ
PubMed
ISI研究所
Google Scholar
79.
Wescombe PA, Heng NCK, Burton JP, Chilcott CN, Tagg JR. 2009. ストレプトコッカス・バクテリオシンと、口腔内プロバイオティクスのモデルとしてのストレプトコッカス・サリバリウス(Streptococcus salivarius)の事例。Future Microbiol 4:819-835.
クロスレフ
PubMed
ISI社
Google Scholar
80.
Egland PG, Palmer RJ, Kolenbrander PE. 2004. Streptococcus gordonii-Veillonella atypicaバイオフィルムにおける種間コミュニケーション:フロー条件下でのシグナル伝達には並置が必要である。Proc Natl Acad Sci U S A 101:16917-16922.
クロスレフ
パブコメ
ISI社
Google Scholar
81.
Brown SA, Whiteley M. 2007. アグリガティバクター・アクチノマイセテムコミタンスにおける炭素資源分配の新しい排除機構。J Bacteriol 189:6407-6414.
Crossref
PubMed
ISIについて
Google Scholar
82.
Cvitkovitch DG, Li Y-H, Ellen RP. 2003. 連鎖球菌感染症におけるクオラムセンシングとバイオフィルム形成。J Clin Invest 112:1626-1632.
クロスレフ
PubMed
ISI研究所
Google Scholar
83.
Surette MG, Miller MB, Bassler BL. 1999. Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: a new family of genes responsible for autoinducer production. Proc Natl Acad Sci U S A 96:1639-1644.
クロスレフ
パブコメ
ISI社
Google Scholar
84.
McNab R, Ford SK, El-Sabaeny A, Barbieri B, Cook GS, Lamont RJ. 2003. Streptococcus gordoniiにおけるLuxsベースのシグナル伝達:autoinducer 2は炭水化物代謝とPorphyromonas gingivalisとのバイオフィルム形成を制御する。J Bacteriol 185:274-284.
クロスレフ
PubMed
ISI社
Google Scholar
85.
Jarosz LM, Deng DM, van der Mei HC, Crielaard W, Krom BP. 2009. Streptococcus mutans competence-stimulating peptide inhibits Candida albicans hypha formation. Eukaryot Cell 8:1658-1664.
クロスレフ
PubMed
ISI社
Google Scholar
86.
Li YH, Hanna MN, Svensäter G, Ellen RP, Cvitkovitch DG. 2001. ストレプトコッカス・ミュータンス(Streptococcus mutans)における酸適応を調節する細胞密度:バイオフィルムにおける生存への示唆。J Bacteriol 183:6875-6884.
クロスレフ
PubMed
ISI社
Google Scholar
87.
Niazy AA. 2021. Luxsクオラムセンシングシステムと口腔内細菌叢のバイオフィルム形成:ショートレビュー論文。Saudi Dent J 33:116-123.
Crossref
PubMed
Google Scholar
88.
Lemos JA, Palmer SR, Zeng L, Wen ZT, Kajfasz JK, Freires IA, Abranches J, Brady LJ. 2019. ストレプトコッカス・ミュータンスの生物学。Microbiol Spectr 7.
クロスレフ
PubMed
グーグル奨学生
89.
Shanker E, Federle MJ. 2017. Streptococcus pneumoniae and mutansにおけるコンピテンスとバクテリオシンのクォーラムセンシング制御。Genes (Basel) 8:15.
Crossref
PubMed
ISI社
Google Scholar
90.
Jack AA, Daniels DE, Jepson MA, Vickerman MM, Lamont RJ, Jenkinson HF, Nobbs AH. 2015. Streptococcus gordonii comCDE (competence) operon modulates biofilm formation with Candida albicans. Micro (Reading) 161:411-421.
クロスレフ
PubMed
ISI社
Google Scholar
91.
Cuadra-Saenz G, Rao DL, Underwood AJ, Belapure SA, Campagna SR, Sun Z, Tammariello S, Rickard AH. 2012. Autoinducer-2は、口腔バイオフィルムにおけるパイオニア常在型連鎖球菌間の相互作用に影響を及ぼす。Microbiology (Reading) 158:1783-1795.
クロスレフ
PubMed
ISI研究所
Google Scholar
92.
Wang X, Li X, Ling J. 2017. Streptococcus gordonii luxs/autoinducer-2 quorum sensing system modulates the dual-species biofilm formation with Streptococcus mutans. J Basic Microbiol 57:605-616.
クロスレフ
PubMed
ISI研究所
Google Scholar
93.
Nobbs AH, Jenkinson HF, Jakubovics NS. 2011. Stick to your gums: Mechanism of oral microbial adherence. J Dent Res 90:1271-1278.
Crossref
PubMed
国際医療福祉大学
グーグル
94.
Kreth J, Merritt J, Qi F. 2009. 口腔連鎖球菌の細菌と宿主の相互作用。DNA Cell Biol 28:397-403.
Crossref
PubMed
国際標準化機構
グーグル
95.
Huang X, Huang X, Huang Y, Zheng J, Lu Y, Mai Z, Zhao X, Cui L, Huang S. 2023. 自己免疫疾患における口腔マイクロバイオーム:敵か味方か?J Transl Med 21:211.
Crossref
PubMed
ISI研究所
Google Scholar
96.
Sedghi L, DiMassa V, Harrington A, Lynch SV, Kapila YL. 2021. 口腔マイクロバイオーム:口腔の健康と疾患における重要な生物と複雑なネットワークの役割。歯周病学 2000 87:107-131.
クロスレフ
PubMed
ISI研究所
Google Scholar
97.
Pandey S, Kawai T, Akira S. 2014. トール様受容体と細胞内核酸センサーによる微生物センシング。Cold Spring Harb Perspect Biol 7:a016246.
Crossref
PubMed
国際標準化機構
Google Scholar
98.
Broad A, Kirby JA, Jones DEJ, Applied Immunology and Transplantation Research Group. 2007. Toll様受容体相互作用:MyD88依存性サイトカインには寛容だが、MyD88非依存性インターフェロンβ産生は増強される。Immunology 120:103-111.
Crossref
PubMed
ISIについて
Google Scholar
99.
Gao W, Xiong Y, Li Q, Yang H. 2017. 炎症性疾患の有望な治療法としてのtoll様受容体シグナルの阻害:分子治療からナノ治療への道のり。Front Physiol 8:508.
Crossref
PubMed
国際標準化機構
Google Scholar
100.
Konkel JE, O'Boyle C, Krishnan S. 2019. 口腔炎症の遠位への影響。Front Immunol 10:1403.
Crossref
パブコメ
ISI社
グーグル
101.
湯本裕之, 廣田和彦, 平尾和典, 二宮正明, 村上和彦, 藤井裕之, 三宅義明. 口腔連鎖球菌による全身疾患の発症因子.IJMS 20:4571.
Crossref
グーグル奨学生
102.
Schwandner R, Dziarski R, Wesche H, Rothe M, Kirschning CJ. 1999. ペプチドグリカンおよびリポテイコ酸によって誘導される細胞の活性化は、toll様受容体2によって媒介される。J Biol Chem 274:17406-17409.
Crossref
PubMed
ISIについて
Google Scholar
103.
Abranches J, Zeng L, Bélanger M, Rodrigues PH, Simpson-Haidaris PJ, Akin D, Dunn WA, Progulske-Fox A, Burne RA. 2009. Streptococcus mutans OMZ175によるヒト冠動脈内皮細胞への浸潤。Oral Microbiol Immunol 24:141-145.
クロスレフ
PubMed
ISI社
Google Scholar
104.
Stinson MW, Alder S, Kumar S. 2003. ビリダンス型連鎖球菌によるヒト内皮細胞への侵入と死滅。Infect Immun 71:2365-2372.
Crossref
PubMed
ISI研究所
グーグル
105.
Hong SW, Baik JE, Kang SS, Yun CH, Seo DG, Han SH. 2014. ストレプトコッカス・ミュータンスのリポテイコ酸は、マウスマクロファージにおける炎症性メディエーターの誘導のために、脂質部分を介してtoll様受容体2と相互作用する。Molecular Immunology 57:284-291.
クロスレフ
PubMed
ISI研究所
Google Scholar
106.
Hajishengallis G, Sharma A, Russell MW, Genco RJ. 2002. 口腔病原体とtoll様受容体との相互作用:アテローム性動脈硬化症における役割の可能性。Ann Periodontol 7:72-78.
クロスレフ
PubMed
グーグル奨学生
107.
Whitmore SE, Lamont RJ. 2011. 市中感染性口腔連鎖球菌の病原性ペルソナ。Mol Microbiol 81:305-314.
クロスレフ
PubMed
ISI研究所
グーグル
108.
Hajishengallis G, Lamont RJ. 2012. レッドコンプレックスを超え、さらなる複雑性へ:歯周病病因の多微生物相乗作用とディスバイオシス(PSD)モデル。Mol Oral Microbiol 27:409-419.
文献
PubMed
Google Scholar
109.
Kim AR, Ahn KB, Kim HY, Seo HS, Kum KY, Yun CH, Han SH. 2017. Streptococcus gordoniiリポ蛋白質はヒト歯根膜細胞においてIL-8を誘導する。Mol Immunol 91:218-224.
Crossref
PubMed
ISI社
Google Scholar
110.
岡田裕之, 村上慎一郎, 1998. 歯周病におけるサイトカイン発現.Crit Rev Oral Biol Med 9:248-266.
Crossref
PubMed
Google Scholar
111.
Chen L, Ge X, Dou Y, Wang X, Patel JR, Xu P. 2011. Streptococcus sanguinisにおける過酸化水素産生関連遺伝子の同定とピルビン酸オキシダーゼとの機能的関係。Micro (Reading) 157:13-20.
Crossref
PubMed
国際標準化機構
Google Scholar
112.
Tong H, Chen W, Merritt J, Qi F, Shi W, Dong X. 2007. Streptococcus oligofermentansは、乳酸のH2O2への変換を通じてStreptococcus mutansを阻害する。Mol Microbiol 63:872-880.
クロスレフ
PubMed
ISI研究所
Google Scholar
113.
Liu L, Tong H, Dong X. 2012. Streptococcus oligofermentansとStreptococcus mutans間の種間競争におけるピルビン酸オキシダーゼ-乳酸オキシダーゼカスケードの機能。Appl Environ Microbiol 78:2120-2127.
クロスレフ
PubMed
ISI研究所
Google Scholar
114.
Baty JJ, Stoner SN, Scoffield JA. 2022. 口腔常在連連鎖球菌:口腔の門番。J Bacteriol 204:e0025722.
クロスレフ
PubMed
ISI研究所
Google Scholar
115.
タンYL、シムTS、タンKS。2022. 口腔連鎖球菌は過酸化水素を介して宿主の自然免疫応答を破壊する。Sci Rep 12:656.
Crossref
PubMed
グーグル奨学生
116.
Tubero Euzebio Alves V, Al-Attar A, Alimova Y, Maynard MH, Kirakodu S, Martinez-Porras A, Hawk GS, Ebersole JL, Stamm S, Gonzalez OA. 2022. ストレプトコッカス・ゴルドニ(Streptococcus gordonii)誘発miRNAは、ヒト口腔上皮細胞におけるCCL20応答を制御する。Infect Immun 90:e0058621.
クロスレフ
PubMed
ISI社
グーグル
117.
Zhang G, Chen R, Rudney JD. 2008. Streptococcus cristatusは、口腔上皮細胞におけるfusobacterium nucleatum誘発性のInterleukin-8発現を抑制する。J Periodontal Res 43:408-416.
クロスレフ
PubMed
国際歯周病学会
Google Scholar
118.
Hasegawa Y, Mans JJ, Mao S, Lopez MC, Baker HV, Handfield M, Lamont RJ. 2007. 口腔内常在微生物種および日和見微生物種に対する歯肉上皮細胞の転写応答。Infect Immun 75:2540-2547.
Crossref
PubMed
国際医療福祉大学
Google Scholar
119.
Myers S, Do T, Meade JL, Tugnait A, Vernon JJ, Pistolic J, Hancock REW, Marsh PD, Trivedi HM, Chen D, Devine DA. 2021. CXCL8の分泌とNFκBの活性化を抑制する免疫調節性連鎖球菌は、口腔微生物叢の一般的なメンバーである。J Med Microbiol 70:001329.
クロスレフ
PubMed
ISI社
Google Scholar
120.
サラムMA、中尾理恵、米澤秀樹、渡辺博之、千福博之、2006. ヒトPBMC-NOD/SCIDマウスにおける口腔連鎖球菌に対するヒトT細胞応答。Oral Microb Immunology 21:169-176.
Crossref
PubMed
ISIについて
Google Scholar
121.
White T, Alimova Y, Alves VTE, Emecen-Huja P, Al-Sabbagh M, Villasante A, Ebersole JL, Gonzalez OA. 2020.口腔常在細菌は、上皮細胞死を異なって調節する。Arch Oral Biol 120:104926.
Crossref
PubMed
ISI研究所
Google Scholar
122.
岡橋直樹, 中田雅彦, 住友貴志, 寺尾靖弘, 川端聡. 2013. 口腔連鎖球菌が産生する過酸化水素はマクロファージ細胞死を誘導する。PLoS One 8:e62563.
クロスレフ
PubMed
国際医用画像学会
グーグル
123.
森田英樹、成清正明、西村英紀、矢野明彦、田辺千恵子、佐々木秀樹、花田直樹、2004. 唾液中のStreptococcus anginosus groupおよびStreptococcus mitisの加齢に伴う変化の分子生物学的解析. Oral Microbiol Immunol 19:386-389.
クロスレフ
PubMed
国際インフルエンザ学会
Google Scholar
124.
Laupland KB, Pasquill K, Parfitt EC, Dagasso G, Steele L. 2018. カナダ、ブリティッシュ・コロンビア州西部内陸部におけるアンギノサス連鎖球菌群血流感染症。Infect Dis (Lond) 50:423-428.
Crossref
PubMed
Google Scholar
125.
Sheflin AM, Whitney AK, Weir TL. 2014. 微生物ディスバイオシスのがん促進作用。Curr Oncol Rep 16:406.
Crossref
PubMed
国際アイソトープ学会
グーグル
126.
Radaic A, Kapila YL. 2021. 口腔内の微生物と宿主の相互作用に関する新たな知見。Comput Struct Biotechnol J 19:1335-1360.
Crossref
PubMed
国際分子生物学連合
グーグル
127.
He J, Li Y, Cao Y, Xue J, Zhou X. 2015. 口腔マイクロバイオームの多様性とヒト疾患との関連。Folia Microbiol (Praha) 60:69-80.
Crossref
PubMed
ISI研究所
Google Scholar
128.
Zhang W-L、Wang S-S、Wang H-F、Tang Y-J、Tang Y-L、Liang X-H. 2019. 口腔がんでは誰が誰なのか?Exp Cell Res 384:111634.
Crossref
パブコメ
国際放射線学会
Google Scholar
129.
Van Dyke TE, Bartold PM, Reynolds EC. 2020. 歯周炎症とディスバイオシスの関連性。Front Immunol 11:511.
Crossref
PubMed
国際歯周病学会
Google Scholar
130.
Al-Hebshi NN, Nasher AT, Maryoud MY, Homeida HE, Chen T, Idris AM, Johnson NW. 2017. 口腔扁平上皮がんとの関連で同定された、フソバクテリウム・ヌクレアタムと緑膿菌を特徴とする炎症性バクテリオーム。Sci Rep 7:1834.
クロスレフ
PubMed
グーグル奨学生
131.
Chen Y, Chen X, Yu H, Zhou H, Xu S. 2019. 口腔内細菌叢のがん診断への応用:系統的レビュー。Onco Targets Ther 12:11131-11144.
クロスレビュー
PubMed
Google Scholar
132.
Mascitti M, Togni L, Troiano G, Caponio VCA, Gissi DB, Montebugnoli L, Procaccini M, Lo Muzio L, Santarelli A. 2019. 頭頸部がんを超えて:口腔微生物叢と遠隔臓器の腫瘍発生との関係。Front Cell Infect Microbiol 9:232.
Crossref
PubMed
ISI研究所
Google Scholar
133.
孫 J、唐 Q、余 S、謝 M、謝 Y、陳 G、陳 L. 2020 年。癌の進化と進行における口腔微生物叢の役割。Can Med 9:6306-6321.
Crossref
PubMed
ISI研究所
Google Scholar
134.
La Rosa G, Gattuso G, Pedullà E, Rapisarda E, Nicolosi D, Salmeri M. 2020. 口腔内ディスバイオシスと口腔がん発症との関連。Oncol Lett 19:3045-3058.
Crossref
PubMed
Google Scholar
135.
Bhatelia K, Singh K, Singh R. 2014. TLR: 炎症と乳がんの関連性。Cell Sig 26:2350-2357.
Crossref
パブコメ
国際放射線学会
グーグル
136.
Cutolo M, Paolino S, Pizzorni C. 2014. リウマチ性疾患における癌の誘発における慢性炎症の寄与の可能性。Clin Exp Rheumatol 32:839-847.
PubMed
国際標準化機構
Google Scholar
137.
Wang D, DuBois RN. 2015. 腫瘍微小環境における慢性炎症に伴う免疫抑制。Carcinogenesis 36:1085-1093.
Crossref
PubMed
国際放射線学会
グーグル
138.
Parsonnet J. 1995年。がんの原因としての細菌感染。Environ Health Perspect 103 Suppl 8:263-268.
文献
パブコメ
国際放射線学会
Google Scholar
139.
Coussens LM, Werb Z. 2002. 炎症と癌。Nature 420:860-867.
文献
PubMed
ISIについて
グーグル
140.
Ma J, Huang L, Hu D, Zeng S, Han Y, Shen H. 2021. 腫瘍免疫微小環境における腫瘍微生物の役割:バイスタンダー、アクチベーター、あるいはインヒビター?J Exp Clin Cancer Res 40:327.
Crossref
PubMed
ISI社
Google Scholar
141.
Dróżdż M, Makuch S, Cieniuch G, Woźniak M, Ziółkowski P. 2020. がん標的治療における偏性嫌気性細菌と通性嫌気性細菌:現在の戦略と臨床応用。生命科学 261:118296.
Crossref
PubMed
国際標準化機構
Google Scholar
142.
Ryan RM, Green J, Williams PJ, Tazzyman S, Hunt S, Harmey JH, Kehoe SC, Lewis CE. 2009. 固形腫瘍の低酸素領域への新規サイトライシンの細菌送達。Gene Ther 16:329-339.
クロスレフ
PubMed
ISI社
Google Scholar
143.
Clairmont C, Lee KC, Pike J, Ittensohn M, Low KB, Pawelek J, Bermudes D, Brecher SM, Margitich D, Turnier J, Li Z, Luo X, King I, Zheng LM. 2000. サルモネラ・チフス菌の遺伝子組換え株である新規抗腫瘍剤VNP20009の生体内分布と遺伝的安定性。J Infect Dis 181:1996-2002.
クロスフレフ
PubMed
ISI社
Google Scholar
144.
Gupta KH, Nowicki C, Giurini EF, Marzo AL, Zloza A. 2021. 細菌を用いたがん治療(BBCT):がん免疫療法の最近の進歩、現在の課題、将来の展望。Vaccines 9:1497.
クロスリファレンス
Google Scholar
145.
Rommasi F. 2022年。細菌を用いたがん治療法:私たちが知っていること、そして現在地。Oncol Ther 10:23-54.
Crossref
パブコメ
グーグル奨学生
146.
Hajishengallis G、Chavakis T. 2021。歯周病と炎症性合併症を結びつける局所的および全身的メカニズム。Nat Rev Immunol 21:426-440.
Crossref
PubMed
歯周病
グーグル
147.
Lee W-H, Chen H-M, Yang S-F, Liang C, Peng C-Y, Lin F-M, Tsai L-L, Wu B-C, Hsin C-H, Chuang C-Y, Yang T, Yang T-L, Ho S-Y, Chen W-L, Ueng K-C, Huang H-D, Huang C-N, Jong Y-J. 2017. 唾液微生物叢における細菌の変化と口腔がんにおけるその関連性。Sci Rep 7:16540.
Crossref
PubMed
グーグル奨学生
148.
Hsiao J-R, Chang C-C, Lee W-T, Huang C-C, Ou C-Y, Tsai S-T, Chen K-C, Huang J-S, Wong T-Y, Lai Y-H, Wu Y-H, Hsueh W-T, Wu S-Y, Yen C-J, Chang J-Y, Lin C-L, Weng Y-L, Yang H-C, Chen Y-S, Chang JS. 2018. 口腔扁平上皮がんのリスクにおける口腔マイクロバイオーム、生活習慣要因、遺伝子多型の相互作用。Carcinogenesis 39:778-787.
Crossref
PubMed
ISI社
Google Scholar
149.
Ganly I, Yang L, Giese RA, Hao Y, Nossa CW, Morris LGT, Rosenthal M, Migliacci J, Kelly D, Tseng W, Hu J-U, Li H, Brown S, Pei Z. 2019. 歯周病原体は、タバコやアルコール、ヒトパピローマウイルスとは独立した口腔扁平上皮がんのリスク因子である。Int J Cancer 145:775-784.
クロスレフ
PubMed
国際放射線学会
Google Scholar
150.
ヒトに対する発がんリスクの評価に関するIARC作業部会。2012. 個人的習慣と室内燃焼。IARC Monogr Eval Carcinog Risks Hum 100:1-538.
Google Scholar
151.
Kurkivuori J, Salaspuro V, Kaihovaara P, Kari K, Rautemaa R, Grönroos L, Meurman JH, Salaspuro M. 2007. 口腔連鎖球菌によるエタノールからのアセトアルデヒド産生。Oral Oncol 43:181-186.
Crossref
PubMed
国際標準化機構
Google Scholar
152.
Al-Hebshi NN, Borgnakke WS, Johnson NW. 2019. 口腔扁平上皮がんのマイクロバイオーム:機能的視点。Curr Oral Health Rep 6:145-160.
Crossref
グーグル奨学生
153.
Kang G-U、Jung D-R、Lee YH、Jeon SY、Han HS、Chong GO、Shin J-H. 2021. 韓国人女性における膣内細菌叢と子宮頸部発がんとの潜在的関連性:コホート研究。Microorganisms 9:294.
クロスレフ
PubMed
グーグル奨学生
154.
Stasiewicz M, Karpiński TM. 2022. 口腔微生物叢と発癌におけるその役割。Semin Cancer Biol 86:633-642.
Crossref
PubMed
ISI研究所
グーグル
155.
後藤哲也:2022年。微生物叢と肺がん。Semin Cancer Biol86:1-10.
Crossref
PubMed
国際放射線学会
Google Scholar
156.
Karpiński TM, Ożarowski M, Stasiewicz M. 2022. 発癌性微生物叢と大腸癌発生におけるその役割。Sem Cancer Bio 86:420-430.
Crossref
PubMed
Google Scholar
157.
Coker OO, Dai Z, Nie Y, Zhao G, Cao L, Nakatsu G, Wu WK, Wong SH, Chen Z, Sung JJY, Yu J. 2018. 胃発がんにおける粘膜マイクロバイオーム異常症。Gut 67:1024-1032.
Crossref
PubMed
ISI研究所
Google Scholar
158.
Martín-Núñez GM, Cornejo-Pareja I, Coin-Aragüez L, Roca-Rodríguez MDM, Muñoz-Garach A, Clemente-Postigo M, Cardona F, Moreno-Indias I, Tinahones FJ. 2019. 抗生物質治療によるH. pylori除菌は、腸内細菌叢の改変に関連するグルコースホメオスタシスの変化を引き起こす。PLoS One 14:e0213548.
クロスレフ
PubMed
ISI研究所
Google Scholar
159.
Wu F, Yang L, Hao Y, Zhou B, Hu J, Yang Y, Bedi S, Sanichar NG, Cheng C, Perez-Perez G, Tseng W, Tseng M, Francois F, Khan AR, Li Y, Blaser MJ, Shu XO, Long J, Li H, Pei Z, Chen Y. 2022. 口腔および胃マイクロバイオームと胃腸管形質転換との関係。Intl J Cancer 150:928-940.
Crossref
PubMed
ISI研究所
Google Scholar
160.
Zhou CB, Pan SY, Jin P, Deng JW, Xue JH, Ma XY, Xie YH, Cao H, Liu Q, Xie WF, et al. 胃癌の非侵襲的スクリーニングおよび早期警告のためのStreptococcus anginosusおよびStreptococcus constellatusの糞便シグネチャー。Gastroenterology 162:1933–1947.
クロスレフ
PubMed
ISI研究所
Google Scholar
161.
Tsai M-S, Chen Y-Y, Chen W-C, Chen M-F. 2022. Streptococcus mutansは口腔扁平上皮癌の腫瘍進行を促進する。J Cancer 13:3358-3367.
Crossref
PubMed
グーグル奨学生
162.
Yu L, Maishi N, Akahori E, Hasebe A, Takeda R, Matsuda AY, Hida Y, Nam J-M, Onodera Y, Kitagawa Y, Hida K. 2022. 口腔内細菌Streptococcus mutansは、血管炎症を誘導することにより腫瘍転移を促進する。Cancer Sci 113:3980-3994.
クロスレフ
PubMed
国際標準化機構
Google Scholar
163.
佐々木秀樹、石塚忠彦、武藤正彦、根津正人、中西義人、稲垣由美子、渡辺博之、寺田稔:1998.食道癌、食道異形成および胃癌におけるレンサ球菌DNAの存在。食道癌、食道異形成および胃癌におけるStreptococcus anginosus DNAの存在。Cancer Res 58:2991-2995.
PubMed
国際アイソトープ学会
Google Scholar
164.
Mager DL, Haffajee AD, Devlin PM, Norris CM, Posner MR, Goodson JM. 2005. 口腔癌の診断指標としての唾液微生物叢:無癌および口腔扁平上皮癌被験者の記述的非ランダム化研究。J Transl Med 3:27.
Crossref
PubMed
ISI社
Google Scholar
165.
Zhao H, Chu M, Huang Z, Yang X, Ran S, Hu B, Zhang C, Liang J. 2017. 口腔癌に関連する口腔微生物叢の変動。Sci Rep 7:11773.
Crossref
PubMed
グーグル奨学生
166.
Pushalkar S, Ji X, Li Y, Estilo C, Yegnanarayana R, Singh B, Li X, Saxena D. 2012. 口腔扁平上皮がん患者の腫瘍組織と非腫瘍組織における口腔微生物叢の比較。BMC Microbiol. 12:144.
Crossref
PubMed
ISI社
グーグル
167.
Daveshwar SR, Kapoor SV, Daveshwar MR. 2020. 放射線治療を受ける口腔がんおよび喉頭がん患者の唾液中のう蝕原性連鎖球菌(Streptococcus mutans)の定量的ポリメラーゼ連鎖反応分析:臨床研究。Int J Appl Basic Med Res 10:91-96.
クロスレフ
PubMed
Google Scholar
168.
Wu J, Xu S, Xiang C, Cao Q, Li Q, Huang J, Shi L, Zhang J, Zhan Z. 2018. 舌苔微生物群集と胃がんリスク効果。J Cancer 9:4039-4048.
Crossref
PubMed
グーグル奨学生
169.
Masood U, Sharma A, Lowe D, Khan R, Manocha D. 2016. Streptococcus anginosus菌血症と肝膿瘍を合併した大腸癌。Case Rep Gastroenterol 10:769-774.
Crossref
PubMed
Google Scholar
170.
Sharma A, Masood U, Kahlon A, Pattar S, Iqbal S, Lehmann D. 2016. レンサ球菌の菌血症と心内膜炎:前癌性結腸ポリープの初期徴候: 1366. American J Gastroenterology 111:S616.
クロスレフ
国際標準化機構
Google Scholar
171.
Rawla P, Vellipuram AR, Bandaru SS, Pradeep Raj J. 2017. Streptococcus anginosus菌血症および肝膿瘍を呈した結腸癌。Gastroenterology Res 10:376-379.
Crossref
PubMed
Google Scholar
172.
アベニC、ロタL、オリオッシC、ベルトッキP、チェントゥリーニPB、ザニボーニA. 2013年。進行結腸癌患者におけるStreptococcus bovis、心内膜炎、敗血症の相関:症例報告。J Med Case Rep 7:185.
クロスレフ
PubMed
Google Scholar
173.
Kumar R, Herold JL, Schady D, Davis J, Kopetz S, Martinez-Moczygemba M, Murray BE, Han F, Li Y, Callaway E, Chapkin RS, Dashwood W-M, Dashwood RH, Berry T, Mackenzie C, Xu Y. 2017. Streptococcus gallolyticus subsp. gallolyticusは大腸腫瘍の発生を促進する。PLoS Pathog 13:e1006440.
Crossref
PubMed
国際標準化機構
グーグル
174.
Zhang Y, Weng Y, Gan H, Zhao X, Zhi F. 2018. Streptococcus gallolyticusは骨髄細胞を共謀させて炎症性腸疾患の腫瘍化を促進する。Biochem Biophysical Research Comm 506:907-911.
Crossref
PubMed
国際標準化機構
グーグル
175.
Pasquereau-Kotula E, Martins M, Aymeric L, Dramsi S. 2018. Streptococcus gallolyticus subsp. gallolyticusと大腸がんとの関連性の意義。Front Microbiol 9:614.
Crossref
PubMed
国際標準化機構
Google Scholar
176.
Elnaggar M, Mahboob S, Beutler BD, Hanfy A, Canaday O. 2020. 肝転移を模倣したレンサ球菌性膿瘍。Cureus 12:e8852.
クロスレフ
PubMed
Google Scholar
177.
成清正明, 田辺千尋, 山田洋一, 井垣博之, 立森泰弘, 加藤寛子, 武藤正明, モンテサーノR, 坂本博之, 中島康之, 佐々木博之, 2004. 食道癌におけるTreponema denticola、Streptococcus mitis、Streptococcus anginosusの高頻度かつ優先的感染。Cancer Sci 95:569-574.
クロスレフ
PubMed
ISI研究所
Google Scholar
178.
舘田真由美、志賀恭一、西條晋一、曽根正人、堀 毅、横山潤一郎、松浦紘一、高坂忠彦、宮城敏明、2000. 頭頸部扁平上皮癌におけるStreptococcus anginosus:発癌への関与。Int J Mol Med 6:699-703.
クロスレフ
PubMed
国際標準化機構
Google Scholar
179.
志賀恭一郎、立田稔、西條茂樹、堀卓也、佐藤一郎、舘野秀樹、松浦一彦、高坂忠彦、宮城敏明:2001. 口腔外咽頭頭頸部扁平上皮癌におけるレンサ球菌感染の有無と発癌への関与。Oncol Rep 8:245-248.
クロスレフ
PubMed
ISI研究所
Google Scholar
180.
森田英樹、成清正明、矢野明彦、西村英紀、井垣博文、佐々木秀樹、寺田正樹、花田直樹、川辺亮一:2003. 口腔がんと食道がんにおけるStreptococcus anginosus感染の頻度の違い。Cancer Sci 94:492-496.
クロスレフ
PubMed
国際標準化機構
Google Scholar
181.
佐々木幹夫, 山浦千春, 大原根本祐子, 田近修一, 児玉祐子, 大谷剛, 原田理恵, 木村聡, 2005. 口腔癌におけるStreptococcus anginosus感染とその感染経路.Oral Dis 11:151-156.
クロスレフ
PubMed
国際標準化機構
Google Scholar
182.
Xu Y, Jia Y, Chen L, Gao J, Yang D. 2021. Streptococcus anginosusが舌扁平上皮癌細胞の生物学的反応に及ぼす影響。BMC Oral Health 21:141.
Crossref
PubMed
国際標準化機構
Google Scholar
183.
Anjali K, Arun AB, Bastian TS, Parthiban R, Selvamani M, Adarsh H. 2020. 癌治療センターにおける放射線治療前後の口腔癌患者の口腔微生物プロファイル-前向き研究。J Oral Maxillofac Pathol 24:117-124.
Crossref
PubMed
Google Scholar
184.
McCarthy EF. 2006. William B. Coleyの毒素と骨・軟部肉腫の治療。アイオワOrthop J 26:154から158まで。
PubMed
グーグル奨学金
185.
Patterson KG, Dixon Pittaro JL, Bastedo PS, Hess DA, Haeryfar SMM, McCormick JK. 2014. 5T4オンコフェタール抗原を標的とする新規ヒト化一本鎖抗体-溶連菌超抗原融合タンパク質を用いた樹立結腸癌異種移植片の制御。PLoS One 9:e95200.
クロス
パブコメ
ISI社
Google Scholar
186.
Tarrah A, de Castilhos J, Rossi RC, Duarte V da S, Ziegler DR, Corich V, Giacomini A. 2018. 新たに分離された葉酸産生ストレプトコッカス・サーモフィルス株のin vitroプロバイオティクスの可能性と抗がん活性。Front Microbiol 9:2214.
Crossref
PubMed
国際標準化機構
Google Scholar
187.
Wei MQ, Ellem KAO, Dunn P, West MJ, Bai CX, Vogelstein B. 2007. 好気性または偏性嫌気性細菌は、固形腫瘍の集学的治療の可能性を秘めている。Eur J Cancer 43:490-496.
Crossref
PubMed
国際標準化機構
Google Scholar
188.
Xiao S, Shi H, Zhang Y, Fan Y, Wang L, Xiang L, Liu Y, Zhao L, Fu S. 2022. 乳がんの転帰を証明する化学療法薬の細菌駆動低酸素標的送達。J Nanobiotechnology 20:178.
Crossref
PubMed
国際標準化機構
Google Scholar
189.
Liu S, Xu X, Zeng X, Li L, Chen Q, Li J. 2014. 細菌療法:口腔がんの潜在的治療法(総説)。Oncol Lett 8:2359-2366.
Crossref
PubMed
グーグル奨学生
190.
Marzhoseyni Z, Shojaie L, Tabatabaei SA, Movahedpour A, Safari M, Esmaeili D, Mahjoubin-Tehran M, Jalili A, Morshedi K, Khan H, Okhravi R, Hamblin MR, Mirzaei H. 2022. がん治療におけるレンサ球菌の細菌成分。Cancer Gene Ther 29:141-155.
クロスレフ
PubMed
ISI社
Google Scholar
全文表示|PDFダウンロード
推奨
腸管病原体感染における炎症、栄養素の利用可能性および常在微生物叢の役割
バーベル・シュテッヒャーほか、スペクトラム編集委員会、2015年
戦闘員の健康とパフォーマンスを向上させるための標的微生物ソリューション開発のためのバイオミメティック腸モデルシステム
mSystems, 2020
重症患者における皮膚常在菌異常とマイクロバイオーム部位特異性の喪失
Tilman E. Klassertら、Microbiology Spectrum、2024年
都市化が地域の気候と異常気象に与える影響: 現在の理解、不確実性、今後の研究の方向性
Yun Qianら、Advances in Atmospheric Sciences、2022年
中国のカーボンニュートラル目標:課題と展望
ニン・ツェンほか、『大気科学の進歩』、2022年
2023年、カナダの記録的な山火事が引き起こす深刻な地球環境問題
Zhe Wangほか、Advances in Atmospheric Sciences、2023年
掲載元
米国微生物学会ロゴ
ASMジャーナルロゴ
ジャーナル
抗菌薬と化学療法
応用・環境微生物学
臨床およびワクチン免疫学
臨床微生物学レビュー
エコサル・プラス
真核細胞
感染と免疫
細菌学ジャーナル
臨床微生物学ジャーナル
微生物学・生物学教育ジャーナル
ウイルス学ジャーナル
mバイオ
微生物学・分子生物学レビュー
微生物学リソース
微生物学スペクトラム
mSphere
mシステム
リソース
Microbiologyについて
著者センター
アクセス許可
ASMジャーナルコレクション
出版倫理
移行情報
広告
ASMメンバーシップ
プライバシーポリシー
会員規約
所有権に関する通知
非商用TDMライセンス
いつでもつながる
アラート
RSSフィード
お問い合わせ
ASMコミュニティ
ニュース
プレスリリース
ポリシーステートメント
著作権 © 2024 米国微生物学会
この記事が気に入ったらサポートをしてみませんか?
