Streptococcus anginosusがマウスの胃の炎症、萎縮、腫瘍形成を促進する
メインコンテンツへスキップ
広告
インスピレーションを与える科学Cell Pressジャーナル
セル
ログイン
検索...
論文|オンライン公開中
Streptococcus anginosusがマウスの胃の炎症、萎縮、腫瘍形成を促進する
https://www.cell.com/cell/fulltext/S0092-8674(24)00006-0?dgcid=raven_jbs_aip_email

カイリ・フー
アルビン・ホー・クワン・チャン
チー・チュン・ウォン
カ・ファイ・トー
ジョセフ・ジャオ・ユーソン
ジュン・ユー6
すべての著者を表示
脚注を表示オープンアクセス掲載:2024年1月30日DOI:https://doi.org/10.1016/j.cell.2024.01.004
ハイライト
S. anginosusはGC患者の胃粘膜に濃縮されている。
S. anginosusはマウスにおいて胃炎-萎縮-異形成-異形成の一連の流れを誘導する
S. anginosusは胃の腫瘍化を促進する
TMPC-アネキシンA2軸はS. anginosusのコロニー形成を媒介し、MAPKシグナルを活性化する。
概要
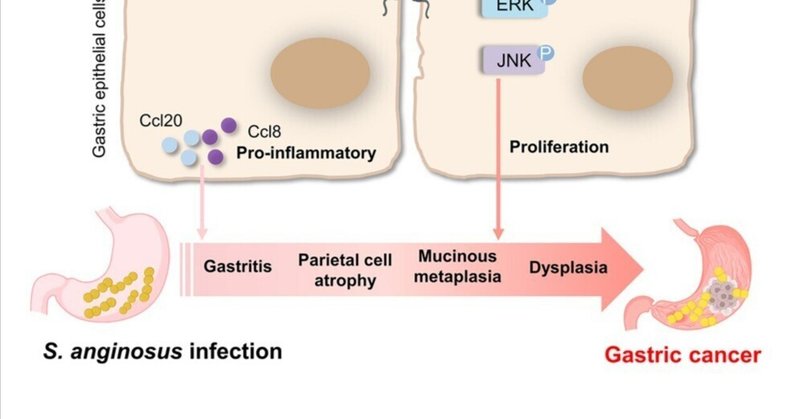
Streptococcus anginosus(S.ginosus)は、胃癌(GC)患者の胃粘膜に濃縮されていた。我々は、S. anginosusがマウスの胃に定着し、急性胃炎を誘発することを示した。また、S. anginosusの感染により、通常マウスでは進行性の慢性胃炎、胃壁細胞萎縮、粘液性形質転換、異形成が自然発生的に誘導され、その所見は無菌マウスでも確認された。さらに、S. anginosusは、発癌誘発胃癌およびYTN16胃癌細胞移植において胃癌の進行を促進した。S. anginosusは胃のバリア機能を破壊し、細胞増殖を促進し、アポトーシスを阻害した。我々は、S. anginosusの表面タンパク質であるTMPCが胃上皮細胞上のAnnexin A2 (ANXA2)受容体と相互作用することを明らかにした。TMPCとANXA2との相互作用は、S. anginosusの付着とコロニー形成を媒介し、マイトジェン活性化プロテインキナーゼ(MAPK)の活性化を誘導した。ANXA2をノックアウトすると、S. anginosusによるMAPKの誘導が消失した。したがって、本研究は、S. anginosusがTMPC-ANXA2-MAPK軸において胃上皮細胞との直接的な相互作用を介して胃腫瘍化を促進する病原体であることを明らかにした。
図解抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
胃がん
アンギノサス連鎖球菌
表面タンパク質
MAPKシグナル伝達
無菌マウス
はじめに
胃がん(GC)は、世界で5番目に多いがんであり、がん死亡の主要な原因である1。GCの主要な危険因子であるヘリコバクター・ピロリ(H. pylori)は、I型発がん物質に分類されている。ヘリコバクター・ピロリ(H.ピロリ)感染は、胃炎、萎縮、腸管形質転換(IM)を促進する2。H.ピロリ感染者のうち、最終的にGCを発症するのはわずか1〜3%であり、他の要因が関与していることが推察される。胃粘膜に相当数の非ピロリ菌マイクロバイオームが存在することを示す新たな証拠が得られており3、それらの調節異常が胃がん発生に関与している可能性がある4にもかかわらず、胃がん発生に関連する非ピロリ菌ドライバー細菌の同定と特性解析は未解明のままである。
ピロリ菌以外の胃マイクロバイオームを探索するために、我々はピロリ菌陰性患者の胃マイクロバイオームを、表在性胃炎、萎縮性胃炎、IMからGCに至る胃腫瘍形成のさまざまな段階を通して特徴付けた。S. anginosus)は、グラム陽性、非芽胞形成性、非運動性の細菌6で、主に口腔、鼻咽頭、消化管、膣管に生息し、膿瘍などの侵襲性化膿性感染症を引き起こすことがある7。S. anginosusは低pH条件(pH3〜5)に著しく強く、胃粘膜での生存を容易にする可能性がある8。しかし、胃がん発生におけるS. anginosusの役割やその病原性分子機構はほとんど不明である。
本研究では、S. anginosusを非H. pylori病原体として同定し、通常マウスおよび無菌マウスに長期感染させたところ、急性胃炎、ひいては慢性胃炎、胃粘液性形質転換、異形成を速やかに誘導することを明らかにした。S. anginosusは胃の発癌を促進する。我々は、S. anginosusの表面蛋白質TMPCが胃粘膜に定着する際に、胃上皮細胞受容体Annexin A2 (ANXA2)と直接相互作用し、その結果、マイトジェン活性化蛋白質キナーゼ(MAPK)シグナル伝達経路が活性化されることを明らかにした。従って、我々の研究は、胃腫瘍形成に直接寄与する非ピロリ菌病原体S. anginosusを定義した。
結果
S. anginosusは2週間の感染でマウスに急性胃炎を引き起こす
我々はまず、胃腫瘍形成の様々な段階におけるS. anginosusの存在量を16s rRNA遺伝子配列決定データセットで解析した。表在性胃炎におけるS. anginosusレベルと比較して、S. anginosusは萎縮性胃炎およびIMにおいて上昇し、GC患者において最も高い存在量に達した(図1AおよびS1A)。このコホートでは、S. anginosus陽性者は萎縮性胃炎(AG)/IMおよびGCの有病率が高い(表S1)。ピロリ菌除菌1年後の胃マイクロバイオームを比較した追跡調査でも、S. anginosusが持続性胃炎と関連していることが確認されている(図S1B)9。 さらに、S. anginosusは、一対の隣接正常組織と比較してGC腫瘍において濃縮されていた(p = 0.003)(図S1C)11。これらの研究は、GCの進行におけるS. anginosusの潜在的な役割を示唆している。マウスの胃におけるS. anginosusの病原性の役割を調べるために、従来のマウスにS. anginosusを3日に1回、2週間にわたって経口投与した(図1B)。この投与間隔により、胃粘膜におけるS. anginosusの継続的なコロニー形成が確保された(図S1D)。陰性対照としてBrain heart infusion(BHI)ブロスを、陽性対照としてH. pylori SS1をマウスに経口投与した。感染後2週目に、胃粘膜基底部におけるS. anginosusのコロニー形成を蛍光in situハイブリダイゼーション(FISH)により観察した(図1C)。胃におけるS. anginosusのコロニー形成は、細菌DNAのPCR検出(図S1E)および新鮮胃組織からの生菌の培養(図S1F)によって確認された。S.ginosus感染マウスでは急性炎症が観察され、H&E染色下で病理医により粘膜下層への好中球浸潤が認められた(図1D)。S.アンジノサスが誘発した急性炎症と同様に、S.アンジノサスを摂取したマウスでは炎症性ケモカインの発現が上昇した(図1F)。Ccl20(p=0.03)とCcl8(p=0.005)を含む炎症性ケモカインの誘導はqPCRによって検証され、BHIコントロールマウスと比較してS. anginosus感染マウスでは両方ともアップレギュレートされた(図1G;表S2)。これらの結果から、S. anginosus感染マウスでは、炎症性ケモカインの有意な上昇に伴って胃に急性炎症が誘導されることが示された。
図サムネイルgr1
図1Streptococcus anginosusは胃粘膜に定着し、急性炎症を促進する。
キャプション
大きな画像を見るダウンロード 高解像度画像
図サムネイルfigs1
図S1Streptococcus anginosusは感染後2週間でマウスの胃粘膜にコロニー形成する。
キャプション
大きな画像を見るダウンロード 高解像度画像
S. anginosusは3ヵ月間感染したマウスに慢性胃炎を誘発する
胃におけるS. anginosus感染の長期的影響を調べるために、感染モデルを3、6、9、12ヵ月に拡大した(図2A)。S. anginosus感染は体重(図S2A)、摂餌量(図S2B)、肝臓/体重比(図S2C)に影響を与えなかった。肝機能マーカー(アラニントランスアミナーゼ[ALT]およびアスパラギン酸アミノトランスフェラーゼ[AST])(図S2D)および腎機能(クレアチニン<0.4mg/dL)は、S. anginosus感染マウスにおいて正常であった。S. anginosusは結腸に炎症を引き起こさなかった(図S2E-S2G)。一方、胃粘膜の基底部におけるS. anginosusの持続感染と粘膜層への拡大が肛門と胃体部の両方でFISHにより証明され(図2B、S2H、S2I)、新鮮胃組織からの細菌培養によりS. anginosusの生菌の存在が確認された(図S2JとS2K;表S3)。S. anginosus感染に伴い、感染後3ヵ月から胃粘膜下に好中球の持続的浸潤とリンパ球巣の形成によって証明される慢性炎症が観察され、それは6ヵ月、9ヵ月、12ヵ月まで持続した(図2C)。S. anginosus感染マウスの胃炎スコアは、BHI対照マウスのそれと比較して、感染後9ヶ月で有意に増加し(p = 0.006)、感染後12ヶ月で増強した(p < 0.0001)(図2D)。特に、S. anginosus感染は、ピロリ菌感染と同等レベルの炎症を、特にそれ以降の時点で惹起した。さらに、H. pyloriとS. anginosusの共感染は、感染後3ヵ月でS. anginosusまたはH. pylori単独感染と比較して胃の炎症を増加させた(図S3A-S3C)。これと一致するように、我々の社内データセット(図1A)の解析から、S. anginosusとH. pyloriに共感染した被験者は、H. pylori単独感染と比較して、萎縮性胃炎の相対リスクが高く、その後のIMおよびGCへの病勢進行が高いことが明らかになった(表S4)。これらの結果から、S. anginosusの長期感染はH. pylori感染に匹敵する集中的な慢性胃炎を引き起こし、これら2つの病原体は胃の炎症を促進するために協調的に作用する可能性が示唆された。
図サムネイルgr2
図2ストレプトコッカス・アンギノサスはマウスの慢性胃炎を促進する
キャプション
大きな画像を見るダウンロード 高解像度画像
図サムネイルfigs2
図S2ストレプトコッカス・アンギノサスはマウスに長期感染しても副作用がない。
キャプション
大きな画像で見る 高解像度画像
サムネイル図3
図S3ストレプトコッカス・アンギノサスはマウスの胃マイクロバイオーム組成を調節する。
キャプション
大きな画像を見るダウンロード 高解像度画像
S. anginosusは9ヶ月間の感染後、マウスに自然発生的な胃の萎縮、形質転換、異形成を引き起こす。
胃の腫瘍形成は、萎縮-形質転換-異形成の一連の前癌病変に沿って進行し、胃炎は主要な危険因子である13。S. anginosusが慢性胃炎を引き起こすことを踏まえ、我々は長期感染が胃粘膜の前癌病変を誘発するかどうかを検討した。9ヵ月目にS. anginosus感染は軽度の壁側板細胞萎縮を引き起こし、12ヵ月目には中等度から重度の萎縮へと進行した(p = 0.01)(図3A)。さらに、S. anginosusに感染したマウスでは、感染後12ヵ月目に粘液性の形質転換が検出された(図3B)。重要なことは、S. anginosus感染マウスは感染後12ヶ月で低悪性度の異形成を形成したことである(図3Cおよび3D)。マウスの胃組織のFISH解析から、S. anginosusは非形成領域と比較して形質転換/異形成領域で濃縮されていることが示された(図S3D)。陽性対照としてH. pyloriはより急速に胃の萎縮を誘導したが、粘液性の形質転換の数は12ヶ月の時点でS. anginosusによって誘導されたものより少なく、異形成は同定されなかった(図3A、3B、および3E)。胃萎縮の誘導と一致して、S. anginosusはBHI対照群と比較して感染9ヵ月後および12ヵ月後に胃pHを上昇させた(p<0.05)(図S3EおよびS3F)。
図サムネイルgr3
図3Streptococcus anginosusはマウスにおいて胃のバリア機能の障害とともに胃の萎縮、形質転換、異形成を誘導する
キャプション
大きな画像を見るダウンロード 高解像度画像
図3Eに示すように、アルシアンブルー陽性細胞はS. anginosus感染マウスの胃粘膜に認められたが、BHIコントロールマウスでは12ヵ月後に認められなかった。形質転換マーカーGriffonia simplicifolia lectin II(GSII)の免疫蛍光染色も行った(図3F)。H&E染色下での形質転換と一致して、S. anginosus感染は感染後12ヵ月で胃腺内のGSII陽性細胞を増加させた。さらに、S. anginosusは、感染後6ヶ月および12ヶ月において、それぞれKi-67(図3G)および増殖細胞核抗原(PCNA)染色(図3H)によって決定されるように、胃粘膜における細胞増殖を誘導した。注目すべきことに、別のGC濃縮口腔病原体であるParvimonas micra(図S3G)の感染では、12ヵ月後にマウスの胃に軽度から中等度の炎症が誘発されたのみで、胃の萎縮や形質転換の徴候は見られなかった(図S3HおよびS3I)ことから、胃腫瘍形成の誘導はS. anginosusに特異的であることが推察される。これらの結果を総合すると、S. anginosus感染は胃粘膜の一連の前癌性変化を特異的に引き起こし、進行性の胃壁細胞萎縮、粘液性形質転換、異形成を引き起こし、細胞増殖の増加を伴うという考えが支持される。
S. anginosusはマウスの胃バリア機能と胃内細菌叢の恒常性を損なう
クラウディン18(CLDN18)は胃に特異的に発現するタイトジャンクションタンパク質である16,17。そこでCLDN18の発現を、ジャンクションマーカーのオクルディン(OCLN)およびゾヌラオクルデンス(ZO-1)とともにウェスタンブロットで調べた。図3Iに示すように、CLDN18(p<0.001)、OCLN(p=0.018)およびZO-1(p=0.006)タンパク質は、BHIコントロールマウスと比較して、S. anginosus感染マウスで有意に減少した。同様に、CLDN18は、免疫蛍光染色によって示されるように、S. anginosus感染3ヵ月後に、コーパスの頸部領域および肛門基部で破壊された(図3J)。その結果、CLDN18の消失は、感染後9カ月および12カ月では、胃体部または肛門部の胃腺の全長にわたって明らかであった。さらに、S. anginosus感染は、MKN28およびNCI-N87単層細胞における経上皮フルオレセインイソチオシアネート(FITC)透過性を増加させる能力によって証明されるように、機能的に胃のバリア機能に影響を与えた(図S3J)。これらの結果は、S. anginosus感染による胃のバリア機能の破壊を示唆するものであった。
S. anginosusまたはH. pylori感染後の胃マイクロバイオームの変化を明らかにするために、S. anginosusおよびH. pylori感染マウスの急性期(2週間)、慢性期(3ヶ月および6ヶ月)、前癌期(9ヶ月および12ヶ月)の胃粘膜の16s rRNA配列決定を行った。急性期および慢性期のS. anginosus感染と比較して、前癌期の感染ではSutterella、Parabacteroides、および口腔常在菌であるBacteroides、Prevotella、Aggregatibacterが濃縮され、Bifidobacterium pseudolongumやLactobacillusなどのプロバイオティクスが減少した(図S3K)。プレボテラ(Prevotella)とアグレガティバクター(Aggregatibacter)は、健常人と比較してGC患者の口腔内で増加することが報告されている18。一方、アグレガティバクターはまた、表在性胃炎と比較してGCの胃微生物叢で濃縮されていた19。ネットワーク解析はさらに、前がん段階におけるB. pseudolongumとS. anginosusの間の負の相関を強調した(図S3L;表S5)。このことは、S. anginosus感染が口腔内常在菌を増加させ、胃内のプロバイオティクスを減少させ、その炎症促進作用と腫瘍形成促進作用を助長している可能性を示している。我々の所見と一致して、ストレプトコッカスを含む口腔内微生物群集は、仮性アントラリア化したIM炎症性微小環境と関連している20。一方、前癌段階のピロリ菌は、B. pseudolongumの枯渇とともに、ラクトバチルス、ストレプトコッカス、ユーバクテリウム、およびプレボテラを豊富に含んでいた(図S3MおよびS3N;表S5)。
S. anginosusは無菌マウスにおいて自然粘液性形質転換を誘導する。
次に、S. anginosusが単一細菌として胃の腫瘍形成を促進するかどうかを検討した。この目的のために、S. anginosusを無菌マウスに9ヵ月間接種した(図4A)。無菌マウスの胃粘膜におけるS. anginosusのコロニー形成の成功はFISH、PCR、qPCRによって確認され、新鮮胃組織の細菌培養によって生きたS. anginosusの存在が示された(図4B-4E)。BHI対照マウスの組織学的評価では異常は認められなかったが、S. anginosus感染マウスでは感染後9カ月で粘液性転移が認められた(8匹中3匹;p = 0.035)(図4Fおよび4G)。Ki-67 陽性細胞の増加(p = 0.007)から明らかなように、S. anginosusは一貫して細胞増殖を促進した(図4Hおよび4I)。CLDN18およびOCLNタンパク質の発現はS. anginosusによって有意に低下したことから、S. anginosusは無菌マウスにおいて胃のタイトジャンクションを破壊することが示唆された(図4J)。以上の結果から、S. anginosusが胃の腫瘍化を促進する直接的な病原性を有することが確認された。
図のサムネイルgr4
図4Streptococcus anginosusは無菌マウスにおいて粘液性形質転換を促進する。
キャプション
大きな画像を見るダウンロード 高解像度画像
S. anginosusはin vivoでYTN16移植片の増殖を促進する
S.アンジノサスがGCの進行を促進するかどうかを調べるために、マイクロサテライト不安定性(MSI)GCのモデルであるマウスGC YTN16細胞21(表S6)をC57BL/6マウスに皮下移植し、その後S.アンジノサスを腫瘍内に注射することにより、GC同種移植モデルを確立した(図5A)。S. anginosusは移植片の成長を有意に促進した(p < 0.01)(図5B)。終点において、S. anginosusを注射した腫瘍は、リン酸緩衝生理食塩水(PBS)を注射した対照マウスと比較して、腫瘍サイズ(図5C)および腫瘍重量(図5D)の有意な増大を示した。一貫して、S. anginosusはYTN16移植片において、Ki-67陽性細胞の増加(図5E)およびターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)媒介dUTPニックエンドラベリング(TUNEL)陽性体の減少(図5F)によって示されるように、それぞれ細胞増殖を増加させ、アポトーシスを抑制した。
図のサムネイルgr5
図5Streptococcus anginosusはマウスの胃がん発生を促進する
キャプション
大きな画像を見るダウンロード 高解像度画像
我々はまた、YTN16細胞を胃漿膜層に注入することにより、正向性GC同種移植マウスモデルを確立した。最終時点で、S. anginosus感染マウスは、BHIブロスを投与した対照マウスと比較して、腫瘍重量(p = 0.03)および腫瘍対胃重量比(p = 0.003)の有意な増加を示した(図5G-5I)。GC細胞の状態に対するS. anginosusの影響を評価するために、S. anginosusに感染した同所性YTN16 GC腫瘍の単一細胞RNA配列決定(scRNA-seq)をさらに行った(図S4A)。悪性細胞の教師なしクラスタリングにより7つの細胞サブクラスターが同定され、YTN16腫瘍における有意な不均一性が示唆された(図S4B)。コントロールと比較して、S. anginosusは分化したGC細胞の割合を減少させ、炎症反応、上皮間葉転換(EMT)、血管新生経路を活性化したクラスターが増加した(図S4Cおよび4D;表S7)。次に、scRNA-seqデータセットに基づいて腫瘍浸潤免疫細胞をマッピングした。S. anginosusに感染したYTN16腫瘍は、炎症性Th17、免疫抑制性腫瘍関連マクロファージ(Angio-TAMおよびLA-TAM)、多形核骨髄由来サプレッサー細胞(PMN-MDSC)、および疲弊したCD8+ T細胞に富んでおり(図S4E-S4H)、S. anginosusは炎症性および免疫抑制性の腫瘍微小環境を促進することが推察された。これらの結果は、S. anginosus-YTN16相互作用が細胞の状態を変化させ、GCにおける腫瘍微小環境を再構築し、腫瘍形成を促進することを示唆した。これらのデータを総合すると、S. anginosusはin vivoにおいてGC移植片の増殖を促進することが示された。
サムネイル図4
図S4Streptococcus anginosusはマウスの胃腫瘍微小環境を再構築する(図5および表S7と関連する
キャプション
大きな画像を見るダウンロード 高解像度画像
S. anginosusはマウスの胃腫瘍形成を促進する
胃腫瘍形成におけるS. anginosusの役割を明らかにするために、N-メチル-N-ニトロソウレア(MNU)誘発GCマウスモデルを樹立した(図5J)。MNU投与9ヵ月後に胃病変が肛門部に観察された(図5KおよびS4I)。S. anginosus感染マウスは、対照マウス(13匹中4匹)およびH. pylori感染マウス(18匹中12匹、p<0.05)と比較して、腫瘍発生率が有意に増加した(11匹中10匹、p=0.003)(図5KおよびS4J)。一貫して、腫瘍数(p = 0.006)および腫瘍サイズ(p < 0.05)の両方が、MNUのみで処置した対照マウスと比較して、S. anginosus感染マウスで有意に高かった(図5L)。組織学的検査では、S. anginosus感染マウスの36.4%に高悪性度異形成(HGD)が認められ、これはMNU単独投与マウス(15.4%)より高く(図5M)、H. pylori感染マウス(HGD22.2%、腺癌5.6%)と同程度であった(図S4K)。従って、S. anginosusはKi-67染色によりMNU処理対照マウスと比較してより高い細胞増殖を誘導した(p < 0.05)(図5N)。これらの所見から、S. anginosusはMNUで誘導されたマウスの胃の腫瘍化を促進することが推察された。
S. anginosus表面タンパク質TMPCは胃上皮細胞上のANXA2レセプターに結合し、S. anginosusのコロニー形成を促進する。
S. anginosusがマウスの胃粘膜にコロニー形成することが確認されたので、この細菌の接着特性を調べた。細菌付着および浸潤アッセイにより、S. anginosus(感染多重度[MOI]=50)はAGSおよびGes-1細胞に付着および浸潤できることがそれぞれ示された(図6A)。次に、走査型電子顕微鏡(SEM)を用いてS. anginosusの胃上皮細胞への接着を可視化した。図6Bに示すように、S. anginosus(<1μm、コロイド状)はAGSおよびGes-1細胞の表面に付着し、病原体と宿主の界面が明瞭であった。このことは、S. anginosusが胃の上皮細胞との直接的な相互作用を通して発癌作用を示す可能性を示している。
図サムネイルgr6
図6TMPC-アネキシンA2(ANXA2)軸を介して胃上皮細胞と相互作用するストレプトコッカス・アンギノサス
キャプション
大きな画像を見るダウンロード 高解像度画像
S.アンジノサスが胃上皮細胞に付着・侵入する基本的なメカニズムを解明するため、宿主レセプターと結合可能な細菌アドヘシンを同定することを試みた。ビオチンプルダウンアッセイを用いて、S. anginosusアドヘシンとGes-1膜タンパク質との相互作用の可能性を探った(図6C)。質量分析により3つのS. anginosusタンパク質が同定されたが、そのうち表面タンパク質はTMPCだけであった(表S8)。TMPCはATP結合カセット(ABC)様トランスポーターファミリーに属するリポタンパク質で、プリンヌクレオチドのトランスポーターとして機能する23。S. anginosus TMPCのホモロジーアラインメントから、GC生検で濃縮された多くのStreptococcus属の細菌と高い相同性を共有することが明らかになった(図S5A)。Tmpc遺伝子はS. anginosusでは構成的に発現しており、その発現レベルは胃上皮細胞との接触に影響されない(図S5B)。次に、胃上皮細胞上のTMPCの結合レセプターを探した。グルタチオンS-トランスフェラーゼ(GST)タグ付きTMPCリコンビナントタンパク質(GST-TMPC)を大腸菌で発現させ、Ges-1膜タンパク質でGSTプルダウンを行った(図6D)。Ges-1とAGS細胞で10以上の候補バンドが同定された(図6EとS5C)。これらの細胞株から得られた候補タンパク質の重なりから、ANXA2がTMPCの共通受容体であることが明らかになった(表S8)。共免疫沈降(co-IP)アッセイでは、Ges-1細胞およびAGS細胞において、GST-TMPCによるANXA2のプルダウンが一貫して示され(図6F)、これは抗ANXA2を用いた相互co-IPによって検証された(図6G)。さらに、TMPCとANXA2の直接的な相互作用は、組換えANXA2と組換えGST-TMPCを用いたCo-IPアッセイ(図6H)およびマイクロスケールサーモフォレーシス(MST)(図6I)によって確認された。MSTは生体分子間相互作用を解析する画期的な技術であり24、ANXA2とTMPCの見かけの解離定数(Kd)が57.4μMであることが示された(図6I)。
サムネイル図5
図S5TMPC-ANXA2軸を介して胃上皮細胞と相互作用するストレプトコッカス・アンギノサス(図6および表S8関連
キャプション
大きな画像を見るダウンロード 高解像度画像
胃上皮細胞におけるS. anginosusのコロニー形成を媒介するTMPC- ANXA2の機能的役割は、Ges-1およびAGS細胞でANXA2を低分子ガイドRNA(sgRNA)により枯渇させることにより検証された(図6J)。ANXA2ノックアウトは、スモールガイド陰性対照(sgNC)細胞と比較して、S. anginosusの付着および浸潤を阻害した(図6KおよびS5D)。S.アンジノサスによる胃腫瘍形成におけるTMPCの機能的重要性を決定するために、挿入的不活性化(図6L)を利用してS.
Δ
Tmpc変異株(図6MおよびS5E)を作製した(図6N)。野生型S. anginosusと比較して、S. anginosus
Δ
Tmpcは、in vitroでは細胞接着能と浸潤能に著しい障害を示し(図6OおよびS5F)、in vivoではYTN16移植片の増殖を誘導できなかった(図6Pおよび6Q)。これらの結果から、TMPCはその表面タンパク質であるTMPCが胃上皮細胞上のANXA2受容体に結合することにより、S. anginosusの胃上皮細胞へのコロニー形成を仲介し、腫瘍形成に機能的に必須であることが確認された。
S. anginosusはTMPC-ANXA2相互作用を介してMAPKシグナル伝達経路を活性化する
S. anginosusによる胃発がんに関与する下流のシグナル伝達機構を調べるために、S. anginosusに感染した従来型マウス(12ヵ月)の胃組織とコントロールマウスの胃組織のRNA-seqを行った。ボルケーノプロットによると、S. anginosus感染マウスでは1,727遺伝子がアップレギュレートされ、1,020遺伝子がダウンレギュレートされた(図7AおよびS6A)。パスウェイ濃縮解析の結果、S. anginosus感染マウスではRas、MAPK、ホスファチジルイノシトール3キナーゼ(PI3K)-AKTを含むいくつかの発がんパスウェイがアップレギュレートされていた(図7B)。エンリッチメントスコアは、MAPKシグナル伝達がS. anginosus感染によって有意に活性化されることを示した(図7C)。実際、S. anginosus感染マウスではp-ERK1/2、p-JNK、およびp-AKTのタンパク質発現がウェスタンブロットで示されるように顕著に増加し(図7D)、下流のサイクリンD1の誘導も伴っていた(図7D)。我々はMNU GCマウス(9ヶ月)においてこの観察結果を検証した。同様に、S. anginosusはp-ERK1/2(p=0.006);p-AKT(p=0.006);p-c-Jun(p=0.002)、下流のCyclin D1(p=0.048);およびc-Myc(p=0.018)のタンパク質発現を有意に増加させた(図7E)。S. anginosusはまた、感染後9ヶ月目に無菌マウスの胃でp-ERK1/2とp-JNKを誘導した(図S6B)。さらに、S. anginosusをGes-1およびAGS細胞と共培養すると、p-ERK1/2、p-ACTおよびp-JNKタンパク質の発現が急速に増加した(図7F)。同様に、S. anginosusはKRAS野生型GC細胞株であるMKN28およびNCI-N87にも接着・侵入し(図S6C)、MAPKシグナル伝達を活性化した(図S6D)。S. anginosusによるMAPKシグナルの活性化は、TMPC-ANXA2相互作用に決定的に依存している。Ges-1およびAGS細胞におけるANXA2のノックアウトは、S. anginosusによるp-ERK1/2、p-AKTおよびp-JNKの誘導を消失させた(図7G)。組換えTMPCタンパク質もまた、AGS細胞およびNCI-N87細胞においてp-ERK1/2、p-AKTおよびp-JNKを誘導した(図S6E)。さらに、TMPCの欠失は、in vivoでのYTN16移植片におけるS. anginosusによるp-ERK1/2およびp-JNKの誘導を阻害した(図7H)。この結果は、S. anginosusがTMPC-ANXA2相互作用を介してMAPKシグナル伝達を促進し、胃上皮における腫瘍形成促進作用に寄与していることを示唆している。
図のサムネイルgr7
図7Streptococcus anginosusはTMPC-ANXA2軸を介してMAPKシグナル伝達を活性化する。
キャプション
大きな画像を見るダウンロード 高解像度画像
図サムネイルfigs6
図S6TMPC-ANXA2軸を介してMAPKシグナル伝達を活性化するストレプトコッカス・アンギノサス(図7関連
キャプション
大きな画像を見るダウンロード 高解像度画像
考察
ピロリ菌は長い間、胃腫瘍形成の原因物質と考えられてきた。しかし、胃粘膜におけるピロリ菌の優位性は、病期が萎縮、形質転換、GCへと進行するにつれてほとんど低下する。この観察に興味をそそられた我々は、GCにおける非H.ピロリ菌のマイクロバイオームの役割を明らかにしようとした。本論文では、S. anginosusが胃の腫瘍形成に関与していることを明らかにし、S. anginosusが胃の上皮細胞とコミュニケートして腫瘍形成を促進するメカニズムを明らかにする。
S. anginosusはマウスの胃に容易にコロニー形成し、Ccl20およびCcl8を含む炎症性サイトカインの上昇を伴う急性炎症反応を開始し、次いで集中的かつ持続的な胃炎を伴う慢性期に移行する。慢性の炎症は胃腫瘍形成の環境的誘因である25。一貫して、我々はS. anginosusの長期感染が、胃壁細胞の萎縮、粘液性形質転換、異形成を含む進行性の胃病理を引き起こすことを見出した。S. anginosusによる形質転換は、組織学的に証明され、アルシアンブルー陽性細胞とGSII陽性粘液頸部細胞の増加、および胃内在性因子(GIF)陽性主任細胞の減少によって確認された26。従来のマウスで得られた知見と同様に、無菌マウスにS. anginosusを単独感染させると、粘液性形質転換の発生も誘導された。このことは、S. anginosus自体ではなく、S. anginosusと胃内細菌叢との相互作用が、胃の腫瘍形成を促進するのに十分であることを示唆している。S.アンジノサス菌の前がん段階での感染は、胃pHの上昇と胃内細菌叢の変化を引き起こし、病原性口腔常在菌(PrevotellaおよびAggregatibacter)の濃縮とプロバイオティックB. pseudolongumの枯渇をもたらす。したがって、S. anginosus感染による胃内細菌叢の異常は、胃の炎症性・腫瘍性微小環境の形成に寄与している可能性がある。我々の結果を裏付けるように、ヒトGCマイクロバイオームを無菌マウスに糞便移植すると、一連の前癌性変化が始まる27。これらの知見から、S. anginosusは非ピロリ菌の病原性細菌であり、マウス胃の再プログラムされた胃マイクロバイオームと同時に、胃炎と前癌性萎縮-多形成-異形成の一連の流れを引き起こすことが明らかになった。
S. anginosusの発癌促進能をさらに調べるため、次にYTN16移植片およびMNU誘発自然胃癌発生に対する効果を評価した。いずれのマウス実験においても、S. anginosusは有意にGCの発生を促進した。S.anginosusは皮下および同所がんモデルの両方でYTN16移植片の増殖速度を高め、MNUモデルにおけるS.anginosusの投与は、特に高悪性度の局所浸潤性異形成について、より高い胃がん発生率で異形成転換を悪化させた。S. anginosus感染は胃粘膜および腫瘍における細胞増殖を増加させる。さらに、S. anginosus感染は、タイトジャンクションマーカーCLDN18、OCLNおよびZO-1の発現の時間依存的低下によって示されるように、胃のバリア機能を障害することを示した。タイトジャンクションは細胞の極性を維持するために重要であり、その破壊は上皮性腫瘍形成の特徴である。例えば、胃のユニークなタイトジャンクションタンパク質であるCLDN18の欠損は、マウスにおいて自然発生的な新生物と腫瘍形成をもたらす28,29。細胞間タイトジャンクションの障害はまた、胃粘膜上皮細胞への細菌の接着と侵入を促進し、持続的なコロニー形成と胃粘膜への損傷を可能にする30。
細菌の付着は、しばしば腫瘍形成の開始の前提条件となる。胃上皮におけるS. anginosusの発癌性の役割に鑑み、我々はS. anginosusと胃上皮との直接的な相互作用を解明した。S. anginosusは胃上皮細胞に容易に接着し、浸潤した。我々はS. anginosusの表面アドヘシンであるTMPCを同定し、このTMPCはプルダウンアッセイで観察されたように胃上皮細胞のレセプターと直接相互作用することを明らかにした。レシプロIPにより、TMPCが胃細胞上に発現するANXA2のリガンドとして機能することが示された。組換えTMPCとANXA2を用いた実験では、見かけのKdが57.4μMであることから、その直接的な相互作用が確認された。この相互作用はS. anginosusの腫瘍形成機能に必須であり、TMPCの遺伝子欠損はS. anginosusの付着、浸潤および腫瘍形成性を消失させた。これらの観察と一致して、TMPCは肺炎球菌の肺感染と病原性に必要であることが報告されており31、ヒトにおける肺炎球菌のコロニー形成におけるこのタンパク質の病原的役割を示している。一方、ヒトGC細胞でANXA2に対応するレセプターをノックアウトすると、S. anginosusの胃上皮細胞への付着と浸潤がほとんど減少した。我々の結果と一致して、ANXA2は大腸菌32や緑膿菌などの他の細菌のレセプターとして同定されている33。これらを総合すると、S. anginosusは主にTMPC-ANXA2タンパク質複合体を介して宿主胃上皮細胞と相互作用している。
そして、S. anginosusと胃上皮細胞との相互作用により、発がん性シグナル伝達カスケードが開始される。トランスクリプトーム・プロファイリングとKyoto Encyclopedia of Genes and Genomes(KEGG)解析により、S. anginosus感染マウスではMAPKシグナル伝達が有意に濃縮されていることが明らかになった。MAPKは以下の3つのサブファミリーの活性化を介してGCの進行に関与している: ERK、JNK、p-38キナーゼ34,35,36は細胞増殖を促進する上で重要な役割を果たす一方、JNKとp38はアポトーシスと炎症に密接に関連している37。S. anginosusは、in vitroおよびin vivoの胃細胞において、ウェスタンブロットで示されるように、ERKとJNKのリン酸化を誘導した。その結果、細胞の生存、増殖、アポトーシスの制御に重要な役割を果たすp-AKT、サイクリンD1、c-Myc、c-Junなどの下流標的が活性化された。さらに、ANXA2を欠損させると、胃上皮細胞におけるS. anginosusが介在するp-ERK、p-AKTおよびp-JNKの活性化が消失し、TMPCとANXA2の相互作用がMAPK活性化とこの細菌の腫瘍形成促進作用の上流で機能していることの重要性が立証された。ANXA2が腫瘍形成促進因子としての役割を果たすことを裏付けるように、これまでの研究で、ANXA2がRalA依存性のERK1/2シグナル伝達を促進し38、JNK-p53経路を活性化することが示されている39。
まとめると、我々はS. anginosusを胃腫瘍化を促進する非ピロリ菌として同定した。S. anginosus感染は、胃炎と前癌性萎縮-異形成-異形成の一連の流れを自然に開始し、マウスモデルにおいて胃腫瘍化を促進する。我々は、S. anginosus由来の病原性表面因子TMPCが胃上皮細胞上のANXA2に結合し、細菌の付着、浸潤、および下流での発癌性MAPKシグナルの活性化を引き起こすことを明らかにした。このように、我々の研究は、S. anginosusが胃がん発生の段階における原因病原体であるという証拠を提供するものである。
研究の限界
本研究にはいくつかの限界がある。第一に、我々はS. anginosusと宿主GCとの相互作用を明らかにしたが、免疫細胞や線維芽細胞のような腫瘍微小環境における他の細胞との相互作用の可能性を今後の研究で考慮すべきである。第二に、S. anginosusがGCの進行中に他のGCに濃縮された病原体と協調して働くことができるか、あるいはプロバイオティック細菌によって拮抗されることができるかについても、さらなる研究が必要である。これらの限界にもかかわらず、我々の研究は、GCの発症に寄与しうる非H. pylori微生物の証拠を提供した。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 Invitrogen Cat#A-21207; RRID: AB_141637
ヤギ抗マウス IgG (H+L) 相互吸着二次抗体, Alexa Fluor 488 Invitrogen Cat#A-11001; RRID: AB_2534069
ウサギモノクローナル抗 Akt1 (クローン C73H10) Cell Signaling Technology Cat#2938s; RRID: AB_915788
マウスモノクローナル抗アネキシン A2 (クローン 3H1B11) ProteinTech Cat#60051-1-Ig; RRID: AB_2057309
ウサギポリクローナル抗 GIF Sigma-Aldrich Cat#HPA040774; RRID: AB_10795626
ウサギモノクローナル抗-c-Jun(クローン60A8) Cell Signaling Technology Cat#9165; RRID: AB_2130165
ウサギポリクローナル抗 Claudin 18 Thermo Fisher Scientific Cat#38-8100; RRID: AB_2533383
ウサギ ポリクローナル抗 c-Myc Cell signaling Cat#9402; RRID: AB_2151827
ウサギ ポリクローナル抗サイクリン D1 細胞シグナル Cat#2922s; RRID: AB_2228523
ウサギ ポリクローナル抗ERK1/2 Santa Cruz Biotechnology Cat#sc-292838; RRID: AB_2650548
ウサギモノクローナル抗 GAPDH(クローン D16H11) Cell Signaling Technology Cat#5174s; RRID: AB_10622025
マウスモノクローナル抗GST-Tag(クローン26H1) Cell Signaling Technology Cat#2624; RRID: AB_2189875
ウサギモノクローナル抗 Ki-67 (クローン D3B5) Cell Signaling Technology Cat#12202; RRID: AB_2620142
マウスモノクローナル抗オクルディン(クローン E-5) Santa Cruz Biotechnology Cat#sc-133256; RRID: AB_2156317
ウサギモノクローナル抗 PCNA(クローン D3H8P) Cell Signaling Technology Cat#13110; RRID: AB_2636979
ウサギポリクローナル抗ホスホ-Akt(Ser473) Cell Signaling Technology Cat#9271s; RRID: AB_329825)
ウサギモノクローナル抗ホスホ-c-Jun (Ser73) (clone D47G9) Cell Signaling Technology Cat#3270; RRID: AB_2129575
ウサギモノクローナル抗ホスホ-p38 MAPK (Thr180/Tyr182) (clone D3F9) Cell Signaling Technology Cat#4511s; RRID: AB_2139682
ウサギモノクローナル抗ホスホ-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (clone 197G2) Cell Signaling Technology Cat#4377; RRID: AB_331775
マウスモノクローナル抗 SAPK/JNK (Thr183/Tyr185) (クローン G9) Cell Signaling Technology Cat#9255s; RRID: AB_2307321
ウサギポリクローナル抗 SAPK/JNK Cell Signaling Technology Cat#9252; RRID: AB_2250373
ウサギ ポリクローナル抗 ZO-1 Abcam Cat#ab96587; RRID: AB_10680012
ウサギ モノクローナル抗 β-アクチン(クローン 13E5) Cell Signaling Technology Cat#4970; RRID: AB_2223172
ウサギポリクローナル抗TMPC 本試験 N/A
細菌およびウイルス株
ストレプトコッカス・アンギノサス ATCC Cat#ATCC 33397
ヘリコバクター・ピロリ SS1 香港中文大学 N/A
大腸菌 Sangon Biotech N/A
S. anginosus
Δ
Tmpc 本研究 N/A
化学物質、ペプチド、リコンビナントタンパク質
Griffonia simplicifolia 由来レクチン GS-II, Alexa Fluor 488 複合体 Invitrogen Cat#L21415
N-メチル-N-ニトロソウレア Aladdin N136701
FITC デキストラン (4kDa) Sigma-Aldrich 46944
EZ-Link™ Sulfo-NHS-LC-ビオチン Thermo Fisher Scientific 21335B
リコンビナントGST-TMPCタンパク質 本研究 NA
組換えアネキシンA2タンパク質 Origene AR09353PU-N
コンピテンス刺激ペプチド1 ChinaPeptides EMRLSKFFRDFILQRKK
エリスロマイシン アラジン E105345
スルファジアジン MedChemExpress Cat#HY-B0273
アストレオナム MedChemExpress Cat#HY-B0129
ゲンタマイシン MedChemExpress Cat#HY-A0276A
重要な市販アッセイ
PrimeScript RT 試薬キット Takara RR037A
マウス炎症反応および自己免疫PCRアレイ QIAGEN PAMM-077Z
Pierce™ 銀染色(質量分析用) Thermo Fisher Scientific 24600
Hisタグ標識キット Red-tris-NTA NanoTemper Technologies MO-L018
QIAamp DNA ミニキット QIAGEN Cat#51306
寄託データ
マウス胃組織のRNA配列データ 本研究GSA: CRA014025
胃生検サンプルの 16S rRNA 遺伝子配列データ Coker et al.5 N/A
胃生検サンプルの16S rRNA遺伝子配列データ Sung et al.9 N/A
胃生検サンプルの16S rRNA遺伝子配列データ Ferreira et al.10 RJNA413125
胃腫瘍サンプルの 16S rRNA 遺伝子配列データ Yu et al.11 PRJNA310127
実験モデル 細胞株
ヒト Ges-1 細胞 細胞研究所、上海 N/A
ヒト AGS細胞 ATCC CRL-1739
ヒト293T細胞 ATCC CRL-3216; RRID: CVCL_0063
マウス YTN16 細胞 野村幸教授より寄贈 N/A
ヒト MKN28細胞 JCRB JCRB0253
ヒト:NCI-N87細胞 ATCC CRL-5822; RRID: CVCL_1603
実験モデル 生物/系統
マウス C57/BL6 香港中文大学 N/A
マウス 無菌 BALB/c 第三軍医科大学 N/A
オリゴヌクレオチド
ガイドRNA標的配列:ヒトANXA2:TCACCTACCTTTGTCTTGA GenScript N/A
PCR用プライマー、表S1参照 BGI Genomics N/A
FITC標識S. anginosusプローブ(配列:5'-AGT TAA ACA GTT TCC AAA GCC TAC-3') FOCOFISH, Guangzhou N/A
組み換えDNA
プラスミド pGEX-4T-1 ベクター Sangon Biotech N/A
プラスミド lentiCRISPRv2 ベクター Addgene Cat#108100; RRID: Addgene_108100
プラスミド pUC19-Tmpc∷Ermb 本研究 N/A
プラスミド p919 ベクター Barbara Spellerberg 教授より寄贈 N/A
ソフトウェアとアルゴリズム
GraphPad Prism 8.2 グラフパッドソフトウェア www.graphpad.com
Image Lab バージョン 5.2.1 Bio-Rad N/A
MO Affinity Analysis v.3.0.5 NanoTemper Technologies N/A
Cell Ranger v7.2.0 10xgenomics www.10xgenomics.com
R project R Core Team www.r-project.org
その他
Tmpc 遺伝子 ATCC 33397 株 ATCC 遺伝子座 タグ EODJBPNH_00792
新しいタブで表を開く
リソースの有無
リードコンタクト
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるJun Yu博士 (junyu@cuhk.edu.hk) までお願いします。
利用可能な材料
本研究で作製したプラスミド、組換えTMPC蛋白質、抗TMPC抗体は、要請があればリードコンタクトが共有する。
データおよびコードの利用可能性
Ferreira et al.10およびYu et al.11の生データは、それぞれSequence Read Archiveのaccession PRJNA413125およびPRJNA310127から取得した。mosue胃組織のRNAシーケンスデータは、China National Center for Bioinformation / Beijing Institute of Genomics, Chinese Academy of Sciences (GSA: CRA014025)のNational Genomics Data Center (Nucleic Acids Res 2022)のGenome Sequence Archive (Genomics, Proteomics & Bioinformatics 2021)に寄託されている。Coker et al.5およびSung et al.9のデータセットは、要請があれば代表者が共有する。
本論文はオリジナルのコードを報告していない。
本論文で報告されたデータの再解析に必要な追加情報は、要請があれば研究責任者から入手可能である。
実験モデルと研究参加者の詳細
マウスモデル
従来型マウスにおけるS. anginosus感染
雄性C57BL/6従来型マウス(6~8週齢)を無作為に3群に割り付けた: BHI(陰性対照)、H. pylori SS1(陽性対照)、S. anginosusの3群に無作為に割り付けた。BHI群およびS. anginosus群には,3日に1回,ブロス培地(200 μL)または細菌(200 μLのBHIブロス中2×109コロニー形成単位(CFU))を経口投与した。H. pylori SS1感染マウスには、2週間で5回、細菌(200μL BHIブロス中2×109 CFU)を投与し、胃内でのコロニー形成を成功させた。各群のマウスは、感染後2週間、3ヶ月、6ヶ月、9ヶ月、12ヶ月で犠牲にした。H. pylori SS1とS. anginosusの同時感染モデルマウスでは、初回投与から両菌を一緒に経口投与した。すべての動物実験は香港中文大学の動物実験倫理委員会の承認を得た。
無菌マウスにおけるS. anginosus感染
S. anginosus単独感染無菌マウスモデルとして、無菌BALB/C系雄性マウス(8週齢)をBHIブロス対照群とS. anginosus感染群に無作為に分けた。マウスにBHI(200μL)またはS. anginosus(2×109 CFU in 200 μL BHI broth)を週1回経口投与し、感染後9カ月目に犠牲とした。すべての動物実験は、第三軍医科大学動物実験倫理委員会の承認を得た。
腫瘍移植マウス
YTN16細胞を50%マトリゲルに懸濁し、雄性C57BL/6マウス(8週齢)に皮下移植した(腫瘍あたり8x106細胞)。無作為にPBS群とS. anginosus群に分けた(各群n = 10)。PBSまたはS. anginosus(50 μL PBS中105 CFU)を5日ごとに腫瘍内に注射した。S. anginosusΔTmpc関連移植マウスモデルでは、PBSまたは細菌(S. anginosusまたはS. anginosusΔTmpc、50μL PBS中105 CFU、各群n=7)を1週間に1回腫瘍内に注射した。同所性腫瘍モデルを確立するため、マウスをイソフルランで麻酔し、腹部の周囲を剃毛した22。切開して胃を露出させ、30μLのマトリゲル(PBS中25%)中のYTN16細胞(5x106)を胃の漿膜に注入し、切開部を縫合した。術後2週目からS. anginosus(2×109 CFU、n=21)またはBHIブロス(n=19)をマウスに経口投与し、8週目に犠牲とした。すべての動物実験は、香港中文大学の動物実験倫理委員会の承認を得た。
マウスにおけるMNU誘発胃発がん
雄性C57/BL6マウス(5週齢)にMNU(240ppm、N136701、アラジン社製)を飲料水にて5代替週投与した。MNU投与の最終サイクル後、マウスにBHIブロス(n =13)またはS. anginosus(n =11)を3日に1回経口投与した。H. pylori SS1群(n =18)のマウスには、H. pylori SS1を3日に1回、5回経口投与し、感染を成立させた。36週目にマウスを犠牲にした。すべての動物実験は香港中文大学の動物実験倫理委員会の承認を得た。
被験者、細菌、細胞株の詳細
ヒト被験者
表在性胃炎(SG)110名、萎縮性胃炎(AG)117名、腸管形質転換(IM)45名、GC39名のヒト胃生検組織311名の16s rRNA遺伝子配列から、胃粘膜におけるS. anginosusの存在量を定量した5。
細菌
S. anginosus(ATCC 33397)はAmerican Type Culture Collectionから入手した。S. anginosusはBHI寒天培地(CM1136B; Thermo Fisher Scientific)プレートで培養し、BHIブロス(CM1135B; Thermo Fisher Scientific)培地で37℃、好気的条件下で一晩増殖させた。H. pylori SS1は、コロンビア血液寒天培地(PP2001、Thermo Fisher Scientific)で、37℃、3日間、嫌気的に培養した。大腸菌DH5aはpUC19-Tmpc∷Ermbプラスミドの宿主となった。大腸菌は400ug/mLのエリスロマイシンを添加したルリアブロス・ミラー(LB)ブロスで培養した。S. anginosus
Δ
Tmpcは5ug/mLのエリスロマイシン存在下で培養した。
細胞株
ヒト胃細胞株AGSおよびNCI-N87はAmerican Type Culture Collection(ATCC)から入手した。ヒト胃細胞株MKN28は、Japanese Collection of Research Bioresources(JCRB)から入手した。ヒト胃細胞株Ges-1はCell Research Institute, Shanghaiから入手した。AGSおよびGes-1細胞株は、Dulbecco's Modified Eagle's Medium(DMEM)培地(11965092、Thermo Fisher Scientific)で培養した。MKN28およびNCI-N87は、Rosewell Park Memorial Institute(RPMI)1640培地(61870036、Thermo Fisher Scientific)で培養した。すべての細胞培養培地は、10% FBS、1% Penicillin-Streptomycin solution (15070063, Thermo Fisher Scientific)で補充した。マウスYTN16胃癌細胞株は、東京大学の野村幸教授から贈られた。21。これらの細胞株はすべて、5%CO2を含む加湿雰囲気で培養した。
方法の詳細
組織学的評価
マウスの胃を大弯に沿って切断し、冷PBS(pH7.4)で洗浄した。非腺部分を除去し、胃を体部と肛門部からなる断片に切断した。胃の隣接していない2片(厚さ2-3mm)を新鮮な10%ホルマリン溶液で固定した。パラフィン包埋胃切片(4 μm)をH&E染色し、経験豊富な病理医が確認した。
蛍光in situハイブリダイゼーション(FISH)
FITC標識S. anginosusプローブ(配列:5'-AGT TAA ACA GTT TCC AAA GCC TAC-3')を使用して、パラフィン包埋胃切片中のS. anginosusコロニー形成を検出した。脱パラフィンおよび再水和後、標本を0.2N塩酸およびプロテイナーゼKで10分間ずつ処理した。55℃のブロッキングバッファーで2時間インキュベートした後、FITC標識S. anginosusプローブ(35%ハイブリダイゼーションバッファー中1:50、使用前に88℃で3分間予熱)を加え、42℃の暗室で一晩ハイブリダイズさせた。標本を洗浄液(20 mM Tris-HCl, pH=7.2; 40 mM NaCl)で洗浄し、DAPI-antifade solution (P36931, Thermo Fisher Scientific)でマウントした。画像は蛍光顕微鏡(Leica)で取得した。
マウス胃からの生菌培養
新鮮なマウス胃組織を50%BHI-グリセロール培地(300μL)でホモジナイズし、ブランクBHI寒天培地または抗生物質添加TSA寒天培地(Tryptic Soy Broth (257371, BD Biosciences)にSulfadiazine 1mg/mL、Aztreonam 0.2mg/mLを添加)で連続希釈(5倍および25倍希釈)して細菌培養を行った。生きたS. anginosusを確認するため、コロニーをMALDI-TOF質量スペクトル(MS)分析用に採取した(表S3)。MSの結果を検証するために、コロニーPCRとサンガーシークエンシングを行った。
血清アラニントランスアミナーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)およびクレアチニンの検出
血清ALT、ASTおよびクレアチニンは、Catalyst One Chemistry Analyzer(IDEXX Laboratories社)を用いて、製造元の指示に従って評価した。50マイクロリットルの血清をPBSで200μLに希釈した。希釈した血清とALT、AST、クレアチニンのスライドを自動分析のために一緒にロードした。
マウス胃pH検出
犠牲にする前に、マウスは6時間餌を絶たれた。胃は直ちに摘出され、大弯部から切断された。胃を2mLの生理食塩水で洗浄し、回収した内容物を遠心分離した(4000rpm、10分、4℃)。その後、得られた上清をpHメーター(8302BNUMD、Thermo Fisher Scientific)による胃pH測定に用いた。
アルシアンブルー染色
パラフィン包埋胃切片をキシレンで脱パラフィンし、勾配アルコール溶液で再水和した。胃切片スライドをまず3%酢酸で10分間インキュベートし、アルシアンブルー溶液(3%酢酸中1%アルシアンブルー)で30分間染色した。核ファストレッドで10分間カウンターステインした後、スライドを水道水で洗浄し、勾配エタノールで脱水し、DPXマウント剤(06522、シグマ)でマウントした。
免疫組織化学(IHC)染色
Ki-67(12202、Cell Signaling Technology)と増殖細胞核抗原(PCNA)(2586、Cell Signaling Technology)のIHC染色をパラフィン包埋切片(4μm)で行った。増殖指標は、陽性細胞のパーセンテージで算出した。各マウスについて、100倍の倍率で、体部から肛門部まで少なくとも5フィールドを無作為にカウントした。
免疫蛍光(IF)染色
クローディン18(38-8100、Invitrogen)、GIF(HPA040774、Sigma)およびGSII(L21415、Thermo Fisher Scientific)のIF染色をパラフィン包埋胃組織切片(4μm)に対して行った。画像は蛍光顕微鏡(Leica)で取得した。
FITC-デキストラン透過性アッセイ
MKN28およびNCI-N87細胞を12ウェルのトランスウェルインサート(孔径0.4μmの組織培養用インサート、CLS3460、Corning Costar)に播種した。細胞はコンフルエントに達した後、さらに7日間培養し、培地は毎日交換した。MKN28またはNCI-N87単層細胞をS. anginosusに30分間感染させ、PBSで3回洗浄した。FITC-デキストラン(4kDa、Hanks' Balanced Salt Solution(HBSS)バッファー中1mg/mL、46944、Sigma)をインサートに添加した。経上皮フラックスFITC-デキストランは、励起λ 485 nmおよび発光λ 535 nmで測定した。
16S rRNA配列決定とデータ解析
マウスの胃組織は、ムタノライシンとリゾチームで消化した後、ビーズビートで破砕した。DNA 抽出は QIAamp DNA mini kit を用いて行った。DNA ライブラリーの調製と 16S リボソーム RNA 遺伝子のシークエンシングは NovoGene, Tianjin, China で行った。16S rRNA遺伝子のV3-V4領域は、特異的プライマー(341F [CCTAYGGGRBGCASCAG]と806R [GGACTACNNGGTATCTAAT])とバーコードを用いて増幅した。16S rRNA遺伝子の配列データは、QIIME2(バージョン2019.4.0;デフォルトパラメーター)ソフトウェアを用いて品質フィルターをかけ、解析した。簡単に述べると、配列決定エラーおよび複製配列は、デフォルトパラメーターを用いたDeblurアルゴリズムによって検出した。アンプリコン配列バリアント(ASV)をコードする配列の複製を解除する前に、ペアリードを結合し、450塩基対にトリミングした。キメラ配列をフィルターした後、VSEARCHソフトウェアにより、Greengenes 16S rRNA遺伝子参照データベースを用いて、同一性99%カットオフで脱複製配列を分類した。ベイズ法を統合することで技術的および統計的誤差を推論する組成指向の手法であるALDEx2(デフォルトパラメータ)を用いて、差次的に濃縮された微生物を解析した。微生物間の相互作用はSparCC法で推定した。分類群間の相関係数は、推論反復の平均を100に設定し、10,000のシミュレーションデータセットを生成して、対応する経験的P値を計算することで推定した(表S5)。
シングルセルRNAシーケンス(scRNA-seq)とデータ解析
YTN16誘導定位性胃がんモデルマウスの胃の腫瘍組織。簡単に述べると、腫瘍組織を1-3 mm3に切り出し、Enzyme cocktail with Tumor dissociation kit (130-090-730, Mitenyi Biotec)で消化した。解離した単一細胞を、Nanocellect WOLF Cell Sorterを用いて、FITC抗マウスCD45(103108, Biolegend)と死細胞マーカーPIで選別した。CD45陰性細胞とCD45陽性細胞は、以下のシングルセル・トランスクリプトーム・シーケンシング解析に供した。
ScRNA-seqデータは、10×GenomicsソフトウェアパッケージCell Ranger version 7.1.0を用いて解析した。データは10×Genomics社が提供するmm10参照ゲノムにマッピングされた。遺伝子数マトリックスは、Cell Rangerによってユニーク分子識別子(UMI)から生成された。データマトリックスは、各細胞のUMIの総数で割ることにより、シーケンス深度に対して正規化され、RパッケージSeuratを用いて対数スケールに変換された。正規化後、細胞をPtprc(Cd45)遺伝子に基づいて免疫細胞と非免疫細胞に分け、さらにEpcam遺伝子によって上皮細胞をスクリーニングした。腫瘍細胞はマーカー遺伝子の発現により同定された: Chga、Chgb、Pgc、Muc5ac、Col3a1、Cdh17、Pdgfrb、Cldn4、Tff3、Cldn7。微分発現遺伝子(DEGs)は、R関数のFindALLMarkersとWilcoxon Rank Sum検定を用いて算出した(表S7)。免疫細胞の解析では、既知のマーカー遺伝子を用いて、以下のように細胞クラスターを割り当てた:Plasma cell_Mzb1/Jchain/Derl3/Igkn/Iglc3/Ppib、 肥満細胞_Tpsb1/Tpsb2/Gata2/Ms4a2/Cpa3/Mcpt2、B細胞_Cd79a/Cd19/Bank1、樹状細胞(DC)_Flt3、好中球_S100a8/S100a9/Csf3r、単球-マクロファージ_Itgam/、T細胞_Cd3g/Cd8a/Cd4。T細胞または骨髄系細胞の各細胞サブタイプの割合は、2比例z検定で計算した。scRNA-seqはSingle Cell Omics Core, School of Biomedical Sciences, Faculty of Medicine, The Chinese University of Hong Kongで行われた。
細菌付着・浸潤アッセイ
生きたS. anginosus、またはS. anginosus
Δ
Tmpc(MOI=50)を10%FBS添加抗生物質フリーDMEM培地に懸濁し、胃上皮Ges-1またはAGS細胞単層と2時間共培養した。細胞溶解液を回収し、BHI寒天培地でストリッピングし、連続希釈で付着細菌数をカウントした。浸潤アッセイのために、胃上皮細胞を200μMのゲンタマイシン(G4918、シグマ)でさらに2時間処理してから、細菌のCFUをカウントした。
PCRアレイ
Trizol試薬(Takara)を用いて全RNAを抽出した。相補的DNA(cDNA)をPrimeScript RT reagent Kit(RR037A、タカラ社製)を用いて合成し、マウス炎症反応・自己免疫PCRアレイ(PAMM-077Z、QIAGEN社製)で解析した。検証に用いたqPCRプライマーを表S2に示す。
ウェスタンブロット
Proteinase inhibitors (Roche)とPhosSTOP (Roche)を添加したTissue Extraction Reagent (FNN0071, Thermo Fisher Scientific)でタンパク質を抽出した。画像はImage-Lab(Bio-Rad、バージョン5.2.1)で取り込み、解析した。タンパク質発現レベルはβ-アクチンまたはGAPDHに対して正規化した。
RNA配列決定(RNA-seq)と解析
感染後12ヶ月のS. anginosus投与マウスおよびBHI対照マウスの胃から、Trizol試薬を用いて全RNAを抽出した。RNA-seqはBGI Genomics社(中国、深圳)で実施した。RNA-seqリードは、cutadapt(バージョン1.18)を用いてアダプターを除去して処理し、HISAT2(バージョン2.1.0)を用いてデフォルトのオプションでマウスリファレンス(GENCODE v30)にマッピングした。各遺伝子にマップされたリード数は、HTSeq (version 0.11.2)を用い、オプション-m intersection-nonemptyでカウントした。遺伝子発現量は、DESeq2を用いて、Fragments per Kilobase of transcript per Million mapped reads (FPKM)として算出した。
走査型電子顕微鏡(SEM)
Ges-1またはAGS細胞を滅菌カバースリップに播種し、S. anginosus(MOI50)と2時間共培養した。次に、細胞を新しく調製したSorensen' phosphate buffer(0.1M、pH7.2)で3回洗浄し、2.5%グルタルアルデヒド固定液で一晩固定した。固定したカバースリップをSorensen' phosphate bufferで3回洗浄し、1%四酸化オスミウムで2時間固定した後、蒸留水ですすいだ。脱水後、金パラジウムでコーティングし、冷陰極走査電子顕微鏡(日立SU8010)で観察した。
S. anginosusにおけるTmpc遺伝子の定量的PCR
S. anginosusを上記のようにGes-1またはAGSと共培養した。共培養後、上清の細菌を非付着菌として回収した。Ges-1またはAGS細胞を0.1% Triton-X100で5分間溶解した後、4000rpm、10分間遠心し、付着菌を回収した。非付着菌と付着菌のtotal RNAは、Trizol試薬を用い、事前にビーズビート処理をして抽出した。リアルタイムPCRでは、PrimeScript RT Reagent kit (RR047B, Takara)を用いて全RNAをcDNAに変換し、TB-Green Premix Ex Taq (RR420W, Takara)を用いて、Tmpc遺伝子と参照遺伝子(GyrbとRpob)を増幅するプライマーを用いて解析した。
ビオチンプルダウンアッセイ
Ges-1膜タンパク質をEZ-Link™ Sulfo-NHS-LC-Biotin (2 mM in PBS pH 8.0, 21335B, Thermo Fisher Scientific)で4℃、4時間標識した後、抽出した。S. anginosusペレットをLysis buffer (50 mM Tris-HCl, pH 8.0, 1 mM EDTA, 50 mM NaCl)とプロテイナーゼ阻害剤に懸濁し、リゾチーム(300 μg/mL)、1%(v/v)Triton X-100、DNase Iを加えて攪拌、超音波処理することによりタンパク質を抽出した。結合アッセイを行うために、ビオチン標識Ges-1膜タンパク質をS. anginosus表面タンパク質およびストレプトアビジン磁気ビーズ(HY-K0208)と4℃で一晩インキュベートした。非標識Ges-1細胞膜タンパク質をネガティブコントロールとして用いた。ビーズを洗浄バッファー(PBS pH 7.4, 0.1% Tween-20)で3回洗浄した後、ローディング色素とともに95℃で5分間煮沸した。煮沸したサンプルをSDS-PAGEと銀染色に供し、質量分析でタンパク質バンドを同定した(表S8)。
GSTプルダウンアッセイ
組換えGST-TMPCタンパク質を作製するために、Tmpc遺伝子(ATCC 33397株、Locus Tag EODJBPNH_00792)をpGEX-4T-1ベクターにクローニングし、大腸菌BL21(DE3)に形質転換した。形質転換した大腸菌をアンピシリン添加LBブロス中で37℃で培養した。光学密度が0.6〜1.0に達した時点で、0.5 mM Isopropyl-β-D-thiogalactoside(IPTG)を添加し、20℃で一晩タンパク質合成を誘導した。細菌ペレットを回収し、PBS-基本溶解バッファー(50 mM NaH2PO4, 150 mM NaCl, pH 7.2, 10 mg/mL Lysozyme, Proteinase inhibitors)に懸濁した。10,000rpmで30分間遠心後、上清からGST-TMPCをGST-resinで精製した。Ges-1またはAGS細胞膜タンパク質をTriton X-100抽出バッファー(3 mM EDTA, 1X PIPES buffer, 1% Triton X-100, Proteinase inhibitors, pH 7.4)で抽出した。細胞質溶解液は、透過化バッファー(Thermo Fisher Scientific)で前処理して除去した。GSTプルダウンでは、Ges-1またはAGS細胞膜タンパク質を、組換えGST-TMPCタンパク質とともに、あるいはGST-TMPCタンパク質を含まない状態で、4℃で一晩インキュベートした。煮沸したサンプルをSDS-PAGEと銀染色に供し、質量分析によってタンパク質バンドを同定した(表S8)。
共免疫沈降(Co-IP)
アネキシンA2の共IPのために、抗アネキシンA2抗体(60051-1, Proteintech)およびGes-1またはAGS細胞膜タンパク質を、組換えGST-TMPCとともに、または組換えGST-TMPCなしで、4℃で一晩インキュベートした。マウスIgGは陰性コントロールとして使用した。その後、Dynabeads™ Protein G磁気ビーズ(10004D、Invitrogen)を加え、4時間インキュベートした。煮沸したサンプルをSDS-PAGEに供し、抗アネキシンA2または抗GST(2624、Cell Signaling Technology)で免疫ブロッティングした。GST-TMPCと組換えアネキシンA2(AR09353PU-N、Origene)を用いて、GSTの相互プルダウンも行った。
マイクロスケール熱泳動(MST)
MSTはMonolith NT.115(NanoTemper Technologies)を用いて行った。リコンビナントアネキシンA2をターゲットとし、His-Tag Labeling Kit Red-tris-NTA (MO-L018, NanoTemper Technologies)により蛍光標識した。リガンドには組換えGST-TMPCを用いた。タンパク質はMST緩衝液(1 X PBS, pH 7.2, 0.05% Tween-20, 2.5 mM DTT)で調製した。サンプルはNT.115標準キャピラリーにロードした。分析は、25℃、励起パワー40%、MSTパワー40%、アネキシンA2濃度50nM一定で行った。見かけのKd値はMO Affinity Analysis v.3.0.5を用いて計算した。
CRISPR-Cas9によるANXA2のノックアウト
ANXA2のヒトゲノム遺伝子座(TCACCTACCTTTGGTCTTGA)を標的とするガイドRNAをGenScriptから入手し、lentiCRISPRv2ベクター(108100、Addgene)にクローニングした。その後、293T細胞にlentiCRISPRv2ベクターとパッケージングプラスミドを共導入してレンチウイルスを作製した。Ges-1またはAGS細胞にCRISPR-Cas9-gRNAレンチウイルスを感染させ、ピューロマイシンで7日間選択した。ピューロマイシン耐性クローンを単離し、ウェスタンブロットで確認した。
S. anginosusの構築
Δ
Tmpc
S. anginosus ATCC 33397の染色体DNAを鋳型として、Tmpcの上流および下流領域をプライマー(Tmpc-up_F/RおよびTmpc-down_F/R)を用いて増幅した。Ermb遺伝子はp919プラスミドからプライマーEMR_F/Rを用いて増幅した。Ermb遺伝子をTmpc遺伝子に挿入し、プラスミドpUC19にクローニングし、pUC19-Tmpc)Ermbを得た。S. anginosus(OD600=0.02)をcompetence-stimulated peptide 1(CSP-1、50ug/mL)および得られたプラスミドDNA(1ug/mL)と37℃で3時間インキュベートした後、THY-エリスロマイシン寒天培地にプレーティングした。48時間後にコロニーを採取し、PCR法で挿入の成功をスクリーニングした。細菌染色体DNAをQIAamp DNA Mini kit (Qiagen, 51304)で抽出し、プライマーTmpc-F/Rで増幅し、Ermb遺伝子の挿入を検証した。プライマー配列は表S2に示した。
定量および統計解析
統計解析
ヒト胃生検におけるS. anginosusの存在量は、両側Wilcoxon順位和検定で比較し、P値はFDRで調整した。病理学的スコアはMann-Whitney U検定またはKruskal-Wallis検定で比較した。2群間の平均値の比較にはStudentのt検定を用いた。多群間比較は一元配置分散分析(ANOVA)で行った。腫瘍成長曲線の統計学的差の検定には二元配置分散分析を用いた。2群間の異形成マウスの割合の比較にはカイ二乗(X2)統計量を用いた。統計解析は、GraphPad Prism 8.2(GraphPad Software, Inc.) P値は0.05未満を有意とした。統計解析の詳細は各図に記載した。
謝辞
本研究は、中国国家重点研究開発計画(No.2020YFA0509200/2020YFA0509203)、RGC Theme-based Res Scheme Hong Kong (T21-705/20-N)、RGC Collaborative Research Fund (C4039-19GF, C7065-18GF)、RGC Research Impact Fund (R4032-21F)、RGC-GRF Hong Kong (14163817)、およびCUHK Vice-Chancellor's Discretionary Fundの支援を受けた。YTN16細胞株を提供してくださった野村幸代教授(東京大学、日本)、p919プラスミドを提供してくださったBarbara Spellerberg教授(ウルム大学医療微生物学・病院衛生学研究所、ドイツ)に感謝する。
著者の貢献
K.F.は実験を行い、原稿を執筆した。A.H.K.C.とK.F.T.は病理医として組織学的評価を行った。W.L.、K.Y.、O.O.C.はバイオインフォマティクス解析を行った。Y.Z.、F.W.、P.H.、Y.P.、D.C.はマウス実験を手伝った。N.M.L.はマイクロスケール熱泳動アッセイを手伝った。M.G.とH.H.はプラスミド構築を手伝った。C.C.W.とX.Z.は研究に対するコメントと論文の修正を行った。J.J.Y.S.は本研究を共同監修した。J.Y.S.は本研究の計画・監督を行い、原稿を修正した。
利害関係
著者らは競合する利益はないと宣言している。
補足情報
pdfダウンロード(.29 MB)
pdfファイルのヘルプ
資料S1. 表S1、S2、S4
ダウンロード .xlsx (.02 MB)
xlsxファイルのヘルプ
表S3. 図S1、S2およびSTAR Methodsに関連するBruker MALDI Biotyperの同定結果
(A) S. anginosus感染マウスの胃からの培養菌コロニー、感染後2週間。(B)S.anginosus感染マウスの胃からの培養菌コロニー、感染後3週間。(C)S.anginosus感染マウスの胃からの培養菌コロニー、感染後6週間。(D)S.anginosus感染マウスの胃からの培養菌コロニー、感染後9週目。(E)S.anginosus感染マウスの胃からの培養細菌コロニー、感染後12週。
.xlsxのダウンロード (.02 MB)
xlsxファイルのヘルプ
表S5. S. anginosusおよびH. pylroi感染マウスの胃内微生物生態系ネットワーク(図S3およびSTAR Methods関連
ダウンロード.xlsx (.01 MB)
xlsxファイルのヘルプ
表S6. 図5に関連するYTN16細胞の変異プロファイル
ダウンロード .xlsx (.04 MB)
xlsxファイルのヘルプ
表S7. 図S4およびSTAR Methodsに関連する、単一細胞RNAシーケンスにより同定されたクラスター細胞における上位60の差次発現遺伝子(調整p <0.01)。
ダウンロード.xlsx (.01 MB)
xlsxファイルのヘルプ
表S8. ビオチンプルダウンおよびGSTプルダウンアッセイによるマススペクトルの結果。
(A) ヒトGes-1細胞膜タンパク質に結合するS. anginosus ATCC 33397の外膜タンパク質候補(カバー率 >3%; #unique >1)。(B) S. anginosusアドヘシンTMPCと結合するGes-1およびAGSの細胞膜タンパク質候補(カバー率 >3%; #unique >1)。
参考文献
Sung H.
Ferlay J.
シーゲル R.L.
ラヴァーサンヌ M.
ソエルジョマタラムI.
ジェマル A.
ブレイ F.
世界のがん統計2020: GLOBOCANによる185ヵ国36癌の世界罹患率および死亡率の推定値。
CA Cancer J. Clin. 2021; 71: 209-249
論文で見る
スコープス (46563)
パブコメ
クロス
グーグル奨学生
植村直己
岡本慎太郎
山本慎太郎
松村直樹
山口真一
山木戸雅人
谷山和彦
佐々木直樹
シュレンパーR.J.
ヘリコバクター・ピロリ感染と胃癌の発生。
N. Engl. J. Med. 2001; 345: 784-789
論文で見る
スコープス (3808)
PubMed
クロス
グーグル奨学生
マーシャル B.J.
ウォーレンJ.R.
胃炎および消化性潰瘍患者の胃における正体不明の曲がった桿菌。
Lancet. 1984; 1: 1311-1315
論文で見る
スコパス (4391)
PubMed
概要
グーグル奨学生
ロフグレンJ.L.
ワリーM.T.
葛 Z.
ムトゥパラニ S.
テイラー N.S.
モブリー M.
ポッター A.
ヴァロ A.
アイバック D.
スエルバウムS.
他
ヘリコバクター・ピロリ感染INS-GASマウスにおける常在菌叢の欠如は胃炎を軽減し、上皮内新生物を遅らせる。
Gastroenterology. 2011; 140: 210-220
論文で見る
スコープス (282)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
コーカーO.O.
ダイ・ズー
ニー Y.
Zhao G.
Cao L.
Cao L.
Wu W.K.
Wong S.H.
チェン Z.
Sung J.J.Y.
et al.
胃がん発生における粘膜マイクロバイオーム異常症。
Gut. 2018; 67: 1024-1032
論文で見る
スコープス (358)
PubMed
クロス
グーグル奨学生
ウィリー R.A.
ベイトンD.
Streptococcus Constellatus、Streptococcus Intermedius、およびStreptococcus Anginosusの記述の修正と別種としての認識。
Int. J. Syst. Bacteriol. 1991; 41: 1-5
論文で見る
PubMed
クロスレフ
グーグル奨学生
浜田 進
スレイドH.D.
Streptococcus mutansの生物学,免疫学およびう蝕原性.
Microbiol. 1980; 44: 331-384
論文で見る
PubMed
クロスレフ
グーグル奨学生
佐々木幹夫
児玉祐子
下山雄一郎
石川哲也
木村 聡.
Streptococcus anginosusの酸性および酸耐性機構.
J. Gen. Appl. Microbiol. 2018; 64: 174-179
論文で見る
スコープス (17)
PubMed
クロス
グーグル奨学生
ソン J.J.Y.
コーカー O.O.
チュー E.
セトC.H.
ルク S.T.Y.
ラウ H.C.H.
Yu J.
ヘリコバクター・ピロリ除菌1年後の胃の炎症、萎縮および腸管形質転換に関連する胃微生物。
Gut. 2020; 69: 1572-1580
論文で見る
スコープス (120)
PubMed
クロス
グーグル奨学生
フェレイラ R.M.
ペレイラ・マルケスJ.
ピント-リベイロI.
コスタ J.L.
カルネイロ F.
マチャド J.C.
フィゲイレド C.
胃微生物群集プロファイリングから明らかになったがん関連微生物叢のdysbiotic。
Gut. 2018; 67: 226-236
論文で見る
スコープス (401)
PubMed
クロス
グーグル奨学生
Yu G.
トーレスJ.
フー N.
メドラノ=グスマンR.
エレラ-ゲップファートR.
ハンフリーズ M.S.
ワン L.
ワン C.
Ding T.
ラヴェルJ.
他。
胃癌患者におけるヒト胃微生物叢の分子学的特性解析。
Front. Cell. Infect. Microbiol. 2017; 7: 302
論文で見る
スコープス (98)
PubMed
クロス
グーグル奨学生
ホートン J.M.
はじめに
in: Helicobacter Species Methods and Protocols. Methods in Molecular Biology. 921. Springer, 2012: 1-5
論文で見る
クロスリファレンス
グーグル・スカラー
バンクス M.
グラハム D.
ヤンセン M.
ゴトダ T.
コーダ S.
ディ・ピエトロ M.
上戸 N.
バンダリ P.
プリチャード D.M.
カイパースE.J.
他
胃腺癌リスクのある患者の診断と管理に関する英国消化器病学会ガイドライン。
Gut. 2019; 68: 1545-1575
論文で見る
スコープス(300)
PubMed
クロス
グーグル奨学生
ピーターセン C.P.
ミルズJ.C.
ゴールデンリングJ.R.
胃体部前形成のマウスモデル。
Cell. Mol. Gastroenterol. Hepatol. 2017; 3: 11-26
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ウェスラーS.
バッカート S.
ヘリコバクター・ピロリによる上皮バリア破壊の分子機構。
Trends Microbiol. 2008; 16: 397-405
論文で見る
ヘリコバクター・ピロリ
PubMed
要旨
全文
全文PDF
グーグル奨学生
フランクJ.A.
肺におけるクローディンと肺胞上皮バリア機能。
Ann. N. Y. Acad. Sci. 2012; 1257: 175-183
論文で見る
スコープス (62)
PubMed
クロス
グーグル奨学生
新美敏郎
長島一彦
ウォードJ.M.
ミヌー P.
ジモンジッチ D.B.
ポペスク N.C.
木村 聡
T/EBP/NKX2.1ホメオドメイン転写因子の新規下流標的遺伝子claudin-18は、alternative splicingにより肺と胃に特異的なアイソフォームをコードする。
Mol. Cell. 生物学 2001; 21: 7380-7390
論文で見る
(172件)
PubMed
クロス
グーグル奨学生
孫 J.H.
Li X.L.
Yin J.
Li Y.H.
Hou B.X.
Zhang Z.
口腔マイクロバイオーム検出による胃がんスクリーニング法。
Oncol. Rep. 2018; 39: 2217-2224
論文で見る
PubMed
グーグル奨学生
フー Y.L.
Pang W.
Huang Y.
Zhang Y.
Zhang C.J.
ショットガン・メタゲノミクスにより同定された進行胃腺癌における胃マイクロバイオームの障害。
Front. Cell. Infect. Microbiol. 2018; 8: 433
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
ホアン・K.K.
Ma H.
チョン R.H.H.
Uchihara T.
リアン B.S.X.
Zhu F.
Sheng T.
Srivastava S.
テイ S.T.
Sundar R.
他。
腸管形質転換の時空間ゲノムプロファイリングにより、胃癌進行のクローン動態が明らかになった。
Cancer Cell. 2023; 41: 2019-2037.e8
論文で見る
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
山本幹男
野村慎一郎
細井 敦
長岡和彦
飯野高志
安田毅
齋藤知行
松下秀樹
内田英明
瀬戸康史
et al.
C57BL/6マウスに移植可能な確立胃癌細胞株は、線維芽細胞増殖因子受容体4による腫瘍増殖促進を示す。
Cancer Sci. 2018; 109: 1480-1492
論文で見る
スコープス (24)
PubMed
クロス
グーグル奨学生
ブスッティル R.A.
リューD.S.
ディ・コスタンゾN.
シュレーダーJ.
ミッチェル C.
Boussioutas A.
胃癌の浸潤と転移の同所性マウスモデル。
Sci. Rep. 2018; 8: 825
論文で見る
スコープス (24)
PubMed
クロス
グーグル奨学生
デカ R.K.
ブラウティガムC.A.
ヤン X.F.
ブレビンス J.S.
マキウス M.
トムチック D.R.
ノルガード M.V.
PnrA (Tp0319; TmpC)リポ蛋白質はTreponema pallidumのATP結合カセット(ABC)様オペロン内にコードされる新しいプリンヌクレオシド受容体ファミリーを代表する。
J. Biol. Chem. 2006; 281: 8072-8081
論文で見る
スコープス (51)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ジェラベック-ヴィレムセンM.
アンドレ T.
ワナー R.
ロートH.M.
デュアー S.
バースケ P.
ブライトシュプレッヒャー D.
マイクロスケール熱泳動: 相互作用解析とその先へ。
J. Mol. Struct. 2014; 1077: 101-113
論文で見る
スコープス (433)
クロスリファレンス
グーグル奨学生
Correa P.
ヒトの胃発癌:多段階的かつ多因子的過程--癌の疫学と予防に関する第1回米国癌学会賞受賞講演。
Cancer Res.
論文で見る
PubMed
グーグル奨学生
ボッカーステット K.A.
ルイス S.A.
ウルフK.J.
ノト C.N.
ジャクソン N.M.
フォード E.L.
アン T.H.
ディパオロ R.J.
胃における急性薬物傷害および慢性炎症に起因する痙攣性ポリペプチド発現形質転換体の単一細胞転写解析。
Gut. 2020; 69: 1027-1038
論文で見る
スコープス (37)
PubMed
クロス
グーグル奨学生
クォン・S.K.
パク J.C.
キム K.H.
Yoon J.
Cho Y.
リー B.
Lee J.J.
Jeong H.
Oh Y.
Kim S.H.
ら。
ヒト胃微生物叢移植は無菌マウスにおける前悪性病変を再現する。
Gut. 2022; 71: 1266-1276
論文で見る
スコープス (29)
PubMed
クロス
グーグル奨学生
鈴木啓一郎
仙谷和人
田中裕之
矢野貴之
鈴木啓一郎
大島雅彦
安井 W.
田村 淳
月田聡
マウスにおける胃型クローディン-18の欠損はピロリ菌感染とは無関係に胃腫瘍形成を誘導する。
Cell. Mol. Gastroenterol. Hepatol. 2019; 8: 119-142
論文で見る
パブコメ
要旨
全文
全文PDF
グーグル奨学生
キャロン T.J.
スコット K.E.
シンハ N.
ムトゥパラニ S.
バカイ M.
アン L.H.
リー Y.
ターナー J.R.
フォックス J.G.
ハーゲン S.J.
クローディン-18の欠損は、胃上皮細胞におけるタイトジャンクションのイオン選択性ではなく、細胞内クロライドフラックスを変化させる。
Cell. Mol. Gastroenterol. Hepatol. 2021; 11: 783-801
論文で見る
スコープス (0)
パブコメ
要旨
全文
全文PDF
グーグル・スカラー
Wroblewski L.E.
ピークR.M.
「ヘリコバクター・ピロリによる上皮バリアの標的破壊」。
Cell Commun. Signal. 2011; 9: 29
記事で見る
ヘリコバクター・ピロリ
PubMed
クロス
グーグル奨学生
アブドラ M.R.
バトゥエカス M.T.
ジェナートF.
ヴォース F.
ウェストホフ P.
コーラー T.P.
モリーナ R.
ヒルシュマン S.
ラルク M.
エルモソJ.A.
他
肺炎球菌ヌクレオシド結合蛋白質PnrAの結晶構造と病態生理学的役割。
J. Mol. Biol.
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
Li X.
Pei G.
Zhang L.
Cao Y.
Wang J.
Yu L.
Dianjun W.
Gao S.
Zhang Z.S.
Yao Z.
他。
尿路病原性大腸菌のYadCとその宿主受容体アネキシンA2を標的とする化合物は、膀胱における細菌のコロニー形成を減少させる。
EBioMedicine. 2019; 50: 23-33
論文で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
キルシュネク S.
アダムス C.
ガルビンス E.
アネキシンIIは緑膿菌の新規レセプターである。
Biochem. Biophys. Res. Commun. 2005; 327: 900-906
論文で見る
スコープス (28)
PubMed
クロス
グーグル奨学生
アクター H.
パク M.
クォン・O.S.
ソン E.J.
パク W.S.
カン M.J.
ニューロテンシンによるマトリックスメタロプロテアーゼ-9(MMP-9)の活性化は、胃がんにおいてERK経路を介して細胞の浸潤と遊走を促進する。
腫瘍生物学(Tumour Biol.
論文で見る
スコープス (56)
PubMed
クロス
グーグル奨学生
ハン・エイチ
イム J.W.
キム・エイチ
リコピンは胃がん細胞における上皮成長因子受容体の活性化とシクロオキシゲナーゼ-2の発現を抑制する。
Nutrients. 2019; 11: 2213
論文で見る
スコープス (33)
PubMed
クロス
グーグル奨学生
Li W.
ファン M.
チェン Y.
Zhao Q.
Song C.
Yan Y.
Jin Y.
Huang Z.
林 C.
Wu J.
メラトニンは、JNKおよびP38 MAPKの活性化とNuclear Factor-Kappa Bの抑制を介してAGS細胞のアポトーシスを誘導する。
Cell. Physiol. Biochem. 2015; 37: 2323-2338
論文で見る
スコープス (81)
PubMed
クロス
グーグル奨学生
ケシェY.
セガーR.
MAPキナーゼシグナル伝達カスケード:数百の構成要素からなるシステムが多様な生理機能を制御している。
Methods Mol. Biol.
論文で見る
PubMed
クロスフィルム
グーグル奨学生
ロング Y.
チョンT.
リュウ X.
Lyu X.
ルオ X.
ファレティ O.D.
Deng S.
Wang F.
He M.
Qian Z.
他。
FOXD1依存性のRalA-ANXA2-Src複合体は乳癌のCTC形成を促進する。
J. Exp. Cancer Res. 2022; 41: 301
論文で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
フェン X.
Liu H.
Zhang Z.
Gu Y.
Qiu H.
He Z.
非小細胞肺癌細胞におけるJNK-p53経路の活性化によるアネキシンA2のシスプラチン耐性への寄与。
J. Exp. Clin. Cancer Res.
論文で見る
パブコメ
クロスフィルム
グーグル奨学生
論文情報
出版履歴
出版 2024年1月30日
受理 受理:2024年1月2日
改訂版受理 2023年10月13日
受理:2023年10月13日 受理日:2022年8月8日
出版段階
インプレス、ジャーナル予稿集
識別
DOI: https://doi.org/10.1016/j.cell.2024.01.004
著作権
© 2024 The Authors. 発行:エルゼビア社
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
図サムネイルgr1
図1Streptococcus anginosusは胃粘膜に定着し、急性炎症を促進する。
図サムネイルfigs1
図S1Streptococcus anginosusは感染後2週間でマウスの胃粘膜にコロニー形成する。
図サムネイルgr2
図2Streptococcus anginosusはマウスの慢性胃炎を促進する
図サムネイルfigs2
図2Streptococcus anginosusはマウスに長期感染しても副作用がない。
図サムネイルfigs3
図S3Streptococcus anginosusはマウスの胃マイクロバイオーム組成を調節する(図3、表S4、S5関連
図サムネイルgr3
図3ストレプトコッカス・アンギノサスはマウスの胃のバリア機能の障害とともに胃の萎縮、形質転換、異形成を誘導する
図サムネイルgr4
図4Streptococcus anginosusは無菌マウスにおいて粘液性形質転換を促進する。
図サムネイルgr5
図5Streptococcus anginosusはマウスの胃がん発生を促進する
図サムネイルfigs4
図S4Streptococcus anginosusはマウスにおいて胃腫瘍微小環境を再構築する(図5および表S7に関連する
図サムネイルgr6
図6TMPC-アネキシンA2(ANXA2)軸を介して胃上皮細胞と相互作用するストレプトコッカス・アンギノサス
図のサムネイルfigs5
図S5Streptococcus anginosusはTMPC-ANXA2軸を介して胃上皮細胞と相互作用する。
図サムネイルgr7
図7ストレプトコッカス・アンギノサスはTMPC-ANXA2軸を介してMAPKシグナル伝達を活性化する
図サムネイルfigs6
図S6TMPC-ANXA2軸を介してMAPKシグナル伝達を活性化するストレプトコッカス・アンギノサス(図7関連
関連記事
広告
ライフ&メディカルサイエンスジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム学
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
細胞幹細胞
細胞システム
カレントバイオロジー
発生細胞
免疫
医学
分子細胞
ニューロン
構造
アメリカン・ジャーナル・オブ・ヒューマン・ジェネティクス (パートナー)
生物物理学雑誌 (パートナー)
生物物理レポート (パートナー)
Human Genetics and Genomics Advances (パートナー)
分子植物 (パートナー)
分子療法 (パートナー)
分子治療法と臨床開発 (パートナー)
分子療法核酸 (パートナー)
分子療法腫瘍学 (パートナー)
Plant Communications (パートナー)
幹細胞レポート (パートナー)
生化学の動向
癌の動向
細胞生物学の動向
生態学と進化の動向
内分泌学・代謝学の動向
遺伝学の動向
免疫学の動向
微生物学の動向
分子医学の動向
神経科学の動向
寄生虫学の動向
薬理学の動向
植物科学の動向
物理科学・工学ジャーナル
セルレポート 物理科学
化学
化学触媒
デバイス
ジュール
物質
化学の動向
学際ジャーナル
セルリポーツ・メソッド
セルリポーツ・サステイナビリティ
Heliyon
アイサイエンス
ワン・アース
パターン
STARプロトコル
ネクサス(パートナー)
イノベーション(パートナー)
バイオテクノロジーの動向
認知科学の動向
著者
論文投稿
複数ジャーナル投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ 著作権 © 2024 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
