腸内細菌はマウスのマクロファージ集積を抑制することにより腹部大動脈瘤の発生に影響を与える
腸内細菌はマウスのマクロファージ集積を抑制することにより腹部大動脈瘤の発生に影響を与える
https://www.ahajournals.org/doi/10.1161/HYPERTENSIONAHA.122.19422
篠原亮平、中島ひとみ、江本拓夫、山下智也、齋藤義博、吉田直史、井上大志、山中勝弘、岡田健二、平田健一
Originally published12 Oct 2022https://doi.org/10.1161/HYPERTENSIONAHA.122.19422Hypertension. 2022;79:2821-2829
この記事の他のバージョン

要旨
背景
腹部大動脈瘤(AAA)は、腹部大動脈の拡張を特徴とする生命を脅かす循環器疾患である。免疫細胞はAAA発症に関与していること、腸内細菌叢は宿主の免疫系や代謝経路を調節することにより、心血管疾患を含む多くの疾患と関連していることが示されている。しかし、腸内細菌叢とAAAとの相互作用は不明なままである。
方法
アポリポ蛋白E欠損雄性マウスを高コレステロール食で飼育し、通常の飲水下で維持する群(コントロール群)、ampicillin、vancomycin、neomycin、metronidazoleを添加した飲水下で維持する経口AVNM群、腹腔内へAVNMを注入したi.p. AVNM群に分けて、それぞれ飼育した。1週間の抗生物質による前処置の後、これらのマウスに皮下浸透圧ポンプを介してAng IIを4週間投与し、安楽死させてAAA形成を評価した。
結果
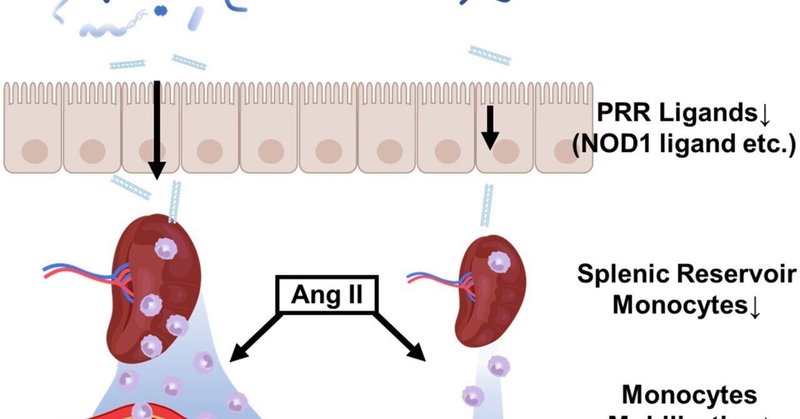
AVNMの経口投与による腸内細菌叢の枯渇は、AAA発生率を改善した(コントロール群。58.9% vs AVNM経口投与群: 28.6% vs AVNM i.p.投与群: 75.0%, P = 0.0005)、動脈瘤の破裂による死亡を予防した(対照群:11%、経口AVNM群:0%、i.p. AVNM群:15%)。AVNMの経口投与は脾臓における単球の蓄積を抑制したが、他の臓器では抑制しなかった。AVNM経口投与群では、高コレステロール血症にもかかわらず、上大静脈への単球の動員は抑制された。AVNM飲用マウスでは、PRRリガンドの一種であるNOD1リガンドが、AAAsの発生と大動脈へのマクロファージの集積を増加させた。
結論
腸内細菌叢は、AAA形成に重要な役割を担っている。したがって、微生物叢あるいは免疫系の調節は、AAAに対する治療アプローチとなり得る。
図をダウンロードするパワーポイントをダウンロードする
新規性・関連性
新規性とは?
抗生物質の経口投与による腸内細菌叢の枯渇は、AAAsの発生を抑制した。本研究は、腸内細菌叢が単発性動脈硬化症に関連していることを示す初めての報告である。
関連性は?
本研究は、将来、腸内細菌叢や細菌シグナルがAAAsの病態生理に寄与することを立証するためのヒトでの研究の基礎を提供するものである。
臨床的/病態生理学的意義は?
小口径動脈瘤の発症初期に薬物療法や生活習慣への介入を開始する必要がある。腸内細菌叢や細菌シグナルが、単発性大動脈瘤の新たな治療ターゲットになり得ることを初めて明らかにした。
腹部大動脈瘤(AAA)は、高齢者の間で生命を脅かす心血管疾患であり、腹部大動脈が弱くなり拡張することが特徴である。AAAは通常、破裂するまで無症状であるため、先進国では無関係な症状を調べるために行われる画像診断や超音波検査によるスクリーニングで診断されることが多くなっています1-3。外科手術や血管内修復術の技術的な向上は見られるものの、AAAsの発生を阻止する医学的な予防療法はまだ不足している。1,4 ある大規模コホート研究では、65歳時に腎動脈瘤下径25~29mmの男性の28%が15年以内に55mm以上のAAAsを発生させていることが示されている5。しかし,無作為化臨床試験では,小さなAAAに対する早期の選択的外科手術や血管内修復術の利点は証明されていない。6-9 小さなAAAが発生したら,早い段階で薬物療法やライフスタイルへの介入を開始する必要がある。小さなAAAを持つ患者やAAA修復に適さないと判断された患者には、現在のところ積極的な治療オプションはない。
自然免疫細胞および適応免疫細胞は、大動脈壁に慢性炎症を引き起こし、それがAAA発症の一因となる重要な役割を担っている。4,10 我々は以前に、アポリポ蛋白E欠乏(Apoe-/-)マウスにマウスIL-2/抗IL-2モノクローナル抗体複合体を注射またはUVB照射すると、選択的に CD4+Foxp3+ Tregsが拡大し、アンジオテンシンIIによるAAA発症および関連死亡率の抑制が有効になることを報告した(11,12)。さらに、腸内細菌叢とその代謝産物の組成の変化は、免疫系を介してヒトの様々な疾患に大きな影響を与えることが知られている。動脈硬化に関しては、我々は以前、腸内細菌叢の枯渇が従来のApoE-/-マウスの動脈硬化病変を有意に予防すること、常在菌が肝胆汁酸生合成の誘導を介して血漿中のコレステロールを低レベルに維持することを示した13が、従来のマウスの腸内細菌叢組成は施設ごとに異なるため、腸内細菌叢枯渇の動脈硬化への影響については議論がある14,15。我々は、冠動脈疾患患者の腸内細菌叢においてBacteroides vulgatusとBacteroides doreiの存在量が少ないこと、生きたB vulgatusとB doreiを経口投与することで糞便中および血漿中のリポ多糖濃度が低下し、マウスを動脈硬化から保護できることを順次報告している16,17。Hazenらは、食事中のコリン、カルニチン、ベタインから腸内細菌叢によって産生されるトリメチルアミンN-オキシド(TMAO)が、独立した大規模臨床コホートにおいて心血管疾患の発症リスクを予測しうることを報告している。また、腸内細菌が減少すると、食事性コリンによる動脈硬化の促進が解除された15,18,19。腸内細菌由来の代謝物や腸内細菌に依存する免疫系が動脈硬化の形成に重要な影響を与えることが明らかにされている。
抗生物質による腸内細菌叢の枯渇は、マクロファージの浸潤と炎症性サイトカインの抑制により頭蓋動脈瘤の発生を減少させる20。別のグループは、Akkermansia muciniphilaの補給がマウスにおけるAAA形成を抑制することを示す論文を発表したばかりである21。しかしながら、ヒトおよびマウスにおける腸内細菌叢とAAAとの相互関係はよく理解されていない。そこで、腸内細菌叢が単核球症の病態にどのように関与しているかを調べる第一歩として、抗生物質カクテルによる腸内細菌叢の枯渇という確立された方法を用いて、マウスの単核球症の形成に及ぼす腸内細菌叢の影響を検討することを目指した。
研究方法
データの入手方法
本研究の結果を裏付けるデータは、著者から入手可能である。
マウス
C57BL/6をバックグラウンドとするアポリポ蛋白E欠損(Apoe-/-)マウスは、以前に記載したとおりである。6週齢の雄マウスに、コレステロール0.2%、脂肪17.1%を含む高コレステロール食と水を自由食とした。11週齢のマウスを、飲料水(偽薬群)、飲料水と抗生物質、飲料水と腹腔内投与(週5回)の3群に分けた。腸内細菌叢を枯渇させるため、アンピシリン(1 g/L)、バンコマイシン(0.5 g/L)、ネオマイシン(1 g/L)、メトロニダゾール(1 g/L)(ライフテクノロジー社、カールズバッド、カリフォルニア)からなる抗生物質カクテルが飲料水から投与された。12週齢のマウスには、既報の通り、皮下浸透圧ミニポンプ(Model 2004、ALZET)を介して1.44mg/kg/日のアンジオテンシンII(Ang II)(Sigma-Aldrich、St.Louis、MO)を4週間にわたって投与した。Nod1リガンド(すなわち、DAP;tlrl-dap;InvivoGen,San Diego,CA)は、抗生物質治療開始以来、100ng/マウスで各週3回腹腔内注射により投与された。簡単に言うと、マウスをイソフルラン(WAKO, Richmond, VA)で麻酔し、滅菌水に溶解したAng IIを含む浸透圧ミニポンプを皮下空間に挿入した。16週目に、AAA形成を評価するために、マウスを麻酔下で頸椎脱臼により安楽死させた。すべての死亡マウスについて剖検を行ったところ、腹部大動脈に血栓の形成が認められ、腹部大動脈破裂事象を示唆するものであった。また、一部の死亡マウスには副腎皮質大動脈破裂の痕跡が見られた。死んだマウスはすべて、死亡率、発生率、AAA重症度の解析に含まれた。マウスは病原体を含まない特定の動物施設に収容した。すべての動物実験は、神戸大学大学院の動物実験倫理委員会の承認を受け、NIHのガイドラインに準拠した。
細胞
RBC Lysis Buffer(BioLegend, San Diego, CA)中のヘパリンコートキャピラリーチューブを用いて眼窩洞から得た末梢血の(原液)1:10希釈液を調製し、総白血球数を測定した。臓器摘出後、脾臓、骨髄の細胞懸濁液を得た。胸部から腸骨分岐部までの大動脈組織を採取した。大動脈組織と肺を小片に切断し、450 U/mL collagenase I, 125 U/mL collagenase XI, 60 U/mL DNase I, 60 U/mL hyaluronidase (Sigma-Aldrich) で37℃、振盪しながら30分間酵素消化をした。
フローサイトメトリー
フローサイトメトリー解析に使用した抗体は、補足資料の表S1に記載されている。データは、LSRFortessa X-20フローサイトメーター(BD Biosciences, Franklin Lakes, NJ)で取得し、FlowJo v8.8.6 (Tree Star, Inc., San Carlos, CA) を用いて解析した。細胞はFcBlock (BD Biosciences) で15分間処理した後、抗体カクテルと30分間インキュベートした。サンプルはフロー解析の前に固定した。細胞集団は以下のように同定された。(使用した細胞マーカーの説明)。
組織学
マウスを安楽死させ、大動脈をPBSで灌流した。AAA病変を切断し、最適切断温度化合物(Tissue-Tek;Sakura Finetek、Torrance、CA)に埋め込んで、断面図(10μm)を作成した。最大AAA病変のアセトン固定またはホルマリン固定の凍結切片(10μm)に対して、核(DAPI、1:400;BioLegend)およびマクロファージ(CD68、1:100;BioLegend)を識別する抗体を用いて免疫組織化学を実施した。免疫組織化学に使用した抗体は、表S1に記載したものと同じであった。
染色した切片は,オールインワン蛍光顕微鏡(BZ-8100; Keyence, Osaka, Japan)を用いてデジタル撮影し,染色面積を算出した.各マウスで最大サイズのAAA病変の切片を解析し、その平均値を統計解析に用いた。
血圧測定
収縮期血圧は,前述したように非侵襲的テールカフ法(BP-98 Softron)を用いて測定した.収縮期血圧は、ベースラインとAng IIポンプ植え込み後3週間で少なくとも7回測定した。各群の平均収縮期血圧は、その群に含まれる各マウスの収縮期血圧を平均することによって決定された。各時点で1日測定したデータを使用した。
腸内細菌叢の定量的PCR解析
腸内細菌の16S rDNAを各糞便サンプルから抽出した。定量的PCRは、SYBR Premix Ex Taq (Takara, Shiga, Japan) と StepOnePlus Real-Time PCR System (Thermo Fisher Scientific, Waltham, MA) を用いて、製造者のプロトコルにしたがって実施された。Phocaeicola vulgatus JCM5826T のゲノム DNA を用いて標準曲線を作成し、標的遺伝子のコピー数を決定した。この実験で使用したプライマーを補足資料の表 S2 に示す。
リアルタイム逆転写PCR解析
NucleoSpin RNA(Takara)を用いて組織から総RNAを抽出した。逆転写(RT)には、PrimeScript RT試薬キット(Takara)を使用した。定量的RT-PCRは、SYBR Premix Ex Taq(Takara)とStepOnePlus Real-Time PCR System(Thermo Fisher Scientific)を用いて、製造元のプロトコルにしたがって実施した。増幅反応は二重で行い、蛍光曲線は付属のソフトウェアを用いて解析した。ケモカインCsf-1、Gm-csf、Mcp-1の遺伝子発現の定量PCR解析には、正規化のためにGAPDHを含む4種類のプライマーセットを使用した。本実験で使用したプライマーを表S2に示す。
統計解析
結果は、平均値±SEM(平均値の標準誤差)で表した。統計学的検定には、Mann-Whitney U検定、Studentのt検定、Kruskal-Wallis検定とDunnのポストホック分析、1-way ANOVAとTukeyのポストホック補正による多重比較、カイ2乗分析を比例データの比較に使用した。P≦0.05を有意とした。
結果
腸内細菌叢の減少によるAAA発症率の低下と腹部大動脈の肥大化の抑制
腸内細菌叢の枯渇がAAA形成に及ぼす影響を評価した。アンピシリン,バンコマイシン,ネオマイシン,メトロニダゾールからなる抗生物質のカクテルの経口投与(AVNM経口群),抗生物質のカクテルの腹腔内注射(AVNM i.p. 群),または薬剤(対照群)をAng II移植1週間前から動脈瘤誘導後4週まで継続した(図 1A)。AVNMの経口投与による腸内細菌叢の枯渇は,動脈瘤の発生を改善し,動脈瘤破裂による死亡を予防したが,i.p. AVNMは動脈瘤の発生に影響を与えなかった(図1B〜図1D).同様に,AVNMの経口投与により,副腎皮質上大動脈径の増大が,AVNM投与群およびi.p.投与群に比べ,有意に抑制された(図1E).血圧は対照群と経口AVNM群で同程度であったが、i.p.AVNM群では原因は不明であるが対照群より高値であった(図S1A)。総コレステロール値は、既報と同様にAVNM経口投与群で高かった(図S1B)13。腸内細菌叢は、既報と同様に、腹腔内注射ではなく、カクテル抗生物質の経口投与により有意に枯渇することを確認した(図1F)13,22。
図1.
図をダウンロードするパワーポイントをダウンロードする
キャプション
腸内細菌叢の減少が動脈瘤形成時の大動脈における単球/マクロファージの蓄積を抑制した
動脈瘤の進展と単球あるいはマクロファージとの関係を明らかにするために、大動脈における免疫細胞を蛍光免疫染色とフローサイトメトリーにより評価した。まず、AAA-とAAA+の有無で分類した各群において、コントロール群とAVNM経口投与群の間で、断面した副腎大動脈のCD68+単球またはマクロファージ面積を比較した。AVNM経口投与により、AAA-群におけるCD68+単球またはマクロファージの集積が有意に抑制された。AAA発生により大動脈に単球浸潤あるいはマクロファージ増殖の大きな波が生じたが、AAA+群では真腔のみならず、偽腔と真腔の合計でのCD68+単球あるいはマクロファージ面積はコントロール群とAVNM(経口)群で有意差はなかった(図2Aおよび2B)。フローサイトメトリー解析により、AVNM経口投与は大動脈における免疫細胞の集積を抑制することが明らかになった(図2Cから図2E)。CD45+細胞では、CD11b+ F4/80+マクロファージの有意な減少が観察されたが、Ly6G+好中球は減少しなかった(図2Cおよび図2D)。
図2.
図をダウンロードするパワーポイントをダウンロードする
キャプション
抗生物質の投与は単球減少に脾臓のみ影響し、他の臓器では影響しない
AVNM群で大動脈に集積する単球やマクロファージが少ない理由を明らかにするために、AVNM治療がプールされた単球や生成された単球の数に及ぼす影響を評価した。骨髄では多数の単球前駆細胞や単球が産生され、含まれているが、脾臓や肺では髄外プール単球が含まれている。AVNMを1週間投与したマウスでは、Ly6Chigh、中間、負のサブセットを含む脾臓リザーバー単球の総数および各サブセットの数は、経口AVNM群で劇的に減少した(図3A)。単球やマクロファージの減少は、AVNM経口投与群の骨髄や肺では観察されなかった(図3Cおよび3D)。さらに、4週間の時点でも同じ結果が観察され、コントロールまたはi.p.AVNM群と比較して、経口AVNM群では脾臓で単球の減少が観察された(図3E)。血液または脾臓の好中球、B細胞およびT細胞などの他の集団は、経口AVNM処理によって影響を受けなかった(図S2)。AVNMの経口投与は、脾臓におけるCsf-1、Gm-csf、Mcp-1などのケモカインの発現に影響を与えなかった(図S3A〜図S3C)。
図3.
図をダウンロードするパワーポイントをダウンロードする
キャプション
腸内細菌叢および細菌シグナルの枯渇は、アンジオテンシンIIによる大動脈への単球の動員を抑制した。
脾臓単球とマクロファージの大動脈への集積とのギャップを埋めるために、Ang II注入後のLy6Chigh血中単球の時間経過を検討した。血中単球はAng II移植2日後、対照群では増加したが、経口AVNM群では増加しなかった(図4A)。腎上大動脈におけるCD68陽性単球マクロファージ面積は,Ang II投与後4日目から10日目にかけてコントロール群では有意に増加したが,AVNM群では増加が見られなかった(図4Bおよび4C).Day10では,AVNM群では単球やマクロファージの集積がコントロール群に比べて抑制される傾向にあった(図4Bおよび図4C).パターン認識受容体リガンドの減少は、脾臓のLy6Chigh単球の障害に関係することが以前の報告で明らかにされている23。特にパターン認識受容体リガンドの一種であるNod1リガンドの存在は、脾臓のLy6Chigh単球の絶対数に影響すると報告されている。興味深いことに、Nod1リガンドを腹腔内注射すると、経口AVNM群では脾臓リザーバー単球が増加し、CD68陽性単球マクロファージ領域の集積が有意に増加し、上大動脈の直径が拡大する傾向があり、Nod1リガンドが腸内細菌叢の枯渇の影響をキャンセルすることがわかった(図4D、4E)。
図4.
図をダウンロードするパワーポイントをダウンロードする
キャプション
考察
近年、腸内細菌叢が免疫系を介して動脈硬化を含むいくつかの心血管疾患を制御することが示されている17,24。ここで、我々の知る限り、AVNMの経口投与がマウスのAAAsの発生または進行を抑制することを証明することにより、腸内細菌叢がAAAの治療標的であるという最初の証拠を提示した。AVNMの腹腔内投与では、単球の発生や進行は抑制されなかったことから、血流への移行ではなく、腸管内の腸内細菌叢の存在が単球の病態に影響を及ぼすことが示唆された。
ヒトのAAAsの病理学的特徴として、免疫細胞の浸潤に伴う細胞外マトリックスの分解と血管平滑筋細胞の消失があり、血管リモデリングと大動脈壁の弱化を助長する1,4。自然免疫細胞と適応免疫細胞のうち、マクロファージはAAAs形成に重要な役割を果たすことが示されており、細胞外マトリックスを分解して血管壁の完全性を損ねるマトリックスメタロプロテイナーゼなどのタンパク質分解酵素の主要供給源になっています4。単球由来のマクロファージは、AAAにおけるマクロファージの蓄積に重要な寄与をしている。25 すべてのタイプの大動脈マクロファージを枯渇させるとAAA発症率が低下するが、リンパ管内皮受容体-1+(Lyve-1+)常在型の外腸管マクロファージの選択的枯渇は予防効果がない26。
対照群では、Ang II投与後4日目から10日目までの初期に、このマウスAAAモデルの特徴である上大動脈へのマクロファージの集積が明確に認められたが27、AVNM群ではAng II投与後にマクロファージの集積は認められなくなった。大動脈壁に浸潤する単球の発生源を明らかにするために、骨髄、肺、脾臓の単球をフローサイトメトリーで計数した。脾臓は、古くなった赤血球を除去し、微生物や細胞の残骸を循環器から効率的に除去する構造になっている28。単球は血液中を循環していると考えられてきたが、未分化単球のリザーバーとしての脾臓の機能も明らかにされてきた29。
さらに、脾臓のリザーバー単球はAng IIに反応して脾臓から大動脈に動員され、血管の炎症反応に寄与し、Apoe-/-マウスのAAAを形成することが示された25。脾臓切除により脾臓から血液への単球の動員を抑制し動脈瘤の発生を阻害したことから、単球が動脈瘤の発生と直接関係していることが示唆された25。ある報告では、動脈瘤患者では循環CD14++CD16+単球の割合が高く、これはマウスではLy6C中間型単球に分類されると考えられている。23,31 別の報告では、大きな動脈瘤患者では中間CD14++CD16+および非古典CD14+CD16+単球サブセットが増加していることが示されている。
AVNMの経口投与は、脾臓のリザーバー単球の数を抑制したが、骨髄や肺の単球の数には影響を与えず、これは以前の報告と一致した32。さらに、初期の血中Ly6chigh単球の減少は、腹部大動脈に集積する単球やマクロファージがAng IIによって脾臓から動員されることを示唆している。本研究では、AVNMの腹腔内注射は脾臓のリザーバー単球の数を抑制することはなかった。このことから、脾臓リザーバー単球の総数を調節しているのは、血流に漏れ出す細菌ではなく、腸内細菌叢であることが明らかとなった。したがって、血圧やコレステロール値とは無関係に、脾臓から大動脈に単球が動員されることによって、動脈硬化症の発症が促進されることが示唆された。
脾臓は腸内細菌叢の存在に大きく影響されることを見いだした。腸内細菌叢の枯渇は、Csf-1、Gm-csf、Mcp-1などのケモカインの発現に影響を与えなかった。従って、脾臓のリザーバー単球数の減少は、これらのケモカインの影響を受けないと考えられる。腸内細菌叢の全廃による腸内細菌ペプチドグリカンを含むNod1リガンドの減少は、脾臓Ly6Chigh単球の数の減少と機能の異常を伴うが、LPS、TLR4リガンドは脾臓Ly6Chigh単球の絶対数に影響しないことが報告されている33。実際、我々の結果は、Nod1リガンドを投与すると、脾臓のリザーバー単球が増加する傾向があり、単球マクロファージの上腸管への集積が抑制され、上腸管径の増大と相関があることを示している。Nod1リガンドなどの腸内細菌叢由来因子の枯渇は、脾臓リザーバー単球の減少に寄与し33、その結果、Ang IIによって血中に動員される単球の数が減少し、AAA発症が抑制される可能性が考えられる。
この研究にはいくつかの限界があった。第一に、AVNMの代わりに無菌マウスを用いて腸内細菌叢を枯渇させることができなかった。これは、Ang IIポンプを用いたこのApoe-/-マウスモデルの実験が複雑であったためである。第二に、抗生物質による腸内細菌叢の枯渇は、副作用や毒性の点から、ヒトではまず不可能であり、AAA患者におけるNod1リガンドなどのリザーバー単球を制御する腸内細菌叢由来の重要因子の評価が必要である。第三に、Nod1 ligandがなぜ脾臓単球にのみ影響を及ぼすのかが明らかにされていない。今後、AAA患者における腸内細菌叢の構成を明らかにし、腸内細菌叢を標的としたAAA治療の選択肢を見出したいと考えている。
展望
本研究は、腹部大動脈瘤の病態に腸内細菌叢が寄与している可能性を示した初めての報告である。腸内細菌叢と腹部大動脈瘤の発症との関係は非常に複雑であり、未だ不明である。我々は、腸内細菌叢の枯渇が単球-マクロファージの動態を変化させることによりAAAsの形成を抑制することを明らかにし、腸内細菌叢が治療のターゲットとなる可能性を示唆したが、抗生物質のカクテルに代わるより安全な方法を見つける必要があると思われる。
論文情報
謝辞
なし
資金提供元
日本学術振興会特別研究員(17K09497, 20H03676; K.H., 19H03653; T.Y., 20K17152; T.E.), 日本医療研究開発機構PRIME (18069370; T.Y.), 持田記念医学薬学振興財団 (T.E.), 日本応用酵素学財団 (T.E) による支援を受けています.
情報公開
著者らは、既知の利益相反はないことを表明している。
非標準の略語と頭字語
AAA
腹部大動脈瘤
アンギオテンシンII
アンジオテンシンII
AVNM
アンピシリン・バンコマイシン・ネオマイシン・メトロニダゾール
アポー
アポリポ蛋白E欠乏症
i.p.
腹腔内
PRR
パターン認識受容体
RT
逆転写
SBP
収縮期血圧
SEM
平均値の標準誤差
脚注
*これらの著者は等しく貢献した。
補足資料は https://www.ahajournals.org/doi/suppl/10.1161/HYPERTENSIONAHA.122.19422 で入手可能。
連絡先 6500017 神戸市中央区楠町7-5-1 神戸大学大学院医学研究科 内科学専攻 循環器内科学講座 山下智也(MD, PhD)。電子メール: tomoya@med.kobe-u.ac.jp
参考文献
1.Golledge J. Abdominal aortic aneurysm: update on pathogenesis and medical treatments.Nat Rev Cardiol. 2019; 16:225-242. doi: 10.1038/s41569-018-0114-9CrossrefMedlineGoogle Scholar
2.Lederle FA, Johnson GR, Wilson SE, Chute EP, Littooy FN, Bandyk D, Krupski WC, Barone GW, Acher CW, Ballard DJ. スクリーニングで発見された腹部大動脈瘤の有病率および関連性。Aneurysm Detection and Management (ADAM) Veterans Affairs Cooperative Study Group.Ann Intern Med. 1997; 126:441-449. doi: 10.7326/0003-4819-126-6-199703150-00004CrossrefMedlineGoogle Scholar
3.Tang W, Yao L, Roetker NS, Alonso A, Lutsey PL, Steenson CC, Lederle FA, Hunter DW, Bengtson LG, Guan W..., et al. Lifetime risk and risk factors for abdominal aortic aneurysm in a 24-year prospective study: the ARIC study (Atherosclerosis risk in communities).Arterioscler Thromb Vasc Biol. 2016; 36:2468-2477. doi: 10.1161/ATVBAHA.116.308147LinkGoogle Scholar
4.Raffort J, Lareyre F, Clement M, Hassen-Khodja R, Chinetti G, Mallat Z. Monocytes and macrophages in abdominal aortic aneurysm.Nat Rev Cardiol.(腹部大動脈瘤の単球とマクロファージ)。2017; 14:457-471. doi: 10.1038/nrcardio.2017.52CrossrefMedlineGoogle Scholar
5.Oliver-Williams C, Sweeting MJ, Turton G, Parkin D, Cooper D, Rodd C, Thompson SG, Earnshaw JJ; Gloucestershire, Swindon Abdominal Aortic Aneurysm Screening P. Lessons learned about prevalence and growth rates of abdominal aortic aneurysms from a 25-year ultrasound population screening programme.Br J Surg.2018; 105:68-74. doi: 10.1002/bjs.10715. CrossrefMedlineGoogle Scholar
6.Powell JT, Brady AR, Brown LC, Fowkes FG, Greenhalgh RM, Ruckley CV, Thompson SG; United Kingdom Small Aneurysm Trial参加者. このような場合、「膀胱炎」と呼ばれる。2002; 346:1445-1452. doi: 10.1056/NEJMoa013527CrossrefMedlineGoogle Scholar
7.Lederle FA, Wilson SE, Johnson GR, Reinke DB, Littooy FN, Acher CW, Ballard DJ, Messina LM, Gordon IL, Chute EP., et al. 小型腹部大動脈瘤の即時修復と監視の比較.N Engl J Med. 2002; 346:1437-1444. doi: 10.1056/NEJMoa012573CrossrefMedlineGoogle Scholar
8.Cao P, De Rango P, Verzini F, Parlani G, Romano L, Cieri E, Group CT. 2011; 41:13-25. doi: 10.1016/j.ejvs.2010.08.026CrossrefMedlineGoogle Scholar.
9.Ouriel K, Clair DG, Kent KC, Zarins CK; Positive Impact of Endovascular Options for treating Aneurysms Early (PIVOTAL) Investigators.動脈瘤の早期治療のための血管内修復術のポジティブインパクト。2010; 51:1081-1087. doi: 10.1016/j.jvs.2009.10.113CrossrefMedlineGoogle Scholar
10.Dale MA, Ruhlman MK, Baxter BT. AAAsにおける炎症性細胞の表現型:治療のターゲットとしての役割と可能性.Arterioscler Thromb Vasc Biol. 2015; 35:1746-1755. doi: 10.1161/ATVBAHA.115.305269LinkGoogle Scholar
11.Yodoi K, Yamashita T, Sasaki N, Kasahara K, Emoto T, Matsumoto T, Kita T, Sasaki Y, Mizoguchi T, Sparwasser T., et al. Foxp3+ regulatory T cells play a protective role in angiotensin II-induced aortic aneurysm formation in mice.Hypertension.HYBRICH.HYBRICH.T., et al. 2015; 65:889-895. doi: 10.1161/HYPERTENSIONAHA.114.04934LinkGoogle Scholar
12.林 崇、佐々木 直、山下 崇、溝口 崇、江本 崇、Amin HZ、淀井 健一、松本 崇、笠原 健一、吉田 典男, et al.紫外線B照射はCD4(+)Foxp3(+)制御性T細胞の拡大によりアンジオテンシンII誘発腹部大動脈瘤形成をマウスで抑制する.J Am Heart Assoc. 2017; 6:e007024. doi: 10.1161/JAHA.117.007024LinkGoogle Scholar
13.Kasahara K, Tanoue T, Yamashita T, Yodoi K, Matsumoto T, Emoto T, Mizoguchi T, Hayashi T, Kitano N, Sasaki N., et al. Commensal bacteria at the crossroad between cholesterol homeostasis and chronic inflammation in atherosclerosis.J Lipid Res. 2017; 58:519-528.doi: 10.1194/jlr.M072165CrossMedlineGoogle Scholar.
14.Stepankova R, Tonar Z, Bartova J, Nedorost L, Rossman P, Poledne R, Schwarzer M, Tlaskalova-Hogenova H. Absence of microbiota (germ-free conditions) accelerates the atherosclerosis in ApoE-deficient mice fed standard low cholesterol diet.J Atheroscler Thromb.(微生物群の不在は、低コレステロールの標準食を与えたApoE欠損マウスにおいて動脈硬化を加速させる).Atheroscler. 2010; 17:796-804. doi: 10.5551/jat.3285CrossrefMedlineGoogle Scholar
15.Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM., et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease.Nature. 2011; 472:57-63. doi: 10.1038/nature09922CrossrefMedlineGoogle Scholar
16.Emoto T, Yamashita T, Kobayashi T, Sasaki N, Hirota Y, Hayashi T, So A, Kasahara K, Yodoi K, Matsumoto T., et al. Characterization of gut microbiota profiles in coronary artery disease patients using data mining analysis of terminal restriction fragment length polymorphism: gut microbiota could be a diagnostic marker of coronary artery disease.Heart Vessels.「冠動脈病患者の消化器病プロファイルの特性」(英文). 2017; 32:39-46. doi: 10.1007/s00380-016-0841-yCrossrefMedlineGoogle Scholar
17.Yoshida N, Emoto T, Yamashita T, Watanabe H, Hayashi T, Tabata T, Hoshi N, Hatano N, Ozawa G, Sasaki N., et al. Bacteroides vulgatus and bacteroides doreiは腸内細菌のリポポリサッカライド生成を抑え、アテローム性動脈硬化を阻害する.Circulation.Circulation. 2018; 138:2486-2498. doi: 10.1161/CIRCULATIONAHA.118.033714LinkGoogle Scholar
18.Tang WH, Wang Z, Levison BS, Koeth RA, Britt EB, Fu X, Wu Y, Hazen SL.(タンWH、ワンZ、レビソンBS、コエスRA、ブリットEB、フーX、ウーY、ヘイゼンSL)。ホスファチジルコリンの腸内細菌代謝と心血管リスク.N Engl J Med. 2013; 368:1575-1584. doi: 10.1056/NEJMoa1109400CrossrefMedlineGoogle Scholar
19.Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, Britt EB, Fu X, Wu Y, Li L., et al. 赤身肉の栄養素であるL-カルニチンの腸内細菌叢代謝は動脈硬化を促進する.Nat Med.を参照。2013; 19:576-585. doi: 10.1038/nm.3145CrossrefMedlineGoogle Scholar
20.Shikata F, Shimada K, Sato H, Ikedo T, Kuwabara A, Furukawa H, Korai M, Kotoda M, Yokosuka K, Makino H., et al. 頭蓋内動脈瘤の形成における腸内細菌叢の潜在的影響。Hypertension.Hypertension.Hypertension.Hypertension.Hypertension.Hypertension.Hypertension.Hypertension.Methods. 2019; 73:491-496. doi: 10.1161/HYPERTENSIONAHA.118.11804LinkGoogle Scholar
21.He X, Bai Y, Zhou H, Wu K. Akkermansia muciniphila alters gut microbiota and immune system to improve cardiovascular diseases in murine model.Front Microbiol. 2022; 13:906920. doi: 10.3389/fmicb.2022.906920CrossrefMedlineGoogle Scholar
22.Miyauchi E, Kim SW, Suda W, Kawasumi M, Onawa S, Taguchi-Atarashi N, Morita H, Taylor TD, Hattori M, Ohno H. Gut microorganisms act together to exacerbate inflammation in spinal cords.Nature. 2020; 585:102-106. doi: 10.1038/s41586-020-2634-9CrossrefMedlineGoogle Scholar
23.Ghigliotti G, Barisione C, Garibaldi S, Brunelli C, Palmieri D, Spinella G, Pane B, Spallarossa P, Altieri P, Fabbi P., et al. CD16(+) monocyte subsets are increased in large abdominal aortic aneurysms and are differentially related with circulating and cell-associated biochemical and inflammatory biomarkers.Dis Markers.2013年3月1日:34章131-142節にあるように、腹部動脈瘤の病変は単球が多い。2013; 34:131-142. doi: 10.1155/2013/836849CrossrefMedlineGoogle Scholar
24.Jonsson AL, Backhed F. Role of gut microbiota in atherosclerosis.Nat Rev Cardiol. 2017; 14:79-87. doi: 10.1038/nrcardio.2016.183CrossrefMedlineGoogle Scholar
25.Mellak S, Ait-Oufella H, Esposito B, Loyer X, Poirier M, Tedder TF, Tedgui A, Mallat Z, Potteaux S. Angiotensin II mobilizes spleen monocytes to promote development of abdominal aortic aneurysm in Apoe-/- mice.Arterioscler Thromb Vasc Biol.2015; 35:378-388.doi: 10.1161/ATVBAHA.114.304389LinkGoogle Scholar
26.Ulndreaj A, Li A, Chen Y, Besla R, Pacheco S, Althagafi MG, Cybulsky MI, Lindsay T, Robbins CS, Byrne JS. Lyve-1-マクロファージのAdventitialリクルートメントは、アンジオテンシン-2ベースのmurine model.Clin Sci(Lond)において大動脈瘤を駆動します。2021; 135:1295-1309. doi: 10.1042/CS20200963CrossrefMedlineGoogle Scholar
27.Daugherty A, Cassis LA. 腹部大動脈瘤のマウスモデル.Arterioscler Thromb Vasc Biol.2004; 24:429-434. doi: 10.1161/01.ATV.0000118013.72016.eaLinkGoogle Scholar
28.Mebius RE, Kraal G. Structure and function of the spleen.Nat Rev Immunol. 2005; 5:606-616. doi: 10.1038/nri1669CrossrefMedlineGoogle Scholar
29.Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, Figueiredo JL, Kohler RH, Chudnovskiy A, Waterman P., et al. 脾臓リザーバー単球の同定と炎症部位への展開.Science.Science. 2009; 325:612-616. doi: 10.1126/science.1175202CrossrefMedlineGoogle Scholar
30.Robbins CS, Chudnovskiy A, Rauch PJ, Figueiredo JL, Iwamoto Y, Gorbatov R, Etzrodt M, Weber GF, Ueno T, van Rooijen N., et al. 骨髄外血液形成は、動脈硬化性病巣に侵入するLy-6C(高)単球を生成する.Circulation。2012; 125:364-374. doi: 10.1161/CIRCULATIONAHA.111.061986LinkGoogle Scholar
31.Rubio-Navarro A, Amaro Villalobos JM, Lindholt JS, Buendia I, Egido J, Blanco-Colio LM, Samaniego R, Meilhac O, Michel JB, Martin-Ventura JL., et al. Hemoglobin induces monocyte recruitment and CD163-macrophage polarization in abdominal aortic aneurysm.Int J Cardiol.(ヘモグロビンは腹部大動脈瘤において、モノサークル(単球)の動員およびCD163-マクロファージの分極を誘導する)。2015; 201:66-78. doi: 10.1016/j.ijcard.2015.08.053CrossrefMedlineGoogle Scholar
32.Weaver LK, Minichino D, Biswas C, Chu N, Lee JJ, Bittinger K, Albeituni S, Nichols KE, Behrens EM. 微生物叢に依存するシグナルは、TLRを介した免疫反応を維持するために必要である.JCI Insight. 2019; 4:e124370. doi: 10.1172/jci.insight.124370CrossrefGoogle Scholar
33.Kolypetri P, Liu S, Cox LM, Fujiwara M, Raheja R, Ghitza D, Song A, Daatselaar D, Willocq V, Weiner HL. 腸内細菌産物による脾臓単球のホメオスタシスと機能の制御.iScience. 2021; 24:102356. doi: 10.1016/j.isci.2021.102356CrossrefMedlineGoogle Scholar
この記事が気に入ったらサポートをしてみませんか?
