ダンゴムシCopris incertus Say (Coleoptera, Scarabaeidae)の発生段階における腸内細菌叢の多様性と組成
Front. Microbiol., 24 July 2020
Sec. システムズ・マイクロバイオロジー
第11巻 - 2020年|https://doi.org/10.3389/fmicb.2020.01698
ダンゴムシCopris incertus Say (Coleoptera, Scarabaeidae)の発生段階における腸内細菌叢の多様性と組成
https://www.frontiersin.org/articles/10.3389/fmicb.2020.01698/full#.ZGlA5o33FVw.twitter
Pablo Suárez-Moo1、Magdalena Cruz-Rosales2、Enrique Ibarra-Laclette1、Damaris Desgarennes3、Carmen Huerta2*、Araceli Lamelas1*。
1メキシコ、ハラパ、生態学研究所、分子生物学的研究開発センター
2メキシコ、サラパ市、生態学研究所、生態学研究室(Red de Ecoetología A.C.
3メキシコ、サラパ市、生態学研究所、生物多様性・組織学研究室(Red de Biodiversidad y Sistemática
糞虫は草食性哺乳類の糞を食べるホロメタボリックな昆虫で、栄養循環や土壌肥沃化などの生態系へのサービスを提供しています。糞のような不完全食で成長する生物は、栄養素の合成や利用のために微生物との関わりが必要であることが示唆されている。我々は、16S rRNA遺伝子シーケンスを用いて、ダンゴムシCopris incertusのライフサイクルにおける腸内細菌叢の多様性と組成を記述した。その結果、C. incertusの腸内には多様な細菌群(1,699 OTU、302属)が存在することがわかった。分類学的組成は甲虫のライフサイクルの中で変化し、特定の発生段階においていくつかの細菌属が優勢であった(Mothers: 母親:EnterobacterとSerratia、卵:NocardioidesとHydrogenophaga、幼虫と蛹の段階: DysgonomonasとParabacteroides、子実体: Ochrobactrum)。β多様性は、発生段階間の類似性を示し、(i)成体段階(母、雄、雌の子)、(ii)中間発生段階(幼虫と蛹)、(iii)初期段階(卵)に分類されました。微生物相の違いは、食餌の特殊性や、発達段階から次の段階への移行に関わる形態生理的な要因に起因する可能性がある。レベル3のカテゴリーを中核とする発育菌の予測機能プロファイル(PICRUSt2解析)は、発育ステージによるグループ化を示していた。SIMPER解析で有意だったのは、幼生期と蛹期に濃縮されたアミノ酸と抗生物質合成の代謝カテゴリーを含む36カテゴリーのみで、両カテゴリーとも変態過程に関与していることがわかった。遺伝子レベルでは、窒素固定、尿酸代謝、植物細胞壁分解に関連する機能をコードするKOにのみ、全発育ステージで有意な差が認められた。窒素固定と植物細胞壁分解は中間ステージで、尿酸代謝は母親で濃縮された。これらのデータから、子孫の腸内細菌叢の組成と多様性に母親の細菌叢が影響していることが示唆された。
はじめに
昆虫は、その発生、生態、進化に影響を与える細菌群集と共生的な関わりを持っている(Feldhaar, 2011; Engel and Moran, 2013; Schwab et al., 2016; Shapira, 2016)。関連する微生物はマイクロバイオータを構成し、昆虫の生存のための追加的な遺伝子や機能のリザーバーとして機能し得る(Feldhaar, 2011)。例えば、有益な共生生物は、限られた栄養素の消化と生産を促進し(Dillon and Dillon, 2004; Douglas, 2009)、病原体から昆虫宿主を守る(Engel and Moran, 2013)。昆虫腸内細菌叢の組成は大きな注目を集めており、発生段階(Chen et al., 2016)、食餌の種類(Colman et al., 2012; Franzini et al., 2016)、宿主分類(Colman et al., 2012; Kolasa et al., 2019)、環境(Ng et al., 2018)、社会的相互作用(Martinson et al., 2012)は昆虫腸内の微生物群組成と多様性に影響を与える重要な因子と実証されてきた。
昆虫の腸内細菌叢の研究への関心が高まり(Engel and Moran, 2013)、糞虫からの高い種多様性(Ridsdill-Smith and Simmons, 2009)、それらによってもたらされる生態機能(Nichols et al., 2008)にもかかわらず、彼らの腸内細菌叢に関連する細菌コミュニティは広くほとんど解明されていない(Thiyonila et al., 2018)ままだった。これまでの研究では、カブトムシの腸内に存在する相互主義的共生生物の役割が報告され、主にセルロース分解による糞の消化を促進している(Halffter and Matthews, 1971)。最近の研究では、母体からの分泌物やブルードボール内のペデスタルと呼ばれる特殊な構造物を介して、雌から子へ特定の細菌が垂直に伝播することが報告されている(Estes et al.、2013)。ペデスタルは母親の排泄物によって作られ、卵をブルードボールに固定するアンカーとして、また幼虫が孵化する際の餌として機能する(Byrne et al., 2013; Estes et al., 2013)。発育特性(成虫の体格、成虫になるまでの時間、幼虫の質量)と環境偶発性における台座微生物相の重要性は、ダンゴムシOnthophagus gazella(Schwabら、2016)において報告された。Parkerら(2019)は、宿主の発達における台座微生物叢の役割を評価した。彼らは、O. gazellaとO. sagittariusの間で母親のペデスタルを入れ替えると、成長が低下し、生存に影響を与え、発育時間を遅らせることを発見した。
ダンゴムシの細菌性微生物相、特に昆虫のライフサイクルにおけるその多様性と組成に関する知見は限られている。ライフステージに関連する腸内細菌群集の違いは、キクイムシ(Briones-Roblero et al., 2017)ハエ(Wang et al., 2018)、甲虫(Arias-Cordero et al., 2012)、鱗翅目(Chen et al., 2016)などいくつかの昆虫種について報告されている。しかし、Euoniticellus属のダンゴムシにおける唯一の報告は、幼虫、雄親、雌親の微生物叢における分類学的存在量プロファイルが、発達段階に従ってグループ化されていると判断しました(Shukla et al.、2016)。著者らは、成虫と比較して、幼虫の腸内でセルロース分解に関わる遺伝子の濃縮を検出しました。これは、各発達段階の食性特化と関連していると考えられる(Shukla et al.、2016)。
Copris incertusは、4つの発生段階(卵、幼虫、蛹、成虫)それぞれに特徴的な形態を持つホロメタボリック昆虫である(Klemperer, 1986; Halffter and Matthews, 1996)。この糞虫は共食いで、糞を掘る(Cruz and Huerta, 1998)。母親の世話は子孫の生存に影響する(Halffter and Matthews, 1996)。糞を埋めた後,雌は雄とペアになって巣を作り,そこに卵を入れるための子球を設置する (Halffter and Matthews, 1996)。Copris属に関する研究の多くは、生活史(Klemperer, 1986)、子育て(Klemperer, 1982; Tyndale-Biscoe, 1984; Halffter and Matthews, 1996)、生殖生態や行動(Cruz and Huerta, 1998)を調査しているが、その微生物相の分類学的・機能的多様性は欠如している。
本研究の目的は、C. incertusのライフサイクルの異なる段階(雌親、卵、幼虫、蛹、雄、雌の子)における腸内細菌叢を記述し比較することである。我々は、腸内細菌叢の多様性や組成、代謝機能の変化が宿主の発達と関連していると仮定した。本研究は、ダンゴムシの全ライフサイクルにおける腸内微生物の多様性を明らかにした初めての研究である。
材料と方法
試料の採取と16S rRNAアンプリコンの作製
Copris incertusを実験室条件下で飼育し、第3世代に属する成虫の雄と雌を交尾させ、土と新鮮な牛糞を与え、円筒形のプラスチックテラリアに入れた[詳細はHalffter and Matthews(1996)に記載]。3家族から母親,卵,3齢幼虫,サナギ,オス,メスの子孫を採集した。卵を除くすべての発生段階から、腸全体(挑心部から直腸まで)を解剖して採集し、完全に浸食した。サンプルは、90%エタノール、PBS、0.1% tween 20で1分間ずつ洗浄し、表面殺菌した。1家族につき1つの発生段階につき1つのサンプルを処理した(補足表S1)。ゲノムDNAは、QiAamp Fast DNA stool Mini Kitを用い、製造元の説明書に従って抽出した。
16S rRNA遺伝子のV4領域は、Illumina Miseqプラットフォームを用いて2×300 bpペアエンドランで配列決定した。16S rRNAの生シーケンス結果は、アクセッション番号PRJNA6039922でSequence Read Archive (SRA1)に寄託されました。
品質フィルターおよび配列解析
MiSeqランから得られたシーケンスリードは、QIIME2パイプライン(ver.2018.8.0)(Bolyen et al.、2018)を用いて処理した。tools import」と「demux」プラグインを使用して、「artifact file」を作成し、ペアエンドシーケンスリードを非多重化した。配列は、Deblurアルゴリズム(Amir et al.、2017)を用いて、PhredスコアQ20および長さ400bp以上の配列で品質フィルタリングを行った。高品質の配列は、Greengenesデータベース(gg_13_8_otus)に対して97%のペアワイズ同一性に基づいて運用分類単位(OTU)にクラスタリングした。uchime-denovo法およびfilter-features法を用いて、キメラ配列を同定し、除外した。OTUはGreengenesデータベース(ver.13_8)とfeature-classifierプラグインを用い、classifier-sklearn法で分類された。分類学的解像度を上げるため、属レベルで分類できなかった配列は、NCBIデータベースとSilva 16S rRNAデータベース(リリース132)に対してブラストした。葉緑体、ミトコンドリア、古細菌に割り当てられたOTU、および全サンプルにわたって少なくとも10カウントを持たない配列は削除された。フィルタリングされたOTU(フィルタリングされたOTUの表)は、各比較セット内で最も配列深度が浅いライブラリからの配列数に基づいて希釈されました。
腸内細菌叢の細菌組成と多様性
ダンゴムシCopris incertus(補足表S1)の合計18個のサンプルを用いて、腸内細菌叢の組成と多様性における発達段階の影響を検証した。分類学的多様性解析には、少なくとも1つのサンプルに存在するOTUとして定義される総OTU(「OT」)(フィルタリングおよび希釈OTU)、および発生段階細菌コア(「DC」)(同じ発生段階のすべてのサンプルで共有するOTUまたは属)が用いられた。機能的多様性については、DCのみを考慮した。
QIIME2を用いて、全OTU(以下、OT)のα多様性(観測OTU、Shannon指数、Faith PD)を推定・可視化し、Kruskal-Wallis検定を用いて群間比較の差を検定した。ライフステージ間の細菌群集の違い(β-diversity)は、フィルターで希薄化したOTU表を用い、Bray-Curtis距離(Bray and Curtis, 1957)を用いて算出した。全グループおよびペアごとのコミュニティ間の差は、QIIME2(Bolyen et al.、2018)の順列多変量分散分析(PERMANOVA)で計算した。
発生段階間の分類学的多様性の非類似性は、RのVEGAN v1.17-2 Package (Oksanen et al., 2018)を用いて、分類群相対存在量のBray-Curtis距離行列によるNMDS ordinationによって可視化した。ライフステージからの全OTUに見られる分類学的多様性(属レベル)を可視化するために、Rパッケージgplots v.3.0.1 (Warnes et al., 2016)を用いてバープロットおよびヒートマップを構築した。発生段階間で共有されるDC OTUとタクサを可視化するために、RパッケージUpsetR(Lex et al.、2014)を用いてUpsetplotが構築された。希薄化曲線は、QIIME2(Bolyen et al.、2018)を用いて直接計算した。
C.incertus微生物叢の機能的予測
各発達段階における細菌コミュニティの代謝機能プロファイルを予測するために、PICRUSt2(the Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)バージョン2を使用した(Douglas et al.、2019年)。DC reads abundanceを用いて、Kyoto Encyclopedia of Genes and Genomes(KEGG)で構築されたオルソロググループと識別子に基づくサンプルごとの予測遺伝子ファミリーカウントを含む表である。KEGGの識別子はレベル3で分類し、細菌の代謝や生理に関係のないカテゴリは削除した。フィルタリングされたカテゴリーにおける相対頻度間の非類似度は、Bray-Curtis距離行列を用いたNMDSで図示された。非類似度マトリックスにおける発達段階の効果は、RのVEGAN v1.17-2 Package (Oksanen et al., 2018)を使用して、PERMANOVAによって検証した。発達段階間の非類似性に寄与するカテゴリーを特定するために、類似性パーセンテージ分析(SIMPER)を行った(Oksanen et al.) SIMPER分析で有意差のあるレベル3のカテゴリは、Rパッケージgplots v.3.0.1 (Warnes et al., 2016)の関数heatmap.2を用いてヒートマップを生成するために使用されました。
昆虫の栄養における4つの特殊な有益機能(窒素固定、尿酸代謝、鉄の取り込み、植物細胞壁分解、補足表S2参照)のKEGGパスウェイマップに関連するKOの相対的存在量の違いを調べるために、Rパッケージggplot2を用いたボックスプロットを作成した(Ginestet、2011)。発達段階間の差は、Kruskal-Wallis検定を用いて検定した。ペア間の有意差は,Benjamini-Hochberg偽発見率(Benjamini and Hochberg, 1995)の補正を加えたポストホックテストとして,ペアワイズWilcoxonを用いて判定した。異なるKOに対する様々な分類群の機能的寄与は、PICRUSt2(Douglas et al., 2019)のコマンド-metagenome_contribで計算し、バープロットで可視化した。
結果の概要
腸内細菌叢の細菌組成と多様性
16S rRNAアンプリコンを用いて、異なる発達段階のダンゴムシCopris incertusから細菌微生物相を分析した。18のサンプルから合計855,407の高品質でフィルタリングされた配列と1,701のOTUが得られ、サンプルあたりの中央値は48,194リードと236 OTUでした(補足表S1)。フィルタリングされたOTUs表から「観察されたOTU」の希釈曲線は、OTUの数が飽和しており、すべてのサンプルについて十分なサンプリングが行われていることを示していた(補足図S1)。正規化OTUデータ(正規化カウント=16,538リード)から1,699 OTUが得られ、主な分類学的ランクで分類すると、100%が王国レベル、97%が門、95%がクラス、90%が目、74%が科、51%が属に割り当てられた(補足図 S2)。
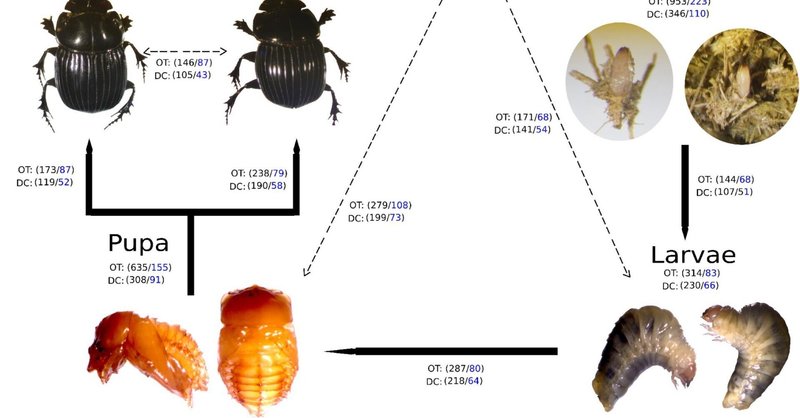
C. incertusの腸内には高い細菌多様性(1,699 OTUs and 302 genera, total OTUs "OT"; 476 OTUs and 128 genera, development's bacterial core "DC" )が見られ、発生ステージによって異なる(図1)。卵期は、OTU数(OT=953、DC=346)と属数(OT=223、DC=110)(図1)、および3つのα多様性指標において最も豊かさを示し、観測OTU数は583-594、Shannon indexは7.2-7.7、Fait PD indexでは16-20という範囲だった。しかし、観測されたOTUとShannon indexの推定値のみが、他の発生段階と比較して有意に異なっていた(いずれもp値=0.03)(図2)。DCから分類学的多様性を分析した結果、ほとんどのOTU(87%)と属(90%)がいくつかの発生段階間で共有され、29OTUと25属がすべてのサンプルで共有されていることがわかった。母親と卵のみ、それぞれ2個と60個のプライベートOTU、1個と12個の専用属があった(補足図S3)。幼虫は、総OTU数(314 OTU、83属)で決定されるリッチネスが最も小さく、雄はDC(136 OTU、55属)において最も少ない数であった(図1)。
図1
図1. Copris incertusの発達段階。各発達段階について、総OTU数(「OT」)と、それに対応するOTUS数(黒字)と属数(青字)を持つ発達段階のバクテリアコア(「DC」)を示す。線は、ある発生段階と次の発生段階(実線)および母親(破線)で共有されるOTUおよび属を示す。
図2
図2. 観察種、Shannon指数、Faith PDで測定した発生段階のα多様性の分布。指標は総OTU(OT)に基づいている。各色は発達段階を表す。
ノン・メトリック多次元尺度法(NMDS)により、発生段階が細菌群集のクラスタリングを決定することが示され、これは順列多変量分散分析(PERMANOVA)により裏付けられた(F = 4.9, p < 0.001) (図3)。また、成体サンプル(母、雄、雌の子)、中間発生サンプル(幼虫、蛹)、初期ステージサンプル(卵)のクラスタリングも観察された。試料MOT3は、3つの卵試料と一緒にグループ化された。これは、卵サンプルと共有するOTUの数が多い(350 OTU/全体の81%)ことから説明できる。
図3
図3 C. incertusの発達段階におけるβ多様性解析。1699のOTU(総OTU)のBray-Curtis距離に基づくNMDS(Non-metric multidimensional scaling)プロット。各記号は単一のダンゴムシサンプルにおける細菌群集を表し、色は起源となる科を表す。
1,699個のOTUから、合計19門、44クラス、84目、162科、302属が検出された。Proteobacteria (48%), Bacteroidetes (29%), Firmicutes (14%), Actinobacteria (7%), Verrucomicrobia (0.3%) の5つのフィラが最も豊富であった。異なる発生段階において、合計302の細菌属が発見された。最も多い20属は、全リード数の51%を占めた(図4)。属レベルでは、細菌組成の分析により、発生段階によっていくつかの細菌群が優勢であることが示されました。
図4
図4. 異なる発生段階の腸内細菌叢における最も豊富な20の細菌属の分類学的組成。細菌属の相対存在量の割合を異なる色で表している。
母親の腸内細菌叢には171属が含まれ、(3つのC. incertusサンプルの中央値/範囲)Enterobacter(0.71%/0-77%)、Serratia(0.71-67%)およびNocardioides(0.30%)は最も多い属であった。卵の微生物相については、223属が見つかり、Nocardioides(14.8%/14.2-16.2%)、Hydrogenophaga(13.9%/3.8-21%)、Stenotrophomonas(12.6%/3.7-15.1%)が最も多い属である(図4)。幼虫期と蛹期はそれぞれ83属と155属で定義され、そのうち80属は両方のステージで共有されていた。幼虫と蛹の3つのサンプルで支配的な分類群は、Dysgonomonas(中央値=34%、41%)とParabacteroides(中央値=49%、26%)でした(図4)。雌の子実体は62属で、Ochrobactrum(中央値=37.4%/32.4-49.2%)とSerratia(中央値=22.6%/13.9-39.4%)が最も多い属であることが分かった。男性の子孫は55属で、Stenotrophomonas(中央値=47.6/14.3-66.8%)とOchrobactrum(中央値=21%/2-56.8%)を最も多く含んでいた。母体と卵は、サンプル内の微生物相の多様性が最も高いことを示した(図4)。
開発コア菌の機能予測
異なるC. incertusサンプルの発生段階細菌コア(以下、DC)において、5,373個のKEGG Orthologyグループ(KO)が予測された(PICRUSt2解析)。KEGGのレベル3では、レベル2の23のカテゴリーに関連する171のカテゴリーが得られた(補足表S3)。KOs頻度が高い代謝カテゴリは、Metabolism of carbohydrates (mean = 19.5 ± 0.40), Amino acids (mean = 13.8 ± 0.20) で、頻度が低いカテゴリは Transport and catabolism (mean = 0.1 ± 0.10), Drug resistance antineoplastic (mean = 0.2 ± 0.01) である (Supplement Table S3) 。
171のカテゴリーの相対頻度に基づくBray-Curtis距離行列を用いて実施したNMDS(補足図S4)により、サンプルの機能構成が発達段階間で有意に異なることが明らかになった(PERMANOVA、F = 3.7, p < 0.001 )。SIMPER分析では、36のカテゴリーが、観察された発達段階間の違いの主要なドライバーとして同定された(図5A)。これらのカテゴリの頻度には、発生段階によって異なるパターンが確認された。幼虫と蛹はより類似しており(図5A)、エネルギー代謝(光合成生物と原核生物による炭素固定)、翻訳(アミノアシルtRNA生合成)に関連する代謝カテゴリーの高い頻度を示している、 糖質の代謝(アミノ糖とヌクレオチド糖の代謝)、抗生物質の生合成(抗植物性、アンサマイシンの生合成、バンコマイシン群の生合成)、アミノ酸(アラニン、アスパラギン酸、グルタミン酸の代謝)。レベル3の「ABCトランスポーター」「不飽和脂肪酸の生合成」などは、これらの発生ステージでは頻度が少なかった。卵では、抗生物質の生合成(エネディイン)、アミノ酸代謝(β-アラニン)など特定のカテゴリー群が見られたが、これらのカテゴリーはこのライフステージに限ったものではない。それ以外のカテゴリーは、C. incertusのサンプルに均等に分布していた(図5A)。この結果は、特定のKOの有無ではなく、KOの相対的な頻度がライフステージ間の非類似性を決定していることを示唆した。
図5
図5. 予測されたKEGGオルソログ群(KO)のレベル3(A)および遺伝子レベル(B)のカウントを発達段階別に比較した。(A) SIMPER解析で有意なレベル3の36カテゴリーのヒートマップ。各列はC. incertusサンプルに対応し、各行は特定のカテゴリーに対応する。(B) 窒素固定、尿酸代謝、鉄の取り込み、植物細胞壁分解に関わる予測されるKEGGオルソログ(KO)の相対的存在量。
代謝能力:窒素固定とリサイクル、鉄の取り込み、植物細胞壁成分(セルロース、ヘミセルロース、リグニン、ペクチン)の分解を、PICRUSt2によって予測された特定のKOの相対存在量に基づいて発達段階間で比較した(補足表S3)。鉄の取り込みを除き、すべての比較項目が発生段階間で有意に異なっていた(図5B)。幼虫と蛹は成虫よりも窒素固定と植物細胞壁分解に関わるKOの相対量が多く、成虫と卵は尿酸代謝(窒素リサイクル)に富むKOを示した(図5B)。Wilcoxonポストホックテストでは、4つの機能について、発生間の一対比較はいずれも有意でなかった。セルロース、ヘミセルロース、リグニンの分解に関連するKOの相対量には、発生段階間で有意な差が見られた。幼虫と蛹はセルロースとヘミセルロースの分解に関連するKOの相対量が高く、初期段階と成虫のKOはリグニン分解に富んでいた(補足図S5)。
PICRUSt2予測による4つの代謝機能に寄与する分類群の解析の結果、植物細胞壁分解機能は細菌属の多様性が最も高く(n = 110)、次いで鉄の取り込み(n = 56)、尿酸代謝(n = 40)、窒素固定(n = 13)だった(補足図S6)。幼虫と蛹の段階で窒素固定に寄与した主な分類群は、(3つのサンプルの中央値/範囲)C. incertusの3サンプルの中央値)Anaerosporomusa属(それぞれ29%/23-35%、29%/25-30%)、Sporomusa属(それぞれ19%/12-29%、13%/12-29%)、卵ではAzoarcus属(36%/13-48%)、 Azovibrio属(17%/3-19% )である、 であり、成体ではHalobacteriaceae科に属するOTU(母親27%/0-80%、男性の子孫4%/0-100%、女性の子孫10%/1-60%)であった(補足図S6A)。尿酸代謝では、全ライフステージにおいて、Enterobacter属、Ochrobactrum属、Nocardioides属、Acinetobacter属、Serratia属が主に寄与していることがわかった。この代謝機能では、卵が最も関連する分類群数が多かった(n = 合計48属)(補足図S6B)。
鉄の取り込みについては、幼虫と蛹の段階で、Dysgonomonas(それぞれ48%/45-50%、51%/49-53%)とParabacteroides(それぞれ36%/35-37%、33%/16-34%)を主な分類群として同定した、 卵ではRhodococcus(16%/11-42%)とPseudomonas(13%/11-23%)、雌の子ではSporomusa(0%/0-65%)とSerratia(0%/0-48%)、雄ではDysgonomonas(19%/6-22%)とGillisia(19%/10-20%)、そして、Elterobacter(15%/0-97%) と Serratia(6%/0. 2-92%)であった(補足図S6C)。植物細胞壁の分解については、Dysgonomonas(それぞれ58%/40-59%、37%/34-61%)とHydrogenophaga(25%/17-28%、11%/6-19%、 幼虫と蛹は、卵のOchrobactrum(0%/0-64%)とDysgonomonas(0%/0-16%)のNocardioides属(8%/7-15%)が、雌の子実体はOchrobactrum(34%/4-69%)、雄の子実体はEnterobacter (0.) だった。 74%/0-86%)、母親ではSerratia(0.17%/0.07-70%)であった。卵はこの代謝機能に関連する分類群の数が最も多かった(補足図S6D)。
考察
発育段階に応じた細菌群の優位性
我々は、16S rRNA遺伝子アンプリコンを用いて、ダンゴムシのライフサイクルを通じた腸内細菌叢を初めて記述し、比較した。本研究の主な発見は、Copris incertusの細菌群集の組成と多様性、および機能的可能性が、発生段階によって異なるということであった。
C. incertusの発達段階における腸内細菌叢の主な違いは、特定の微生物の有無ではなく、OTU(および属)の相対頻度によって決定されました。同様の結果は、E. intermediusやE. triangulatusといった他のダンゴムシでも観察されており、幼虫期と成虫期で細菌ファミリーの相対的存在量に違いが見られた(Shukla et al., 2016)。その他、マラリア蚊のAnopheles gambiae (Wang et al., 2011)、蝶のHeliconius erato (Hammer et al., 2014)などでも、主に幼虫と成虫で共有分類群の相対存在量に違いが見られる。
我々は、他のホロメタボリック昆虫と同様に、卵と母親はOTU数、属数、および/またはα多様性メトリクスにおいてより多様であることを発見した(Chen et al.、2016;Shukla et al.、2016)。これら2つの発生段階の微生物叢で観察される細菌組成と多様性の高い変動は、食物や環境に存在する日和見菌のコロニー形成に起因している可能性があります。卵の構造的特性により、ブルードチャンバーに堆積した雌の分泌物や糞から細菌がコロニー化する可能性がある(Shukla et al.、2016)。しかし、本研究では、ブルードボールと未処理の糞の微生物相は含まれていない。ブルードボールと未処理糞の間に有意な差(非加重UniFrac距離)があることから、母体分泌物や台座はブルードボールの細菌源として示唆されている(Shukla et al.、2016)。したがって、もしかすると、卵のコロニー形成のためのバクテリアの供給源は、ブルードボールである可能性があります。また、雌親の分泌物や子実体球に含まれる細菌が、滅菌処理後も卵の表面に残っていたと考えることもできる。しかし、C. incertusの腸内細菌叢の多様性と組成における母親の微生物叢と水平伝播の重要性を明らかにするためには、牛糞、台座、卵球を含む環境からのサンプリングが必要であろう。
C. incertusの腸内細菌叢のβ多様性解析では、初期(卵)、中間(幼虫と蛹)、成体(母親、子孫)のステージがクラスター化した。同様の結果は、シナハマダラカミキリ、Chrysomya megacephalaでも報告されている(Wang et al.、2018)。宿主のライフサイクルを通じて腸内細菌叢のこれらの変化は、次のような異なる要因によるものかもしれない:a)成虫と幼虫の食性特化。成虫は牛糞の小粒子を食べるが、幼虫は出生地のブルードボールを食べる(Holter and Scholtz, 2007; Scholtz, 2008)。ブルードボールには、バルクの牛糞よりもかなり小さな粒子径と比較的高い炭素/窒素比が含まれています(Byrne et al.、2013;Shukla et al.、2016)。3種のダンゴムシについて、糞、巣、子球の有機物中のアミノ酸濃度の違いが報告されている(Rougon et al.、1990)。食餌の種類が異なると、異なる細菌群集の選択を支える腸内の生化学的条件が異なる可能性がある。Shuklaら(2016)は、幼虫と成虫は、食餌の特殊性と各発達段階に内在する先天性形質に関連した異なる分類学的および機能的潜在能力(PICRUSt2分析)を有することを報告した。 b)ある発達段階から次の段階への移行に関わる形態生理学的要因。ホロメタボリック昆虫の変態期には、腸を含む器官が解剖学的リモデリングを乗り越える(Engel and Moran, 2013; Johnston and Rolff, 2015; Hammer and Moran, 2019)。C. incertusでは、第3幼虫から蛹への移行で、成虫期に観察されるものと同様の腸の形態変化が見られた(C. Huerta, unpublished data)。幼虫と比較して、成虫の腸は直径と長さが大きく、後腸の区分けがない(Halffter and Matthews, 1966; Halffter and Edmonds, 1982; Shukla et al., 2016)。
我々は、C. incertusからの腸のこれらの変化が、その発生過程における細菌群の優位性を決定することを示唆した。しかし、我々はさらに、蛹の腸の形態的な違いにもかかわらず、蛹の微生物群の多様性と組成は、他の発生段階よりも幼虫に似ていることを観察しました。この結果は、幼虫の微生物相が蛹の細菌群集に影響を与えていることを裏付けていると考えられる。私たちは、ミツバチの働き蜂やドローンの蛹で報告されているように、C. incertusの蛹に免疫反応がない場合(Gätschenberger et al.、2013年)、幼虫が免疫反応を担うのではないかと考えた。幼虫は、病原体の攻撃に対する防御機構を補助する微生物相を提供する責任があると考えられる。これは、甲虫のライフスタイル(未消化の廃棄物、および哺乳類の消化管からの病原性微生物が一般的である、糞の住人)を考慮すると関連性がある(Thyonila et al.、2018)。他の種のダンゴムシの研究では、3齢幼虫がその排泄物や再嚥下された液体の混合物で蛹の保護殻を構築することが報告されており(Edwards, 1986; Rougon et al., 1990)、これもこれらの発生段階の微生物相に見られる類似性を説明できるだろう。
また、蛹は成虫と多くのOTUや属を共有していることが確認されたが、その差は存在量レベルであった。このことから、変態の過程自体が特定の微生物群の優位性に影響を与えることが示唆された。さらに、異なる細菌群によってコロニー形成される可能性のある新しい宿主組織の出現は、特定の細菌群の優位性を決定する別の要因である(Hammer and Moran, 2019)。とはいえ、これらの微生物の変化は、Spodoptera littoralis(Chenら、2016)およびGalleria mellonella(JohnstonおよびRolff、2015)、埋没性甲虫Nicrophorus vespilloides(WangおよびRozen、2017)などの他の昆虫について報告されているように、C. incertusの成虫にとって有益な結果となる。
母親ではEnterobacterとSerratia、卵ではNocardioidesとHydrogenophaga、幼虫と蛹ではDysgonomonasとParabacteroides、雌の子虫ではOchrobactrumとSerratia、雄の子虫ではStenotrophomonasとOchrobactrumが優勢属となった。Onthophagus taurusの母親の腸内細菌叢(Estes et al., 2013)およびOnthophagus damaの成虫の腸内(Kumari et al., 2018)では、Enterobacterが最も豊富な属であった。Dysgonomonas 属は E. intermedius と E. triangulatus の幼虫期 (Shukla et al., 2016) と Pachysoma MacLeay 砂漠糞虫2種の腸内細菌叢 (Franzini et al., 2016) においてより豊富であった.
PICRUSt2の解析結果から、昆虫の宿主に窒素などの必須栄養素、ビタミン、補酵素、解毒や食品加工に関わる酵素を提供する共生微生物に期待されるように、発生段階の腸内細菌叢は宿主に有益な様々な代謝機能を担い得ることがわかった(Douglas, 2009)。レベル3の多様性(L3)のカテゴリーは、発生段階によってグループ化され、幼虫とサナギの段階でより類似していることが示された。このことは、これらの発生段階において、細菌の多様性とL3カテゴリーが多く共有されていることを示す。ホロメタボリック昆虫の発生段階に関連した機能差は、Euoniticellus属のダンゴムシでは植物細胞壁分解(グリコシドヒドロラーゼ)や窒素固定など、鱗翅目Spodoptera littoralisでは第2階層レベルのいくつかのKEGGカテゴリー(細胞運動、膜輸送)で報告されている(Chen et al.、2016)。
その結果、幼虫と蛹で濃縮されたL3カテゴリがアミノ酸代謝に関連する機能に関与していることがわかりました。ダンゴムシ3種の幼虫期では、アラニンを含む6種類のアミノ酸を中心に高いアミノ酸分解率が報告されており(Rougon et al., 1990)、C. incertusの幼虫期および蛹期ではこの代謝が濃縮されていました。さらに、カブトムシのTenebrio molitorでは、アミノ酸の不足が幼虫の発育や生存に影響を与えることが報告されている(Davis, 1975)。
抗生物質の生合成に関するカテゴリー(アンチフォレート耐性、アンサマイシン、バンコマイシン)は、蛹と幼虫のステージで高い相対頻度を示した。これは、鱗翅目Spodoptera littoralis幼虫において、Enterococcus属の病原株に対して作用するバクテリオシン(mundticin KS)の生産を担う共生体を含むことがこれまでに報告されている(Shao et al.、2017)。蛹の腸内に抗菌ペプチドを産生することで、変態時の病原微生物の感染を防ぐことができると考えられている(Hammer and Moran, 2019)。レベル3のカテゴリーには、無症状に植物をコロニー化する細菌など、人間の病気に関連するKOが含まれていることが分かった。特定の条件下では、これらの病原体は、一次宿主にコロニーを作る前に、昆虫の腸を二次宿主として特定する(Tyler and Triplett, 2008; Holden et al., 2009)。一方、昆虫の腸内細菌叢は、ヒトの病原体に対する抗菌性化合物の供給源である(Heise et al.、2019)。
鉄の取り込みを除き、ライフステージ間(遺伝子レベル)で特定の代謝機能の相対的な存在量に大きな違いがあることがわかった。窒素固定と植物細胞壁分解に関わるKOの相対存在量は、幼虫期と蛹期で初期と成虫期より高かった。同様の結果が、Euoniticellus属の幼虫対雄成虫のグリコシドヒドロラーゼ酵素(植物細胞壁分解酵素を含む)およびニトロゲナーゼに関与するKOについて報告された(Shukla et al., 2016)。我々の結果とは逆に、尿酸代謝に関与するKEGG Orthologsの相対的な存在量に有意な差がないことを発見した(Shukla et al.、2016)。我々の場合、初期および成虫ステージは、幼虫および蛹ステージよりも有意に高い相対存在量を示した。
その結果、中間ステージでは植物細胞壁分解酵素とニトロゲナーゼの高い活性が示唆された。これは、窒素に比較的乏しいがセルロースに富む幼虫の餌の内容で説明できる(Shukla et al.、2016)。中間ステージの窒素固定に関わるKOの相対量が高いことは、高いアミノ酸濃度がダンゴムシ類の幼虫に必須であるという考えを支持する(Rougon et al.、1990)。植物細胞壁分解酵素に関連するKOの予測は、ダンゴムシが栄養素を完全に利用するために微生物に依存しており、腸をセルロース消化細菌による発酵室として想定していることを示唆した(Halffter and Matthews, 1971)。アフリカ糞虫Euoniticellus intermediusの幼虫の微生物相について、in vivoでのエンドヌクレアーゼ活性が報告されている(Mabhegedhe, 2017)。セルロースの分解産物であるペクチンやキシランは、幼虫の発育に不可欠な栄養素であることが示唆されています(Shukla et al.、2016)。さらに、尿酸の再利用は、初期および成虫の段階では窒素源となり、幼虫および蛹ではニトロゲナーゼ活性が窒素獲得に主な役割を果たすと考えられる。鉄の取り込みに関連するKOが、特定の代謝プロセスに関連するのか、鉄の毒性から保護するのか、あるいは他の昆虫種の微生物相について提案されているように、病原性細菌に対して拮抗作用を持つのかは、まだ明らかにされていません(Sonawane et al.、2018)。
実験的および分子生物学的研究により、窒素固定、鉄の取り込み、尿酸代謝、および植物細胞壁分解における多くの細菌属の機能的可能性が支持されている(Schäfer et al., 1996; Indiragandhi et al., 2007; Anand et al., 2010; Engel and Moran, 2013; Inoue et al., 2015). Serratia、Enterobacter、Pseudomonasは、植物細胞壁分解に最も関連する貢献者のトップ20に含まれています。Bombyx moriの腸から分離されたこれらの属の細菌株は、セルロース、キシラン、ペクチン、デンプンを分解するセルロース分解活性を示した (Anand et al., 2010) 。本研究では、成虫および卵において、Ochrobactrum属が植物細胞壁分解の主役であった。この属の細菌株はシロアリの腸内でヘミセルロース分解活性(1,3-b-Galactanase, b-D-Galactosidase, 1,4-b-xylanase, b-D-Xylosidase) を有する (Schäfer et al., 1996). DysgonomonasはC. incertusの幼虫および蛹の腸内における植物細胞壁分解の決定因子であると思われた。Dysgonomonas属に分離された株は、グルコース発酵の主な最終産物として酢酸、乳酸、プロピオン酸、コハク酸の生産を示している(Sakamoto, 2014)。また、シロアリ腸内のβ-グルコシダーゼによるセルロースの加水分解能力から、本属が植物細胞壁の分解に関与している証拠がある(Zhang et al.、2014)。セラチア属は、成虫と卵の段階で鉄の取り込みに最も重要な貢献をしていた。鱗翅目腸からのこの属の分離株は、in vitroでシデロフォアの合成に陽性であった(Indiragandhi et al.、2007)。
尿酸代謝については、Pseudomonas属とSerratia属が最も重要な貢献者のトップ20に含まれていた。これらは試験管内で尿酸をリサイクルすることができ、甲虫Dendroctonus valensの卵、幼虫、成虫(雄と雌)の窒素源として使用されました(Morales-Jiménez et al., 2013)。細菌の窒素固定活性は、シロアリ、ゴキブリ、アリ、アブラムシ、甲虫などの昆虫で報告されている[Bar-Shmuel et al.(2020)参照]が、昆虫腸内の窒素固定因子として報告された属はなく、植物の窒素固定能力で知られている根粒菌目(Masson-Boivin et al.、2009)は例外だった。
PICRUSt2解析により明らかになった機能的可能性と分類群の貢献度から、C. incertusの発生における腸内細菌叢の重要性と機能を確認するためには、実験的な評価が必要である。
発育段階における母親微生物相の影響
本研究では、母子間で細菌の多様性とその代謝機能が共有されていることを明らかにした。また、C. incertusにおける母親の世話は、初期、中間、子孫の各段階の細菌微生物相の多様性と構成に大きな影響を与えることが示唆された。埋没性甲虫Nicrophorus vespilloidesにおける母性介護は、母親から子孫への腸内細菌叢伝達のメカニズムとして示唆されており、幼虫の腸のコロニー化を促進する(Wang and Rozen, 2017)。コプリス属では、母性介護の仕事として、排泄物や分泌物を子球に使う糞の塊に取り込むこと、日和見性の昆虫や菌類から子球を守ること、子球が出現するまで子球を常に維持することが挙げられる(Klemperer、1982;Tynder-Biscoe、1984;Halffter and Matthews、1996)。C. incertusにとって、母性的なケアは、子実体の発達と生存のための重要な要因であることが報告されている(Halffter and Matthews, 1996)。また、このような母性的な行動は、細菌群集の後期への垂直伝播のメカニズムとして、また、子孫の生存を有利にするメカニズムとして働く可能性も否定できない。C. incertusの母親は、他のCopris種と同様に、卵を台座でブルードボールに固定する(Bang et al., 2004)。母親の糞から作られたこの構造は、Euoniticellus属(Shukla et al., 2016)やOnthophagus属(Estes et al., 2013)のダンゴムシに見られる母親の贈り物とは異なる。しかし、他のダンゴムシで報告されているように、この母体構造による微生物叢の垂直伝播、C. incertusの子孫の成長・発達促進を否定するものではない(Estes et al., 2013; Schwab et al., 2016; Shukla et al., 2016)。子実体における母親の影響は、ダンゴムシのO. taurusでも報告されている。この種では、幼虫と蛹は母親といくつかの同一のOTUを共有していた(Estes et al.、2013)。我々の結果は、ダンゴムシの発達と生存における母親の微生物相の重要性を報告した初期の研究を支持するものである(Halffter and Matthews, 1971; Byrne et al., 2013; Estes et al., 2013; Schwab et al., 2016; Shukla et al., 2016; Parker et al., 2019).
データの利用可能性に関する声明
データはここで見ることができます:https://www.ncbi.nlm.nih.gov/bioproject/PRJNA603992.
著者による貢献
AL、CH、MC-R、EI-L:作品の構想・設計。CHとAL:資金獲得。PS-MおよびAL:本作品のデータの分析および解釈、および本作品のドラフト作成。DD:重要な知的内容のために批判的に改訂した。すべての著者が原稿を承認した。
資金提供
この研究は、「Dirección General del Instituto de Ecología」(INECOL 2003530893)およびCONACyT-FORDECYT番号292399の支援を受けた。
利益相反
著者らは、本研究が、潜在的な利益相反と解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
謝辞
Luisa Fernanda Cruzの有益な議論と提案に感謝したい。また、生物学的サンプルの処理にご協力いただいたOfelia Ferrera Rodríguezに感謝します。CH と AL には、Dirección General del Instituto de Ecología の 2003530893 賞が授与されたことを感謝する。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2020.01698/full#supplementary-material でオンライン公開されています。
脚注
^ http://www.ncbi.nlm.nih.gov/sra
^ https://www.ncbi.nlm.nih.gov/bioproject/PRJNA603992
参考文献
Amir, A., Daniel, M., Navas-Molina, J., Kopylova, E., Morton, J., Xu, Z. Z., et al. (2017). Deblur は一塩基のコミュニティ配列パターンを迅速に解決する。 mSystems 2:e00191-16.
グーグル スカラー
Anand, A. A. P., Vennison, S. J., Sankar, S. G., Prabhu, D. I. G., Vasan, P. T., Raghuraman, T., et al. (2010). セルロース、キシラン、ペクチン、デンプンを分解するBombyx moriの腸内細菌の単離と特徴づけおよび消化への影響。その結果、セルロース、キシラン、ペクチン、デンプンを分解するバクテリアの分離とその消化への影響を明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
Arias-Cordero, E., Ping, L., Reichwald, K., Delb, H., Platzer, M., and Boland, W. (2012). フォレストコックチャーファー(Melolontha hippocastani)の地下および地上ライフステージ(幼虫および甲虫)に関連する腸内細菌叢の比較評価。(注) 1.本データはこの書籍が刊行された当時に掲載されていたものです この文書は英文著書『PLoS One 7:e51557.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
バング、H. S. 、クォン、O. S. 、ホワン、S. J. 、マー、Y. I. 、ワットホー、K. G. (2004). 韓国産糞虫Copris ochus (Motschulsky) (Coleoptera: Scarabaeidae) の発生生態とフェノロジー.Coleopt. Bull. 58, 522-533.
クロスレフフルテキスト|Google Scholar
Bar-Shmuel, N., Behar, A., and Segoli, M. (2020). 昆虫の生物学的窒素固定について我々は何を知っているか?エビデンスと昆虫と生態系への示唆。昆虫科学 27, 392-403. doi: 10.1111/1744-7917.12697.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Benjamini, Y., and Hochberg, Y. (1995). 偽発見率の制御:多重検定への実用的で強力なアプローチ。J. R. Stat. Soc. Ser. B 57, 289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x.
クロスレフフルテキスト|Google Scholar
Bolyen, E., Dillon, M., Bokulich, N., Abnet, C., Al-Ghalith, G., Alexander, H., etc. (2018). QIIME 2: 再現可能、インタラクティブ、スケーラブル、かつ拡張可能なマイクロバイオームデータサイエンス. PeerJ Prepr. 6:e27295v2. doi: 10.7287/peerj.preprints.27295.
クロスレフフルテキスト|Google Scholar
Bray, J. R., and Curtis, J. T. (1957). ウィスコンシン州南部の高地林相の序列化.Ecol. Monogr. 27, 325-349.
クロスレフフルテキスト|Google Scholar
Briones-Roblero, C. I., Hernández-García, J. A., Gonzalez-Escobedo, R., Soto-Robles, L. V., Rivera-Orduña, F. N., and Zúñiga, G. (2017). キクイムシ、Dendroctonus rhizophagus (Curculionidae: Scolytinae) のライフステージに渡る腸内細菌微生物群の構造と動態。PLoS One 12:e0175470. doi: 10.1371/journal.pone.0175470
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Byrne, M. J., Watkins, B., and Bouwer, G. (2013). ダンゴムシの幼虫が糞を食べるには、親からの微生物共生体が必要なのか?Ecol. Entomol. 38, 250-257. doi: 10.1111/een.12011.
クロスレフフルテキスト|Google Scholar
Chen, B., Teh, B. S., Sun, C., Hu, S., Lu, X., Boland, W., et al. (2016). 昆虫草食動物Spodoptera littoralisの生活史に渡る腸内細菌叢の生物多様性と活動性。Sci. Rep. 6:29505. doi: 10.1038/srep29505.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Colman, D. R., Toolson, E. C., and Takacs-Vesbach, C. D. (2012). 昆虫の腸内細菌群集は食性と分類学に影響されるか?Mol. Ecol. 21, 5124-5137. doi: 10.1111/j.1365-294X.2012.05752.x.
PubMed Abstract|CrossRef Full Text|Google Scholar
Cruz, M., and Huerta, C. (1998). コクゾウムシ科コクゾウムシ属(Coleoptera Scarabaeidae: Scarabaeaeae)の生態と繁殖活動.Acta Zool. Mex. 74, 163-173.
Google Scholar
Davis, G. R. (1975). J. Nutr. 105, 1071-1075. doi: 10.1093/jn/105.8.1071.
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Dillon, R. J., and Dillon, V. M. (2004). 昆虫の腸内細菌:非病原性相互作用。Annu. Rev. Entomol. 49, 71-92. doi: 10.1146/annurev.ento.49.061802.123416.
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Douglas, A. E. (2009). 昆虫の栄養生態における微生物次元。Funct. Ecol. 23, 38-47. doi: 10.1111/j.1365-2435.2008.01442.x.
クロスレフフルテキスト|Google Scholar
Douglas, G., Maffei, V. J., Zaneveld, J., Yurgel, S. N., Brown, J. R., Taylor, C. M., et al. (2019). PICRUSt2: an improved and extensible approach for metagenome inference Gavin. bioRxiv [Preprint]. doi: 10.3997/2214-4609.201404048.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Edwards, P. B. (1986). アフリカ南部における糞虫Onitis caffer Boheman (Coleoptera: Scarabaeidae) のフェノロジーと野外生物学。Bull. Entomol. Res.76,433-446。
クロスレフフルテキスト|Google Scholar
Engel, P., and Moran, N. A. (2013). 昆虫の腸内細菌叢 - 構造と機能の多様性. FEMS Microbiol. Rev.37、699-735。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Estes, A. M., Hearn, D. J., Snell-Rood, E. C., Feindler, M., Feeser, K., Abe, T., 他 (2013). ダンゴムシ、Onthophagus taurus (Coleoptera: Scarabaeidae)におけるマイクロバイオームメンバーのブルードボール媒介による伝達。そのため、このような現象が起こる可能性がある。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Feldhaar, H. (2011). 昆虫宿主の生態学的に重要な形質の媒介者としての細菌共生体。Ecol. Entomol. 36, 533-543. doi: 10.1111/j.1365-2311.2011.01318.x.
クロスレフフルテキスト|Google Scholar
Franzini, P. Z. N., Ramond, J. B., Scholtz, C. H., Sole, C. L., Ronca, S., and Cowan, D. A. (2016). 異なる餌を食べる2種のPachysoma Macleay砂漠の糞虫(Coleoptera: Scarabaeidae: Scarabaeinae)の腸内細菌叢(The gut Microbiomes)。PLoS One 11:e0161118. doi: 10.1371/journal.pone.0161118.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gätschenberger, H., Azzami, K., Tautz, J., and Beier, H. (2013). ミツバチ(Apis mellifera)の抗菌免疫能力は、異なるライフステージと環境リスクに適応している。PLoS One 8:e66415. doi: 10.1371/journal.pone.0066415.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ginestet、C. (2011). ggplot2: データ解析のためのエレガントなグラフィックス. J. R. Stat. 174、245-246、doi: 10.1007/978-0-387-98141-3
クロスレフフルテキスト|Google Scholar
Halffter, G., and Edmonds, D. W. (1982). ダンゴムシの営巣行動(Scarabeinae).An Ecological and Evolutive Approach. México: Instituto de Ecología, D.F. 10. 177.
Google Scholar
ハルフター、G.、マシューズ、E.G. (1966). スカラベエ亜科の糞虫の自然史(Coleoptera: Scarabaeidae).Folia Entomologica Mexicana 12-14, 1-312.
Google Scholar
ハルフター、G.、マシューズ、E.G. (1966). スカラベ亜科の糞虫の博物誌(Coleoptera: Scarabaeidae)(Folia entomoloì gica Mexicana. México: メキシコ:メキシコ昆虫学会(Sociedad Mexicana de Entomología).
クロスレフフルテキスト|Google Scholar
ハルフター、G.、マシューズ、E.G. (1971). 糞虫の自然史。関連する生物相についての補足。Rev. Latinoam. Microbiol. 13, 147-164.
Google Scholar
Hammer, T. J., McMillan, W. O., and Fierer, N. (2014). 蝶に関連する細菌コミュニティのメタモルフォーゼ(Metamorphosis of a butterfly-associated bacterial community)。PLoS One 9:e86995. doi: 10.1371/journal.pone.0086995.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hammer, T. J., and Moran, N. A. (2019). ホロメタボリック昆虫における変態と共生の関連性.フィロス.Trans. R. Soc. B Biol. Sci. 374:20190068. doi: 10.1098/rstb.2019.0068.
PubMed Abstract|CrossRef Full Text|Google Scholar
Heise, P., Liu, Y., Degenkolb, T., Vogel, H., Schäberle, T. F., and Vilcinskas, A. (2019). 埋没性甲虫Nicrophorus vespilloidesの腸内における抗生物質産生性有益細菌。Front. Microbiol. 10:1178. doi: 10.3389/fmicb.2019.01178.
PubMed Abstract|CrossRef Full Text|Google Scholar
Holden, N., Pritchard, L., and Toth, I. (2009). Colonization outwith the colon: Plant as an alternative environmental reservoir for human pathogenic enterobacteria: 総説。FEMS Microbiol. Rev.33、689-703。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Holter, P., and Scholtz, C. H. (2007). ダンゴムシは何を食べているのか?Ecol. Entomol. 32, 690-697. doi: 10.1111/j.1365-2311.2007.00915.x
クロスレフフルテキスト|Google Scholar
Indiragandhi, P., Anandham, R., Madhaiyan, M., Poonguzhali, S., Kim, G. H., Saravanan, V. S., etc. (2007). プロチオフォス耐性、プロチオフォス感受性、および野外で捕獲したコナガの幼虫腸に関連する培養可能な細菌と、昆虫病原性真菌および宿主昆虫の栄養に対する拮抗作用の可能性について。J. Appl. Microbiol. 103、2664-2675.doi: 10.1111/j.1365-2672.2007.03506.x.
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
井上淳一、大島和彦、須田和彦、坂本真理、飯野哲也、野田聡、他(2015).バクテロイデーテス門における窒素固定遺伝子の分布と進化. Microbes Environ. 30, 44-50. doi: 10.1264/jsme2.ME14142.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Johnston, P. R., and Rolff, J. (2015). 完全変態時に宿主と共生者が共同で腸内細菌叢を制御する。PLoS Pathog. 11:e1005246. doi: 10.1371/journal.ppat.1005246.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Klemperer, H. G. (1982). コプリス・ルナリス(Coleoptera, Scarabaeidae)における親行動:子球と巣の世話と防衛。Ecol. Entomol. 7, 155-167. doi: 10.1111/j.1365-2311.1982.tb00654.x.
クロスレフフルテキスト|Google Scholar
Klemperer, H. G. (1986). 新熱帯雨林の糞虫Copris laeviceps (Coleoptera, Scarabaeidae)の生活史と親行動. J. Zool. 209, 319-326. doi: 10.1111/j.1469-7998.1986.tb03594.x
クロスレフフルテキスト|Google Scholar
コラサ、M.、シュシビオル、R.、マズール、M.A.、クビシュ、D.、ドゥデク、K.、カイトチ、Ł. (2019). 宿主の分類学、トロフィー、内共生体が甲虫のマイクロバイオーム多様性をどのように形成しているか。Microb. Ecol. 78, 995-1013. doi: 10.1007/s00248-019-01358-y
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kumari, S., Rangeshwaran, R., Shylesha, A. N., and Patil, J. (2018). ダンゴムシの成虫Oniticellus cinctusとOnthophagus dama(Coleoptera: Scarabaeidae)に関連する腸内微生物叢。イント.J. Curr. Microbiol. Appl.Sci. 7, 847-854. doi: 10.20546/ijcmas.2018.703.099
クロスレフフルテキスト|Google Scholar
Lex, A., Gehlenborg, N., Strobelt, H., Vuillemot, R., and Pfister, H. (2014). UpSet: 交差する集合の可視化. IEEE Trans. Vis. Comput. Graph. 20, 1983-1992. doi: 10.1109/TVCG.2014.2346248
PubMed Abstract|CrossRef Full Text|Google Scholar
Mabhegedhe, M. (2017). ダンゴムシ、Euoniticellus intermedius、幼虫の腸内ミクロフローラによるセルロース分解活性. オープンバイオテクノル. J. 11, 105-113. doi: 10.2174/1874070701711010105
クロスレフフルテキスト|Google Scholar
Martinson, V. G., Moy, J., and Moran, N. A. (2012). ミツバチ働き蜂の発育過程における特徴的な腸内細菌の確立。Appl. Environ. Microbiol. 78, 2830-2840. doi: 10.1128/AEM.07810-11.
PubMed Abstract | CrossRef Full Text | Google Scholar
Masson-Boivin, C., Giraud, E., Perret, X., and Batut, J. (2009). マメ科植物と窒素固定共生を確立する: 根粒菌のレシピはいくつあるのか?Trends Microbiol. 17, 458-466. doi: 10.1016/j.tim.2009.07.004.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Morales-Jiménez, J., Vera-Ponce de León, A., García-Domínguez, A., Martínez-Romero, E., Zúñiga, G., and Hernández-Rodríguez, C. (2013). Dendroctonus rhizophagus and Dendroctonus valens (Curculionidae: Scolytinae) の腸に関連する窒素固定細菌および尿分解細菌。Microb. Ecol. 66, 200-210. doi: 10.1007/s00248-013-0206-3
PubMedアブストラクト|クロスリード全文|Google Scholar
Ng, S. H., Stat, M., Bunce, M., and Simmons, L. W. (2018). 飼料と環境が畑コオロギの腸内微生物群集に与える影響。Ecol. Evol. 8, 4704-4720. doi: 10.1002/ece3.3977.
PubMed Abstract|CrossRef Full Text|Google Scholar
Nichols, E., Spector, S., Louzada, J., Larsen, T., Amezquita, S., and Favila, M. E. (2008). Scarabaeinae科の糞虫が提供する生態系機能と生態系サービス. Biol. Conserv. 141, 1461-1474.
クロスレフフルテキスト|Google Scholar
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., et al. (2018). Vegan: コミュニティエコロジーパッケージ。R Package Version 2.5-1. Available online at: https://CRAN.R-project.org/package=vegan.
グーグル・スカラー
Parker, E. S., Dury, G. J., and Moczek, A. P. (2019). Onthophagus dung beetlesにおける種特異的で母体から伝達される微生物相の世代を超えた発達効果。Ecol. Entomol. 44, 274-282. doi: 10.1111/een.12703.
クロスレフフルテキスト|Google Scholar
Ridsdill-Smith, J., and Simmons, L. W. (2009). また、"Dung beetles", in Encyclopedia of Insects, 2nd Edn, eds V. H. Resh, and R. T. Carde (San Diego, CA: Academic Press, 304-307), doi: 10.1016/B978-0-12-374144-8.00090-4.
クロスレフフルテキスト|Google Scholar
Rougon, D., Rougon, C., Levieux, J., and Trichet, J. (1990). ダンゴムシ(Coleoptera, Scarabaeidae)の営巣時におけるサヘルのゼブ糞中のアミノ酸含量の変動。Soil Biol. 生物化学. 22, 217-223. doi: 10.1016/0038-0717(90)90090-M
クロスレフフルテキスト|Google Scholar
坂元美樹(2014)."ポルフィロモナド科", 原核生物-細菌と古細菌の他の主要系統, E. Rosenberg, E. F. DeLong, S. Lory, E. Stackebrandt, and F. Thompson 編 (Berlin: Springer), 811-822. doi: 10.1007/978-3-642-38954-2_132.
クロスレフフルテキスト|Google Scholar
Schäfer, A., Konrad, R., Kuhnigk, T., Kämpfer, P., Hertel, H., and Köning, H. (1996). シロアリ腸内細菌のヘミセルロース分解菌と酵母。J. Appl. Bacteriol. 80, 471-478. doi: 10.1111/j.1365-2672.1996.tb03245.x
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Scholtz, C. H. (2008). "セクション B. 生理・行動生態", C. H. Scholtz, A. L.V. Davis, and U. Kryger (Sofia: Pensoft Publishers), 119-328, eds Dung Beetle Evolutionary Biology and Conservation of Dung Beetle, in 119-329.
Google Scholar
Schwab, D. B., Riggs, H. E., Newton, I. L. G., and Moczek, A. P. (2016). ダンゴムシにおける母体感染微生物群の発達的・生態学的利益。アム.Nat. 188, 679-692. doi: 10.1086/688926
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Shao, Y., Chen, B., Sun, C., Ishida, K., Hertweck, C., and Boland, W. (2017). 共生生物由来の抗菌剤が鱗翅目腸内細菌叢の制御に寄与している。セル・ケム.Biol. 24, 66-75. doi: 10.1016/j.chembiol.2016.11.015.
PubMed Abstract|CrossRef Full Text|Google Scholar
シャピラ、M. (2016). 腸内細菌と宿主の進化:共生のスケールアップ。トレンド・エコル(Trends Ecol. Evol. 31, 539-549. doi: 10.1016/j.tree.2016.03.006.
PubMed Abstract|CrossRef Full Text|Google Scholar
Shukla, S. P., Sanders, J. G., Byrne, M. J., and Pierce, N. E. (2016). ダンゴムシの腸内細菌叢は、成虫と幼虫の食性特殊化に対応している。モル. Ecol. 25, 6092-6106. doi: 10.1111/mec.13901.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sonawane, M. S., Chaudhary, R. D., Shouche, Y. S., and Sayyed, R. Z. (2018). 昆虫の腸内細菌:シデロフォア生産のための新しいソース。Proc. Natl. Acad. Sci. India Sect. B Biol. Sci. 88, 567-572. doi: 10.1007/s40011-016-0785-0
クロスレフフルテキスト|Google Scholar
Thiyonila, B., Paulin Reneeta, N., Kannan, M., Shantkriti, S., and Krishnan, M. (2018). ダンゴムシの腸内微生物:宿主システムにおける多様性、代謝および免疫に関連する役割。Int. J. Sci. Innov. 1, 84-91.
グーグル スカラー
Tyler, H. L., and Triplett, E. W. (2008). 有益な細菌および/またはヒト病原性細菌の生息地としての植物。Annu. Rev. Phytopathol. 46, 53-73. doi: 10.1146/annurev.phyto.011708.103102.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Tyndale-Biscoe, M. (1984). Copris diversus Waterhouse (Coleoptera: Scarabaeidae) のブルードケアに関する適応的意義。Bull. Entomol. Res.74、453-461、doi: 10.1017/S0007485300015704
クロスレフフルテキスト|Google Scholar
Wang, X., Gao, Q., Wang, W., Wang, X., Lei, C., and Zhu, F. (2018). シナチュウカイミバエChrysomya megacephalaのライフステージを超えた腸内細菌。BMC Microbiol. 18:131. doi: 10.1186/s12866-018-1272-y
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang, Y., Gilbreath, T. M., Kukutla, P., Yan, G., and Xu, J. (2011). ケニアにおけるマラリア蚊Anopheles gambiaeの生活史に渡るダイナミックな腸内細菌叢。PLoS One 6:e24767. doi: 10.1371/journal.pone.0024767.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang, Y., and Rozen, D. E. (2017). 埋没性甲虫Nicrophorus vespilloidesにおける腸内細菌叢のコロニー形成と伝播の発達過程を通して。Appl. Environ. Microbiol. 83, 1-13.
グーグル スカラー
Warnes, G. R., Bolker, B., Bonebakker, L., Gentleman, R., Liaw, W. H. A., Lumley, T., et al. (2016).gplots: データをプロットするための様々な R プログラミングツール。バージョン3.0.1. オンラインで入手可能: https://CRAN.R-project.org/package=gplots (accessed September 12, 2019).
グーグル・スカラー
Zhang, M., Liu, N., Qian, C., Wang, Q., Long, Y., et al. (2014). 菌類を生育する高等シロアリの腸内細菌叢の系統的・機能的解析(Phylogenetic and functional analysis of gut microbiota of a fungus-growing higher termite): 高等シロアリ由来のバクテロイデーテスは、β-グルコシダーゼ遺伝子の豊富な供給源である。Microb. Ecol. 68, 416-425. doi: 10.1007/s00248-014-0388-3
PubMed Abstract|CrossRef Full Text|Google Scholar
キーワード:糞虫、腸内細菌叢、発達段階、PICRUSt2解析、KOs
引用元:日本経済新聞 Suárez-Moo P, Cruz-Rosales M, Ibarra-Laclette E, Desgarennes D, Huerta C and Lamelas A (2020) Dung Beetle Copris incertus Say (Coleoptera, Scarabaeidae) の発生段階における腸内微生物群の多様性と構成. Front. Microbiol. 11:1698. doi: 10.3389/fmicb.2020.01698.
Received(受理)された: 21 May 2020; Accepted: 29 June 2020;
発行:2020年7月24日。
編集者
ジョージ・ツィアミス(パトラス大学、ギリシャ
レビューした人
アゲリキ・サリダキ、クレタ工科大学、ギリシャ
Jean-Pierre Lumaret, Université Paul Valéry Montpellier III, France (フランス)
Copyright © 2020 Suárez-Moo、Cruz-Rosales、Ibarra-Laclette、Desgarennes、HuertaおよびLamelas. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、学術的に認められた慣例に従って、他のフォーラムでの使用、配布、複製が許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Carmen Huerta, carmen.huerta@inecol.mx; Araceli Lamelas, araceli.lamelas@inecol.mx
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
土壌環境が外来型カブトムシPopillia japonica Newmanの幼虫の腸内原核生物群集に影響を及ぼす
ヘレナ・アビラ=アリアス、マイケル・E・シャーフ、ロナルド・F・ターコ、ダグラス・S・リッチモンド
異なるリグノセルロース系飼料がコットンボルゾウムシ(Anthonomus grandis)の腸内細菌叢および加水分解酵素活性に及ぼす影響
エミリアーノ・ベン・ゲレーロ、マルセロ・ソリア、リカルド・サルバドール、ハビエル・A・セハ=ナバロ、エレオノーラ・カンポス、エオイン・L・ブロディ、パオラ・タリヤ
埋没性甲虫Nicrophorus vespilloidesの腸内における抗生物質産生善玉菌の存在
フィリップ・ハイゼ、ヤン・リュウ、トーマス・デゲンコルブ、ハイコ・フォーゲル、ティル F. シェーベル、アンドレアス・ヴィルチンスカス
甲虫の宿主と植物環境間におけるゲノム侵食の有無による細菌共生体の伝播
ユルゲン・C.Wierz, Paul Gaube, Dagmar Klebsch, Martin Kaltenpoth, Laura V. Flórez
論説 新しいエマルジョンシステム: 栄養素のバイオアベイラビリティと健康的な食生活を向上させるソリューション
Aimin Shi、Hongzhi Liu、Jin-Rong Zhou、Benu Adhikari、Dominic Agyei
この記事が気に入ったらサポートをしてみませんか?
