
炭酸飲料のいろは
突然ですが皆さんは、炭酸飲料はお好きですか?
お好きだという方は、それらがどのように作られているかご存知ですか?
最近は家庭でも簡単に作れる炭酸水メーカーなんてものが市販されていますので、そんなの常識だよという方が大半かもしれませんが…
本記事では炭酸飲料の原理を科学的な視点で見てみようと思います。
@有識者
以下、特に断りが無い場合は、気体といったら完全気体のことを指していると解釈してください。話を簡単にするのもそうなのですが、完全気体であると仮定することで、今までに勉強してきた内容と直感的に結びつくことがあると期待してのモデル化です。ご了承ください。尚、どうしてもここは勘違いしてほしくない、というところで完全気体を考えると言うことがあります。しつこく感じられる方も多いと思いますが、こちらもご勘弁ください。
純度の高い二酸化炭素の集め方
義務教育を受けたことがある方ならば恐らく一度は、炭酸飲料には何が溶けているのかを耳にしたことがあると思うのですが、いかがでしょうか?
そうですね、二酸化炭素(CO₂)です。
大気に多く含まれるガスTOP5にランクインしていますね。もっとも、約0.3‰(‰はパーミルと読みます。0.03%と同じです)で第4位…
上位の窒素(N₂)と酸素(O₂)が、4:1程の割合で残りを占めています。
二酸化炭素は大気全体で見ると1%に満たないのですね。
さて、話を徐々に炭酸飲料のシュワシュワに寄せていきたいと思います。
炭酸飲料の規格を見てみると分かるのですが、私たちが必死にストローで水に対してぶくぶく息を吐き出したとしても(そもそもシュワシュワしないというのは置いておいて…)、出来た水を炭酸水とは呼んではいけないとのことです。
ここで注目してほしいのは、如何に高い純度の二酸化炭素の精製を行えているのかというところです。
炭酸ガスの元には主に、工場で出る二酸化炭素(副生ガス)を利用します。
工業的にものを作る過程で二酸化炭素は必ずといっていいほど発生しますが、それらは総じて、先程見たように他の大気中の多くのガスに混じってしまったりするために、純度はそれほど高くなりません。そこで
純度の高い炭酸ガス(二酸化炭素のことです)を得るためには、その他の多くのガスを選り分ける必要が出てくる
のですが一体全体、どのようにしているのでしょうか。もっとも、工業的レベルの話をしても実感は湧かないでしょうから、実験室レベルでの話をしましょう。
これを考えるためには、炭酸ガスを科学的に考えられるようにならなくてはなりませんので、以下に二酸化炭素の科学的特徴と、それを活かした集め方を記そうと思います。
・比重が大きい(空気よりも重い)👉下方置換
・水に溶けにくい(or溶けない)👉水上置換
義務教育を受けた方ならば、〇〇置換という単語を一度は聞いたことがあるはずですので、スルーしますね。
比重、という言葉はもしかしたら聞いたことがないかもしれません。これは、一口で言えば密度の比のことです。
比の計算には、大体は水(H₂O)や空気の密度を基準に持ってきて、注目している物質の密度がその基準の何倍なのかを考えてあげます。水の密度は1cm³あたり1g、空気の密度は22.4Lあたり28.8gとなっています。
(※厳密には、空気に関しては物質量というものを持ってきて、1molあたり何グラムなのかを考えます。更に、標準状態と呼ばれる状態においては、1molの「気体は」22.4Lに対応します)
👆なぜ、密度の代わりに、個数の単位を持ってくるのかについてですが、
(※molが個数を表すことについては、後で詳説を与えます。)
それは、一般の液体や固体は蒸発したり凝固したりしなければその体積は不変(と見做せる)だからです。
☜これは、厳密には状態図を見てくれれば分かります。凝縮したりして液体になってしまうと、ちょびっとの体積変化でも加えなくてはならない圧力の増加量は馬鹿にならないほど増えますので、容易には体積を小さくできなくなります。
直感的には注射器に詰めた水を手で圧縮しようとしても無理だという感じです。
(以下、「化学」の内容を含みます。厳密な話はいいって人は飛ばしてね。)
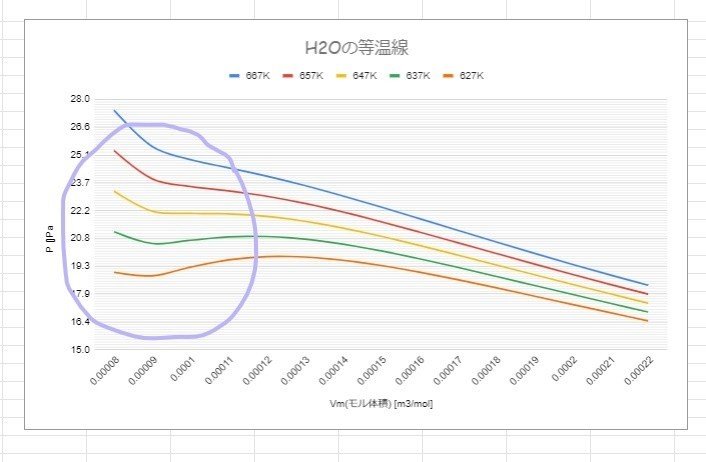
以下に示すのは等温線。等温ではBoyleの法則が成り立ちますので、皆さんは圧力と体積の積(PV)が一定となることを知っています。ですから、低温になって凝縮が起こり体積が縮む(Vが小さくなる)と、Pは大きくなります。
例えば、PVは25で一定という条件下で、
Vが10から9に変化したときと、1から0.9に変化したときのPの変化量(ΔPと名前を付けましょう)を計算してみると…どうなりますか?
(Vが10→9のとき)ΔP=2.5|V=10 - 2.78|V=9 = -0.28
(V=1→0.9のとき)ΔP=25|V=10 - 27.8|V=0.9 = -2.78
体積が大きい(Vが10から9に変化した)ときよりも、小さい(Vが1から0.9に変化した)ときの方がΔPは10倍も大きいですね。簡単に言えばこういうことです。
(「化学」おしまい)
水の密度については、皆さんが今すぐにでも知ることができます。
試しにビーカーを持ってきて500mL(=500cm³)量りとってください。そしてそれをはかりに乗せて重さ(※厳密には質量と呼ばれるものになります)を量ると、大体500gになると思います。
この場合、皆さんは水の密度は1g/cm³(1グラムパー立法センチメートルと読みます)だと知ったことになります。
しかし、空気についてはそうはいきません。
仮に空気入れを使って空気をぴったり1L分ビニル袋に詰めたとして、はかりに乗せたとしてもなんだか正しく重さが量れているのか不安ですよね(この説明は無理矢理感がありますが…)。
そこで先程ちらりと出したmolという科学特有の考え方を持ってきます。これは義務教育の範囲を逸脱しますので知らないという方もいらっしゃることでしょう。
簡単に言えば、英語のダース(dozen)と考え方の根幹は一緒です。ただ12個で1ダースではなく、
6.02×10²³個という莫大な数で1mol
とすることがルールです。
また体積との相関については、簡素なイメージとしては、部屋の中に段ボールを隙間なく入れていくのと同じ要領です。
体積112Lの部屋に体積3.721×10^(-18)Lの段ボールは最大で30.1×10¹⁸個入れられますから、平均して22.4L(112Lの五分の一)あたりには6.02×10²³個の段ボールが詰まっていることが計算できると思います。
これをミクロな世界での議論に持っていくと、
(標準状態という特別視した状態においては)分子の種類に依らずどんな気体についても22.4Lの容器の中に6.02×10²³個のものがピッタリと収まる
ということができます。ここまでが、上述の内容の補足になります。
ちなみに、どうしてこのような関係が成り立つのかについては状態方程式を勉強すると分かります。
この関係が気体についてのみ成り立つことを再三強調しましたが、その理由はpV=nRTという気体の状態を記述する方程式を利用することで論理的に導いた関係だからです。
計算式だけ書いておくと、次の通りです。
空気が1molあたり約28.8gであることは、実は冒頭の大気中のガスの組成の知識で導くことが出来てしまいます。
空気は80%がN₂(28g/mol)、20%がO₂(32g/mol)とざっくりと考えてしまえば(※これくらいの雑さでも値は大体一致しますのでご安心を👍)、1molあたり28.8(=28×0.8+32×0.2)gと計算できます。
冒頭で4:1ほどの比率と言っていたのを思い出していただくと、あれは80%:20%のことを指しているのです。
同じようにして二酸化炭素の1molあたり何グラムかを考えると、分子式がCO₂で、1molあたりCは12g、Oは16gと見做せるので、CO₂は1molあたり44g(=12+2×16)と計算できますね。
以上のことを踏まえて二酸化炭素の比重を計算してみますとと、およそ1.5(=44/28.8)ですね。
先だって比重は比だと申し上げましたから、
・比重が1よりも大きい👉重い
・比重が1よりも小さい👉軽い
というざっくりとした比較をすることが出来てしまいます。
少し付け加えておくと、二酸化炭素の比重1.5が意味するのは、同体積においてCO₂ガスの重さは空気(主にN₂とO₂の混合気体)の1.5倍だということです。これはつまるところは、CO₂ガスが重いということです。
こうして比重を考えることによって、二酸化炭素は空気よりも重いと自信を持って言えるようになりました。
重いということは、周りの空気を押しやってどんどん下へ下へと落ちていくことになります。
イメージとしては、水の中に鉄球を入れる感じです。鉄球は水よりも重いです(事実、鉄球の比重は1よりも大きいです)から、底の方へとずぶずぶと沈んでいきますよね。
それと同じ原理で、容器の下の方から徐々に上の方に二酸化炭素は溜まっていくことになります。
それに合わせてもともとあった気体はどんどん上に押し上げられますから、実験室では下方置換という方法が好まれるのですね。
しかし二酸化炭素は無色無臭なので、下方置換では二酸化炭素がどれくらい溜まったのかを直接見ることが出来ず不便なのは事実です。
二酸化炭素が水に溶けにくいという性質を利用して、水上置換に切り替えると、容器の中に溜まった気体は全て二酸化炭素ですからとても便利ですね。
水がどんどん容器の外へと二酸化炭素によって押し出されていきますから、溜まった量も見易くて良いです。
というように、二通りの置換方法がありますが、このような理由で水上置換が選ばれます。
二酸化炭素が水に溶けにくいのはなぜ?ということについても、せっかくなので触れておきましょう。
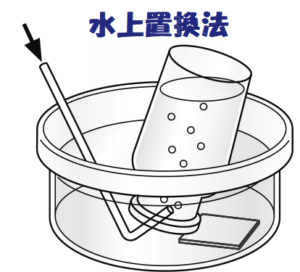
二酸化炭素CO₂の分子構造を見てみると、これはCを中心とした左右対称の直鎖状(O=C=O)になっています。このおかげで、CO₂分子は無極性分子と呼ばれます。
一方で水は極性分子と呼ばれ、H₂Oの構造内で電荷(+,−)を均等に分け合うことが出来ていない状態です。
イオンなどはそもそもが電荷の均等な分け合いを諦めていますから、水分子とは均等に分け合えていなかった者同士の相性が良く、近づきあってなかなか離れようとしなくなります(これを、水和と言います)。
一方で電荷を均等に分け合っているものは均等に分け合っている者同士で仲良く近づき合います。
今回は二酸化炭素と水の相性を考えてみるのですが、二酸化炭素は均等に分け合った分子、水は均等に分け合っていない分子なのでCO₂分子は残念ながら水和することが出来ません。
これをマクロな視点から見ると、二酸化炭素は水に溶けない(or溶けにくい)という結論を運んでくるのです。
もっとも「なぜCO₂分子は直線なんだ、それならH₂OもH-O-Hで直線じゃないか!」と仰りたい方もおられるかもしれませんが、この記事ではこれ以上の脱線はご勘弁…その話は、また別の機会に譲ります。
(※参考までに、分子の図👇。図中のδが極性と呼ばれるものです。)
二酸化炭素が水に溶ける世界
二酸化炭素は水と相性が悪いということを、前節で述べました。
ですが、炭酸飲料には二酸化炭素が溶けている…
はて、これはどういうことなのでしょうか。これが本節で扱う内容です。
先ず、中学までで習う「溶けない」というのは、私たちが普段過ごしている環境では溶けない(とみなせる)、という意味です。その点では、溶けにくいという表現はなかなかに的を射ていますね。
ですから、今いる環境からはかけ離れた環境を作り出してあげれば、二酸化炭素でも水に溶ける世界を生み出せます。
具体的には、二酸化炭素の入った容器の温度を下げたり加える圧力を大気圧(1bar=1.013×10⁵Pa)よりも大きくしてやるという二つのやり方が主流です。
それぞれ詳しく見てみましょう。
①高圧
容器にかける圧力を増大させるには、簡単には注射器のようなピストンのついた容器をイメージしてください。
何もしなければその状態では容器には大気圧と同じ圧力がかかっています。
ここで私たちがピストンを押し込むと、容器にかかる圧力は大気圧よりも大きくなります。
こうしてかかる圧力を大きくすると(ピストンを押し込むと)、容器の体積は小さくなってしまいますね―いわゆる圧縮ですが、このとき何が起こっているのかをミクロな視点で見てみましょう。
水の表面をズームアップすると、CO₂分子が盛んに水面に衝突します。
その衝突具合は、ピストンを押し込む前よりも激しくなっています。
それは端的に言えば、圧縮による体積の減少によって気体分子が動き回ることのできる空間が狭まったことで、CO₂分子が水面に衝突する頻度が相対的に増えたからです。
(少し脱線)**********************************************************************
これをきちんと理論化したのが、Henryの法則になります。
気になる人は調べてみてほしいのですが、一つの表現としては、
温度一定、溶媒の量が変化しないという条件下で、溶媒に溶ける気体の量はその気体に加える圧力に比例する
という書き方があります。他の表現は、御自分で調べてみてください。
**********************************************************************************
ここで勘違いしてほしくないのは、移動できる空間が小さくなったからと言って、その気体のスピードが速くなるわけではないということです。
ですから、気体の水面にぶつかるスピードが大きくなって(※スピードが速くなる、という言い方は科学では些か不自然な響きを持ちます)それで水面にめりこんだんじゃないのか、と考えるのは些か早計です。
これはCO₂分子を完全気体と呼ばれる仮想的な気体と考えると分かるのですが、分子の運動する速さは、温度にのみ依存します(かっこよく言えば温度の関数、つまりv(T)と書けます)。
以下の式がその根拠なのですが、これ自体は統計力学という分野でMaxwell-Boltzmannの分布を考えることで得られるものなので、ここでは詳しく触れません。
詳しいことは量子力学に丸投げ!(私もそこまで勉強が進んでないので、進んだら加筆するかもしれません。)
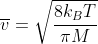
※現実の気体では、壁に衝突することで力学的エネルギーを熱として失ったり、分子間の相互作用でポテンシャルエネルギーが変化したりするため、話は複雑になります。
②低温
さきほど①でお話した通り、温度を変化させるとそれが分子の速さに直接の影響を与えます。
紹介した式を見てもらうと…
[1]温度Tが小さくなるほど、√の中の式の値は小さくなります
[2]すると、√を含めた値も小さくなります
[3]結果として、等式で結ばれた分子の(平均)速さも小さくなります
ここで一見すると、
CO₂分子が水面に衝突する頻度が相対的に減少しますから、①の真逆で二酸化炭素分子は水に溶けにくくなっているじゃないか!と思われるかもしれませんが
ちょっと待って!
では、既に溶けている二酸化炭素分子についてはどう思いますか?
①では触れなかったので後出しじゃんけんみたいで申し訳ないのですが、実は低温であることが溶けやすさに関係するのは、既に水中に入ったCO₂分子の挙動に関係するからです。
水中に入ったといってもCO₂分子は気体状態を保っていますから、別に先ほど紹介した分子の速さの式を用いることに抵抗は覚えないと思います。
(※液体の中に入ることで粘流性は増していますからそこら辺をしっかり考えるとなるとまた七面倒くさいことになるので、ここではそこら辺は無視してください)
温度が下がるにつれて分子の速さはどんどん小さくなりますから、分子が水中から水面に衝突する頻度は少なくなります。
これが溶けやすさアップの基本原理です。
以上①、②をまとめると、
①高圧になることで空気中のCO₂分子が水面に衝突する機会が増え
👉水中に入り込みやすくなる
②低温になることで水中のCO₂分子が水面に衝突する機会が減る
👉気相(容器の中で液体ではない領域)に出ていきにくくなる
ことで、低温高圧下でのCO₂の水への溶けやすさのアップが図られているのです。
無限に炭酸ガスを溶かして超シュワシュワにできるか
水に砂糖や塩をドバっと入れてしまったとき、必死にかき混ぜて全て溶かそうと苦労した経験は誰にでもあるはずです。それは大概は徒労に終わってしまいます。
必ず容器の水の下の方に、溶け残った砂糖や塩が溶け切らずに溜まってしまいますよね。
これは、水にはその量ごとに溶かすことのできる最大量か決まっているからなのです。
飽和食塩水という言葉を聞いたことはありませんか?
―義務教育を受けた方なら理科の時間に一度は耳にしたワードなはず。
そうですね、もうこれ以上は溶けないという限界まで塩を溶かしてみた水のことです。
この溶ける上限というのは、何も砂糖や塩といった固体だけではなくて、ガス(気体)についても存在していることはさほど驚くことではないでしょう。
といっても、二酸化炭素に限って言えば無色ですから、どれくらい溶けたのかよく分かりませんね。
そのときの溶解度の目安として用いられるのが、蒸気圧と呼ばれるものです。
蒸気圧と言っても「飽和蒸気圧」という特別な圧力を考えます。
これは先程と同じで、限界まで炭酸ガスを水の中に溶かしこんだとき、容器内のCO₂ガスの示す圧力のことです。
そのとき、二酸化炭素について、次の「(気液)平衡」と呼ばれる状態が成り立っています。
CO₂(気)⇄CO₂(液)
(気)というのは気相(容器内の水が入っていない部分)、(液)というのは液相(容器内の水の部分)にそれぞれCO₂分子がいますよ、という意味です。
つまり気液平衡というのは、CO₂分子が気相から液相へと溶け込む速度と液相から気相へと飛び出す速度が一致した状態のことを指す言葉です。
従って、気相を出入りするCO₂分子の数には総じて変化が無いことになりますから、圧力だって大きく変化するはずがありませんよね。
これが飽和水蒸気圧が一定であることの直感的な理解になると思います。
もっとも、これは少々難しい話なので完全に理解する必要はありません。
ですが、ある温度においてCO₂が水に溶ける量には限度があって、そのときに計られる圧力は(ほぼ)一定だということだけは頭の片隅に入れておくと良いでしょう。
(以下、完全に脱線)
※物理化学の観点から踏み込んだ話をすると、飽和水蒸気圧はvan der Waalsの状態方程式の圧力と(モル)体積のグラフの気液平衡が生じている部分に対して、Maxwellの構成法と呼ばれるテクニックを用いて直線を引っ張ることで可視化することが出来ますので、興味のある人は合わせて調べてみてください。
ちなみに水についての気液平衡はいわゆる沸騰と深い関わり合いがあるのですが、それはまた別の機会にお話することにしましょう。お楽しみに♪
げっぷ
ここで少し小話を挟みましょう。
皆さんは炭酸飲料を飲むと、お腹が膨れたり、げっぷをしたくなりますよね。
炭酸飲料を飲むことで出るげっぷは炭酸ガスが原因です。
またこの炭酸ガスがお腹の中に溜まっているうちはなんだかお腹が膨れたように感じます。
同じように胃カメラを通す時に呑まされる炭酸バリウムでげっぷが出るのも同じく炭酸ガスです。
溜まった炭酸ガスは、げっぷとして放出されることもあれば、血液中に溶け込んで肺に運ばれる等して体外へと出ていきます。
おうちでしゅわしゅわを作る方法の提案
クエン酸と重曹(炭酸水素ナトリウム)から、お手軽にしゅわしゅわを生み出すことが出来ます。
手順自体はクックパッドなりを参照してもらうとして、ここではどうしてこの手順でしゅわしゅわするのかを考えてみたいと思います。
中学までの理科で基礎的な化学反応式の書き方は習っているはずなのですが、簡単におさらいしておきましょうか。
![]()
例えば、こんな式はどうでしょうか。式の左側にあるH₂O₂というのは過酸化水素という分子です。
これは「過マンガン酸カリウムを触媒として起こる」などと教わった記憶がある方も多いのではないでしょうか。
実験室レベルで酸素を生成したかったらこの方法が有名でしょうか。
注意してほしいのは、式中の「→」は厳密には正しくなく、先程の気液平衡のところで見たように「⇄」で結ばれます。
どんな化学反応も「⇄」で結ばれるのですが、反応することで出来る物質が特異的な場合には「→」と見做す、という暗黙の了解があることだけは忘れないでください。
今回のしゅわしゅわ作りに利用する化学反応も、この特殊な場合に分類されます。
反応させて積極的にCO₂を生成することで、水にCO₂を封じ込めていくのです。
その気になる具体的な化学式は次のようになります。
C₆H₈O₇というのはクエン酸の分子式、C₆H₅O₇(Na)₃というのはクエン酸ナトリウムのイオン式です。
![]()
式の右側に何やら見慣れない記号「↑」がありますね。
これは、H₂CO₃という分子は反応で生成されるとその反応系から出ていってしまいますよ、ということを私たちに分かり易く示してくれるサインです。
同様の発想で、「↓」も存在します。
これらのサインは、先程からちらほらと述べていた特殊な場合に該当する化学反応になります。
このときには、「⇄」ではなく「→」を書き記すのみで許されます。
それは、H₂CO₃と、反応系に再び戻ってこないという「↑」の記号との間に深い関わりがあるからです。
H₂CO₃が生成してはどこかに行ってしまうせいで、「←」の反応を起こそうにも起こせない状況が出来上がってしまっているんです。
これが、特殊な場合の基本原理です。
逆反応を起こせなくなるような事情を生み出すことで「→」記法を許容させるに至ったのです。
このH₂CO₃のように比較的弱い酸が生成される反応は一般に、弱酸遊離反応と呼ばれます。
尚、H₂CO₃はH₂OとCO₂に分解します。これは逐次反応と呼ばれ、H₂CO₃が生成すると半自動的にH₂OとCO₂へと分解されます。これについても「←」の反応は起こりません。
まぁ細かい話は置いておいて、クエン酸と重曹を冷水に溶かすと炭酸ガスが発生するというわけです。
水中で発生した二酸化炭素の気泡は、水が低温であればあるほど抜けにくいのは以前の節でお話した通りです。
炭酸が抜け切った後の炭酸飲料を甘く感じるワケ
ただの炭酸水を飲んでみて、なんだか辛い(酸っぱい)と感じたことはありませんか。
それは、炭酸水に溶けている炭酸ガスによって炭酸水の液性が酸性に偏っていることに起因します。
もっと厳密に言えば口の中でも同じことが起こるので、その刺激を辛さとして認識していると言えます。
![]()
![]()
それは、上の二つの式のようにH₂CO₃やHCO₃-が(ブレンステッド)酸として働くことで、炭酸水のpH(ペーハーやピーエッチと読みます。pHが7よりも小さいほど酸性に寄っています)が7より小さくなります(たしか、6.3とかそれくらいだった気がします)。
―pHというとリトマス試験紙を思い出すのは私だけではないはず……。
酸性(pHが7より小さい)だと酸っぱく感じる例として、他に有名どころにはお酢(酢酸)があります。
あれに関しては炭酸水よりもずっとpHは小さい値になりますので、炭酸水とは比べ物にならないほどに酸っぱいと分かります。
pHの話はこれくらいにしておきましょう。
始めはキンッキンに冷えていた炭酸水も、やがては常温になります。
そうすると、冷水のときには溶けていた炭酸ガスが溶け切れなくなって(※飽和蒸気圧の温度との関係を参照してください)、気相へと出て行ってしまいます。
それに伴って、水中に酸がいなくなることで液性は中性(pH=7)へと戻っていきます。
甘く感じるのは、炭酸ガスの刺激が無くなって残った甘味料のせいです。
氷を入れると、炭酸の抜けが早くなった気がする
子どもならぬるいコーラ、大人ならぬるいビールが、どれほど美味しくないかご存知でしょう。
しゅわしゅわの刺激を求めていたのに、ただの味の付いた水という悲惨な思いはしたくないはず!
そこで皆さんがすることと言えば、そう―氷を入れることですね。
氷を入れることで、キンキンに!

ですが、なんだか気になることはありませんか。
氷を入れることで、氷の周囲で異様にしゅわしゅわし出しませんか?
あれは一体全体、なんなのでしょうか?
大変ガッカリなのですが、氷を入れることでその周囲の炭酸ガスの抜けが早まります…
これは、簡潔に言えば衝撃が原因です。
もともと、だいぶ無理した環境(低温・高圧)で炭酸ガスは水に溶かされていますから、だいぶ不安定な状態にあります。
低温・高圧の極限状態のおかげで辛うじて、溶けたままを保っているわけです。
ですから、外部から予想外の刺激が与えられると、そのかりそめの安定はあっけなく崩されてしまいます。
その例が、炭酸飲料に氷を入れる、というものなのです。

氷の場合には特に、周囲が気体になるとそこが気化のコアとなってしまいます。
コアとなると、そこで一旦状態変化が起こるとそこを中心として、あたかも堰を切ったかのように状態変化が盛んに行われます。
「過冷却」という現象について、このコアの考え方を使える面白い話があるので、気になった方は調べてみてください。
炭酸飲料の容器の工夫
皆さん誰しもが、炭酸飲料の入ったペットボトルを見たことはありますよね。
Quiz
①ペットボトルの底は、どんな形でしたか?
②ペットボトルの側面の硬さはどうでしたか?
考えてみてください。
**********************************************************************************
Answer
①不思議な突起が付いている
②硬い
大体は、これと同じ回答になったと思います。
まず②に関しては簡単ですが、今までの知識を総動員すれば答えられると思いますので、ヒントを差し上げましょう。
硬いと、ペットボトルの強度が上がりますよね。ということは……?
**********************************************************************************
そうですね、ペットボトル内の高圧に耐えられるようにするためですね。
ペットボトル内がなぜ高圧かって?
―それは、今までの記事をもう一度読み返してくださいね☆
少し脱線すると、自販機で炭酸飲料を買ったときの話なのですが、自販機から出てきたペットボトルがやけにパンパンなことはありませんか。
あれは、自販機内から出てくるときに外からの衝撃で炭酸がいくらか抜けて、容器の中の気相の圧力が上がったからです。
つい先程の氷の例と同じギミックですよ。
また、そういうパンパンのペットボトルのキャップを取ると、プシュッ!という気持ち良い音がしますね。
あれは、高圧だった容器内から元気良くガスが飛び出した音です。
①については、別に底面に限った話ではなく、お茶が入ったペットボトルの側面の凹凸にも共通するのですが、
こういった凸凹があることで、圧力を分散させられる
という効果を期待しています。
凸凹があると、その分だけ表面積が増えますよね。
これは小腸の絨毛(じゅう毛)や、肺の肺胞と同じ考え方です。
ちょっと、ここで圧力の求め方を復習しておきましょう。
ある面積Sに対して、Fという大きさの力が掛かるとしましょう。このとき、そのエリアに掛かる圧力Pは、次の式で計算できたはずです。
![]()
この式を基に、なぜ圧力が分散させられるのかについて考えてみましょう。
凸凹があることで表面積が増える、というところまでは説明しましたね。
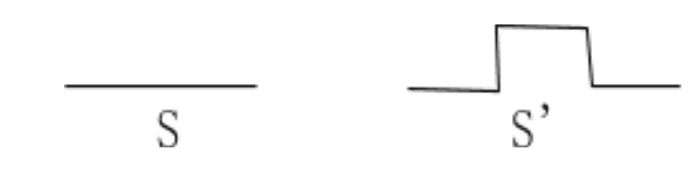
上のように、凸凹を簡単にして考えてみましょう。
まず、左の方にかかる圧力Pについては
![]()
次に、右の方にかかる圧力P'については
![]()
です。
凸凹がある方が表面積は大きいのですから、S<S'。ということから1/S>1/S'であることは、説明なしに使いますよ。
すると、P>P'であることが分かりますね。
元は同じエリアで、掛かる力の大きさも同じだけれども、凸凹ができることによって掛かる圧力は小さくなったわけです。
容器を振ってから開けると、吹き出すのはなぜ?
シェイクする(振る)のも、刺激を与える手段のひとつです。
刺激を与えると炭酸ガスはたくさん抜けていくのですから、振ることによってもたくさんの炭酸ガスが一斉に気相へと出ていきます(これを炭酸が抜けるというわけですね)。
気相へと炭酸ガスが出ていくと、ペットボトルの水ではない部分(気相)に掛かる圧力は上昇しますね。
圧力の差が吸引力の原理だという話を知らないなんてありえませんよね?もし知らなければ死んでますからね( )
これさえ知っていれば、もう察せられるのではないでしょうか。
振りまくることで、もともとは液相にあったガスが相当な量、気相にやってきますから、気相は超高圧になっていると考えられます。
それをいきなりプシュッと開放してやるわけですから、その吸引力はすさまじいでしょうね。
噴出します。アンモニアの噴水実験なんか、原理の直感的理解に役立つのではないでしょうか?
あれは、アンモニアが水に溶けることで、丸底フラスコ内の圧力が真空(大気圧よりも低い圧力)になることを利用していましたよね。
メントスコーラ(メントスガイザー)
折角なので調べてみましたが、振りまくって大惨事になるのと似た感じのようです(?)。
ちなみに、ガイザーというのは「湧き出すもの」みたいな意味らしい。
メントスを入れることで、炭酸ガスが急激に気化して…気泡となってプシューって感じらしいです。
まとめ
さて、途中色々と脱線しながら炭酸飲料(主に炭酸水を扱いましたが…)についてその特徴を見てきましたが、面白かったでしょうか。
私なりに、炭酸飲料についての現象を理屈で理解できるように書いたつもりですが…しかし、
説明としてどこまで踏み込むか悩んだ箇所もありましたし、私の方で知識が若干曖昧な部分もあって説明が薄くなってしまった箇所もあった気がします。
この先、加筆等で内容のアップデートを行っていきたい所存ですので、何か気になる点などございましたら、コメントしてくださると嬉しいです。
最後まで読んでくださり、ありがとうございました!
この記事が気に入ったらサポートをしてみませんか?
