”うつ診断→2型糖尿病”では認められないが、”2型糖尿病→うつ診断”ではHbA1c変動大きい
結果の”うつ診断→2型糖尿病”では認められないが、”2型糖尿病→うつ診断”ではHbA1c変動大きいという報告をどう考えるかが問題
縦断的研究でMDDとT2Dの診断の相対的なタイミングと経時的なHbA1cの傾向の関係は検討という意味で重要
MDDとT2Dの併存は、糖尿病合併症のリスク上昇3や自殺リスクの上昇など、より予後不良な疾患と関連し、ライフスタイル要因、T2D治療の非遵守、抗うつ薬の使用、遺伝的要因などが考えられる。MDDとT2Dの診断の相対的なタイミングもT2Dの臨床特性に影響を与える可能性があり、T2D後にうつ病と診断された場合、うつ病がない、あるいは既往のあるT2D患者と比較して、血糖コントロール不良や糖尿病合併症の有病率が高くなるとされている
Gillett, Alexandra C, Saskia P Hagenaars, Francesco Casanova, Katherine G Young, Harry Green, Cathryn M Lewis, and Jess Tyrrell. The Impact of Major Depressive Disorder on Glycaemic Control in Type 2 Diabetes: A Cohort Study Using UK Biobank Primary Care Records. Preprint. Endocrinology (including Diabetes Mellitus and Metabolic Disease), January 13, 2022. Accessed May 4, 2023.
http://medrxiv.org/lookup/doi/10.1101/2022.01.13.22269229.
【背景】 本研究は、2型糖尿病(T2D)患者における血糖コントロール(糖化ヘマグロビン(HbA1c)値の平均値および患者内変動)と大うつ病性障害(MDD)の縦断的関連性を評価するものである。
【方法】 UK Biobank(UKB)において、T2Dは自己申告、リンクされたプライマリケア記録、処方記録、病院エピソード統計を用いて定義され、その後、多遺伝子スコアを用いて検証されました。プライマリケア記録とUKBバイオマーカーのベースライン値からHbA1cの反復測定を抽出し、混合効果モデルのアウトカムとして使用し、最大10年間のT2D疾患期間にわたるMDDと血糖コントロールとの関連を調査した。調査した曝露はMDDで、MDDとT2D診断の相対的な時期によってサブグループを定義した(MDDなし、MDD診断がT2D前、T2D後)。
多重置換(n=9264)および完全症例(n=4233)解析が行われた。
【結果】 T2D診断基準は、T2D多遺伝子スコアと強固に関連していた。
混合効果モデルと多重置換(追跡期間中央値7.6年)を用いると、平均HbA1cの時間的傾向はMDDサブグループによって差はなかった。
T2D後にMDDと診断されたUKB参加者のHbA1cの患者内変動は、MDDと診断されなかった参加者に比べて1.14倍(95%CI:1.12-1.16)であった。完全症例解析の結果は異なるが、欠測が完全にランダムであることに対する実質的な証拠があることから、完全症例解析にはバイアスがかかると考えられる。
【結論】 これらの知見は、T2D診断後にMDDを発症した個人において、T2Dコントロールを改善するためのより緊密なモニタリングが重要であることを示唆している。さらに、本研究は、欠損データを正しく考慮することの重要性を強調している。
【www.DeepL.com/Translator(無料版)で翻訳しました。】
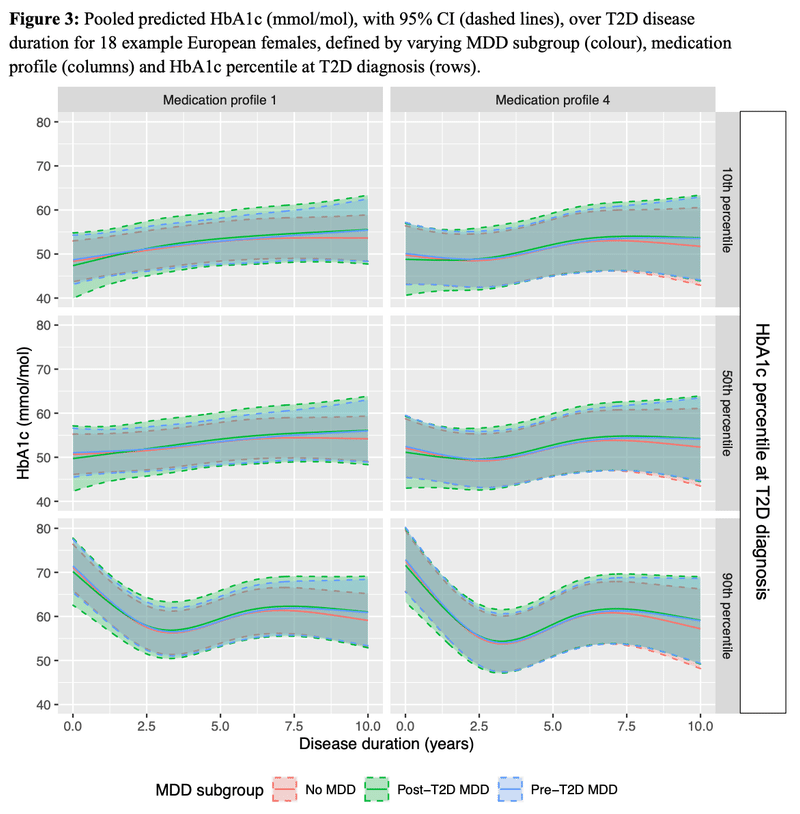
Medication profile 4 = monotherapy prescribed at baseline, monotherapy prescribed during follow-up, no additional T2D medications prescribed.
Covariates held constant: sex = female, genetic ancestry = European, year of birth = 1947, year of diagnosis = 2008, age at T2D diagnosis = 61, assessment centre = 11010
【研究デザイン】
研究グループは、2006年から2020年の期間に40~69歳の英国居住者を前向きに登録したUK Biobankのデータを分析した。
研究グループは、以下の基準のうち少なくとも2つを満たすことに基づいて、2型糖尿病である個人を特定した: (1)2型糖尿病の診断コードが記録されている、(2)A1c値が6.5%以上である、(3)グルコース低下薬が処方されている、(4)35歳以降に2型糖尿病の診断を自己申告している。これらの基準を満たさない人は、2型糖尿病でないとみなされ、コントロールとして含めることができた。
また、医療記録に2回以上MDDと診断された履歴があることから、MDDの被験者を特定した。対象者を、MDDを伴わない糖尿病、糖尿病診断前にMDDと診断された者、糖尿病診断後にMDDと診断された者の3群に分類した。
【主な結果】
縦断的解析サンプルは、2型糖尿病の適格患者9264名で、中央値で7.6年間追跡された: 82%がMDDなし、13%が糖尿病診断前にMDDと診断された、5%が糖尿病診断後にMDDと診断された。
A1cの患者内変動は、臨床的うつ病のない2型糖尿病患者に比べて、2型糖尿病と診断された後にMDDと診断された患者では14%高く、その差は有意であった。
解析の結果、最初に2型糖尿病と診断される前に臨床的うつ病と診断された患者では、A1cの経時的変動は有意に増加しなかった。
平均A1cの経時的な変化は、MDDの状態に基づく3つの患者群すべてで同様であった。
【制限事項】
本研究は、プライマリケア医への定期的な訪問時に行われたA1c測定に一部依存しているが、MDDの発症により、一部の被験者ではこのスケジュールが変更され、A1c値の記録が少なくなった可能性がある。
これはレトロスペクティブな観察研究であり、交絡因子が結果に影響を与えた可能性がある。
A1cの多くの測定値と2型糖尿病の多くの診断が欠落しているようである。
被験者が最初にMDDの診断を受けた年齢の妥当性は不明である。
この記事が気に入ったらサポートをしてみませんか?
