
食事の免疫系への影響:ビーガン、ケトジェニック食
食事の免疫系への影響:ビーガン、ケトジェニック食
Ketogenicだと、Treg,CD16+NKs増加
Veganだと、CD561high・CD16low増加
CD56^highCD16^lowは、NK細胞の特定のサブセットを示します。CD56^highCD16^low NK細胞は、CD56とCD16の発現レベルに基づいて、CD56^highCD16^+/-、CD56^lowCD16^high、およびCD56^lowCD16^lowの3つの異なるサブセットに分類されます[4]。これらのサブセットは、免疫応答において重要な役割を果たし、特に多発性骨髄腫細胞の認識と殺傷において重要な役割を果たすことが示されています[5]。NK細胞の中でも、CD56^lowCD16^low NK細胞は骨髄内でより豊富であり、DNAM-1やNKp30の発現が低く、多発性骨髄腫細胞に対して主要な細胞傷害活性を持ちます[5]。このサブセットは、自家移植後に多発性骨髄腫患者で早期に拡大し、多機能性を示すことが報告されています[5]。
Citations:
[1] https://niigata-u.repo.nii.ac.jp/record/19367/files/108%285%29_358-366.pdf
[2] https://pubmed.ncbi.nlm.nih.gov/36585877/
[3] https://www.researchgate.net/figure/CD56-low-CD16-low-NK-cell-chemokine-receptor-and-adhesion-molecules-profile-after-a-b_fig2_319047362
[4] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4380722 /[5] https://www.mdpi.com/2072-6694/10/12/473CD16+NK細胞は、CD16という表面分子を発現する自然キラー細胞(NK細胞)を指します。CD16は、NK細胞の活性化後に抗体でコーティングされた細胞を認識する際に重要なシグナルを提供し、NK細胞が直接的な殺傷やサイトカインの産生を通じて標的を排除するのに役立ちます[4]。NK細胞はCD56という細胞表面マーカーを発現し、CD3のT細胞受容体を欠いていることで定義されます。CD16は、主にCD56dim末梢血中のほぼすべてのNK細胞に存在しています[4]。NK細胞の活性化によってCD16の表面発現が減少することがあり、これはADAM17というメタロプロテアーゼによって調節されています[4]。ADAM17の過剰活性化はNK細胞の効果機能に悪影響を及ぼす可能性があり、CD16の剥離を防ぐためにADAM17を標的とすることが重要であることが示唆されています[4]。Citations:[1] https://niigata-u.repo.nii.ac.jp/record/19367/files/108%285%29_358-366.pdf[2] https://pubmed.ncbi.nlm.nih.gov/36585877/[3] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4380722 /[4] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3643761 /[5] https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-022-02661-1 Treg(Regulatory T)細胞は、免疫応答を抑制し、自己免疫を防ぎ、慢性炎症を制限するために重要な役割を果たす細胞です[1][2][3]。Treg細胞は、T細胞の特殊なサブポピュレーションであり、T細胞の増殖やサイトカインの産生を抑制することで自己免疫反応を抑制します[3]。これらの細胞は通常、FoxP3という特異的なマーカーで識別され、CD25^high(高分子密度)およびCD127^low(低分子密度)などの表面マーカーが一般的に使用されます[3]。Treg細胞の頻度や機能の異常は自己免疫疾患の発症に関連しており、Tregの調節はアレルギーや移植物拒絶などの特定の障害の治療法として有望視されています[3]。Treg細胞は、免疫応答においてバランスを保ち、健康な免疫系の機能をサポートする重要な役割を果たしています[4]。Citations:[1] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10154599 /[2] https://en.wikipedia.org/wiki/Regulatory_T_cell[3] https://pubmed.ncbi.nlm.nih.gov/20672742/[4] https://www.sciencedirect.com/topics/immunology-and-microbiology/regulatory-t-cell[5] https://niigata-u.repo.nii.ac.jp/record/19367/files/108%285%29_358-366.pdf
Link, Verena M., Poorani Subramanian, Foo Cheung, Kyu Lee Han, Apollo Stacy, Liang Chi, Brian A. Sellers, ほか. 「Differential peripheral immune signatures elicited by vegan versus ketogenic diets in humans」. Nature Medicine 30, no. 2 (2024年2月1日): 560–72. https://doi.org/10.1038/s41591-023-02761-2 .
栄養は、すべての生理的プロセスに幅広い影響を与えます。しかし、栄養が人間の免疫にどのように影響するかは、主に未知のままです。
各参加者が2週間ずつビーガンまたはケトジェニックダイエットを順次摂取した臨床試験(NCT03878108)の事後分析を行い、食事介入が免疫と微生物叢の両方に与える影響を探りました。
多次元フローサイトメトリー、トランスクリプトーム、プロテオーム、メタボローム、メタゲノムのデータセットを含むマルチオミクスアプローチを使用して、各ダイエットおよび食事の切り替えが宿主の免疫と微生物叢に与える影響を評価しました。
体として、ケトジェニックダイエットは適応免疫系に関連する経路の顕著なアップレギュレーションと、それに関連する細胞の濃縮と関連していることを明らかにしました。
対照的に、ビーガンダイエットは、抗ウイルス免疫に関連する経路のアップレギュレーションを含む、先天的免疫系に顕著な影響を与えました。
両方のダイエットは、微生物叢および宿主関連アミノ酸代謝にも顕著かつ異なる影響を与え、
ケトジェニックダイエット後のほとんどの微生物経路の強いダウンレギュレーションを、
ベースラインおよびビーガンダイエットと比較して示しました。
参加者の多様性にもかかわらず、アミノ酸、脂質、免疫系に関連する化合物によって駆動されるデータセット間の密接に連携したネットワークも観察しました。
総合的に、この研究は、多様な参加者において2週間の管理された食事介入が宿主の免疫に顕著かつ異なる影響を与えるのに十分であり、精密な栄養介入に対する意味合いを持つ可能性があることを示しています。ClinicalTrials.govの登録:NCT03878108。
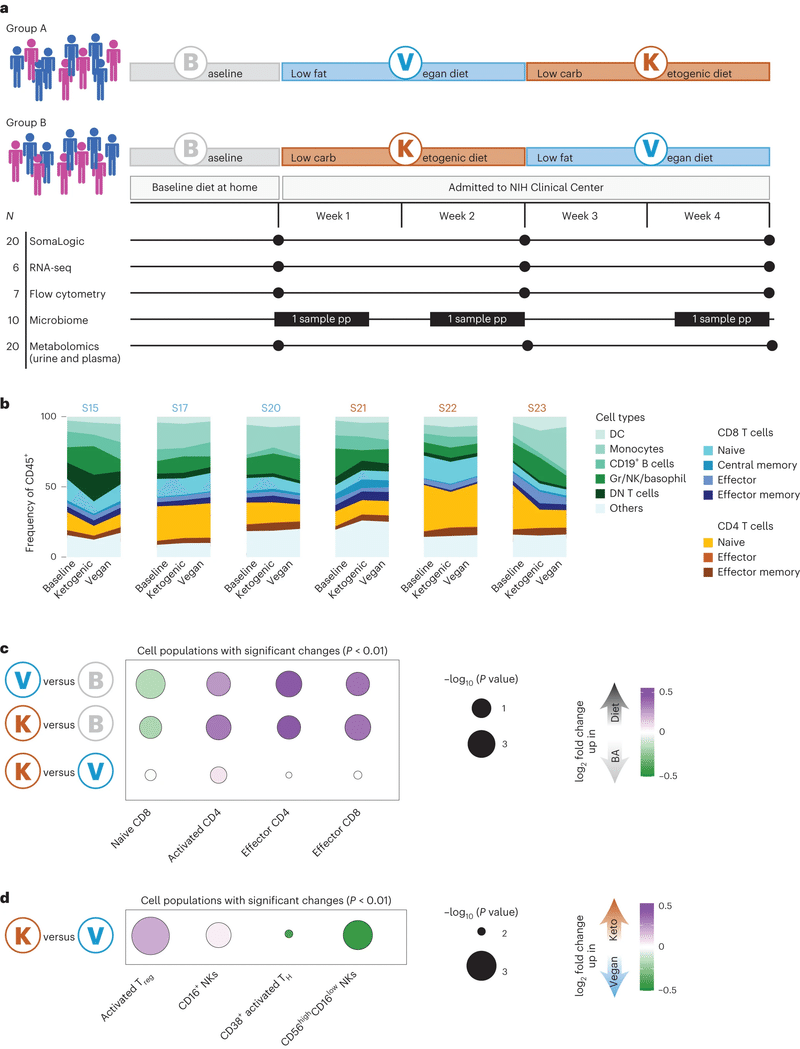
b, 基準値、ケトジェニックダイエット、ビーガンダイエットのためにフローサイトメトリーで測定された主要な細胞タイプの頻度(すべてのCD45+生細胞の頻度として)が、各参加者について示されています。フローサイトメトリーのゲーティング戦略については、拡張データテーブル1および拡張データ図2を参照してください。このパネルに記載されているダイエットの順序は、最初のダイエットに関係なくすべての参加者について同じです。プロットの上の個人の色は、開始ダイエットを示します(オレンジ、ケトジェニックダイエット;青、ビーガンダイエット)。
c, ケトジェニック/ビーガンダイエットと基準ダイエットの間で頻度が有意に変化した細胞集団の倍増変化(P値<0.01)(紫、ビーガン/ケトジェニックダイエットでアップレギュレート;緑、基準ダイエットでアップレギュレート)。ドットは-log10(P値)によってスケーリングされます。有意性は両側対応ありt検定によって計算されました。
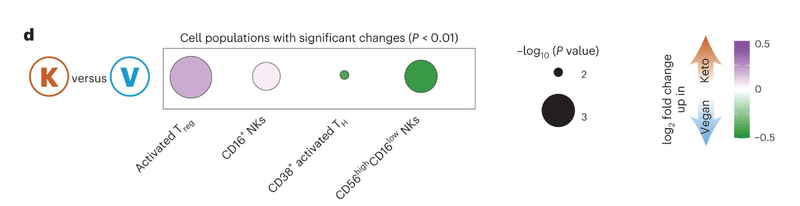
d, ケトジェニックとビーガンダイエットの間で頻度が有意に変化した細胞集団の倍増変化(P値<0.01)(紫、ケトジェニックダイエットでアップレギュレート;緑、ビーガンダイエットでアップレギュレート)。ドットは-log10(P値)によってスケーリングされます。
有意性は両側対応ありt検定によって計算されました。
ゲーティング戦略については、拡張データ図2および参考文献37を参照してください。レギュラトリーT(Treg)細胞、CD127低CD25高CCR4+HLA-DR+;CD16+ NK細胞、CD3−CD19−CD14−HLA-DR−CD123−CD56+CD16+;活性化Tヘルパー(TH)細胞、CD3+CD19−CD4+CD8−HLA-DR+CD38+;活性化NK細胞、CD3−CD19 −CD14−HLA-DR−CD123−CD56+CD16低CD57高。BA、基準;DC、樹状細胞;DN、ダブルネガティブ;Gr、顆粒球;pp、一人当たり;S、サンプル。
食事摂取量の基準値は食事アンケート(拡張データ図1j)の助けを借りて推定されました。このコホートに基づく以前の報告では、ケトジェニックダイエットを消費する参加者のケトン体が増加し、ビーガンダイエットの参加者がケトジェニックダイエットの参加者と比較して著しく少ないカロリーを消費していることが示されました。血液サンプルは複数の時間点で採取され、細胞集団の構成はフローサイトメトリー(n=7)、遺伝子発現は一括RNAシーケンシング(RNA-seq)(n=6)、タンパク質構成はSomaLogic(n=20)を通じて評価されました。便サンプルは微生物叢のメタゲノミクスシーケンシング(n=10)(拡張データ図1k)のために採取され、血液と尿の両方でメタボロミクス分析が行われました。サンプルの利用可能性のため、すべての参加者に対してすべてのアッセイを実施することはできませんでした。
まず、フローサイトメトリー(拡張データ図1l、2、拡張データテーブル1、2および参考文献26)を通じて末梢血単核細胞(PBMCs)の細胞構成を評価しました。PBMC分析は中性球を除くすべての主要な免疫細胞タイプに焦点を当てました。予想通り、参加者間で基準値での高い変動性が観察されました(例えば、ナイーブCD4 T細胞の頻度は全CD45+細胞の5%からほぼ25%まで変動しました)。
特に、食事の変更自体が、食事の順序に関係なく、ナイーブCD8 T細胞のレベルの有意な減少と、活性化CD4 T細胞、効果的CD4 T細胞、効果的CD8 T細胞のレベルの有意な増加を含む、有意な変化を引き起こしました(ケトジェニック/ビーガン対基準ダイエット)。これらの変化がダイエットのシフトから生じたのか、または標準的な西洋式ダイエットでしばしば表される加工食品の急激な消費減少から生じたのかは明らかではありませんが、将来の調査の対象となります。
食事の順序に関係なく、各ダイエットの消費に続くいくつかの独特な変化も観察されました。例えば、ケトジェニックダイエットに比べてビーガンダイエット後に活性化レギュラトリーT細胞とCD16+ナチュラルキラー(NK)細胞の頻度の有意な増加が観察されました。さらに、ビーガンダイエットに比べてケトジェニックダイエット後では活性化Tヘルパー細胞と活性化NK細胞の頻度の有意な増加が観察されました。したがって、食事の変化自体は宿主の免疫システムに有意な影響を与えました。さらに、ケトジェニックダイエットとビーガンダイエットの両方がリンパ組織の構成と活性化状態に独自の変化をもたらしました。
ビーガンとケトジェニックのダイエットは、免疫システムに異なる影響を与える。
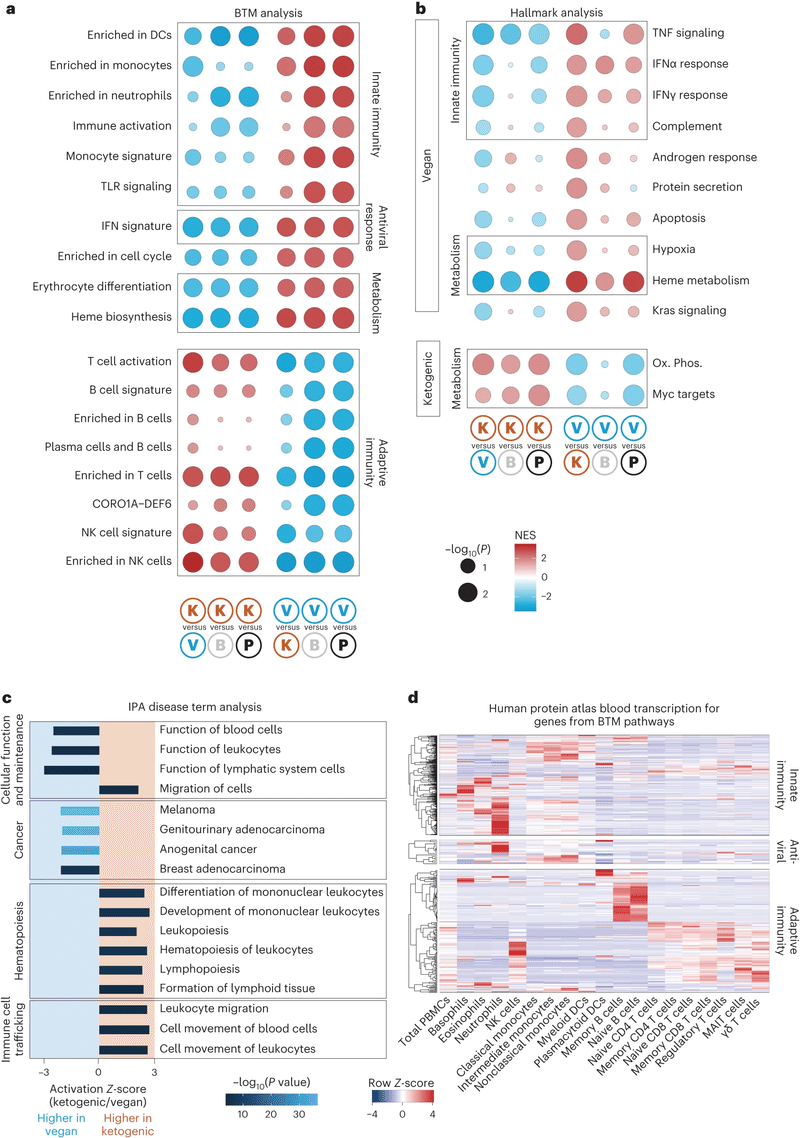
全血の一括RNAシーケンシングで、ダイエットによる転写物の発現に著しい違いが観察された。
主成分分析は、参加者間の違いとダイエット間の違いの両方を捉えた。
ケトジェニックダイエットは適応免疫経路のアップレギュレーションと関連し、T細胞の活性化やB細胞とプラズマ細胞、NK細胞の増加が見られた。
ビーガンダイエットは先天性免疫経路と抗ウイルス反応のアップレギュレーションと関連していた。
ダイエットによる内因性レトロウイルス(ERV)の発現の変化が観察され、個々のダイエット後に特有のERVがアップレギュレートされた。
ビーガンダイエットではケトジェニックダイエットよりも鉄の摂取量が多く、赤血球分化やヘム生合成と代謝のアップレギュレーションが見られた。
病気の状態とダイエット関連のシグネチャーを関連付ける試みとして、ビーガンダイエット後に赤血球関連経路の増加、ケトジェニックダイエット後にリンパ球増殖が増加することが確認された。
ケトジェニックダイエットががん治療と併用する場合に有益である可能性がある一方で、ビーガンダイエットががんに与える影響については研究が公開されていない。
ビーガンダイエット後の先天性免疫のアップレギュレーションは主に好中球によって、ケトジェニックダイエット後の適応免疫のアップレギュレーションはB細胞とT細胞によって駆動されると予測された。
全体として、ダイエットは免疫システムに対して異なる効果を示し、ケトジェニックダイエットは適応免疫のシグネチャーを、ビーガンダイエットは先天性免疫のシグネチャーを強化する。
プロテオソームとの関連
SomaLogicを用いて、全20名の参加者の血漿から約1,300種類のタンパク質の豊富さを基準時とケトジェニックまたはビーガンダイエット後に測定した。
線形混合効果モデル(LME)を適用した結果、異なるグループの参加者間でビーガンとケトジェニックダイエットのタンパク質の豊富さに有意な差は見られなかった(P = 0.5624)。
分散分析(ANOVA)により、ダイエット間で顕著に影響を受けたタンパク質の一部が明らかになった。特に、ケトジェニックダイエットはタンパク質の豊富さに最大の影響を与えた(基準対ケトジェニックで107; ビーガン対ケトジェニックで137)、一方で基準とビーガンダイエット間ではわずかなタンパク質のみが顕著に変化した(21)。
ダイエットの順序は、差異のあるタンパク質の変化の方向や大きさに影響を与えなかった。
異なる開始ダイエットの参加者のデータにANOVAを適用しても、ダイエットによって顕著に影響を受けた追加のタンパク質は明らかにならず、ダイエットの順序がタンパク質の豊富さに及ぼす効果に影響を与えないことが確認された。
ケトジェニックダイエットは、血液、脳、骨髄など複数の組織から由来すると予測されるタンパク質に影響を与える一方で、ビーガンダイエットも含め、両方のダイエットは肝臓と二次リンパ器官から由来すると予測されるタンパク質に影響を及ぼした。
機能的な濃縮分析では、STRINGを用いて全タンパク質の倍増変化に基づき実施され、トランスクリプトーム解析から得られた結果と一致して、ビーガンダイエットに続くヘム代謝の顕著な濃縮が観察された。
基準ダイエットとケトジェニックダイエットを比較した際、インスリンシグナル経路の濃縮も観察された。
PCAはダイエットによる分離を示さなかったが、ケトジェニックダイエットに続いて顕著な変化を示した女性参加者のみが外れ値として現れ、ダイエットへの反応性に性差がある可能性を強調した。
ダイエット間での性別特有のタンパク質の豊富さの違いには、グルコース代謝および免疫に関連するタンパク質が含まれていた。
プロテオミクスデータの解析は、ケトジェニックダイエットが研究参加者のプロテオームに最も強い影響を与える可能性があることを示し、ビーガンダイエットがヘム代謝を促進し、ダイエットへの反応の大きさに性別特有の違いがあるという考えを支持した。
ケトジェニックダイエットは微生物のアミノ酸代謝をダウンレギュレート
参加者ごとのダイエット間で微生物叢の多様性(アルファ多様性)に有意な違いはなかったが、ケトジェニックダイエットとビーガンダイエット間での微生物叢の組成には有意な違い(ベータ多様性)があり、ケトジェニックダイエット消費後の微生物叢の組成のシフトが示された。
ファイラ解析は、基準と比較してケトジェニック/ビーガンダイエット間で顕著な変化を示したが、ケトジェニックとビーガンダイエットを比較した際の違いはわずかだった。
ケトジェニックとビーガンダイエット間の種の豊富さの変化は、主にアクチノバクテリア、バクテロイデス、フィルミクテス、プロテオバクテリアで観察され、フィルミクテスが最も影響を受けた門だった。
ケトジェニックダイエットは、基準およびビーガンダイエットと比較して、微生物遺伝子の豊富さの大幅なダウンレギュレーションをもたらし、多くの経路のダウンレギュレーションが観察された。
ケトジェニックダイエットによるアミノ酸代謝の減少は、ケトジェニックダイエットに含まれるアミノ酸の豊富さが高いため、宿主が微生物由来のアミノ酸に依存する必要が少なくなる結果かもしれない。
機能的変化のドライバーを特定するため、データセットで評価された全酵素および食事介入後に顕著に影響を受けた経路の一部である酵素を産生する主要な属を特定した。
代謝物分析は、ダイエットが宿主の代謝にどのように影響を与えるかについての洞察を提供し、プラズマ代謝物データは、全参加者をダイエットによって分離し、ケトジェニックとビーガンダイエットプロファイルの間に基準代謝物プロファイルが直接クラスタリングされた。
総合的に、代謝物分析は、トランスクリプトームやプロテオミクスデータよりも直接的にダイエットの宿主への影響を読み取ることができ、食事介入への宿主反応のメカニスティックな規制を理解するためのより良いデータセットかもしれない。
ダイエットは宿主のアミノ酸代謝と脂質に影響を与える。
全参加者の血漿と尿に対して標的メタボロミクス分析を実施し、プラズマメタボロミクスデータから生成されたPCAは、ダイエットによって全参加者を分離した。
血中では、ビーガンとケトジェニックダイエット間で185の代謝物(ビーガンでアップレギュレートされた54、ケトジェニックでアップレギュレートされた131)が顕著に変化し、脂質が最も影響を受けた。
機能的な洞察を得るために、血中サンプルからの機能的濃縮分析を実施し、ケトジェニックとビーガンの両ダイエットがアミノ酸生合成経路のアップレギュレーションと関連していることが示された。
ケトジェニックダイエットでは、バリン、ロイシン、イソロイシンの生合成および分解経路が顕著にアップレギュレートされた。
ケトジェニックダイエットでは多くの脂質が豊富であり、特に飽和および不飽和脂肪酸の含有量が高かったが、血中では飽和脂肪酸を含む脂質が豊富だった。
ビーガンダイエットは不飽和脂肪酸を含む脂質を顕著にアップレギュレートした。
酵素、代謝物、タンパク質間の相関に特に焦点を当て、高い相関のエリアを観察し、データセット間の密接に接続されたネットワークを明らかにした。
このネットワークは、アミノ酸、脂質、免疫関連因子に主に駆動されていた。
序文要約
栄養は、免疫システムを含むすべての生理的プロセスに影響を及ぼし、栄養と宿主免疫との間のリンクは、がんや慢性炎症性疾患など様々な病態において治療的栄養介入を開発する重要な機会を提供します。低脂肪のビーガンまたはベジタリアンダイエットは炎症の減少、心血管疾患のリスク減少、全体的な死亡率の減少と関連している一方、高脂肪で非常に低炭水化物のダイエット(一般的にケトジェニックダイエットと呼ばれる)は、特定のタイプのてんかんにおける症状の減少や神経炎症の軽減と関連しています。しかし、栄養介入の予防的および治療的な可能性にもかかわらず、栄養が人間の免疫にどのように影響を与えるかはほとんど分かっていません。
栄養は、燃料の量と質だけでなく微生物叢を通じても宿主の生理に影響を与えることができます。微生物叢は、宿主の回復力を促進すると信じられている方法でその機能を再構成し、変化させる能力を持っています。したがって、栄養は微生物叢の構成と機能を形成する上で主導的な役割を果たします。微生物叢と栄養の間の接続は実験モデルで明確に確立されていますが、このような共生の二項関係が人間の免疫にどのように影響を与えるかはほとんど探究されていません。
栄養介入が人間の免疫システムに与える影響に関するデータの不足に加え、以前の研究は一度に1つのダイエットに対する反応を探究してきました。栄養介入に対する個人の反応の高い変動性と多数のダイエットが消費されることを踏まえ、個人が異なるダイエットにどのように反応するかを解明することは重要な研究分野です。厳密に設計された臨床介入がない限り、栄養を利用して人間の健康を形成することは継続的な課題となります。
ここでは、参加者が2週間ごとに異なるダイエットを順番に消費する高度に管理された臨床環境で、食事介入が免疫と微生物叢の両方に与える影響を探りました。私たちの知る限り、この研究はケトジェニックおよびビーガンダイエットが人間に与える影響を調査する最初のマルチオミクス研究です。総合的に、私たちの結果は宿主の免疫と微生物叢の顕著な改造を示し、ケトジェニックダイエットとビーガンダイエットの異なる影響を明らかにしました。この研究から得られた洞察は、病気の予防と治療のための食事ベースの治療オプションの理解を改善する可能性があります。
この記事が気に入ったらサポートをしてみませんか?
