ARDS:シグナル伝達経路と治療ターゲットの可能性
ARDS:シグナル伝達経路と治療ターゲットの可能性
Huang, Qianrui, Yue Le, Shusheng LiとYi Bian. 「Signaling pathways and potential therapeutic targets in acute respiratory distress syndrome (ARDS)」. Respiratory Research 25, no. 1 (2024年1月13日): 30. https://doi.org/10.1186/s12931-024-02678-5 .
日本語訳 written with Copilot
ARDS(急性呼吸窮迫症候群)は、非心原性肺水腫による難治性低酸素血症を伴う、重症患者に関連する一般的な疾患です。世界中で新型コロナウイルス感染症が流行している現在、ARDSの死亡率が相応に増加しています。ARDSの病態生理と基礎的な分子メカニズムを理解することは、有効な治療戦略を開発し、死亡率を低下させるために不可欠です。このレビューでは、ARDSの病態生理から分子メカニズムまで包括的な情報を提供し、ターゲットとなる治療法を提示して、病態の理解と新しい治療法の探求を促進します。まず、病態生理学における炎症の不均衡、肺胞毛細血管障壁の機能不全、肺胞液排出の障害、酸化ストレスに関連するARDSの病因と病態生理を説明します。次に、ARDS病態生理の上記4つの側面に関連する分子メカニズムとシグナル伝達経路を、最新の研究進展とともにまとめます。最後に、薬理療法、マイクロRNA療法、間葉系幹細胞療法など、ARDSで有望な治療戦略を紹介し、その病態生理学的基盤とシグナル伝達経路への影響を強調します。
病態生理学における炎症の不均衡、肺胞毛細血管障壁の機能不全、肺胞液排出の障害、酸化ストレスに関連するARDSの病因と病態生理
written with ChatGPT4
「ARDS(急性呼吸窮迫症候群)の病態生理と病因」
正常な肺は酸素の移動と二酸化炭素の排出を促進する機能を持ち、これは肺胞-毛細血管ユニットによって確立されている。肺胞上皮は、ガス交換を可能にする緊密なバリアを形成する肺胞型I細胞と、表面張力を減少させ肺胞を開いた状態に保つための界面活性剤を産生する肺胞型II細胞で構成されている。これらの細胞は肺水腫液を吸収し、浮腫の解消に寄与する。肺胞の正常な構成には、宿主防御を提供する肺胞マクロファージも含まれる。
ARDSの病態生理的表現は、原因疾患に関わらず非常に類似している。これらの症候群は、肺胞-毛細血管バリアの機能不全、AFC(肺胞液クリアランス)の障害、および制御されていない急性炎症反応による酸化的損傷を反映している。
過剰な炎症
急性肺損傷(ALI)は、初期には炎症によって引き起こされ、肺内の様々な細胞タイプによって放出される炎症性サイトカインとケモカインの複雑な相互作用によって媒介される。この効果は、炎症の増幅と肺損傷の悪化をさらに引き起こす。好中球はARDSの病因において重要な役割を果たしている。好中球の活性化は、持続的な炎症と肺胞-毛細血管バリアの損傷を引き起こす。
肺内部のARDSとは異なり、間接的要因によって引き起こされる炎症性損傷は、全身の部分から始まり肺胞部分に広がる。循環する刺激物によって引き起こされる肺内皮の活性化は、免疫細胞の接着と浸潤を促進する炎症性分子を産生し、血管炎症と肺胞損傷をさらに引き起こす。
肺は他の臓器と異なり、微生物病原体、汚染物質、ほこりなど様々な環境的挑戦に常にさらされている。肺内皮細胞も循環する炎症成分、ホルモン、外毒素、内毒素にさらされ、局所的および全身的な炎症反応と相互作用する。肺胞上皮、肺内皮、および免疫系内のクロストークは、肺における物理的バリアと免疫恒常性を構成する。ARDS中の免疫調節の伝統的な説明は、免疫の区画化反応の認識によって挑戦されている。
内皮および上皮の透過性
別の核心的な病態生理的変化は、肺内皮と肺胞上皮の2つの別々のバリアの透過性の増加である。免疫応答の乱れにより、細胞間接合の破壊、内皮細胞死、およびグリコカリックスの剥離によって内皮バリアの障害が生じる。肺胞上皮のバリア機能の破壊も、細胞間接合の解離と肺胞上皮細胞死に関与する。
肺胞液クリアランス
肺胞浮腫液の吸収不全は、ARDSにおける死亡率の増加に大きく寄与する。しかし、ARDS患者では、炎症性サイトカインの上昇による上皮損傷により、これらの輸送システムと機能が障害される。
酸化ストレスと肺損傷
酸化ストレスは、反応性酸素種(ROS)の産生により、ARDSの進行と肺損傷において重要な役割を果たす。炎症刺激に応答して、肺内の様々な細胞タイプがROSを生成する。過剰なROSの産生は、内因性抗酸化物質を圧倒し、酸化的細胞損傷と炎症反応の悪化を引き起こす。

ARDS病態生理の上記4つの側面に関連する分子メカニズムとシグナル伝達経路を、最新の研究進展とともにまとめ
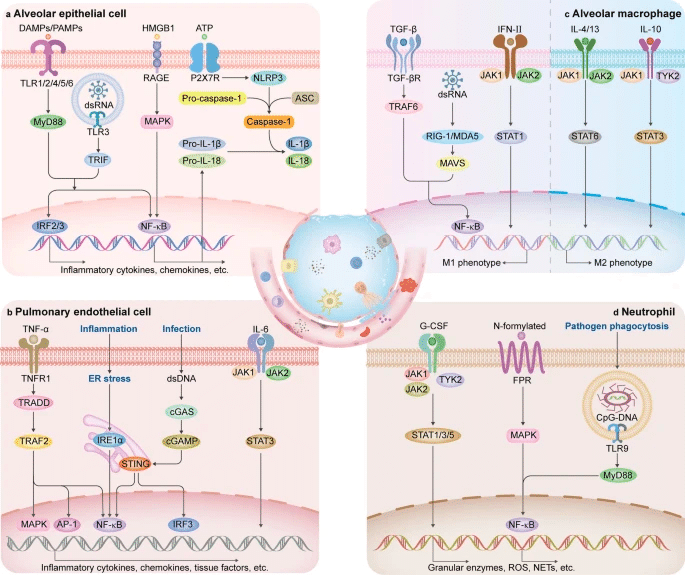
a. 肺胞上皮細胞(AEC)の活性化におけるシグナル伝達経路で、炎症の増加につながる。 b. 肺内皮細胞におけるシグナル伝達経路で、炎症と凝固を促進する。 c. マクロファージ分化の調節におけるシグナル伝達経路。破線の左側の領域は肺胞マクロファージ(AM)がM1表現型を示すことを促進し、破線の右側の領域はM2分化を促進する。 d. 好中球の活性化におけるシグナル伝達経路。
AP-1, activator protein-1; ASC, apoptosis-associated speck-like protein containing a CARD; cGAMP, cyclic dinucleotide cyclic GMP-AMP; cGAS, cyclic GMP-AMP synthase; DAMPs, damage-associated molecular patterns; dsRNA, double-stranded RNA; ER, endoplasmic reticulum; FPR, N-formyl peptide receptor; G-CSF, granulocyte colony-stimulating factor; HMGB1, high-mobility group box 1; IRE1α, inositol requiring kinase 1α; IRF, interferon regulatory factor; JAK, janus kinase; MAPK, mitogen-activated protein kinase; MAVS, mitochondrial antiviral signaling protein; MDA5, melanoma differentiation-associated gene 5; MyD88, myeloid differentiation primary response gene 88; NF-κB, nuclear factor-κB; NLRP3, nucleotide-binding domain leucine-rich repeat protein 3; P2X7R, P2X7 receptor; PAMPs, pathogen-associated molecular patterns; RAGE, receptor for advanced glycation end product; RIG-I, retinoic acid-inducible gene I; STAT, signal transducer and activator of transcription; STING, stimulator of interferon gene; TGF-β, transforming growth factor-β; TGF-βR, transforming growth factor-β receptor; TLR, toll-like receptor; TNFR1, TNF receptor 1; TNF-α, tumor necrosis factor-α; TRADD, TNFR-associated death domain; TRAF, TNFR–associated factor; TRIF, Toll/interleukin-1 receptor-domain-containing adaptor-inducing interferon-β; TYK2, tyrosine kinase 2; IFN, interferon
Signaling pathways related to inflammation
Pattern recognition receptors
NF-κB signaling pathway
Notch signaling pathway
Janus kinase (JAK)/STAT signaling pathway
MAPK signaling pathway
PI3K/AKT signaling pathway
ER stress-mediated signaling pathway
Transforming growth factor-β (TGF-β)/Small mothers against decapentaplegic (Smad) signaling pathway
TNF-α signaling pathway
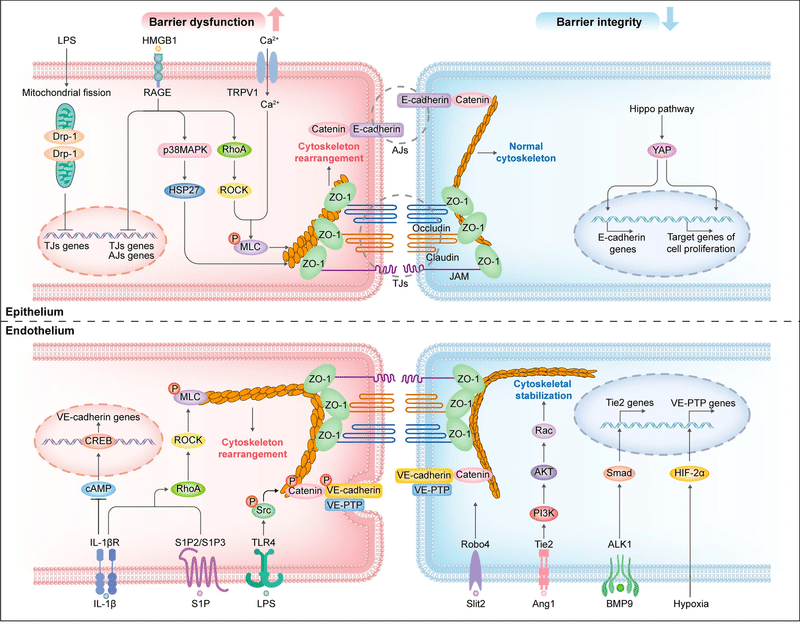
Increased endothelium and epithelium permeability
Alveolar epithelial and pulmonary endothelial cell death
Intercellular junction impairment of epithelium and endothelium
Impaired alveolar fluid clearance
ROS-mediated signaling pathways

AFC, alveolar fluid clearance; AM, alveolar macrophage; AT I, alveolar type I cell; AT II, alveolar type II cell; DC, dendritic cell; IL-1β, interleukin-1β; IL-6, interleukin-6; IL-8, interleukin-8; NETs, neutrophil extracellular traps; PLT, platelet; RBC, red blood cell; ROS, reactive oxygen species; TNF-α, tumor necrosis factor-α
薬理療法、マイクロRNA療法、間葉系幹細胞療法など、ARDSで有望な治療戦略を紹介
Pharmacologic therapies for ARDS
Therapeutic agents potentially targeting anti-inflammation
Therapeutic agents potentially protecting the alveolar-capillary barrier
Therapeutic agents potentially enhancing AFC
Therapeutic agents potentially attenuating oxidative injuries
MicroRNAs in ARDS
Mesenchymal stromal cell therapy
Subphenotypes in ARDS and prospects for targeted therapies
多くの前臨床研究ではARDS(急性呼吸窮迫症候群)の薬理治療が有望であるとされていますが、臨床試験でARDSの死亡率に顕著な影響を示したものはまだありません。これはARDSの異質性に部分的に起因する可能性があります。ARDS患者のより均質なサブグループは、生理学的、臨床的、生物学的特徴に基づいて特定できます。Calfeeらは、臨床的および生物学的特徴を統合して、高い炎症と高い死亡率を特徴とする高炎症サブフェノタイプを特定しました。その後の研究でも同様の結果が報告されています。これらの予後の豊かさは、不良な結果の可能性が高いことを特定し、臨床現場での医療決定に役立つ可能性があります。一方、予測的豊かさは、特定の治療に対して肯定的な反応が高い可能性のある患者の選択や、基礎となるメカニズムや生物学的特徴に基づいて特定の介入から恩恵を受ける可能性が高い患者の特定に役立ちます。予測的豊かさのための生理学的および臨床的フェノタイピングは興味深い発見をもたらしています。例えば、Calfee CSらは、直接的なARDS患者において上皮損傷バイオマーカーの上昇を発見しました。また、一部の研究では、原発性ARDSのラットモデルではリクルートメント操作が効果的でないこと、メチルプレドニゾロンが炎症反応の緩和により効果的であることが示されています。バイオマーカーテストの限られた利用可能性のため、予測的豊かさのための生物学的フェノタイピングを含む事前
ランダム化試験は臨床実践でまれですが、後ろ向き研究では、低炎症および高炎症フェノタイプが介入に対して異なる反応を示すことが示されています。これらの介入には、陽圧呼吸終末圧、液体管理戦略、シンバスタチンなどが含まれます。
低炎症および高炎症フェノタイプはARDSにおける炎症の一般的な特徴付けに過ぎないため、主要なシグナル伝達経路に基づいてより具体的なサブフェノタイプを特定することは価値があります。標的治療のさらなる評価は、治療反応を向上させ、効果的な介入を特定する能力を改善する可能性があります。例えば、Bosらは、「反応性」サブフェノタイプにおいて、プラズマタンパク質バイオマーカーによって特定された酸化的リン酸化遺伝子の発現の上昇を報告しました。著者らは、この経路を標的とする介入のさらなる調査を「反応性」サブフェノタイプの患者に対して提案しています。しかし、Wilson JGらによると、ARDSのフェノタイピングと予測的豊かさのためのメタボロミクス、トランスクリプトミクス、ゲノミクス、シグナル伝達経路の特徴の使用はまだ初期段階にあります。
この記事が気に入ったらサポートをしてみませんか?
