
Co-Localization 3 2.画像処理
2.画像処理
前章(1. 画像撮影)では、蛍光画像には乱れ・歪みが生じることを説明しました。乱れ・歪みは画像撮影時に抑えることが重要であることも説明しました。本章(2. 画像処理)では、画像撮影時に抑えきれなかった画像の乱れ・歪みの補正方法について解説します。補正とは、「画像のズレ補正」・「蛍光のもれこみ補正」・「励起光の照明ムラ補正」のことです。これに加えて、タイムラプスで共局在の時間変化を定量する場合には、蛍光退色(消光)を補正する必要があります。蛍光退色の補正については別の機会で解説します。また、補正以外にも、共局在の定量をする際に必要となる「バックグラウンド減算」・「Threshold(閾値)の決定」についても解説します。
「バックグラウンド減算」
バックグラウンド減算をする目的は2つあります。1つは、共局在の定量を正確におこなうためです。正確な定量には、定量に使う画像が標的分子の蛍光だけからなり、それ以外の余計な蛍光を含んでいない必要があります。もう1つは、蛍光のもれこみ補正や照明ムラ補正といった画像補正を正確におこなうためです。バックグラウンドの蛍光が残っていると補正を正確におこなうことができません。そのため、バックグラウンド減算によって、目的の標的分子の蛍光だけを抽出する必要があります(下図)。
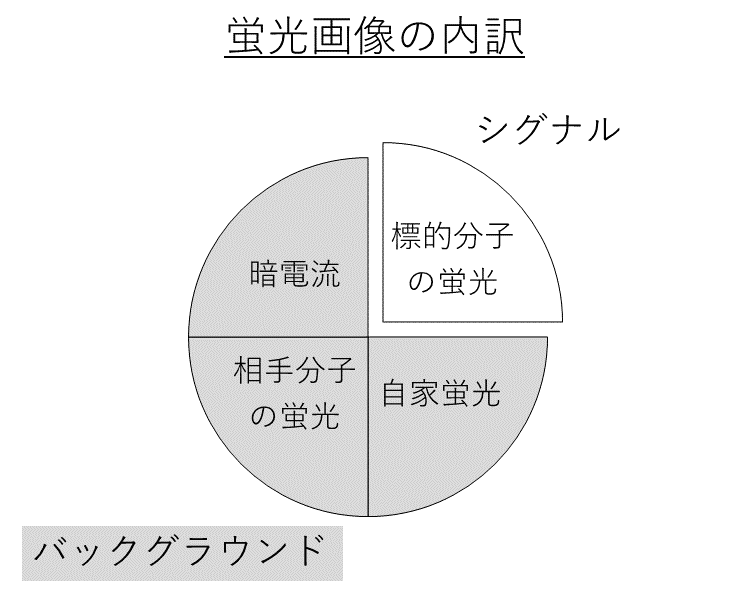
蛍光のバックグラウンドとは、細胞の自家蛍光といった、本来の標的分子(色素)以外の物質に由来する蛍光のことです。蛍光のバックグラウンドは、光学系に由来したものか、それとも実験材料に由来したものかで2つに大別されます。光学系に由来するバックグランドとは、暗電流のことです。CCDやPMTといった蛍光検出器では、蛍光の光子を電子に変換し、電子の量(電流)で蛍光の輝度値を決めています。暗電流とは、光子が存在していないのにもかかわらず、流れている電流のことです。暗電流によって、たとえ蛍光分子が存在しなくても、すべてのピクセルは一定の輝度値を持つことになります。一方、実験材料に由来するバックグラウンドとは、実験材料に含まれる物質が放つ蛍光のことです。フェノールレッドといった培地に由来する蛍光と、NADPHといった細胞を構成する物質に由来する自家蛍光とがあります。
バックグラウンドの推定方法は由来ごとで異なります。光学系由来の暗電流を求めるには、検出器に蛍光が入ってこない状態で画像を撮影します。検出器に蛍光が入ってこない状態とは、例えば、蛍光が、検出器の光路を通るのではなく、目視観察用の光路を通るように、光路を切り替えて画像を撮影するといったことです。培地由来のバックグラウンドは、細胞が存在しない領域の蛍光輝度値から求めることができます。自家蛍光由来のバックグラウンドは、コントロール細胞から推定します。コントロール細胞とは、目的の色素が存在しない細胞、いわゆるmock細胞のことです。
バックグラウンド減算は正確におこなうことができません。バックグラウンドが時間的・空間的にばらつき、正確に推定することが不可能なためです。たとえば、暗電流は、温度といった外的要因の影響を受けるために、撮影のたび(時間ごと)に変わります。また、自家蛍光由来のバックグラウンドも空間ごとにばらつきます。自家蛍光の波長や明るさは、自家蛍光を放つ分子ごとに異なるため、細胞の種類や細胞内小器官ごとに、自家蛍光の明るさが異なるためです。バックグラウンドを正確に推定することができないため、減算の誤差を少しでも小さくし、共局在の定量への影響を抑える必要があります。最も効果的な対策は、バックグラウンドが問題にならないくらいに標的分子の蛍光輝度を高めておくことです。目的の蛍光シグナルをドミナント(支配的)にしておくということです。そうすれば、バックグラウンド減算が不正確でも定量への影響は相対的に小さくできます。標的分子の蛍光輝度を高めるには、「明るい」色素を選ぶことと、色素の「量」を増やすといった方法があります。目的の蛍光シグナルを高くするという対策に対して、バックグラウンドそのものを小さくするという対策もあります。暗電流には温度依存性があるため、検出器を十分に冷却することでその発生を抑えることができます。培地由来のバックグラウンドに対しては、蛍光を発する物質を含まない培地に変更するといった対策が有効です。また、細胞の自家蛍光に対する対策としては、自家蛍光の波長から離れた蛍光色素を選択するといったことが挙げられます。
「画像のズレ補正」
共局在を正確に定量するために、2色の画像のズレ・ボケを補正する必要があります。波長が異なる2色の画像では、位置や大きさにズレが生じてしまうことを1章の対物レンズの種類のところで説明しました。ズレが生じる原因として、軸上色収差・倍率色収差・像面湾曲収差といった蛍光の特性と検出光学系での2色の光路の差がありました。
画像のズレ補正は、多色蛍光ビーズを使っておこなうのが一般的です。多色蛍光ビーズとは、短波長から長波長(青・緑・オレンジ・近赤外)のそれぞれの蛍光色素を直径100 nm程度のビーズに封入したものです。商用では、TetraSpeck™ビーズ (Thermo Fischer)といった顕微鏡用キャリブレーションビーズが市販されています。ズレの補正は、この蛍光ビーズの画像を基準におこないます。まず、蛍光ビーズを均一に撒き、2色の蛍光画像を撮影します。2色のうち片方の蛍光画像を平行移動や拡大・縮小といった変換をし、2色の画像の誤差を計算します。この誤差が最小となるように、移動距離や拡大率といった変換パラメータを求めます。そして、この変換パラメータをもとにして、実際の解析に用いる画像のズレを補正します(図1)。
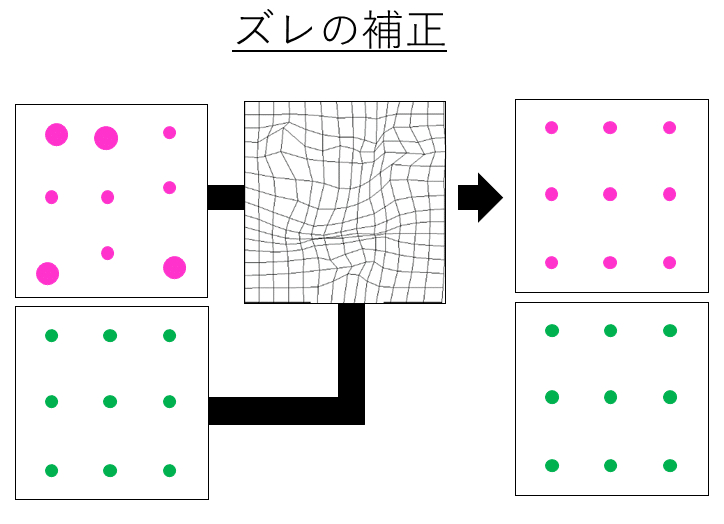
ズレの原因によって、画像の変換方法は異なります。たとえば、視野全体が一様にボケてしまう軸上色収差が原因の補正では、画像を拡大・縮小する必要があります。視野全体が一様にずれてしまう光路差が原因の補正では、画像の平行移動・回転といった変換が必要です。それに対し、画像の一部がズレ・ボケてしまう倍率色収差や像面湾曲収差では、せん断・弾性変形といった高度な変換が必要になります。これら画像変換の具体的な内容は、解説ポイントが多すぎるため今回は省略します。今後、画像の位置合わせ (画像Registration)のときに改めて詳しく説明します。
ズレの補正には、補正エラーがつきものです。そのため、できれば補正をしないで済むように努力すべきです。努力とは、たとえば、PlanApoといった収差補正処理を施してある対物レンズを使うといったことです。このほかには、2色の光路に差が出ないように光学系の調整したり、視野の中心部といったズレが少ない領域だけを解析に使うといったことが挙げられます。
(引用D)
「蛍光のもれこみ補正」
蛍光画像のノイズ成分を減らすために、蛍光のもれこみ成分を減算する必要があります。2色の蛍光分子の波長にオーバーラップがあると、分光を完璧におこなうことができないため、片方の蛍光画像にもう一方の蛍光成分がもれこんでしまいます。理論上は、2色の蛍光画像がともに相手の蛍光画像にもれこむことになります。しかし、蛍光波長があまりにも近すぎるペアを使わない限りは、片方の蛍光分子のもれこみだけを考えます。片方の蛍光分子が相手分子よりも極端に多いときにのみ、もれこみが問題となるからです。もれこみ補正には、補正エラーがつきものです。そのため、できれば補正をしないで済むように、1章の分光のところで説明したように、もれこみを防ぐ対策をすべきです。
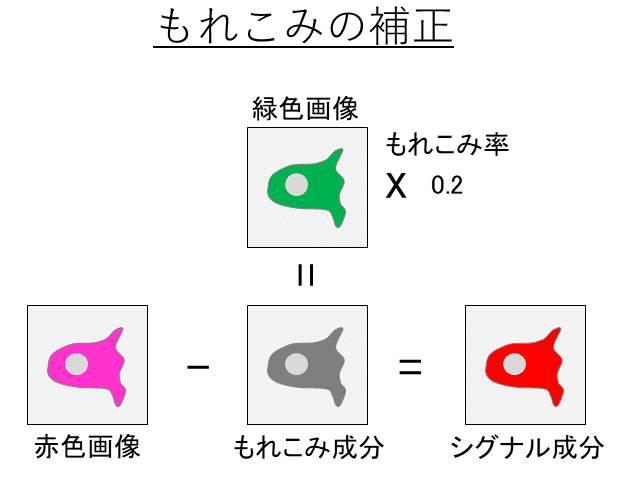
もれこみ補正は3つのステップからなります。1つ目のステップは、もれこみの割合、つまり、もれこみ率を計算することです。もれこみ率の算出は、実際に共局在の定量に用いる画像ではなく、もれこみが問題となる蛍光分子だけを染色した単色の蛍光サンプル (e.x. GFP)を用いておこないます。この単色のサンプルを自分 (e.x. GFP)と相方 (e.x. RFP)の2色の蛍光画像で撮影します。単色 (e.x. GFP)しか存在しないため、相方 (e.x. RFP)の蛍光画像に映る蛍光は、自分 (e.x. GFP)の蛍光がもれこんだものになります。相方 (e.x. RFP)の蛍光画像を自分 (e.x. GFP)の蛍光画像で割ることによって、もれこみ率を算出します。もれこみ率は、撮影の露光時間、レザーパワーと言った条件によって変わってきます。このため、実際に定量に使う画像を撮影するときと同じ撮影条件にする必要があります。2つ目のステップでは、実際の定量に使う画像からもれこみ成分を抽出します。もれこみ成分は、自分 (e.x. GFP)の蛍光画像にもれこみ率を掛けることで抽出します。最後に3つ目のステップとして、実際の定量に使う画像からもれこみ成分を減算します。相方 (e.x. RFP)の蛍光画像から、ステップ2で求めたもれこみ成分の画像を引きます(下図)。
「励起光の照明ムラ補正」
標的分子の正確な局在を反映した画像を得るために、励起光の照明ムラを補正する必要があります。励起光の照明ムラとは、励起光源の照明が空間的に不均一になることです。原因は対物レンズの特性にあります。対物レンズの特性として、光軸の中心部が光強度が高く、中心部から離れるほど強度が弱くなるためです。照明ムラが問題となるケースは2つあります。1つは、照明ムラによってバックグラウンドが均一にならないケースです。バックグラウンド減算を正確におこなえず、局所的な減算の超過や不足が起こります。もう一つは、2色の蛍光分子を別々の光源で励起しているケースです。照明ムラは励起光源ごとで異なるため、たとえ2色の分子が全く同じ局在パターンを示していても、照明ムラによって異なった局在をとっているように見えてしまうからです。
簡易的な照明ムラの補正は、2ステップからなります。第1ステップとして、フルオレセインやローダミンといった蛍光色素を含む溶液を用意し、その溶液を撮影します。蛍光色素は溶液内で均一に存在しているため、溶液の画像は励起光の照明ムラを反映した画像になります。第2ステップとして、この溶液画像、実際に共局在で定量に使う画像を除算します。この除算によって、励起光強度が高いところは蛍光輝度値が低く、励起光強度が低いところは、相対的に輝度値が高くなるように補正されます。
照明ムラ補正も、補正エラーがでてきます。原因の1つに、焦点面近くの照明ムラを、焦点面以外の照明ムラも含む画像で推定している点が挙げられます。細胞は高々10 μmくらいの厚さしかありません、それに対し、蛍光色素を含む溶液は通常数 mmの厚みを持ちます。両者で照明ムラが同じとは限らないからです。このため、他の補正と同様に、できれば補正をしないで済むように、照明ムラを防ぐ対策をすべきです。対策とは、2色の励起光の光軸に差が出ないように光学系の調整することです。また、視野の中心部といった、照明ムラが少ない領域だけを解析に使うのも共局在の正確な定量には有効です。
「Threshold(閾値)の決定」
共局在の定量を正確におこなうために、蛍光強度に従って、標的分子がいる領域といない領域とを分ける必要があります。蛍光画像を前景と背景とに分ける(二値化する)ということです。二値化の閾値 (Threshold)は共局在の正確な定量の要です。Manders Correlation係数(後述)といった共局在定量の指標では、Thresholdの値によって正反対の結論が導かれる場合があり、注意が必要です。理論的には、バックグラウンド減算が正しくおこなわれていれば、二値化をおこなう必要はありません。しかしながら、バックグラウンドは空間的に不均一であったりして推定が困難であるといった問題のため、バックグラウンド減算には誤差が出てきます。そのため、閾値 (Threshold)を設定して、「確実に」標的分子が存在する領域(ピクセル)だけを解析に回す必要があります。閾値 (Threshold)のアルゴリズムは無数にあり、それだけで1つのトピックになってしまいます。アルゴリズムの解説は別の機会にします。今回は共局在の定量でよく使われるCostesのThreshold決定法だけを解説します。
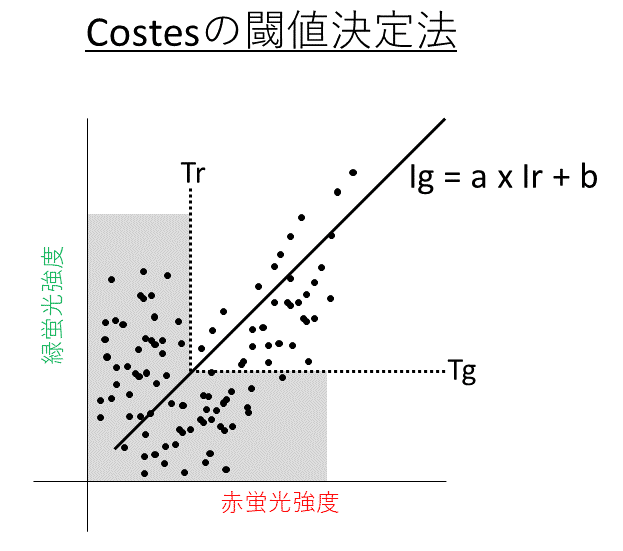
CostesのThreshold決定法は、相関係数にもとづいてThresholdを決定する方法です。まず、2色の蛍光値をピクセルごとにプロットした散布図から回帰直線 (Ig = a x Ir + b)を求めます(図1)。そして、片方の色(e.x. 赤)の閾値 (Tr)を適当に決めます。もう一方の色(e.x. 緑)の閾値は回帰直線から自動的に求まります (Tg = a x Tr + b)。<Tr or <Tgの領域(図のグレー域)の相関係数を求めます。相関係数が0より大きければ、Trを下げ、再度Tg, 相関係数を求めます。これを繰り返し、相関係数が0になるまで続けます。そして相関係数が0となるTr, Tgを閾値として採用します。Tr, Tgよりも大きい蛍光輝度値を持つピクセルだけを定量解析に回します。
(引用E)
参考文献・サイト
(引用D)
http://www.nikon-instruments.jp/jpn/learn-know/microscope-abc/learn-more-microscope/about-aberration#Anchor_7
https://aska-sg.net/shikumi/015-20051019.html
http://blog.eflens.net/2014/11/aberration-and-its-effect/
https://mathwords.net/affine
https://www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cellular-imaging/fluorescence-microscopy-and-immunofluorescence-if/microscopy-reagents-and-media/microscope-calibration-reagents.html
http://zellij.hatenablog.com/entry/20120523/p1
http://delta-mat.ist.osaka-u.ac.jp/DeltaViewer/docs/HosoiThesis.pdf
(引用E)
Costes, Sylvain V., Dirk Daelemans, Edward H. Cho, Zachary Dobbin, George Pavlakis, and Stephen Lockett. “Automatic and Quantitative Measurement of Protein-Protein Colocalization in Live Cells.” Biophysical Journal 86, no. 6 (June 2004): 3993–4003. https://doi.org/10.1529/biophysj.103.038422.
この記事が気に入ったらサポートをしてみませんか?
