【概要】Inhibition mechanism of SARS-CoV-2 main protease by ebselen and its derivatives / ebselenおよびその誘導体によるSARS-CoV-2メインプロテアーゼの阻害機構

・ebselenと類似の5つの誘導体(有機セレン化合物)について、SARS-CoV-2のMproとの共結晶構造解析
・Mproの活性部位で加水分解され、フェノール性の副生成物(ebselenの場合はサリチルアニリド)をLC-MSにて分析
・セレン化による阻害メカニズムは、SARS-CoV-2やβ-コロナウイルスなどに対して、より広い範囲で治療に用いることを示唆
NATURE COMMUNICATIONS | (2021)12:3061 | https://doi.org/10.1038/s41467-021-23313-7 |
導入
SARS-CoV-2のパンデミックをきっかけに、治療薬の開発が世界的に進められている。
SARS-CoV-2の症状は、他のコロナウイルスと同様に、主に呼吸器系に感染し、特に高齢者や免疫力の低い人では、人工呼吸や集中治療を必要とする重篤な肺炎を発症する。
ワクチンの開発は飛躍的に進んでいるが、現在の展開は供給面でも時間面でも限界がある。いくつかのワクチンが開発され、集団免疫用として承認されている。(ex.ファイザー社、モデルナ社など)
しかし、ワクチンの中には極低温で保存しなければならないものもあり、世界の発展途上地域では展開できず、さらに、SARS-CoV-2のゲノムに存在するいくつかの変異は、ウイルスを抑制するワクチンの効果に影響を与える可能性がある。
そもそもSARS-CoV-2は、エンベロープ型のポジティブセンスの一本鎖RNAウイルスで、約3万塩基の大きなゲノムを持っている。SARS-CoV-2の全ゲノムは、コウモリ由来のコロナウイルスと96%一致し、SARS-CoV-1とは80%の配列同一性を持つ近縁種である。
ゲノムの3分の2を占めるレプリカーゼ遺伝子(ORF 1a/1b)には、pp1aとpp1abという2つのオーバーラップするポリタンパク質がコードされている。
pp1aとpp1abは、2つのウイルスプロテアーゼによって15の非構造タンパク質(NSP)に分類される。
各NSPは、ウイルスのRNAポリメラーゼ複合体を形成し、宿主における新鮮なウイルスの複製と転写に関与する。
SARS-CoV-2の主要プロテアーゼ(Mpro)もしくはNSP5は、ヒトには相同タンパク質が存在しないことから、ウイルスの複製に不可欠であり、治療法開発の重要なターゲットとなっている。
Mproは3つのドメインからなる33.8kDaのホモ二量体の酵素である。
構造として、キモトリプシン様ドメインIとピコルナウィルス3Cプロテアーゼ様ドメインIIの間には、His41とCys145の触媒二重構造を持つ基質結合部位が存在する。
ドメインIIIは、プロトマー間の塩橋相互作用を介してMproの二量体化に重要な役割を果たしている。これまでにいくつかの阻害剤やフラグメントが共結晶化されており、それらは触媒作用を阻害する。
他にも、アリティックキャビティをブロックする阻害剤やフラグメントがいくつか発見されている。
治療薬の一つ、ebselenと呼ばれる有機セレン化合物は、強力なMpro阻害作用と抗ウイルス作用を有することが明らかになっている。
ebselenは、有機セレン分子があり、グルタチオンペルオキシダーゼとして機能し、多くのタンパク質のシステイン(Cys)のチオール基とセレノ型のスルフィド結合を形成し、抗炎症作用、抗微生物作用、神経保護作用する。
その作用から脳卒中、難聴、双極性障害の治療薬として臨床試験が行われており、副作用のない良好な安全性が確認されている。
そして、分子動力学シミュレーションにより、ebselenは2つの可能性のある部位に結合することが示唆されており、1つは触媒キャビティ内のCys145にセレノ型のスルフィド結合を介して結合する部位、もう1つは二量体化領域に結合する部位だ。
しかし、SARS-CoV-2 Mproの結合部位に関する実験データは得られていない。
なので、高分解能共結晶構造にてebselen とその誘導体の Mpro への結合様式を調べ、質量分析を用いてその化学反応性を調べた。
結果
ebselenと2つのセレニウム化合物(MR6-7-2とMR6-18-2)に、高いMpro阻害効果
最初に、Mpro阻害剤として機能するかどうか、蛍光共鳴エネルギー移動法を用いて、ebselenと5つの誘導体について、SARS-CoV-2のMproの阻害と抗コロニーウイルス活性を評価しました。
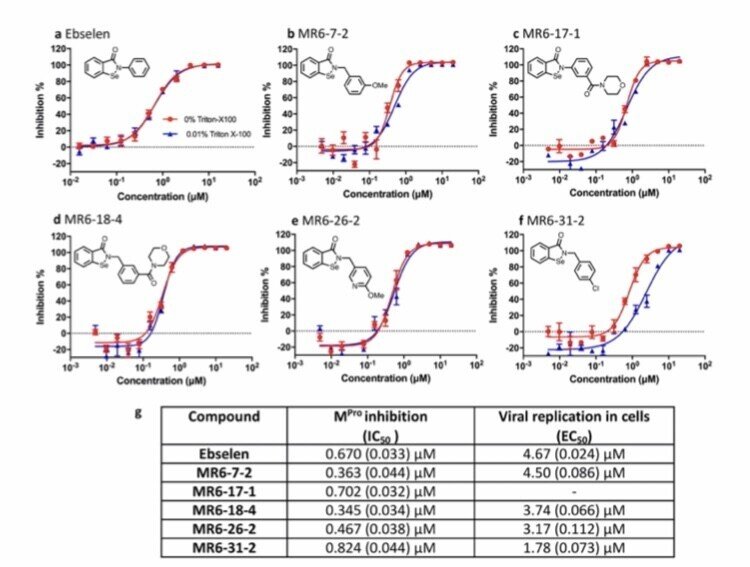
図1. ebselenおよび5つの誘導体の化学構造、in vitro Mpro阻害および細胞ベースの抗ウイルスアッセイ。
このデータは、ebselenを含む5つの化合物が、IC50がサブマイクロモルレベルの強力なMpro阻害剤であることを明確に示している。
これらのebselenをベースにした2つのセレニウム化合物(MR6-7-2とMR6-18-2)は、Mpro酵素およびSARS-CoV-2の複製に対してebselenよりも高い阻害効果がある。
さらに、SARS-CoV-2に感染した霊長類Vero細胞に対するin vitro抗ウイルス活性も評価し、その結果、いくつかの誘導体において、ebselenよりも強いMpro阻害作用と、感染した細胞を救済する強力な能力が確認されました。
これらの化合物とMproとの明確なオンターゲット相互作用を示しており、SARS- CoV-2に対して大きな阻害力を持つことから、患者の治療法として開発できる可能性がある。
SARS-CoV-2 Mproとの共結晶構造解析
次に、ebselenと5つの誘導体について、SARS-CoV-2のMproの共結晶構造解析を行い、リガンドフリーおよび Mpro と ebselen および MR6-31-2 との複合体の構造を 1.6-2.0 Åの分解能で構造解析された。
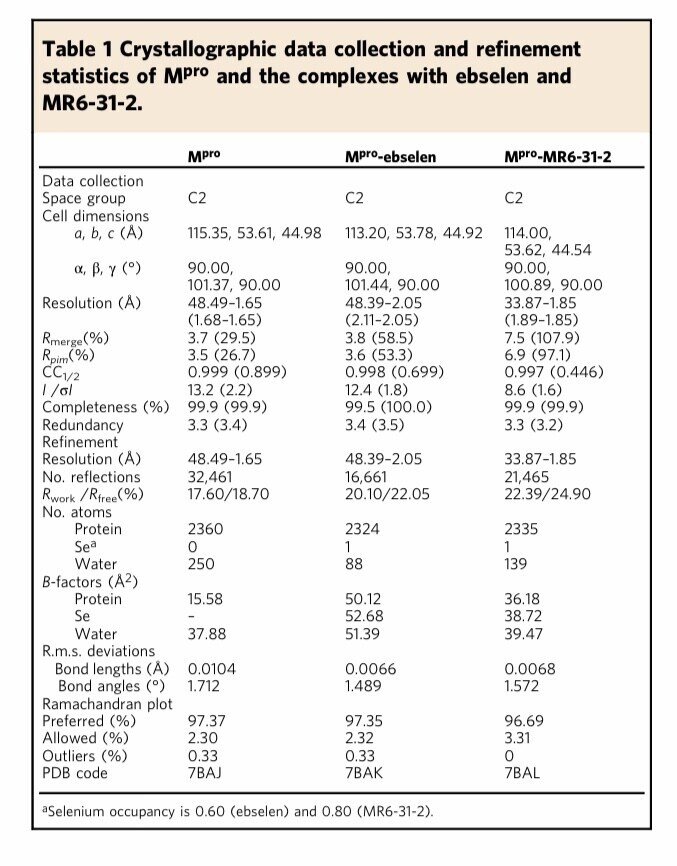
今回のMpro構造は,C2空間群に同じパッキングをしており,1つのMproプロトマーだけが非対称ユニットとして観察された。
共結晶の材料になるebselenとその誘導体は、運動ニューロン疾患に関連した神経保護剤として開発され、化合物とスーパーオキシドディスムターゼ1の共結晶構造は、二量体界面のCys111とセレン性のスルフィド結合を形成していることが証明されている。
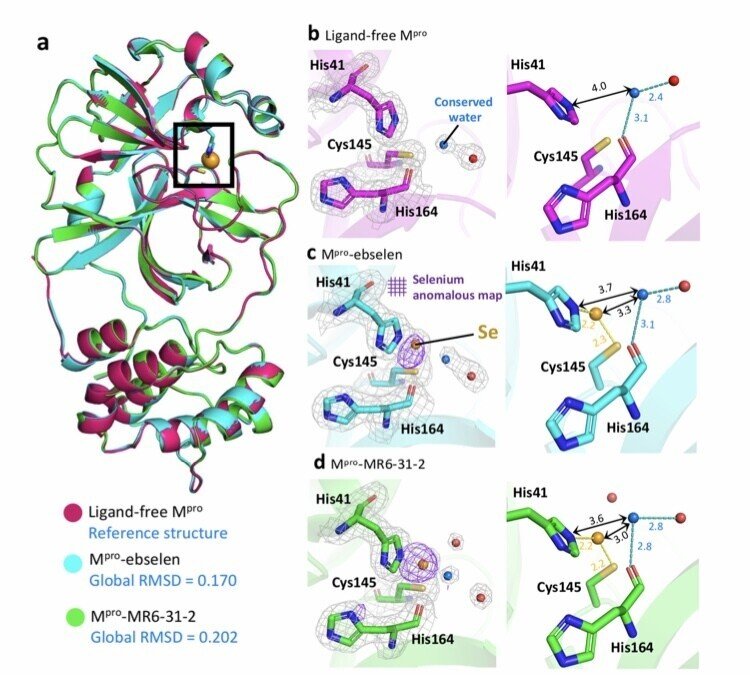
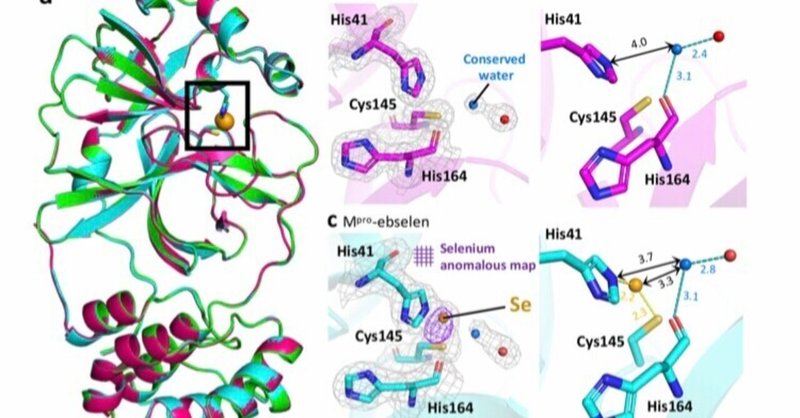
図2.リガンドフリーのMproとebselenおよびMR6-31-2との複合体の結晶構造。
構造解析により観察された内容は3つ。
①Mpro と ebselen および MR6-31-2 の結晶構造において、触媒ダイアドのシステインに結合した遊離のセレン原子が発見されました。
経緯は…
Mpro-ebselenとMpro-MR6-31-2の共結晶では、Cys145とHis41の間に明確な電子密度のパッチが観察された。
↓
リガンド処理したMpro構造では、Cys-ヒスチジンのcatalytic dyadにのみ、3σに強い異常密度が見られた。
↓
ebselenとMR6-31-2が主にMproの触媒ポケットに結合し、Cys145とセレン性のスルフィド結合を形成している。
↓
酵素の活性部位にセレン原子のみが観察されることから、セレンによるCysの不活性化が、Mproの活性とウイルスの複製の阻害につながる。
②セレンの結合は、活性部位内の周囲のアミノ酸残基のコンフォメーションに影響を与えない。
③ His41のNεから3.6〜4.0Å離れた保存された水分子が、His164の主鎖と水素結合を形成していることが、すべての構造で確認された。
Mpro-ebselenとMpro-MR6-31-2の構造では、His41と保存水の距離が近くなっており、タンパク質-化合物の付加物の加水分解にHis41が関与していることが示唆された。
ebselenの加水分解により生成されたサリチルアニリドのLC-MSによる特性解析
Mpro と ebselen および MR6-31-2 の共結晶構造から、これらの化合物が触媒二重鎖の Cys145 のセレン化によって Mpro を阻害する。
そうすると、化合物はMproの活性部位で加水分解され、フェノール性の副生成物(ebselenの場合はサリチルアニリド、図3a)を放出される。
Mpro-ebselen付加体に由来する加水分解産物を同定するために、標準的なサリチルアニリドを用いてLC/MRM-MS法で特性解析を行った。
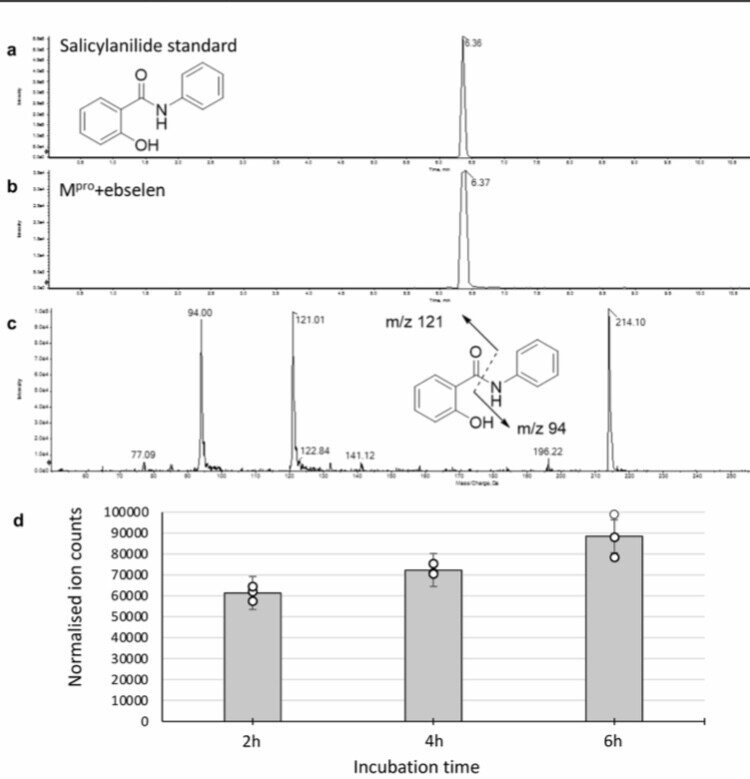
図3. サリチルアニリド標準品の代表的なクロマトグラフと、Mproとebelenのインキュベーションにおける生成物。
ebselenのインキュベーションで得られたサンプルをLS-MS法を行うと次のような結果が得られた。
・6.37分にサリチルアニリドに対応する強いピーク
・240分後に測定されたこれらのサンプル中のサリセラニリドの濃度は1.28ng/ml
・Mproとebelenのインキュベーションにおけるサリチルアニリドの生成は,時間に依存していた。
これは、酵素に結合した有機セレンの共有結合付加物が加水分解され、フェノール性の副生成物が形成されたことを示唆していることが、質量分析により確認された。
考察
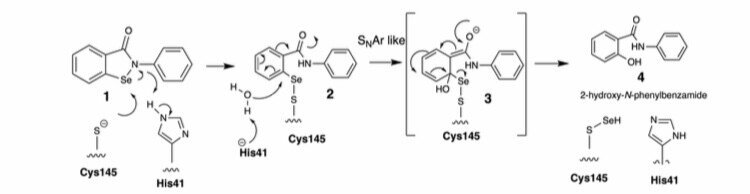
図4. エベセレンによるMproシステイン145のセレン化の化学的メカニズム
・Fig.4から
親電子的なセレン中心にCys145チオラートが求核攻撃を受けることにより、ebselen 1からSARS-CoV-2 Mpro 薬剤添加物2が生成される。
↓
他のMpro共有結合阻害剤とは異なり、ebselenの有機骨格は共結晶構造中に存在せず、Cysプロテアーゼの活性部位でebselenのコアからセレン原子が押し出されていることが示唆。
↓
His41がSNAr型の加水分解反応において、中間体付加物2への水を介した攻撃を助け、中間体3がペプチド加水分解の四面体中間体のように活性部位のオキシアニオンホール内で安定化する可能性。
※SNAr機構とは…
芳香族求核置換反応の一種で、化学反応のうち、ベンゼン環などの芳香環上にある置換基が求核剤の攻撃を受けて置き換られる反応のこと。
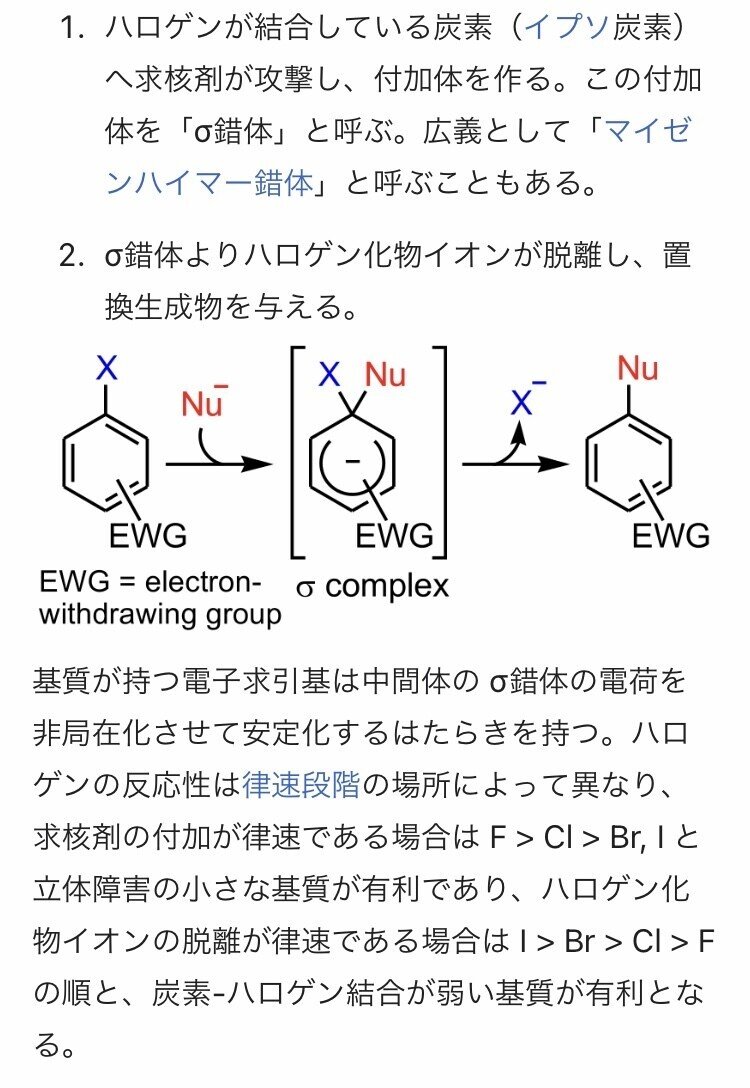
ドラッグデザイン分野では、触媒的および非触媒的なチオールの共有結合修飾が盛んに行われており、求核的な芳香族置換を可能にするために脱離基(例えばハロゲン化物)で調整された芳香族弾頭がいくつか報告されているので、提案されたメカニズムのSNArの側面は前例がある。
このように明確なターゲットが存在することで、安全性を確保しつつ、より効果的に触媒のCysに作用させ、より大きな阻害効果を得ることができるよう、さらなる開発に向けた道が開かれました。
このようなセレン化による阻害メカニズムは、SARS-CoV-2やその他の人獣共通感染症であるβ-コロナウイルスに対して、これらの化合物をより広い範囲で治療に用いることを示唆している。
この記事が気に入ったらサポートをしてみませんか?
