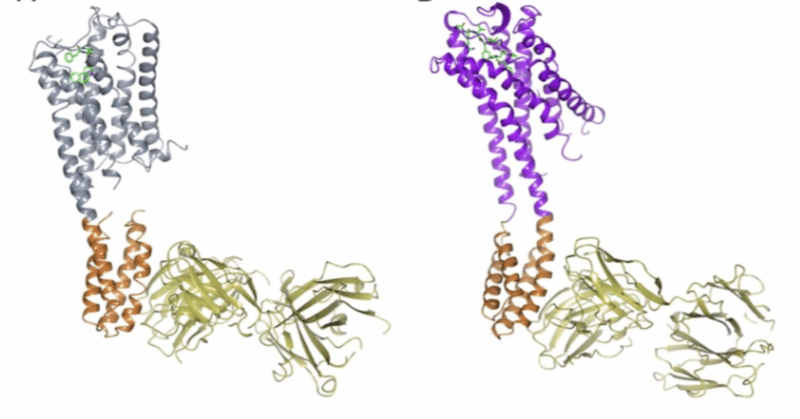
【概要】 The discovery of a new antibody for BRIL-fused GPCR structure determination / BRIL融合GPCR構造決定のための新しい抗体の発見

導入:Gタンパク質共役型受容体(GPCR)の必要性と構造解析に至るまでの実験技術
結果:抗体SRP2070Fabと5HT1B-BRIL/エルゴタミン(ERG)およびAT2R-BRIL/[Sar1, Ile8]-アンジオテンシンII(s-Ang II)の構造解析を行い、抗体なしとの構造を比較
考察:抗体SRP2070FabはGPCRの結晶構造に有用か?
導入:Gタンパク質共役型受容体(GPCR)の必要性と構造解析に至るまでの実験技術
Gタンパク質共役型受容体(GPCR)とは、細胞表面に存在する最大の膜タンパク質ファミリーであり、リガンドと細胞内シグナル伝達を仲介し、約800の遺伝子から構成される、膜貫通型受容体である。
GPCRは、免疫反応、血圧調節、神経系、視覚系、嗅覚系など、さまざまな生理機能に関与している。
そのため、GPCRを標的とした薬剤は、中枢神経系疾患、炎症性疾患、代謝異常、心疾患、癌などの複数のヒト疾患の治療に用いられている。
構造は、7回膜貫通ヘリックス(TM 1-7)と、リガンド結合部位に相当する3つの細胞外ループ(ECL 1-3)、3つの細胞内ループ(ICL 1-3)でつながっている。
3つ目の細胞内ループ(ICL3)が、細胞内のシグナル伝達に必要なGタンパク質と相互作用する。
細胞内の状態に応じて、複数のコンフォメーション状態をとり、主に活性状態と不活性状態の2つの状態がある。
低分子医薬品の開発において、標的タンパク質と候補化合物の3次元構造を把握することは、化合物のと結合を改良するに非常に有効で、特にGPCRのX線結晶構造は、構造に基づく薬物設計(SBDD)に非常に有用である。
SBDDを用いると、合理的なドラッグデザインが可能となり、医薬品開発の成功率がはね上がる。しかし、GPCRの構造決定は、体組織や異種発現系でのタンパク質の発現が乏しいこと、タンパク質の安定性が低いこと、複数の受容体のコンフォメーション状態が存在することなどから、非常に困難であった。
そんな折、タンパク質の発現、精製、結晶化、X線回折データの収集に関する技術がいくつか開発された。
例えば、T4リゾチームやBRILのような融合タンパク質により、目的のGPCRタンパク質を精製し、その構造を決定することができるようになった。
他の実験開発として、結晶化の技術は以下の3つが例に挙げられる。
①GPCRの安定性を向上させるために、ICLはしばしばT4リゾチーム、BRIL、ルブレドキシンなどの可溶性タンパク質で置き換えられる。
②可溶性タンパク質と融合しても標的GPCRの結晶化がうまくいかない場合には、結晶化性を高めるための新たなアプローチが必要であり、そのために標的GPCRに特異的に結合する抗体が用いられる。
③結晶化する際に、GPCRの熱安定性を考慮し高める、もう一つの一般的な方法は、膜貫通部のヘリックスを変異させる。
→ただし、結晶化実験にコンストラクトを使用するより先に、ターゲットGPCR内の変異部位をスクリーニングし、活性型または不活性型の状態を安定化させる変異部位を決定する必要があり。
それでは、②の融合タンパク質に対する抗体が、活性または不活性のコンフォメーション状態でリガンドを持つGPCRの結晶化を促進するのだろうか。
本論文では、GPCRの熱安定化したアポシトクロムb562を標的とした新しい抗体(SRP2070)を作製し、この抗体の断片(SRP2070Fab)が、BRILにタグ付けされたリガンド結合型GPCRである5HT1BとAT2Rの結晶化にどう影響するか、研究を行った。
結果:抗体SRP2070Fabと5HT1B-BRIL/エルゴタミン(ERG)およびAT2R-BRIL/[Sar1, Ile8]-アンジオテンシンII(s-Ang II)の構造解析を行い、抗体なしとの構造を比較。
試料の調製と結晶化
5HT1B-BRIL/エルゴタミン(ERG)およびAT2R-BRIL/[Sar1, Ile8]-アンジオテンシンII(s-Ang II)、
SRP2070Fab(SRP2070のFabフラグメント GPCRの熱安定化させるためにアポシトクロムb562を標的とした新しい抗体)を作製し、複合化して,結晶化実験を行った。
結晶化実験は、LCP(lipidic cubic phase)法。
LCP(lipidic cubic phase)法とは…
脂質と水溶液を混合して脂質キュービック相を形成し,そこでタンパク質を結晶化させる膜タンパク質の結晶化するための方法。
5HT1B-BRIL/ERG/SRP2070Fabについては,400 mM KSCN,100 mM NaOAc pH5.5,30% PEG 400の条件で,1週間以内に回折結晶が成長し、AT2R-BRIL/s-Ang II/SRP2070Fabでは、50mM KOAc、100mM MES-NaOH pH6.5、26-36% PEG 300、100μM s-Ang IIで1週間以内に結晶の成長が見られたので、SPring-8のBL32XU ビームラインでX線回析、そして構造解析を行った。
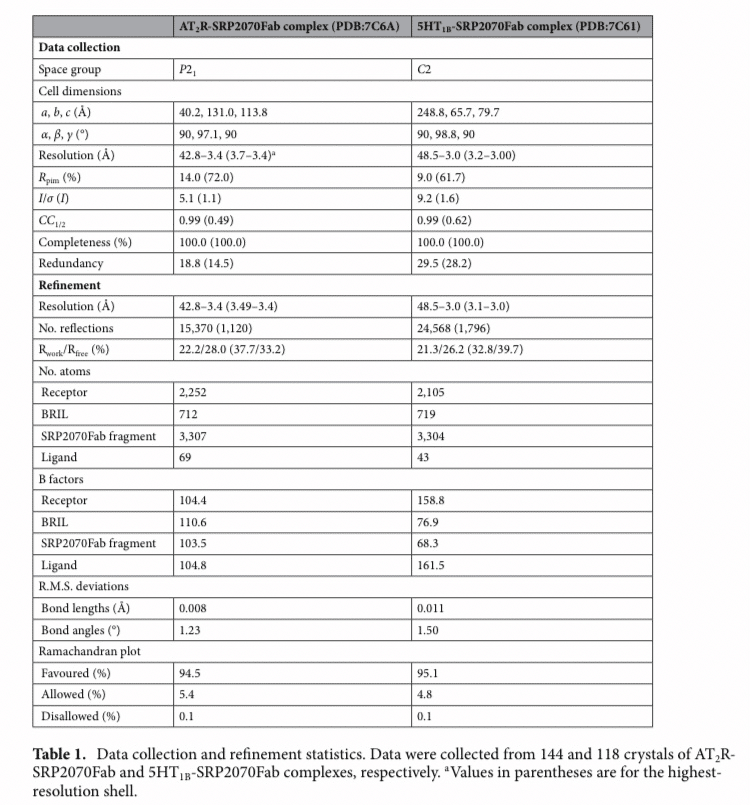
Table1:5HT1B-BRIL/ERG/SRP2070FabとAT2R-BRIL/s-Ang II/SRP-2070Fabの回析データ
両複合体の構造を分子置換法し、精密化した。
分子置換法とは、タンパク質のX線結晶構造解析で位相を求める方法。
プロトコルは、
1.非対称単位中のタンパク質分子数の見積もり
2.自己回転関数による非結晶学的回転軸の確認
3.類似タンパク質(モデル分子)の選択と編集
4.分子の回転/並進
5.結晶中の分子のパッキングの確認
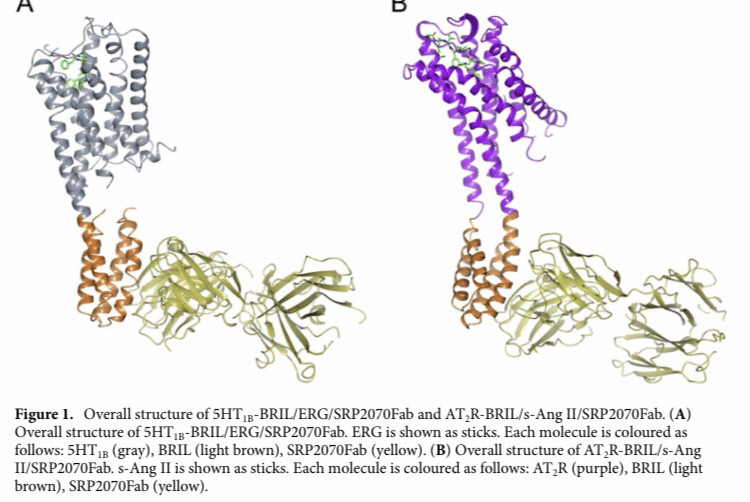
Fig 1. 5HT1B-BRIL/ERG/SRP2070FabとAT2R-BRIL/s-Ang II/SRP-2070Fabの構造解析図。
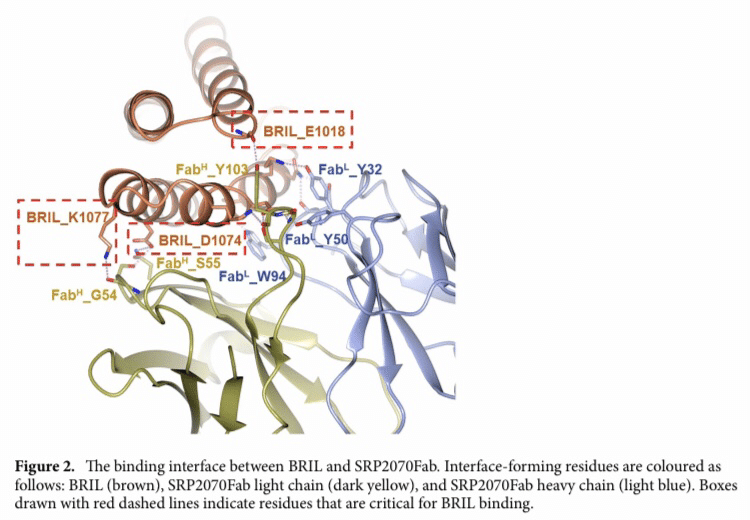
Fig 2. BRILとSRP2070Fabの結合面
構造解析の結果、SRP2070FabはBRILのヘリックスに垂直に結合していた。
また、BRILのヘリックスIIIとIVがSRP2070Fabのエピトープ(抗体が認識して結合する抗原の特定の構造単位を抗原決定基 エピトープとよび、6~10個のアミノ酸や5~8個の単糖の配列から成る)として機能していた。
特に、ヘリックスIIIは、CDR-L3とCDR-H3の両方で認識されたことから、この領域が支配的なエピトープであることが示唆された。
結晶化促進剤として、SRP2070Fabの重要な特徴となる。
結晶化に対するSRP2070Fabの効果を評価するため、クリスタルパッキングの相互作用を調べた。
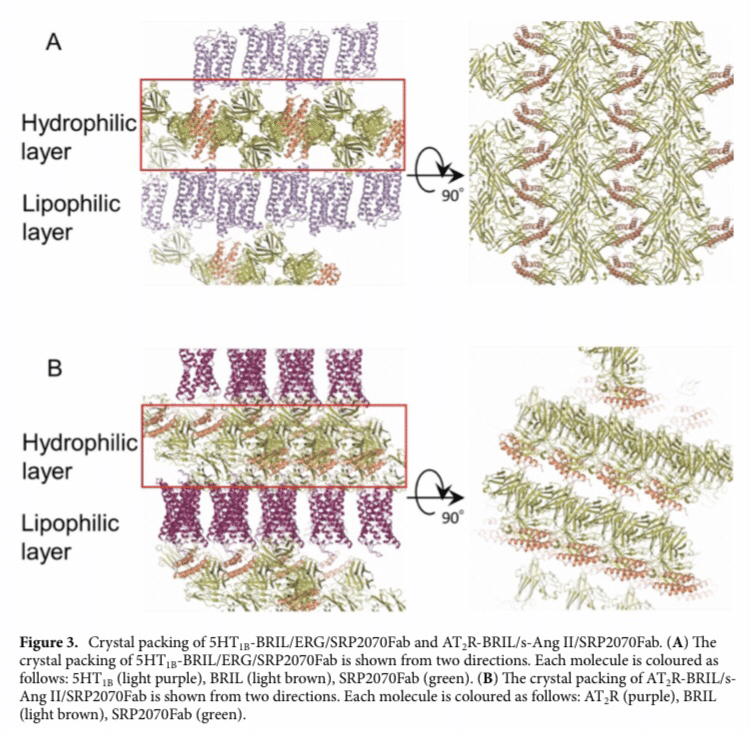
Fig 3. 5HT1B-BRIL/ERG/SRP2070FabとAT2R-BRIL/s-Ang II/SRP-2070Fabのクリスタルパッキング
Fig 3.で示すように、5HT1B-BRIL/ERG/SRP2070FabおよびAT2R-BRIL/s-Ang II/SRP2070Fabの結晶は、SRP2070FabとBRILからなる水性層と、受容体領域からなる親油性層が交互に積層して形成されていた。
特に5HT1B-BRIL構造は、以前に報告されたSRP2070Fabを含まない5HT1B-BRIL/ERG構造(PDB ID: 4IAR)と同様に、GPCRの結晶でしばしば観察されるhead-to-tail二量体構造であった。
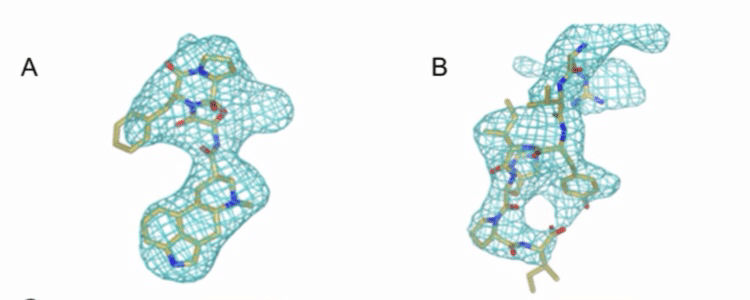
Fig 4 A,B. エルゴタミン(ERG)とs-Ang IIの電子密度マップ
リガンドERGとs-Ang IIペプチドにそれぞれ5HT1BとAT2Rに対応する明確な電子密度が、受容体のオルソステリック結合ポケット内で観測された。(Fig 1. 4. A,B)
構造比較
SRP2070のBRILへの結合によってGPCR部分の構造が影響を受けるかどうかを確認するために、5HT1B-BRIL/ERG/SRP2070FabおよびAT2R-BRIL/s-Ang II/SRP2070Fabの構造を、過去に報告された5HT1B-BRIL/ERG (PDB ID: 4IAR)およびAT2R-BRIL/s-Ang IIと抗AT2R抗体との複合体 (PDB ID: 5XJM)の構造と比較した。
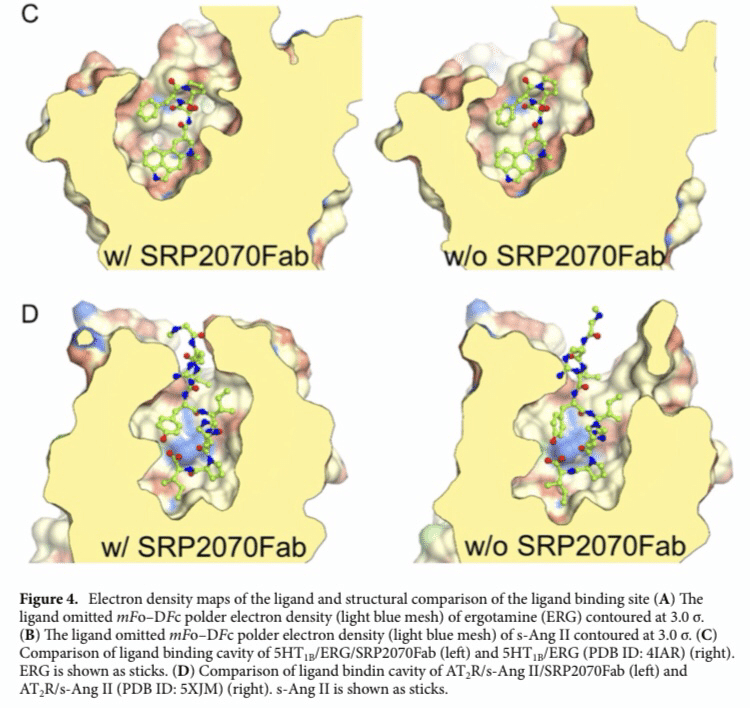
Fig 4. C 5HT1B-BRIL/ERG/SRP2070Fabおよび5HT1B-BRIL/ERG/noneのリガンド結合部位を比較。
D AT2R-BRIL/s-Ang II/SRP2070FabおよびAT2R-BRIL/s-Ang II/noneのリガンド結合部位を比較。
AT2R-BRIL/s-Ang II、5HT1B-BRIL/ERGともに、SRP2070Fabが結合を比較した結果、リガンド結合部位の周辺には大きな違いは見られなかった(Fig 4.C,D)
さらに詳細に、GPCRで3つの活性化モチーフ(別名:microswitch residue。受容体の不活性状態と活性状態では、実質的に異なる構造をとり、異なる相互作用に関与している)PIF、NPxxY、DRYも比較した。
その結果、この3つのモチーフはどちらの比較においても非常に似た構造を示すことが確認された。
なので、BRILに結合したSRP2070Fabは、GPCRの構造にほとんど影響を与えないことがわかった。
さらに、SRP2070Fabが結合している時にGPCRが不活性なのか活性状態の構造をしているのかも調べた。
・AT2R-BRIL/s-AngII/SRP2070Fabの構造は、活性型AT2R-BRIL/s-Ang II/抗AT2R抗体との複合体と重ね合わせると、活性型を示している可能性があると考えられる。
・5HT1B-BRIL/ERG/SRP2070Fabや5HT1B-BRIL/ERGが活性型を示すのか、不活性型を示すのかを明確に述べることは非常に難しい。
ー根拠ー
3つの活性化モチーフPIF、NPxxY、DRYを比較して、以下の4つが示唆される。
①PIFモチーフの配置は、β2アドレナリン受容体(β2AR)-Gs複合体の構造(PDB ID: 3SN6)と比較し、5HT2B-BRILのERGとの複合体構造(PDB ID: 5TUD)と一致したので、活性型と言える。
②NPxxYモチーフとDRYモチーフは活性型5HT2B-BRIL/ERGとは異なっていた。
なので、5HT1B-BRIL/ERG/SRP2070Fab構造は活性型を示していないのではないのかと疑問が出てきた。
③不活性型として知られる部分インバースアゴニストのカラゾロール(PDB ID: 2RH1)に結合したβ2ARのモチーフと一致しなかった。
④5HT1B-BRIL/ERG/SRP2070FabのTM6ヘリックスの向きは、5HT2B-BRIL/ERGのそれよりも、カラゾロールを結合したβ2ARの構造に近い。
具体的には、
1.不活性型構造で観察される構造をとっているTM6のこの細胞内領域の向きから特に明らかである。
2.TM6の細胞内領域の外側への変位は、不活性から活性への状態変化の構造的特徴である。
3.ICL3の位置に対応するTM5とTM6の間の融合BRILの向きは、GPCRの活性状態または不活性状態に直接影響される。
①〜④より、
報告されているSRP2070Fabを含まない5HT1B-BRIL/ERG構造と類似した中間的な活性状態なのでは?と推察される。
考察:抗体SRP2070FabはGPCRの結晶構造に基づくSBDDに有用か?
ICL BRIL融合タンパク質とSRP2070Fabの複合体を用いるこの方法は、これまで未解決だったGPCRの構造を解明するためにも利用できるのでは?
そのためにはSRP2070Fabは、N-またはC-末端にBRILを融合したGPCRに使用できると考えているが、それを実証するにはさらなる研究が必要である。
SRP2070Fabを用いた共結晶化は、結晶化の成功率を高めるだけでなく、構造決定にも有利に働く。
構造に基づく薬物設計(SBDD)に用いるためには、SRP2070Fabがリガンドの電子密度に悪影響を及ぼさないことを確認することが非常に重要だ。
過去の研究から、ICLを認識する抗体は、リガンドの電子密度が不明確になりがちなため、SBDDには適していないとされており、BRILはGPCRを安定化させるためにICL3の代わりに挿入されることが多い。
なので、SRP2070FabがSBDDに利用できるかどうかを調べるために、今回の構造のB因子とリガンド密度マップを比較した。(Fig.4と5)
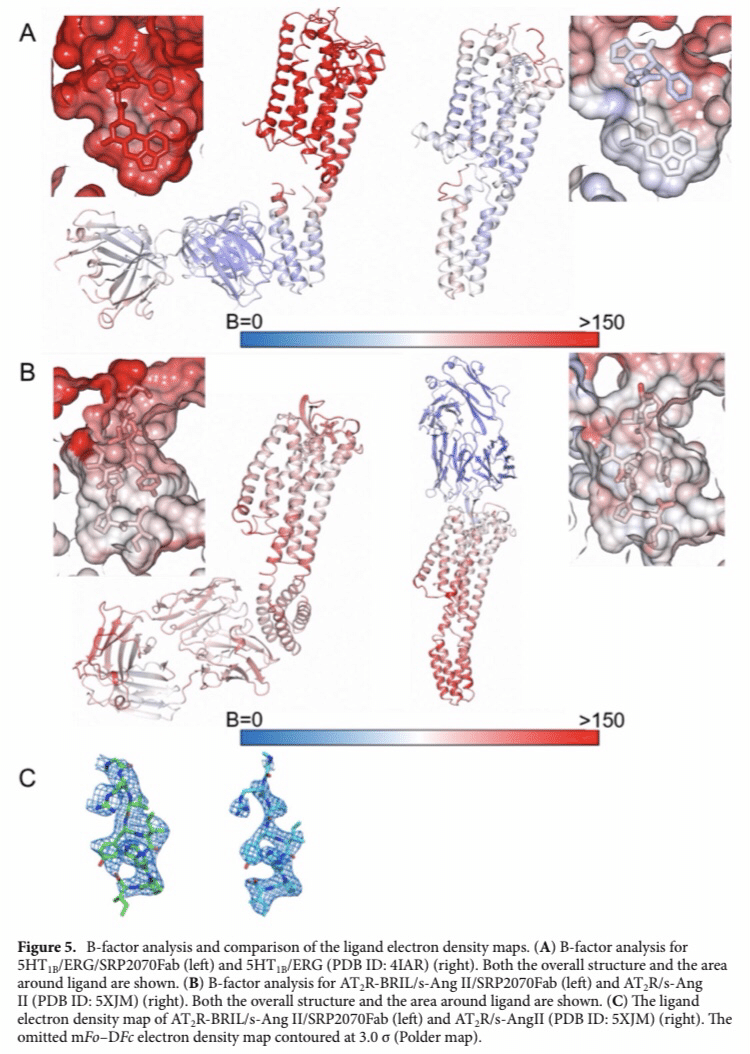
Fig 5.5HT1B/AT2R-SRP2070Fabのリガンド結合時のB因子
Fig 3と同様に、SRP2070Fab間の相互作用がクリスタルパッキングに重要な役割を果たしており、それはGPCR間の相互作用が比較的弱いためである。
しかし、この特性は、SRP2070Fabの汎用性を高めるために必要であると考えている。
つまり、SRP2070FabはGPCRの構造に影響を与えることなく、クリスタルパッキングを改善することができるのだ。
リガンドの電子密度も分離されたことから、SPR2070FabはGPCRのSBDDに汎用性があり、適応可能であることが示唆される。
新しいツールは、他のGpcRの構造決定や、それらを標的とした低分子医薬品の設計を大幅に加速させるものとされている。
この記事が気に入ったらサポートをしてみませんか?
